一种具有免疫活性的白及多糖及其制备方法与应用与流程
本发明涉及多糖提取领域,具体涉及一种具有免疫活性的白及多糖及其制备方法与应用。
背景技术:
现代药理研究表明,自由基是引起多种疾病和老化的诱因,如癌症、心血管疾病等,抗氧化剂能有效清除活性氧自由基,减缓人体衰老,预防疾病;同样,免疫力低下会增大细菌病毒对人体的侵袭,威胁人类健康,免疫调节剂能提高机体免疫功能。因此,寻找开发安全无毒副作用的天然抗氧化剂、免疫调节剂成为当下的研究热点。
白及为兰科植物白及bletillastriata(thunb.)reiehb.f.的干燥块茎,多年生草本,主产于贵州、四川、湖南、安徽等地。白及中主要含有多糖类、菲类、联苄类、萜类等化学成分。据报道:多糖具有广泛的生物学活性,作为抗氧化剂可以消除给人体带来极大危害的自由基,维护健康、延长生命;作为免疫调节剂可激活多种免疫细胞,促进细胞因子生成,增加抗体生成量,提高巨噬细胞、白细胞吞噬能力;提高淋巴细胞转化率和nk细胞活性,达到增强免疫功能的作用。白及多糖作为白及的主要活性成分,因具有安全高效、毒副作用小的优点成为极具开发潜力的天然活性物质。酶解法作为一种高效的提取方法,由于其对产品进行降解时能让更多的有效物质得以溶出,在食品与药品行业正大量被使用。白及属根茎部位,富含果胶,利用果胶酶对其细胞壁进行降解能有效的使胞内多糖成分快速溶出,从而增加多糖提取率。
技术实现要素:
本发明的目的在于提供一种具有免疫活性的白及多糖及其制备方法与应用,通过利用果胶酶对其细胞壁进行降解能有效的使胞内多糖成分快速溶出,从而增加白及多糖提取率。同时制备的白及多糖可应用到增强免疫的药物或者保健食品中,为了实现上述目的所采用的技术方案为:一种具有免疫活性的白及多糖,所述的白及多糖对dpph自由基、oh自由基和abts+自由基的清除率分别可达到43.6%、74.8%、51.7%;对细胞raw264.7生长有促进作用和免疫调节活性。
制备上述白及多糖的方法为:采用酶解法制备,酶解步骤分为:白及破碎,恒温酶解,灭酶,其中恒温酶解的条件为:酶添加量0.5-2%,酶解温度:35-60℃,酶解时间:50-100min,ph值为:4-7。
优选恒温酶解的条件为:酶添加量1.4%,酶解温度:55℃,酶解时间:87min,ph值为:5.43。
上述中所述的酶解法采用的酶制剂为果胶酶,酶活性为2万u/g。
所述步骤灭酶离心是指白及酶解液于沸水浴中保温3-5分钟;在5000-8000转/min的转速下离心8-10min,上清液为白及多糖酶解液。
所述的白及多糖应用到免疫增强药物或增强免疫力的保健食品的开发中。
有益效果:通过本发明制备的白及多糖对dpph自由基、oh自由基和abts+自由基的清除率分别可达到43.6%、74.8%、51.7%,对raw264.7细胞生长有一定的促进作用,具有免疫调节活性,其浓度为400μg/ml时免疫诱导活性效果显著。
附图说明
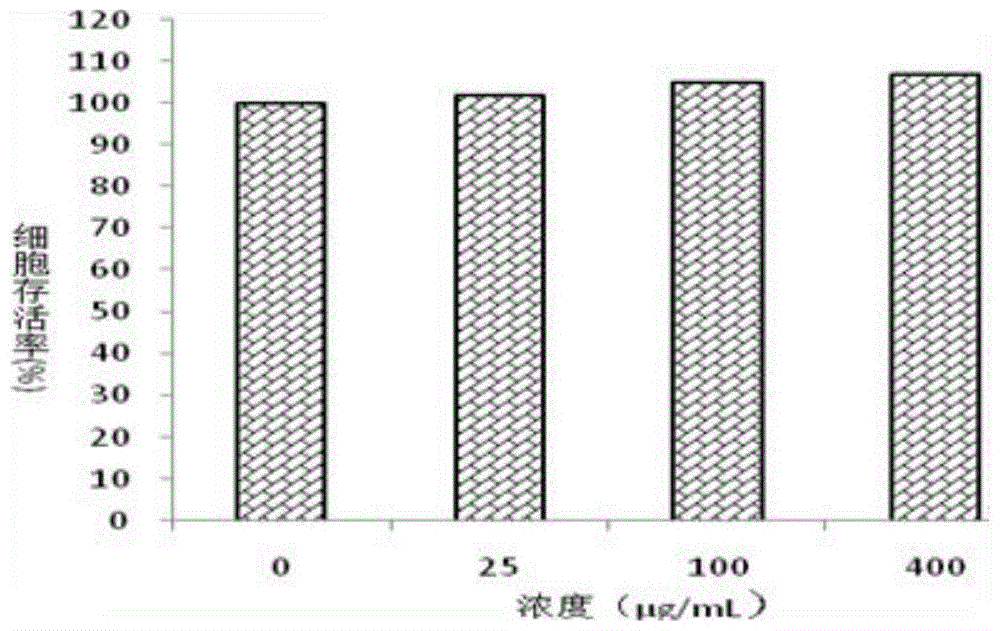
图1不同浓度白及多糖对raw264.7细胞的存活率影响
图2不同浓度白及多糖诱导raw264.7细胞分泌tnf-α的水平
具体实施方式
实施例1:最佳酶解工艺条件的确定
选择果胶酶酶解,以葡萄糖作标准曲线,所得多糖提取液按硫酸-苯酚法计算提取率。首先通过单因素试验考察酶添加量,酶解温度,酶解时间,ph值,通过设置不同梯度酶解条件初步确定范围,再利用响应面优化出最佳酶解工艺条件。
单因素实验:酶添加量的考察:在酶解温度为50℃,时间75min,ph值5.5,液料比100∶1的条件下,依次考察酶添加量为0.8%、1.0%、1.2%、1.4%、1.6%、1.8%对白及多糖提取率的影响。从实验结果可知,白及多糖提取率随着酶添加量的增多而上升,在酶添加量为1.2%以后上升缓慢,所以酶添加量定为1.2%。酶解温度的考察:在酶添加量为1.2%,时间85min,ph值5.5,液料比100∶1的条件下,依次考察酶解温度为40、45、50、55、60、65℃对白及多糖提取率的影响。从实验结果可知,在55℃之前,白及多糖提取率随着酶解温度的增加而升高,但55℃之后,温度越高,提取率却越小,可能温度过高使得酶活性降低所致。所以选择55℃为酶解温度。酶解时间的考察:在酶添加量为1.2%,温度55℃,ph值5.5,液料比100∶1的条件下,依次考察酶解时间为55、70、85、100、115min对白及多糖提取率的影响。从实验结果可知,酶解时间在85min以后随着时间延长多糖提取率增加缓慢。所以选择酶解时间为85min。ph的考察:在酶添加量为1.2%,温度55℃,酶解时间85min,液料比100∶1的条件下,依次考察ph为4.0、4.5、5.0、5.5、6.0、6.5。从实验结果可知ph为5.5时提取率最高。所以选择ph为5.5。
响应面优化实验设计:在单因素考察的基础上,选择酶添加量(a)、ph值(b)、酶解温度(c)、酶解时间(d)为自变量,多糖提取率为响应值。采用designexpertv8.0.6软件进行四因素三水平星点设计试验,试验设计见表1。
表1白及多糖的提取工艺因素水平表
在单因素试验的基础上,运用响应面-星点设计法优化白及多糖提取率的试验结果见表2和表3。其中表2为星点设计试验和结果;表3为多糖优化工艺所建立的回归方程的方差分析。
表2响应面设计试验与结果
表3多糖优化工艺所建立的回归方程的方差分析
通过design-expertv8.6.0表2试验结果进行多元线性回归二项式拟合,得方程为y=+59.50+2.99a-0.11b-4.83c+0.17d-1.80ab+2.83ac+1.35ad+0.35bc+2.08bd+1.32cd-4.03a2-6.78b2-13.70c2-3.90d2,方程r2=0.9203,表明方程可信度较好,能够分析和预测多糖的酶解工艺。经预测分析所得的最佳优化条件为:酶添加量1.40%,酶解温度54.71℃,ph5.43,酶解时间87.54min,此条件多糖提取率期望值为58.29%。
根据响应面法优化的白及多糖最佳酶解工艺,以酶添加量1.40%,酶解温度54.71℃,酶解时间87.54min,ph5.43。此条件下平行检测5次,多糖得率均值为58.32%。
因此确定最佳的提取工艺条件为:酶添加量1.40%,酶解温度54.71℃,酶解时间87.54min,ph5.43
实施例2:针对本发明实施例1制备的及多糖的抗氧化活性验证
样品溶液的制备:白及多糖溶液的制备:取白及多糖适量,精密称定,加蒸馏水制得0.1、0.2、0.4、0.8、1.6、3.2mg/ml的多糖溶液。vc对照品溶液的制备:取vc对照品适量,精密称定,加水溶解,配制成8mg/ml的对照品溶液,加蒸馏水稀释为0.1、0.2、0.4、0.8、1.6、3.2mg/ml的vc对照品溶液。
dpph·清除能力的测定:往试管分别加入2ml各浓度样品溶液,再依次加入1ml蒸馏水和2ml0.1mmol/ldpph溶液,混合充分,于25℃条件下避光反应40min。在517nm处测吸光度(am)。固定其它操作,以2ml蒸馏水代替dpph溶液,所测得吸光度为试样本吸收值(a1);以2ml蒸馏水代替样品液,所测得吸光度为空白吸收值(a0);阳性对照为vc。计算公式如下:
dpph自由基清除力/%=[a0-(am-a1)]/a0×100
通过实验结果分析可知白及多糖对dpph·有一定的清除作用,且随着浓度(0.1-3.2mg/ml)的增加而逐渐增强,在1.6mg/ml后清除率增加缓慢,在浓度为3.2mg/ml时,其dpph·清除率高达43.6%。
oh清除能力的测定:往试管分别加入1ml各浓度样品溶液,再依次加入8mmol/lh2o2溶液、蒸馏水、8mmol/lfeso4溶液及10mmol/l水杨酸无水乙醇溶液各1ml,混合充分,于37℃条件下水浴30min。在510nm处测吸光度(am)。固定其它操作,以1ml蒸馏水代替水杨酸溶液,所测得吸光度为试样本吸收值(a1);以1ml蒸馏水代替样品液,所测得吸光度为空白吸收值(a0);阳性对照为vc。清除率公式如下:oh自由基清除力/%=[a0-(am-a1)]/a0×100
实验结果表明白及多糖对oh自由基有一定的清除作用,且随着浓度(0.1-3.2mg/ml)的增加而逐渐增强,在1.6mg/ml后清除率增加缓慢,在浓度为3.2mg/ml时,其oh自由基清除率高达74.8%。
abts+·清除能力的测定:分别配制14mmol/labts溶液和4.9mmol/lk2s2o7溶液,按1∶1比例混合,配制终浓度为7mmol/labts和2.45mmol/lk2s2o7混合液,室温避光条件下放置12h,制得abts储备液。使用时用无水乙醇将pbs储备液稀释至734nm处吸光度为0.70±0.05的工作液。分别取2ml各浓度样品溶液和2mlabts工作液混合,室温反应20min,在734nm处测吸光度值,阳性对照为vc。清除率公式如下:abts+自由基/%=[(acontrol-asample)/acontrol]×100式中:acontrol为2mlabts工作液与2ml无水乙醇混合后的吸光度;asample为2mlabts工作液与2ml样品混合后的吸光度。
结果表明白及多糖对abts+自由基有一定的清除作用,且随着浓度(0.1-3.2mg/ml)的增加而逐渐增强,在1.6mg/ml后清除率增加缓慢,在浓度为3.2mg/ml时,其abts+自由基清除率高达51.7%。
实施例3:针对本发明实施例1制备的及多糖的的免疫活性验证
raw264.7细胞培养:精密称取白及多糖适量,配制成25、100、400μg/ml3个浓度供试液;空白组(bc):dmem培养基组;对照组(pc):1μg/mllps组;实验组:不同浓度白及多糖组。细胞培养:小鼠巨噬细胞系raw264.7细胞,10%胎牛血清、1ml胰酶(0.25%trypsin-0.53mmedta)的90%dmem培养基,在37℃、5.0%co2的细胞培养箱中传代培养。
mtt法检测各浓度白及多糖对细胞存活率的影响:采用mtt法测定细胞存活率。选取对数生长期raw264.7细胞,按1×106个/ml、100μl/孔接种于96孔板中,置于37℃、5%的co2培养箱培养过夜,吸去上清,加入不同浓度白及多糖各100μl继续培养24h,吸去上清,每孔加入mtt工作液100μl,继续培育3h后每孔加入mtt终止液100μl继续培养20h,用酶标仪在550nm处测定od值,实验重复3次,计算细胞的相对存活率。
相对细胞存活率=(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)×100%
结果表明:不同浓度白及多糖对raw264.7细胞存活率的影响。结果表明不同浓度白及多糖对细胞的生长没有抑制作用;不同浓度样品的细胞存活率高于100%,对细胞的生长具有一定的促进作用,在所测定的浓度范围(25、100、400μg/ml)内,细胞的存活率呈现浓度依赖性,。具体见附图1。
白及多糖诱导raw264.7细胞活化释放免疫因子tnf-α:将密度为1×106个/ml细胞按每孔100μl接种于96孔板中,置于37℃、5.0%co2细胞培养箱中培养过夜,吸去上清,分别加入100μl不同浓度白及多糖实验组、空白组、阳性对照组继续培养24h。按elisa检测试剂盒操作方法对tnf-α进行定量测定,根据标准曲线计算出细胞因子tnf-α的分泌量。
结果表明:不同时间段的酶解产物分别孵育24、36、48h后对raw264.7细胞分泌tnf-α的影响。在所测定的浓度范围内(25、100、400μg/ml),不同时间段的酶解产物能显著抑制lps诱导的巨噬细胞raw264.7中tnf-α的分泌量,且呈明显剂量依赖性关系。结果显示白及多糖具有抑制促炎因子产生的作用。
以上所述仅是本发明的优选实施方式,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!