细胞凋亡信号调节激酶抑制剂及其应用的制作方法
本发明涉及药物化学领域,具体涉及细胞凋亡信号调节激酶抑制剂及其应用。
背景技术:
丝裂原活化蛋白激酶(mapk)信号级联将不同的细胞外和细胞内队列与适当的细胞应激反应结合起来,包括细胞生长、分化、炎症以及细胞凋亡。mapk以依次活化的三个成员map3k、map2k和mapk的方式存在。mapk3直接响应环境信号并使map2k磷酸化,继而特定地磷酸化mapk,mapk随后通过使包括调节基因表达的转录因子的细胞底物磷酸化来介导适当的细胞反应。
细胞凋亡信号调节激酶1(ask1)是活化c-junn端蛋白激酶(jnk)和p38map激酶的丝裂原活化蛋白激酶激酶激酶(map3k)家族成员。通过包括氧化应激、反应性氧物质(ros)、lps、tnf-α、fasl、er应激以及提高的细胞内钙浓度的多种刺激活化ask1,激活后的ask1通过thr838处的自体磷酸化活化使map2k(如mkk3/6和mkk4/7)磷酸化,然后分别使p38和jnkmapk磷酸化和活化。ask2是与ask1共有45%序列同源性的相关map3k。虽然ask2组织分布受限制,但在一些细胞类型中,已报导ask1和ask2在蛋白质复合物中相互作用并且一起起作用。在非应激条件中,ask1通过结合到其阻遏物硫氧还蛋白(trx)并且通过与akt缔合来保持非活性状态。
研究表明ask1的过度表达与肝纤维化的发生发展密切相关,当ask1活化时可导致其下游的两个激酶jnk和p38发生磷酸化,磷酸化的jnk和p38激酶可导致多种炎性细胞因子的生成,以及促进与纤维化相关的基因的表达,这将会导致肝星状细胞由静息态转化为激活态,激活态的肝星状细胞是产生细胞外基质的最主要的细胞,而细胞外基质中含有大量的胶原蛋白(主要包括ⅰ型、ⅲ型和ⅳ型胶原等),当胞外基质大量沉积时,则会引起纤维化的发生。因此,当ask1被激活时,可导致肝星状细胞的活化,从而引起细胞外基质的沉积,最终导致肝纤维化的发生。另外,ask1蛋白质的磷酸化可能导致细胞凋亡或者其它细胞反应,取决于细胞类型。据报导,ask1活化和信号传导还可在包括神经变性疾病、心血管疾病、炎性疾病、自身免疫性疾病以及代谢病症的宽范围的疾病中发挥重要作用。
技术实现要素:
本发明提供了充当ask1抑制剂的新型化合物。
具有ask1抑制活性的如通式(i)所示的化合物、其药学上可接受的盐、对映异构体、非对映异构体、外消旋体或它们的混合物,以及其药学上可接受的盐、结晶水合物及溶剂合物:
其中x1、x2和x3独立的为c或n;
r1选自取代或未取代的芳基或杂芳基,所述的取代为单取代或多取代,取代基选自c1-6的烷基、c3-6的环烷基、c1-6的卤代烷基;
r2代表
r3选自c1-4的烷基或烷氧基。
作为本发明的优选,x1和x3为n,x2为c。
作为本发明的优选,r1选自取代的芳基,所述的取代基为c1-6的烷基,进一步优选c3-5的烷基,最优选叔丁基。
作为本发明的优选,r2选自
作为本发明的进一步优选,本发明部分化合物的代号及化学结构如下:
本发明的式(i)化合物可以用下列方法制备:
1)将化合物i-1溶于适量二甲基亚砜(或n,n-二甲基甲酰胺),在搅拌下加入碳酸钾、碘化亚铜,最后加入6-溴六元杂环甲酸甲酯,氮气保护,升温至130~150℃,回流反应12h。反应结束后冷却反应液至室温,依次用水、二氯甲烷和食盐水洗涤反应液,无水硫酸钠干燥,抽滤后浓缩,经过石油醚/乙酸乙酯柱层析,得到化合物i-2。
化合物i-2的合成反应式:
2)将化合物i-2溶于适量甲醇中,氢氧化锂溶于适量水中(甲醇:水=10:1),在0℃条件下将氢氧化锂的水溶液缓慢滴加到反应液中,滴加完毕移至室温,反应4~6h。反应结束后,旋蒸除去甲醇,浓缩后溶解于二氯甲烷(或乙酸乙酯),依次用水,10%柠檬酸水溶液和饱和食盐水洗涤反应液,无水硫酸钠干燥,抽滤后浓缩,经过石油醚/乙酸乙酯柱层析,得到化合物i-3。
化合物i-3的合成反应式:
3)将化合物i-3溶于适量溶解于二氯甲烷(或四氢呋喃,或氯仿),放置于0℃,搅拌下依次加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc.hcl)和1-羟基苯并三唑(hobt),转移至室温,搅拌下反应1~3h。将r2h和三乙胺溶解于二氯甲烷(或四氢呋喃,或氯仿),搅拌下室温反应1~3h。再将两个反应体系混合,搅拌下室温反应6~12h。反应结束后,依次用水,10%柠檬酸水溶液和饱和食盐水洗涤反应液,无水硫酸钠干燥,抽滤后浓缩,经过二氯甲烷/甲醇柱层析,得到化合物i。
化合物i的合成反应式:
本发明的另一个目的是提供一种药物组合物,该药物组合物包含治疗有效量的选自所述通式(i)化合物、其对映异构体、非对映异构体、外消旋体及其混合物以及其药学上可接受的盐、结晶水合物及溶剂合物中的一种或多种;以及一种或多种药学上可接受的载体。
本发明再一个目的是提供一种所述通式(i)化合物、其对映异构体、非对映异构体、外消旋体及其混合物以及其药学上可接受的盐、结晶水合物及溶剂合物在制备治疗与ask1受体相关的疾病的药物中的应用,优选在制备治疗ask1激活或信号传递引起的疾病的药物中的应用,进一步优选在制备治疗神经变性疾病、心血管疾病、肾脏疾病疾病、炎症、纤维化疾病、呼吸道疾病、自体免疫性疾病和新陈代谢紊乱疾病、癌症的药物中的应用,更进一步优选在制备治疗糖尿病、糖尿病性肾病、慢性肾病、肺或肾纤维化、慢性阻塞性肺病、急性肺部损伤、纤维化、急性或慢性肝病的药物中的应用。
本发明化合物或其药学上可接受的盐可通过添加药学上可接受的载体制成各种制剂。在临床用于口服、注射、局部用药等。
有益效果:
本发明提供了一类结构新颖的化合物,药效学实验证明:本发明的化合物对ask1受体有较好的抑制能力,具有理想的抗i型胶原合成活性,能体外有效抑制纤维化的形成,且对正常细胞毒性较低。因此,本发明的化合物可以用于治疗多种纤维化及相关性疾病。
附图说明
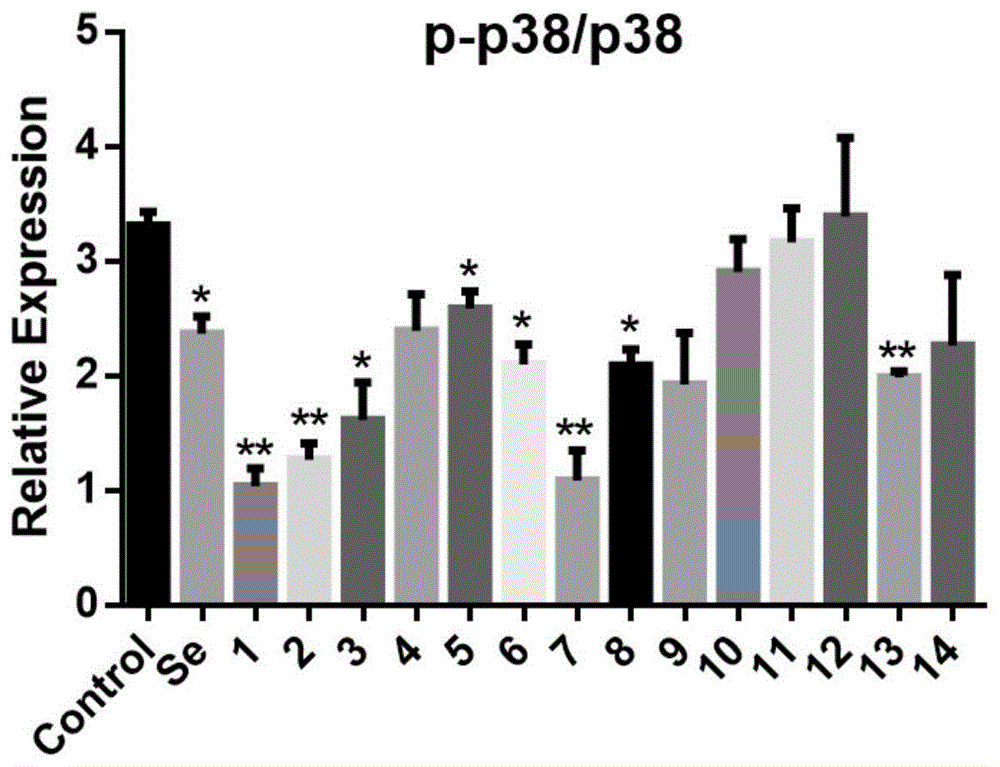
图1为本发明化合物对蛋白激酶p38磷酸化的相对表达量的影响
图2为本发明化合物对ⅰ型胶原合成量的影响
具体实施方式
通过以下实施例对本发明进一步解释,但这些实施例不对本发明构成任何限制。
实施例1
化合物1的制备,结构式如下:
将6-溴吡啶甲酸(50g,0.249mol)溶解于300ml甲醇中,在0℃搅拌状态下向反应液中缓慢滴加100ml浓硫酸,滴加完毕后0℃搅拌30min,再升温至65℃,回流反应3h。反应结束后冷却至室温,然后将反应液倾入3l冰水中。将析出的固体过滤并用冷水洗,烘干得白色结晶固体51g,收率:95%。熔点:67-78℃;1hnmr(300mhz,dmso)δ(ppm)8.08(dd,j=1.51hz,1.39hz,1h),7.94(d,j=1.51hz,1h),7.92(d,j=1.39hz,1h),3.90(s,3h).ms(tof)m/z:215.9[m+h]+.
实施例2
化合物2的制备,结构式如下:
将4-甲基-2-氨基苯甲腈(50g,0.378mol)溶解于400ml二甲基亚砜中,在搅拌状态下加入碳酸钾(78.5g,0.568mol),0℃条件下向反应液中缓慢滴加200ml30%过氧化氢溶液,滴加完毕后0℃搅拌1h,再移至室温反应4h。反应结束后0℃条件下向反应液中加入500ml水,然后将析出的固体过滤并用冷水洗,烘干得淡黄色固体52g,收率:92%。熔点:87-93℃;1hnmr(300mhz,cdcl3)δ(ppm)7.42(d,j=8.07hz,1h),6.46(s,1h),6.29(d,j=8.07hz,1h),2.15(s,3h).ms(tof)m/z:151.1[m+h]+.
实施例3
化合物3的制备,结构式如下:
将化合物2(52g,0.346mol)溶解于300ml1,2二氯乙烷中,在搅拌状态下加入三乙胺(52.5g,0.519mol),0℃条件下向反应液中缓慢加入二碳酸二叔丁酯(151.0g,0.692mol),滴加完毕后0℃搅拌30min,再升温至60℃反应2h。反应结束后将反应液冷却至室温,浓缩除去大部分溶剂,然后将固体用100ml乙酸乙酯溶解,0℃条件下向溶液中加入150ml石油醚进行重结晶。将析出固体抽滤,石油醚洗涤,重复重结晶操作两次。烘干得黄色固体65g,收率:75%。熔点:59-73℃;1hnmr(300mhz,cdcl3)δ(ppm)8.26(s,1h),7.40(d,j=7.91hz,1h),6.83(d,j=7.91hz,1h),2.40(s,3h),1.55(s,9h).ms(tof)m/z:273.1[m+na]+.
实施例4
化合物4的制备,结构式如下:
将化合物3(65g,0.260mol)溶解于500ml乙腈中,在搅拌状态下加入n-溴代琥珀酰亚胺(69.4g,0.39mol),升温至85℃反应4h。反应结束后将反应液冷却至室温,抽滤除去不溶物,将滤液浓缩除去溶剂,然后将固体用100ml乙酸乙酯溶解,0℃条件下向溶液中加入150ml石油醚进行重结晶。将析出固体抽滤,石油醚洗涤,重复重结晶操作两次。烘干得棕黄色固体69g,收率:81%。熔点:86-93℃;1hnmr(300mhz,cdcl3)δ(ppm)7.49(s,1h),7.18(s,1h),2.42(s,3h),1.50(s,9h).ms(tof)m/z:351.0[m+na]+.
实施例5
化合物5的制备,结构式如下:
将化合物4(69g,0.210mol)加入1l反应瓶,在0℃条件下缓慢滴加500ml盐酸二氧六环溶液,0℃反应6~8h。反应结束后将反应液浓缩除去溶剂,烘干得淡黄色固体42g,收率:88%。熔点:71-85℃;1hnmr(300mhz,dmso)δ(ppm)7.73(s,1h),6.65(s,1h),2.20(s,3h).ms(tof)m/z:228.9[m+h]+.
实施例6
化合物6的制备,结构式如下:
将化合物5(42g,0.184mol)加入500ml反应瓶,搅拌条件下加入300ml甲酸溶液,升温至100℃反应5~8h。反应结束后将反应液浓缩除去大部分溶剂,加入200ml水,在0℃条件下缓慢滴加饱和碳酸氢钠溶液至反应液呈中性,将析出固体抽滤,大量水洗涤,烘干得灰色固体37g,收率:84%。熔点:82-96℃;1hnmr(300mhz,dmso)δ(ppm)8.20(s,1h),8.11(s,1h),7.66(s,1h),2.48(s,3h).ms(tof)m/z:238.9[m+h]+.
实施例7
化合物7的制备,结构式如下:
将化合物6(10g,0.042mol)溶解于300ml1,4二氧六环中,加入叔丁基苯硼酸(11.2g,0.063mol),将碳酸钾(8.7g,0.063mol)溶于20ml水中,在搅拌状态下滴加碳酸钾水溶液,最后迅速将四三苯基膦钯(4.8g,0.004mol)加入溶液中,氮气保护,升温至100℃,回流反应12h。反应结束后冷却反应液至室温,浓缩除去溶剂,加入200ml二氯甲烷溶解,再依次用水和食盐水洗涤有机层,无水硫酸钠干燥,抽滤后浓缩,经过石油醚/乙酸乙酯柱层析,得到淡黄色固体8.3g,收率:68%。熔点:73-77℃;1hnmr(300mhz,dmso)δ(ppm)8.07(s,1h),7.85(s,1h),7.60(s,1h),7.49(d,j=8.20hz,2h),7.33(d,j=8.20hz,2h),2.37(s,3h),1.34(s,9h).ms(tof)m/z:293.1[m+h]+.
实施例8
化合物8的制备,结构式如下:
将化合物7(8.3g,0.028mol)溶解于250ml二甲基亚砜中,在搅拌下加入碳酸钾(5.9g,0.043mol)、碘化亚铜(0.5g,0.003mol),最后加入化合物1(9.2g,0.043mol),氮气保护,升温至130~150℃,回流反应12h。反应结束后冷却反应液至室温,依次用水、二氯甲烷和食盐水洗涤反应液,无水硫酸钠干燥,抽滤后浓缩,经过石油醚/乙酸乙酯柱层析,得到淡黄色固体7.3g,收率:61%。熔点:65-76℃;1hnmr(300mhz,cdcl3)δ(ppm)8.66(s,1h),8.21(s,1h),8,19(s,1h),8.11(d,j=8.00hz,1h),8.04(t,j=8.00hz,1h),7.67(s,1h),7.46(d,j=8.12hz,2h),7.31(d,j=8.12hz,2h),4.03(s,3h),2.46(s,3h),1.38(s,9h).ms(tof)m/z:450.2[m+na]+.
实施例9
化合物9的制备,结构式如下:
将化合物8(7.3g,0.017mol)溶解于200ml甲醇中,将氢氧化锂(0.61g,0.025mol)溶于5ml水中,在0℃条件下将氢氧化锂的水溶液缓慢滴加到反应液中,滴加完毕移至室温,反应4~6h。反应结束后,浓缩除去甲醇,加入100ml二氯甲烷溶解,再依次用水、10%柠檬酸水溶液和饱和食盐水洗涤,无水硫酸钠干燥,抽滤后浓缩,经过石油醚/乙酸乙酯柱层析,得到黄色油状物6.7g,收率:95%。1hnmr(300mhz,cdcl3)δ(ppm)8.61(s,1h),8.32(s,1h),8,21(s,1h),8.19-8.13(m,2h),7.67(s,1h),7.47(d,j=8.15hz,2h),7.30(d,j=8.15hz,2h),2.46(s,3h),1.38(s,9h).ms(tof)m/z:436.1[m+h]+.
实施例10
化合物a-3的制备,结构式如下:
将化合物9(2g,0.005mol)溶解于50ml二氯甲烷中,放置于0℃,搅拌下依次加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1.4g,0.007mol)和1-羟基苯并三唑(0.99g,0.007mol),转移至室温,搅拌下反应1~3h。将甘氨酸(0.64g,0.007mol)和三乙胺(0.74g,0.007mol)溶解于二氯甲烷,搅拌下室温反应1~3h。再将两个反应体系混合,搅拌下室温反应6~12h。反应结束后,依次用水,10%柠檬酸水溶液和饱和食盐水洗涤反应液,无水硫酸钠干燥,抽滤后浓缩,经过二氯甲烷/甲醇柱层析,得到黄色油状物2.1g,收率:87%。1hnmr(300mhz,cdcl3)δ(ppm)8.60(s,1h),8.30(s,1h),8,23(s,1h),8.09(s,2h),8.07(s,1h),7.69(s,1h),7.48(d,j=8.16hz,2h),7.32(d,j=8.16hz,2h),4.29(d,j=5.68hz,2h),3.79(s,3h),2.47(s,3h),1.38(s,9h).13cnmr(75mhz,cdcl3)δ(ppm)169.36,162.91,159.77,150.02,148.61,148.04,146.03,145.88,143.81,143.74,142.06,139.14,136.62,128.37,128.27,127.51,124.72,124.07,121.81,119.25,51.92,40.80,34.11,30.87,29.65,29.17,28.83,20.88.hrms,esi+,m/z:calcdforc28h28n4o4[m+h]+,485,2111;found,485.2187.
实施例11
化合物a-5的制备,结构式如下:
将化合物a-3(2.1g,0.004mol)溶解于50ml甲醇中,将氢氧化锂(0.16g,0.006mol)溶于1ml水中,在0℃条件下将氢氧化锂的水溶液缓慢滴加到反应液中,滴加完毕移至室温,反应4~6h。反应结束后,浓缩除去甲醇,加入50ml二氯甲烷溶解,再依次用水、10%柠檬酸水溶液和饱和食盐水洗涤,无水硫酸钠干燥,抽滤后浓缩,经过二氯甲烷/甲醇柱层析,得到黄色油状物1.6g,收率:85%。1hnmr(300mhz,cdcl3)δ(ppm)8.93(s,1h),8.22(s,1h),8,07(s,2h),7.66(s,1h),7.47(d,j=8.20hz,2h),7.35(s,1h),7.30(d,j=8.20hz,2h),4.38(d,j=5.67hz,2h),2.47(s,3h),1.38(s,9h).13cnmr(75mhz,cdcl3)δ(ppm)149.22,144.90,143.02,139.66,136,85,128.82,128.23,127.38,125.26,124.26,123.94,122.51,119.45,53.36,34.62,33.50,31.89,31.48,31.41,31.34,30.19,29.66,29.32,24.71,22.65,21.39,14.06.hrms,esi+,m/z:calcdforc27h26n4o4[m+h]+,471.1954;found,471.2025.
实施例12
化合物a-1的制备,结构式如下:
将化合物a-5(1.6g,0.003mol)溶解于50ml甲醇中,在0℃条件下将硼氢化钠(0.19g,0.005mol)加入反应液中,然后移至室温,反应4~6h。反应结束后,浓缩除去甲醇,加入20ml二氯甲烷溶解,再依次用水和饱和食盐水洗涤,无水硫酸钠干燥,抽滤后浓缩,经过二氯甲烷/甲醇柱层析,得到黄色油状物1.1g,收率:80%。1hnmr(300mhz,cdcl3)δ(ppm)8.24(s,1h),8.11(s,1h),8,01(s,2h),7.99(s,1h),7.90(s,1h),7.46(d,j=8.20hz,2h),7.30(d,j=8.20hz,2h),6.75(s,1h),3.91(t,j=4.82hz,2h),3.71(d,j=5.26hz,2h),2.34(s,3h),1.41(s,9h).13cnmr(75mhz,cdcl3)δ(ppm)164.47,163.40,150.62,149.21,146.88,146.50,143.93,142.69,139.16,138.05,137.14,134.09,130.05,128.45,124.50,123.70,121.20,117.93,116.31,114.82,61.55,57.66,41.83,34.01,30.88,29.17,20.66.hrms,esi+,m/z:calcdforc27h28n4o3[m+h]+,459.2161;found,459.2392.
实施例13
化合物a-4的制备,结构式如下:
按实施例10中的制备方法,用缬氨酸(0.86g,0.0073mol)代替甘氨酸合成化合物a-4。1hnmr(300mhz,cdcl3)δ(ppm)8.60(s,1h),8.28(s,1h),8,24(s,1h),8.08(s,2h),8.06(s,1h),7.68(s,1h),7.48(d,j=8.31hz,2h),7.32(d,j=8.31hz,2h),4.76-4.71(m,1h),3.77(s,3h),2.48(s,3h),2.35-2.29(m,1h),1.39(s,9h),1.1(t,j=7.06hz,6h).13cnmr(75mhz,cdcl3)δ(ppm)171.40,162.53,159.79,150.02,148.86,147.95,145.89,143.82,143.69,142.08,139.11,136.62,130.07,128.37,128.27,127.54,124.72,124.04,123.89,121.87,119.31,57.02,51.71,34.11,30.92,30.86,29.17,20.89,18.65,17.46.hrms,esi+,m/z:calcdforc31h34n4o4[m+h]+,527.2580;found,527.2549.
实施例14
化合物a-2的制备,结构式如下:
按实施例11中的制备方法,用化合物a-4替代化合物a-3进行水解反应,合成化合物a-2。1hnmr(300mhz,cdcl3)δ(ppm)8.28(d,j=7.47hz,1h),8.24(s,1h),8,22(s,1h),8.11(d,j=8.07hz,1h),8.05(d,j=8.07hz,7.47hz,1h),7.68(s,1h),7.48(d,j=7.87hz,2h),7.30(d,j=7.87hz,2h),4.88-4.59(m,1h),2.48(s,3h),2.44-2.40(m,1h),1.38(s,9h),1.09-1.05(m,6h).13cnmr(75mhz,cdcl3)δ(ppm)147.56,144.56,138.66,138.48,128.06,127.84,127.64,127.23,126.62,124.26,124.15,123.11,121.47,118.00,117.47,116.58,56.69,56.39,30.91,30.37,30.11,28.68,28.33,21.66,20.40,19.80,18.24,17.21,16.75,13.07.hrms,esi+,m/z:calcdforc30h32n4o4[m+h]+,535.2424;found,535.2321.
实施例15
化合物a-6的制备,结构式如下:
按实施例12中的制备方法,用化合物a-2替代化合物a-5进行还原反应,合成化合物a-6。1hnmr(300mhz,cdcl3)δ(ppm)8.14(s,1h),7.95(s,1h),7.94(s,1h),7.85(s,1h),7.42(d,j=7.85hz,2h),7.24(d,j=7.85hz,3h),6.69(s,1h),3.91(s,1h),3.81(d,j=3.85hz,2h),2.28(s,3h),2.08-2.02(m,1h),1.36(s,9h),1.04-0.99(m,6h).13cnmr(75mhz,cdcl3)δ(ppm)164.85,163.78,151.15,149.74,147.52,146.75,143.17,138.66,137.65,134.86,130.67,128.97,125.04,121.86,118.56,116.87,115.60,64.16,58.13,57.40,34.53,31.91,31.39,29.68,29.27,22.67,21.17,19.73,18.66,14.08.hrms,esi+,m/z:calcdforc30h34n4o4[m+h]+,499.2631;found,499.2699.
实施例16
化合物a-7的制备,结构式如下:
按实施例10中的制备方法,用n,n-二乙基乙二胺替代甘氨酸进行酰胺缩合反应,合成化合物a-7。1hnmr(300mhz,cdcl3)δ(ppm)8.61(s,1h),8.27(t,1h),8.23(s,1h),8.05(s,1h),8.04(s,1h),7.68(s,1h),7.47(d,j=8.39hz,2h),7.31(d,j=8.39hz,3h),3.57-3.54(m,2h),3.71(t,2h),2.64-2.60(m,4h),2.46(s,3h),1.38(s,9h),1.07(t,6h).13cnmr(125mhz,cdcl3)δ(ppm)163.13,160.32,150.49,149.99,148.34,146.47,144.28,144.20,142.47,139.45,137.14,128.84,128.80,128.00,125.20,123.93,121.98,119.81,51.87,47.18,37.27,34.60,31.89,31.36,29.66,29.63,29.32,22.65,21.36,14.06,11.96.hrms,esi+,m/z:calcdforc30h34n4o4[m+h]+,512.2947;found,512.3024.
实施例17
化合物a-8的制备,结构式如下:
按实施例10中的制备方法,用1-(2-氨乙基)哌啶替代甘氨酸进行酰胺缩合反应,合成化合物a-8。1hnmr(300mhz,cdcl3)δ(ppm)8.64(s,1h),8.27(dd,j=2.37hz,1h),8.23(s,1h),8.05(s,1h),8.04(s,1h),7.68(s,1h),7.47(d,j=8.22hz,2h),7.31(d,j=8.22hz,2h),3.61-3.57(m,2h),3.01(s,3h),2.60(t,j=6.24hz,2h),2.04-1.95(m,4h),1.64-1.59(m,4h),1.47-1.42(m,2h),1.38(s,9h).13cnmr(125mhz,cdcl3)δ(ppm)163.13,160.34,150.49,149.94,148.32,146.47,144.30,144.21,142.48,139.47,137.14,128.85,128.79,128.01,125.20,123.86,121.95,119.81,114.03,57.15,54.36,39.09,31.89,31.36,29.66,29.32,25.91,24.27,22.65,21.36,14.06.hrms,esi+,m/z:calcdforc32h37n5o2[m+h]+,524.2947;found,524.3019.
实施例18
化合物a-9的制备,结构式如下:
按实施例10中的制备方法,用3-氨基-1,2-丙二醇替代甘氨酸进行酰胺缩合反应,合成化合物a-9。1hnmr(300mhz,cdcl3)δ(ppm)8.58(s,1h),8.25-8.22(m,1h),8.15(s,1h),8.04(d,j=1,84hz,1h),8.02(s,1h),7.60(s,1h),7.44(d,j=8.30hz,2h),7.26(d,j=8.30hz,2h),3.97-3.93(m,1h),3.73-3.62(m,4h),2.41(s,3h),1.37(s,9h).13cnmr(75mhz,cdcl3)δ(ppm)164.15,159.65,150.05,148.65,147.91,145.61,143.92,143.86,142.11,139.21,136.51,128.06,127.47,124.72,123.82,121.71,70.53,63.49,52.87,42.03,31.41,30.86,29.17,28.83,22.16,20.86,13.57.hrms,esi+,m/z:calcdforc28h30n4o4[m+h]+,487.2267;found,487.2348.
实施例19
化合物a-10的制备,结构式如下:
按实施例10中的制备方法,用n-(2-氨基乙基)吗啉替代甘氨酸进行酰胺缩合反应,合成化合物a-10。1hnmr(500mhz,cdcl3)δ(ppm)8.64(s,1h),8.31(s,1h),8.27(s,1h),8.10(s,1h),8.09(s,1h),7.72(s,1h),7.51(d,j=8.20hz,2h),7.35(d,j=8.20hz,2h),3.77(t,j=4.55hz,4h),3.64(q,j=6.07hz,2h),2.67(t,j=6.27hz,2h),2.57(s,4h),2.51(s,3h),1.42(s,9h).13cnmr(125mhz,cdcl3)δ(ppm)163.09,160.31,150.53,149.82,148.33,146.42,144.33,144.17,142.59,139.59,137.10,128.84,127.99,125.22,124.01,122.00,119.77,67.02,57.06,53.42,53.38,35.95,34.60,31.89,31.41,30.19,29.66,22.65,21.37,14.06.hrms,esi+,m/z:calcdforc31h35n5o3[m+h]+,526.2740;found,526.2806.
实施例20
化合物a-11的制备,结构式如下:
按实施例10中的制备方法,用3-二乙胺基丙胺替代甘氨酸进行酰胺缩合反应,合成化合物a-11。1hnmr(500mhz,cdcl3)δ(ppm)8.53(s,1h),8.29(d,j=7.67hz,1h),8.22(s,1h),8.04(t,j=7.67hz,7.86hz,1h),7.98(d,j=7.86hz,1h),7.68(s,1h),7.47(d,j=8.29hz,2h),7.31(d,j=8.29hz,2h),3.60-3.57(m,2h),2.62-2.60(m,2h),2.57-2.55(m,4h),2.47(s,3h),1.82-1.79(m,2h),1.38(s,9h),1.02-0.99(m,6h).13cnmr(125mhz,cdcl3)δ(ppm)163.20,160.29,150.50,150.35,148.41,146.51,144.42,144.20,142.47,139.44,137.13,128.85,127.98,125.20,123.99,122.22,119.75,51.68,47.01,44.52,39.50,34.60,31.89,31.36,29.66,29.32,25.89,22.65,21.37,14.06,11.33.hrms,esi+,m/z:calcdforc32h39n5o2[m+h]+,526.3104;found,526.3190.
实施例21
化合物a-12的制备,结构式如下:
按实施例10中的制备方法,用1(3-氨丙基)-4-甲基哌嗪替代甘氨酸进行酰胺缩合反应,合成化合物a-12。1hnmr(500mhz,cdcl3)δ(ppm)8.20(d,j=7.77hz,1h),8.07(s,1h),7.99(t,j=7.96hz,7.77hz,1h),7.89(s,1h),7.85(d,j=7.96hz,1h),7.56(s,1h),7.52(d,j=8.32hz,2h),7.34(d,j=8.32hz,2h),2.57-2.55(m,2h),2.50(s,3h),2.34(s,3h),2.11-2.06(m,6h),1.65-1.62(m,2h),1.43(s,9h).13cnmr(125mhz,cdcl3)δ(ppm)150.57,149.53,147.62,144.02,143.47,142.39,141.00,139.46,137.04,131.08,128.08,128.74,127.79,125.72,125.24,124.39,124.35,119.45,115.53,115.37,114.02,56.86,45.05,44.53,31.90,31.35,29.66,29.32,22.65,21.34,15.62,14.06.hrms,esi+,m/z:calcdforc33h40n6o2[m+h]+,551.3213;found,551.3125.
实施例22
化合物a-13的制备,结构式如下:
按实施例10中的制备方法,用n-(3-氨丙基)吗啉替代甘氨酸进行酰胺缩合反应,合成化合物a-13。1hnmr(500mhz,cdcl3)δ(ppm)8.54(s,1h),8.34(d,j=7.81hz,1h),8.27(s,1h),8.11(t,j=7.81hz,7.96hz,1h),8.02(d,j=7.96hz,1h),7.71(s,1h),7.51(d,j=8.22hz,2h),7.36(d,j=8.22hz,2h),3.68-3.66(m,4h),3.64-3.60(m,2h),2.51(s,3h),2.38(s,6h),1.89-1.84(m,2h),1.43(s,9h).13cnmr(125mhz,cdcl3)δ(ppm)163.16,160.31,150.52,150.21,148.50,146.45,144.33,144.29,142.60,139.66,137.10,128.85,128.76,127.99,125.21,124.30,122.38,119.74,66.80,57.13,53.77,38.68,34.60,32.69,31.90,31.48,29.67,27.39,25.81,22.66,21.39.hrms,esi+,m/z:calcdforc32h37n5o3[m+h]+,540.2896;found,540.2967.
实施例23
化合物a-14的制备,结构式如下:
按实施例10中的制备方法,用4-甲基-1-哌嗪乙胺替代甘氨酸进行酰胺缩合反应,合成化合物a-14。1hnmr(500mhz,cdcl3)δ(ppm)8.39(s,1h),8.05(s,1h),8.02(s,1h),7.81(s,1h),7.53(d,j=8.16hz,2h),7.34(d,j=8.16hz,2h),7.25(s,1h),4.03-3.98(m,2h),2.69(s,3h),2.51(s,3h),2.10-2.00(m,8h),1.65-1.62(m,2h),1.44(s,9h).13cnmr(125mhz,cdcl3)δ(ppm)159.41,150.63,146.16,144.15,1139.57,139.23,131.69,130.90,128.79,127.80,125.91,125.27,124.55,123.53,119.43,115.30,114.03,44.59,33.79,32.57,31.90,31.35,30.13,29.67,29.33,29.13,28.94,26.83,25.02,22.66,21.37,14.06.hrms,esi+,m/z:calcdforc32h38n6o2[m+h]+,539.3056;found,539.3118.
下面是本发明部分化合物的药效学试验及结果,化合物代号对应的结构式见实施例。阳性药selonsertib(缩写为se)的结构式:
实施例24:化合物抑制ask1的能力测定:
实验方法:采用westernblot的方法,通过测定ask1下游的重要激酶p38的磷酸化水平表征化合物对ask1的抑制活性。
a.蛋白提取
取对数生长期的lx2(人肝星状细胞)细胞接种于6孔板中,调整细胞密度为1×105个/孔,置于37℃,5%co2恒温培养箱内培养,利用培养液将配制的10mg/ml待测化合物的dmso母液稀释成1μm,于37℃,5%co2恒温培养箱内孵育1h,再加入1mm链脲霉素孵育1h。吸取培养基,pbs洗涤,加入sds裂解液120μl/孔,用细胞刮板迅速刮遍板底部,将液体吸出至ep管,冰浴放置30min,ep管中加入5×sds-page蛋白上样缓冲液,置于水中100℃加热10min,用于后续试验。
b.westernblot过程
(1)配制10%分离胶。液面上层加满蒸馏水,室温放置20min,吸去水层。
(2)配制5%浓缩胶。加入分离胶上层,插入梳齿,室温放置20min。
(3)上样。将蛋白样品分别加入浓缩胶的孔洞中,20μl/孔,于边缘孔洞中加入marker5μl,用1×loadingbuffer补齐至20μl。
(4)电泳。将胶板置入电泳槽中,加入runningbuffer,100v条件下电泳85min。
(5)转膜。电泳结束前,剪裁滤纸与1张pvdf膜,并用甲醇浸泡5min,再用1×transfer浸泡。电泳结束后,裁剪下分离胶,放置于pvdf膜上,于胶与膜外侧分别放置滤纸,并用夹板固定,置入电泳槽,冰浴下300ma条件转膜90min。
(6)封闭非特异性蛋白结合。转膜结束后,将膜取出,裁剪出目标条带,并浸泡于50ml牛奶中,置于37℃下,50rpm摇晃1h。倒出牛奶,加入tbst洗涤3次,每次5min。
(7)孵育一抗。将条带分别与5%bsa稀释的phospho-p38mapk(thr180/tyr182)抗体和p38mapk抗体共孵12h,tbst洗涤。
(8)孵育二抗。用tbs配制的5%奶粉稀释羊抗兔二抗,与条带37℃条件下共孵1h,tbst洗涤。
(9)化学发光。配制显影液,润湿条带,使用全自动化学发光图像分析系统成像。从而测定激酶p38的磷酸化含量。
实验结果见表1,药效试验证明,在给予链脲霉素刺激的情况下,本发明化合物a-1、a-2、a-3、a-5、a-6、a-7、a-8、a-13具有较好的抑制p38激酶磷酸化的能力,并且a-1、a-2和a-7的抑制活性优于阳性对照,其中化合物a-1表现出最佳的抑制活性。
表1:本发明化合物体外抗p38激酶磷酸化活性
*p<0.05,**p<0.01vscontrol
实施例25:化合物体外抗i型胶原合成能力测定:
实验方法:将对数生长期的lx2(人肝星状细胞)细胞以细胞密度为1×105个/孔接种于6孔板中,置于37℃,5%co2恒温培养箱内培养,将待测化合物以1μm的浓度加入培养板中,并给予tgfβ1刺激。孵育24h后进行蛋白提取,最后通过westernblot的方法测定lx2细胞i型胶原合成量。用graphpadprism软件计算各化合物相对与阳性对照的抗ⅰ型胶原合成量和95%可信区间。
实验结果见表2,药效试验证明,本发明部分化合物具有较好的体外抗i型胶原合成能力。其中化合物a-4、a-6、a-8的抗i型胶原合成能力均明显高于阳性对照selonsertib。其中化合物a-6表现出了最佳的抗i型胶原合成活性。
表2本发明化合物体外抗ⅰ型胶原合成的相对活性
*p<0.05,**p<0.01vsselonsertib.
实施例26:化合物对正常细胞毒性的测定:
取对数生长期的l02细胞(人正常肝细胞),调整细胞密度为1×105个/ml的细胞悬液,接种于96孔细胞培养板中,每孔接种细胞悬液200μl,置于37℃,5%co2恒温培养箱内培养。细胞接种24h后,弃去上清,利用dmem/f-12不完全培养液将配制的10mg/ml待测化合物的dmso母液稀释成1μm、10μm、20μm和50μm,每孔给予200ul此溶液,每个化合物设6个平行孔;同时每块板均设3个调零孔(不铺细胞仅含200uldmem/f-12培养液)及3个对照孔(仅铺细胞不给药),继续置于37℃,5%co2恒温培养箱内培养。细胞与药物共孵育24h后弃上清,每孔加入100μl含10%cck-8的无血清培养基继续培养2h。用酶标仪测定波长450nm的吸光值(d450),重复测定三次。用graphpadprism软件计算各化合物细胞活力值和95%可信区间。
实验结果见表3,药效实验结果证明,本发明化合物对肝细胞l02不具有明显毒性,部分化合物的安全性可比拟阳性对照selonsertib。
表3本发明化合物对l02细胞的毒性
- 还没有人留言评论。精彩留言会获得点赞!