含脲基苯并咪唑类衍生物及其制备方法和应用与流程
本发明涉及药物化学合成领域,具体涉及含脲基苯并咪唑类衍生物及其制备方法和应用。
背景技术:
慢性肾病(ckd)是一类疾病的总称,包括糖尿病肾病、高血压肾病、肾小球肾炎、iga肾病、肾盂肾炎、过敏性紫癜肾炎、红斑狼疮肾炎、痛风肾、肾病综合征、多囊肾等。ckd的发病率和(尤其是)患病率有逐年增长的趋势。ckd的发病率与患者年龄呈正相关,且已经出现低龄化趋势。然而,ckd在普通人群中的知晓率低,临床上缺乏有效的防治手段。
导致ckd的诱因较多,有糖尿病、高血压、肥胖、感染等。不同诱因导致的ckd有相同的病理改变,即伴有炎症的肾脏纤维化。临床上除了控制高血糖、高血压、高血脂以及限制蛋白的摄入等基础治疗外,血管紧张素转化酶抑制剂(acei)和血管紧张素受体抑制剂(arb)已成为国际公认的防治糖尿病肾病的一线药物。acei和arb类药物在糖尿病肾病的早期能调节肾小球血流动力学,抑制肾纤维化,降低微量的蛋白尿等肾脏保护作用。然而,acei和arb类药物在糖尿病肾病晚期疗效方面并无优势,且可能出现程度不等的血肌酐升高现象,有引起肾功能不全的风险。因而,与其他疾病不同的是,即使较好地控制了病因,ckd仍会持续进展,针对病理过程的治疗是控制ckd重要且必须的手段。
目前,针对病理过程的药物治疗策略主要包括抗炎或抗纤维化单一策略和兼有双重作用的多靶点策略等。研究表明,纤维化与炎症之间存在复杂的相互作用,单纯抑制纤维化并不能阻断炎症,由于炎症引发的细胞通透性增加会使肾脏产生蛋白尿恶化;同样单纯阻断炎症过程,肾脏的纤维化程度由于tgf-β等促纤维细胞因子的持续刺激,细胞外基质过度沉积,加重肾脏的负担和功能丧失。而且,临床试验结果显示现有的药物多存在潜在风险(如作为抗炎药物的三萜类化合物bardoxolonemethyl通过诱导对nk-κb信号通路具有抑制作用的核因子nrf2以减少炎症和氧化应激,发挥对肾脏的保护作用,但由于提升患者死于心血管功能异常的风险,被迫终止iii期临床试验)。因此,单纯阻断炎症或纤维化的治疗策略目前没有取得成功。多靶点药物吡非尼酮兼有抗炎和抗纤维化双重作用,具有较好的糖尿病肾病治疗应用前景,但其半衰期短、活性低、用量及副作用大,对于需要长期用药的慢性肾病治疗而言其应用受到限制。因此,慢性肾病治疗药物研发需要新的思路与策略。
同源结构域相互作用蛋白激酶(hipk)家族包含4个成员:hipk1,hipk2,hipk3及hipk4,在正常水平下表达水平均较低,hipk1和hipk3主要分布在心脏、平滑肌等组织,hipk2主要在分布在肾脏病变部位,hipk4研究较少。hipk2可以调控慢性肾病模型中的炎症及纤维化过程(natmed,2012,18,580)。jiny等人研究发现,与对照组相比,多种患者肾病组织(hiv感染、糖尿病肾病、iga肾病、局灶性节段性肾小球硬化)中hipk2处于高表达水平。在人肾小管上皮细胞hk-2细胞模型中,hipk2可直接与smad3相互作用,激活smad3通路,促进纤维化的产生;通过激活wnt-β-catenin及notch通路调控上皮间质转化;通过抑制iκb-α激活nf-κb通路激活炎症的发生;调节p53介导的自噬过程。综上所述,hipk2可同时调节纤维化与炎症过程,hipk2抑制剂用作慢性肾病治疗药物是一个很有前景的领域。
近年来,有研究者们为考察其他激酶抑制剂的脱靶效应测定了化合物对hipk不同亚型的抑制作用,这些抑制剂多数被用于抗肿瘤药物研究,有些已获批上市,如索拉菲尼、舒尼替尼等。
目前,直接以hipk2为靶点的慢性肾病治疗药物研究报道极少。文献(plosone,2014,9,e891762)报道了一类2-芳基-4,5,6,7-四溴异吲哚-1,3-二酮衍生物(通式vi),该类化合物可以抑制肝癌细胞hipk2对p53蛋白ser46的磷酸化。但化合物对hipk1-3亚型无选择性,且并无对纤维化或慢性肾病相关的数据报道。
文献(jamsocnephrol,2017,28,2133)和专利wo2018129274公开了一类噁二唑类(通式vii)hipk2抑制剂可通过抑制hipk2与smad3的相互作用改善单侧输尿管结扎和tg26小鼠模型的肾纤维化,但该类化合物并不直接抑制hipk2的激酶活性。
其中z为噁二唑环;x选自c或nh;r1和r2分别独立选自c1-c8烃基,-oh,o(c1-c8)烃基,卤素,硝基,c1-c3烷氨基,c1-c3二烷氨基,c1-c3酰胺基,c1-c3烷磺酰基,c1-c3烷硫基,c1-c3卤代烷基,c1-c3卤代烷氧基,c1-c3卤代烷硫基,-cooh,c1-c3烷氧羰基,b(or3)2,bf3k;r3选自h,c1-c8烃基;或(or3)2整体选自二杂氧戊硼烷或二杂氧己硼烷。
鉴于慢性肾病重大的临床需求和hipk2抑制剂的良好前景,本领域迫切需要开发有效的hipk2抑制剂。
技术实现要素:
本发明所要解决的技术问题是:解决上述现有技术存在的问题,提供一种含脲基苯并咪唑类衍生物及其制备方法和应用,有效抑制hipk2,并能对ipk1-3亚型有选择性,同时调节纤维化与炎症过程。
本发明采用的技术方案是:
一种含脲基苯并咪唑类衍生物,结构通式如式(i)所示:
其中,
r1选自氢、c1-c6脂肪链、c3-c6脂肪环、取代c3-c6脂肪环、芳环、取代芳环、芳杂环和取代芳杂环其中一种;
r2选自氢、甲基、三氟甲基、二甲胺基、芳环、芳杂环、取代芳环和取代芳杂环其中一种;
a部分选自芳环、芳杂环、取代芳环和取代芳杂环其中一种;
b部分选自脂肪杂环、芳杂环、c1-c4开链胺类化合物、c1-c6直链或支链烷氧基、c1-c6直链或支链烷烃、c3-c6脂肪环和取代c3-c6脂肪环其中一种;
n=1~6。
优选的,所述芳环选自苯、萘和蒽其中一种;
优选的,所述芳杂环选自吡咯、呋喃、噻吩、咪唑、噻唑、噁唑、吡唑、异噁唑、噻二唑、噁二唑、四氮唑、吡啶、嘧啶、吡嗪、哒嗪、嘌呤、喹啉、异喹啉、吲哚、吖啶和咔唑其中一种;
优选的,所述脂肪杂环选自吡咯烷、哌嗪、哌啶、二氧六环和四氢呋喃其中一种;
优选的,所述取代芳环或取代芳杂环中的取代基选自羟基、甲基、甲氧基、氨基、三氟甲基和卤素其中一种。
优选的,上述含脲基苯并咪唑类衍生物,其药学上可用的盐是盐酸盐、硫酸盐、磷酸盐、高氯酸盐、甲磺酸盐、三氟甲磺酸盐、甲酸盐、乙酸盐、丙酸盐、丁酸盐、马来酸盐、丁二酸盐、三氟乙酸盐、琥珀酸盐、水杨酸盐、dl-天冬氨酸盐、d-天冬氨酸盐、l-天冬氨酸盐、dl-谷氨酸盐、d-谷氨酸盐、l-谷氨酸盐、甘油酸盐、硬脂酸盐、dl-酒石酸盐、d-酒石酸盐、l-酒石酸盐、(±)扁桃酸盐、(r)-(-)扁桃酸盐、(s)-(+)扁桃酸盐、柠檬酸盐、粘酸盐、丙二酸盐、苯甲酸盐、dl-苹果酸盐、(±)乳酸盐、l-(+)-乳酸盐、d-(+)-乳酸盐、扑酸盐、d-α-半乳糖醛酸盐、甘油酸盐、dl-半胱氨酸盐、d-半胱氨酸盐、l-半胱氨酸盐、(4s)-羟基-l-脯氨酸盐、环丙烷-1,1-二羧酸盐、2,2-甲基丙二酸盐、酪氨酸盐、脯氨酸盐、富马酸盐、1-羟基-2-萘甲酸盐、膦酰基乙酸盐、碳酸盐、碳酸氢盐、3-膦酰基丙酸盐、dl-焦谷氨酸盐、d-焦谷氨酸盐、l-焦谷氨酸盐、对甲苯磺酸盐、苯磺酸盐、乙磺酸盐、(±)樟脑磺酸盐、萘磺酸盐、1r-(-)-樟脑磺酸盐、1s-(+)-樟脑磺酸盐、1,5-萘二磺酸盐、1,2-乙烷二磺酸盐、1,3-丙烷二磺酸盐、3-(n-吗啉代)丙烷磺酸盐、联苯基磺酸盐,羟乙基磺酸盐、1-羟基-2-萘磺酸盐、磷酸二氢盐、磷酸氢钾盐、磷酸二钾盐、磷酸钾盐、磷酸氢钠盐、磷酸二钠盐、磷酸钠盐、磷酸二氢钠盐、磷酸钙盐、三代磷酸钙盐、六氟代磷酸盐、乙烯基磷酸盐、2-羟基乙基磷酸盐和苯基磷酸盐。
优选的,b部分选自脂肪杂环、c1-c4开链胺类化合物、c1-c6直链或支链烷氧基、c1-c6直链或支链烷烃、c3-c6脂肪环和取代c3-c6脂肪环其中一种。
优选的,b部分选自脂肪杂环、c3-c6脂肪环和取代c3-c6脂肪环其中一种。
优选的,b部分为脂肪杂环,所述脂肪杂环选自吡咯烷、哌嗪、哌啶、二氧六环和四氢呋喃其中一种。
优选的,a部分为芳环或取代芳环。
优选的,r1为芳环或取代芳环。
优选的,r2为甲基或三氟甲基。
优选的,上述含脲基苯并咪唑类衍生物具体为以下化合物:
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-吗啉乙基)脲;
1-(2-吗啉乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(3-吗啉丙基)脲;
1-(3-吗啉丙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-(哌啶-1-基)乙基)脲;
1-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(2-(哌啶-1-基)乙基)脲;
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-(吡咯烷-1-基)乙基)脲;
1-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(2-(吡咯烷-1-基)乙基)脲;
1-异戊基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-异戊基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(3-(吡咯烷-1-基)丙基)脲;
1-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(3-(吡咯烷-1-基)丙基)脲;
1-(2-环己基乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-(2-环己基乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-戊基脲;
1-戊基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-丁基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-丁基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(环己基甲基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-(环己基甲基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-异丁基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-异丁基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲;
1-(2-甲氧基乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-(3-甲氧基乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-yl)苯基)脲;
1-(3-甲氧基丙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-(3-甲氧基丙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-yl)苯基)脲;
1-(3-(二乙胺)乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
1-(3-(二乙胺)丙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲;
本发明还公开了一种含脲基苯并咪唑类衍生物的制备方法,包括以下步骤:
s1、化合物ii在催化剂醋酸钯作用下与硼酸取代物发生耦联反应得到化合物iii,所述硼酸取代物上的取代基选自氨基苯、氨基萘、氨基蒽、氨基菲、取代氨基苯、取代氨基萘、取代氨基蒽和取代氨基菲;所述硼酸取代物结构如式iv所示:
s2、化合物iii与伯胺在缩合剂的作用下形成所述含脲基苯并咪唑类衍生物,所述缩合剂选自三光气、n,n'-羰基二咪唑和氯甲酸对硝基酚酯其中一种;所述伯胺结构如式v所示:
其中:
r1选自氢、c1-c6脂肪链、c3-c6脂肪环、取代c3-c6脂肪环、芳环、取代芳环、芳杂环和取代芳杂环;
r2选自氢、c1-c6的烷基、c1-c6的卤代烷基、c1-c6的烷基胺基、芳环、芳杂环、取代芳环和取代芳杂环;
a选自芳环、芳杂环、取代芳环和取代芳杂环其中一种;
b选自脂肪杂环、芳杂环、c1-c4开链胺基、c1-c6直链或支链烷氧基、c1-c6直链或支链烷烃、c3-c6脂肪环和取代c3-c6脂肪环其中一种;
n=1~6。
本发明还公开了上述含脲基苯并咪唑类衍生物在制备治疗慢性肾病药物制备中的应用。优选的,其作为活性成分用于制备抗糖尿病肾病药物。
本发明作为选择性同源结构域相互作用蛋白激酶-2(hipk2)抑制剂,能够同时下调hipk2的蛋白水平,发挥双重作用,对hipk2激酶及蛋白水平、纤维化信号分子smad3、炎症信号分子iκb-α磷酸化水平均具有抑制作用,可同时调节纤维化与炎症过程,在慢性肾病治疗上具有良好的市场应用前景。
附图说明
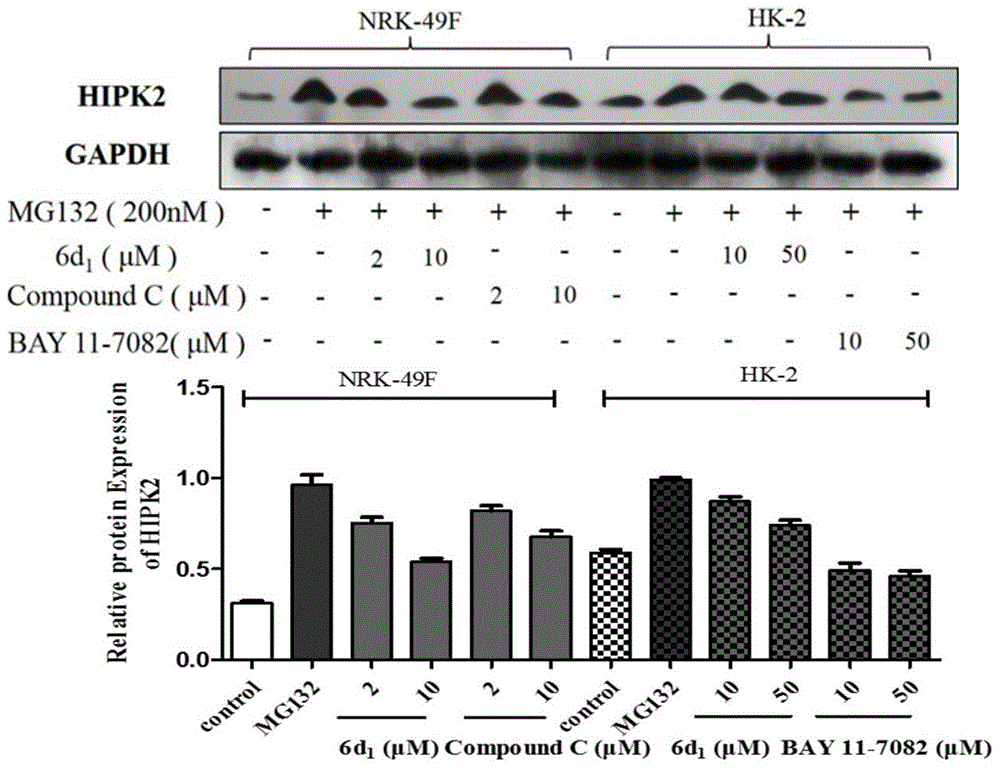
图1为实施例7制备的化合物6d1对hipk2的影响;
图2为实施例7制备的化合物6d1对纤维化通路的影响;
图3为实施例7制备的化合物6d1对炎症通路的影响。
具体实施方式
以下实施例以a部分选取苯环进行说明,具体反应方程式如下:
实施例11-(2-吗啉乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6a2)
1、制取4-溴-2-硝基-n-苯胺(3)
将根据文献方法由1和2制备或购置2-氟-5-溴硝基苯(4.4g,20mmol)和苯胺(2.2ml,24mmol)加入装有15ml水的微波管中,于120℃下反应4h。冷却后,用乙酸乙酯萃取3次,乙酸乙酯层用饱和nacl溶液洗涤,无水na2so4干燥并放置4h。旋干有机溶剂,用石油醚进行硅胶柱层析分离,得到橙红色结晶4.92g,产物3与原料1极性非常相近,即使是用极性最小的石油醚展开,二者位移值依旧非常相近,较难得到纯品,直接投入下一步反应。
2、制取5-溴-1-苯基-2-(三氟甲基)-1h-苯并咪唑(4b)
在50ml三颈瓶中,加入铁粉(0.4g,7.2mmol),20ml三氟乙酸,滴加2-3滴浓盐酸催化,随后在超声中活化3min。在反应体系中加入步骤一中得到的4-溴-2-硝基-n-苯胺(0.58g,2mmol),于回流下反应6h,停止反应后静置至室温。以20g硅藻土用布氏漏斗除去铁屑,用乙酸乙酯冲洗至硅藻土基本无产物残留。减压旋蒸除去大部分溶剂,以饱和koh溶液调ph至7,乙酸乙酯萃取3次,饱和nacl溶液洗涤3次,无水na2so4干燥并放置4h,旋干有机溶剂。粗产物经过硅胶柱层析分离(以pe:ea=3:1分离反应原料,极性增至1:1分离出产物),得到4a共0.37g。
白色晶体,收率:80%,mp:70.8-71.9℃。1hnmr(500mhz,dmso-d6):δ8.20(d,j=1.7hz,2h),7.67(s,2h),7.60(d,j=1.9hz,1h),7.58(d,j=1.9hz,1h),7.17(s,1h),7.15(s,1h).13cnmr(125mhz,dmso-d6):δ141.81,136.57,133.98,130.81,130.41,129.43,127.94,123.82,122.18,119.98,117.78,116.67,115.73,113.78.hrms(esi)m/zcalcdfor[c14h8brf3n2+h]+:340.9823;found:340.9901[m+h]+.
3、制取叔丁基(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)羰基酰胺(5b)
在50ml茄形瓶中加入步骤2中制得的5-溴-1-苯基-2-(三氟甲基)-1h-苯并咪唑(0.5g,1.74mmol),boc保护的对氨基苯硼酸(0.5g,2.12mmol),pd(oac)2(0.008g,0.04mmol),k2co3(0.8g,5.78mmol),加入20mldmf溶解。ar保护,于80℃下反应5h。所得溶液在室温下冷却4h。将冷却后的反应液加入盛有80ml水的200ml烧杯中,静置2h,过滤,得灰色黏稠物。将黏稠物烘干,进行硅胶柱柱层析(石油醚:乙酸乙酯=1:1),得到5a共0.28g。
白色晶体,收率72%,mp:176.9-177.3℃。1hnmr(400mhz,dmso-d6):δ9.47(s,1h),8.15(d,j=1.2hz,1h),7.73(dd,j=8.7,1.6hz,1h),7.71–7.61(m,7h),7.58(d,j=8.7hz,2h),7.23(d,j=8.7hz,1h),1.50(d,j=4.5hz,9h).
4、制取1-(2-吗啉乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6a2)
在50ml茄形瓶中加入20ml甲苯,三光气(0.187g,0.4mmol),在-20℃,ar保护的条件下搅拌10min。将反应温度升温至0℃,将中间体叔丁基(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)羰基酰胺(0.35g,1mmol)溶于5ml甲苯,缓慢滴加约5min,搅拌10min,此时反应体系中有大量白色沉淀生成。将反应瓶移出冷阱,擦干瓶底,升温至回流,反应4.5h至反应液澄清。反应冷却至室温,滴加溶解于5ml甲苯的氨乙基吗啉溶液(0.197ml,1.5mmol),搅拌30min后停止反应。用二氯甲烷:甲醇=15:1进行硅胶柱层析,旋干有机溶剂,接着用甲醇作洗脱剂进行凝胶柱层析,得化合物6a2共0.3g。
黄色油状物,收率:60%。1hnmr(400mhz,cdcl3):δ8.10(d,j=1.1hz,1h),7.65–7.58(m,6h),7.47(d,j=8.4hz,4h),7.29(s,1h),7.23(d,j=8.6hz,1h),5.63(s,1h),3.78–3.73(m,4h),3.44(dd,j=11.1,5.3hz,2h),2.62(dd,j=13.0,7.5hz,4h),2.51(s,2h).13cnmr(100mhz,cdcl3):δ155.98,141.01,138.30,137.37,136.44,135.96,134.35,130.02,129.86,128.08,127.39,125.46,120.91,119.06,111.43,66.70,57.45,53.36,36.74.hrms(esi)m/zcalcdfor[c27h26f3n5o2+h]+:510.2039;found:510.2101[m+h]+.
实施例21-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-吗啉乙基)脲(6a1)
1、制备4-溴-2-硝基-n-苯胺(3)
将2-氟-5-溴硝基苯(4.4g,20mmol),苯胺(2.2ml,24mmol)加入装有15ml水的微波管中,于120℃下反应4h。冷却后,用乙酸乙酯萃取3次,乙酸乙酯层用饱和nacl溶液洗涤,无水na2so4干燥并放置4h。旋干有机溶剂,用石油醚进行硅胶柱层析分离,得到橙红色结晶4.92g,产物3与原料1极性非常相近,即使是用极性最小的石油醚展开,二者位移值依旧非常相近,较难得到纯品,直接投入下一步反应。
2、5-溴-2-甲基-1-苯基-1h-苯并咪唑(4a)
在50ml三颈瓶中,加入铁粉(0.4g,7.2mmol),20ml冰醋酸,滴加2-3滴浓盐酸催化,随后在超声中活化3min。在反应体系中加入4-溴-2-硝基-n-苯基苯胺(1)(0.58g,2mmol),于回流下反应6h,停止反应后静置至室温。以20g硅藻土用布氏漏斗除去铁屑,用乙酸乙酯冲洗至硅藻土基本无产物残留。减压旋蒸除去大部分溶剂,以饱和koh溶液调ph至7,乙酸乙酯萃取3次,饱和nacl溶液洗涤3次,无水na2so4干燥并放置4h,旋干有机溶剂。粗产物经过硅胶柱层析分离(以pe:ea=3:1分离反应原料,极性增至1:1分离出产物),得到4a共0.37g。
白色粉末,收率:64%,mp:122.2-123.8℃。1hnmr(400mhz,dmso-d6):δ7.83(d,j=1.6hz,1h),7.64(d,j=7.7hz,2h),7.59(d,j=7.3hz,1h),7.57–7.54(m,2h),7.32(dd,j=8.5,1.8hz,1h),7.07(d,j=8.5hz,1h),2.44(s,3h).13cnmr(100mhz,dmso-d6):δ153.44,144.18,135.43,130.42,129.40,127.21,125.57,121.30,114.50,112.06,14.37.hrms(esi)m/zcalcdfor[c14h11brn2+h]+:287.0106;found:287.0184[m+h]+.
3、制备叔丁基(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)羰酰胺(5a)
在50ml茄形瓶中加入5-溴-2-甲基-1-苯基苯并咪唑(0.5g,1.74mmol),boc保护的对氨基苯硼酸(0.5g,2.12mmol),pd(oac)2(0.008g,0.04mmol),k2co3(0.8g,5.78mmol),加入20mldmf溶解。ar保护,于80℃下反应5h。所得溶液在室温下冷却4h。将冷却后的反应液加入盛有80ml水的200ml烧杯中,静置2h,过滤,得灰色黏稠物。将黏稠物烘干,进行硅胶柱柱层析(石油醚:乙酸乙酯=1:1),得到5a共0.28g。
白色固体,收率:40%,mp:125.8-127.1℃。1hnmr(500mhz,dmso-d6):δ9.42(s,1h),7.84(d,j=1.2hz,1h),7.66(t,j=7.6hz,2h),7.62–7.57(m,4h),7.57–7.53(m,3h),7.45(dd,j=8.4,1.6hz,1h),7.16(d,j=8.4hz,1h),2.46(s,3h),1.50(s,9h).13cnmr(100mhz,dmso-d6):δ153.18,152.46,143.46,138.84,136.05,135.70,135.08,134.89,130.49,129.19,127.44,127.31,121.65,118.95,116.41,110.54,79.51,28.61,14.57.
4、1-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-吗啉乙基)脲(6a1)
在50ml茄形瓶中加入20ml甲苯,三光气(0.187g,0.4mmol),在-20℃,ar保护的条件下搅拌10min。将反应温度升温至0℃,将中间体5a(0.35g,1mmol)溶于5ml甲苯,缓慢滴加约5min,搅拌10min,此时反应体系中有大量白色沉淀生成。将反应瓶移出冷阱,擦干瓶底,升温至回流,反应4.5h至反应液澄清。反应冷却至室温,滴加溶解于5ml甲苯的氨乙基吗啉溶液(0.197ml,1.5mmol),搅拌30min后停止反应。用二氯甲烷:甲醇=15:1进行硅胶柱层析,旋干有机溶剂,接着用甲醇作洗脱剂进行凝胶柱层析,得化合物6a1共0.3g。
黄色油状物,收率:65.1%。1hnmr(500mhz,dmso-d6):δ8.79(s,1h),8.12(s,1h),7.80–7.69(m,2h),7.64(dd,j=18.2,9.3hz,6h),7.51(d,j=8.1hz,2h),7.23(d,j=8.5hz,1h),6.09(s,1h),3.21(d,j=5.5hz,2h),2.36(s,7h),1.40(s,2h).13cnmr(125mhz,dmso-d6):δ155.60,152.38,143.54,140.04,136.06,135.59,135.06,134.04,130.49,129.18,127.48,127.31,121.63,118.42,116.20,110.51,66.64,58.32,53.70,36.43,14.67.hrms(esi)m/zcalcdfor[c27h29n5o2+h]+:456.2321;found:456.2373[m+h]+.
实施例31-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(3-吗啉丙基)脲(6b1)
化合物6b1的制备方法参考6a2,黄色油状物,收率:63.0%。1hnmr(500mhz,dmso-d6):δ8.59(s,1h),7.82(d,j=1.4hz,1h),7.73–7.64(m,2h),7.63–7.52(m,5h),7.53–7.46(m,2h),7.45(dd,j=8.4,1.6hz,1h),7.16(d,j=8.4hz,1h),6.23(s,1h),3.61(s,4h),3.14(dd,j=12.7,6.6hz,2h),2.46(s,3h),2.42–2.33(m,2h),1.64(s,2h).13cnmr(125mhz,dmso-d6):δ155.60,152.38,143.54,140.04,136.06,135.59,135.06,134.04,130.49,129.18,127.48,127.31,121.63,118.42,116.20,110.51,66.64,58.32,53.70,36.43,14.67.hrms(esi)m/zcalcdfor[c28h31n5o2+h]+:470.2478;found:470.2964[m+h]+.
实施例41-(3-吗啉丙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6b2)
化合物6b2的制备方法参考6a2,黄色油状物,收率:58.9%。1hnmr(400mhz,dmso-d6)δ8.56(s,1h),8.12(d,j=1.2hz,1h),7.75–7.69(m,2h),7.69–7.65(m,4h),7.63(d,j=4.3hz,1h),7.61(s,1h),7.51(d,j=8.7hz,2h),7.23(d,j=8.6hz,1h),7.23(d,j=8.6hz,1h),6.18(t,j=5.7hz,1h),3.62–3.56(m,4h),3.14(dd,j=12.7,6.7hz,2h),2.34(d,j=7.9hz,4h),2.30(d,j=7.3hz,2h),1.61(p,j=7.0hz,2h).13cnmr(125mhz,dmso-d6)δ155.65,141.35,140.60,140.43,137.21,136.60,134.45,133.07,130.67,130.43,128.02,127.73,125.64,122.50,120.34,118.55,118.25,118.18,116.02,112.15,66.68,56.36,53.87,37.98,27.13.hrms(esi)m/zcalcdfor[c28h28f3n5o2+h]+,524.2195;found,524.2243[m+h]+.
实施例51-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-(哌啶-1-基)乙基)脲(6c1)
化合物6c1的制备方法参考6a2,黄色油状物,收率:55.3%。1hnmr(500mhz,dmso-d6):δ8.75(s,1h),7.82(s,1h),7.66(t,j=7.7hz,2h),7.62–7.53(m,5h),7.52–7.46(m,2h),7.45(dd,j=8.4,1.3hz,1h),7.16(d,j=8.4hz,1h),6.09(t,j=5.2hz,1h),3.26–3.16(m,2h),2.46(s,3h),2.43–2.23(m,6h),1.58–1.47(m,4h),1.40(s,2h).13cnmr(125mhz,dmso-d6):δ155.61,152.38,143.52,140.07,136.06,135.58,135.10,134.01,130.50,129.19,127.48,127.31,121.64,118.41,116.21,110.47,58.56,54.48,36.86,25.92,24.57,14.61.hrms(esi)m/zcalcdfor[c28h31n5o+h]+:454.2529;found:454.2581[m+h]+.
实施例61-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(2-(哌啶-1-基)乙基)脲(6c2)
化合物6c2的制备方法参考6a2,黄色油状物,收率:53.1%。1hnmr(500mhz,dmso-d6):δ8.74(s,1h),7.82(d,j=10.3hz,1h),7.63(d,j=21.0hz,2h),7.53(m,5h),7.50–7.31(m,3h),7.15(s,1h),6.11(s,1h),3.54(m,4h),3.23(s,2h),2.47–2.30(m,8h).13cnmr(125mhz,dmso-d6):δ155.60,141.31,140.66,137.19,134.42,132.99,130.68,130.43,128.03,127.75,127.56,125.66,118.41,118.24,112.16,99.99,58.56,54.49,36.87,26.03,24.56.hrms(esi)m/zcalcdfor[c28h28f3n5o+h]+:508.2246;found:508.2314[m+h]+.
实施例71-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(2-(吡咯烷-1-基)乙基)脲(6d1)
化合物6d1的制备方法参考6a2,黄色油状物,收率:54.5%。1hnmr(500mhz,dmso-d6):δ9.19(s,1h),7.83(d,j=1.2hz,1h),7.69–7.64(m,2h),7.58(m,5h),7.52(d,j=8.8hz,2h),7.45(dd,j=8.4,1.6hz,1h),7.16(d,j=8.4hz,1h),6.77(t,j=5.8hz,1h),3.57(d,j=19.5hz,2h),3.49(dd,j=12.5,6.3hz,2h),3.24(t,j=6.2hz,2h),3.03(s,2h),2.46(s,3h),1.92(d,j=8.9hz,4h).13cnmr(125mhz,dmso-d6):δ155.97,152.40,143.50,139.80,136.04,135.60,135.03,134.26,130.50,129.20,127.45,127.31,121.65,118.63,116.21,110.49,54.50,53.83,36.18,23.07,14.74.hrms(esi)m/zcalcdfor[c27h29n5o+h]+:440.2372;found:440.2418[m+h]+.
实施例81-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(2-(吡咯烷-1-基)乙基)脲(6d2)
化合物6d2的制备方法参考6a2,黄色油状物,收率:47.8%。1hnmr(500mhz,dmso-d6):δ8.78(s,1h),8.13(t,j=5.7hz,1h),7.72(dd,j=8.7,1.5hz,1h),7.71–7.67(m,3h),7.67–7.63(m,2h),7.61(d,j=8.7hz,2h),7.50(dd,j=17.1,7.2hz,2h),7.22(d,j=8.6hz,1h),6.22–6.10(m,1h),3.23(dd,j=11.8,6.0hz,2h),2.57–2.51(m,2h),2.48(s,4h),1.71(s,4h).13cnmr(125mhz,dmso-d6):δ155.65,141.35,140.60,140.43,137.21,136.60,134.45,133.07,130.67,130.43,128.02,127.73,125.64,122.50,120.34,118.55,118.25,118.18,116.02,112.15,66.68,56.36,53.87,37.98,27.13.hrms(esi)m/zcalcdfor[c27h26f3n5o+h]+:494.2089;found:494.2169[m+h]+.
实施例91-异戊基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6e1)
化合物6e1的制备方法参考6a2,浅黄色固体,收率60.3%,mp:210.5-212.3℃。
1hnmr(500mhz,dmso-d6):δ8.49(s,1h),7.83(s,1h),7.65(t,j=7.6hz,2h),7.57(dd,j=9.3,8.2hz,5h),7.49(d,j=8.7hz,2h),7.44(dd,j=8.4,1.5hz,1h),7.15(d,j=8.4hz,1h),6.12(t,j=5.6hz,1h),3.13(dd,j=13.4,6.5hz,2h),2.45(s,3h),1.62(m,1h),1.34(dd,j=14.3,7.0hz,2h),0.90(d,j=6.6hz,6h).13cnmr(125mhz,dmso-d6):δ155.65,152.37,143.52,140.06,136.05,135.54,135.11,134.01,130.48,129.17,127.46,127.29,121.64,118.45,116.22,110.46,39.25,37.69,25.60,22.89,14.63.hrms(esi)m/zcalcdfor[c26h28n4o+h]+:413.2263;found:413.2321[m+h]+.
实施例101-异戊基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6e2)
化合物6e2的制备方法参考6a2,浅黄色固体,收率:65.5%,mp:223.0-225.5℃。1hnmr(500mhz,dmso-d6):δ8.53(s,1h),8.12(s,1h),7.73(d,j=8.7hz,1h),7.67(d,j=8.2hz,3h),7.62–7.56(m,4h),7.54–7.48(m,2h),7.22(d,j=8.5hz,1h),6.13(s,1h),3.13(dd,j=13.0,6.5hz,2h),1.62(m,1h),1.35(q,j=6.9hz,2h),0.91(d,j=6.4hz,6h).13cnmr(125mhz,dmso-d6):δ155.61,141.32,140.61,137.21,136.57,134.43,133.02,130.66,130.43,128.01,127.73,125.63,120.33,118.47,118.24,112.08,39.24,37.75,25.62,22.87.hrms(esi)m/zcalcdfor[c26h25f3n4o+h]+:467.1980;found:467.2039[m+h]+.
实施例111-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-(3-(吡咯烷-1-基)丙基)脲(6f1)
化合物6f1的制备方法参考6a2,浅黄色油状物,收率:47.2%。1hnmr(500mhz,dmso-d6):δ8.91(s,1h),7.85(s,1h),7.67(t,j=7.6hz,2h),7.64–7.53(m,5h),7.50(d,j=8.4hz,2h),7.45(d,j=8.5hz,1h),7.16(d,j=8.4hz,1h),6.55(s,1h),3.21–3.17(m,2h),3.12(d,j=7.0hz,2h),2.46(s,3h),2.01–1.89(m,4h),1.89–1.78(m,2h),1.32–1.16(m,4h).13cnmr(125mhz,dmso-d6):δ155.99,139.95,135.99,135.59,135.10,134.11,130.52,129.24,127.45,127.32,121.68,118.55,116.21,110.50,53.54,52.35,36.83,27.07,23.11,14.58.hrms(esi)m/zcalcdfor[c28h31n5o+h]+:454.2529;found:454.2617[m+h]+.
实施例121-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)-3-(3-(吡咯烷-1-基)丙基)脲(6f2)
化合物6f2的制备方法参考6a2,浅黄色油状物,收率:45.8%。1hnmr(500mhz,dmso-d6):δ8.62(s,1h),8.12(d,j=1.2hz,1h),7.72(dd,j=8.7,1.6hz,1h),7.70–7.66(m,3h),7.64(dd,j=7.1,2.7hz,2h),7.61(d,j=8.7hz,2h),7.52(d,j=8.7hz,2h),7.22(d,j=8.6hz,1h),6.21(m,1h),3.15(dd,j=12.7,6.6hz,2h),2.43(t,j=6.8hz,6h),1.71–1.66(m,4h),1.64–1.57(m,2h).13cnmr(125mhz,dmso-d6):δ155.68,141.33,141.00,140.70,140.63,140.40,140.09,137.20,136.55,134.42,133.02,130.64,130.41,127.99,127.71,125.61,120.32,118.50,118.24,112.10,54.08,53.73,38.04,29.49,23.55.hrms(esi)m/zcalcdfor[c28h28f3n5o+h]+:508.2246;found:508.2325[m+h]+.
实施例131-(2-环己基乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6g1)
化合物6g1的制备方法参考6a2,透明油状物,收率:55.9%。1hnmr(500mhz,dmso-d6):δ8.48(s,1h),7.86(s,1h),7.66(d,j=7.5hz,2h),7.64–7.50(m,5h),7.52–7.38(m,3h),7.16(d,j=8.3hz,1h),6.11(s,1h),3.12(d,j=5.5hz,2h),2.47(s,3h),1.68(m,4h),1.62(d,j=10.1hz,1h),1.34(d,j=6.0hz,2h),1.25–1.07(m,4h),0.96–0.84(m,2h).13cnmr(125mhz,dmso-d6):δ155.63,152.55,143.30,140.09,135.97,135.46,135.21,133.93,130.51,129.23,127.46,127.34,121.75,118.44,116.16,110.54,37.75,37.20,35.05,33.17,26.60,26.27,14.63.hrms(esi)m/zcalcdfor[c29h32n4o+h]+:453.2576;found:453.2665[m+h]+.
实施例141-(2-环己基乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6g2)
化合物6g2的制备方法参考6a2,透明油状物,收率:53.3%。1hnmr(500mhz,dmso-d6):δ8.53(s,1h),8.12(s,1h),7.73(dd,j=8.7,1.5hz,1h),7.71–7.67(m,3h),7.66–7.63(m,2h),7.61(d,j=8.6hz,2h),7.50(d,j=8.6hz,2h),7.23(dd,j=11.6,5.6hz,1h),6.13(t,j=5.6hz,1h),3.12(dd,j=12.8,6.5hz,2h),1.69(m,4h),1.62(d,j=11.8hz,1h),1.34–1.24(m,6h),0.90(m,2h).13cnmr(125mhz,dmso-d6):δ155.65,147.66,141.32,141.00,140.72,140.60,140.42,140.12,137.21,136.58,134.42,133.03,130.68,130.44,128.00,127.73,125.65,118.49,118.19,112.15,37.23,35.07,33.17,30.30,26.59,26.26.hrms(esi)m/zcalcdfor[c29h29f3n4o+h]+:507.2293;found:507.2377[m+h]+.
实施例151-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)-3-戊基脲(6h1)
化合物6h1的制备方法参考6a2,浅黄色油状物,收率:62.4%。1hnmr(500mhz,dmso-d6):δ8.50(s,1h),7.84(s,1h),7.66(t,j=6.8hz,2h),7.58(dd,j=15.7,7.5hz,5h),7.51–7.43(m,3h),7.16(d,j=8.4hz,1h),6.18–6.11(m,1h),3.09(dd,j=12.8,6.8hz,2h),2.46(d,j=4.8hz,3h),1.48–1.41(m,2h),1.30(m,4h),0.89(t,j=6.9hz,3h).13cnmr(125mhz,dmso-d6):δ155.68,141.33,141.00,140.70,140.63,140.40,140.09,137.20,136.55,134.42,133.02,130.64,130.41,127.99,127.71,125.61,120.32,118.50,118.24,112.10,54.08,53.73,38.04,29.49,23.55.hrms(esi)m/zcalcdfor[c26h28n4o+h]+:413.2263;found:413.2349[m+h]+.
实施例161-戊基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6h2)
化合物6h2的制备方法参考6a2,浅黄色油状物,收率:53.5%。1hnmr(500mhz,dmso-d6):δ8.53(s,1h),8.12(s,1h),7.77–7.64(m,6h),7.61(d,j=8.6hz,2h),7.51(d,j=8.6hz,2h),7.22(d,j=8.6hz,1h),6.16(t,j=5.6hz,1h),3.09(dd,j=12.9,6.6hz,2h),1.49–1.40(m,2h),1.30(dd,j=13.6,8.3hz,4h),0.89(t,j=6.9hz,3h).13cnmr(125mhz,dmso-d6):δ155.60,141.32,141.00,140.70,140.62,140.40,140.17,137.19,136.57,134.43,132.99,130.67,130.43,128.02,127.73,125.62,120.36,118.44,118.24,112.15,31.61,29.91,29.08,22.36,14.44.hrms(esi)m/zcalcdfor[c26h25f3n4o+h]+:467.1980;found:467.2069[m+h]+.
实施例171-丁基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6i1)
化合物6i1的制备方法参考6a2,浅黄色固体,收率:65.0%,mp:220.3-221.5℃。
1hnmr(500mhz,dmso-d6):δ8.48(s,1h),7.83(s,1h),7.69–7.65(m,2h),7.58(m,5h),7.46(dd,j=15.2,8.6hz,3h),7.16(d,j=8.4hz,1h),6.14(t,j=5.6hz,1h),3.10(dd,j=12.8,6.6hz,2h),2.46(s,3h),1.47–1.39(m,2h),1.34(dd,j=14.9,7.4hz,2h),0.91(t,j=7.3hz,3h).13cnmr(125mhz,dmso-d6):δ155.65,152.36,143.49,140.08,136.06,135.57,135.11,133.98,130.49,129.19,127.46,127.31,121.63,118.43,116.17,110.36,39.19,32.37,20.01,14.71,14.18.hrms(esi)m/zcalcdfor[c25h26n4o+h]+:399.2107;found:399.2246[m+h]+.
实施例181-丁基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6i2)
化合物6i2的制备方法参考6a2,浅黄色固体,收率:58.8%,mp:217.4-219.0℃。
1hnmr(500mhz,dmso-d6):δ8.53(s,1h),8.12(s,1h),7.73(d,j=8.6hz,1h),7.71–7.64(m,5h),7.61(d,j=8.6hz,2h),7.51(d,j=8.6hz,2h),7.23(d,j=8.6hz,1h),6.16(t,j=5.6hz,1h),3.10(dd,j=12.8,6.6hz,2h),1.47–1.39(m,2h),1.32(dd,j=15.1,7.6hz,2h),0.91(t,j=7.3hz,3h)13cnmr(125mhz,dmso-d6):δ155.61,141.32,140.99,140.70,140.62,140.40,140.08,137.19,136.57,134.42,132.99,130.66,130.42,128.02,127.73,125.62,120.33,118.44,118.24,112.14,39.19,32.35,20.06,14.17.hrms(esi)m/zcalcdfor[c25h23f3n4o+h]+:453.1824;found:453.1901[m+h]+.
实施例191-(环己基甲基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6j1)
化合物6j1的制备方法参考6a2,浅黄色油状物,收率:57.7%。1hnmr(500mhz,dmso-d6):δ8.46(s,1h),7.82(d,j=1.3hz,1h),7.66(t,j=7.6hz,2h),7.62–7.53(m,5h),7.49(t,j=11.3hz,2h),7.44(dd,j=8.4,1.6hz,1h),7.16(d,j=8.4hz,1h),6.23–6.14(m,1h),2.96(t,j=6.2hz,2h),2.47(d,j=14.0hz,3h),1.68(t,j=13.4hz,4h),1.63(d,j=11.2hz,1h),1.26–1.16(m,4h),0.98–0.87(m,2h).13cnmr(100mhz,dmso-d6):δ155.71,152.38,143.51,140.06,136.05,135.57,135.10,133.98,130.49,129.18,127.47,127.30,121.63,118.38,116.15,110.47,45.76,38.47,30.81,26.56,25.90,14.67.hrms(esi)m/zcalcdfor[c28h30n4o+h]+:439.2420;found:439.2535[m+h]+.
实施例201-(环己基甲基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6j2)
化合物6j2的制备方法参考6a2,浅黄色油状物,收率:49.8%。1hnmr(400mhz,dmso-d6):δ8.53(s,1h),8.11(s,1h),7.72(dd,j=8.7,1.3hz,1h),7.70–7.65(m,3h),7.65–7.57(m,4h),7.50(d,j=8.5hz,2h),7.21(d,j=8.6hz,1h),6.21(t,j=5.7hz,1h),2.96(t,j=6.2hz,2h),1.67(t,j=11.3hz,4h),1.62(d,j=9.4hz,1h),1.27–1.09(m,4h),0.95–0.84(m,2h).13cnmr(100mhz,dmso-d6):δ155.71,152.38,143.51,140.06,136.05,135.57,135.10,133.98,130.49,129.18,127.47,127.30,121.63,118.38,116.15,110.47,45.76,38.47,30.81,26.56,25.90,14.67.hrms(esi)m/zcalcdfor[c28h27f3n4o+h]+:493.2137;found:493.2217[m+h]+.
实施例211-异丁基-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6k1)
化合物6k1的制备方法参考6a2,浅黄色固体,收率:48.8%,mp:226.6-227.9℃。1hnmr(500mhz,dmso-d6):δ8.49(s,1h),7.83(d,j=1.4hz,1h),7.69–7.64(m,2h),7.61–7.55(m,5h),7.48(d,j=8.7hz,2h),7.45(dd,j=8.4,1.6hz,1h),7.16(d,j=8.4hz,1h),6.21(t,j=5.8hz,1h),2.94(t,j=6.3hz,2h),2.46(s,3h),1.76–1.65(m,1h),0.89(d,j=6.7hz,6h).13cnmr(100mhz,dmso-d6):δ155.75,152.41,143.41,140.03,136.00,135.54,135.13,134.01,130.50,129.21,127.48,127.29,121.68,118.44,116.15,110.50,47.00,28.96,20.47,14.63.hrms(esi)m/zcalcdfor[c25h26n4o+h]+:399.2107;found:399.2198[m+h]+.
实施例221-异丁基-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-基)苯基)脲(6k2)
化合物6k2的制备方法参考6a2,浅黄色固体,收率:43.9%,mp:219.3-221.6℃。1hnmr(400mhz,dmso-d6):δ8.56(s,1h),8.12(d,j=1.2hz,1h),7.73(dd,j=8.7,1.6hz,1h),7.70–7.67(m,3h),7.65(dd,j=7.2,3.0hz,2h),7.62(d,j=8.7hz,2h),7.52(d,j=8.7hz,2h),7.22(d,j=8.7hz,1h),6.25(t,j=5.8hz,1h),2.95(t,j=6.3hz,2h),1.79–1.63(m,1h),0.89(d,j=6.7hz,6h).13cnmr(100mhz,dmso-d6):δ155.76,141.26,140.53,137.19,136.54,134.36,133.05,130.69,130.45,127.97,127.75,125.67,120.46,118.50,118.20,117.83,112.15,47.00,28.93,20.45.hrms(esi)m/zcalcdfor[c25h23f3n4o+h]+:453.1824;found:453.1907[m+h]+.
实施例231-(2-甲氧基乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6l1)
化合物6l1的制备方法参考6a2,浅黄色油状物,收率:65.6%。1hnmr(500mhz,cdcl3):δ8.04(s,1h),7.90(s,1h),7.60(dd,j=10.2,4.7hz,2h),7.56–7.50(m,3h),7.43(d,j=8.6hz,2h),7.39(dd,j=9.7,4.3hz,3h),7.14(d,j=8.4hz,1h),6.00(s,1h),3.52–3.49(m,2h),3.48(s,2h),3.33(s,3h),2.54(s,3h).13cnmr(125mhz,cdcl3):δ156.55,152.19,142.69,138.36,136.15,136.01,135.85,135.55,130.00,128.95,127.88,126.98,122.27,120.19,116.70,110.15,72.15,58.78,40.05,14.13.hrms(esi)m/zcalcdfor[c24h24n4o2+h]+:401.1899;found:401.1996[m+h]+.
实施例241-(3-甲氧基乙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-yl)苯基)脲(6l2)
化合物6l2的制备方法参考6a2,浅黄色油状物,收率55.3%。1hnmr(400mhz,dmso-d6):δ8.67(s,1h),8.13(d,j=1.1hz,1h),7.73(dd,j=8.7,1.5hz,1h),7.71–7.58(m,7h),7.51(d,j=8.7hz,2h),7.23(d,j=8.6hz,1h),6.25(t,j=5.5hz,1h),3.40(t,j=5.2hz,2h),3.29(s,3h),3.29–3.24(m,2h).13cnmr(125mhz,dmso-d6):δ155.55,141.32,140.72,140.48,137.17,136.60,134.38,133.12,130.68,130.43,128.03,127.77,125.64,118.44,118.26,112.16,71.74,58.40,39.30.hrms(esi)m/zcalcdfor[c24h21f3n4o2+h]+:455.1617;found:455.1708[m+h]+.
实施例251-(3-甲氧基丙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6m1)
化合物6m1的制备方法参考6a2,浅黄色油状物,收率43.9%。1hnmr(500mhz,cdcl3):δ7.90(s,1h),7.61(t,j=7.5hz,2h),7.58–7.52(m,3h),7.50–7.36(m,6h),7.15(dd,j=12.1,5.4hz,1h),5.82(s,1h),3.51–3.45(m,2h),3.40(d,j=4.7hz,2h),3.28(s,3h),2.55(s,3h),1.81(m,2h).13cnmr(100mhz,dmso-d6):δ155.76,141.26,140.53,137.19,136.54,134.36,133.05,130.69,130.45,127.97,127.75,125.67,120.46,118.50,118.20,117.83,112.15,47.00,28.93,20.45.hrms(esi)m/zcalcdfor[c25h26n4o2+h]+:415.2056;found:415.2144[m+h]+.
实施例261-(3-甲氧基丙基)-3-(4-(1-苯基-2-(三氟甲基)-1h-苯并咪唑-5-yl)苯基)脲(6m2)
化合物6m2的制备方法参考6a2,浅黄色油状物,收率:47.3%。1hnmr(400mhz,dmso-d6):δ8.59(s,1h),8.13(d,j=1.2hz,1h),7.73(dd,j=8.7,1.6hz,1h),7.71–7.66(m,4h),7.66–7.59(m,3h),7.55–7.49(m,2h),7.23(d,j=8.6hz,1h),6.19(t,j=5.7hz,1h),3.38(t,j=5.6hz,2h),3.26(s,3h),3.16(dd,j=12.6,6.7hz,2h),1.68(m,2h).13cnmr(100mhz,dmso-d6):δ155.61,141.33,140.53,137.21,136.57,134.44,132.99,130.67,130.43,128.03,127.73,125.63,118.49,118.24,112.12,70.37,58.37,37.00,30.14.hrms(esi)m/zcalcdfor[c25h23f3n4o2+h]+:469.1773;found:469.1849[m+h]+.
实施例271-(3-(二乙胺)乙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6n)
化合物6n的制备方法参考6a2,浅黄色油状物,收率:37.5%。1hnmr(500mhz,cdcl3):δ8.68(s,1h),7.89(s,1h),7.59(t,j=7.8hz,2h),7.56–7.49(m,5h),7.43–7.35(m,3h),7.25(d,j=21.0hz,1h),7.14(d,j=8.4hz,1h),3.65(d,j=5.1hz,2h),3.16(dd,j=12.0,6.9hz,2h),3.11(m,4h),2.53(s,3h),1.34(t,j=7.2hz,6h).13cnmr(100mhz,dmso-d6):δ155.61,141.33,140.53,137.21,136.57,134.44,132.99,130.67,130.43,128.03,127.73,125.63,118.49,118.24,112.12,70.37,58.37,37.00,30.14.hrms(esi)m/zcalcdfor[c27h31n5o+h]+:442.2529;found:442.2604[m+h]+.
实施例281-(3-(二乙胺)丙基)-3-(4-(2-甲基-1-苯基-1h-苯并咪唑-5-基)苯基)脲(6o)
化合物6o的制备方法参考6a2,黄色油状物,收率:28.8%。1hnmr(500mhz,cdcl3):δ8.91(s,1h),7.87(s,1h),7.63–7.55(m,4h),7.51(m,3h),7.36(d,j=5.5hz,3h),7.12(d,j=8.3hz,1h),7.07(s,1h),3.36(s,2h),3.11–3.03(m,6h),2.51(s,3h),1.99(s,2h),1.29(d,j=6.8hz,6h).13cnmr(125mhz,cdcl3):δ157.10,152.11,142.98,138.79,135.93,135.75,135.57,135.46,129.95,128.84,127.58,126.95,121.97,119.12,116.63,110.10,49.73,46.70,36.67,29.66,14.42,8.61.hrms(esi)m/zcalcdfor[c28h33n5o+h]+:456.2685;found:456.2770[m+h]+.
实施例1-28中所合成的化合物的结构式所对应的取代基如表1所示:
表1化合物的结构式与所对应的取代基
对实施例1-28所合成的化合物分别进行细胞增殖抑制实验、酶活性抑制实验和蛋白免疫印迹实验,具体实验如下所示:
1、细胞增殖抑制实验
为了考察目标化合物对肾成纤维细胞的增殖抑制活性,本实验采用cck-8法测定所合成的化合物对大鼠肾成纤维细胞nrk-49f细胞株的抑制率,以compoundc、sorafenib为阳性对照,计算各化合物的ic50值,进行初步的构效关系研究。进一步为了探讨化合物的肾毒性,测定化合物对人近端肾小管上皮细胞hk-2细胞株的增殖抑制活性,以compoundc、sorafenib为阳性对照,计算各化合物的ic50值,利用ic50(hk-2)、ic50(nrk-49f)的比值,考察化合物对细胞的选择性,以初步探讨化合物的肾毒性。
(1)实验材料
a.细胞株:大鼠肾成纤维细胞nrk-49f细胞株和人近端肾小管上皮细胞hk-2细胞株。
b.试剂和仪器:96孔细胞培养板购自costar公司;rpmi1640培养基购自gibco公司;dmem培养基购自gibco公司;胎牛血清购自gibco公司;dmso购自sigma公司;enogenecelltmcountingkit-8(cck-8)细胞活力检测试剂盒(e1ck-000208-10)购自南京恩晶生物科技有限公司。chembasecbs-cj-1fd超净工作台;mco-15ac二氧化碳培养箱(sanyo);xd-202荧光倒置生物显微镜显微镜(南京江南永新光学有限公司);thermomk3酶标仪(美国热电公司)。
(2)实验方法
a.细胞培养:nrk-49f、hk-2细胞采用常规培养。实验时均用对数生长期细胞,且取活细胞比例达90%以上的细胞进行实验。
b.细胞生长检测:细胞消化、计数、制成浓度为1×105个/ml的细胞悬液,96孔板中每孔加入100μl细胞悬液(每孔1×104个细胞);96孔板置于37℃,5%co2培养箱中培养24小时;每孔加入100μl相应的含药物的培养基,使孔中化合物终浓度为100、50、25、12.5、6.25、3.125、1.5625、0.78125、0.390625、0.1953125μm/ml,同时设立阴性对照组,溶媒对照组,阳性对照组,每组5复孔;96孔板置于37℃,5%co2培养箱中培养72小时后;每孔加入10μlcck-8溶液,将培养板在培养箱内孵育4小时,用酶标仪测定在450nm处的od值。
(3)数据处理
采用graphpadprism5.0软件,以浓度为横坐标,抑制率为纵坐标拟合曲线,计算化合物的ic50值。酶标仪上于450nm处测定每孔的吸光度od值,细胞生长抑制率按下式计算:
表2:化合物对细胞增殖抑制的抑制作用
注:本实验细胞增殖抑制实验ic50值为5次独立实验求平均值所得;
ratioofic50(roi)=ic50(hk-2)/ic50(nrk-49f);“-”表示数值无法确定。
2、酶活性抑制实验
本实验通过htrf实验测定目标化合物对hipk2酶活性的抑制效果。
(1)实验材料
atp,dtt,mgcl2,cacl2,cgmp购自sigma公司;钙连蛋白购自upstate公司,hipk2购自carna公司;其他试剂未经说明均来自cisbio公司。htrfkinease–stk试剂盒购自cisbio公司。
(2)实验方法
a.酶准备阶段:预先配置缓冲液(5mmmgcl2,1mmdtt,50μmamp);化合物溶液(100,000nm,20,000nm,4,000nm,800nm,160nm,32nm,6.4nm,1.3nm,0.26nm,0,051nm);在384孔板中每孔加入4μl化合物溶液(或缓冲液),加入2μlhipk2溶液,加入2μlatp,2μlstk-s2,在rt下孵育1h。选取compoundc和staurosporine为阳性对照药物。
b.检测阶段:预先配置荧光物溶液(0.5μmsa-xl665,0.5μmstkab);在每孔中加入5μlsa-xl665溶液,5μlstkab溶液;在rt下孵育1h;用htrf酶标仪读取620nm及665nm处的od值。
(3)数据处理
采用graphpadprism5.0软件,以浓度为横坐标,抑制率为纵坐标拟合曲线,计算化合物的ic50值。酶标仪上于620nm及665nm处测定每孔的吸光度od值,细胞生长抑制率按下式计算:
表3:化合物对激酶的抑制作用
从表2中可以看出,化合物对hipk2亚型的选择性远大于对hipk1和hipk3亚型的选择性。
3、蛋白免疫印迹实验
hipk2在正常水平由于受到泛素连接酶的降解表达较低,在疾病状态下泛素连接酶失活,hipk2高度稳定,mg132可抑制泛素连接酶的活性,无细胞试验中ic50为100nm。本实验选取hipk2酶抑制活性最佳的化合物6d1进行westernblot实验,在实验过程中采用mg132提高细胞中hipk2的浓度,浓度为200ng/ml,实验组分为:对照组,mg132处理组,mg132处理/药物组,mg132/对照药组。本论文分别在nrk-49f和hk-2细胞中测定四组细胞hipk2的水平;在nrk-49f细胞中,以compoundc为对照药,分别测定细胞中总smad3和磷酸化smad3水平,α-sma水平,以探讨化合物对纤维化相关信号分子的影响;在hk-2细胞中,以bay11-7082为对照药,分别测定细胞中总iκb-α和磷酸化iκb-α的水平,以探讨化合物对炎症相关信号分子的影响。
(1)实验材料
a.细胞株:nrk-49f、hk-2细胞株。
b.抗体:smad2/3、p-smad3、iκb-α、p-iκb-α、α-sma、hipk2、gapdh均购自enogene公司。
c.药品及试剂:ecl化学发光试剂购自碧云天公司;maxisignalwesternsoltion购自sudgen公司;ripa裂解液,bsa,预染蛋白marker,羊抗兔二抗,显影液、定影液,bca蛋白浓度检测试剂盒,均购自南京恩晶生物科技有限公司。
d.仪器及耗材:6孔板;二氧化碳培养箱(sanyo);荧光倒置生物显微镜(南京江南永新光学有限公司);台式高速离心机(scilogex);微型垂直电泳槽(上海天能科技有限公司);转移电泳槽(上海天能科技有限公司);电泳仪(上海天能科技有限公司);脱色摇床(江苏省金坛市荣华仪器制造有限公司);静音混合器(江苏海门市其林贝尔仪器制造有限公司);酶标仪(thermoscientific)。
(2)实验方法:
a.细胞样本制备:取对数生长期nrk-49f、hk-2细胞进行实验。细胞经消化、计数、制成1×105个/ml的细胞悬液,接种于6孔板中(2ml/孔),置于37℃,5%co2培养箱中培养24小时;每孔加入200nmmg132,同时设立空白对照组;将板置于培养箱中培养72h后,更换新鲜培养基,同时加入不同浓度化合物,nrk-49f加入2um、10um的化合物6d1及compoundc,hk-2加入10um、50um的化合物6d1及bay11-7082,同时设立mg132单独作用组,作用5小时后,收集细胞样本,wb检测各目的蛋白。
b.蛋白测定:胰酶消化收集细胞样本,加入100μlripa裂解液(含pmsf及磷酸酶抑制剂),在冰浴中反复吹打,充分裂解样本,获得裂解液后离心(4℃,12000rpm,15min),收集上清并进行蛋白含量测定。根据上清体积按4:1比例加入5×loadingbuffer,100℃水浴10min使蛋白变性,冷却至室温后短暂离心后保存于-20℃待测。
根据目的蛋白分子量分别配置8%及10%分离胶,按40μg蛋白上样量进行上样,同时加入5μl蛋白marker,于恒压80v-100v条件下进行电泳,当marker各分量条带充分分开时可终止电泳。pvdf膜经甲醇活化15s-5min后,于低温环境下转膜,转膜条件:恒压80v,1h-2h。
转膜完成后,膜用5%bsa中封闭1h,经tbst充分洗涤后(5min/次,3次),与相应目的蛋白抗体结合,4℃过夜。tbst充分洗涤后(5min/次,3次),与相应二抗室温结合1h,tbst充分漂洗(10min/次,3次),于暗室中利用胶片及ecl发光液分别进行显影及定影。利用adobephotoshopcs5软件分析目的条带的净光密度值,以gapdh为内参。
(3)数据处理
数据以mean±sd表示,应用graphpadprism5.0统计软件,两组组间比较采用t-test检验,多组间比较采用one-wayanova(dunnett),p<0.05为有统计学意义。
(4)实验结果
在正常情况下图1中的对照组(control)细胞中hipk2均处于较低的水平,加入200ng/ml的mg132处理72h后细胞中的hipk2水平大大增加。在hk-2细胞中加入化合物6d1处理5h后hipk2磷酸化水平降低,且降低水平对化合物浓度具有剂量依赖性,化合物6d1在10μm,50μm下对hipk2磷酸化水平的抑制均强于对照药bay11-7082。在nrk-49f细胞中加入化合物6d1处理5h后hipk2磷酸化水平降低,其磷酸化降低水平对化合物浓度具有剂量依赖性。综上所述,化合物对hipk2蛋白水平具有抑制作用。
hipk2可调节纤维化及炎症通路,为了验证化合物对纤维化信号通路的影响,本发明测定了化合物刺激nrk-49f细胞后p-smad3,α-sma磷酸化水平的改变。如图2所示,加入化合物6d1,compoundc后p-smad3磷酸化水平降低,且降低水平对化合物6d1,compoundc浓度均具有剂量依赖性,这证明化合物对纤维化关键信号分子smad3有调节作用。化合物对α-sma的磷酸化水平基本不影响。
为了验证化合物对炎症通路的影响,本实验测定了化合物对p-iκb-α水平的影响。如图3所示,当细胞中加入mg132处理后p-iκb-α水平增高,加入化合物6d1,bay11-7082后p-iκb-α降低,且对化合物的浓度均具有剂量依赖性,故化合物对炎症信号分子iκb-α具有调节作用。
综上所述,化合物6d1对hipk2激酶及蛋白水平、纤维化信号分子smad3、炎症信号分子iκb-α磷酸化水平均具有抑制作用。本发明所制得的化合物直接以hipk2为靶点,同时对hipk1-3亚型有选择性,兼有抗炎和抗纤维化双重作用,具有较好的慢性肾病治疗应用前景。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种1‑(4‑氯苯基)‑2‑吡啶‑1‑基‑1‑基乙酮溴化物的制备方法与制造工艺
- 一种1‑(4‑溴苯基)‑2‑吡啶‑1‑基‑1‑基乙酮溴化物的制备方法与制造工艺
- 一类噁唑并香豆素衍生物在农药方面的应用
- 一种香豆素衍生物、其制备方法以及由其制得的水凝胶的制作方法
- 3-(2-芳基-1h-吲哚-3-基)-4-羟基香豆素衍生物及其合成方法
- 一种羟甲香豆素的药物组合物及其医药用图
- 含卤素或苯并咪唑类功能基团的香豆素类衍生物及其制备方法和应用
- 一种有机叠氮与香豆素合成3-氨基苯并吡喃-2-酮类衍生物的新方法
- 香豆素-3-羧酸/1-辛烷磺酸/LGdH复合体及其合成方法
- 香豆素-3-羧酸/1-辛烷磺酸/LGdH复合体及其合成方法