大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法与流程
本发明属于生物医药技术领域,具体涉及一种大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法。
背景技术:
口蹄疫是由口蹄疫病毒(foot-and-mouthdiseasevirus,fmdv)引起的以偶蹄动物发病为主的一种急性、热性、高度接触传染性动物疫病。该病是当前在世界范围内对畜牧业发展威胁最大的一种烈性传染病,因而世界动物卫生组织(oie)列为必须上报的传染病。弱毒疫苗曾在控制欧洲口蹄疫的大流行中发挥了巨大的作用,但由于疫苗株毒力的返强曾引起口蹄疫暴发流行而被停用。目前使用的灭活疫苗虽然较弱毒疫苗安全,但若灭活不完全仍有引起疫病暴发的风险,已不能适应当前国际贸易形势。
病毒样颗粒(virus-likeparticlesvlps)是有病毒的一个或多个结构蛋白在体内或体外自组装而成的空心颗粒,因其不含病毒的遗传物质,无法复制和扩增,而不具备感染致病的能力。vlps在形态结构上与天然病毒颗粒相似,很好地模拟天然病毒的抗原表位,数十纳米的尺度和高度有序的表位结构也有利于树突状细胞的吞噬和抗原加工,从而有效地诱导集体产生对病毒的免疫保护反应。与传统疫苗相比,vlps具有相当的免疫原性和更好的安全性,还可以作为载体蛋白携带外源抗原或者通过化学耦连介入非蛋白抗原,是疫苗涉及的重要构件。
为了充分去除杂质,特别是避免含有病毒基因,vlps的制备通常在表达系统外源表达后进行体外组装。表达系统可分为真核表达系统和原核表达系统。真核系统场面临培养周期长、成本高、表达量低、难纯化等难题,制约了vlps疫苗的规模化生产。与真核表达系统相比,大肠杆菌表达系统更早、更广泛地应用于生物医药领域,是公认的高效、低成本、安全性良好的表达系统。由于颗粒型抗原结构和组装都较为复杂,其表达量和表达形式对抗原结构和后续的纯化和体外组装有着至关重要的影响,而体外组装效率这是决定病毒样颗粒产品质量的关键因素。在大肠杆菌系统进行抗原表达时,抗原表达量过低,在降低产能的同时,大大增加了生产成本;抗原表达量过高,抗原以包涵体形式进行表达的可能性大大增加,增加后续纯化难度和成本,影响体外组装效率。
技术实现要素:
本发明的目的在于:针对现有技术中存在的问题,提供一种可规模化生产病毒样颗粒抗原的高密度规模化发酵培养基,以及规模化发酵培养方法,使用高密度发酵培养工艺提高了抗原的表达量,同时也保证了抗原以可溶性形式进行表达,达到了降低生产成本的同时提高最终病毒样颗粒质量的效果。
本发明采用的技术方案如下:
一种大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基,包括大肠杆菌培养用基础培养基和补料用培养基,以及诱导表达时的诱导表达用培养基;
每升基础培养基包括:磷酸二氢钾6~12g、磷酸氢二铵3~8g、氯化钠1~5g、酵母提取物5~10g、胰蛋白胨8~15g、甘油15~30g、消泡剂0.01~0.02wt%、微量元素溶液0.4~0.6vt%、抗生素溶液1~3vt%和硫酸镁溶液1~3vt%;
每升补料用培养基包括:酵母提取物5~10g、胰蛋白胨8~15g、微量元素溶液0.4~0.6vt%、抗生素溶液1~3vt%和硫酸镁溶液1~3vt%;
每升诱导表达用培养基包括:酵母提取物5~10g、胰蛋白胨8~15g、甘油50~100g、异丙基硫代半乳糖苷溶液0.05~0.1vt%和硫酸镁溶液1~3vt%。
进一步地,基础培养基由以下操作获得:将磷酸二氢钾、磷酸氢二铵、氯化钠、酵母提取物、胰蛋白胨、甘油和消泡剂溶于水得混合物,调节混合物的ph值至7.0~7.2,116℃高压灭菌25~30min,然后降温至50℃及以下时,向其中加入微量元素溶液、抗生素溶液和硫酸镁溶液,混合均匀制得。
进一步地,补料用培养基由以下操作获得:将酵母提取物和胰蛋白胨溶于水得混合物,调节混合物ph值至7.0~7.2,116℃高压灭菌25~30min,然后降温至50℃及以下时,向其中加入微量元素溶液、抗生素溶液和硫酸镁溶液,混合均匀后制得。
进一步地,诱导表达用培养基由以下操作获得:将酵母提取物、胰蛋白胨和甘油溶于水得混合物,调节混合物ph值至7.0~7.2,116℃高压灭菌25~30min,然后降温至50℃及以下时,向其中加入异丙基硫代半乳糖苷溶液和硫酸镁溶液,混合均匀制得。
进一步地,每升微量元素溶液包括柠檬酸150~200g、乙二胺四乙酸二钠0.5~1.0g、氯化钴0.1~0.4g、氯化钙2~5g、氯化铜0.05~0.3g、硼酸0.2~0.5g、氯化锰0.8~2.5g、钼酸钠0.1~0.4g、醋酸锌0.5~2.0g和柠檬酸铁5~12g;每升所述抗生素溶液包括氨苄青霉素50~150g、卡那霉素50~100g和氯霉素25~60g;微量元素溶液和抗生素溶液包括上述成分但不限于上述成分,提供发酵培养中菌类所需的微量元素和抗生素即可,制备过程中,各成分经溶解后再经0.22μm过滤器过滤;异丙基硫代半乳糖苷溶液浓度为235-240g/l;异丙基硫代半乳糖苷溶液制备中经溶解后再经0.22μm过滤器过滤。
上述的发酵培养基在抗原生产及疫苗制备中的应用。
采用上述的大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基进行发酵培养的方法,包括以下步骤:
s1.将表达口蹄疫病毒样颗粒抗原的大肠杆菌按2~5vt%的比例接种于基础培养基中,37℃培养6~12h,然后进行扩菌培养;
s2.当菌液的od600nm值为5~10时,使用补料用培养基进行补料,补料速度为每小时补料0.5~2ml/l,继续培养;
s3.当菌液的od600nm值达到30及以上时,降温至15~20℃,当菌液温度降低至20℃时,继续培养0.5h;
s4.向菌液中添加诱导表达用培养基,培养基添加速度为每小时添加1ml/l,诱导表达12~16h;
s5.将诱导表达后的菌液离心10-15min,收集菌泥,即可。
进一步地,在发酵培养过程中,每间隔一定时间记录发酵参数,并无菌取样测定菌液od600nm值。
进一步地,步骤s1中扩菌培养和步骤s2中继续培养的具体条件均为:培养温度为36.8~37.2℃,溶氧率为30~50%,使用氨水对ph值进行调控,使ph值为6.8~7.2。
进一步地,步骤s3中继续培养的具体条件为:培养温度为15~20℃,溶氧率为20~40%,使用氨水对ph值进行调控,使ph值为7.2~7.4。
进一步地,步骤s4中诱导表达的具体条件为:温度为15~20℃,溶氧率为20~40%,使用氨水对ph值进行调控,使ph值为7.0~7.2。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明中,培养基分为3种培养基,配合低温诱导表达等发酵工艺,在未额外增加工艺程序的基础上,能实现口蹄疫病毒样颗粒抗原规模化生产中的高表达量及高可溶性抗原比例,降低规模化病毒样颗粒抗原的生产成本,为后续病毒样颗粒的组装和病毒样颗粒疫苗的配制奠定基础;
2、本发明中,基础培养基可缩短生产用菌种的迟缓期,更早进入对数生长期;补料用培养基能提高大肠杆菌对数生长期的增殖能力,提高大肠杆菌高密度发酵过程的总菌数;诱导表达用培养基能维持大肠杆菌平台期,以提高病毒样颗粒抗原的表达量,同时培养中的成分可促进抗原以可溶性形式进行表达;
3、本发明采用规模化发酵培养工艺,其中在诱导表达环节采用低温和连续少量添加诱导剂的诱导表达方式,使得本发明的规模化发酵培养工艺可大大提高病毒样颗粒的抗原表达量,同时可使抗原最大程度以可溶性形式进行表达,有效降低大肠杆菌表达系统规模化生产口蹄疫病毒样颗粒抗原的成本,为后续抗原的纯化和病毒样颗粒的体外组装奠定良好的基础;
4、本发明的培养基及发酵培养方法,不仅可用于规模化生产并获得高表达量和高可溶性的口蹄疫病毒样颗粒抗原,同时也能用于生产其他病毒的病毒样颗粒抗原,且也能明显提高抗原的总表达量和可溶性抗原的比例。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为生产用种子生长曲线图;
图2为扩菌培养生长曲线图;
图3为补料生长曲线图;
图4为不同诱导表达方式的细菌曲线图;
图5为不同诱导表达方式的表达量图;
图6为不同诱导表达时间的抗原表达量图;
图7为不同诱导表达温度下的抗原表达量及可溶性抗原比例图;
图8为使用本发明的培养基及发酵培养方法对大肠杆菌表达其他病毒的病毒样颗粒抗原的表达量及可溶性抗原比例图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,术语“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本发明较佳实施例提供的一种大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法,包括大肠杆菌培养用基础培养基和补料用培养基,以及诱导表达时的诱导表达用培养基;
基础培养基由以下方式获得:将磷酸二氢钾、磷酸氢二铵、氯化钠、酵母提取物、胰蛋白胨、甘油和消泡剂溶于水,其中各组分浓度为:磷酸二氢钾为6g/l、磷酸氢二铵为3g/l、氯化钠为1g/l、酵母提取物为5g/l、胰蛋白胨为8g/l、甘油为15g/l、消泡剂为0.01wt%,调节ph值至7.0,116℃高压灭菌30min,然后降温至50℃以下,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀制得;
补料用培养基由以下方式获得:将酵母提取物、胰蛋白胨溶于水,其中各组分浓度为:酵母提取物为5g/l、胰蛋白胨为8g/l,调节ph值至7.0,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀后制得;
诱导表达用培养基由以下方式获得:将酵母提取物、胰蛋白胨和甘油溶于水,其中各组分浓度为:酵母提取物为5g/l、胰蛋白胨为8g/l、甘油为50g/l,调节ph值至7.0,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.05vt%浓度为238g/l的异丙基硫代半乳糖苷溶液和2vt%硫酸镁溶液,混合均匀制得。
其中,微量元素溶液包括柠檬酸150g/l、乙二胺四乙酸二钠0.5g/l、氯化钴0.1g/l、氯化钙2g/l、氯化铜0.05g/l、硼酸0.2g/l、氯化锰0.8g/l、钼酸钠0.1g/l、醋酸锌0.5g/l和柠檬酸铁5g/l;抗生素溶液包括氨苄青霉素50g/l、卡那霉素50g/l和氯霉素25g/l。
采用上述的大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基进行发酵培养的方法,包括以下步骤:
s1.将表达口蹄疫病毒样颗粒抗原的大肠杆菌按2vt%的比例接种于基础培养基中,37℃培养6h,然后在培养温度为36.8℃,溶氧率为30%,使用氨水对ph值进行调控,使ph值为6.8,进行扩菌培养;
s2.当菌液的od600nm值为5-10时,使用补料用培养基进行补料,补料速度为每小时补料0.5ml/l,在培养温度为36.8℃,溶氧率为30%,使用氨水对ph值进行调控,使ph值为6.8,继续培养;
s3.当菌液的od600nm值达到30及以上时,降温至15℃,溶氧率为20%,使用氨水对ph值进行调控,使ph值为7.2,继续培养0.5h;
s4.向菌液中添加诱导表达用培养基,培养基添加速度为每小时添加1ml/l,在温度为15℃,溶氧率为20%,使用氨水对ph值进行调控,使ph值为7.0,诱导表达12h;
s5.将诱导表达后的菌液经9000r/min离心10min,收集菌泥,置于-20℃保存。
实施例2
本发明较佳实施例提供的一种大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法,包括大肠杆菌培养用基础培养基和补料用培养基,以及诱导表达时的诱导表达用培养基;
基础培养基由以下方式获得:将磷酸二氢钾、磷酸氢二铵、氯化钠、酵母提取物、胰蛋白胨、甘油和消泡剂溶于水,其中各组分浓度为:磷酸二氢钾为12g/l、磷酸氢二铵为8g/l、氯化钠为5g/l、酵母提取物为10g/l、胰蛋白胨为15g/l、甘油为30g/l、消泡剂为0.02wt%,调节ph值至7.2,116℃高压灭菌30min,然后降温至50℃以下,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀制得;
补料用培养基由以下方式获得:将酵母提取物、胰蛋白胨溶于水,其中各组分浓度为:
酵母提取物为10g/l、胰蛋白胨为15g/l,调节ph值至7.2,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀后制得;
诱导表达用培养基由以下方式获得:将酵母提取物、胰蛋白胨和甘油溶于水,其中各组分浓度为:酵母提取物为10g/l、胰蛋白胨为15g/l、甘油为100g/l,调节ph值至7.2,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.1vt%浓度为238g/l异丙基硫代半乳糖苷溶液和2vt%硫酸镁溶液,混合均匀制得。
其中,微量元素溶液包括柠檬酸200g/l、乙二胺四乙酸二钠1.0g/l、氯化钴0.4g/l、氯化钙5g/l、氯化铜0.3g/l、硼酸0.5g/l、氯化锰2.5g/l、钼酸钠0.4g/l、醋酸锌2.0g/l和柠檬酸铁12g/l;抗生素溶液包括氨苄青霉素150g/l、卡那霉素100g/l和氯霉素60g/l。
采用上述的大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基进行发酵培养的方法,包括以下步骤:
s1.将表达口蹄疫病毒样颗粒抗原的大肠杆菌按2vt%的比例接种于基础培养基中,37℃培养12h,然后在培养温度为37.2℃,溶氧率为50%,使用氨水对ph值进行调控,使ph值为7.2,进行扩菌培养;
s2.当菌液的od600nm值为5-10时,使用补料用培养基进行补料,补料速度为每小时补料0.5ml/l,在培养温度为37.2℃,溶氧率为50%,使用氨水对ph值进行调控,使ph值为7.2,继续培养;
s3.当菌液的od600nm值达到30及以上时,降温至20℃,溶氧率为40%,使用氨水对ph值进行调控,使ph值为7.4,继续培养0.5h;
s4.向菌液中添加诱导表达用培养基,培养基添加速度为每小时添加1ml/l,在温度为20℃,溶氧率为40%,使用氨水对ph值进行调控,使ph值为7.2,诱导表达16h;
s5.将诱导表达后的菌液经9000r/min离心10min,收集菌泥,置于-20℃保存。
实施例3
本发明较佳实施例提供的一种大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法,包括大肠杆菌培养用基础培养基和补料用培养基,以及诱导表达时的诱导表达用培养基;
基础培养基由以下方式获得:将磷酸二氢钾、磷酸氢二铵、氯化钠、酵母提取物、胰蛋白胨、甘油和消泡剂溶于水,其中各组分浓度为:磷酸二氢钾为10g/l、磷酸氢二铵为5g/l、氯化钠为2g/l、酵母提取物为8g/l、胰蛋白胨为10g/l、甘油为20g/l、消泡剂为0.015wt%,调节ph值至7.1,116℃高压灭菌30min,然后降温至50℃以下,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀制得;
补料用培养基由以下方式获得:将酵母提取物、胰蛋白胨溶于水,其中各组分浓度为:
酵母提取物为8g/l、胰蛋白胨为10g/l,调节ph值至7.1,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.5vt%微量元素溶液、2vt%抗生素溶液和2vt%硫酸镁溶液,混合均匀后制得;
诱导表达用培养基由以下方式获得:将酵母提取物、胰蛋白胨和甘油溶于水,其中各组分浓度为:酵母提取物为8g/l、胰蛋白胨为10g/l、甘油为80g/l,调节ph值至7.1,116℃高压灭菌30min,然后降温至50℃以下时,向其中加入0.08vt%浓度为238g/l异丙基硫代半乳糖苷溶液和2vt%硫酸镁溶液,混合均匀制得。
其中,微量元素溶液包括柠檬酸180g/l、乙二胺四乙酸二钠0.8g/l、氯化钴0.2g/l、氯化钙3g/l、氯化铜0.15g/l、硼酸0.3g/l、氯化锰1.2g/l、钼酸钠0.3g/l、醋酸锌1.0g/l和柠檬酸铁8g/l;抗生素溶液包括氨苄青霉素100g/l、卡那霉素80g/l和氯霉素45g/l。
采用上述的大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基进行发酵培养的方法,包括以下步骤:
s1.将表达口蹄疫病毒样颗粒抗原的大肠杆菌按2vt%的比例接种于基础培养基中,37℃培养6h,然后在培养温度为37.0℃,溶氧率为40%,使用氨水对ph值进行调控,使ph值为7.0,进行扩菌培养;
s2.当菌液的od600nm值为5-10时,使用补料用培养基进行补料,补料速度为每小时补料0.5ml/l,在培养温度为37.0℃,溶氧率为40%,使用氨水对ph值进行调控,使ph值为7.0,继续培养;
s3.当菌液的od600nm值达到30及以上时,降温至17℃,溶氧率为30%,使用氨水对ph值进行调控,使ph值为7.3,继续培养0.5h;
s4.向菌液中添加诱导表达用培养基,培养基添加速度为每小时添加1ml/l,在温度为17℃,溶氧率为30%,使用氨水对ph值进行调控,使ph值为7.1,诱导表达15h;
s5.将诱导表达后的菌液经9000r/min离心10min,收集菌泥,置于-20℃保存。
实验例
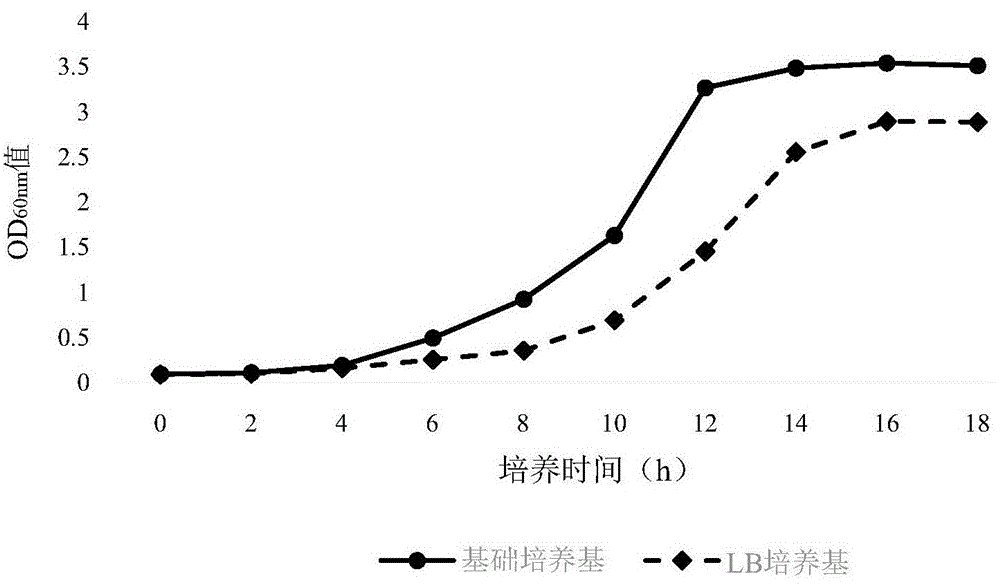
1、分别使用实施例3的基础培养基和lb培养基对表达口蹄疫病毒样颗粒的大肠杆菌生产用种子进行培养,并绘制生产用菌种的生长曲线。
结果如图1所示,由图可知与lb培养基相比较,使用本发明的基础培养基对生产用菌种进行培养时,生产用菌种在6-12小时处于对数生长期,较lb培养基其进入对数生长期的时间缩短约2h,同时生产用菌种进入对数生长期及平台期的od600nm值更高。
2、分别使用实施例3的基础培养基与lb培养基对表达口蹄疫病毒样颗粒抗原的大肠杆菌进行扩菌培养。
结果如图2所示,由图可知与使用lb培养基相比较,使用本发明的基础培养基进行扩菌培养时,细胞进入对数生长期的时间缩短,同时od600nm值远高于lb培养基。
3、在表达口蹄疫病毒样颗粒抗原的大肠杆菌进入对数生长期后,分别使用实施例3的基础培养基及补料培养基进行补料,结果与仅使用基础培养基进行补料相比较,使用补料培养基进行补料时,大肠杆菌在对数生长期的od600nm值明显更高。结果见如图3所示。
4、分别采用一次性添加足量的iptg诱导剂,和本发明采用的连续少量添加含iptg的诱导表达用培养基,对表达大口蹄疫病毒样颗粒抗原的大肠杆菌进行诱导表达,结果如图5和图6所示。
由图可知,一次性添加iptg后,细菌的od600nm值出现明显下降现象,此后再缓慢回升,而使用实施例3的诱导表达用培养基进行诱导表达时,细菌od600nm一直处于较为稳定的状态。对采用两种诱导表达方式进行口蹄疫病毒样颗粒抗原诱导表达总量进行比较,结果采用诱导表达用培养基进行诱导培养的表达总量明显高于一次性添加iptg诱导剂的表达总量,且使用诱导表达培养基时可溶性抗原的表达比例更高。
5、使用实施例3的诱导表达用培养基进行诱导表达,并于诱导开始后不同时间进行口蹄疫病毒样颗粒抗原的表达量测定,结果如图6所示。结果表明,在诱导后12~16h,抗原的表达量最高。
6、在不同温度条件进行口蹄疫病毒样颗粒抗原的诱导表达,结果如图7所示,当诱导表达温度为15~20℃时,在该温度条件下诱导表达,口蹄疫病毒样颗粒抗原的表达量较高,且可溶性抗原的表达量最高。
7、使用本发明实施例3的培养基及发酵培养方法对大肠杆菌表达其他病毒的病毒样颗粒抗原,结果如图8所示,结果表明,与传统培养基及发酵培养基相比较,本发明的培养基及方法发酵培养的抗原的表达量和/或可溶性抗原的比例均更高。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!