突变的L-氨基酸连接酶以及酶催化法制备L-谷氨酸-L-色氨酸二肽的工艺的制作方法
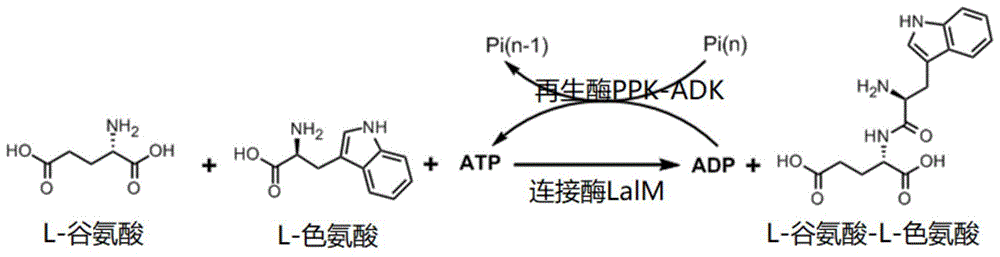
本发明涉及生化技术领域,具体涉及突变的l-氨基酸连接酶以及酶催化法制备l-谷氨酸-l-色氨酸二肽的工艺。
背景技术:
l-谷氨酸-l-色氨酸(oglufanide)是由l-谷氨酸、l-色氨酸两种基本氨基酸通过alpha位酰胺键连接而成的二肽,其分子式为c16h19n3o5,分子量为333.3,cas号为122933-59-9。该二肽是一种治疗慢性丙型肝炎(hepatitisc)感染时用的免疫调变剂(immunomodulator),它也被用来在癌症的临床治疗过程中进行人体免疫反应的调节,同时也是一种抑制血管生成的药。
l-谷氨酸-l-色氨酸主要是通过化学合成法制备,同时市面上还存在少量的酶法及发酵法。化学合成多肽工艺大部分非常成熟,但在生产含有多个官能团的氨基酸(如含两个羧基的谷氨酸,两个氨基的赖氨酸)、含不稳定基团的氨基酸(如含巯基的半胱氨酸)以及水溶性差的氨基酸(如含苯环的色氨酸)组成的短肽产品时成本非常高,品质差,因而很难满足该二肽作为药物的高品质要求。
迄今为止,自然界还没有发现以l-谷氨酸及l-色氨酸为催化底物的氨基酸连接酶,因此在现有的酶催化制备工艺中主要利用非特异性蛋白水解酶在有机溶剂里的缩合实现,由于该酶缺少专一性,杂质短肽极大的影响了总体收率及最终产品纯化。发酵法生产l-谷氨酸-l-色氨酸二肽产品还停留在利用少量非特异性连接酶制备的实验阶段,由于转化效率低,副产物多,极大的限制了该方法的工业化应用。
自然界中存在不少的氨基酸连接酶,其中一类是l-氨基酸连接酶(lal,ec6.3.2.49),它能直接连接不同种l-氨基酸形成二肽。虽然有不少文献报道了部分lai对l-谷氨酸及l-色氨酸有活性,但是迄今为止还没有发现能直接连接该氨酸酸成二肽的连接酶。由于l-氨基酸连接酶底物适应性很强,尤其是枯草芽孢杆菌(bacillussubtilis)里的lal(uniprotid:p39641)具有非常完整的酶催化及结构信息,这为该酶理性改造以适应l-谷氨酸、l-色氨酸生成相应二肽产品提供了很好的基础。
技术实现要素:
有鉴于此,本发明的目的在于提供一种突变的l-氨基酸连接酶,使其能够催化l-谷氨酸及l-色氨酸生成l-谷氨酸-l-色氨酸二肽,并具备较高收率;
本发明的另外一个目的在于利用上述突变的l-氨基酸连接酶,提供一种酶催化法制备l-谷氨酸-l-色氨酸二肽的工艺,可制备高收率的l-谷氨酸-l-色氨酸二肽。
为实现上述目的,本发明提供如下技术方案:
一种突变的l-氨基酸连接酶,在野生型l-氨基酸连接酶基础上具有h276g/s、w332k/n/q/s、m334d/s、l12a/s、y75s/g和w76l/v的位点突变。
本发明针对目前缺少专一性的以l-谷氨酸及l-色氨酸为催化底物的氨基酸连接酶的缺陷,在现有非特异性氨基酸连接酶的基础上进行位点突变改造,可特异性快速实现l-谷氨酸和l-色氨酸的连接,提高二肽的收率和生产效率。
在本发明具体实施方式中,所述l-氨基酸连接酶,其特征在于,在野生型l-氨基酸连接酶基础上具有h276g、w332k、m334d、l12a、y75s和w76l的位点突变;或者具有h276s、w332n、m334s、l12s、y75g和w76v的位点突变。其中,所述野生型l-氨基酸连接酶来源于枯草芽孢杆菌(bacillussubtilis,ec6.3.2.49)。
野生型l-氨基酸连接酶以及其他位点突变的l-氨基酸连接酶用于催化l-谷氨酸及l-色氨酸时,二肽收率仅为2.7%和15%。而采用本发明突变的l-氨基酸连接酶,二肽收率可高达80%以上。基于这种优异的技术效果,本发明提供了所述突变的l-氨基酸连接酶在催化l-谷氨酸及l-色氨酸生成l-谷氨酸-l-色氨酸二肽中的应用或在制备催化l-谷氨酸及l-色氨酸生成l-谷氨酸-l-色氨酸二肽的酶制剂中的应用。
同时,多聚磷酸激酶(ppk,ec2.7.4.1)能利用廉价的多聚磷酸作为原料将二磷酸腺苷adp转化成三磷酸腺苷atp,而腺苷酸激酶(adk,ec2.7.4.3)则能实现三种磷酸腺苷(amp、adp、atp)的相互转化,通过联合使用这两个酶或将两个酶融合表达生成(ppk-adk)不仅可以降低酶发酵生产成本,还能有效加快atp再生速度。因此,本发明还提出了所述突变的l-氨基酸连接酶联合融合蛋白在催化l-谷氨酸及l-色氨酸生成l-谷氨酸-l-色氨酸二肽中的应用或在制备催化l-谷氨酸及l-色氨酸生成l-谷氨酸-l-色氨酸二肽的酶制剂中的应用。
在本发明具体实施方式中,所述ppk来源于paenarthrobacteraurescens或meiothermusruber红色亚栖热菌,所述adk来源于escherichiacoli大肠杆菌。
此外,本发明还提供了一种酶催化法制备l-谷氨酸-l-色氨酸二肽的工艺,所述突变的l-氨基酸连接酶在其最适ph值范围内的反应介质中催化反应原料l-谷氨酸、l-色氨酸、atp或其盐生成l-谷氨酸-l-色氨酸二肽;在反应过程中维持体系ph值在所述突变的l-氨基酸连接酶最适ph值范围内;在本发明具体实施方式中,所述突变的l-氨基酸连接酶最适ph值范围选自为6.5-8.5,但不排除其他的能够发挥所述突变的l-氨基酸连接酶功能的ph值范围。作为优选,所述atp盐为atp钠盐,如三磷酸腺苷二钠盐,其同样可以提供atp。
作为优选,所述反应介质为缓冲液,在本发明具体实施方式中,所述反应介质为tris-hcl。
利用ppk和adk或两者融合酶(ppk-adk)再生atp,通过ppk和adk或融合多聚磷酸激酶ppk(ec2.7.4.1)与腺苷激酶adk(ec2.7.4.3)能有效循环再生单磷酸腺苷amp以及二磷酸腺苷adp到三磷酸腺苷atp,因此本发明所述工艺还包括添加反应原料ppk和adk或两者融合蛋白ppk-adk、多聚磷酸、氯化镁和氯化钾(氯化镁和氯化钾用于atp再生),,具体的反应原理示意图见图1。
在联合ppk和adk或两者融合酶(ppk-adk)时,本发明所述突变的l-氨基酸连接酶与ppk和adk或两者融合酶(ppk-adk)的体积比优选为1:(0.8-4.0),例如2:3、1:3、1:2、3:5等比例;本发明所述突变的l-氨基酸连接酶、ppk和adk或两者融合酶(ppk-adk)可以利用表达各酶的宿主细胞、各酶的酶液或各酶的固定化酶形式参与酶催化反应。
与大多数的反应一样,本发明还包括选自除蛋白杂质、除残留反应原料、除盐、除磷酸和结晶中的一种或两种以上操作的纯化步骤,具体选择何种纯化步骤,根据实际情况调整。具体地,酸化处理除去蛋白杂质,反渗透除盐,阴离子交换树酯除含磷酸杂质,结晶通过乙醇水溶液来结晶纯化,更优选为纯水:乙醇(2-4):1v/v来结晶纯化。
由以上技术方案可知,本发明在已知报道的非特异性l-氨基酸连接酶研究的基础上,对其底物活性结合位点进行系统的氨基酸替换,最终得以实现l-谷氨酸及l-色氨酸的快速连接,同时结合辅酶atp循环再生、固定化酶催化,一方面降低了生产成本,另一方面很好的提高了该二肽产品的品质及生产的稳定性,因而满足应用要求。
附图说明
图1所示为本发明反应原理示意图。
具体实施方式
本发明公开了突变的l-氨基酸连接酶以及酶催化法制备l-谷氨酸-l-色氨酸二肽的工艺,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明突变的l-氨基酸连接酶和工艺已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文突变的l-氨基酸连接酶和工艺进行改动或适当变更与组合,来实现和应用本发明技术。
本发明所述工艺的步骤旨在清楚的描述核心的反应路线,并不限制整个反应采用一步法还是多步法进行。
本发明所采用的各酶可以根据序列进行人工合成,本发明中所提及的各酶的序列汇总如下表1:
表1
上述各酶也可以通过各自的编码基因构建重组质粒进行细胞转化,例如:
以提取的大肠杆菌(escherichiacoli)、红色亚栖热菌(meiothermusruber)、枯草芽孢杆菌(bacillussubtilis)以及paenarthrobacteraurescens染色体为模板,利用表2引物pcr扩增出lal、ppk1、ppk2(ppk1和ppk2分别来源于paenarthrobacteraurescens和meiothermusruber)以及adk基因片段,然后通过试剂公司提供的标准实验方法,以ndei/xhoi酶切位点亚克隆到pet28a质粒上,然后利用lal基因为模板,利用表2中突变引物(翊圣生物突变试剂盒)构建lal突变库,通过改多个位点活性中心氨基酸能有效提高该酶对l-谷氨酸及l-色氨酸的结合能力,从而大大提高其催化专一性及酶活力。多聚磷酸激酶基因ppk与腺苷激酶adk基因同样利用以上酶切、连接最终亚克隆到pet28a质粒上。
上述构建好的质粒转入e.coli(bl21)菌株(通用生物),平板培养后挑单克隆转入5ml含50um卡那霉素的lb培养液中(37℃)进行培养,当细胞生长至对数期后(od:0.5-0.6)加入0.4mm异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导蛋白表达4小时,最后通过细胞收集、破碎及高速离心得上清液,然后利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sds-page)确认蛋白表达正确后菌体可以逐级接入到5l培养发酵罐里进行37℃生长、0.5mmiptg诱导表达6小时,最终获得湿细胞40-60g。lb培养基构成为:1%胰蛋白胨、0.5%酵母粉,1%nacl,1%磷酸氢二钾、1%磷酸氢二钾以及5%的甘油。
表2
各酶可以以含酶的粗酶液、纯化后的酶或固定化酶的方式进行催化反应:
例如:收集的含突变的l-氨基酸连接酶或atp再生酶ppk-adk的湿细胞混合在500ml50mmtrisph8.0的缓冲液中(缓冲液a),搅拌均匀后通过高压破碎细胞,高速离心除去细胞壁,收集到的清液为粗酶液,直接进行后续催化反应;
或者,上述上清液逐渐加入硫酸铵固体直至析出蛋白析出(35%-55%,w/v硫酸铵/缓冲液)。该蛋白固体随后通过高速离心收集(10000rpm,12min),并缓慢溶入100ml缓冲液a,经g25脱盐柱(购于sigma)除盐后经deaesepliteff(西安蓝晓公司)阴离子交换柱分离纯化,最终得到初纯化突变的l-氨基酸连接酶及ppk-adk酶。
在进行固定化时,可参照本领域常规的固定化酶制备方式,在本发明具体实施方式中,本发明利用lx-1000ep环氧树脂(西安蓝晓公司)按照活性单位1:(1.5-3.0)进行一次性混合固定,其固定方法如下:1500-4000u混合酶溶解在1l50mmph8.0的磷酸钾溶液中,随后加入35-55mm苯氧乙酸以及100-400克lx-1000ep环氧树脂至缓冲液,室温搅拌3-6小时后过滤得固定化酶,该固体用清水以及缓冲液a各洗涤三次后低温保存待用。获得的固定化混合酶(lalm-1、ppk1-adk)具有液体酶的35-60%的活性。
依照本发明工艺的反应路线,各反应物质的用量可以根据实际情况调整,为了最大效率化,本发明提供了如下各反应物质的摩尔比:
l-谷氨酸:l-色氨酸:三磷酸腺苷二钠盐:多聚磷酸:氯化镁:氯化钾:突变的lal:ppk-adk=1:1:(0.02):1:2:5:(0.0002):(0.0003)
下面结合实施例,进一步阐述本发明。
实施例1:液体酶催化制备l-谷氨酸-l-色氨酸二肽(lalm-1&ppk1-adk)
参照具体实施方式中的方法获得含氨基酸连接酶lalm-1(h276g、w332k、m334d、l12a、y75s和w76l)或atp再生酶ppk1-adk的湿细胞;混合在500ml50mmtrisph8.0的缓冲液中(缓冲液a),搅拌均匀后通过高压破碎细胞,高速离心(16000rpm,45min)除去细胞壁,收集到的清液粗酶液直接进行以下催化反应:
在1000ml含有100mmph8.0的三羟甲基氨基甲烷盐酸(tris.hcl)溶液中先后加入11.1克l-谷氨酸(75mm)、14.3克l-色氨酸(70mm)、2.8克三磷酸腺苷二钠盐atp(5mm)、10.3克多聚磷酸(sigma,25聚,100mm单磷酸)、0.9克氯化镁(10mm)、1.5克氯化钾(20mm);待ph值调节到8.0后,lalm1与ppk1-adk以1:2的湿细胞体积加入溶液中开始反应,在反应过程中通过添加hcl或naoh水溶液维持体系ph值在6.5-8.5,该溶液在30℃轻微搅拌2小时后直接酸化处理(调节溶液ph值到1.5并快速搅拌),离心除去蛋白杂质;调节溶液ph值到7.0后利用反渗透除盐,随后利用d201阴离子交换树酯除含磷酸杂质(用去离子水做洗脱液,二肽产物与树脂结合弱直接流出),冻干后l-谷氨酸-l-色氨酸粗品通过纯水:乙醇(2-4):1v/v结晶得到24.4克白色粉末(最终收率92%)。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果:
1h-nmr:7.60(d,1.0h),7.32(d,1.0h),7.11(d,2.0h),7.18(s,1.0h),4.55(t,1.0h),3.95(t,1.0h),3.31(d,1.0h),3.06(d,1.0h),2.33(t,2.0h),2.05(t,2.0h);
13c-nmr:178.4,174.7,171.7,136.5,127.4,123.0,121.7,119.8,118.8,111.1,107.1,57.1,54.4,30.4,27.4,26.0。
实施例2:液体酶催化制备l-谷氨酸-l-色氨酸二肽(lalm-2&ppk2-adk)
参照具体实施方式中的方法获得含氨基酸连接酶lalm-2(h276s、w332n、m334s、l12s、y75g和w76v)或atp再生酶ppk2-adk的湿细胞;混合在500ml50mmtrisph8.0的缓冲液中(缓冲液a),搅拌均匀后通过高压破碎细胞,高速离心(16000rpm,45min)除去细胞壁,收集到的清液粗酶液直接进行以下催化反应:
与实施例1类似,但反应浓度稍低,在1000ml含有100mmph8.0的三羟甲基氨基甲烷盐酸(tris.hcl)溶液中先后加入7.4克l-谷氨酸(50mm)、13.4克l-色氨酸(47mm)、2.8克三磷酸腺苷二钠盐atp(5mm)、6.7克多聚磷酸(sigma,25聚,65mm单磷酸)、0.9克氯化镁(10mm)、1.5克氯化钾(20mm);待ph值调节到8.0后,lalm-2与ppk2-adk以2:3的湿细胞体积比加入溶液中开始反应,该反应液在ph6.5-8.530℃轻微搅拌3小时后依上法直接酸化处理除去蛋白杂质,随后进行反渗透除盐,d201阴离子交换树酯除含磷酸杂质,最后所得澄清溶液冻干后纯水:乙醇(2-4):1v/v结晶纯化得15.4克白色粉末(最终收率87%)。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果同实施例1。
实施例3:液体酶催化制备l-谷氨酸-l-色氨酸二肽(lalm-3&ppk1-adk)
参照具体实施方式中的方法获得含氨基酸连接酶lalm-3(n108h、l110a、l182f、g331d)或atp再生酶ppk1-adk的湿细胞;混合在500ml50mmtrisph8.0的缓冲液中(缓冲液a),搅拌均匀后通过高压破碎细胞,高速离心(16000rpm,45min)除去细胞壁,收集到的清液粗酶液直接进行以下催化反应:
与实施例1和2类似,但酶量更多;在1000ml含有100mmph8.0的三羟甲基氨基甲烷盐酸(tris.hcl)溶液中先后加入7.4克l-谷氨酸(50mm)、13.4克l-色氨酸(47mm)、2.8克三磷酸腺苷二钠盐atp(5mm)、6.7克多聚磷酸(sigma,25聚,65mm单磷酸)、0.9克氯化镁(10mm)、1.5克氯化钾(20mm);待ph值调节到8.0后,lalm-3与ppk1-adk以1:3的体积比加入溶液中开始反应,该反应液在ph6.5-8.530℃轻微搅拌8小时后依上法直接酸化处理除去蛋白杂质,随后进行反渗透除盐,d201阴离子交换树酯除含磷酸杂质,最后所得澄清溶液冻干后纯水:乙醇(2-4):1v/v结晶纯化得2.6克白色粉末(最终收率15%)。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果同实施例1。
该实施例旨在说明其他位点的突变获得的突变酶lalm-3,在其他反应条件相一致的前提下,并不能够获得较高的收率。
实施例4:液体酶催化制备l-谷氨酸-l-色氨酸二肽(lal&ppk1-adk)
未突变的lal对甘氨酸、l-丙氨酸、l-丝氨酸、l-亮氨酸、l-异亮氨酸、l-蛋氨酸、l-苯丙胺酸、酪氨酸、l-色氨酸、l-谷氨酰胺等氨基酸有催化活性,但最佳底物是l-丙氨酸(l-alanine)及l-苯丙胺酸(l-phenylalanine)。可直接用来生产l-丙氨酸-l-苯丙胺酸二肽(参考文献:kazuhikotabataetal,journalofbacteriology,2005,187,5195-5202)。
本实施例尝试利用未改造的lal催化l-谷氨酸及l-色氨酸,在实施例3条件下,lal与ppk1-adk以20:1的体积加入,30℃反应24小时后,最终转化率是2.7%。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果同实施例1。
实施例5:固定化酶催化制备l-谷氨酸-l-色氨酸二肽
参照具体实施方式中的方法获得含氨基酸连接酶lalm-1及atp再生酶ppk1-adk的湿细胞混合在500ml50mmtrisph8.0的缓冲液中(缓冲液a),搅拌均匀后通过高压破碎细胞,高速离心(16000rpm,45min)除去细胞壁,往收集到的上清液中逐渐加入硫酸铵固体直至析出蛋白析出(35%-55%,w/v硫酸铵/缓冲液)。该蛋白固体随后通过高速离心收集(10000rpm,12min),并缓慢溶入100ml缓冲液a,经g25脱盐柱(购于sigma)除盐后经deaesepliteff(西安蓝晓公司)阴离子交换柱分离纯化,最终得到初纯化lalm-1及ppk1-adk酶。该酶再利用lx-1000ep环氧树脂(西安蓝晓公司)按照活性单位1:(1.5-3.0)进行一次性混合固定,其固定方法如下:1500-4000u混合酶(lalm-1与ppk1-adk=1:2湿细胞体积比)溶解在1l50mmph8.0的磷酸钾溶液中,随后加入35-55mm苯氧乙酸以及100-400克lx-1000ep环氧树脂至缓冲液,室温搅拌3-6小时后过滤得固定化酶,该固体用清水以及缓冲液a各洗涤三次后低温保存待用。获得的固定化混合酶(lalm-1、ppk1-adk)具有液体酶的35-60%的活性。
在1000ml含有100mmph8.0的三羟甲基氨基甲烷盐酸(tris.hcl)溶液中先后加入8.8克l-谷氨酸(60mm)、13.3克l-色氨酸(65mm)、2.8克三磷酸腺苷二钠盐atp(5mm)、8.3克多聚磷酸(sigma,25聚,80mm单磷酸)、0.9克氯化镁(10mm)、1.5克氯化钾(20mm);待ph值调节到8.0后,1000-3000u固定化混合酶(lalm-1、ppk1-adk)加入溶液开始反应,反应溶液维持ph值在6.5-8.5,该溶液在30℃轻微搅拌5小时后直接过滤回收固体,回收固定化酶具有75-90%的初始活性。过滤液经过反渗透除盐后利用d201阴离子交换树酯除含磷酸杂质,冻干后l-谷氨酸-l-色氨酸粗品通过纯水:乙醇(2-4):1v/v结晶得到19.1克白色粉末(最终收率90%)(活性单位u代表30℃每分钟转化1μm底物所需要的酶量)。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果同实施例1。
实施例6:固定化酶连续流催化制备l-谷氨酸-l-色氨酸二肽
按照实施例5的方法制备固定化酶(lalm-1与ppk1-adk=3:5湿细胞体积比),然后填充到玻璃柱中(柱径10厘米,柱长100厘米),即得固定化酶柱,然后将原料预混液(55mml-谷氨酸,60mml-色氨酸,20mmmgcl2,2mmatp,80mm多聚磷酸(以单磷酸计),100mm磷酸缓冲液,ph7.5)预热至30℃,以流速20l/h通入柱子收集流出液,流出液含l-谷氨酸-l-色氨酸二肽50mm(17.7g/l),底物转化率达91%,反应3h收集反应流出液60l,流出液经反渗透除盐后进行离子交换树脂吸附洗脱,而后进行浓缩、纯水:乙醇(2-4):1v/v结晶后干燥获得l-谷氨酸-l-色氨酸二肽0.88公斤,回收率83%。固定化酶柱连续反应25天后固定化酶具有最初的46%酶活。
纯化后的l-谷氨酸-l-色氨酸在600mvarian,d2o溶液1h-nmr、13c-nmr核磁结果同实施例1。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>深圳瑞德林生物技术有限公司
<120>突变的l-氨基酸连接酶以及酶催化法制备l-谷氨酸-l-色氨酸二肽的工艺
<130>s19p2065
<160>5
<170>siposequencelisting1.0
<210>1
<211>472
<212>prt
<213>人工序列(artificialsequence)
<400>1
metgluarglysthrvalleuvalilealaaspleuglyglycyspro
151015
prohismetphetyrlysseralaalaglulystyrasnleuvalser
202530
pheileproargprophealailethralaserhisalaalaleuile
354045
glulystyrservalalavalilelysasplysasptyrphelysser
505560
leualaaspphegluhisproaspseriletyrtrpalahisgluasp
65707580
hisasnlysprogluglugluvalvalgluglnilevallysvalala
859095
glumetpheglyalaaspalailethrthrasnasngluleupheile
100105110
alaprometalalysalacysgluargleuglyleuargglyalagly
115120125
valglnalaalagluasnalaargasplysasnlysmetargaspala
130135140
pheasnlysalaglyvallysserilelysasnlysargvalthrthr
145150155160
leugluasppheargalaalaleuglugluileglythrproleuile
165170175
leulysprothrtyrleualaserserileglyvalthrleuilethr
180185190
aspthrgluthralagluaspglupheasnargvalasnasptyrleu
195200205
lysserileasnvalprolysalavalthrpheglualapropheile
210215220
alagluglupheleuglnglyglutyrglyasptrptyrglnthrglu
225230235240
glytyrserasptyrileserilegluglyilemetalaaspglyglu
245250255
tyrpheproilealailehisasplysthrproglnileglyphethr
260265270
gluthrserhisilethrproserileleuaspgluglualalyslys
275280285
lysilevalglualaalalyslysalaasngluglyleuglyleugln
290295300
asncysalathrhisthrgluilelysleumetlysasnargglupro
305310315320
glyleuilegluseralaalaargphealaglytrpasnmetilepro
325330335
asnilelyslysvalpheglyleuaspmetalaglnleuleuleuasp
340345350
valleucyspheglylysaspalaaspleuproaspglyleuleuasp
355360365
glngluprotyrtyrvalalaaspcyshisleutyrproglnhisphe
370375380
lysglnasnglyglnileprogluthralagluaspleuvalileglu
385390395400
alaileaspileproaspglyleuleulysglyaspthrgluileval
405410415
serpheseralaalaalaproglythrservalaspleuthrleuphe
420425430
glualapheasnserilealaalaphegluleulysglyserasnser
435440445
glnaspvalalagluserileargglnileglnglnhisalalysleu
450455460
thralalystyrvalleuproval
465470
<210>2
<211>472
<212>prt
<213>人工序列(artificialsequence)
<400>2
metgluarglysthrvalleuvalilealaaspalaglyglycyspro
151015
prohismetphetyrlysseralaalaglulystyrasnleuvalser
202530
pheileproargprophealailethralaserhisalaalaleuile
354045
glulystyrservalalavalilelysasplysasptyrphelysser
505560
leualaaspphegluhisproaspserileserleualahisgluasp
65707580
hisasnlysprogluglugluvalvalgluglnilevallysvalala
859095
glumetpheglyalaaspalailethrthrasnasngluleupheile
100105110
alaprometalalysalacysgluargleuglyleuargglyalagly
115120125
valglnalaalagluasnalaargasplysasnlysmetargaspala
130135140
pheasnlysalaglyvallysserilelysasnlysargvalthrthr
145150155160
leugluasppheargalaalaleuglugluileglythrproleuile
165170175
leulysprothrtyrleualaserserileglyvalthrleuilethr
180185190
aspthrgluthralagluaspglupheasnargvalasnasptyrleu
195200205
lysserileasnvalprolysalavalthrpheglualapropheile
210215220
alagluglupheleuglnglyglutyrglyasptrptyrglnthrglu
225230235240
glytyrserasptyrileserilegluglyilemetalaaspglyglu
245250255
tyrpheproilealailehisasplysthrproglnileglyphethr
260265270
gluthrserglyilethrproserileleuaspgluglualalyslys
275280285
lysilevalglualaalalyslysalaasngluglyleuglyleugln
290295300
asncysalathrhisthrgluilelysleumetlysasnargglupro
305310315320
glyleuilegluseralaalaargphealaglylysasnaspilepro
325330335
asnilelyslysvalpheglyleuaspmetalaglnleuleuleuasp
340345350
valleucyspheglylysaspalaaspleuproaspglyleuleuasp
355360365
glngluprotyrtyrvalalaaspcyshisleutyrproglnhisphe
370375380
lysglnasnglyglnileprogluthralagluaspleuvalileglu
385390395400
alaileaspileproaspglyleuleulysglyaspthrgluileval
405410415
serpheseralaalaalaproglythrservalaspleuthrleuphe
420425430
glualapheasnserilealaalaphegluleulysglyserasnser
435440445
glnaspvalalagluserileargglnileglnglnhisalalysleu
450455460
thralalystyrvalleuproval
465470
<210>3
<211>472
<212>prt
<213>人工序列(artificialsequence)
<400>3
metgluarglysthrvalleuvalilealaaspserglyglycyspro
151015
prohismetphetyrlysseralaalaglulystyrasnleuvalser
202530
pheileproargprophealailethralaserhisalaalaleuile
354045
glulystyrservalalavalilelysasplysasptyrphelysser
505560
leualaaspphegluhisproaspserileglyvalalahisgluasp
65707580
hisasnlysprogluglugluvalvalgluglnilevallysvalala
859095
glumetpheglyalaaspalailethrthrasnasngluleupheile
100105110
alaprometalalysalacysgluargleuglyleuargglyalagly
115120125
valglnalaalagluasnalaargasplysasnlysmetargaspala
130135140
pheasnlysalaglyvallysserilelysasnlysargvalthrthr
145150155160
leugluasppheargalaalaleuglugluileglythrproleuile
165170175
leulysprothrtyrleualaserserileglyvalthrleuilethr
180185190
aspthrgluthralagluaspglupheasnargvalasnasptyrleu
195200205
lysserileasnvalprolysalavalthrpheglualapropheile
210215220
alagluglupheleuglnglyglutyrglyasptrptyrglnthrglu
225230235240
glytyrserasptyrileserilegluglyilemetalaaspglyglu
245250255
tyrpheproilealailehisasplysthrproglnileglyphethr
260265270
gluthrserserilethrproserileleuaspgluglualalyslys
275280285
lysilevalglualaalalyslysalaasngluglyleuglyleugln
290295300
asncysalathrhisthrgluilelysleumetlysasnargglupro
305310315320
glyleuilegluseralaalaargphealaglyasnasnserilepro
325330335
asnilelyslysvalpheglyleuaspmetalaglnleuleuleuasp
340345350
valleucyspheglylysaspalaaspleuproaspglyleuleuasp
355360365
glngluprotyrtyrvalalaaspcyshisleutyrproglnhisphe
370375380
lysglnasnglyglnileprogluthralagluaspleuvalileglu
385390395400
alaileaspileproaspglyleuleulysglyaspthrgluileval
405410415
serpheseralaalaalaproglythrservalaspleuthrleuphe
420425430
glualapheasnserilealaalaphegluleulysglyserasnser
435440445
glnaspvalalagluserileargglnileglnglnhisalalysleu
450455460
thralalystyrvalleuproval
465470
<210>4
<211>508
<212>prt
<213>人工序列(artificialsequence)
<400>4
metvalalaalavalgluphealalysserproalagluvalleuarg
151015
valglyserglypheserleualaglyvalaspprogluserthrpro
202530
glytyrthrglyvallysalaaspglylysalaleuleualaalagln
354045
aspalaargleualagluleuglnglulysleuphealagluglylys
505560
pheglyasnprolysargleuleuleuileleuglnalametaspthr
65707580
alaglylysglyglyilevalserhisvalvalglyalametasppro
859095
glnglyvalglnleuthralaphelysalaprothraspgluglulys
100105110
serhisasppheleutrpargileglulysglnvalproalaalagly
115120125
metvalglyvalpheaspargserglntyrgluaspvalleuilehis
130135140
argvalhisglytrpalaaspalaalagluleugluargargtyrala
145150155160
alaileasnaspphegluserargleuthrgluglnglythrthrile
165170175
vallysvalmetleuasnileserlysaspgluglnlyslysargleu
180185190
ilealaargleuaspaspproserlyshistrplystyrserarggly
195200205
aspleualagluargalatyrtrpaspasptyrmetaspalatyrser
210215220
valalapheglulysthrserthrgluilealaprotrphisvalval
225230235240
proalaasnlyslystrptyralaargilealavalglnglnleuleu
245250255
leuaspalaleuglyglyleuglnleuasptrpprolysalaaspphe
260265270
aspvalalaalagluargalaleuvalvalgluserglnsersergly
275280285
leuvalproargglysermetargileileleuleuglyalaprogly
290295300
alaglylysglythrglnalaglnpheilemetglulystyrglyile
305310315320
proglnileserthrglyaspmetleuargalaalavallyssergly
325330335
sergluleuglylysglnalalysaspilemetaspalaglylysleu
340345350
valthraspgluleuvalilealaleuvallysgluargilealagln
355360365
gluaspcysargasnglypheleuleuaspglypheproargthrile
370375380
proglnalaaspalametlysglualaglyileasnvalasptyrval
385390395400
leuglupheaspvalproaspgluleuilevalaspargilevalgly
405410415
argargvalhisalaproserglyargvaltyrhisvallyspheasn
420425430
proprolysvalgluglylysaspaspvalthrglyglugluleuthr
435440445
thrarglysaspaspglnglugluthrvalarglysargleuvalglu
450455460
tyrhisglnmetthralaproleuileglytyrtyrserlysgluala
465470475480
glualaglyasnthrlystyralalysvalaspglythrlysproval
485490495
alagluvalargalaaspleuglulysileleugly
500505
<210>5
<211>492
<212>prt
<213>人工序列(artificialsequence)
<400>5
metlyslystyrargvalglnproaspglyargphegluleulysarg
151015
pheaspproaspaspthrseralaphegluglyglylysglnalaala
202530
leuglualaleualavalleuasnargargleuglulysleuglnglu
354045
leuleutyralagluglyglnhislysvalleuvalvalleuglnala
505560
metaspalaglyglylysaspglythrileargvalvalpheaspgly
65707580
valasnproserglyvalargvalalaserpheglyvalprothrglu
859095
glngluleualaargasptyrleutrpargvalhisglnglnvalpro
100105110
arglysglygluleuvalilepheasnargserhistyrgluaspval
115120125
leuvalvalargvallysasnleuvalproglnglnvaltrpglnlys
130135140
argtyrarghisilearggluphegluargmetleualaaspglugly
145150155160
thrthrileleulysphepheleuhisileserlysaspgluglnarg
165170175
glnargleuglngluargleuaspasnproglulysargtrplysphe
180185190
argmetglyaspleugluaspargargleutrpaspargtyrglnglu
195200205
alatyrglualaalailearggluthrserthrglutyralaprotrp
210215220
tyrvalileproalaasnlysasntrptyrargasntrpleuvalser
225230235240
hisileleuvalgluthrleugluglyleualametglntyrprogln
245250255
progluthralaserglulysilevalilegluserglnsersergly
260265270
leuvalproargglysermetargileileleuleuglyalaprogly
275280285
alaglylysglythrglnalaglnpheilemetglulystyrglyile
290295300
proglnileserthrglyaspmetleuargalaalavallyssergly
305310315320
sergluleuglylysglnalalysaspilemetaspalaglylysleu
325330335
valthraspgluleuvalilealaleuvallysgluargilealagln
340345350
gluaspcysargasnglypheleuleuaspglypheproargthrile
355360365
proglnalaaspalametlysglualaglyileasnvalasptyrval
370375380
leuglupheaspvalproaspgluleuilevalaspargilevalgly
385390395400
argargvalhisalaproserglyargvaltyrhisvallyspheasn
405410415
proprolysvalgluglylysaspaspvalthrglyglugluleuthr
420425430
thrarglysaspaspglnglugluthrvalarglysargleuvalglu
435440445
tyrhisglnmetthralaproleuileglytyrtyrserlysgluala
450455460
glualaglyasnthrlystyralalysvalaspglythrlysproval
465470475480
alagluvalargalaaspleuglulysileleugly
485490
- 还没有人留言评论。精彩留言会获得点赞!