一种帕布昔利布的制备方法与流程
1.本发明属于药物化学领域,具体涉及一种帕布昔利布的制备方法。
背景技术:
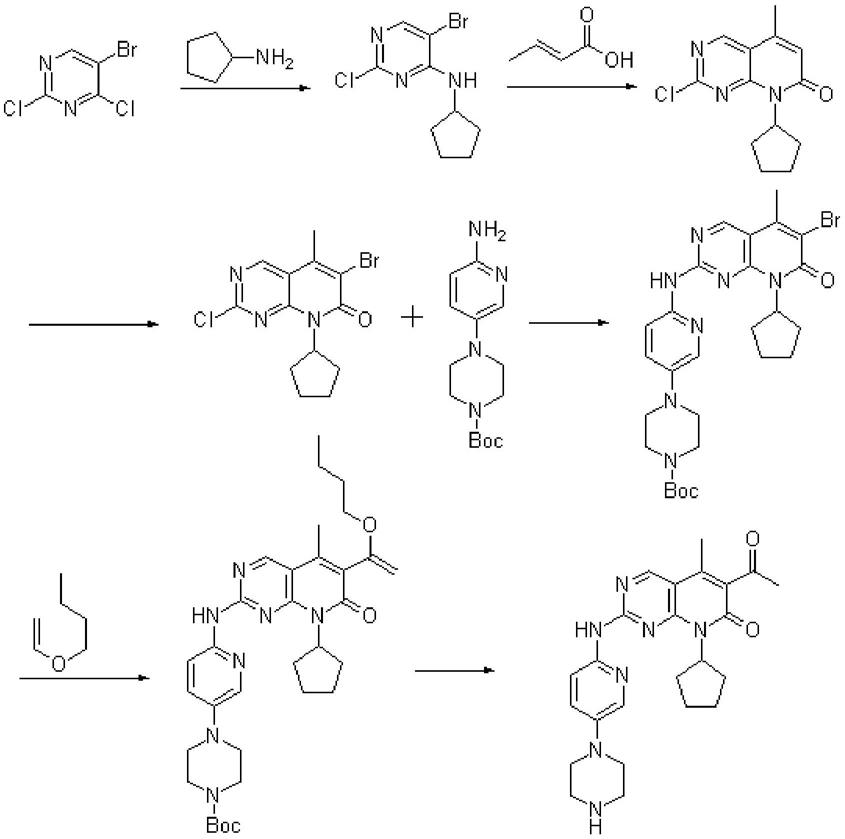
2.帕布昔利布是辉瑞研发的全球首个上市的口服靶向性cdk4/6抑制剂,能够选择性抑制细胞周期蛋白依赖性激酶4和6(cdk4/6),恢复细胞周期控制,阻断肿瘤细胞增殖。其可以联合femara用于既往未接受过系统治疗以控制晚期病情的绝经后女性hr+/her2-晚期或转移性乳腺癌的一线治疗。也可以联合阿斯利康肿瘤学药物faslodex,用于接受内分泌治疗后病情进展的激素受体阳性(hr+)、人表皮生长因子受体2阴性(her2-)晚期或转移性乳腺癌女性患者的治疗。该药物于2015年2月经美国fda加速批准上市。其化学名为6-乙酰基-8-环戊基-5-甲基-2-[[5-(哌嗪-1-基)吡啶-2-基]氨基]-8h-吡啶并[2,3-d]嘧啶-7-酮,结构如下所示:
[0003][0004]
专利wo2014128588 a1报道的帕布昔利布合成方法如下:
[0005][0006]
此专利使用了巴豆酸为原料,后为上乙酰基经过繁琐的步骤,使得总收率降低。
[0007]
因此,需要开发一种帕布昔利布的制备方法,能使合成步骤简单易操作,提高收率和纯度。
技术实现要素:
[0008]
本发明目的是提供一种新的帕布昔利布的制备方法。
[0009]
本发明的第一方面,提供一种帕布昔利布的制备方法,包括以下步骤:
[0010][0011]
(i-a)在惰性溶剂中,缩合剂存在下,乙酰乙酸乙酯与乙醛缩合,水解,得到2-乙酰-2-丁烯酸(a);
[0012]
(i-b)在惰性溶剂中,缚酸剂存在下,5-溴-2,4-二氯嘧啶和环戊胺反应,得到5-溴-2-氯-6-环戊胺-吡啶嘧啶(b);
[0013]
(ii)在惰性溶剂中,碱性条件和催化剂作用下,化合物a与化合物b反应,得到6-乙酰-2-氯-8-环戊基-5-甲基-8h-吡啶[2,3-d]嘧啶-7-酮(c);
[0014]
(iii)在惰性溶剂中,碱性条件下,化合物c与化合物d反应,得到4-{6-[6-乙酰-8-环戊基-5-甲基-7-氧-7,8-二氢-吡啶[2,3-d]嘧啶-2-基氨基]-吡啶-3-基}-哌嗪-1-羧酸叔丁基酯(e);
[0015]
(iv)化合物e脱boc,得到帕布昔利布。
[0016]
在另一优选例中,所述步骤(i-a)和步骤(i-b)中,溶剂各自独立地选自下组:无水甲醇、无水乙醇、甲苯,或其组合,较佳地为无水乙醇。
[0017]
在另一优选例中,所述步骤(ii)中,溶剂选自下组:nmp、正丁醇、二氧六环,或其组合,更佳地为nmp。
[0018]
在另一优选例中,所述步骤(iii)中,溶剂选自下组:无水四氢呋喃、无水二氯甲烷、无水甲苯,或其组合,更佳地为无水四氢呋喃。
[0019]
在另一优选例中,所述步骤(i-a)中,乙醛与乙酰乙酸乙酯的摩尔比为1:1.2-1.5。
[0020]
在另一优选例中,所述步骤(i-a)中,乙醛与乙酰乙酸乙酯的摩尔比为1:1.3。
[0021]
在另一优选例中,所述步骤(i-a)中,缩合剂为哌啶。
[0022]
在另一优选例中,所述步骤(i-a)中,反应的温度为0~70℃,较佳地,10-50℃,更佳地,20~30℃。
[0023]
在另一优选例中,所述步骤(i-a)中,反应的时间为1-24h,较佳地,2-8h,更佳地,
6h。
[0024]
在另一优选例中,所述步骤(i-a)中,在碱存在下水解。
[0025]
在另一优选例中,所述步骤(i-a)中,所述碱液为氢氧化钠水溶液、氢氧化钾水溶液、碳酸钠水溶液、碳酸钾水溶液,或其组合,较佳的,氢氧化钠水溶液。
[0026]
在另一优选例中,所述步骤(i-a)中,在碱存在下水解后,用酸调ph。
[0027]
在另一优选例中,所述步骤(i-a)中,用盐酸调节ph。
[0028]
在另一优选例中,所述步骤(i-b)中,5-溴-2,4-二氯嘧啶与环戊胺的摩尔比为1:1.0-1.5。
[0029]
在另一优选例中,所述步骤(i-b)中,5-溴-2,4-二氯嘧啶与环戊胺的摩尔比为1:1.1-1.3;更佳地为1:1.2。
[0030]
在另一优选例中,所述步骤(i-b)中,缚酸剂选自下组:三乙胺、吡啶、n,n-二异丙基乙胺、4-二甲氨基吡啶、三乙醇胺、四丁基溴化铵、碳酸钾、碳酸铵、碳酸钠,或其组合。
[0031]
在另一优选例中,所述步骤(i-b)中,缚酸剂为三乙胺。
[0032]
在另一优选例中,所述步骤(i-b)中,5-溴-2,4-二氯嘧啶与缚酸剂的摩尔比为1:2.5-8.0;较佳地,1:4-6;更佳地,1:5。
[0033]
在另一优选例中,所述步骤(i-b)中,反应的温度为0~70℃,较佳地,10-50℃,更佳地,20~30℃。
[0034]
在另一优选例中,所述步骤(i-b)中,反应的时间为1-4h,较佳地,2-3h,更佳地,2h。
[0035]
在另一优选例中,所述步骤(ii)中,化合物b与化合物a的摩尔比为1:2-4。
[0036]
在另一优选例中,所述步骤(ii)中,化合物b与化合物a的摩尔比为1:2.3-2.8;优选地为1:2.5。
[0037]
在另一优选例中,所述步骤(ii)中,惰性溶剂与化合物b的体积质量比为1:2-10;较佳地,1:3-7;更佳地,1:5。
[0038]
在另一优选例中,所述催化剂为醋酸钯、氯化钯或其组合,较佳的,醋酸钯。
[0039]
在另一优选例中,所述步骤(ii)中,所述碱为三乙胺。
[0040]
在另一优选例中,所述步骤(ii)中,化合物b与三乙胺的摩尔比为1:3-9;较佳地,1:4-6;更佳地,1:5。
[0041]
在另一优选例中,所述步骤(ii)中,化合物b与催化剂的质量比为1:0.01-0.04。
[0042]
在另一优选例中,所述步骤(ii)中,化合物b与催化剂的质量比为1:0.02-0.03;更佳地为1:0.025。
[0043]
在另一优选例中,所述步骤(ii)中,反应的温度为0~90℃,较佳地,50-70℃,更佳地,65℃。
[0044]
在另一优选例中,所述步骤(ii)中,反应的时间为1-10h,较佳地,5-8h,更佳地,6h。
[0045]
在另一优选例中,所述步骤(ii)中,还需要加入乙酸酐。
[0046]
在另一优选例中,所述化合物b与乙酸酐的摩尔比为1:1.3-2.5;较佳地,1:1.6-1.9;更佳地,1:1.8。
[0047]
在另一优选例中,所述步骤(ii)中,加入乙酸酐后,继续反应的时间为1-4h,较佳
地,2-3h,更佳地,2h。
[0048]
在另一优选例中,所述步骤(iii)中,化合物c与化合物d的摩尔比为1:1.2-1.8。
[0049]
在另一优选例中,所述步骤(iii)中,化合物c与化合物d的摩尔比为1:1.4-1.6;优选地为1:1.5。
[0050]
在另一优选例中,所述步骤(iii)中,溶剂的体积与化合物c的质量比为1:6-20;较佳地,1:8-12;更佳地,1:10。
[0051]
在另一优选例中,所述步骤(iii)中,温度为0~30℃,更佳地,10~20℃。
[0052]
在另一优选例中,所述步骤(iii)中,反应的时间为10-24h,较佳地,14-18h,更佳地,16h。
[0053]
在另一优选例中,所述步骤(iii)中,所述碱为lda、lihmds、丁基锂或其组合。
[0054]
在另一优选例中,所述步骤(iii)中,化合物c与碱的摩尔比为1:1.5-3.0;较佳地,1:1.8-2.2;更佳地,1:2.0。
[0055]
在另一优选例中,所述步骤(iii)中,所述碱为lihmds。
[0056]
在另一优选例中,所述步骤(iv)中,将化合物e在酸性条件下脱boc后,用碱液调节ph至10,得到帕布昔利布。
[0057]
在另一优选例中,所述步骤(iv)中,反应的温度为30~80℃,较佳地,45-75℃,更佳地,75℃。
[0058]
在另一优选例中,所述步骤(iv)中,酸选自下组:氯化氢气体、浓盐酸、乙酰氯,或其组合,较佳地为浓盐酸。
[0059]
在另一优选例中,所述步骤(iv)中,反应的时间为1-4h,较佳地为1.5-3h,更佳地为2h。
[0060]
在另一优选例中,所述步骤(iv)中,碱液选自下组:氢氧化钠水溶液、氢氧化钾水溶液、碳酸钠水溶液、碳酸钾水溶液,或其组合,较佳地为氢氧化钠水溶液。
[0061]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0062]
本发明人经过广泛而深入的研究,通过大量筛选和测试,开发了一种帕布昔利布制备方法,操作简单安全,产物纯度高,收率提高。在此基础上完成了本发明。
[0063]
术语
[0064]
除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。
[0065]
如本文所用;
[0066]“v”是指体积质量比。
[0067]
术语“化合物a”与“2-乙酰-2-丁烯酸”可互换使用。
[0068]
术语“化合物b”与“5-溴-2-氯-6-环戊胺-吡啶嘧啶”可互换使用。
[0069]
术语“化合物c”与“6-乙酰-2-氯-8-环戊基-5-甲基-8h-吡啶[2,3-d]嘧啶-7-酮”可互换使用。
24h,较佳地,2-8h,更佳地,6h;碱液为氢氧化钠水溶液、氢氧化钾水溶液、碳酸钠水溶液、碳酸钾水溶液或其组合。
[0082]
步骤(2):将5-溴-2,4-二氯嘧啶溶于溶剂中,加入缚酸剂,降温,滴加环戊胺,滴加完毕,在合适的温度下,反应一定时间,待反应完全后,加水搅拌,过滤,得化合物b;其中,缚酸剂可以是本领域常用的缚酸剂,例如:三乙胺、吡啶、n,n-二异丙基乙胺、4-二甲氨基吡啶、三乙醇胺、四丁基溴化铵、碳酸钾、碳酸铵、碳酸钠,或其组合;该步骤中,反应溶剂、反应温度、反应时间等可以根据具体的反应物进行选择,例如反应的温度可以为0~70℃,较佳地,10-50℃,更佳地,20~30℃;反应的时间可以为1-4h,较佳地,2-3h,更佳地,2h。
[0083]
步骤(3):将化合物b溶于溶剂中,加入三乙胺,化合物a,催化剂,氮气保护,在合适的温度下反应一定时间,待反应完全后,加入乙酸酐反应一定时间,待反应完全后,过滤,回收催化剂,加入水搅拌,过滤,得化合物c;其中,催化剂可以为常用的钯催化剂,例如醋酸钯、氯化钯或其组合;该步骤中,反应溶剂、反应温度、反应时间等可以根据具体的反应物进行选择,例如反应的温度可以为0~90℃,较佳地,50-70℃,更佳地,65℃;反应的时间可以为1-10h,较佳地,5-8h,更佳地,6h。
[0084]
步骤(4):将化合物d溶于溶剂中,在一定温度下,氮气保护,滴加拔氢试剂(碱),搅拌一定时间,分批加入化合物c,在室温下,反应一定时间,待反应完全后,加入醋酸,析出固体,过滤,得化合物e;拔氢试剂为本领域常用的有机强碱,例如可以为lda、lihmds、丁基锂或其组合;该步骤中,反应溶剂、反应温度、反应时间等可以根据具体的反应物进行选择,例如反应的温度可以为0~30℃,更佳地,10~20℃。
[0085]
步骤(5):将化合物e加入溶剂中搅拌,在一定温度下,在酸性条件下脱boc,搅拌一定时间,反应完全,加入苯甲醚,用碱液调节ph至10,分液,有机相加热回流分出水分,降温,过滤得帕布昔利布;其中,酸为氯化氢气体、浓盐酸、乙酰氯,或其组合;碱液为氢氧化钠水溶液、氢氧化钾水溶液、碳酸钠水溶液、碳酸钾水溶液,或其组合;该步骤中,反应溶剂、反应温度、反应时间等可以根据具体的反应物进行选择,例如反应的温度为30~80℃,较佳地,45-75℃,更佳地,75℃。
[0086]
本发明的主要优点包括:
[0087]
(1)本发明采用以2-乙酰-2-丁烯酸代替巴豆酸的制备方法使之直接得带有乙酰基的产物,无需经过繁琐的步骤上乙酰基,使得合成路线简化。
[0088]
(2)本发明使用的2-乙酰-2-丁烯酸制备方法简单,易制得。
[0089]
(3)本发明合成路线生产周期短,总反应收率提高,反应条件温和,产品纯度高。
[0090]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0091]
以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0092]
实施例
[0093]
实施例1化合物a的合成
[0094]
[0095]
将乙酰乙酸乙酯(100.0g,0.7684mol)溶于无水乙醇(500ml,5v)中搅拌,加入哌啶(98.2g,1.1526mol),乙醛(44.0g,0.9989mol)在温度20-30℃反应6h,反应完全后,滴加30%氢氧化钠水溶液(175ml),搅拌2h,反应完全,旋蒸除去乙醇,向旋蒸物中加入水(500ml),乙酸乙酯(300ml)搅拌分液,水相用稀盐酸调节ph至3-4,用乙酸乙酯(500ml)萃取,干燥,旋干有机相,得化合物a 81.3g,收率:82.6%(以乙酰乙酸乙酯计),ms(esi):[m+1]
+
=129.14。
[0096]
实施例2化合物b合成
[0097][0098]
将5-溴-2,4-二氯嘧啶(100.0g,0.4388mol)溶于无水乙醇(300ml,3v)中搅拌,加入三乙胺(53.3g,0.5266mol)降温至0-5℃,保持温度,滴加环戊胺(44.8g,0.5266mol),在温度20-30℃反应2h,反应完全,加入水(250ml)搅拌,过滤,烘干,得白色固体106.5g,收率:87.8%(以5-溴-2,4-二氯嘧啶计),ms(esi):[m+1]
+
=277.56。
[0099]
实施例3化合物c合成
[0100][0101]
将化合物b(80.0g,0.2893mol)溶于nmp(400ml,5v)中搅拌,加入三乙胺(146.4g,1.4465mol),化合物a(92.7g,0.7233mol),醋酸钯(2.0g),氮气保护,加热至温度65℃,反应6h,反应完全,加入乙酸酐(53.2g,0.5207mol)反应2h,趁热过滤,回收醋酸钯,滤液降温至10-20℃,加入水(800ml)搅拌,过滤,烘干,得白色固体73.7g,收率:83.3%(以化合物b计),ms(esi):[m+1]
+
=306.75。
[0102]
实施例4化合物e合成
[0103][0104]
将化合物d(95.6g,0.3434mol)溶于无水四氢呋喃(700ml,10v)中搅拌降温10-20℃,氮气保护,保持温度,滴加lihmds四氢呋喃溶液(470ml,0.4578mol),滴加完毕搅拌1h,分批加入化合物c(70.0g,0.2289mol),在室温下反应15h,反应完全,加入醋酸(23.4g,
0.3891mol),搅拌2h,析出黄色固体,过滤,烘干,得黄色固色117.5g,收率:93.7%(以化合物c计),ms(esi):[m+1]
+
=548.65。
[0105]
实施例5帕布昔利布的合成
[0106][0107]
将化合物e(110g,0.2005mol)加入正丁醇(1320ml,12v)与水(1100ml,10v)中搅拌,加热至70℃,开始滴加浓盐酸(49.2g,0.5013mol),滴加完毕搅拌2h反应完毕,加入苯甲醚(2000ml,18v)搅拌,用30%氢氧化钠水溶液调节ph至10,分出有机相,有机相加热至回流分出水,降温至10℃,过滤,烘干,得黄色固体76.1g,收率:84.8%(以化合物e计),纯度99.82%ms(esi):[m+1]
+
=448.53。
[0108]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1