一种用于检测多种人乳头状瘤病毒分型的试剂盒及操作方法与流程
1.本发明涉及病毒核酸检测领域,更具体而言,其涉及一种用于检测多种人乳头状瘤病毒(hpv)分型的试剂盒及操作方法。
背景技术:
2.宫颈癌是全球女性第二大恶性肿瘤。据世界卫生组织(who)统计,全世界每年约有50多万宫颈癌新发病例,约27万妇女死于宫颈癌,其中85%以上发生在缺乏有效宫颈癌筛查及治疗规划的低收入和中等收入国家。目前世界已公认,高危型人乳头状瘤病毒(hpv)感染是引发宫颈癌变的首要因素,这使得高危型hpv检测可作为宫颈疾病辅助诊断及处理后定性监测的主要手段之一。
3.qiagen公司(收购digene公司)的产品hc2于2009年通过了美国fda的认证,其能一次性检测13种高危型hpv,具体包括hpv16、18、31、33、35、39、45、51、52、56、58、59和68型。其检测原理及反应条件为:样本中的hpv双链dna在65℃条件下45分钟变性分解成单链,单链dna与13种rna探针混合物在65℃条件下60分钟结合为dna-rna杂合体,dna-rna杂合体与捕获微孔板上的抗dna-rna杂合体的特异性抗体在20-25℃条件下1100rpm的速度振荡60分钟结合固定在捕获微孔板上,再与偶联有碱性磷酸酶的抗dna-rna杂合体的特异性抗体在20-25℃条件下反应30-45分钟结合,洗板后加入碱性磷酸酶底物20-25℃条件下反应15-30分钟酶促发光,在化学发光免疫分析仪上测量出来并用相对光单位(rlu)表示来确定碱性磷酸酶的含量,从而确定dna-rna杂合体含量,最终判定样本中的hpv dna含量。
4.然而,在这些检测技术中,操作步骤较多,容易导致检测所花费的时间较长,难以快速定量判断样本中的所携带的细菌或者病毒的dna含量,且其他检测hpv的方法主要以pcr技术为主,其检测过程中涉及到靶标dna的扩增,容易导致靶标dna量受到影响,最终导致检测结果不够准确。另外,这些目前公知的技术不能高效且准确地检测其中的一些分型,例如hpv16或hpv18。因此,本领域中仍然需要一种能够快速且准确定量检测出靶标dna的手段,尤其是一种能够快速、准确地检测多种人乳头状瘤病毒分型的手段。
技术实现要素:
5.针对现有技术存在的不足,本发明的目的在于提供一种能够检测多种(例如18种)人乳头状瘤病毒分型的试剂盒及操作方法。利用该试剂盒,能够快速、全面、准确地检测18种人乳头状瘤病毒分型,从而为该病毒的检查和确认提供有力的支持。
6.上述目的通过以下方案来实现:在第一方面,提供了一种用于检测多种人乳头状瘤病毒分型的试剂盒,其包括:分别容纳变性试剂、多种hpv分型特异性探针的混合物、检测试剂、底物试剂、阴性对照品和阳性对照品的试剂瓶、捕获板和洗涤液,其中所述多种hpv分型包括选自hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73和82中的一种或多种。
7.利用该试剂盒,能够一次性检测样本中是否携带多种hpv分型中的一种或多种,具
有检测全面、快速、准确的优点。
8.进一步地,根据前述第一方面所述的试剂盒,所述变性试剂为氢氧化钠溶液。
9.进一步地,根据前述第一方面所述的试剂盒,所述检测试剂为偶联有标记物的抗dna-rna杂合体的高特异性抗体。在一个优选方案中,标记物为荧光标记物、金标记物或酶标记物。在一个进一步优选的方案中,所述酶标记物为辣根过氧化物酶(hrp)或碱性磷酸酶。
10.进一步地,根据前述第一方面所述的试剂盒,所述底物试剂为碱性磷酸酶化学发光底物。
11.进一步地,根据前述第一方面所述的试剂盒,所述捕获板为包被有抗dna-rna杂合体的特异性抗体的化学发光板。
12.进一步地,根据前述第一方面所述的试剂盒,所述阴性对照品为含有载体dna的溶液。在一个优选方案中,所述载体dna为动物基因组dna,优选人类基因组dna。在一个实施方案中,所述载体dna的浓度为10-200mg/ml,优选为30、50、70、90、100、120、140、160或180mg/ml。
13.进一步地,根据前述第一方面所述的试剂盒,所述阳性对照品为含有1pg/ml hpv16 dna和载体dna的溶液。
14.进一步地,根据前述第一方面所述的试剂盒,所述洗涤液为tris-hcl缓冲盐水液。
15.在第二方面,提供了一种用于检测多种人乳头状瘤病毒分型的试剂盒,其包括:分别容纳变性试剂、16种hpv分型特异性探针的混合物、2种hpv分型特异性探针的混合物、检测试剂、底物试剂、阴性对照品和阳性对照品的试剂瓶、捕获板和洗涤液。
16.利用该试剂盒,不仅能够一次性检测样本中是否携带18种hpv分型,而且能够检测其是否携带hpv16或18,具有检测全面、快速、准确的优点。
17.进一步地,根据前述第一方面所述的试剂盒,所述16种hpv分型包括hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82,所述2种hpv分型包括hpv16和hpv18。
18.进一步地,根据前述第一方面所述的试剂盒,所述变性试剂为氢氧化钠溶液。
19.进一步地,根据前述第一方面所述的试剂盒,所述检测试剂为偶联有标记物的抗dna-rna杂合体的高特异性抗体。在一个优选方案中,标记物为荧光标记物、金标记物或酶标记物。在一个进一步优选的方案中,所述酶标记物为辣根过氧化物酶(hrp)或碱性磷酸酶。
20.进一步地,根据前述第一方面所述的试剂盒,所述底物试剂为碱性磷酸酶化学发光底物。
21.进一步地,根据前述第一方面所述的试剂盒,所述捕获板为包被有抗dna-rna杂合体的特异性抗体的化学发光板。
22.进一步地,根据前述第一方面所述的试剂盒,所述阴性对照品为含有载体dna的溶液。
23.进一步地,根据前述第一方面所述的试剂盒,所述阳性对照品为含有1pg/ml hpv16 dna和载体dna的溶液。
24.进一步地,根据前述第一方面所述的试剂盒,所述洗涤液为tris-hcl缓冲盐溶液。
25.在第三方面,提供了一种用于检测多种人乳头状瘤病毒分型的试剂盒,其包括:分
别容纳变性试剂、16种hpv分型特异性探针的混合物、hpv16特异性探针、hpv18特异性探针、检测试剂、底物试剂、阴性对照品和阳性对照品的试剂瓶、捕获板和洗涤液。
26.进一步地,根据前述第一方面所述的试剂盒,所述16种hpv分型包括hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82。
27.进一步地,根据前述第一方面所述的试剂盒,所述变性试剂为氢氧化钠溶液。
28.进一步地,根据前述第一方面所述的试剂盒,所述检测试剂为偶联有标记物的抗dna-rna杂合体的高特异性抗体。在一个优选方案中,标记物为荧光标记物、金标记物或酶标记物。在一个进一步优选的方案中,所述酶标记物为辣根过氧化物酶(hrp)或碱性磷酸酶。
29.进一步地,根据前述第一方面所述的试剂盒,所述底物试剂为碱性磷酸酶化学发光底物。
30.进一步地,根据前述第一方面所述的试剂盒,所述捕获板为包被有抗dna-rna杂合体的特异性抗体的化学发光板。
31.进一步地,根据前述第一方面所述的试剂盒,所述阴性对照品为含有载体dna的溶液。
32.进一步地,根据前述第一方面所述的试剂盒,所述阳性对照品为含有1pg/ml hpv16 dna和载体dna的溶液。
33.进一步地,根据前述第一方面所述的试剂盒,所述洗涤液为tris-hcl缓冲盐溶液。
34.在第四方面,提供了一种操作根据前述第一、第二或第三方面所述的试剂盒的方法,其包括以下步骤:采集多个细胞样本;变性:将对照品及各细胞样本中加入变性试剂并混匀,然后在水浴中孵育;杂交:在独立准备的杂交板中加入探针试剂,将从步骤2)中获得的变性后的对照品和各样本转移至对应的所述杂交板中并在加热振荡的条件下进行杂交;捕获:将在步骤3)获得的杂交液体完全转移至对应的捕获板中并在40-45℃的条件下振荡40-80分钟;检测:移除捕获板中的液体并加入检测试剂,并在40-45℃的条件下振荡20-40分钟;化学发光:移除捕获板中的检测试剂,然后加入底物试剂,室温避光孵育5-20分钟,然后读取相对光量子数,计算阴性对照品和阳性对照品的变系数cv值。
35.在第五方面,提供了一种快速定量检测靶标dna的方法,包括如下步骤:步骤一,变性:将待检测样本的细胞破碎,使蛋白质变性、rna降解,且使dna变性分解为单链dna,获得变性后的样本;步骤二,杂交:将步骤一中获得的变性后的样本与保存在ph值为3.5-4.0的核酸保存液中的特异性的单链rna探针混合,在ph值为7.0-7.4的范围内、温度为60-70℃的条件下杂交30-60min,使特异性的单链rna探针与变性后样本中的单链dna进行杂交,形成dna-rna杂合体溶液;步骤三,捕获:将第一抗体固定在载体上,再加入步骤二中获得的dna-rna杂合体溶液,在温度为40-45℃的条件下,用第一抗体对dna-rna杂合体溶液中的杂合体捕获30-90min,将液体移除;
步骤四,检测:将步骤三中获得的用第一抗体捕获的dna-rna杂合体与保存于蛋白保存液中的第二抗体在40-45℃进行反应20-40min后,洗涤,在室温避光条件下静置5-20min,进行检测;所述步骤二中,所述变性后的样本中的单链dna与单链rna探针形成dna-rna杂合体;所述步骤三中,第一抗体为特异性识别杂合体的物质,所述特异性识别杂合体的物质为dna-rna杂合体结构特异性抗体、多克隆抗体或单克隆抗体或其片段、蛋白质、催化失活的核糖核酸酶h、核酸、核酸适配体或与dna-rna杂合体特异性结合形成三链体结构的寡核苷酸中的一种。在一个优选方案中,所述第一抗体为包被试剂,优选为-抗dna-rna杂合体的高特异性抗体。
36.所述第二抗体上携带有标记物,所述标记物在出现受激发光激发反应而发射荧光,或金颗粒聚集而显色,或酶催化反应而发光或显色。在一个实施方案中,所述第二抗体为-检测试剂,优选为偶联有标记物的抗dna-rna杂合体的高特异性抗体。在一个优选方案中,所述标记物优选为碱性磷酸酶。
37.通过采用上述技术方案,步骤一中,将细胞破碎后,通过浓度为1.75mol/l、与待检测样本的体积比为1:2的氢氧化钠溶液的作用,在65℃的条件下反应30min,可使蛋白质变性,同时使rna降解,从而减少了蛋白质、rna对后续检测造成影响。此外,氢氧化钠溶液还可使dna的双螺旋结构被打开,变性分解为单链的dna。本发明中,采用化学和物理方法相结合的方法,可达到高效降解rna和使双链dna变性成单链dna的作用。
38.步骤一中,若待检测样本中含有待测细菌或病毒,则细菌或者病毒的双螺旋结构的双链dna被变性分解为单链dna;而在步骤二中,将特异性的单链核酸探针置于ph值为3.5-4.0的核酸保存液中进行保存,有助于使异性的单链核酸探针在无需冻存的情况下保持稳定不被环境中的酶所降解。当ph值为3.5-4.0的特异性的单链核酸探针溶液与ph值为碱性的变性分解为单链dna溶液的样本按一定比例混合形成ph为中性的溶液,特异性的单链核酸探针为单链rna探针。在65℃条件下,根据碱基序列互补配对原则,变性后的样本中的单链dna与单链rna探针形成dna-rna杂合体。而之所以需要在65℃的温度下进行,这部分试验在实施例中有具体的公开。
39.步骤二中,以100ml核酸保存液计,核酸保存液包括如下用量的组分:柠檬酸三钠5.8-5.95g;生物缓冲剂19.56-20.21g;乙二胺四乙酸二钠0.173-0.192g;酸度调节剂8.2-9.0ml;防腐剂28-33μl;余量为纯水;保存液的ph值为3.5-4.0;缓冲液包括盐酸三乙醇胺、n,n-双(2-羟乙基)-2-氨基乙磺酸中的至少一种;酸度调节剂包括冰乙酸、聚丙烯酸中的至少一种。
40.步骤二中,将特异性的单链核酸探针保存在核酸保存液中,采用该核酸保存液可在无所冷冻的情况下对单链rna探针进行保存,并能使单链rna探针保持组织结构稳定且不易被降解。
41.在步骤二中并不对裂解后的样本进行纯化,有助于缩短时间。现有技术中,如果对裂解后的样本进行纯化,则会对单链dna造成一定的影响,甚至使单链dna的数量降低,从而有可能使靶标dna的量受到影响,进而造成对靶标dna的定量不准。
42.虽然,步骤二中并未进行纯化,但最终并没有对后续的操作带来不利的影响。因此,不仅节约了处理的时间,还不易造成检测不准确的现象。
43.步骤三中,第一抗体为特异性识别杂合体的物质,特异性识别杂合体的物质为dna-rna杂合体结构特异性抗体,多克隆抗体或单克隆抗体或其片段、蛋白质、催化失活的核糖核酸酶h、核酸、核酸适配体或与dna-rna杂合体特异性结合形成三链体结构的寡核苷酸中的一种。催化失活的核糖核酸酶h是将核糖核酸酶h处理后失去催化作用,有利于保留和dna-rna杂合体结合作用。
44.第一抗体的主要作用在于,可以捕获杂合体溶液中的杂合体,且在42℃的温度下反应60min,有助于使第一抗体充分捕获杂合体。第二抗体具有标记物,标记物在出现受激发光激发反应时而发射荧光,或金颗粒聚集而显色,或酶催化反应而发光或显色,从而实现检测的目的。步骤三中,第一抗体将杂合体捕获,即第一抗体与杂合体上的靶点结合,第二抗体与dna-rna杂合体或者杂交体进行结合,并且通过第二抗体上的标记物进行显示(该种情况为单链rna探针上不含有修饰物),从而获得对dna-rna杂合体进行检测,同时也对样本中的靶标dna进行检测。
45.在步骤三的操作过程中,先将第一抗体固定在载体上,有助于增加第一抗体的在操作过程中的稳定性,且当其与杂合体形成结合/捕获时,有助于提高其捕获杂合体而获得的第一抗体和杂合体结合的产物在载体上的稳固程度。当第一抗体与杂合体进行充分结合后,将其他的杂质洗涤去除,留下第一抗体与杂合体,进行步骤四中的操作。
46.与此同时,筛第一抗体和第二抗体是自行筛选(在实施例部分具体提出),主要是为了尽量减少特异性的单链核酸探针和靶标dna的错配,以及尽量避免第一抗体和第二抗体出现失活的现象。其中,当筛选第一抗体和第二抗体所采用的温度设置在42℃,此时获得的第一抗体和第二抗体的性能好,且所需的反应时间较短。42℃的温度与25℃、37℃的温度相比,较高的温度加快了分子热运动,从而有助于缩短反应所需的时间;第二抗体与第一抗体进行结合,而第一抗体则与杂合体上的靶标dna进行连接,而温度较高可有效增加第二抗体与第一抗体之间的结合,从而更为准确地显示出信噪比。在42℃的温度与45℃、50℃、65℃的温度相比,随着温度越升越高,导致第一抗体、第二抗体的活性逐渐下降甚至失活,最终导致难以通过第二抗体上携带的标记物而准确检测出信噪比。
47.然而,步骤四中,用标记物标记的第二抗体工作液中的浓度含量极低,为10-50ng/ml级别,而将第二抗体保存在蛋白保存液中,可使第二抗体达到较好的稳定性,并达到使检测结果较为准确的效果。且该保存法无需在冷冻条件下进行,大幅降低了保存的难度,并且有助于使标记物以及第二抗体保持原始状态,从而使获得的检测结果更为准确。
48.且在步骤四中,蛋白保存液以100ml保存液计,包括如下用量的组分:氯化钠2.535-3.501g;tris-hcl缓冲液6-7ml;酪蛋白溶液20-28ml;防腐剂28-31μl;
余量为纯水;tris-hcl的ph值为7.4-7.5。
49.在步骤四中,引入了第二抗体,且第二抗体上还标记有标记物,而标记物通常为蛋白质类物质,采用该蛋白液保存,不仅不需要置于极低的温度下进行保存操作,还可使第二抗体以及其上所标记的标记物保持良好的活性,从而使检测效果更为准确和真实。
50.进一步优选为:所述步骤二中,所述特异性的单链rna探针可以为针对靶标dna的全长单链rna探针或者针对部分靶标dna的片段单链rna探针;当特异性的单链rna探针为针对靶标dna的全长单链rna探针时,针对靶标dna的全长单链rna探针为连续的针对靶标dna的全长单链rna探针或者分段的针对靶标dna的全长单链rna探针。通过采用上述技术方案,无论是针对靶标dna的全长单链核酸探针或者针对部分靶标dna的片段单链rna探针,其上面能与单链dna形成结合的碱基具有一定的特异性,从而可使特异性的单链rna探针与单链dna上的碱基形成配对并实现特异性的单链rna探针与单链dna的杂合,获得dna-rna杂合体。
51.进一步优选为:所述分段的针对靶标dna的全长单链rna探针的长度大于100bp。
52.通过采用上述技术方案,关于分段的针对靶标dna的全长单链核酸探针的长度的选取,可以举个例子:hpv靶标dna的长度为8000bp,而单链rna探针可以选择长度为8000bp的全长单链rna探针;也可以选择100-2000bp的片段单链rna探针,如选择2000bp长度的片段单链rna探针时,需要有4段单链rna探针组合使用,分别是1-2000bp、2001-4000bp、4001-6000bp以及是6001-8000bp的长度。
53.且无论是连续的还是分段的,都可以使全长单链rna探针与单链dna产生杂合效果,从而获得dna-rna杂合体。
54.此外,分段的优点是便于在每段分段的特异性的单链核酸探针的首尾引入标记物,比如生物素,后续可以用与生物素所亲和的亲和素去特异性捕获生物素并进行后续的检测,可获得更好的标识效果。
55.而经研究发现,只要分段的针对靶标dna的全长单链核酸探针的长度大于100bp时,比如长度在100-2000bp时,均可与单链dna形成碱基配对,进而使单链dna与分段的针对靶标dna的全长单链核酸探针形成杂合。若分段的针对靶标dna的全长单链核酸探针的长度小于100bp,则容易引起杂合过程不够稳定而导致最终的检测效果不够准确。
56.进一步优选为:所述步骤四中,所述第二抗体为dna-rna杂合体结构特异性抗体,多克隆抗体或单克隆抗体或其片段,蛋白质,催化失活的核糖核酸酶h、核酸、核酸适配体或与dna-rna杂合体特异性结合形成三链体结构的寡核苷酸中的一种。
57.通过采用上述技术方案,当杂合体为dna-rna杂合体时,用有标记物的特异性识别杂合体或杂合体上修饰物的物质(即第二抗体)为dna-rna杂合体结构特异性抗体,多克隆抗体或单克隆抗体或其片段、蛋白质、催化失活的核糖核酸酶h、核酸、核酸适配体或与dna-rna杂合体特异性结合形成三链体结构的寡核苷酸中的一种,因此,第二抗体得以与dna-rna杂合体形成结合,进而使最终获得的检测结果更为准确。
58.进一步优选为:所述步骤二中,特异性的单链rna探针携带修饰物;所述步骤四中,采用能与修饰物结合并且出现特异性显色的物质代替第二抗体。
59.通过采用上述技术方案,当单链rna探针上携带有修饰物,且该修饰物为生物素,
当采用亲和素代替第二抗体时,亲和素与生物素形成结合,也会出现较好且较快的对特异性的显色效果,从而达到快速检测靶标dna的目的。
60.进一步优选为:所述修饰物为生物素;所述能与修饰物结合并且出现特异性显色的物质为亲和素。
61.通过采用上述技术方案,亲和素能与生物素进行结合,并且出现特异性显色,因此,采用亲和素代替第二抗体,也能达到快速检测靶标dna的目的。
62.进一步优选为:所述步骤二中,特异性的单链核酸探针与变性后的样本的体积比为1:3。
63.通过采用上述技术方案,在本发明中尽可能过量加入特异性的单链核酸探针,从而可使其与变性后的样本中的单链dna形成充分的杂合,配合后续的操作,进而有助于提高检测靶标dna的准确性。若待测样本中的细菌或者病毒的靶标dna的浓度最高在1ng/ml,变性后的细菌或者病毒的靶标dna的浓度最高也为1ng/ml,本发明所用特异性的单链核酸探针的浓度为500-1000ng/ml,为靶标dna的500-1000倍,根据分子动力学原理,这种操作方法可使99.8%以上的变性后单链dna与rna探针结合。
64.进一步优选为:所述步骤三中的载体为固相载体或是非固相载体。
65.通过采用上述技术方案,固相载体和非固相载体,均可为第一抗体提供附着的环境。
66.进一步优选为:所述固相载体为平板、微孔板、载玻片、皿、磁珠、微球、芯片、膜、微阵列、试管、硅、玻璃、陶瓷、金属或者塑料中的至少一种;所述非固相载体为在第一抗体上标记荧光共振能量转移探针。
67.通过采用上述技术方案,而固相载体具有固定的环境,稳定性较好;非固相载体更方便操作,可以有效减少反应步骤,因此,选择在第一抗体和第二抗体上标记荧光共振能量转移探针,主要是为了当有dna-rna杂合体时,第一抗体会捕获dna-rna杂合体,且第二抗体会与第一抗体形成结合从而出现发光的现象,达到检测dna-rna杂合体的目的。
68.进一步优选为:所述步骤四中,标记物为荧光标记物、金标记物、酶标记物中的一种。
69.通过采用上述技术方案,荧光标记物、金标记物、酶标记物在检测过程中,均可出现发光的效果,从而可使获得的检测情况更为直观和准确。
70.综上所述,本发明具有以下有益效果:本发明中,无需将变性后的样本进行纯化处理,步骤减少,缩短了检测时杂交步骤所需时间,提高了操作的效率。
71.在步骤二中,不对变性后的样本进行靶标dna的提取纯化处理,从而使其中存在的单链dna的数量不受到任何影响,将待测样本中的细菌或者病毒的靶标尽可能保留,即不经过纯化处理的变性后的样本中所含有的所有单链dna均可以被用于检测靶标dna,对后续会产生的检测的信号进行放大,进而使检测的结果更为真实和准确。
72.在检测过程中,没有对靶标dna进行模板扩增,只是单纯采用信号放大的方法,所添加的特异性的单链核酸探针与单链dna结合形成杂合体(dna-rna杂合体),所添加的第一抗体进会与杂合体进行结合,再加入第二抗体,而第二抗体则与杂合体进行结合,因此,通过第二抗体上的标记物与杂合体上相互配合,有助于直接、准确地反应出发光的情况,从而
得知靶标dna的检测结果。在这过程中,所采用的特异性的单链核酸探针、第一抗体、第二抗体均根据该类靶标dna而筛选获得,未添加其他干扰信号、背景信号、非特异性信号,有助于使检测的结果定量更为准确。
73.综上所述,本发明具有以下有益效果:利用本发明所述的试剂盒,能够快速、全面、准确地对18种hpv人乳头状瘤病毒分型进行检测。
74.无需将变性后的样本进行纯化处理,步骤减少,缩短了检测时杂交步骤所需时间,提高了操作的效率。
75.在步骤二中,不对变性后的样本进行靶标dna的提取纯化处理,从而使其中存在的单链dna的数量不受到任何影响,将待测样本中的细菌或者病毒的靶标尽可能保留,即不经过纯化处理的变性后的样本中所含有的所有单链dna均可以被用于检测靶标dna,对后续会产生的检测的信号进行放大,进而使检测的结果更为真实和准确。
76.在检测过程中,没有对靶标dna进行模板扩增,只是单纯采用信号放大的方法,所添加的特异性的单链核酸探针与单链dna结合形成杂合体(dna-rna杂合体),所添加的第一抗体进会与杂合体进行结合,再加入第二抗体,而第二抗体则与杂合体进行结合,因此,通过第二抗体上的标记物与杂合体上相互配合,有助于直接、准确地反应出发光的情况,从而得知靶标dna的检测结果。在这过程中,所采用的特异性的单链核酸探针、第一抗体、第二抗体均根据该类靶标dna而筛选获得,未添加其他干扰信号、背景信号、非特异性信号,有助于使检测的结果定量更为准确。
77.进一步地,跟现有的技术(例如qiagen公司产品hc2)相比,本发明还具有以下优点:1.检测类型全面:qiagen公司产品hc2只能检测13种高危型hpv,并且为一次性检测,无法判断为何种分型;而根据本发明的试剂盒(或方法)能够检测18种高危型hpv:bh2:对18种高危型hpv一次性检测,具体不分型,适合大规模人群体检筛查;bh3:对hpv16/18和其他16种高危型hpv分开进行检测,可以实现风险分层管理,hpv16/18风险比较高,若阳性建议直接转诊阴道镜,其他16种高危型hpv风险较低,若阳性,需结合细胞学或者其他检测结果做进一步打算;bh8:对hpv16、hpv18和其他16种高危型hpv分别进行检测,hpv16和宫颈鳞癌相关性大,hpv18和宫颈腺癌相关性大;2.检测时间缩短:qiagen公司产品hc2的检测时间:1.变性:65℃45分钟;2.杂交:65℃60分钟3.捕获:20-25℃1100rpm振荡60分钟;4.检测:20-25℃30-45分钟;5.化学发光:20-25℃15-30分钟;与此相比,根据本发明的试剂盒(或操作方法):1.变性:65℃30分钟,相比减少15分钟;2.杂交:65℃45分钟,相比减少15分钟;3.捕获:42℃1100rpm振荡60分钟,相比本产品所用包被抗体在42℃条件下反应最佳,一般抗体在高温条件下活性会降低;4.检测:42℃1100rpm振荡30分钟,相比减少0-15分钟,本产品所用的酶标抗体在42℃条件下反应最佳,一般抗体在高温条件下活性会降低;5.化学发光:室温10分钟,相比减少了5-20分钟。因此,总体而言,根据本发明的试剂盒检测时间相比现有技术缩短了将近1小时。
附图说明
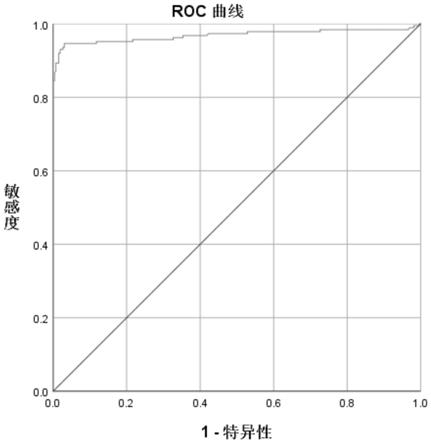
78.图1为根据子宫颈脱落细胞样本的检测结果制作的roc曲线。
具体实施方式
79.前期准备:(一)第一抗体的筛选:当杂合体为dna-rna杂合体时,第一抗体为dna-rna杂合体结构特异性抗体,其筛选包括如下板块:dna-rna杂合体制备:在2ml反应体系中,采用120μg噬菌体φ174的单链dna为模板,300单位dna依赖的rna聚合酶,85mmph为8.0的tris-hcl缓冲液,50mm kcl,10mm dtt,10mm mgcl2,0.8mm的四种ntp(atp,ctp,gtp,utp)在37℃的温度下反应2小时,然后加5m nacl至0.3m,加rnaseⅰ至0.5μg/ml,在37℃的温度下反应30分钟,加等体积的tris-苯酚:氯仿(1:1),涡旋振荡20秒,13000g离心5分钟,上清转移,加入2ml反应体系的2倍体积无水乙醇和1/10体积的3m的醋酸钠(ph5.2),-20℃过夜放置,13000g离心5分钟,并且用20μl纯化水重悬,用od260测试dna-rna杂合体浓度,放于-20℃保存。
80.dna-rna杂合体免疫原制备、免疫:以100μg/ml dna-rna杂合体和100μg/ml甲基化的牛血清白蛋白按质量比1:1在10mm te缓冲液中进行混合,按每只balb/c小鼠30μg dna-rna杂合体的量与弗氏完全佐剂乳化,腹部皮下注射,第14天和第28天分别加强免疫(采用同初次免疫同样的剂量和弗氏不完全佐剂乳化)一次;第35天小鼠尾巴取血进行检测。
81.血清效价检测:用0.1μg/ml的poly(a)-oligo(dt)120在elisa板上进行4℃包被过夜,用明胶进行封闭,在常温下检测小鼠血清效价,效价大于2000的小鼠按每只balb/c小鼠30μg dna-rna杂合体的量进行冲击免疫,3天后取小鼠脾脏。
82.细胞融合以及第一抗体的制备:无菌制备小鼠脾细胞悬液,与小鼠骨髓瘤细胞sp2/0按10:1比例混合,用peg进行融合,用hat培养基筛选7天后换成ht培养基,当孔中有明显可见的细胞团时进行筛选,用和检测血清效价一致的方法进行筛选,筛选出来的阳性孔经3次有限稀释法制备单克隆细胞株,并对其进行扩大培养后进行小鼠腹水制备,用proteina纯化得到第一抗体。
83.第一抗体的验证:验证方法一:用0.1μg/ml的不同的核酸(dna-rna杂合体、双链dna、单链dna、单链rna)重复2孔进行4℃包被过夜,用明胶37℃进行封闭2小时,在常温条件(23
±
2℃)下用不同的抗体浓度(1μg/ml、100ng/ml、10ng/ml、0)反应1个小时,加入1:5000稀释后的hrp标记的羊抗鼠二抗,常温反应1小时,pbs洗板3次后加hrp显色底物tmb,10分钟后加0.5m h2so4进行终止后在酶标仪上进行读数。
84.验证结果:不同的核酸与不同抗体浓度作用后在酶标仪上的读数情况如表1所示。
85.表1不同的核酸与不同抗体浓度作用后在酶标仪上的读数情况由表1中的检测结果可知,第一抗体与dna-rna杂合体之间的结合效果好,但与dna-rna
杂合体以外的其他核酸(双链dna、单链dna、单链rna)基本上没有结合,说明该第一抗体的特异性较好。
86.验证方法二:用不同的抗体反应温度验证抗体对dna-rna杂合体的最佳反应条件,用0.1μg/ml dna-rna杂合体包被,不同浓度(1μg/ml、100ng/ml、10ng/ml、0)的抗体检测,重复2孔检测,用不同的抗体反应温度(25℃、37℃、42℃、45℃、50℃、65℃)进行测试,用不同的抗体反应温度验证第一抗体对dna-rna杂合体的最佳反应条件的结果如表2所示。
87.表2用不同的反应温度验证第一抗体对dna-rna杂合体的最佳反应条件的结果由表2可知,在反应温度为42℃的温度下,获得的数据最佳,表明第一抗体与dna-rna杂合体在42℃的条件下两者之间的包被或结合效果最佳。
88.(二)特异性的单链核酸探针的制备(此处以hpv16 rna探针为例)高危型人乳头状瘤病毒(hpv)是一种长度为8000bp左右的双链dna病毒,是导致宫颈癌的罪魁祸首,目前明确的导致宫颈癌的高危型hpv有18种,具体为hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型。其中和宫颈癌相关性最大的为hpv16型。
89.根据ncbi查询hpv16基因序列,用常规方法合成基因,将其克隆至puc18载体中以质粒形式保存。
90.全长连续的hpv16 rna探针的制备:根据合成的基因序列首尾设计一对引物,其中,上游引物的5’端引入t7启动子序列(taatacgactcactataggg),以hpv16质粒为模板,进行pcr扩增,扩增后的pcr产物即为全长连续的hpv16 rna探针的模板,用t7 rna聚合酶和ntp(atp、ctp、gtp、utp)在37℃的温度条件下反应4小时后加入dnaseⅰ再处理15分钟,纯化得到的即为全长连续的hpv16 rna探针。
91.全长不连续的hpv16 rna探针的制备:将长度为8000bp左右的hpv16做4条长度为2000bp的全长不连续的hpv16 rna探针,根据合成的基因序列每2000bp就设计一对引物,共四对,每对引物的上游引物均引入t7启动子序列(taatacgactcactataggg),以hpv16质粒为模板,进行pcr扩增,扩增后的pcr产物即为全长不连续的hpv16 rna探针的模板,共有四条;每条模板分别与t7 rna聚合酶、ntp(atp、ctp、gtp、utp)在37℃的温度条件下反应4小时后加入dnaseⅰ再处理15分钟,纯化得到的即为全长不连续的hpv16 rna探针。
92.验证过程:将同一浓度(0.5μg/ml)的四条全长不连续的hpv16 rna探针混合,用于对hpv16质粒检测和0.5μg/ml全长连续的hpv16 rna探针对hpv16质粒检测的效果基本没有差异。
93.同时,将hpv16 rna探针分成8段或16段全长不连续的hpv16 rna探针时和全长连续的hpv16 rna探针,所达到的效果基本没有差异。只有当hpv16rna探针的长度小于100bp时,检测信号急剧下降,可能当rna探针长度小于100bp时不能有效形成结构特异性的抗原
决定簇。
94.用不同的hpv16质粒浓度(500pg/ml、50pg/ml、5pg/ml)和0浓度做比值,即为信噪比(s/n)。当s/n大于2,说明hpv16质粒能检测到;当s/n小于2,说明此时的hpv16质粒浓度和0浓度时的差异不大,即hpv16质粒检测不到。
95.hpv16 rna探针长度、hpv16质粒浓度对信噪比(s/n)的影响如表3所示。
96.表3hpv16 rna探针长度、hpv16质粒浓度对信噪比(s/n)的影响由表3可知,在一定hpv16质粒浓度的前提下,当hpv16 rna探针的长度在500bp及以上时,无论是hpv16rna探针为全长连续的hpv16 rna探针(长度为8000bp),还是hpv16rna探针为全长不连续的hpv16 rna探针(长度由4段2000bp组成,或8段1000bp组成,或16段500bp组成),横向比较所测出的信噪比相差不大。
97.因此,对浓度为5-500pg/ml的hpv16质粒进行检测时,hpv16 rna探针与hpv16质粒之间具有非常好的结合效果,而且检测过程中不涉及核酸的提取纯化,也没有涉及到核酸的扩增,即可作为定量检测,并且检测获得的数据更为准确和真实。
98.表4rna探针长度、hpv16质粒浓度对信噪比(s/n)的影响由表4可知,在一定hpv16质粒浓度的前提下,当hpv16 rna探针的长度在100bp及以上时,无论是hpv16rna探针为全长连续的hpv16 rna探针(长度为500bp),还是hpv16rna探针为全长不连续的hpv16 rna探针(长度由4段125bp组成,或5段100bp组成),横向比较所测出的信噪比相差不大;但当全长不连续的hpv16 rna探针(长度由6段83bp组成)时,信噪比与前几种情况相差非常大。
99.快速定量测定多靶标:用与制备全长连续的hpv16 rna探针一样的方法制备全长连续的hpv18 rna探针,用同浓度的hpv16 rna探针(0.5μg/ml)、hpv18 rna探针(0.5μg/ml)、以及hpv16 rna探针(0.5μg/ml)和hpv18 rna探针(0.5μg/ml)混合分别检测不同浓度的hpv16质粒、hpv18质粒、以及hpv16和18质粒的混合物。同浓度的hpv rna探针、不同质粒情况对信噪比的影响如表5所示。
100.表5同浓度的hpv rna探针、不同质粒情况对信噪比的影响
由表5可知,hpv16 rna探针对不同浓度的hpv16质粒的检测具有较好的线性范围,对hpv18质粒无交叉反应;hpv18 rna探针对不同浓度的hpv18质粒的检测具有较好的线性范围,对hpv16质粒无交叉反应;hpv16和18rna混合探针对不同浓度的hvp16、hpv18质粒的检测均具有较好的线性范围,并且对hpv16和18的混合质粒有信号叠加效果。
101.实施例1:一种快速定量检测靶标dna的方法,包括如下步骤:步骤一,变性:将氢氧化钠溶液与子宫颈脱落细胞样本在65℃的条件下反应30min,且氢氧化钠溶液的浓度为1.75mol/l,氢氧化钠溶液与待检测样本的体积比为1:2,将待检测样本的细胞破碎,使蛋白质变性、rna降解,且使dna变性分解为单链dna,获得变性后的样本;步骤二,杂交:将步骤一中获得的变性后的样本与保存在ph值为3.5-4.0的核酸保存液中的hpv16 rna探针(为针对靶标dna的全长单链核酸探针,长度为8000bp)混合,hpv16 rna探针与变性后的样本的体积比为1:3,在ph值为7.0-7.4的范围内、温度为65℃的条件下杂交45min,使hpv16 rna探针与变性后样本中的单链dna进行杂交,形成dna-rna杂合体溶液,其中含有dna-rna杂合体;步骤三,捕获:将采用上述筛选方法获得的第一抗体固定在载体(平板)上,再加入步骤二中获得的dna-rna杂合体溶液,在温度为42℃的条件下,用第一抗体对dna-rna杂合体溶液中的杂合体捕获60min,将液体移除;步骤四,检测:将步骤三中获得的用第一抗体捕获的dna-rna杂合体与保存于蛋白保存液中的第二抗体在42℃进行反应30min后,洗涤,在室温避光条件下静置10min,进行检测,获得信噪比。
102.步骤二中所采用的核酸保存液包括的组分及其用量如表6所示;步骤四中所采用的蛋白保存液包括的组分及其用量如表7所示。
103.表6实施例1的步骤二中所采用的核酸保存液包括的组分及其用量
表7步骤四中所采用的蛋白保存液包括的组分及其用量组分用量柠檬酸三钠5.8g盐酸三乙醇胺9gn,n-双(2-羟乙基)-2-氨基乙磺酸10.71g乙二胺四乙酸二钠0.192g冰乙酸4.4ml聚丙烯酸4.3mlproclin-30028μl实施例2:一种快速定量检测靶标dna的方法与实施例1的区别在于,hpv16 rna探针由4段全长不连续的hpv16 rna探针,且全长不连续的hpv16 rna探针的长度为2000bp。
104.实施例3:一种快速定量检测靶标dna的方法与实施例1的区别在于,hpv16 rna探针由80段全长不连续的hpv16 rna探针,且全长不连续的hpv16 rna探针的长度为100bp。
105.实施例4:一种快速定量检测靶标dna的方法与实施例3的区别在于,hpv16 rna探针由100段全长不连续的hpv16 rna探针,且全长不连续的hpv16 rna探针的长度为80bp。
106.实施例5:一种快速定量检测靶标dna的方法与实施例1的区别在于,步骤四中,hpv16 rna探针上携带修饰物,其中,hpv16 rna探针上有修饰物且修饰物为生物素,且采用亲和素与生物素结合。
107.其中,实施例1-5中的采用的样本均为同一批中的质粒样本,且第一抗体、第二抗体均为dna-rna杂合体结构特异性抗体。
108.试验:靶标dna检测试验根据实施例1-5中的方式进行检测,获得的信噪比记录如表8中所示,并进行分析。
109.表8实施例1-5中获得的信噪比针对10pg/ml hpv16质粒信噪比实施例1100.12实施例299.23实施例398.03实施例450.43实施例510.27由表8可知,实施例1-3获得的信噪比高于实施例4-5中的信噪比,说明采用第一抗体和
第二抗体一同进行相互配合时,获得的信噪比的结果更好。实施例4中,虽然跟实施例1-3相比,全长不连续的hpv16 rna探针的长度低于100bp,虽然检测获得的信噪比的效果没有采用实施例1-3获得的信噪比的效果那么好,但是,依然能够达到检测的目的。
110.实施例5中,之所以信噪比的检测结果会比实施例1-4中的要低,是因为实施例5的检测方法中,未采用第二抗体,而是采用亲和素与生物素结合,相比较第二抗体与杂合体之间的结合点更少,因此,获得的信噪比的数值较低。
111.对比实施例4和实施例5,是否采用亲和素和生物素进行相互配合,跟是否采用长度为100bp以上的hpv16 rna探针进行检测相比,会对检测的灵敏性产生更大的影响。
112.因此,采用本申请中的方法进行靶标dna检测时,可达到更灵敏、更快速的检测效果。
113.实施例6人乳头状瘤病毒(18型)核酸检测试剂盒及操作方法该试剂盒用于体外定性检测子宫颈脱落细胞样本中的18种(hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)核酸。样本中的人乳头状瘤病毒双链dna变性分解成单链,单链dna与特异性全长rna探针结合为dna-rna杂合体,dna-rna杂合体与捕获板上的特异性抗体结合固定在捕获板上,再与偶联有碱性磷酸酶的抗dna-rna杂合体的特异性抗体结合,酶促化学发光,定性检测样本中的人乳头状瘤病毒核酸。
114.根据ncbi查询18种高危型hpv(分别为16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73和82型)基因序列,18种高危型hpv的ncbi序列号分别为:hpv16为k02718.1,hpv18为x05015.1,hpv26为x74472.1,hpv31为hq537666.1,hpv33为m12732.1,hpv35为x74477.1,hpv39为m62849.1,hpv45为x74479.1,hpv51为m62877.1,hpv52为x74481.1,hpv53为x74482.1,hpv56为x74483.1,hpv58为d90400.1,hpv59为x77858.1,hpv66为u31794.1,hpv68为fr751039.1,hpv73为x94165.1,hpv82为ab027021.1,用常规方法合成基因,将其克隆至puc18载体中以质粒形式保存。
115.探针的制备:根据合成的hpv基因序列首尾设计一对引物,其中,上游引物的5’端引入t7启动子序列(taatacgactcactataggg),以hpv质粒为模板,进行pcr扩增,扩增后的pcr产物即为探针的模板,用t7 rna聚合酶和ntp(atp、ctp、gtp、utp)在37℃的温度条件下反应4小时后加入dnaseⅰ再处理15分钟,纯化得到探针。
116.表9实施例6的试剂盒的主要组成成分
化学发光免疫分析仪,型号及厂家:tzd-cl-200s,厦门天中达生物科技有限公司。
117.以常规方法采集子宫颈脱落细胞样本,然后在室温(18-25℃)条件下保存2周;样本在2-8℃条件下保存1个月;样本在-20
±
5℃条件下保存12个月,冻融次数不超过5次。
118.操作方法1.准备1.1所有样本及试剂需恢复至室温(18-25℃)后操作。
119.1.2提前开启水浴锅,达到65℃后运行至少15分钟,水位高于样本液位。
120.1.3提前开启微孔板加热振荡器,达到65℃后运行至少15分钟。
121.1.4阴性对照品(nc)、阳性对照品(pc)要做三个重复检测,检测的样本做单个检测。
122.2.变性2.1对照品及各样本中加入一半体积的变性试剂,如1ml阳性对照品中加入0.5ml变性试剂,拧紧后充分混匀,各管应呈蓝色。
123.2.2上述各管放至65℃水浴中孵育30分钟。
124.注意:
①
变性试剂具有腐蚀性,操作时做好防护工作。
125.②
加入变性试剂后应呈蓝色,有些样本含有血或其它物质,可能对添加变性试剂后的颜色变化有掩盖作用,在这种情况下,没有呈现预期的颜色变化不会影响此方法的检测结果。
126.3.杂交3.1自备一块96孔微孔板作为杂交板,在其中加入探针试剂(25μl/孔),。
127.3.2从水浴中取出变性后的对照品和样本,恢复至室温。
128.3.3各管取75μl转移至相应的杂交板;3.4用板盖封住杂交板,将杂交板放在微孔板加热振荡器上,在65℃条件下1100rpm振荡45分钟,各孔应呈淡黄色。
129.4.捕获4.1从微孔板加热振荡器上取出杂交板,将微孔板加热振荡器设置成42℃。
130.4.2从铝箔袋中取出捕获板。
131.4.3将杂交板中的液体(约100μl/孔)完全转移至捕获板对应的孔中。
132.4.4用板盖封住捕获板,放至42℃的微孔板加热振荡器上,在1100rpm振荡60分钟。
133.5.检测5.1将捕获板中的液体(约100μl/孔)移除,拍干。
134.5.2捕获板中加入检测试剂(75μl/孔),每孔应呈粉红色。
135.5.3用板盖封住捕获板,放至42℃的微孔板加热振荡器上,在1100rpm振荡30分钟。
136.6.化学发光6.1将捕获板中的检测试剂(约75μl/孔)移除。
137.6.2用1
×
洗涤液清洗捕获板6次,拍干。
138.6.3捕获板中加入底物试剂(75μl/孔)。
139.6.4室温避光孵育10分钟,在化学发光免疫分析仪上读数。
140.阳性判断值对450例子宫颈脱落细胞样本进行检测,作roc曲线(见图1,其中对角段由绑定值生成)得最佳诊断分界点为1pg/ml高危型人乳头状瘤病毒(hpv)核酸。
141.检测有效性的判定是用来判断试剂以及操作是否有效,能否精确的给定检测参考值,每次检测都必须进行检测有效性的判定。
142.检测有效性的判定标准:(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
143.(2)阳性对照品(pc):阳性对照品重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品b均值;否则就无效,必须重做。
144.(3)阳性对照品均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
145.(4)满足上述的标准,检测有效,阳性对照品均值为此次检测的参考值。
146.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
147.结果说明1.本实施例测限是1pg/ml(5000拷贝/反应)高危型人乳头状瘤病毒(hpv)核酸。
148.2.捕获板为“阳性”,说明样本中含有18种(hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒中的一种或几种。
149.3.捕获板检测结果为“阴性”,说明样本中不含有18种(hpv16、18、26、31、33、35、
39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)或含量低于检测限。
150.实施例7人乳头状瘤病毒(hpv16/18+其他16型)核酸检测试剂盒及操作方法该试剂盒用于体外定性检测子宫颈脱落细胞样本中的2种(hpv16、hpv18)和其他16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)核酸。样本中的人乳头状瘤病毒双链dna变性分解成单链,单链dna与特异性全长rna探针结合为dna-rna杂合体,dna-rna杂合体与捕获板上的特异性抗体结合固定在捕获板上,再与偶联有碱性磷酸酶的抗dna-rna杂合体的特异性抗体结合,酶促化学发光,定性检测样本中的人乳头状瘤病毒核酸。
151.表10实施例7的试剂盒的主要组成成分化学发光免疫分析仪,型号及厂家:tzd-cl-200s,厦门天中达生物科技有限公司。
152.以常规方法采集子宫颈脱落细胞样本,然后在室温(18-25℃)条件下保存2周;样本在2-8℃条件下保存1个月;样本在-20
±
5℃条件下保存12个月,冻融次数不超过5次。
153.操作方法1.准备1.1所有样本及试剂需恢复至室温(18-25℃)后操作。
154.1.2提前开启水浴锅,达到65℃后运行至少15分钟,水位高于样本液位。
155.1.3提前开启微孔板加热振荡器,达到65℃后运行至少15分钟。
156.1.4阴性对照品(nc)、阳性对照品a(pc-a)和阳性对照品b(pc-b)要做三个重复检测,检测的样本做单个检测。
157.2.变性2.1对照品及各样本中加入一半体积的变性试剂,如1ml阳性对照品b中加入0.5ml变性试剂,拧紧后充分混匀,各管应呈蓝色。
158.2.2上述各管放至65℃水浴中孵育30分钟。
159.注意:
①
变性试剂具有腐蚀性,操作时做好防护工作。
160.②
加入变性试剂后应呈蓝色,有些样本含有血或其它物质,可能对添加变性试剂后的颜色变化有掩盖作用,在这种情况下,没有呈现预期的颜色变化不会影响此方法的检测结果。
161.3.杂交3.1自备二块96孔微孔板,并做好标记,如“杂交板a”、“杂交板b”。在杂交板a中加入探针试剂a(25μl/孔),在杂交板b中加入探针试剂b(25μl/孔)。
162.3.2从水浴中取出变性后的对照品和样本,恢复至室温。
163.3.3各管取75μl转移至相应的杂交板;3.4用板盖封住杂交板a和杂交板b,将杂交板a和杂交板b放在微孔板加热振荡器上,在65℃条件下1100rpm振荡45分钟,各孔应呈淡黄色。
164.4.捕获4.1从微孔板加热振荡器上取出杂交板a和杂交板b,将微孔板加热振荡器设置成42℃。
165.4.2从铝箔袋中取出捕获板,并做好标记,如“捕获板a”、“捕获板b”。
166.4.3将杂交板a中的液体(约100μl/孔)完全转移至捕获板a对应的孔中,将杂交板b中的液体(约100μl/孔)完全转移至捕获板b对应的孔中。
167.4.4用板盖封住捕获板a和捕获板b,放至42℃的微孔板加热振荡器上,在1100rpm振荡60分钟。
168.5.检测5.1将捕获板a和捕获板b中的液体(约100μl/孔)移除,拍干。
169.5.2捕获板a和捕获板b中加入检测试剂(75μl/孔),每孔应呈粉红色。
170.5.3用板盖封住捕获板a和捕获板b,放至42℃的微孔板加热振荡器上,在1100rpm振荡30分钟。
171.6.化学发光6.1将捕获板a和捕获板b中的检测试剂(约75μl/孔)移除。
172.6.2用1
×
洗涤液清洗捕获板a和捕获板b各6次,拍干。
173.6.3捕获板a和捕获板b中加入底物试剂(75μl/孔)。
174.6.4室温避光孵育10分钟,在化学发光免疫分析仪上读数。
175.阳性判断值对450例子宫颈脱落细胞样本进行检测,作roc曲线得最佳诊断分界点为1pg/ml高危型人乳头状瘤病毒(hpv)核酸。
176.检测有效性的判定是用来判断试剂以及操作是否有效,能否精确的给定检测参考
值,每次检测都必须进行检测有效性的判定。
177.检测有效性的判定标准:捕获板a(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
178.(2)阳性对照品a(pc-a):阳性对照品a重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品a均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品a的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品a均值;否则就无效,必须重做。
179.(3)阳性对照品a均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
180.(4)满足上述的标准,检测有效,阳性对照品a均值为此次检测的参考值。
181.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
182.捕获板b(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
183.(2)阳性对照品b(pc-b):阳性对照品b重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品b均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品b的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品b均值;否则就无效,必须重做。
184.(3)阳性对照品b均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
185.(4)满足上述的标准,检测有效,阳性对照品b均值为此次检测的参考值。
186.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
187.结果说明1.本实施例测限是1pg/ml(5000拷贝/反应)高危型人乳头状瘤病毒(hpv)核酸。
188.2.本实施例分别检测hpv 16/18和其它16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)核酸。
189.3.捕获板a和捕获板b检测结果均为“阳性”,说明样本中既含有的种(hpv16和hpv18)高危型人乳头状瘤病毒(hpv)核酸中的一种或两种,也含有16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒中的一种或几种。
190.4.捕获板a检测结果为“阳性”,捕获板b检测结果为“阴性”,说明样本中含有2种(hpv16和hpv18)高危型人乳头状瘤病毒(hpv)核酸中的一种或两种。
191.5.捕获板a检测结果为“阴性”,捕获板b检测结果为“阳性”,说明样本中含有16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒中
的一种或几种。
192.6.捕获板a和捕获板b检测结果均为“阴性”,说明样本中不含有18种(hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)或含量低于检测限。
193.实施例8人乳头状瘤病毒(hpv16+hpv18+其他16型)核酸检测试剂盒及操作方法该试剂盒用于体外定性检测子宫颈脱落细胞样本中的hpv16、hpv18和其他16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)核酸。样本中的人乳头状瘤病毒双链dna变性分解成单链,单链dna与特异性全长rna探针结合为dna-rna杂合体,dna-rna杂合体与捕获板上的特异性抗体结合固定在捕获板上,再与偶联有碱性磷酸酶的抗dna-rna杂合体的特异性抗体结合,酶促化学发光,定性检测样本中的人乳头状瘤病毒核酸。
194.表11实施例8的试剂盒的主要组成成分化学发光免疫分析仪,型号及厂家:tzd-cl-200s,厦门天中达生物科技有限公司。
195.以常规方法采集子宫颈脱落细胞样本,然后在室温(18-25℃)条件下保存2周;样
本在2-8℃条件下保存1个月;样本在-20
±
5℃条件下保存12个月,冻融次数不超过5次。
196.操作方法1.准备1.1所有样本及试剂需恢复至室温(18-25℃)后操作。
197.1.2提前开启水浴锅,达到65℃后运行至少15分钟,水位高于样本液位。
198.1.3提前开启微孔板加热振荡器,达到65℃后运行至少15分钟。
199.1.4阴性对照品(nc)、阳性对照品16(pc-16)、阳性对照品18(pc-18)和阳性对照品b(pc-b)要做三个重复检测,检测的样本做单个检测。
200.2.变性2.1对照品及各样本中加入一半体积的变性试剂,如1ml阳性对照品b中加入0.5ml变性试剂,拧紧后充分混匀,各管应呈蓝色。
201.2.2上述各管放至65℃水浴中孵育30分钟。
202.注意:
①
变性试剂具有腐蚀性,操作时做好防护工作。
203.②
加入变性试剂后应呈蓝色,有些样本含有血或其它物质,可能对添加变性试剂后的颜色变化有掩盖作用,在这种情况下,没有呈现预期的颜色变化不会影响此方法的检测结果。
204.3.杂交3.1自备三块96孔微孔板,并做好标记,如“杂交板16”、“杂交板18”、“杂交板b”。在杂交板16中加入探针试剂16(25μl/孔),在杂交板18中加入探针试剂18(25μl/孔),在杂交板b中加入探针试剂b(25μl/孔)。
205.3.2从水浴中取出变性后的对照品和样本,恢复至室温。
206.3.3各管取75μl转移至相应的杂交板;3.4用板盖封住杂交板16、杂交板18和杂交板b,将杂交板16、杂交板18和杂交板b放在微孔板加热振荡器上,在65℃条件下1100rpm振荡45分钟,各孔应呈淡黄色。
207.4.捕获4.1从微孔板加热振荡器上取出杂交板16、杂交板18和杂交板b,将微孔板加热振荡器设置成42℃。
208.4.2从铝箔袋中取出捕获板,并做好标记,如“捕获板16”、“捕获板18”、“捕获板b”。
209.4.3将杂交板16中的液体(约100μl/孔)完全转移至捕获板16对应的孔中,将杂交板18中的液体(约100μl/孔)完全转移至捕获板18对应的孔中,将杂交板b中的液体(约100μl/孔)完全转移至捕获板b对应的孔中。
210.4.4用板盖封住捕获板16、捕获板18和捕获板b,放至42℃的微孔板加热振荡器上,在1100rpm振荡60分钟。
211.5.检测5.1将捕获板16、捕获板18和捕获板b中的液体(约100μl/孔)移除,拍干。
212.5.2捕获板16、捕获板18和捕获板b中加入检测试剂(75μl/孔),每孔应呈粉红色。
213.5.3用板盖封住捕获板16、捕获板18和捕获板b,放至42℃的微孔板加热振荡器上,在1100rpm振荡30分钟。
214.6.化学发光
6.1将捕获板16、捕获板18和捕获板b中的检测试剂(约75μl/孔)移除。
215.6.2用1
×
洗涤液清洗捕获板16、捕获板18和捕获板b各6次,拍干。
216.6.3捕获板16、捕获板18和捕获板b中加入底物试剂(75μl/孔)。
217.6.4室温避光孵育10分钟,在化学发光免疫分析仪上读数。
218.阳性判断值对450例子宫颈脱落细胞样本进行检测,作roc曲线得最佳诊断分界点为1pg/ml高危型人乳头状瘤病毒(hpv)核酸。
219.检测有效性的判定是用来判断试剂以及操作是否有效,能否精确的给定检测参考值,每次检测都必须进行检测有效性的判定。
220.检测有效性的判定标准:捕获板16(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
221.(2)阳性对照品16(pc-16):阳性对照品16重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品16均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品16的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品16均值;否则就无效,必须重做。
222.(3)阳性对照品16均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
223.(4)满足上述的标准,检测有效,阳性对照品16均值为此次检测的参考值。
224.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
225.捕获板18(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
226.(2)阳性对照品18(pc-18):阳性对照品18重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品18均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品18的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品18均值;否则就无效,必须重做。
227.(3)阳性对照品18均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
228.(4)满足上述的标准,检测有效,阳性对照品18均值为此次检测的参考值。
229.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
230.捕获板b(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若
cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
231.(2)阳性对照品b(pc-b):阳性对照品b重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品b均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品b的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品b均值;否则就无效,必须重做。
232.(3)阳性对照品b均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效,必须重做。
233.(4)满足上述的标准,检测有效,阳性对照品b均值为此次检测的参考值。
234.(5)所有的检测都以样本测量值/参考值的比值表示,比值≥1.0,结果为“阳性”;比值<1.0,结果为“阴性”。
235.结果说明1.本实施例测限是1pg/ml(5000拷贝/反应)高危型人乳头状瘤病毒(hpv)核酸。
236.2.捕获板16为“阳性”,说明样本中含有hpv16;捕获板18为“阳性”,说明样本中含有hpv18;捕获板b检测结果为“阳性”,说明样本中含有16种(hpv26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒中的一种或几种。
237.3.捕获板16、捕获板18和捕获板b检测结果均为“阴性”,说明样本中不含有18种(hpv16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型)高危型人乳头状瘤病毒(hpv)或含量低于检测限。
238.4.分析特异性:a)交叉反应:非试剂盒检测范围内的其他型别hpv dna(hpv6、11、40、42、43、44、54、61、67、69、70、71、72、81、83)、试剂盒检测范围内的hpv dna(hpv18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82),浓度在200pg/ml;可在人类泌尿、生殖道寄生微生物或经性传播的病原体如淋球菌、白色念珠菌、沙眼衣原体、解脲支原体、hsv ii、人型支原体、阴道毛滴虫、巨细胞病毒、梅毒螺旋体,捕获板16检测结果为阴性,与试剂盒中捕获板16无交叉反应;非试剂盒检测范围内的其他型别hpv dna(hpv6、11、40、42、43、44、54、61、67、69、70、71、72、81、83)、试剂盒检测范围内的hpv dna(hpv16、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82),浓度在200pg/ml;可在人类泌尿、生殖道寄生微生物或经性传播的病原体如淋球菌、白色念珠菌、沙眼衣原体、解脲支原体、hsv ii、人型支原体、阴道毛滴虫、巨细胞病毒、梅毒螺旋体,捕获板18检测结果为阴性,与试剂盒中捕获板18无交叉反应;非试剂盒检测范围内的其他型别hpv dna(hpv6、11、40、42、43、44、54、61、67、69、70、71、72、81、83)、试剂盒检测范围内的hpv dna(hpv16、18),浓度在200pg/ml;可在人类泌尿、生殖道寄生微生物或经性传播的病原体如淋球菌、白色念珠菌、沙眼衣原体、解脲支原体、hsv ii、人型支原体、阴道毛滴虫、巨细胞病毒、梅毒螺旋体,捕获板b检测结果为阴性,与试剂盒中捕获板b无交叉反应。b)干扰因素:干扰物质(血液、宫颈粘液、人体润滑剂、洁尔阴洗液、硝酸咪康唑乳膏、硝呋太尔制霉素)对试剂盒检测无影响。
239.实施例10试剂盒有效期测试将试生产的试剂盒检测(0个月)合格后,放置在试剂盒所需的2-8℃储存条件下,在3、6、9、12、15、16个月时按照说明书操作标准进行检测。
240.检测有效性判定标准如下:(1)阴性对照品(nc):阴性对照品重复3孔,如果cv≤25%,则有效,计算3孔阴性对照品
均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阴性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阴性对照品均值;否则就无效,必须重做。
241.(2)阳性对照品(pc):阳性对照品重复3孔,如果cv≤25%,则有效,计算3孔阳性对照品均值;如果cv>25%,那么舍弃离均值最远的测量值,计算剩下的2孔阳性对照品的cv值,若cv≤25%,则仍然有效,计算剩下的2孔阳性对照品均值;否则就无效,必须重做。
242.(3)阳性对照品均值/阴性对照品均值≥2.0时,此次检测有效;如果比值<2.0,则检测无效。
243.具体检测数据如下表12:表12信噪比随储存时间的变化试剂盒在2-8℃储存时间pc和nc的信噪比(s/n)0个月8.163个月7.496个月6.339个月5.1812个月4.3715个月3.4116个月3.01在2-8℃条件下放置16个月后,pc和nc的信噪比(s/n)仍然能大于2,说明试剂盒仍然有效,其有效期可达到15个月,而qiagen有效期只有12个月。
244.另外,还对振荡条件进行了测试,结果见下表13和14。
245.表13 1100rpm振荡条件下不同反应温度的对比从表13可见,在42℃下进行振荡培养,在1pg/ml、10pg/ml和100pg/ml的检测限下均获得了最高的信噪比,即检测结果最为明显。
246.表14在42℃反应条件下1100rpm振荡和不振荡的对比
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1