siRNA定向自组装量子点生物传感器及其检测方法和应用与流程
本发明属于分子检测技术领域,具体涉及sirna定向自组装量子点生物传感器及其检测方法和应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
microrna是在进化上保守的非编码rna,它长度短(一般22个核苷酸左右)。作为至关重要的转录后调节剂,microrna可以通过信使rna(mrna)分解或翻译抑制来有效抑制靶基因的表达。大量证据表明,microrna在多种生物学过程(例如细胞分化,凋亡,增殖和免疫应答)中起重要作用。microrna异常表达可能不可避免地干扰正常基因的调控网络从而导致多种疾病的产生,其中包括癌症。外周血中循环的microrna已成为非侵入性疾病诊断的潜在生物标志物。特别是,多种microrna可以共同调节单个基因的表达,而单一类型的疾病可能与多种不同microrna的失调有关。因此,同时检测多种microrna对生物医学研究和临床实践应用具有重要的意义。
microrna微阵列芯片,定量逆转录聚合酶链反应(quantitativereversetranscription-polymerasechainreaction,qrt-pcr)和等温核酸扩增是用于microrna分析的最流行方法。然而,对直接标记microrna分子的需要,多种dna探针、酶和繁琐费力的程序的可能会大大增加测定成本和复杂性。此外,有机染料在microrna分析中经常用作信号报告基因,但它们的光稳定性差、量子产率低、吸收窄、斯托克斯位移较小,这不可避免地会损害测定的准确性、可重复性和多路复用能力。大多数基于量子点的生物传感器仍需要有机染料来实现目标检测的荧光共振能量转移分析方法,并不能排除有机染料的局限性。基于量子点的时间门控方法用于microrna分析,但它需要仔细优化铽(tb)和量子点标记的探针的长度和方向。核酸扩增方法虽然可以大大提高microrna分析的灵敏度,但是不同酶和特殊模板/引物的参与不可避免地增加了分析成本,并倾向于诱导非特异性扩增导致的假阳性。
技术实现要素:
针对现有技术的不足,本发明提供一种sirna定向自组装量子点生物传感器及其检测方法和应用。本发明通过量子点探针与靶标特异性结合形成sirna,p19sirna结合蛋白(p19)高亲和力特异性结合sirna,从而形成qds-sirnas-p19-mmp生物缀合物,实现了sirna指导的量子点生物共轭自组装用于单颗粒水平上同时检测多种microrna。在此分析中,将试剂(即量子点探针,p19和几丁质功能化的磁珠)与目标microrna一步混合即可诱导qds-sirnas-p19-mmp生物缀合物的组装,从而实现同时编码,富集和分离单个样品中的多种microrna,因此具有良好的实际应用之价值。
为实现上述技术目的,本发明采用的技术方案如下:
本发明的第一个方面,提供sirna定向自组装量子点生物传感器,所述生物传感器包括:量子点探针,p19和几丁质功能化磁珠。
其中,所述量子点探针由量子点和检测探针偶联获得;
具体的,所述量子点探针通过量子点表面修饰的链霉素亲和素和检测探针末端修饰的生物素的偶联作用构建获得。
所述检测探针为由含有与待测microrna发生碱基互补配对的核苷酸构成;
所述量子点包括但不限于605qd和655qd。
所述p19为p19sirna结合蛋白,其n末端带有mbp麦芽糖结合蛋白,c末端带有几丁质结合蛋白(chitin-bindingdomain,cbd),该蛋白与sirna具有纳摩尔级的亲和力,可通过市售获得。
所述几丁质功能化磁珠(magneticmicroparticle,mmp)可通过市售获得,其为一种亲和介质,能分离纯化与几丁质结合域(cbd,chitinbindingdomain)融合的目的蛋白。且由于该磁珠有一个磁力核心,因此可以从细胞培养上清液中磁力分离与cbd融合的蛋白。
在本发明中,所述几丁质功能化磁珠使用前经过预处理以减少非特异性结合,所述预处理方法为向几丁质功能化磁珠中加入预处理缓冲液,所述预处理缓冲液包括bsa;具体的,所述预处理缓冲液由氯化钠、edta、tcep、bsa和三羟基氨甲烷-盐酸组成。
当待测microrna为mir-155和mir-21时,
量子点探针包括:量子点605qd和能与mir-155发生碱基互补配对的检测探针偶联获得;以及,量子点655qd和能与mir-21发生碱基互补配对的检测探针偶联获得。
所述生物传感器还包括p19变性剂,所述p19变性剂为十二烷基硫酸钠。
本发明的第二个方面,提供上述sirna定向自组装量子点生物传感器在检测一种或多种microrna中的应用。
本发明的第三个方面,提供一种检测microrna的方法,所述方法包括:
采用一步混合法将量子点探针,p19和几丁质功能化的磁珠与待测microrna样品混合,诱导qds-sirnas-p19-mmp生物缀合物的组装,从而实现同时编码,富集和分离单个样品中的microrna。
其中,所述microrna包括但不限于mir-155和mir-21。
本发明的第四个方面,提供上述sirna定向自组装量子点生物传感器和/或检测方法在microrna生物医学研究和非侵入性临床诊断中的应用。
所述非侵入性临床诊断包括临床血清中与肺癌相关的循环microrna的检测与诊断。
本发明的有益技术效果:
1.操作简单:相比其他采用核酸扩增检测microrna的方法,本发明无需引入多种酶而即可完成microrna的高灵敏检测,这不仅避免了非特异性的dna背景扩增,同时也降低了分析成本,简化了分析过程;此外,由于具有高亲和高特异性的p19的使用,因此本技术方案的检测准确性也得到了保证。值得注意的是,基于有机染料的单分子检测方法,其需要使用不同的激发光来分别激发不同的荧光分子,但是量子点的宽激发和窄发射使该测定方法能够以单激发、双发射的方式进行,从而简化仪器设置和实验程序。
2.效率高,效果好:本发明反应时间短,检测效率高;单分子检测方法的引入也大大降低了数据处理难度,提高了数据呈现的直观性和数据处理效率,实现了对microrna的高效简单测定。
3.灵敏度高,同时检测多种microrna:本技术方案中,由于量子点对靶标microrna的有效编码将microrna信号转换为不同的量子点信号;引入了磁分离,背景信号极低;以及单分子检测技术固有的高信噪比。因此检测限低至飞摩尔,优于多数现有传统的microrna检测方法;此外,本技术方案还能实现对多种microrna进行检测,并能很好地对复杂的实际样品(癌症病人的血清)内microrna的灵敏测定,应用范围广泛,研究潜力较大。
4.特异性好:由于本发明所使用的p19具有高亲和力和高特异性识别能力,使得本技术方案具有较高的检测特异性;此外,对本技术方案中的各项反应条件也做了细致的优化,因此检测特异性较为出色,因此本发明具有良好的实际应用之价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
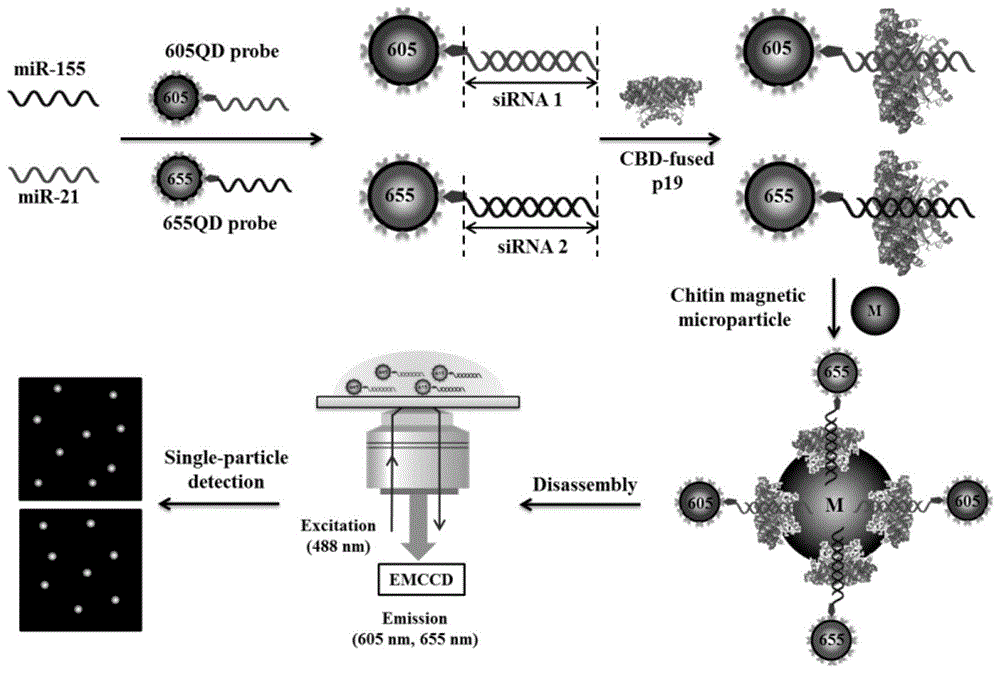
图1:量子点生物共轭自组装用于多重用于microrna分析的示意图。
图2:p19对两种qd-sirna结合的凝胶迁移率迁移分析相关图。其中,a为p19与605qd-sirna1结合的凝胶迁移率迁移分析图。1至4道:605qd探针;p19+mir-155+605qd探针;p19+605qd探头;mir-155+605qd探针。b为对p19与655qd-sirna的结合的凝胶迁移率迁移分析图。泳道1至4:655qd探针;p19+mir-21+655qd探针;p19+655qd探头;mir-21+655qd探针。
图3:量子点探针组装到磁珠表面以及从磁珠表明拆卸相关图,其中,a,b,e和f表明将量子点探针组装到磁珠表面,c,d,g和h表明从磁珠表面拆卸量子点探针。比例尺在a,b,e和f中为100微米,比例尺在c,d,g和h中为10微米。
图4:同时检测单颗粒水平的mir-155和mir-21相关图。其中,a、e分别为不存在mir-155、mir-21时605qd和655qd的荧光信号图,b、f分别为存在mir-155,不存在mir-21时605qd和655qd的荧光信号图,c、g分别为存在不存在mir-155,存在mir-21时605qd和655qd的荧光信号图,d、h分别为存在mir-155、mir-21时605qd和655qd的荧光信号图;比例尺为5微米。
图5:量子点计数与mirna浓度的校准曲线图,其中,a为605qd计数与mir-155浓度的校准曲线;b为655qd计数与mir-21浓度的校准曲线。
图6:sirna定向自组装量子点生物传感器特异性检测相关图,其中,a为mir-155,m-mir-155(单碱基突变变体mir-155),mir-21和m-mir-21(单碱基突变变体mir-21)的序列图;b为响应m-mir-155,m-mir-21,mir-155,mir-21,mir-155和mir-21并存的605qd和655qd计数,对照组没有任何靶标microrna。每个microrna的浓度为50皮摩尔/升;c为p19与605qd标记的sirna1结合的凝胶迁移率分析。泳道1:mir-155+605qd探针,泳道2:m-mir-155+605qd探针,泳道3:mir-155+p19+605qd探针,泳道4:m-mir-155+p19+605qd探针;d为p19与655qd标记的sirna结合的凝胶迁移率分析。泳道1:mir-21+655qd探针,泳道2:m-mir-21+655qd探针,泳道3:mir-21+p19+655qd探针,泳道4:m-mir-21+p19+655qd探针。
图7:同时检测正常人和非小细胞肺癌患者血清中的循环mirna相关图,其中,a为mir-155,b为mir-21。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
如前所述,目前对microrna的检测分析方法存在费时费力、程序复杂,检测准确度及灵敏度不佳等问题。
有鉴于此,本发明的一个具体实施方式中,提供sirna定向自组装量子点生物传感器,所述生物传感器包括:量子点探针,p19和几丁质功能化磁珠。
本发明的又一具体实施方式中,所述量子点探针由量子点和检测探针偶联获得;
其中,所述量子点探针由量子点和检测探针偶联获得;具体的,所述量子点探针通过量子点表面修饰的链霉素亲和素和检测探针末端修饰的生物素的偶联作用构建获得。
所述检测探针为由含有与待测microrna能够发生碱基互补配对的核苷酸构成;
所述量子点包括但不限于605qd和655qd。
所述p19为p19sirna结合蛋白,其c末端带有cbd(几丁质结合蛋白),该蛋白与sirna具有高亲和力(kd=1.7×10-10m),可通过市售获得。此外,p19与sirna的结合具有序列独立性,因此p19可以同时识别多种microrna,而无需复杂的检测探针设计和优化。
所述几丁质功能化磁珠可通过市售获得,其为一种亲和介质,能少量分离纯化与cbd(chitinbindingdomain)融合的目的蛋白。且由于该磁珠有一个磁力核心,因此可以从细胞培养上清液中磁力分离与cbd融合的蛋白。
本发明的又一具体实施方式中,所述几丁质功能化磁珠使用前经过预处理以减少非特异性结合,所述预处理方法为向几丁质功能化磁珠中加入预处理缓冲液,所述预处理缓冲液包括bsa。
本发明的又一具体实施方式中,所述预处理缓冲液由氯化钠、edta、tcep、bsa和三羟基氨甲烷-盐酸组成。
本发明的又一具体实施方式中,所述预处理方法为:
将几丁质功能化的磁珠悬浮液转移至无菌微量离心管中,并使用磁力架将磁珠拉至管的侧面以去除上清液。
将几丁质功能化的磁珠预处理缓冲液(100毫摩尔/升氯化钠,1毫摩尔/升edta,1毫摩尔/升tcep,1毫克/毫升bsa,20毫摩尔/升三羟基氨甲烷-盐酸,ph7.0)添加到试管中,剧烈搅拌悬浮液,并除去上清液。
加入新鲜的磁珠预处理缓冲液,并将试管进行旋转处理。
所述旋转处理条件为:低温(4℃)旋转处理3~5小时(优选为4小时)。
本发明的又一具体实施方式中,当待测sirna为mir-155和mir-21时,
量子点探针包括:量子点605qd和第一检测探针,所述第一检测探针为与mir-155发生碱基互补配对的核苷酸;以及,量子点655qd和第二检测探针,所述第二检测探针为与mir-21发生碱基互补配对的核苷酸。
本发明的又一具体实施方式中,
所述第一检测探针的序列为:5'-po4-cccuaucacgauuagcauuaauu-biotin-3'(seqidno.1)。
所述第二检测探针的序列为:5'-po4-uuaucgaauagucugacuacaa-biotin-3'(seqidno.2)。
其中,po4表示磷酰基,biotin表示生物素。
所述生物传感器还包括p19变性剂,所述变性剂为十二烷基硫酸钠(sodiumdodecylsulfate,sds)。通过使用十二烷基硫酸钠使p19变性后,量子点探针从磁珠表面被拆卸下来。可以通过单颗粒计数同时检测游离的量子点。
本发明的又一具体实施方式中,提供上述sirna定向自组装量子点生物传感器在同时检测一种或多种microrna中的应用。
本发明的又一具体实施方式中,提供一种检测microrna的方法,所述方法包括:
采用一步混合法将量子点探针,p19和几丁质功能化的磁珠与待测microrna混合,诱导qds-sirnas-p19-mmp生物缀合物的组装,从而实现同时编码,富集和分离单个样品中的microrna。
本发明的又一具体实施方式中,所述检测方法还包括加入p19变性剂,使得量子点探针从磁珠表明被拆卸下来,采用全内反射荧光成像技术测定单个量子点的荧光信号,从而实现对microrna的定量检测。
其中,所述p19变性剂为十二烷基硫酸钠。
所述microrna包括但不限于mir-155和mir-21。
本发明的又一具体实施方式中,提供上述sirna定向自组装量子点生物传感器和/或检测方法在microrna生物医学研究和非侵入性临床诊断中的应用。
本发明的又一具体实施方式中,所述非侵入性临床诊断包括临床血清中与肺癌相关的循环microrna的检测与诊断。
本发明通过量子点探针与靶标特异性结合形成sirna,p19高亲和力特异性结合sirna,从而形成qds-sirnas-p19-mmp生物缀合物,实现了sirna指导的量子点生物共轭自组装用于单颗粒水平上同时检测多种microrna。在此分析中,将试剂(即量子点探针,p19和几丁质功能化的磁珠)与目标microrna一步混合即可诱导qds-sirnas-p19-mmp生物缀合物的组装,从而实现同时编码,富集和分离单个样品中的多种microrna。
量子点具有高光稳定性、高量子产率、宽吸收光谱、窄尺寸可调谐发射光谱和大斯托克斯位移等优良的光物理性质,是一种很有吸引力的生物传感器构件。此外,引入单分子检测构建的基于单量子点的分析方法具有分析时间短、信噪比高、样品消耗量低、灵敏度高等优良的分析性能。在这里,本发明提供了sirna定向自组装量子点生物共轭物,其可在单颗粒水平上同时检测多种microrna。缀合构建光谱上可区分的两种量子点探针,其中605qd探针与mir-155互补,655qd探针与mir-21互补,分别形成605qd-sirna1和655qd-sirna2。这两个qds-sirna可以通过静电识别同时与p19结合,从而促进它们在磁珠表面上的组装,形成qds-sirnas-p19-mmp生物缀合物。这些生物缀合物能够同时编码、富集和从复杂的生物样品中分离出多种microrna。可以通过单颗粒计数同时检测游离的量子点。该测定仅需要量子点作为信号报告基团,并且可以通过自组装过程完成,无需任何化学/酶反应,从而可以从单个样品中同时检测多种microrna。借助单分子检测技术,该方法可实现单分子选择性的飞摩尔灵敏度,并可进一步用于临床血清中与肺癌相关的循环microrna的检测,在生物医学研究和非侵入性临床诊断中具有巨大的潜力。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。需要说明的是,在实施例1中,605qd探针核苷酸序列为:5'-po4-cccuaucacgauuagcauuaauu-biotin-3'(seqidno.1);655qd探针的核苷酸序列为:5'-po4-uuaucgaauagucugacuacaa-biotin-3'(seqidno.2)。
实施例1
血清提取物的制备:使用qiagenmirneasyrna分离试剂盒提取总rna。取0.5毫升新鲜或冻融的血液,加入1毫升micrornaextractor,充分振荡混匀。将裂解后样品或匀浆液室温放置5-10分钟,使得核蛋白与核酸完全分离。加入0.2毫升氯仿,剧烈振荡30秒,室温放置3分钟。以12000转/分钟的速度在4℃离心10分钟。吸取上层水相转移至干净的离心管中,加入1.5倍体积无水乙醇(如540微升上清液需加入810微升无水乙醇)后混匀。将吸附柱(spincolumntr)放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加至吸附柱中,静置1分钟,以12000转/分钟的速度在4℃离心2分钟,倒掉收集管中废液。将吸附柱(spincolumntr)放回收集管中,加入500微升rpesolution,静置2分钟,以10000转/分钟的速度在4℃离心30秒,倒掉收集管中废液(该步骤重复一次)。将吸附柱(spincolumntr)放回收集管中,以12000转/分钟的速度在4℃离心2分钟。将吸附柱放入干净的1.5毫升离心管中,在吸附膜中央加入30微升rnase-freewater,静置2分钟,以12000转/分钟的速度在4℃离心2分钟,将所得到的rna溶液置于-80℃保存或用于后续试验。取出1微升使用nanodrop2000c分光光度计对提取液中的总rna浓度进行测定。
microrna检测:对几丁质功能化的磁珠进行预处理以减少非特异性结合。首先,将500微升几丁质功能化的磁珠悬浮液转移至无菌微量离心管中,并使用磁力架将磁珠拉至管的侧面以去除上清液。其次,将500微升几丁质功能化的磁珠预处理缓冲液(100毫摩尔/升氯化钠,1毫摩尔/升edta,1毫摩尔/升tcep,1毫克/毫升bsa,20毫摩尔/升三羟基氨甲烷-盐酸,ph7.0)添加到试管中,剧烈搅拌悬浮液,并除去上清液。最后,加入500微升新鲜的磁珠预处理缓冲液,并将试管在4℃旋转4小时。立即使用所得的磁珠或将其放在4℃下保存(至少可以保存4个月)。通过将等摩尔比例的量子点和相应的microrna探针在室温下孵育30分钟来制备量子点探针。
在室温下孵育含有指定浓度靶标microrna的杂交溶液,2.5毫升几丁质功能化磁珠,0.2单位/微升p19蛋白,1×p19结合缓冲液(100毫摩尔/升氯化钠,1毫摩尔/升edta,1毫摩尔/升tcep,0.02%(v/v)tween-20,20毫摩尔/升三羟基氨甲烷-盐酸,ph7.0),1毫克/毫升牛血清蛋白(bsa)和30纳摩尔/升量子点探针的30微升反应体系30分钟。杂交后,除去上清液,并将所得的磁珠用1×洗涤缓冲液(100毫摩尔/升氯化钠,1毫摩尔/升edta,100克/毫升牛血清蛋白,20毫摩尔/升三羟基氨甲烷-盐酸,ph7.0)充分洗涤3次。最后,将捕获的量子点探针用含有0.5%sds的1x洗脱缓冲液(100毫摩尔/升氯化钠,1毫摩尔/升edta,1毫摩尔/升tcep,0.5%sds,20毫摩尔/升三羟基氨甲烷-盐酸,ph7.0)洗脱,并进行单颗粒检测。
单颗粒检测:倒置的olympusix-71显微镜(olympus,东京,日本)用于基于全内反射荧光(totalinternalreflectionfluorescence,tirf)成像的单粒子检测。蓝宝石488nm激光(50mw,美国coherent)用于同时激发605qd和655qd。发射的光子由油浸式100x物镜(日本奥林巴斯)收集,并以100毫秒的曝光时间在安道尔ixondu897emccd相机(安德鲁,英国贝尔法斯特)成像。所有图像均通过imagej软件(nih,贝塞斯达,医学博士,美国)进行分析,粒子的大小设置为2-20像素,以减少由噪声产生的误报信号。为了进行数据分析,选择了600×600像素的图像区域(roi)对量子点进行单颗粒计数。
凝胶电泳:在室温和110伏的恒定电压下用12%的非变性聚丙烯酰胺凝胶电泳对p19-605qd-sirna1复合物以及p19-655qd-sirna2复合物进行分析,使用1×的tbe缓冲液(含9毫摩尔每升的ph7.9的三羟基氨甲烷-盐酸、9毫摩尔每升的硼酸和0.2毫摩尔每升的edta),电泳时间为60分钟。此后,通过bio-radchemidocmp成像系统进行拍摄分析。
实验原理:以非常重要的癌症生物标记物mir-155和mir-21作为靶标microrna。如图1所示,通过将单链rna与两个在光谱上可区分的量子点偶联来构建量子点探针(量子点探针通过量子点表面修饰的链霉素亲和素和检测探针末端修饰的生物素biotin的偶联作用构建获得),其中605qd探针与mir-155互补,而655qd探针与mir-21互补。通过特定的p19与几丁质结构域(chitin-bindingdomain,cbd)相互作用,p19结合到几丁质功能化的磁珠表面。mir-155和mir-21分别可以与605qd探针和655qd探针杂交,分别形成605qd-sirna1和655qd-sirna2。这两个qds-sirnas可以通过静电识别同时与p19结合,从而促进它们在磁珠上的组装,从而形成qds-sirnas-p19-mmp生物结合物。通过使用十二烷基硫酸钠(sodiumdodecylsulfate,sds)使p19变性后,量子点探针从磁珠上拆卸下来。可以通过单颗粒计数同时检测游离的量子点。本技术方案仅需要量子点作为报告信号和通过自组装过程完成,而无需任何化学/酶反应,从而可以从单个样品中同时检测多种microrna。
1.原理的实验验证
我们使用凝胶迁移率移动试验来验证p19与qds-sirna的结合。如图2a所示,当p19,mir-155和605qd探针共存时(泳道2),观察到p19-605qd-sirna1复合物的明显的凝胶位移带,表明p19与605qd-sirna1的结合。相反,在缺少mir-155(泳道3),p19蛋白(泳道4)或mir-155和p19蛋白(泳道1)的情况下,p19-605qd-sirna1条带消失,仅观察到605qd探针(条带1和3)和605qd-sirna1(条带4)的条带。在mir-21的情况下观察到相似的结果。如图2b所示,仅在存在p19,mir-21和655qd探针(泳道2)的情况下,才能观察到p19-655qd-sirna2复合物的明显凝胶位移带,而在没有mir-21的情况下该条带消失(泳道3)。p19(第4道)或mir-21和p19(第1道)。这些结果显然证明p19蛋白可以有效地与qd-sirna结合,仅当存在相应的靶标microrna时才能够特异性捕获量子点探针。
我们进一步使用荧光成像来验证量子点探针和磁珠之间的组装和拆卸。如图3所示,添加目标microrna后,可以在磁珠周围观察到明显的605qd和655qd信号(图3b和图3f),而在添加目标之前(图3a和图3e)没有产生荧光信号,表明量子点的有效组装到磁珠表面。此外,在拆卸之前,在上清液中未检测到荧光信号(图3c和图3g);在十二烷基硫酸钠(sds)使p19变性后,量子点探针从磁珠表面被拆卸下来,观察到明显的单个605qd和655qd点(图3d和图3h)。这些结果清楚地证明了量子点探针和磁珠之间的自组装和拆卸可用于多种microrna分析。
与传统的荧光测定方法相比,单分子检测具有样品消耗量少、分析时间短、灵敏度高等显著优点。因此我们同时采用全内反射荧光成像技术测定了单个量子点的荧光信号。如图4所示,在这项研究中,我们使用单分子检测来量化量子点信号。仅在存在mir-155的情况下,仅检测到605qd信号(图4b),而未观察到655qd信号(图4f)。仅存在mir-21时,只能检测到655qd信号(图4g),而没有检测到605qd信号(图4c)。相反,在没有mir-155和mir-21的情况下,既没有605qd(图4a)也没有655qd(图4e)信号。此外,加入mir-155和mir-21可以同时检测到605qd(图4d)和655qd(图4h)荧光信号。这些结果清楚地证明了量子点的组装和拆卸:磁珠纳米复合物可用于同时检测多种microrna。
2.灵敏度实验
在优化的实验条件下,我们测量了不同浓度microrna对应的量子点进行单分子计数来评估本技术方案的分析灵敏度。我们通过测量对不同浓度的目标microrna的量子点计数进一步评估了所提出方法的敏感性。如图5所示,605qd计数随着mir-155浓度从0到2×10-10m的增加而逐渐增加,并且在605qd计数和mir-155浓度从1×10-13到1×10-11m,回归方程为y=6.425+3.647x,线性相关系数r2=0.9991。此外,655qd计数随mir-21浓度从0到1×10-10m的变化而提高,并且在655qd计数与mir-21浓度从1×10-13到线性相关到1×10-11m,回归方程为y=17.61+15.17x,线性相关系数r2=0.9986。值得注意的是,可以将100飞摩尔/升,microrna与没有靶标的对照组很好地区分开,与基于有机染料的分子信标方法(1纳摩尔/升)相比,其灵敏度提高了4个数量级,甚至可以与双链特异性核酸酶信号扩增方法(100飞摩尔/升),适用于检测临床样品中的microrna。此方法的高灵敏度可归因于(1)量子点对靶标microrna的有效编码,以将microrna信号转换为不同的量子点信号;(2)由于引入了磁分离,背景信号极低;(3)固有的单分子检测技术的高信噪比。
3.特异性实验
我们使用单碱基错配的microrna靶标m-mir-155和m-mir-21(图6a)来研究所提出方法的特异性。如图6b所示,在没有任何目标microrna的对照组中,仅观察到了605qd和655qd的低背景信号。相反,在仅存在mir-155的情况下观察到高605qd荧光信号,而在仅存在mir-21的情况下检测到高655qd荧光信号。此外,当mir-155和mir-21共存时,可以同时检测到655qd和605qd荧光信号。特别是,mir-155的信号比m-mir-155的信号高2.77倍,而mir-21的信号比m-mir-21的信号高7.03倍,表明即使单所提出的方法可以很好地区分基本差异。拟议方法的高选择性可以归因于p19蛋白与完全互补的sirna和错配sirna的不同结合亲和力,这可以通过对p19蛋白与量子点标记的sirna的结合进行凝胶迁移分析来验证。如图6c所示,在存在mir-155的情况下产生了相似的sirna条带(泳道1)或m-mir-155(泳道2),表明mir-155中的单碱基差异不会影响sirna的形成。添加p19蛋白后,由于p19与605qd标记的sirna1的结合,可以观察到p19-605qd-sirna复合物的明显凝胶位移带(泳道3和4)。值得注意的是,与mi-155组(第3道)相比,m-mir-155(第4道)与p19结合后剩下的sirna多得多,这表明p19对错配的sirna1具有较低的亲和力。同样,与mir-21相比,m-mir-21不会影响sirna2的形成(第1和2道),但导致与p19结合后留下的sirna2多得多(第3和4道)。这些结果表明,使用p19作为识别元件能够以单碱基错配选择性准确检测microrna。
4.血清实验
为了验证提出的方法同时检测循环microrna的可行性,我们测量了非小细胞肺癌(nsclc)患者和健康供体血清中的mir-155和mir-21。如图7所示,患者样品中的mir-155(图7a)和mir-21(图7b)水平均显着高于正常样品中的水平。平均水平与健康组相比,肺癌组中的mir-155和mir-21分别增加了5.43倍和1.55倍。这些结果与先前的报告一致,即肺癌患者的血清mir-155和mir-21的水平显着高于健康者。这些结果清楚地表明,所提出的方法可用于同时检测循环microrna,为癌症研究和非侵入性诊断提供了新的强大平台。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
sequencelisting
<110>山东师范大学
<120>sirna定向自组装量子点生物传感器及其检测方法和应用
<130>
<160>2
<170>patentinversion3.3
<210>1
<211>23
<212>rna
<213>人工序列
<400>1
cccuaucacgauuagcauuaauu23
<210>2
<211>22
<212>rna
<213>人工序列
<400>2
uuaucgaauagucugacuacaa22
- 还没有人留言评论。精彩留言会获得点赞!