寡养单胞菌、包含其的组合物以及应用的制作方法
本发明属于环境治理领域,涉及一种硫氧化菌。
背景技术:
水体黑臭现象成因复杂,涉及物理、化学和生物等诸多过程,影响因素较多。已有研究表明,上覆水中的s2-是导致水体变黑的关键因素。它与水体中fe2+、mn2+、cu2+等金属离子结合,累积生成金属硫化物,从而引起水体变黑。因此,将黑臭水体中的s2-氧化为价态稳定的so42-可避免水体变黑现象的产生。s2-的氧化过程在自然环境下非常缓慢,主要依靠天然水体中的土著硫氧化菌(sob)完成,这使得外源输入的s2-在黑臭水体中进一步富集,导致水质出现恶化。s2-等黑臭水体中污染物质的去除方法主要包括曝气复氧、底泥疏浚、强化混凝和微生物法等。其中,微生物法具有针对性强、对环境无二次污染等优点,已被成功应用于中小河道的治理中。目前,针对黑臭水体治理,微生物菌剂的开发已开展了一些研究工作,主要包括不动杆菌(acinetobacter)、乳酸菌(lactobacillus)、芽孢杆菌(bacillus)和假单胞菌(pseudomonas)等。但是,这些微生物菌剂以非硫氧化菌为主,且集中于菌剂对水体中cod、nh3-n和tp等污染物的去除效果研究,鲜少涉及对黑臭水体中致黑关键污染物s2-的去除影响研究。
技术实现要素:
本申请发明人以无机硫(s2)-为目标污染物,筛选出一株能够高效氧化s2-的土著硫氧化菌,有利于黑臭水体水质的净化。
在第一个方面,本发明提供一株寡养单胞菌(stenotrophomonassp.)sp3,其保藏编号为cgmccno.18394。
在第二个方面,本发明提供培养所述寡养单胞菌sp3的方法,所述方法包括在含有葡萄糖的培养基中培养所述菌。
优选地,培养温度为25-35℃,优选25℃;培养的ph值为6-7;培养基中葡萄糖的初始浓度为0.25~1%,优选0.25~0.5%;初始菌浓度为1~5g/l;培养时间为25~35h,优选30~35h。
在第三个方面,本发明提供一种包含所述寡养单胞菌sp3的组合物。
优选地,所述组合物为一种制剂。
优选地,所述组合物还包括吸附剂。优选地,所述吸附剂为沸石。优选地,所述组合物可以是菌剂,所述菌剂可以是固体形式或混悬液形式。
在第四个方面,本发明提供制备所述组合物的方法,包括将所述寡养单胞菌和吸附剂混合。
在第五个方面,本发明提供寡养单胞菌sp3或其组合物在净化或治理含s2-的水体水质中的应用。优选地,所述含s2-的水体为黑臭水体。
如无特别说明,本发明中涉及葡萄糖浓度、接种量时使用的“%”表示质量百分比。
本发明的寡养单胞菌能够高效地氧化s2-,有效降低水体中s2-含量,从而改善水体质量,特别是在黑臭水体的治理和净化上,有显著的效果。
本发明的寡养单胞菌sp3,保藏在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.18394,保藏时间为2019年8月19日。
附图说明
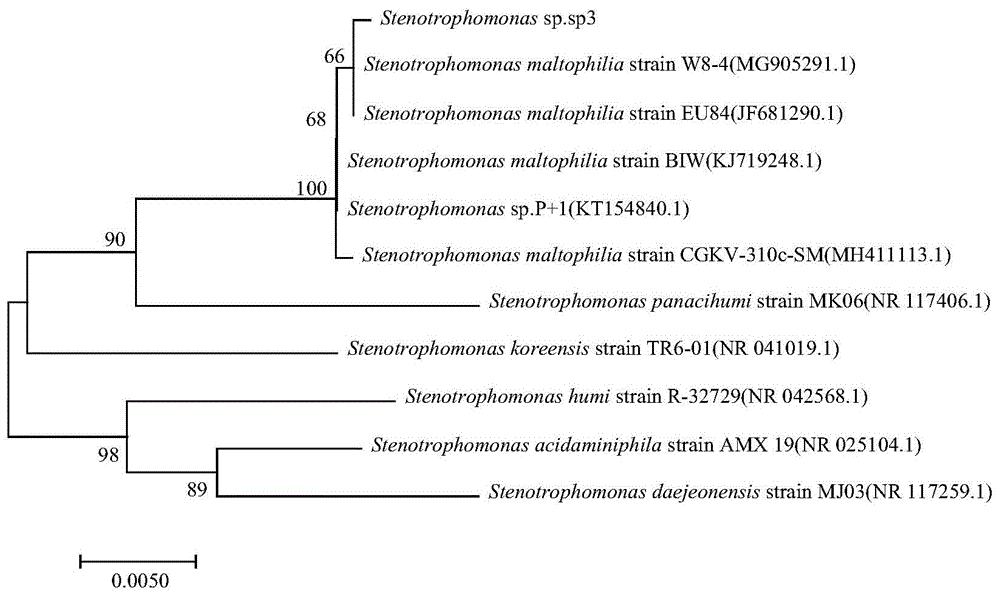
图1:菌株sp3系统发育树;
图2:温度(a)、初始ph值(b)、初始葡萄糖浓度(c)和初始菌浓度(d)对菌株sp3生长及s2-氧化率的影响;
图3:菌株sp3的生长曲线和s2-氧化曲线;
图4:各存在形态无机硫浓度变化,a:实验组;b,对照组;
图5:菌株sp3对s2-的生物氧化主要途径;
图6:菌株sp3对北京东沙河水样中污染物的去除效果;
图7:固定化初始ph值对菌剂处理黑臭水体效果的影响(a:s2-氧化率;b:cod、nh3-n和tp的去除率);
图8:固定化吸附时间对菌剂处理黑臭水体效果的影响(a:s2-氧化率;b:cod、nh3-n和tp的去除率);
图9:接种量对菌剂处理黑臭水体效果的影响(a:s2-氧化率;b:cod、nh3-n和tp的去除率);
图10:载体添加量对菌剂处理黑臭水体效果的影响(a:s2-氧化率;b:cod、nh3-n和tp的去除率);
图11:等高线图及响应曲面图;其中,
a:ph和时间两两因素交互作用对s2-氧化率影响的等高线图;
b:ph和时间两两因素交互作用对s2-氧化率影响的响应面图;
c:ph和接种量两两因素交互作用对s2-氧化率影响的等高线图;
d:ph和接种量两两因素交互作用对s2-氧化率影响的响应面图;
e:ph和载体添加量两两因素交互作用对s2-氧化率影响的等高线图;
f:ph和载体添加量两两因素交互作用对s2-氧化率影响的响应面图;
g:时间和接种量两两因素交互作用对s2-氧化率影响的等高线图;
h:时间和接种量两两因素交互作用对s2-氧化率影响的响应面图;
i:时间和载体添加量两两因素交互作用对s2-氧化率影响的等高线图;
j:时间和载体添加量两两因素交互作用对s2-氧化率影响的响应面图;
k:接种量和载体添加量两两因素交互作用对s2-氧化率影响的等高线图;
l:接种量和载体添加量两两因素交互作用对s2-氧化率影响的响应面图;
图12:菌剂固定化前后沸石颗粒的扫描电镜图,a:固定吸附菌剂前;b:固定吸附菌剂后。
具体实施方式
将通过以下实施例进一步说明本发明的内容,但本发明内容不限于此。
如无特殊说明,以下实施例中使用的试剂和仪器均为本领域常规试剂和仪器,可以通过商购方式获得。所使用的方法为常规方法,本领域技术人员根据实施记载的内容,可以毫无疑义地知道如何进行所述方案并获得相应的结果。
实施例一:寡养单胞菌的筛选及富集
1、从北京市东沙河采集底泥与水样等比例混合均匀,以此泥水混合物作为微生物富集分离培养的来源。水样采集于东沙河表层水,经10μm的膜过滤,剔除大块悬浮颗粒、藻类和浮萍等杂质。底泥用抓泥斗采集于水下0.5~1.0m,剔除石块和动植物残体等杂质。采样时进行多点布置,确保菌源的多样性。
2、实验所用培养基分别为富集培养基:na2s·9h2o0.162g/l,可溶性淀粉2g/l,kno30.1g/l,k2hpo40.05g/l,nacl0.05g/l,mgso4·7h2o0.05g/l,feso40.001g/l,营养琼脂2%;分离纯化培养基:na2s·9h2o0.162g/l,kno30.1g/l,k2hpo40.05g/l,nacl0.05g/l,mgso4·7h2o0.05g/l,feso40.001g/l,葡萄糖20g/l,蛋白胨10g/l,酵母浸膏粉5g/l,琼脂15~20g/l;液体培养基:葡萄糖20g/l,蛋白胨10g/l,酵母浸膏粉10g/l。每种培养基在使用前均调节ph值至7.0,在100mpa和121℃条件下灭菌20min。
3、取5ml步骤1制备的泥水混合物稀释于500ml浓度为5%无菌nacl溶液,再将其接种于富集培养基(s2-浓度为21.6mg/l)中,于25℃恒温培养2~3d。待硫氧化菌在培养基中大量生长后,选取长势较好的单菌落在分离纯化培养基上进行划线,于25℃恒温培养2~3d。不断重复进行划线分离,直至平板上所有菌落特征一致,即为硫氧化菌,能高效氧化黑臭水体致黑关键污染物即s2-的土著硫氧化菌,在s2-浓度为21.6mg/l的培养基上,s2-氧化率可达到60%以上,将其命名为sp3。
4、种子液的制备与扩培发酵。用接种环挑取分离纯化出来的硫氧化菌,接种到装有100ml液体培养基的锥形瓶中,转速120r/min,25℃恒温培养2d后用作种子液,再按照5%的接种量转接至新鲜的液体培养基中,于25℃,120r/min的恒温摇床中培养2d,分批次发酵,用于黑臭水体硫氧化实验。
实施例二:菌株的鉴定
1、16srrna测序:采用生工生物工程(上海)股份有限公司的ezup柱式细菌基因组dna抽提试剂盒sk8255对实施例一得到的硫氧化菌总dna进行抽提,具体实验步骤遵照试剂盒说明书进行。设计引物序列为27f(agtttgatcmtggctcag)和1492r(ggttaccttgttacgactt)。以细菌总dna为模板,pcr扩增,长度为1500bp。最后由生工生物工程(上海)股份有限公司完成测序工作。将碱基序列测序结果通过blast程序和genbank中核糖数据进行同源性分析,构建系统发育树。
结果表明,菌株sp3的16srrna基因序列与stenotrophomonas菌属的多株菌株同源性高达99%以上。为此,菌株sp3鉴定为stenotrophomonas属。为进一步分析菌株sp3的系统进化位置,选取相似度最高的10条已命名纯培养菌株的16srrna基因序列,利用mega7软件构建系统发育树,结果如图1所示。
2、形态及生理生化特性实验。
(1)菌落形态观察:采用平板稀释法将分离纯化所获得的硫氧化单菌株涂布于固体培养基上,在25℃下恒温培养2~3d,待菌落生长出来后,观察并记录其表面形态、大小、颜色等菌落特征。
菌株sp3在营养琼脂上进行25℃恒温培养后,为灰黄色不透明圆形菌落,边缘光滑,部分不规则,质地粘稠,菌落有氨气味,直径0.5~1mm,中央突起。
(2)菌株生理生化特性实验:参考东秀珠等编著的《常见细菌系统鉴定手册》和沈萍等编著的《微生物学实验》,完成硫氧化菌株生理生化特性实验。
通过革兰氏染色实验观察到菌株sp3颜色呈红色,为革兰氏阴性菌,且菌体微小呈短杆状。生理生化特性实验结果表明,菌株sp3具有赖氨酸脱羧酶活性,可还原硝酸盐和利用麦芽糖,并可水解七叶苷和液化明胶。由此可见,菌株sp3与stenotrophomonasmaltophilia的个体形态和生理生化特性具有相似性。结合菌株sp3的16srrna测序鉴定结果,初步确定菌株sp3为寡养单胞菌属。寡养单胞菌属代谢功能多样,大多体现在对抗生素的耐药性、降解有机磷、降解ddt等方面的研究,关于硫氧化功能研究鲜有报道。
实施例三:菌株sp3的生长及硫氧化特性的验证
1、含s2-废水的配制
实验采用人工配置的含s2-废水。根据zhuang等(zhuangr,louy,qiux,etal.identificationofayeaststrainabletooxidizeandremovesulfidehighefficiently[j].appliedmicrobiology&biotechnology,2017,101(1):391-400.)的描述对配水成分进行优化,主要成分见表1。含s2-废水配制后灭菌备用。灭菌条件为:100mpa,121℃灭菌20min。后续试验以此废水为基础进行调配。
表1含s2-人工配制废水
2、sp3生长条件和氧化条件的优化
2.1将实施例一步骤4的扩培发酵实验中生长至稳定期的硫氧化菌sp3接入装有200ml含s2-人工配制废水的锥形瓶中,于120r/min转速条件下进行生物氧化反应,分别考察温度(5、15、20、25、30、35℃,其它条件为:初始ph值7.0,初始葡萄糖浓度0.25%,初始菌浓度1.00g/l),ph值(4、5、6、7、8,其它条件为:温度25℃,初始葡萄糖浓度0.25%,初始菌浓度1.00g/l),葡萄糖浓度(0.05%、0.10%、0.25%、0.50%、1.00%,其他条件为:温度25℃,初始ph值7.0,初始菌浓度1.00g/l)及初始菌浓度(0.01、0.10、1.00、2.00、5.00g/l,其他条件为:温度25℃,初始ph值7.0,初始葡萄糖浓度0.25%)对s2-氧化率的影响,测定反应过程中细菌生长量od600值,进而确定sp3对s2-的最适生物氧化条件。在最适s2-氧化条件下,通过定时测定细菌生长量和剩余s2-浓度,绘制硫氧化菌sp3的生长曲线和s2-氧化曲线。
2.2sp3对s2-的生物氧化途径研究在最适的硫氧化条件下进行。实验设计2组容积为5l的生化反应装置,每组设置3个平行实验。将硫氧化菌按1g/l的接种量转接至含s2-人工配制废水中(实验组),设立不添加硫氧化菌的对照组。反应过程中定时取样,测定水样中s2-、s0、s2o32-、s4o62-、so32-和so42-的质量浓度。
3、实验结果:
(1)温度对菌株生长及s2-氧化率的影响:如图2的a所示,菌株sp3的生长量和对s2-的氧化率均随着温度的升高而增加,在温度为25℃时达到最高,此时s2-的氧化率高达85.2%。当温度继续提高至35℃时,菌株sp3的生长量和对s2-的氧化率略有下降。可以明显得出,菌株sp3嗜中温,能够在温度适宜的条件下,尤其是25℃进行各项代谢活动。因此,控制温度为25℃对s2-的氧化较为适宜。
(2)初始ph值对菌株生长及s2-氧化率的影响:如图2的b所示,菌株sp3的生长量和对s2-的氧化率随着初始ph值由强酸性到弱碱性呈现先上升后显著下降的变化趋势。当初始ph值在6~7范围内时,菌株sp3的生长较好,s2-的氧化率亦较高,皆达到85%左右。碱性条件不适合菌株sp3生长,也不利于对s2-的生物氧化。因此,初始ph值为7时较为适宜菌株sp3的生长及对s2-的生物氧化。
(3)初始葡萄糖浓度对菌株生长及s2-氧化率的影响:如图2的c所示,当初始葡萄糖浓度由0.05%提高至0.25%时,菌株sp3的生长量显著增加。这说明葡萄糖是菌株sp3可利用的碳源,能促进细菌的生长繁殖。当初始葡萄糖浓度继续提高至1%时,菌株sp3生长量的增长趋于缓慢,这是因为微生物细胞膜输入葡萄糖的能力趋近饱和。s2-的氧化率随着初始葡萄糖浓度的提高呈现先增加后下降的变化趋势。当初始葡萄糖浓度为0.25%时,菌株sp3对s2-的生物氧化能力最强,s2-的氧化率达到83%左右。因此,最适宜的初始葡萄糖浓度为0.25%。
(4)初始菌浓度对菌株生长及s2-氧化率的影响:如图2的d所示,初始菌浓度是影响s2-去除效率的重要因素之一。当初始菌浓度由0.01g/l提高至1.00g/l时,s2-的氧化率达到最高,为81%。继续提高初始菌浓度后,菌株sp3对s2-的氧化却保持基本稳定。因此,最适宜的初始菌浓度为1.00g/l。
综上,s2-氧化最适宜条件是:25℃、ph值为7、葡萄糖初始浓度为0.25%、初始菌浓度为1.00g/l。在此条件下,菌株sp3对s2-的氧化率最高可达86.9%。
(5)菌株sp3的生长曲线与s2-氧化曲线:将菌株sp3在最适条件下培养72h,得到s2-的剩余浓度及菌株生长量的变化曲线,如图3所示。菌株sp3的生长曲线符合细菌的群体生长规律。前16h为菌株的延滞期。随着菌株的加入,s2-剩余浓度开始迅速下降。在第16h后,菌株开始快速生长,至第35h达到最大值。因此,这19h为菌株的对数生长期。在此期间,菌株对s2-的氧化反应继续进行,促使s2-的剩余浓度持续下降。在第35~60h,菌株sp3的数量处于基本稳定的状态,菌株的生长进入稳定期。在菌株sp3稳定期,s2-的剩余浓度缓慢下降,在第60h达到最低值,为2.9mg/l,s2-氧化率高达86.6%。此后,菌株的数量开始迅速下降,菌株sp3处于衰亡期。而s2-的剩余浓度在菌株sp3的衰亡期保持基本稳定的状态。可以明显得出,菌株sp3对s2-的生物氧化过程发生在前35h,即菌株sp3的延滞期和对数生长期。
(6)菌株sp3对s2-的生物氧化过程:s2-在生物氧化过程中可能涉及6种不同的存在形态,包括s2-、s0、s2o32-、s4o62-、so32-以及so42-。因此,通过测定这6种无机硫存在形态的变化可推测s2-的生物氧化过程。在最适条件下,s2-在菌株sp3氧化作用过程中硫的存在形态变化如图4的a所示。随着s2-生物氧化过程的进行,检测到不同存在形态的无机硫,包括s2-、s0、s2o32-、so32-以及so42-,并且这些无机硫浓度的变化在整个反应过程中呈现明显差异。由于s2-作为电子供体被氧化为其它价态的无机硫,它的浓度在前10h迅速下降;随后缓慢减少并逐渐趋于平缓,在反应30h后,水样中s2-的剩余浓度为3.0mg/l,其氧化率达到86.1%。s0、s2o32-和so32-的浓度随着反应进行呈现明显的波动,这说明这些存在形态的无机硫在反应过程中同时存在生成与消耗2个过程。s0和so32-浓度均呈现先上升后下降再上升的变化趋势,它们的浓度分别于18和45h达到最大值,这可能与前18h内s2-的氧化消耗有关。s2o32-的浓度呈现先上升后下降并逐渐趋于平稳的变化趋势,它的浓度在第8h取得最大值,为11.2mg/l。与s2-的浓度变化相反,so42-的浓度在反应过程中则持续增加,最终达到9.2mg/l。
上述结果表明,菌株sp3对s2-的氧化过程是将非稳定态的s2-逐步转化为稳定态so42-的过程。其中伴随着一系列中间存在形态无机硫的产生。这些无机硫最终部分转化为so42-。需要说明的是,在整个反应中并未检测到s4o62-。此外,在未添加菌株sp3的对照组中,s2-的浓度呈现略微下降的趋势,并检测到极低浓度的s2o32-和so42-产生,如图4的b所示。其它存在形态的无机硫在反应过程中并未检测到。可以得出,菌株sp3的添加可明显促进s2-的生物氧化。
实施例四:硫氧化菌sp3对硫离子的生物氧化途径分析
基因组制备与测序:硫氧化菌总dna提取采用美国omega公司的
基因组组装与注释:对测序完成后所获得的reads进行质量剪切工作,以去除illuminahiseq原始测序过程中产生的一些质量较低的reads,使用idba-ud软件拼接组装优化序列,以获得最优选的组装结果。利用glimmer3.02软件进行细菌的基因预测,将预测基因的蛋白序列分别与nr、genes、string和go等数据库进行blastp比对,从而获得所预测基因的注释信息。
结果:
基因组测序结果显示,总碱基数为1047369985bp,平均测序深度为204×。根据剪切后的数据,将reads拼接成contigs;而后,将contigs按顺序排列在一起形成scaffolds。利用glimmer3.02软件对菌株sp3组装后的scaffolds进行分析和基因预测。统计获得的基因数量,基因总长度和gc含量等指标,结果如表2所示。
研究得出sob对无机硫氧化的2条主要途径。一条为pso(副球菌硫氧化)途径,即从s0氧化为so32-,再氧化为so42-的硫氧化途径。另一条为s4i(连四硫酸盐)途径,即伴随有多硫酸盐产生的四硫化物中间物途径。s4o62-仅存在于s4i途径,是此途径中重要的中间代谢产物。pso和s4i这2条途径都存在3个阶段的氧化过程,包括s2-到s0,低价态无机硫到so32-,so42-的生成,涉及硫化物醌氧化还原酶(sqr),亚硫酸盐还原酶(srn),硫代硫酸盐-硫转移酶(tst),异二硫化物还原酶(hdr),连四硫酸盐水解酶(tth)以及亚硫酸盐氧化酶(so)等关键酶。其中,tth酶仅存在于s4i途径中,起到将s4o62-转化为so42-的作用。
表2菌株sp3基因测试结果
根据现有文献报道与公共数据库kegg中有关硫氧化代谢途径中相关基因的描述,结合基因组测序结果,在菌株sp3中检测出31种与无机硫生物氧化过程相关的功能基因,如表3所示。前人研究表明,在菌株sp3检测出的部分硫氧化功能基因同样存在于其它sob中,例如编码半胱氨酸脱硫酶的sufes基因,编码吡啶核苷酸二硫键氧化还原酶的hdra基因,编码tst酶的tst基因,编码nad(p)h-泛醌氧化还原酶的nqor基因,以及编码硫酸盐abc转运体渗透酶的stp基因等。此外,还检测出其它一些与硫氧化相关的功能基因,包括编码srn酶的cysij基因,编码fad黄素腺嘌呤二核苷酸soxf,编码电子传递体的cybb基因以及编码so酶的sox基因簇。虽然测序结果中未检测出编码sqr酶的sqr基因,但是检测到编码吡啶核苷酸二硫键氧化还原酶的hdra基因。此基因已被证实同样可以起到编码sqr酶的作用。
基因测序结果表明,在菌株sp3中不存在编码连四硫酸盐水解酶tth的teth基因,结合未检测出中间产物s4o62-,可推测菌株sp3对s2-的氧化可能仅存在pso途径,见图5所示。此途径中涉及的无机硫存在形态包含s2-、s0、s2o32-、so32-以及so42-。s2-在菌株sp3作用下的主要氧化途径推测如下:一部分底物s2-作为电子供体被氧化为s0,此过程涉及到编码sqr酶的hdra基因和编码fad黄素腺嘌呤二核苷酸的soxf基因;另一部分底物s2-在编码srn酶的cysij基因调控下直接氧化为so32-;在氧化过程中生成的s0与so32-可自发反应生成s2o32-,而s2o32-可在编码tst酶的tst基因调控下发生歧化反应释放出so32-和s0;so32-在编码so酶的sox基因簇调控进一步氧化生成so42-。
表3菌株sp3基因组中无机硫生物氧化过程相关基因
hdra基因可编码sqr酶,该酶主要起催化s2-转化为s0的作用。cysij基因通过控制srn酶的合成调控s2-至so32-的生化反应,此过程为可逆。过量的so32-可对微生物细胞产生毒害作用。而so32-还原为s2-的反应有助于减少so32-在体系中的累积并降低对细胞的毒害风险。s2-直接氧化为so32-的代谢途径仅存在于少数sob中。此外,srn酶通路亦发现于具有有机硫化物矿化功能的微生物中,起着调节so32-的作用。这说明菌株sp3可能同样具有有机硫化物矿化功能,可能成为降解黑臭水体中致味硫醇和硫醚类致臭污染物的功能微生物。s0也可直接氧化为so32-。此反应需通过异二硫化物还原酶通路,该通路存在于大多数sob中。在此通路中,s0在硫醇基团rsh的作用下被活化为硫烷硫原子rssh,接着经异二硫化物还原酶催化转化为so32-,并重新形成rsh。rssh的生成过程由grx基因调控,而异二硫化物还原酶由hdrbc基因编码。在菌株sp3中虽然检测到grx基因,但未检测出hdrbc基因。这表明在菌株sp3中可能无s0→rsh→rssh→so32-的通路。因此,菌株sp3中可能仅存在s0与so32-之间的自发反应,以及s2o32-的歧化反应。so32-可直接或间接氧化为so42-。在直接氧化途径中,sox基因簇,尤其是soxc基因扮演着重要作用,其通过调控so酶的合成控制so42-的生成。而间接氧化途径是指so32-由apr基因调控磷酸腺苷硫酸盐(aps)途径而被氧化成so42-。在菌株sp3中未检测出apr基因,故so32-的氧化可能只存在直接氧化途径。
实施例五:硫氧化菌对黑臭水体处理实验
黑臭水样取自于北京市东沙河黑臭河段,具体水质参数如表4所示。将培养后的硫氧化菌以1g/l的接种量接种于装有200ml黑臭水样的锥形瓶中。同时设立不添加硫氧化菌的对照组,每组设置3个平行实验。在120r/min转速和25℃下反应60h,测定s2-的氧化率,以及cod,nh3-n,tp及色度的去除率。
表4黑臭水样主要水质参数
水样中测定指标包括s2-、s0、s2o32-、s4o62-、so32-、so42-、cod、nh3-n、tp、色度和od600。s2-和s0采用分光光度法测定,s2o32-、so32-和so42-采用离子色谱仪(cic-d120,青岛盛翰)测定。s4o62-采用高效液相色谱法(lc-10ad,岛津液相)测定。cod和nh3-n采用hach多参数水质测定仪(db2800,美国哈希)测定,tp采用紫外分光光度计(uv-1800,日本岛津)测定。色度评价参照稀释倍数法(国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[m].4版.中国环境科学出版社,2002)。硫氧化菌生长量按照冯玉雪等(冯玉雪,毛缜,吕蒙蒙.一株ddt降解菌的筛选及其降解特性[j].中国环境科学,2018,(5):1935-1942.)描述的细菌计数法测定,即以od600值来表示细菌的生长量。
每组实验设置3个平行样品,每组实验数据测3次求平均值。数据处理及分析分别采用originpro9.0和microsoftexcel2013软件。
菌株sp3对北京东沙河黑臭水样中的主要污染物去除效果如图6所示。结果表明,菌株sp3对实际黑臭水体中的s2-亦表现出较好的氧化能力。s2-由12.9mg/l的初始浓度降低为5.7mg/l,氧化率达到55.8%。水样中的色度随着s2-浓度的降低而下降,去除率高于50%。同时,菌株sp3对cod、nh3-n和tp亦具有明显的去除效果,去除率分别为38.9%,45.4%和44.1%。未添加菌剂sp3的对照组中s2-氧化率仅为5.1%,且cod等污染物去除率变化并不明显。
实施例六:硫氧化菌sp3的固定和条件优化
本实施例以人造沸石颗粒为载体,采用吸附固定法将sp3固定在人造沸石颗粒上,分别考察固定化初始ph、吸附时间、接种量、载体添加量等固定化过程主要因素对黑臭水体中的s2-氧化率、cod、氨氮以及tp等去除率的影响。进而,在单因素实验的基础上,采用响应面方法进一步优化固定化初始ph、吸附时间、接种量等固定化主要因素,以便获得高效sp3最优的固定化组合条件。
实验黑臭水样:
本实验黑臭水样采集于辽宁省沈阳市某典型黑臭河道上覆水,经10μm的膜过滤,将杂质去除并储存。s2-的浓度在黑臭水样中高达33.9mg/l,而cod、nh3-n和tp分别高出地表水环境质量v类标准的1.95、7.8和4倍,这些常规指标的具体数值见表5所示。
表5黑臭水样水质指标
液体培养基:
固定化实验中所用的液体培养基如下:20g/l葡萄糖,10g/l蛋白胨,10g/l酵母浸膏粉。每种培养基在使用前均调节ph值至7.0,在100mpa和121℃条件下灭菌20min。
固定化单因素实验:
1、ph
将sp3菌按5%(质量百分比)的接种量接入200ml液体培养基中,再投加0.5g沸石颗粒,用hcl(1.0mol/l)或naoh(1.0mol/l)将初始ph值分别调节为4.0、5.0、6.0、7.0、8.0和9.0,置于恒温振荡培养箱中于30℃和140r/min转速条件下进行48h的微生物固定化实验。
2、吸附时间
将sp3按5%的接种量接入200ml液体培养基中,取0.5g沸石颗粒加入其中,置于恒温振荡培养箱中于30℃和140r/min转速条件下分别进行18、24、30、36、48和60h不同吸附时间的微生物固定化实验。
3、接种量
将sp3菌分别按0.01%、0.1%、1.0%、5.0%、10.0%及20%的接种量接入200ml的液体培养基,随之加入0.5g的沸石颗粒,置于恒温振荡培养箱中于30℃和140r/min转速条件下进行48h的微生物固定化实验。
4、载体添加量
将sp3菌按5%的接种量接入200ml液体培养基中,再分别投加0.01、0.1、0.5、1.0、1.5和2.0g不同质量的沸石颗粒后,置于恒温振荡培养箱中于30℃和140r/min转速条件下进行48h的微生物固定化实验。
5、响应面优化实验
在单因素实验的结果基础上,以固定化初始ph、吸附时间、接种量以及载体添加量这4个固定化过程中涉及的主要因素为自变量,以固定化菌剂对黑臭水样中s2-氧化率(y)为响应值,通过design-expert8.0.6软件进行box-behnken中心组合实验设计,实验设计因素及水平见表6所示。
表6box-behnken设计因素及水平表
6、固定化菌剂对黑臭水体中s2-的氧化实验
将单因素实验所获得的固定化菌液在4℃和4000r/min条件下离心6min,去除上清液,再使用无菌去离子水分别冲洗固定化菌剂表面3次,以去除沸石颗粒表面未固定的游离微生物。将获得的固定化菌剂按5.0g/l质量浓度接入黑臭水样中,于25℃和120r/min转速条件下恒温振荡反应48h,测定s2-氧化率、cod、nh3-n及tp的去除率,分别考察ph、吸附时间、接种量和载体添加量对sp3氧化s2-的影响,以及去除cod、nh3-n及tp的影响。响应面优化实验所获得的固定化菌液处理方法同单因素实验。通过优化实验获得sp3菌体最佳的固定化组合条件。每个单因素及响应面优化实验重复3次,取其平均值进行数据分析。
分析方法
水样中测试指标包括s2-、cod、nh3-n和tp。所有样品经0.45μm膜过滤后再测定。s2-浓度采用亚甲基蓝分光光度法测定,cod、nh3-n、tp采用hach多参数水质测定仪测定。固定化菌剂的微观结构采用扫描电子显微镜(quanta200,荷兰fei公司)进行观察。所有数据处理及分析分别采用originpro8.0、design-expert8.0.6和spss22.0等软件。
结果与讨论
1、固定化初始ph对s2-氧化率的影响
ph是影响微生物代谢活动及污染物处理效率的重要因素之一。不同ph条件下所制备的固定化菌剂对s2-氧化率的影响如图7a所示。由图可知,当ph由强酸性变为碱性时,固定化菌剂对s2-的氧化率呈现先上升后下降的变化趋势。ph值在4.0~7.0范围时,s2-氧化率从23.9%提高至68.9%;s2-氧化率在ph值为8.0时达到最大,为73.3%。继续提高ph值至9.0,s2-氧化率则显著下降至61.6%。不同ph条件下所制备的固定化菌剂对cod、nh3-n和tp的去除率如图7b所示。当ph值由4.0提高至8.0时,cod、nh3-n和tp的去除率都显著提高,分别达到31.2%、47.0%和30.4%的最高值。然而,当ph值由8.0提高至9.0时,cod、nh3-n和tp的去除率则都明显下降,分别为23.1%、38.1%和15.2%。固定化初始ph值对s2-氧化率,cod、nh3-n和tp的去除率具有明显的影响作用,它们都随着ph值升高呈现先上升后下降的变化趋势。因此,sp3固定化过程适宜的初始ph值为7.0~9.0,最适宜的初始ph值为8.0~8.1。
2、吸附时间对s2-氧化率的影响
固定化过程中不同吸附时间对sp3菌剂氧化黑臭水样中s2-的影响如图8a所示。由图可知,当固定化吸附时间从18h延长至37.5h时,菌剂对s2-的氧化率从43.1%增至75.9%,s2-的氧化率达到了最高值;当继续延长固定化吸附时间时,s2-的氧化率却随之下降,至60h时降低为64.1%。吸附时间对固定化菌剂去除cod、nh3-n和tp的效率如图8b所示。当固定化吸附时间从18h延长至45h时,固定化菌剂对cod的去除率从4.7%显著提高至27.4%,以及nh3-n的去除率从19.6%提高至48.2%;但是,随着吸附时间继续延长,cod和nh3-n的去除率却呈现下降的变化趋势。不同于cod和nh3-n,tp的去除率在37.5h达到最高值,为31.9%。上述结果表明,适宜的吸附时间可增强固定化菌剂对污染物的去除效果。固定化过程中菌株的生长周期和底物的消耗速率都可能影响吸附时间,当菌株生长处于稳定期和需利用的底物量合适时,可提高载体上附着的菌体活性及数量。此外,吸附时间可影响微生物在载体上形成的生物膜,过长的吸附时间可能导致生物膜外层菌体的脱落,从而减少了沸石颗粒载体中菌株的数量。图8结果表明,固定化吸附时间可显著影响s2-氧化率,以及cod、nh3-n和tp的去除率。随着固定化吸附时间的延长,s2-氧化率,以及cod、nh3-n和tp的去除率呈现先上升后下降的趋势。因此,sp3固定化过程适宜的吸附时间为30~45h,更适宜为37.5~40h,最适宜的吸附时间为37.4~37.5h。
3、接种量对s2-氧化率的影响
固定化过程接种量对s2-氧化率的影响见9a所示。从图9a可见,随着菌体接种量的增加,固定化菌剂对s2-氧化率呈现先快速上升后逐渐平稳的变化趋势。当菌体接种量由0.01%增加至5%时,固定化菌剂对s2-的氧化率从7.3%快速提升为76.4%;随着菌体接种量继续增加至20%时,s2-的氧化率却保持平稳甚至略有下降。cod、nh3-n和tp去除率的变化趋势与s2-氧化率相似,如图9b所示。当菌体接种量由0.01%增加至5%时,cod、nh3-n和tp的去除率分别提高至27.8%、48.2%和26.3%;继续增加接种量,它们的去除率却保持平稳并皆略有下降。因此,sp3固定化过程适宜的接种量为5%~10%,最适宜的接种量为5%~6%。
4、载体添加量对s2-氧化率的影响
固定化载体添加量对s2-氧化率的影响如图10a所示。当载体添加量从0.01g提高至1g时,固定化菌剂对s2-的氧化率从13.0%显著提高到76.8%;而,随着载体添加量从1g继续提高至2g时,s2-的氧化率却降低为68.6%。黑臭水体中cod、nh3-n和tp的去除率随沸石颗粒添加量的变化见图10b所示。cod和tp的去除率均随着载体添加量的增加呈现先提高后下降的变化趋势,最高分别达到31.2%和30.8%。与cod和tp的去除率变化趋势不同,nh3-n的去除率随着沸石添加量从0.01g提高至1g而从7.7%快速增加至50.6%;当沸石添加量增加至2g时,nh3-n的去除率继续缓慢提高至60.7%。nh3-n的去除率随着载体添加量的增加而增加,这是因为人造沸石具有吸附nh3-n的功能。因此,sp3固定化过程适宜的载体添加量为0.5~2.0g,更适宜的添加量为1.0~1.5g,最适宜的载体添加量为1.0g。
5、响应面优化菌剂固定化组合条件
在固定化单因素实验的基础上,确定每个因素采用响应面优化的含量范围,设计4因素3水平的响应面优化试验,设计方案及相应的实验结果见表7所示。用designexpert8.0.6软件对表中数据进行多元回归拟合,得到s2-氧化率(y)对固定化初始ph(a)、吸附时间(b)、接种量(c)、载体添加量(d)的多元回归方程为:
y=82.23+1.54a+0.51b+1.65c+0.096d-3.14ab-3.06ac-1.93ad-2.73bc-2.31bd-1.66cd-4.62a2-4.05b2-5.78c2-4.75d2
表7响应面的box-behnken试验设计方案及结果
对上述多元回归模型进行方差分析,结果如表8所示。回归模型整体方差分析表明,f值为25.061,p远小于0.01,说明该模型是极显著的,有统计学意义。失拟合项方差分析表明,f值为8.043,p=0.0566,大于0.05,说明该模型合理,无需拟合更高次项方程,未知因素对实验结果干扰较小,无需引入更多的自变量。此外,该模型的决定系数为0.967,这表明回归方程与实际情况拟合较好,可较好地反映黑臭水体中s2-的氧化率与固定化初始ph值、吸附时间、接种量及载体添加量的关系。因此,该模型可用于分析和预测氧化黑臭水体中s2-的sp3菌体固定化组合条件。回归方程系数显著性检验结果表明,在模型中一次项a和c为极显著,而b和d都不显著;二次项a2、b2、c2、d2,以及交互项ab、ac、ad、bc、bd、cd皆为极显著。在回归方程中,一次项的回归系数绝对值从大到小的顺序为c、a、b和d,这表明在固定化组合条件下接种量对黑臭水体中s2-的氧化率影响最大,其次是固定化初始ph,继而是吸附时间和载体添加量。此外,二次项和交互项均处于极显著水平,这说明固定化初始ph值、吸附时间、接种量及载体添加量这4个固定化因素对s2-氧化率的影响存在二次项效应和交互效应,而不是简单的线性关系。
表8响应面回归模型方差分析
注:*p<0.05表示显著,**p<0.01表示极显著
依据前面回归模型的方差分析结果可知,各交互项均处于极显著水平。因此,利用软件designexpert8.0.6对回归方程进行响应面分析,得出所有交互项的响应面等高线图及其立体分析图,如图11所示。等高线越趋近于椭圆,说明两者的交互作用越显著;等高线越密集,对s2-氧化率影响越明显。在本发明中,所有等高线图均呈椭圆形,这进一步证明因素间存在显著的交互作用。由图11可见,在每个交互项中,当保持其中一个固定化因素不变的条件下,s2-氧化率均随着另一个固定化因素的提高呈现先上升后缓慢下降的趋势。然而,这6个交互项对s2-氧化率的影响大小呈现差异。其中,固定化初始ph值和吸附时间的交互作用对s2-氧化率的影响最大,见图11a和11b所示。当接种量和载体添加量分别为5.5%和1.0g时,在保持固定化初始ph值不变的条件下,s2-氧化率随着吸附时间的增加先缓慢上升后缓慢下降;但当保持吸附时间不变时,s2-氧化率随着固定化初始ph值的升高先上升后缓慢下降。
从图11可见,响应曲面图均呈现开口向下的钟罩形,即随着因素水平的增加,s2-氧化率呈现先增加后下降的趋势,存在极大值。利用design-expert8.0.6软件对拟合的二次方程以s2-氧化率最高为目标进行分析计算,获得sp3菌体最佳固定化组合条件:固定化初始ph值为8.14,吸附时间为37.35h,菌体接种量为6.02%,人造沸石载体添加量为0.98g。在此条件下sp3固定化菌剂对黑臭水体中s2-的氧化率预测值达到82.4%。基于方差分析结果,并结合实际操作的可行性,确定最佳的固定化组合条件为:固定化初始ph值为8.1,吸附时间为37.4h,菌体接种量为6.0%,以及人造沸石载体添加量为0.98g。为进一步验证响应面预测的结果,在上述最佳固定化条件下进行3次平行验证实验,结果表明s2-氧化率的平均值达到81.2%,与模型预测值82.4%比较接近,实际值拟合率达到99%以上,这表明模型预测值和实际值有良好的拟合性,优化模型可信度高。此外,与优化前未固定化的sp3菌体对实际黑臭水样中的s2-氧化率(55.8%)相比较,优化后的s2-氧化率(81.2%)提高了47.7%,这说明实验所确定的优化方案设计合理有效,所获得的sp3固定化菌剂可明显提高黑臭水体中s2-的氧化率。
采用扫描电镜分别对固定化前后的沸石颗粒进行微观结构表征,结果如图12所示。从图12a可见,未吸附菌剂的沸石颗粒表面较粗糙,构架中有较多的空腔及孔隙结构,比表面积大,具有较多的吸附位点,这有利于吸附和贮存微生物。从图12b可以观察到沸石颗粒表面附着的短杆状菌体,另有部分菌体在内壁连接成片状或团聚成块状,这是因为微生物通过新陈代谢分泌胞外物质再快速粘附在沸石颗粒表面并相互连接形成生物膜结构,促使菌体更牢固地附着在载体上。与未采用固定化处理的沸石颗粒相比,吸附微生物后的沸石颗粒表面变得更加平滑,孔隙结构不再那么明显且数量略有减少,这可能是因为微生物填充和覆盖了大部分沸石颗粒孔隙。
- 还没有人留言评论。精彩留言会获得点赞!