用于在乳腺癌患者中预测新辅助化疗疗效的标志物及其应用的制作方法
本发明属于癌症领域,具体地说,涉及用于在乳腺癌患者中预测新辅助化疗的疗效的标志物及其应用,尤其是luminal型乳腺癌对包含表柔比星和多西紫杉醇的新辅助化疗的疗效。
背景技术:
乳腺癌(bc)是女性中最常见的恶性肿瘤,约占全球癌症病例的25.2%和全球癌症相关死亡病例的14.7%。早期乳腺癌被认为是可以治愈的。新辅助化疗(nac)能增加乳腺癌保乳率,也能使部分不能手术的患者获得手术机会,已成为局部晚期乳腺癌患者的标准疗法。病理学完全缓解(pcr)被提议作为新辅助治疗中最常见的临床观察终点,并与患者的长期生存相关。her-2阳性和三阴性乳腺癌,pcr率可达60%或更高,但luminal型乳腺癌较低。
luminal型乳腺癌是一种高度内分泌反应性疾病,为雌激素受体(er)阳性和人表皮生长因子受体2(her-2)阴性,占所有bc的70%。尽管luminal型乳腺癌的pcr率较低,但部分患者可以从新辅助化疗中获益。此外,许多接受化疗的乳腺癌患者产生化疗药物耐药,其潜在机制尚未明确。目前,尚无明确的新辅助化疗疗效预测生物标志物,无法判断能从化疗中获益的潜在人群,这可能是患者对药物治疗反应不佳的原因之一。而er、pr受体的状态是临床疗效的主要预测标志之一。由于个体差异的存在,确定更有效的标记物以选择更合理的患者治疗方案至关重要。
目前,含有表柔比星和多西紫杉醇的方案是乳腺癌化疗的基石。然而,如上所述,化疗药物的耐药性是治疗乳腺癌的关键挑战,对于占据乳腺癌大部分的luminal型乳腺癌更是如此。乳腺癌细胞对表柔比星的反应与治疗的有效性密切相关,进而影响治疗方案的选择,并影响患者的预后。化疗药物敏感性的调节过程涉及诸多因素,特定的遗传或表观遗传的改变和与癌症相关的基因组可塑性是耐药性的基础,然而,潜在的分子机制尚未完全阐明。
既往研究表明,参与化疗药物代谢或作用的相关遗传易感基因,如果发生种系变异,可能会通过影响细胞凋亡能力来引起患者间的疗效差异。这些变体的鉴定可有助于促进患者的个体化治疗,并发现新的准确的生物标志物和药物靶标。表柔比星/多西紫杉醇反应基因的潜在调控遗传变异可能在luminal型乳腺癌新辅助化疗的病理反应中起重要作用。本研究试图寻找luminal型乳腺癌新辅助化疗反应的有效标志物。
技术实现要素:
我们整合了生物信息学方法,筛选可能调节表柔比星/多西紫杉醇反应基因的功能变异。然后,进行两阶段队列研究以鉴定候选变异与luminal型乳腺癌患者中表柔比星/多西紫杉醇nac的病理反应的关联。最后,进行生物学测定以确定遗传变异对包含表柔比星的新辅助化疗的疗效影响。
具体地,本发明提供了一种检测样本中abtb2表达水平的试剂在制备用于预测乳腺癌患者对新辅助化疗的反应性的工具中的应用,所述新辅助化疗是指包含表柔比星的化疗。
具体地,当与正常对照相比abtb2表达水平显著升高时,说明患者对表柔比星耐药。
具体地,abtb2通过抑制胱天蛋白酶-3的活化来增强肿瘤细胞对表柔比星的抗性。
还提供了检测样本中rs6484711的基因分型的试剂在制备用于预测乳腺癌患者对新辅助化疗的反应性的工具中的应用,所述新辅助化疗是指包含表柔比星和多西紫杉醇的化疗。
具体地,含rs6484711的等位基因a者对化疗的疗效显著降低。
具体地,rs6484711显著影响abtb2的表达水平,携带rs6484711的ga和aa基因型的患者,abtb2的表达显着高于具有gg基因型的患者。
优选地,本发明所述乳腺癌是luminal型乳腺癌。
优选地,检测样本中abtb2表达水平的试剂或检测样本中rs6484711的基因分型的试剂包括利用pcr、杂交测序方法,检测abtb2表达水平时所需的试剂。
优选地,利用pcr检测abtb2表达水平的试剂为如下引物对:abtb2-f:5'-tgcggcaagaacgccaatg-3'和abtb2-r:5'-acgggagaccaagtcactcagct-3'。
本发明提供一种预测乳腺癌患者对新辅助化疗的反应性的工具,其特征在于,所述工具包括检测abtb2表达水平的试剂和/或检测rs6484711基因分型的试剂,所述新辅助化疗是指包含表柔比星和多西紫杉醇的化疗。
此外,本发明还提供rs6484711在制备调节abtb2基因表达水平的试剂中的应用。
具体地,rs6484711的ga和aa基因型相对于gg基因型能显著提高abtb2的表达水平。
本发明具有以下积极效果:
1、本发明首次发现了rs6484711在预测包含化疗敏感性方面的重要价值,尤其是对于luminal型乳腺癌的新辅助化疗疗效的预测作用,尤其是基于表柔比星和多西紫杉醇的化疗。通过预测乳腺癌患者对新辅助化疗的反应性,从而有助于医生确定乳腺癌患者的化疗方案。
2、本发明首次发现了abtb2的表达与表柔比星的化学敏感性具有显著的负相关。这表明abtb2在肿瘤患者尤其是乳腺癌患者中对nac治疗的反应中起重要作用。
3、本发明首次发现rs6484711通过调节abtb2表达参与肿瘤细胞系的表柔比星抗性,并有望作为新治疗药物开发的目标。
4、通过提供预测乳腺癌患者尤其是luminal型乳腺癌患者对新辅助化疗的反应性,能够根据个体差异确定更有效的更合理的患者治疗方案。
附图说明
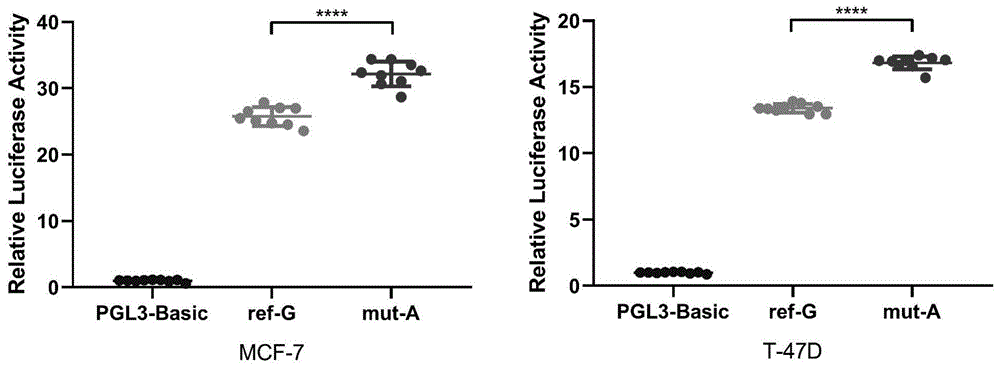
图1是在mcf-7(a)和t-47d(b)细胞中,发现包含不同rs6484711等位基因的片段驱动的相对报道基因表达。萤光素酶活性显示其表达水平相对于空载体(pgl3-basic)转染的细胞增加数倍。所有构建体均与prl-tk共转染,以标准化转染效率。所示数据为平均值±标准差。来自三个独立的实验,每个实验都有三个重复。****p<0.0001。
图2是rs6484711的eqtl分析。在乳腺癌组织中,abtb2mrna水平与rs6484711基因型相关(n=65)。携带rs6484711[ga]和[aa]基因型组织中的abtb2mrna水平显著高于rs6484711[gg]基因型(**p=0.004)。结果表示为平均值±标准差,p值来自两侧t检验。
图3是abtb2对表柔比星处理的mcf-7和t-47d细胞中细胞活力的影响。用pcdna-abtb2或对照载体转染24小时后,将mcf-7(a-b)和t-47d(c-d)细胞分别用表柔比星(分别为0.5μm和1.0μm)处理0、24、48和72h。(e-f)在两种用1.0μm表柔比星处理过乳腺肿瘤细胞系中检测的abtb2过表达细胞以及对照细胞中caspase-3活性。重复实验三次,均值±标准差。*p<0.05,**p<0.01,***p<0.001。
图4是通过gobo基因集分析(a)和kaplan-meier绘图仪数据库(b)分析abtb2的表达水平与er阳性乳腺癌的不良临床结果之间的相关性。
图5是rs6484711的潜在生物学功能特征。乳腺癌细胞和组织中的组蛋白修饰标记和dnase峰从encode项目获得;红色虚线是rs6484711的位置。(该图改编自washuepigenome浏览器)。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
下述实施例采用如下统计分析方式:pearson的χ2检验(对于分类变量)和student'st检验(对于连续变量)用于检查在人口统计学特征分布中具有不同临床结果的组之间的差异。通过pearsonχ2检验计算具有不同临床结局的组之间基因型频率的分布。在调整临床因素后,使用无条件多变量逻辑回归分析,通过比值比(or)和置信区间(95%ci)估计候选snp与新辅助化疗的反应之间的关联。所有p值均为双侧,p值小于0.05的差异被认为具有统计学意义。所有统计分析均由统计分析系统软件(版本8.2,sasinstitute,cary,nc)进行。
实施例1候选snp的筛选
1、候选snp的初步筛选
首先在cellminer数据库中筛选表柔比星(nci号256942)或多西他赛(nci号628503)的抗性/敏感性相关基因(http://discover.nci.nih.gov/cellminer/)。以皮尔逊相关系数与生长抑制值(gi50,细胞系灵敏度的测量指数)低于-0.4或高于0.4的基因表达为标准,得到284个表柔比星基因和228个多西紫杉醇基因。考虑到冗余,从中去除了511个基因并将其视为抗性或敏感性的潜在生物标志物。然后,我们从1000个基因组计划(http://www.1000genomes.org/)获得位于5kb上游的所有snp和具有次要等位基因频率(maf)>0.05的汉族中的基因。最后,应用annovar软件工具来注释遗传变异的功能,并将14个snp优先作为候选调控snp用于以下基因分型。候选snp的信息显示在表1中。
表1.14个候选调控snp
缩写:chr,染色体;maf,次要等位基因频率;chb,中国北京的汉族;tf,转录因子。a.pearson的相关系数基于60的人口规模。表柔比星(加粗)或多西他赛治疗的正相关和负相关比较(p<0.05)以正号或负号表示。b.转录因子由encode注释。
2、受试者的选择
在t1-4n1-3m0期(ajcc第7版)年龄>18岁的421名患者通过粗针穿刺组织病理学证实的luminal(her2阴性)型乳腺癌。探索队列(dc)为2015年1月至2016年12月在中国医学科学院肿瘤医院招募231名的乳腺癌患者,验证队列(rc)纳入2017年1月和2017年12月的190名患者,其中包括来自河北医科大学第四医院的95名患者和中国医学科学院肿瘤医院100名患者。根据st.gallen指南2013版,通过ihc(免疫组织化学)和fish结果确定患者的分子亚型。
将肿瘤组织进行免疫组化染色,er、pr阳性定义为er、pr染色≥10%的肿瘤细胞阳性。ki-67的百分比通过免疫组化确定(0至100)%。人类表皮生长因子受体-2(her2)在0至3+的范围内,her20-2+定义为her2阴性,ihc评分为3+时定义为her2的过表达。luminal乳腺癌定义为er和/或pr阳性,her2阴性。所有患者均为luminal型乳腺癌,方案为:表柔比星75mg/m2d1,多西紫杉醇75mg/m2d1,每21天为1个周期。每2周期完善乳腺磁共振成像评估治疗效果。病理完全缓解(pcr)定义为术后乳腺和腋窝淋巴结中肿瘤细胞完全消失,临床完全缓解(cr)定义为影像学上肿瘤病灶消失。在我们的研究中,将具有pcr、完全缓解(cr)和部分缓解(pr)反应的患者分为有效组,并将疗效评价为疾病稳定(sd)和疾病进展(pd)的患者分为无效组。dc中65.8%(152/231)的患者有腋窝淋巴结转移或者同侧锁骨区淋巴结转移,rc中有69.5%(132/190)。总共75.5%(318/421)患者,dc中77.5%(179/231)和rc中73.2%(139/190)疗效评估有效。总人群、探索队列(dc)、验证队列(rc)评价为疾病稳定或者进展的病人比率分别为24.5%(103/421),22.5%(52/231),26.8%(51/190)。
参与研究前每位参与者都签署了知情同意书。采集患者治疗前后的血样,收集患者人口统计学特征,包括年龄,产科病史,癌症的一级家族史以及疾病阶段,治疗,治疗反应和副作用等临床信息。并根据recist标准1.1版,并且通过nci-ctc3.0评分系统评估副作用数据。
该项目获得了中国医学科学院肿瘤医院和河北医科大学第四医院伦理委员会的批准。
结果:两阶段队列研究中患者的人口统计学特征见表2。在第1阶段,新辅助治疗的有效率为77.5%,有效组、无效组的中位年龄分别为47.9岁,无效组50.3岁,两组年龄分布匹配良好(p=0.112)。150例患者为浸润性导管癌(idc)i级,36例为idcii级,43例为idciii级,其余2例对应病理类型未知。有效组和无效组之间在绝经状态(p=0.337),淋巴结转移(p=0.368),骨髓抑制(p=0.085)和胃肠道副作用(p=0.546)方面无统计学差异。此外,在第2阶段新辅助治疗后观察到有效率为73.2%。除骨髓抑制外,其余特征在两组之间分布相似(p>0.05)。
表2.两阶段病人的临床病理特征
3、基因分型
使用relaxgeneblooddnasystemdp319-02(tiangen,beijing,china)从2ml外周血淋巴细胞中分离基因组dna。在研究的第1阶段中使用taqmanopenarray测定系统对14种候选变体进行基因分型。当探针设计失败或干扰反应系统中的其他聚合酶链反应引物时,候选snp被其高度连锁不平衡(ld)snp替代用于基因分型。每个96样品阵列芯片包含一个ntc(无模板dna)和一个重复样品以验证基因分型准确性。所有基因分型的候选snp的平均检出率>95%,并且重复组的一致率为100%。在验证阶段,通过taqman实时聚合酶链反应(pcr)测定(appliedbiosystems,fostercity,ca)或直接测序分析潜在snp,而不知道受试者的临床结果。来自有效组和无效组的大约5%的随机样品进行了两次基因分型,结果是100%一致。
结果:在阶段1中,如表3所示,在调整年龄,绝经状态,淋巴结转移和副作用后,通过非条件logistic回归评估具有治疗效果的snp之间的关联。与cg和gg基因型相比,rs1925368的cc基因型(与rs6484711完全ld)与化疗疗效差(隐性模型:or=0.39,95%ci=0.15-0.98,p=0.044)显著相关。与cc基因型相比,rs10747780(具有rs184301136的完整ld)的tt基因型也与疗效低显著相关(or=0.44,95%ci=0.22-0.89,p=0.023)。因此,选择这两个snp用于验证研究。在验证阶段,只有rs6484711变异体a等位基因与治疗效果差显著相关,or为0.36(95%ci=0.13-0.96,p=0.041),与第1阶段的结果一致(表4)。表5中的组合分析进一步证实了含rs6484711的等位基因a者对化疗的疗效显著降低(隐性模型,or=0.42,95%ci=0.23-0.78,p=0.006)。
表3.阶段1候选变异与新辅助化疗疗效的关系
缩写:hw,野生型纯合子;ht,杂合子;hv,纯合子变体;or,优势比;95%ci,95%置信区间。重要结果以粗体显示。
a.在校正年龄,更年期状态,淋巴结转移,骨髓抑制,胃肠道副作用后,通过无条件逻辑回归模型计算数据。
b.rs1925368代表rs6484711(r2=1);rs10747780代表rs184301136(r2=0.97).
表4.阶段2单核苷酸变异与新辅助化疗疗效的关系
a.在校正年龄,更年期状态,淋巴结转移,骨髓抑制,胃肠道副作用后,通过无条件逻辑回归模型计算数据。
表5.rs6484711与新辅助化疗疗效的关系
a.有效组包括对新辅助化疗有pcr,cr或pr反应的参与者;无效组包括sd和pd参加新辅助化疗的参与者。b.数据通过调整年龄,更年期状态,淋巴结转移,骨髓抑制,胃肠道副作用后,通过无条件逻辑回归模型计算。
实施例2、生物学验证
1、荧光素酶报告检测试验
质粒构建
将含有rs6484711[g]或rs6484711[a]的dna片段分别亚克隆到pgl3-basic载体(promega,usa)中。将abtb2的全长cdna亚克隆到pcdna3.1(+)载体(invitrogen,usa)中。合成所有重组质粒并由genewiz公司(中国苏州)验证序列。
细胞培养
人mcf-7和t-47dbc细胞系购自中国典型培养物保藏中心(中国武汉)。细胞系在dulbecco'smodifiedeagle'smedium(dmem)或roswellparkmemorialinstitute(rpmi)1640培养基(gibco,usa)中培养,补充有10%胎牛血清(fbs;gibco,usa)和1%抗生素(100u/ml青霉素和0.1mg/ml链霉素)在37℃,5%co2的湿润环境中。使用appliedbiosystemsampf/stridentifier试剂盒进行dna测序以常规测试所有细胞系,并测试细胞系不含支原体感染(mycoalert,usa)。
双荧光素酶报告基因检测
根据说明书,使用双荧光素酶报告试剂盒(promega)进行荧光素酶报告基因测定。将mcf-7和t-47d细胞接种在96孔板中24小时。随后,分别使用lipofectamine3000reagent(invitrogen)将具有不同等位基因rs6484711和阴性对照pgl3-basic载体的构建载体用prl-tkrenilla萤光素酶载体(promega)瞬时共转染到细胞中。转染24小时后测量荧光素酶活性。对于每个样品,通过萤火虫与海肾荧光素酶信号的比率计算相对活性。进行三次独立实验,并在每次实验中转染一式三份孔。
结果:由于非编码区中的变体可能与基因表达调控有关,因此我们用含有rs6484711的等位基因不同片段的pgl3-basic萤火虫荧光素酶表达载体进行双荧光素酶报告基因测定。将这些质粒转染到mcf-7和t-47d细胞中,结果显示细胞中相对荧光素酶活性显著不同(图1a和b),在这两种细胞系中,rs6484711[a]等位基因与rs6484711[g]等位基因相比具有更高的荧光素酶活性(p<0.0001)。这些结果表明rs6484711可以起到调节abtb2转录的启动子活性的作用。
2、表达数量性状基因座(eqtl)分析rs6484711对于abtb2表达的影响
根据说明书,使用trizollsreagent(invitrogen,carlsbad,ca,usa)从中国医学科学院肿瘤医院招募的65名luminal型患者的肿瘤组织中提取总rna,并立即通过使用逆转录为cdna(primescriptrtmastermix(日本京都takara))。使用powersybrgreenpcrmastermix(takara),按照abi7900实时pcr系统(appliedbiosystems,fostercity,ca,usa)上的sybr-green方法进行定量pcr(qpcr)。将abtb2表达标准化为gapdh的表达。qpcr中使用的引物如下:abtb2-f:5'-tgcggcaagaacgccaatg-3'和abtb2-r:5'-acgggagaccaagtcactcagct-3'。每个样本重复2次,以减少混杂变异。还从肿瘤组织中提取dna,并如上所述进行rs6484711的基因分型。
结果:通过进行eqtl分析以确定rs6484711是否与luminal型肿瘤组织中abtb2基因的mrna表达水平相关。结果如图2所示,rs6484711显著影响abtb2的表达水平(p=0.004,图2)。携带rs6484711的ga和aa基因型的患者,abtb2的表达显著高于具有gg基因型的患者。
3、abtb2对于乳腺癌细胞系表柔比星耐药的影响
细胞活力测定
将mcf-7和t-47d细胞接种并用含有全长abtb2cdna或pcdna3.1(+)载体(对照)的构建载体分别在12孔平底板(每孔1×105个细胞)中转染。孵育24小时后,通过胰蛋白酶消化细胞,接种在96孔板中37℃环境下过夜,每孔含有7×103个细胞。用不同浓度的表柔比星(medchemexpress)在培养基中处理细胞24,48和72小时。在每个时间点,根据说明书,使用cck-8试剂盒(dojindo,tokyo,japan)测量细胞活力。
细胞凋亡检测
用1.0μm表柔比星处理细胞24小时后,用上文所述cck-8方法测定细胞凋亡。用0-4℃磷酸盐缓冲盐水冲洗96孔板中的细胞,然后加入细胞裂解缓冲液(#7018,cellsignalingtechnology,danvers,ma,usa)。根据进行半胱天冬酶活性测定(caspase-3活性测定试剂盒#5723,cellsignalingtechnology,danvers,ma,usa)。用激发波长380nm和发射波长460nm测量荧光,并以相对荧光单位(rfu)表示。
结果:在过表达abtb2后,用表柔比星处理mcf-7和t-47d细胞一段时间。在暴露于0.5μm表柔比星时,mcf-7细胞活力降低。然而,与对照组相比,abtb2过表达的mcf-7细胞中细胞存活率显著增加(图3a)。此外,当用1.0μm表柔比星处理时,具有abtb2过表达的mcf-7细胞中表柔比星抗性更明显(图3b),在来自d2-d4的abtb2过表达的t-47d细胞系中也观察到一致的结果(图3c,3d)。
此外,为了探索abtb2是否有助于增强对表柔比星诱导的细胞凋亡的抗性,我们评估了在表柔比星存在下mcf-7和t-47d细胞中的胱天蛋白酶-3活性。过量表达abtb2后,用1.0μm表柔比星处理细胞24h,我们检测到表柔比星显著激活了两种细胞系中的caspase-3。但是与对照组相比,用abtb2转染的细胞显着抑制了胱天蛋白酶-3的活化(图3e,3f)。因此,abtb2过表达明显增强了mcf-7和t-47d细胞对表柔比星的抗性。
此外,我们通过gobo基因集分析观察到abtb2表达与560名er阳性乳腺癌患者的总生存期相关(图4a),并且在kaplan-meierplotter数据库中发现了类似的结果(图4b),这表明abtb2与er+肿瘤的进展和不良预后相关。因此,我们的结果表明,abtb2作为抗药性蛋白质负面影响表柔比星诱导的细胞凋亡,并介导mcf-7和t-47d细胞中表柔比星的耐药性。
总结:通过基于人群的两阶段关联分析,我们发现携带rs6484711的a等位基因的患者与g等位基因携带者相比治疗效果差。rs6484711是指导个体化治疗nac的潜在标志物。通过生物信息学分析,rs6484711位于组蛋白标记的chip-seq峰中,如h3k4me3和h3k27ac,以及活性染色质可及性(图5),这表明rs6484711可能具有潜在的启动子样作用。这与报告基因测定一致,rs6484711a等位基因通过激活基因启动子调节基因表达,而g等位基因并未观察到此类作用。eqtl分析是估计候选基因的表达水平是否受变体影响的有效策略,由此可解释了非编码变体的生物学相关性。肿瘤组织中相关性分析的基因型依赖性分析表明rs6484711多态性对abtb2的表达具有调节作用。总之,这些结果表明rs6484711的功能性启动子元件通过调节abtb2显著干扰了肿瘤细胞对含表柔比星方案nac的反应。
我们检测到abtb2的表达与表柔比星的化学敏感性具有显着的负相关(r=-0.418)。这表明abtb2可能在肿瘤对nac治疗的反应中起重要作用。abtb2基因编码的蛋白质产物是锚蛋白重复序列和含有btb/poz结构域的蛋白质。在本研究中,我们发现abtb2的过表达可通过减少细胞凋亡来促进细胞对表柔比星的耐药性。总之,本研究证明rs6484711的变体通过调节abtb2表达参与mcf7和t47d细胞系的表柔比星抗性。我们的研究结果加深了对遗传变异在乳腺癌细胞化疗耐药中的作用的认识,并提示rs6484711在预测化疗敏感性方面的重要价值,这有助于补充新辅助化疗的适应症,并有望作为新治疗药物开发的目标。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!