新型吡咯化合物的制作方法
1.本发明属涉及药物化学领域,更具体而言,涉及一类新型吡咯化合物,及其制备方法和该类化合物的用途。
背景技术:
2.侵袭性真菌感染(invasive fungal infections,ifi)已经成为危害人类健康的严重威胁之一,全球年均死亡超过一百五十万人。虽然,真菌感染也可发生于健康人群,大部分真菌感染源于免疫力低下的病人,因此靶向真菌的抗真菌药物是治疗ifi的主要手段。随着免疫抑制剂的使用、肿瘤放化疗、体内置管及久驻icu病人的增加,ifi逐年上升的发病率与致死率正越来越多地引起人们的关注。然而,临床上常用的抗真菌药物较为有限,主要包括氮唑类、多烯类、棘白菌素类以及5-氟胞嘧啶等[biochem pharmacol,2017,133:86-96.]。
[0003]
氮唑类是目前最常用的一类抗真菌药物,根据化学结构可分为咪唑类和三氮唑类。咪唑类药物(咪康唑、酮康唑等)开发最早,抗真菌活性也较高,但由于毒性较大而局限于外用。三氮唑类药物出现较晚,可体内给药治疗ifi,主要通过细胞色素p450酶依赖性机制抑制14-α羊毛甾醇脱甲酶(cyp51)。抑制真菌细胞膜中的羊毛甾醇转化为麦角甾醇,并使毒性的甾醇在真菌细胞中累积,从而抑制真菌的生长和复制。唑类药物面临的主要问题为耐药和其对人体中cyp51的同源酶体(cyp3a4、cyp2c9等)抑制。易于引起与多种药物相互作用。多烯类药物仅对其外膜中含有固醇的真菌有效,其确切抗真菌机制仍不十分清楚。多烯烃类药物中两性霉素b是目前最有效的抗ifi药物,但它具有严重的发热、寒战、肾毒性等毒副作用[med mycol,2017,55(1):118-124.]。棘白菌素类化合物通过抑制-glucan进而抑制细胞壁的合成。临床常用的棘白菌素类药物仅卡泊芬净、米卡芬净、阿尼芬净三种,它们的抗菌谱较窄,对隐球菌无效,且难以通过胃肠道吸收,仅能通过每日一次静脉滴注给药维持体内药物浓度。此外由于基因突变导致对棘白菌素耐药真菌的出现,也限制了此类药物的使用[lancet,2003,362(9390):1142-1151.]。5-氟胞嘧啶是rna,dna的主要组分之一嘧啶的类似物。其主要通过干扰细胞内嘧啶的代谢,以及dna,rna,继而蛋白的合成抑制细胞的生长。除了以上所述的四大类抗菌药以外,wo2009/130481公开了一类新型的吡咯化合物也具有较强的抗真菌活性。
[0004]
由上可见,药物治疗是应对ifi的主要策略,然而有限的药物种类、日渐严重的耐药性和毒副作用等问题,使得研发抗真菌新药的需求变得愈加迫切,临床急需新型的抗真菌药物,给患者带来积极的治疗效果。
技术实现要素:
[0005]
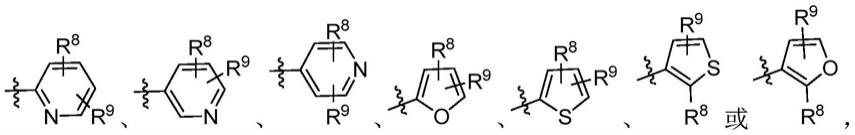
本发明旨在提供一类结构通式如式(1)所示的化合物、或其各光学异构体、各晶型、药学上可接受的盐、水合物或溶剂合物:
pr、
t-bu、
i-bu、bu、
[0023]
其中r
10
和r
11
独立地为h、卤素、c1-c3烷基、c3-c6环烷基、c1-c3烷氧基、卤素取代c1-c3烷基或卤素取代c1-c3烷氧基。
[0024]
本发明的一些方案中,上述化合物、异构体或药学上可接受的盐,其选自:
[0025]
[0026][0027]
本发明的另一个目的是提供了一种药物组合物,它含有药理上可接受的赋形剂或载体,以及本发明通式(1)化合物、或其各光学异构体、药学上可接受的无机或有机盐做为活性成分。
[0028]
本发明的再一个目的提供了本发明的上述化合物、或其各光学异构体、药学上可接受的无机或有机盐用于制备治疗真菌感染相关疾病中的应用。
[0029]
应理解,本发明的前述一般性描述和以下详细描述都是示例性和说明性的,旨在提供对所要求保护的本发明的进一步说明。
[0030]
定义和说明
[0031]
除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定或不清楚的,而应该按照普通的定义去理解,当本文中出现商品名称是,意在指代其对应的商品或其活性成分。这里所采用的术语“药学上可接受的”,是针对那些化合物、组合物和/或制剂而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
[0032]
术语“药学上可接受的盐”指一种化合物的存在形式,该形式不会引起对给药有机体的重要的刺激,且不会使化合物的生物活性和性质消失。在某些具体方面,药学上可接受的盐是通过式(1)化合物与酸反应获得,如盐酸、氢溴酸、氢氟酸、硫酸、磷酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、三氟乙酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯磺酸、对甲苯磺酸等有机酸以及天冬氨酸、谷氨酸等酸性氨基酸。
[0033]
应理解药学上可接受的盐的参考包括溶剂添加形式或结晶形式,尤其是溶剂化物或多晶型。溶剂化物含有化学计量或非化学计量的溶剂,且是在与药学上可接受溶剂如水,乙醇等,结晶化过程中选择性形成的。当溶剂是水时形成水合物,或当溶剂是乙醇时形成醇化物。式(1)化合物的溶剂化物按照本文所述的方法,很方便的制得或形成。举例说明,式
c3)烷基连接形成的基团,并通过(c1-c3)烷基与母体部分键接。
[0043]“芳基”是芳族单环或多环系统。优选的芳基包括但不限于苯基。“杂芳基”是指含有一个或多个环原子的芳族单环或多环基团。优选的5-10元杂芳基包括但不限于吡啶基、吡嗪基、呋喃基、噻吩基、嘧啶基、吡啶酮、噁唑基、异噻唑基、噁唑基、噁二唑基、噻唑基、噻二唑基、吡唑基、呋咕基(furazanyl)、吡咯基、三唑基、1,2,4-噻二唑基、哒嗪基、喹喔啉基、酞嗪基、羟吲哚基、咪唑并[1,2-a]吡啶基、咪唑并[2,1-b]噻唑基、苯并呋咕基(benzofurazanyl)、吲哚基、氮杂吲哚基、苯并咪唑基、苯并噻吩基、喹啉基、咪唑基、噻吩并吡啶基、喹唑啉基、噻吩并嘧啶基、吡咯并吡啶基、咪唑并吡啶、异喹啉基、苯并吖嗪基、1,2,4-三嗪基、苯并噻唑基其氧化物等。
[0044]
除非另有规定,术语“杂环烷基”指由碳原子以及选自氮、氧或硫等杂原子组成的饱和或部分饱和的非芳香环状基团,此环状基团可为单环或多环基团,在本发明中,杂环烷基中杂原子个数优选1、2、3或4,杂环烷基中的氮、碳或硫原子可人选地被氧化。氮原子可任选地进一步被其它基团取代而形成叔胺或季铵盐。杂环烷基的实例包括但不限于:氮丙啶基、氮杂环丁烷-1-基、n-烷基氮杂环丁烷-3-基、四氢呋喃
--
2基、四氢呋喃-3-基、吗啉-4基、硫代吗啉-4-基、硫代吗啉-s-氧化物-4-基、哌啶-1-基、n-烷基哌啶-4-基、吡咯烷-1-基、n-烷基吡咯烷-2-基、哌嗪-1-基、4-烷基哌嗪-1-基等。
[0045]
除非另有规定,术语“卤素取代”或“卤素”本身或作为另一取代基的一部分表示氟、氯、溴或碘原子。此外,“卤代烷基”意在包括单卤代烷基或多卤代烷基。例如“卤代c1-c3烷基”意在包括但不限于三氟甲基、2,2,2-三氟乙基、2-氯丙基和3-溴丙基等等。
[0046]
术语“元环”包括任何环状结构。术语“元”意为表示构成环的骨架原子的数量。例如,环己基、吡啶基、吡喃基、噻喃基是六元环,环戊基、吡咯基、呋喃基和噻吩基是五元环。
[0047]
术语“片断”指分子的具体部分或官能团。化学片断通常被认为是包含在或附在分子中的化学实体。
[0048]
化合物的合成
[0049]
下面具体地描述本发明式(1)化合物的制备方法,但这些具体方法不对本发明构成任何限制。
[0050]
以上说明的式(1)化合物可使用标准的合成技术或公知的技术与文中结合的方法来合成。此外,在此提到的溶剂,温度和其他反应条件可以改变。用于表1化合物的合成的起始物料可以由合成或从商业来源上获得,如,但不限于aldrich chemical co.(milwaukee,wis.)或sigma chemical co.(st.louis,mo.)。本文所述的化合物和其他具有不同取代基的有关化合物可使用公知的技术和原料来合成,包括发现于march,advanced organic chemistry 4
th ed.,(wiley 1992);carey和sundberg,advanced organic chemistry 4
th ed.,vols.a和b(plenum 2000,2001),green和wuts,protective groups in organic synthesis 3
rd ed.,(wiley1999)中的方法。化合物制备的一般方法可通过使用适当的试剂和在此提供的分子式中引入不同基团的条件来改变。
[0051]
一方面,本文所述的化合物根据工艺中公知的方法。然而方法的条件,例如反应物、溶剂、碱、所用化合物的量、反应温度、反应所需时间等不限于下面的解释。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便的制得,这样的组合可由本发明所属领域的技术人员容易的进行。一方面,本发明还提供了一种
所述的式(1)所示化合物的制备方法,其采用下列方法a制备:
[0052]
方法a包含下列步骤:首先化合物a1和化合物a2在碱性条件下反应生成化合物a3,化合物a3进一步在强碱作用下反应生成化合物a4,化合物a4脱除保护基得到化合物a5,化合物a5和合适的原料反应得到化合物a7,最后化合物a7和a8进行感应得到目标化合物a9。
[0053][0054]
上述反应方程式中,w、r1、r2、r3、r4、r5和r7的定义如前所述。
[0055]
本发明提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
[0056]
在下面的说明中将会详细阐述上述化合物、方法、药物组合物的各个具体方面、特性和优势,使本发明的内容变得十分明了。在此应理解,下述的详细说明及实例描述了具体的实施例,仅用于参考。在阅读了本发明的说明内容后,本领域的技术人员可对本发明作各种改动或修改,这些等价形势同样落于本申请所限定的范围。
[0057]
所有实施例中,1h-nmr用vian mercury 400核磁共振仪记录,化学位移以δ(ppm)表示;分离用硅胶未说明均为200-300目,洗脱液的配比均为体积比。
[0058]
本发明采用下述缩略词:acn代表乙腈;ar代表氩气;cdcl3代表氘代氯仿;cd3od代表氘代甲醇;(cocl)2代表草酰氯;dcm代表二氯甲烷;dipea代表二异丙基乙基胺;diox或dioxane代表1,4-二氧六环;dmf代表二甲基甲酰胺;dmso代表二甲基亚砜;ea或etoac代表乙酸乙酯;etoh代表乙醇;h代表小时;h2代表氢气;hoac代表乙酸;k2co3代表碳酸钾;ki代表碘化钾;k3po4代表磷酸钾;lc-ms代表液相-质谱;lioh代表氢氧化锂;ml代表毫升;meoh代表甲醇;mgcl2代表氯化镁;min代表分钟;ms代表质谱;nabh(oac)3代表三乙酰氧基硼氢化钠;nah代表氢化钠;nano2代表亚硝酸钠;na2so4代表硫酸钠;nmr代表核磁共振;pd2(dba)3代表三(二亚苄基丙酮)二钯;pe代表石油醚;socl2代表二氯亚砜;
t-buona代表叔丁醇钠;tea代表三乙胺;thf代表四氢呋喃;toluene代表甲苯;tscl代表对甲苯磺酰氯;xantphos代表4,
5-双二苯基膦-9,9-二甲基氧杂蒽。
具体实施方式
[0059]
实施例1:化合物1
[0060][0061]
合成路线:
[0062][0063]
步骤1:化合物1-1的合成
[0064]
将3-羟甲基哌嗪-1-甲酸叔丁酯(1.0g,4.63mmol)和1,2-二氟-4-硝基苯(809mg,5.1mmol)溶于dmf(20ml)中,加入dipea(1.8g,13.89mmol),升温至120℃反应过夜,lc-ms监测反应完毕后,反应体系加入水(100ml),ea(50ml*2)萃取,合并有机相,有机相用饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=10/1to 5/1)得到黄色固体化合物(600mg,收率60%),esi-ms m/z:356.1[m+h]
+
。
[0065]
步骤2:化合物1-2的合成
[0066]
将化合物1-1((3.6g,10mmol)溶于dmf(30ml)中,冰盐浴,加入nah(60%含量,440mg,11mmol),升温至80℃反应过夜,lc-ms监测反应完毕,冷却,倒入冰水(100ml)中,ea(50ml*2)萃取,合并有机相,有机相用水洗(150ml*2),饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 10/1)得到黄色固体化合物(2.1g,收率62%),esi-ms m/z:336.1[m+h]
+
。
[0067]
步骤3:化合物1-3的合成
[0068]
将化合物1-2(2.0g,6.0mmol)溶于ea(40ml)中,加入hcl/二氧六环溶液(4.0m,
10ml),r.t.搅拌3h,lc-ms监测反应完毕,直接浓缩,得到黄色固体粗产物(2.0g,收率100%),未经纯化并直接投入下一步反应,esi-ms m/z:236.1[m+h]
+
。
[0069]
步骤4:化合物1-4的合成
[0070]
将上步所得粗产物1-3(2.0g,6.0mmol)悬浮于二甘醇二甲醚(20ml),加入2-氯-5-氟嘧啶(875mg,6.6mmol),无水k2co3(4.15g,30mmol),升温100℃反应6h,lc-ms监测反应完毕,冷却,过滤,所得滤饼用冷水(10ml)打浆,过滤,所得滤饼用水洗和pe洗,干燥,得到黄色固体(1.6g,收率80%),esi-ms m/z:332.1[m+h]
+
。
[0071]
步骤5:化合物1-5的合成
[0072]
将上步所得粗产物1-4(1.6g,4.8mmol)溶于meoh中(20ml),加入pd/c(10%,200mg),于r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体(1.1g,收率79%),esi-ms m/z:302.1[m+h]
+
。
[0073]
步骤6:化合物1的合成
[0074]
将上步所得粗产物1-5(300mg,1mmol)溶于dcm中(20ml),加入tea(202mg,2.0mmol),ar保护,冰盐浴冷却至0℃,滴加2-(1,5-二甲基-3-苯基-1h-吡咯-2-基)-2-氧代乙酰氯(合成参见wo2009130481,314mg,1.2mmol)的dcm溶液,加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(260mg,收率49%)。
[0075]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),8.79(s,2h),7.55-7.43(m,5h),7.17-7.08(m,2h),6.79(d,j=8.9hz,1h),6.32(s,1h),4.58(dd,j=12.1,1.5hz,1h),4.21(d,j=11.5hz,1h),3.87(t,j=9.8hz,1h),3.78(s,3h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.79(d,j=12.1,2h),2.61-2.51(m,2h),2.19(s,3h);esi-ms m/z:527.2[m+h]
+
.
[0076]
通过不同的手性原料或者手性分离的方法,可以得到化合物1的两个光学异构体,其结构式如下:
[0077][0078]
实施例2:化合物2
[0079][0080]
合成路线:
[0081][0082]
步骤1:化合物2-1的合成
[0083]
将化合物1-3(705mg,3.0mmol),2-溴-4,6-二甲基吡啶(670mg,3.6mmol),叔丁醇钠(721mg,7.5mmol),binap(187mg,0.3mmol)溶于toluene(50ml)中,ar保护下,升温100℃反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,柱层析(pe/ea=10/1to 2/1)纯化,得到黄色固体(360mg,收率35%),esi-ms m/z:341.1[m+h]
+
。
[0084]
步骤2:化合物2-2的合成
[0085]
将上步所得粗产物2-1(360mg,1.06mmol)溶于meoh中(20ml),加入pd/c(10%,50mg),通入h2于r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体粗产物(270mg,收率82%),esi-ms m/z:311.1[m+h]
+
。
[0086]
步骤3:化合物2的合成
[0087]
将上步所得粗产物2-2(250mg,0.8mmol)溶于dcm中(20ml),加入tea(162mg,1.6mmol),ar保护,冰盐浴冷却至0℃,滴加2-(1,5-二甲基-3-苯基-1h-吡咯-2-基)-2-氧代乙酰氯(合成参见wo2009130481,261mg,1mmol)的dcm溶液,加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(ch2cl2/meoh=100/1to 20/1)纯化,得到浅黄色固体(160mg,收率37%)。
[0088]1h nmr(400mhz,dmso-d6)δ:10.20(s,1h),7.54-7.42(m,5h),7.16-7.06(m,2h),6.78(d,j=8.9hz,1h),6.66(s,1h),6.40(s,1h),6.25(s,1h),4.54(dd,j=11.5,1.5hz,1h),4.25(d,j=11.5hz,1h),3.89(t,j=9.8hz,1h),3.76(s,3h),3.60(d,j=11.6hz,1h),2.9(t,j=9.9hz,1h),2.76(d,j=11.9hz,2h),2.65-2.50(m,5h),2.45(s,3h),2.19(s,
3h);esi-ms m/z:536.2[m+h]
+
.
[0089]
通过不同的手性原料或者手性分离的方法,可以得到化合物2的两个光学异构体,其结构式如下:
[0090][0091]
实施例3:化合物3
[0092][0093]
以2-溴-6-甲基吡啶代替2-溴-4,6-二甲基吡啶为原料,采用实施例2相似的合成方法,得到化合物3。
[0094]1h nmr(400mhz,dmso-d6)δ:10.22(s,1h),7.56-7.41(m,6h),7.15(s,1h),7.04(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),6.67(d,j=8.9hz,1h),6.41(d,j=8.9hz,1h),6.24(s,1h),4.55(dd,j=11.5,1.5hz,1h),4.26(d,j=11.5hz,1h),3.88(t,j=9.8hz,1h),3.80(s,3h),3.63(d,j=11.6hz,1h),2.95(t,j=9.9hz,1h),2.77(d,j=11.7hz,2h),2.62-2.51(m,2h),2.45(s,3h),2.19(s,3h);esi-ms m/z:522.2[m+h]
+
.
[0095]
实施例4:化合物4
[0096][0097]
以2-氯嘧啶代替2-氯-5-氟嘧啶为原料,采用实施例1相似的合成方法,得到化合物4。
[0098]1h nmr(400mhz,dmso-d6)δ:10.23(s,1h),8.50(d,j=9.3hz,2h),7.56-7.43(m,5h),7.13(s,1h),7.02(d,j=8.8hz,1h),6.87-6.80(m,2h),6.25(s,1h),4.52(dd,j=11.0,1.5hz,1h),4.23(d,j=11.2hz,1h),3.86(t,j=9.8hz,1h),3.81(s,3h),3.62(d,j=
11.5hz,1h),2.96(t,j=9.9hz,1h),2.80(d,j=11.7hz,2h),2.65-2.53(m,2h),2.19(s,3h);esi-ms m/z:509.2[m+h]
+
.
[0099]
实施例5:化合物5
[0100][0101]
以2-溴吡啶代替2-溴-4,6-二甲基吡啶为原料,采用实施例2相似的合成方法,得到化合物5。
[0102]1h nmr(400mhz,dmso-d6)δ:10.22(s,1h),8.12(d,j=9.5hz,1h),7.56-7.41(m,6h),7.15(s,1h),7.04(d,j=8.9hz,1h),6.83-6.73(m,2h),6.63(d,j=8.9hz,1h),6.24(s,1h),4.53(dd,j=11.2,1.5hz,1h),4.25(d,j=11.3hz,1h),3.87(t,j=9.8hz,1h),3.79(s,3h),3.62(d,j=11.0hz,1h),2.96(t,j=9.9hz,1h),2.78(d,j=11.7hz,2h),2.62-2.53(m,2h),2.18(s,3h);esi-ms m/z:508.2[m+h]
+
.
[0103]
实施例6:化合物6
[0104][0105]
合成路线:
[0106][0107]
步骤1:化合物6-1的合成
[0108]
将化合物1-3(705mg,3.0mmol),异丁醛(325mg,4.5mmol),溶于1,2-二氯乙烷(30ml)中,加入hoac,r.t.搅拌1h,加入nabh(oac)3,于r.t.反应过夜,lc-ms监测反应完毕,加入dcm稀释,用饱和aq nahco3液洗,分液,有机相浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化,得到黄色固体(350mg,收率40%),esi-ms m/z:292.1[m+h]
+
。
[0109]
步骤2:化合物6-2的合成
[0110]
将上步所得粗产物6-1(300mg,1.03mmol)溶于meoh中(20ml),加入pd/c(10%,60mg),通入h2于r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体(200mg,收率74%),esi-ms m/z:262.1[m+h]
+
。
[0111]
步骤3:化合物6的合成
[0112]
将上步所得粗产物6-2(200mg,0.76mmol)溶于dcm中(20ml),加入tea(162mg,1.6mmol),ar保护,冰盐浴至0℃,滴加2-(1,5-二甲基-3-苯基-1h-吡咯-2-基)-2-氧代乙酰氯(合成参见wo2009130481,260mg,1mmol)的dcm溶液,加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(120mg,收率32%)。
[0113]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),7.54-7.42(m,5h),7.11(s,1h),7.03(d,j=9.5hz,1h),6.78(d,j=9.4hz,1h),6.25(s,1h),4.54(dd,j=11.5,1.5hz,1h),4.25(d,j=11.5hz,1h),3.89(s,3h),3.21-3.15(m,1h),2.96(t,j=9.9hz,1h),2.76(d,j=11.9hz,2h),2.61-2.50(m,2h),2.19(s,3h),2.09-2.00(m,2h),1.65-1.55(m,2h),0.91(ss,6h);esi-ms m/z:487.2[m+h]
+
.
[0114]
实施例7:化合物7
[0115][0116]
以环丙甲醛代替异丁醛为原料,采用实施例6相似的合成方法,得到化合物7。
[0117]1h nmr(400mhz,dmso-d6)δ:10.23(s,1h),7.55-7.43(m,5h),7.12(s,1h),7.02(d,j=9.5hz,1h),6.79(d,j=9.4hz,1h),6.24(s,1h),4.53(dd,j=11.5,1.5hz,1h),4.23(d,j=11.5hz,1h),3.87(s,3h),3.21-3.13(m,1h),2.95(t,j=9.9hz,1h),2.74(d,j=11.9hz,2h),2.61-2.52(m,2h),2.18(s,3h),2.09-2.01(m,2h),1.63-1.53(m,1h),1.15-1.23(m,1h),0.55-0.45(m,2h),0.32-0.23(m,2h);esi-ms m/z:485.2[m+h]
+
.
[0118]
实施例8:化合物8
[0119][0120]
以特戊醛代替异丁醛为原料,采用实施例6相似的合成方法,得到化合物8。
[0121]1h nmr(400mhz,dmso-d6)δ:10.24(s,1h),7.54-7.43(m,5h),7.10(s,1h),7.01(d,j=9.5hz,1h),6.77(d,j=9.4hz,1h),6.25(s,1h),4.52(dd,j=11.5,1.5hz,1h),4.24(d,j=11.5hz,1h),3.86(s,3h),3.20-3.12(m,1h),2.92(t,j=9.9hz,1h),2.72(d,j=11.9hz,2h),2.60-2.49(m,2h),2.17(s,3h),2.10-2.01(m,2h),1.65-1.52(m,1h),1.15-1.02(m,9h);esi-ms m/z:501.2[m+h]
+
.
[0122]
实施例9:化合物9
[0123][0124]
以2,4,5-三氟硝基苯代替3,4-二氟硝基苯为原料,采用实施例1相似的合成方法,得到化合物9。
[0125]1h nmr(400mhz,dmso-d6)δ:10.28(s,1h),8.78(s,2h),7.53-7.42(m,5h),7.06(s,1h),6.93(d,j=10.2hz,1h),6.30(s,1h),4.57(dd,j=11.1,1.5hz,1h),4.21(d,j=11.5hz,1h),3.86(t,j=9.7hz,1h),3.79(s,3h),3.65(d,j=11.6hz,1h),2.95(t,j=9.9hz,1h),2.78(d,j=12.1,2h),2.61-2.52(m,2h),2.19(s,3h);esi-ms m/z:545.2[m+h]
+
.
[0126]
实施例10:化合物10
[0127][0128]
以2-硝基-4,5-二氟toluene代替3,4-二氟硝基苯为原料,采用实施例1相似的合成方法,得到化合物10。
[0129]1h nmr(400mhz,dmso-d6)δ:10.26(s,1h),8.78(s,2h),7.53-7.43(m,5h),7.03(s,
1h),6.87(s,1h),6.26(s,1h),4.57(dd,j=11.1,1.5hz,1h),4.21(d,j=11.5hz,1h),3.86(t,j=9.7hz,1h),3.79(s,3h),3.65(d,j=11.6hz,1h),2.95(t,j=9.9hz,1h),2.78(d,j=12.1,2h),2.61-2.50(m,2h),2.19(s,3h),2.11(s,3h);esi-ms m/z:541.2[m+h]
+
.
[0130]
实施例11:化合物11
[0131][0132]
以2-硝基-4,5-二氟苯甲醚代替3,4-二氟硝基苯为原料,采用实施例1相似的合成方法,得到化合物11。
[0133]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),8.77(s,2h),7.53-7.42(m,5h),7.09(s,1h),6.55(s,1h),6.26(s,1h),4.58(dd,j=11.2,1.5hz,1h),4.22(d,j=11.5hz,1h),3.87-3.82(m,4h),3.79(s,3h),3.65(d,j=11.5hz,1h),2.95(t,j=9.5hz,1h),2.78(d,j=11.6,2h),2.62-2.50(m,2h),2.17(s,3h);esi-ms m/z:557.2[m+h]
+
.
[0134]
实施例12:化合物12
[0135][0136]
合成路线:
[0137]
[0138]
步骤1:化合物12-1的合成
[0139]
将4-(2-氟-4-硝基苯)-3-(羟甲基)哌嗪-1-甲酸叔丁酯(3.55g,10mmol)溶于dcm(50ml)中,加入dipea(2.6g,20mmol),加入tscl(2.3g,12mmol),加毕,r.t.搅拌反应过夜,lc-ms监测,反应完毕,到入水(50ml)中,分液,水层用dcm(30ml)萃取,合并有机相,有机相用水(50ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(pe/ea=20/1to 5/1),得到浅黄色胶状物(4.0g,收率78%),esi-ms m/z:510.1[m+h]
+
。
[0140]
步骤2:化合物12-2的合成
[0141]
将化合物12-1(1.4g,2.75mmol)溶于etoh(20ml)中,加入甲胺醇溶液(25%~30%,1.8g,ca.55mmol),于封管中80℃反应过夜,lc-ms监测反应完毕,浓缩,残留物经柱层析(pe/ea=5/1to 1/1)纯化,得到黄色胶状物(480mg,收率50%),esi-ms m/z:349.1[m+h]
+
。
[0142]
步骤3:化合物12-3的合成
[0143]
将化合物12-2(3.48g,10.0mmol)溶于ea(50ml)中,加入hcl/二氧六环(4.0m,15ml),于r.t.搅拌3h,lc-ms监测反应完毕,直接浓缩,得到黄色固体化合物(3.5g,收率100%),未经纯化并直接投入下一步反应,esi-ms m/z:249.1[m+h]
+
。
[0144]
步骤4:化合物12-4的合成
[0145]
将上步所得粗产物12-3(2.1g,6.0mmol)悬浮于二甘醇二甲醚(20ml),加入2-氯-5-氟嘧啶(875mg,6.6mmol),无水k2co3(4.15g,30mmol),升温100℃反应6h,lc-ms监测反应完毕,冷却,过滤,所得滤饼用冷水(10ml)打浆,过滤,所得滤饼用水洗和pe洗,干燥,得到黄色固体(1.5g,收率72%),esi-ms m/z:345.1[m+h]
+
。
[0146]
步骤5:化合物12-5的合成
[0147]
将上步所得粗产物12-4(1.5g,4.36mmol)溶于甲醇中(20ml),加入pd/c(10%,200mg),通入h2于r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体(1.0g,收率73%),esi-ms m/z:315.1[m+h]
+
。
[0148]
步骤6:化合物12的合成
[0149]
将上步所得粗产物12-5(167mg,0.5mmol)溶于dcm中(15ml),加入tea(101mg,1.0mmol),ar保护,冰盐浴冷却至0℃,滴加2-(1,5-二甲基-3-苯基-1h-吡咯-2-基)-2-氧代乙酰氯(合成参见wo2009130481,167mg,0.6mmol),加毕,r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(100mg,收率37%)。
[0150]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),8.76(s,2h),7.55-7.43(m,5h),6.71-6.65(m,3h),6.25(s,1h),3.86(s,3h),3.64(d,j=12.3hz,1h),3.22-3.11(m,2h),3.02(d,j=10.1hz,2h),2.97-2.81(m,3h),2.75-2.65(m,4h),2.19(s,3h);esi-ms m/z:540.2[m+h]
+
.
[0151]
通过不同的手性原料或者手性分离的方法,可以得到化合物12的两个光学异构体,其结构式如下:
[0152][0153]
实施例13:化合物13
[0154][0155]
合成路线:
[0156][0157]
步骤1:化合物13-1的合成
[0158]
将化合物12-3(745mg,3.0mmol),2-溴-4,6-二甲基吡啶(670mg,3.6mmol),叔丁醇钠(721mg,7.5mmol),binap(187mg,0.3mmol)溶于toluene(50ml)中,ar保护下,升温100℃反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,柱层析(pe/ea=10/1to 3/1)纯化,得到黄色固体(300mg,收率28%),esi-ms m/z:354.1[m+h]
+
。
[0159]
步骤2:化合物13-2的合成
[0160]
将上步所得化合物13-1(300mg,0.85mmol)溶于meoh中(20ml),加入pd/c(10%,60mg),通入h2于r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体(200mg,收率72%),esi-ms m/z:324.1[m+h]
+
。
[0161]
步骤3:化合物13的合成
[0162]
将上步所得粗产物13-2(200mg,0.62mmol)溶于dcm中(20ml),加入tea(132mg,
1.3mmol),ar保护,冰盐浴冷却至0℃,滴加2-(1,5-二甲基-3-苯基-1h-吡咯-2-基)-2-氧代乙酰氯(合成参见wo2009130481,261mg,1mmol)的dcm溶液,加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(100mg,收率29%)。
[0163]1h nmr(400mhz,dmso-d6)δ:10.22(s,1h),7.54-7.42(m,5h),6.75-7.68(m,4h),6.43(s,1h),6.25(s,1h),3.85(s,3h),3.65(d,j=11.8hz,1h),3.20-3.10(m,2h),3.01(d,j=9.8hz,2h),2.97-2.81(m,3h),2.75-2.65(m,4h),2.50(s,3h),2.46(s,3h),2.19(s,3h);esi-ms m/z:549.2[m+h]
+
.
[0164]
通过不同的手性原料或者手性分离的方法,可以得到化合物13的两个光学异构体,其结构式如下:
[0165][0166]
实施例14:化合物14
[0167][0168]
合成路线:
[0169][0170]
步骤1:化合物14-1的合成
[0171]
将5-甲基-3-苯基-1h-吡咯-2,4-二甲酸二乙酯(6g,20mmol)溶于thf(50ml)中,冰盐浴冷却至0℃,分批加入nah(1.2g,30mmol,60%),加毕,恢复r.t.搅拌1h,再次冷却至0℃,加入mei(8.5g,60mmol),加毕,于r.t.反应过夜,lc-ms监测反应完毕,冷的稀盐酸淬灭反应(ph约7~8),浓缩,残留物加入dcm(80ml),分液,水相用dcm(50ml*2)萃取,合并有机相,有机相用水(100ml)洗,饱和食盐水(100ml)洗,无水na2so4干燥,过滤,滤液浓缩,得到浅黄色固体(5.9g,收率90%),直接投入下一步反应,esi-ms m/z:330.1[m+h]
+
。
[0172]
步骤2:化合物14-2的合成
[0173]
将14-1(5.9g,18mmol)溶于etoh(100ml)中,加入naoh(4.32g,108mmol)水(100ml)溶液,升温至回流反应过夜,lc-ms监测反应完毕,旋蒸除去etoh,冰盐浴下用浓盐酸调ph约2,析出固体,搅拌1h,过滤,滤饼用水洗,pe洗,干燥,得到浅黄色固体(3.4g,收率70%),粗产物直接用于下一步反应,esi-ms m/z:274.1[m+h]
+
。
[0174]
步骤3:化合物14-3的合成
[0175]
将14-2(5.8g,21.2mmol)悬浮于乙醇胺(15ml)中,ar保护下升温175℃,反应约1h,lc-ms监测反应完毕,冷却,反应液用水(30ml)稀释,ea(20ml*2)萃取,合并有机相,有机相分别用水(20ml)洗,饱和食盐水(20ml)洗,干燥,浓缩,残留物经中性氧化铝柱层析(pe/ea=10/1to 2/1),得到类白色固体(2.8g,收率71%),esi-ms m/z:186.1[m+h]
+
。
[0176]
步骤4:化合物14-4的合成
[0177]
将14-3(556mg,3mmol)溶于dcm(10ml)中,ar保护下冰盐浴冷却至0℃,滴加(cocl)2(419mg,3.3mmol),加毕,于r.t.反应约1h,lc-ms监测反应完毕,浓缩,得到棕黄色油状物(248mg,收率90%)。直接用于下一步反应。
[0178]
步骤5:化合物14的合成
[0179]
将化合物1-5(300mg,1mmol)溶于dcm中(20ml),加入tea(202mg,2.0mmol),ar保护,冰盐浴冷却至0℃,滴加14-4(331mg,1.2mmol),加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(270mg,收率50%)。
[0180]1h nmr(400mhz,dmso-d6)δ:10.26(s,1h),8.79(s,2h),7.55-7.43(m,5h),7.17-7.08(m,2h),6.79(d,j=9.2hz,1h),6.32(s,1h),4.57(dd,j=12.1,1.5hz,1h),4.25-4.15(m,3h),3.87(t,j=9.8hz,1h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.76(d,j=12.1,2h),2.62-2.52(m,2h),2.18(s,3h),1.22(t,3h);esi-ms m/z:541.2[m+h]
+
.
[0181]
实施例15:化合物15
[0182][0183]
以溴代异丁烷代替碘乙烷为原料,采用实施例14相似的合成方法,得到化合物15。
[0184]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),8.78(s,2h),7.55-7.43(m,5h),7.15-7.06(m,2h),6.78(d,j=9.2hz,1h),6.28(s,1h),4.57(dd,j=12.1,1.5hz,1h),4.25-4.15(m,3h),3.86(t,j=9.8hz,1h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.76(d,j=12.1,2h),2.57-2.48(m,2h),2.18(s,3h),2.02-1.98(m,1h),1.12(ss,6h);esi-ms m/z:569.2[m+h]
+
.
[0185]
实施例16:化合物16
[0186][0187]
以2-溴乙基甲基醚代替碘乙烷为原料,采用实施例14相似的合成方法,得到化合物16。
[0188]1h nmr(400mhz,dmso-d6)δ:10.27(s,1h),8.78(s,2h),7.55-7.43(m,5h),7.17-7.05(m,2h),6.78(d,j=9.8hz,1h),6.32(s,1h),4.56-4.45(m,2h),4.25-4.15(m,2h),3.87(t,j=9.8hz,1h),3.65-3.54(m,3h),3.32(s,3h),2.96(t,j=9.9hz,1h),2.75(d,j=11.8,2h),2.61-2.51(m,2h),2.18(s,3h);esi-ms m/z:571.2[m+h]
+
.
[0189]
实施例17:化合物17
[0190][0191]
合成路线:
[0192][0193]
步骤1:化合物17-1的合成
[0194]
将2-呋喃甲酸(11.2g,0.1mol)溶于dcm(150ml)中,加入socl2(36ml,0.5mol),于r.t.反应过夜,lc-ms监测反应完毕,浓缩,得到浅棕色胶状物(13g,收率100%),直接用于下一步反应。
[0195]
步骤2:化合物17-2的合成
[0196]
将丙二酸单乙酯钾盐(13.4g,78.5mmol)溶于acn(80ml)中,约10℃下加入tea(11.7ml,84.3mmol),加入无水mgcl2(9.12g,95.8mmol),于r.t.反应2.5h,冷却至0℃,滴加17-1(5g,38.3mmol)的acn(30ml)溶液,于r.t.反应过夜,lc-ms监测反应完毕,浓缩,残留物toluene加热回流溶解,然后冷却,约在0~5℃下,用13%的稀盐酸酸(50ml)化处理,搅拌约15min,分液,有机相分别用稀盐酸(50ml*2)洗,水(25ml*2)洗,浓缩,残留物经柱层析(pe/ea=10/1to 4/1),得到灰黄色固体(5g,收率72%),esi-ms m/z:183.1[m+h]
+
。
[0197]
步骤3:化合物17-3的合成
[0198]
将17-2(9.1g,50mmol)溶液hoac(25ml)中,保持0~5℃下,缓慢滴加nano2(4.5g,65mmol)水溶液(30ml)约1h,滴加过程有固体析出,滴加完毕,恢复r.t.搅拌反应约30min,加入水(200ml)继续搅拌约30min,lc-ms监测反应完毕,过滤,滤液用dcm(50ml*2)萃取,合并有机相,有机相用水(50ml*2)洗,饱和食盐水(50ml*2)洗,无水na2so4干燥,过滤,滤液浓缩,得到浅黄色固体(7g,收率66%),esi-ms m/z:212.1[m+h]
+
。
[0199]
步骤4:化合物17-4的合成
[0200]
将乙酰ea(7.25g,56mmol),锌粉(9.8g 151mmol),naoac(10.2g,121mmol)溶于hoac中,升温60℃,剧烈搅拌下,分三批次加入的7-3(10.6g,50mmol)的hoac溶液,加入期间温度迅速上升至90℃左右,加毕,维持温度60-75℃反应3h,补加锌粉(4.9g,75mmol),继续反应约1h,lc-ms监测反应完毕,冷却,过滤,滤液浓缩,用toluene共沸带走残留的的hoac,加入水(200ml)和ea(50ml),搅拌,分液,水相用ea(30ml*2)萃取,合并有机相,有机相用碳酸氢钠水溶液(100ml*2)洗,水(100ml*2)洗,饱和食盐水(100ml*2)洗,无水na2so4干燥,过滤,滤液浓缩,残留物用dcm/pe(1/6,15ml)打浆,过滤,得到浅黄色固体(5.8g,收率40%),esi-ms m/z:292.1[m+h]
+
。
[0201]
步骤5:化合物17-5的合成
[0202]
将17-4(5.8g,20mmol)溶于thf(50ml)中,冰盐浴冷却至0℃,分批加入nah(1.2g,30mmol),加毕,恢复r.t.搅拌1h,再次冷却至0℃,加入mei(8.5g,60mmol),加毕,于r.t.反应过夜,lc-ms监测反应完毕,冷的稀盐酸淬灭反应(ph约7~8),浓缩,残留物加入dcm(80ml),分液,水相用dcm(50ml*2)萃取,合并有机相,有机相用水(100ml)洗,饱和食盐水(100ml)洗,无水na2so4干燥,过滤,滤液浓缩,得到浅黄色固体(5.5g,收率90%),直接投入下一步反应,esi-ms m/z:306.1[m+h]+。
[0203]
步骤6:化合物17-6的合成
[0204]
将17-5(5.5g,18mmol)溶于etoh(100ml)中,加入naoh(4.32g,108mmol)水(100ml)溶液,升温回流过夜,lc-ms监测反应完毕,旋蒸除去etoh,冰盐浴下用浓盐酸调ph约2,析出固体,搅拌1h,过滤,滤饼用水洗和pe洗,干燥,得到浅黄色固体(2.5g,收率55%),粗产物直接用于下一步反应,esi-ms m/z:250.1[m+h]
+
。
[0205]
步骤7:化合物17-7的合成
[0206]
将17-6(2.5g,10mmol)悬浮于乙醇胺(10ml)中,ar保护下升温175℃,反应约1h,lc-ms监测反应完毕,冷却,反应液用水(30ml)稀释,ea(20ml*2)萃取,合并有机相,有机相分别用水(20ml)洗,饱和食盐水(20ml)洗,干燥,浓缩,残留物经中性氧化铝柱层析(pe/ea=10/1to 4/1),得到浅黄色固体(805mg,收率50%),esi-ms m/z:162.1[m+h]+。
[0207]
步骤8:化合物17-8的合成
[0208]
将17-7(805mg,5mmol)溶于dcm(10ml)中,ar保护下冰盐浴0℃,滴加草酰氯(700mg,5.5mmol),加毕,于r.t.反应约1h,lc-ms监测反应完毕,浓缩,得到棕黄色油状物(1.13g,收率90%),直接用于下一步反应。
[0209]
步骤9:化合物17的合成
[0210]
将化合物1-5(300mg,1mmol)溶于dcm中(20ml),加入tea(202mg,2.0mmol),ar保护,冰盐浴冷却至0℃,滴加2-(3-(呋喃-2-基)-1,5-二甲基-1h-吡咯啉-2-基)-2-氧代乙酰氯(17-8,300mg,1.2mmol)的dcm溶液,加毕,于r.t.反应30min,lc-ms监测反应完毕,加冰水淬灭反应,分液,水相用dcm(20ml*2)萃取,合并有机相,无水na2so4干燥,过滤,滤液浓缩,柱层析(dcm/meoh=100/1to 20/1)纯化,得到浅黄色固体(200mg,收率39%)。
[0211]1h nmr(400mhz,dmso-d6)δ:10.25(s,1h),8.79(s,2h),7.72(s,1h),7.17-7.08(m,3h),6.76-6.68(m,2h),6.18(s,1h),4.56(dd,j=11.3,1.5hz,1h),4.20(d,j=11.5hz,1h),3.87(t,j=9.8hz,1h),3.78(s,3h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.78(d,j=12.1,2h),2.61-2.53(m,2h),2.16(s,3h);esi-ms m/z:517.2[m+h]
+
.
[0212]
实施例18:化合物18
[0213][0214]
以3-噻吩甲酸代替2-呋喃甲酸为原料,采用实施例17相似的合成方法,得到化合
物18。
[0215]1h nmr(400mhz,dmso-d6)δ:10.27(s,1h),8.79(s,2h),7.95(d,j=2.3hz,1h),7.85(dd,j=11.5,2.3hz,1h),7.38(dd,j=11.3,2.4hz,1h),7.17-7.08(m,2h),6.76(d,j=11.2hz,1h),6.22(s,1h),4.56(dd,j=11.3,1.5hz,1h),4.20(d,j=11.5hz,1h),3.87(t,j=9.8hz,1h),3.78(s,3h),3.66(d,j=11.6hz,1h),2.95(t,j=9.9hz,1h),2.77(d,j=12.1,2h),2.61-2.52(m,2h),2.17(s,3h);esi-ms m/z:533.2[m+h]
+
.
[0216]
实施例19:化合物19
[0217][0218]
以烟酸代替2-呋喃甲酸为原料,采用实施例17相似的合成方法,得到化合物19。
[0219]1h nmr(400mhz,dmso-d6)δ:10.28(s,1h),9.13(s,1h),8.79(s,2h),8.73(d,j=11.5hz,1h),8.42(d,j=10.8hz,1h),7.55-7.52(m,1h),7.18-7.07(m,2h),6.79(d,j=11.2hz,1h),6.21(s,1h),4.55(dd,j=11.3,1.5hz,1h),4.21(d,j=11.5hz,1h),3.86(t,j=9.8hz,1h),3.79(s,3h),3.67(d,j=11.6hz,1h),2.96(t,j=8.9hz,1h),2.76(d,j=11.5,2h),2.60-2.50(m,2h),2.18(s,3h);esi-ms m/z:528.2[m+h]
+
.
[0220]
实施例20:体外抗真菌活性(mic)测试
[0221]
将实验中使用的菌株接种到sabouraud葡萄糖琼脂培养基上,然后在35℃培养5天,向培养的sabouraud葡萄糖琼脂添加1ml用0.85%无菌生理盐水稀释的0.2%tween 20,然后振摇平板,将从平板表面收集溶液转移到无菌管中,将所得含有真菌的上清液转移到无菌管中,充分悬浮,制备浓度为0.4*106至5*106cfu/ml的菌株稀释液。将此制备的菌株稀释液以1:100比率稀释于rpmi 1640培养基中,并将此生物悬浮液加入到含有药物稀释的平板的孔中,将所有板在35℃下孵育24-48小时,通过监测每个孔的485nm的光来评价菌株的生长。化合物的mic定义为:与不加药物的阴性对照相比,能够抑制大于80%的菌株生长的最低药物浓度。a表示mic值大于0.1μg/ml,b表示mic值大于0.01μg/ml但小于或等于0.1μg/ml,c表示mic值小于0.01μg/ml。
[0222]
表1化合物的抗真菌活性mic值(μg/ml)
[0223][0224]
从上表数据可知,和临床上应用的抗真菌药物伊曲康唑相比,本发明化合物具有更强的体外抗真菌活性,这对开发新型抗真菌药物具有重要意义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1