肿瘤乳酸微环境相关非编码小RNA分子谱及其应用
本发明属生物化学与分子生物学领域,具体涉及扩增和分析人类细胞编码的hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974和tirnahisgug,以及其表达情况,和应用于预测恶性淋巴瘤的预后效果和治疗。
背景技术:
现有技术公开了小分子rna包括microrna(mirna)、转运rna(trna)、piwi蛋白相关rna(pirna)、小核仁rna(snorna)、小核rna(snrna)和核糖体rna(rrna)等。mirna是一类长度在18-25nt左右的非编码小rna,在生物体内的表达具有时序性,保守性,组织特异性和疾病特异性,可通过与靶基因互补结合,负调控mrna的表达,在细胞增殖分化、凋亡、胚胎发育、血管生成等多种生命活动中发挥作用,可作为肿瘤诊断性、治疗性、预测性的生物标记物。
研究表明了肿瘤微环境(tumormicroenviroment,tme)是肿瘤细胞赖以生存的复杂内环境,由肿瘤细胞和其周围环境共同组成,其特点是酸性,低氧,低ph值。临床实践中,对淋巴瘤的临床诊断和预后判断主要通过有创的淋巴结切除活检并结合免疫组化等进行,由于其发病部位可出现在全身淋巴结内或结外任何组织,病理标本不易获取;另外,淋巴瘤病变部位常伴有感染、坏死等情况,导致病理诊断困难,需多次活检。因此寻找能够反映淋巴瘤酸性微环境的生物标志物,建立创伤小、高特异性、高灵敏性的检测方法对淋巴瘤诊断和治疗极其重要。
trna半分子(trnahalves,tirna)是由血管生成素(angiogenin,ang)在成熟trna反密码子环处特异性切割产生的非编码小rna,长度约为30-35nt,分为5′-tirna和3′-tirna,可类似mirna行使rna干扰功能,在转录后水平发挥调控作用。研究显示,tirna与多种人类疾病有关,例如淋巴瘤,乳腺癌,前列腺癌,慢性病毒性肝炎,其组成和表达水平具有细胞特异性和疾病特异性,在疾病诊断中具有广阔的生物学前景。但由于mirna和tirna序列比较短,如何准确且特异的对这些小分子进行定量,变得尤为重要。
基于现有技术的现状,本申请的发明人拟提供肿瘤微环境中小分子rna的准确定量方法。具体涉及一种在肿瘤乳酸微环境中表达的非编码小rna分子谱及其应用。
技术实现要素:
本发明的目的在于基于现有技术的现状,提供肿瘤微环境中小分子rna的准确定量方法。具体涉及一种在肿瘤乳酸微环境中表达的非编码小rna分子谱。
本发明建立并优化了小分子rna的荧光定量pcr检测方法,下面结合前期细胞及临床样品检测情况对本发明做进一步详细说明,具体实施如下。
弥漫大b细胞淋巴瘤,前列腺癌等实体瘤组织中均存在酸性环境,乳酸能够促进肿瘤细胞的增殖,促进肿瘤细胞的侵袭。本发明采用外源乳酸添加来模拟体内酸性微环境,分别处理不同ebv阳性和阴性b淋巴瘤细胞系,通过深度测序及定量pcr验证,筛选出5种乳酸响应mirna分子和1种5’-tirna分子,这组小分子rna的表达水平随乳酸浓度的升高有一致稳定的变化趋势,用于预测乳酸微环境相关淋巴瘤等肿瘤疾病恶性程度的诊断和治疗应用上有一定的临床价值。
更具体的,本发明提供了一种定量小分子rna的方法,该方法包括以下步骤:
(1)收集样本;样本处于含有乳酸的环境,乳酸的浓度范围是100-250u/l;
(2)茎环法定量pcr;
(3)获得目标mirna分子或者5’-tirna分子。
在本发明的一个优选实施例中,乳酸的浓度范围是109-245u/l。
所述的样本是离体的实体瘤样本,或者加入乳酸用于模拟肿瘤微环境的样本。
例如,所述的样本是体外培养的恶性淋巴瘤细胞。
所述方法还可以包括深度测序的步骤。
在本发明的优选实施例中,所述目标mirna分子是hsa-mir-9-5p、hsa-mir-210-3p、hsa-mir-7-5p、hsa-mir4521或者hsa-mir-7974;
所述的5’-tirna分子是5’-tirnahisgug。
hsa-mir-9-5p成熟的核苷酸序列(5’-ucuuugguuaucuagcuguauga-3’,seqidno1),该序列rna片段长为23bp。
hsa-mir-210-3p成熟的核苷酸序列(5’-cugugcgugugacagcggcuga-3’,seqidno2),该序列rna片段长为22bp。
hsa-mir-7-5p成熟的核苷酸序(5’-uggaagacuagugauuuuguuguu-3’,seqidno3),该序列rna片段长为24bp。
hsa-mir4521成熟的核苷酸序列(5’-gcuaaggaaguccugugcucag-3’,seqidno4),该序列rna片段长为22bp。
hsa-mir-7974成熟的核苷酸序列(5’-aggcugugaugcucuccugagccc-3’,seqidno5),该序列rna片段长为24bp。
5’-tirnahisgug成熟的核苷酸序(5’-gccgtgatcgtatagtggttagtactctgcgtt-3’,seqidno6),该序列rna片段长为33bp。
编码hsa-mir-9-5p成熟核苷酸的茎环结构(5’-ucuuugguuaucuagcuguaugagucguauccagugcgaauaccucggacccugcacuggauacgac-3’,seqidno7),该序列rna片段长为67bp。
编码hsa-mir-210-3p成熟核苷酸的茎环结构(5’-cugugcgugugacagcggcugagucguauccagugcgaauaccucggacccugcacuggauacgac-3’,seqidno8),该序列rna片段长为66bp。
编码hsa-mir-7-5p成熟核苷酸的茎环结构(5’-uggaagacuagugauuuuguuguugucguauccagugcgaauaccucggacccugcacuggauacgac-3’,seqidno9),该序列rna片段长为68bp。
编码hsa-mir4521成熟核苷酸的茎环结构(5’-gcuaaggaaguccugugcucaggucguauccagugcgaauaccucggacccugcacuggauacgac-3’,seqidno10),该序列rna片段长为66bp。
编码hsa-mir-7974成熟核苷酸的茎环结构
(5’-aggcugugaugcucuccugagcccgucguauccagugcgaauaccucggacccugcacuggauacgac-3’,seqidno11),该序列rna片段长为68bp。
编码5’-tirnahisgug与3'rnaadaptor连接后的成熟核苷酸结构(5’-gccgugaucguauagugguuaguacucugcguugaacacugcguuugcuggcuuugagaguucuacaguccgacgauc-3’,seqidno12),该序列rna片段长为78bp。
用于反转录hsa-mir-9-5p茎环结构的特异性反转录引物序列(5’-gtcgtatccagtgcagggtccgaggtattcgcactggatacgactcatac-3’,seqidno13),该序列rna片段长为67bp。
用于反转录hsa-mir-210-3p茎环结构的特异性反转录引物序列(5’-gtcgtatccagtgcagggtccgaggtattcgcactggatacgactcagcc-3’,seqidno14),该序列rna片段长为66bp。
用于反转录hsa-mir-7-5p茎环结构的特异性反转录引物序列(5’-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaacaac-3’,seqidno15),该序列rna片段长为68bp。
用于反转录hsa-mir4521茎环结构的特异性反转录引物序列(5’-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacctgagc-3’,seqidno16),该序列rna片段长为66bp。
用于反转录hsa-mir-7974茎环结构的特异性反转录引物序列(5’-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacgggctc-3’,seqidno17),该序列rna片段长为68bp。
用于延伸5’-tirnahisgug序列长度的3'-rnaadaptor,其序列为(/5phos/gaacactgcgtttgctggctttgagagttctacagtccgacgatc/3ddc/-3’,seqidno18),该序列rna片段长为45bp。
用于扩增成熟hsa-mir-9-5p的荧光定量pcr引物(正向引物:5’-gcgcgtctttggttatctagct-3’,seqidno19(22bp);反向引物:5’-agtgcagggtccgaggtatt-3’,seqidno20(20bp)。
用于扩增成熟hsa-mir-210-3p的荧光定量pcr引物(正向引物:5’-atgcctgtgcgtgtgac-3’,seqidno21(17bp);反向引物同seqidno20。
用于扩增成熟hsa-mir-7-5p的荧光定量pcr引物(正向引物:5’-cgcgtggaagactagtgatttt-3’,seqidno22(22bp);反向引物同seqidno20。
用于扩增成熟hsa-mir4521的荧光定量pcr引物(正向引物:5’-cgcggctaaggaagtcctgt-3’,seqidno23(20bp);反向引物同seqidno20。
用于扩增成熟hsa-mir-7974的荧光定量pcr引物(正向引物:5’-cgaggctgtgatgctctcct-3’,seqidno24(20bp);反向引物同seqidno20。
用于扩增成熟5-tirnahisgug的荧光定量pcr引物(正向引物:5’-gctcgccgtgatcgtatagt-3’,seqidno25(20bp);反向引物同seqidno21。
另一方面,本发明通过上述方法获得了一种肿瘤检测标志物。
该肿瘤检测标志物含有hsa-mir-9-5p、hsa-mir-210-3p、hsa-mir-7-5p、hsa-mir4521、hsa-mir-7974或者5’-tirnahisgug中的一种或者几种,或者这些rna相对应的dna。
具体而言,
hsa-mir-9-5p的成熟核苷酸序列如seqidno1所示;
hsa-mir-210-3p的成熟核苷酸序列如seqidno2所示;
hsa-mir-7-5p的成熟核苷酸序列如seqidno3所示;
hsa-mir4521的成熟核苷酸序列如seqidno4所示;
hsa-mir-7974的成熟核苷酸序列如seqidno5所示;
5’-tirnahisgug的成熟核苷酸序列如seqidno6所示。
本发明提供了上述肿瘤检测标志物的应用,即在正常乳酸浓度的淋巴瘤患者外周血单核细胞中,使用荧光定量pcr法检测;所述的rna的正常参考值如下:
hsa-mir-9-5p,0.32-4.44;
hsa-mir-210-3p,0.4-1.50;
hsa-mir-7-5p,0.14-2.19;
hsa-mir4521,0.3-1.47;
hsa-mir-7974,0.23-3.69;或者
5’-tirnahisgug,0.62-7.48。
较好的,所述的rna作为恶性肿瘤的诊治或者预后评判靶标的标志物。
所述的恶性肿瘤可以是恶性淋巴瘤,例如,在本发明的一个优选实施例中,所述的恶性肿瘤源自ebv阳性或者ebv阴性的b淋巴瘤细胞。
进一步,本发明提供了一种检测恶性淋巴瘤的试剂盒,所述的试剂盒含有定量检测hsa-mir-9-5p、hsa-mir-210-3p、hsa-mir-7-5p、hsa-mir4521、hsa-mir-7974或者5’-tirnahisgug的试剂。
较好的,所述的试剂盒含有hsa-mir-9-5p、hsa-mir-210-3p、hsa-mir-7-5p、hsa-mir4521、hsa-mir-7974或者5’-tirnahisgug的扩增引物。
本发明提供了一系列与肿瘤乳酸微环境相关非编码mirna和tirna分子,可作为一个分子靶标应用于抑制相关恶性淋巴瘤生长和判断恶性淋巴瘤患者的预后情况。其中包括hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521和hsa-mir-7974及tirnahisgug表达谱在不同恶性淋巴瘤细胞(或外周血单核细胞)中的表达与胞外(或外周血包浆)乳酸浓度存在一致相关性。建立了针对这些肿瘤乳酸微环境特异相关mirna和tirna表达谱靶标快速检测方案,可用于乳酸微环境相关恶性肿瘤临床诊治和预后效果检测。
本发明提供了在肿瘤微环境中定量小分子rna的方法。本发明设计并合成了hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974和5’-tirnahisgug反转录和扩增引物;确了hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974和5’-tirnahisgug荧光定量pcr所需的反应条件。进一步的,本发明研究并确立了荧光定量pcr法检测hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974和5’-tirnahisgug在恶性淋巴瘤患者外周血单核细胞中的正常范围参考值。本发明具有无创性,操作简单,敏感性高,特异性强等优点,具有较大潜在的社会效益。
为便于理解,以下将通过具体的附图和具体实施方式对本发明进行详细地描述。需要特别指出的是,具体实施方式和附图仅是为了说明,显示本领域的技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。
附图说明
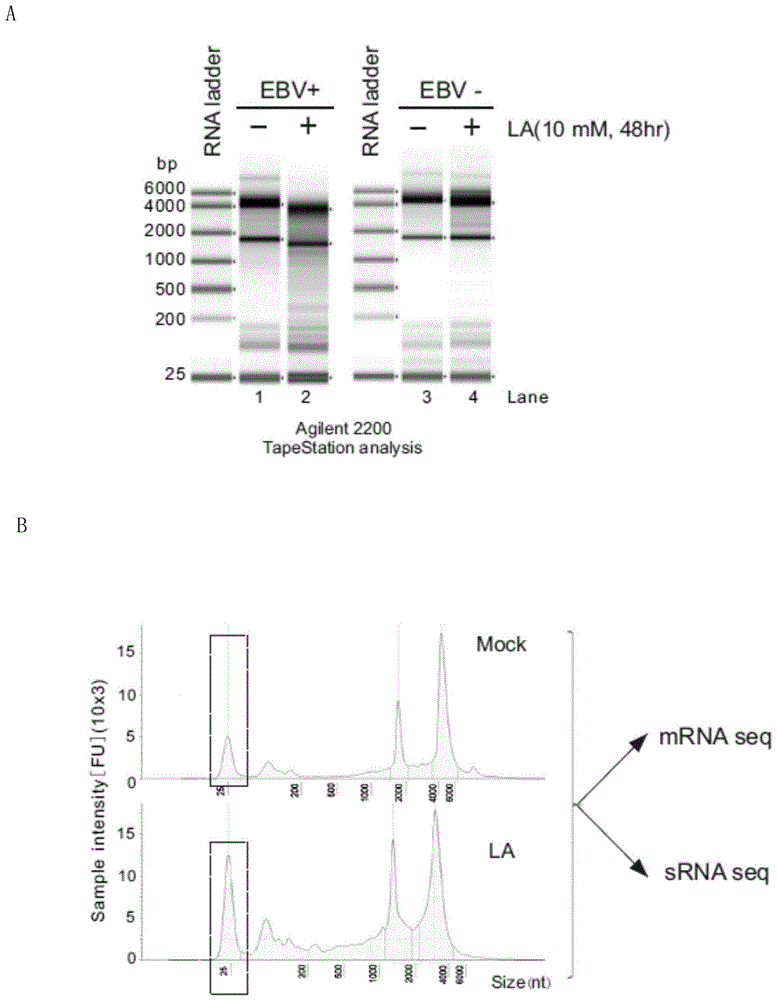
图1.ebv阳性(lcl)和阴性(ramous)b淋巴瘤细胞经乳酸处理前后总rna的凝胶电泳图(图1a)和定量分析图(图1b)。mock,处理前对照;la,乳酸处理组。
图2.深度rna测序分析ebv阳性b淋巴瘤细胞(lcl)经乳酸处理前后不同小rna百分比率。mock,处理前对照;la,乳酸处理组。
图3.5种mirna在不同恶性b淋巴瘤细胞经不同乳酸浓度和时间处理后响应趋势的定量pcr检测表达谱。
图4.深度rna测序分析ebv阳性b淋巴瘤细胞(lcl)经乳酸处理前后不同转运rna(trna)百分比率。mock,处理前对照;la,乳酸处理组。
图5.深度rna测序分析ebv阳性b淋巴瘤细胞(lcl)经乳酸处理前后与转运rna(trna)相关蛋白转录水平(图a)和免疫印迹检测在不同b淋巴瘤细胞表达水平(图b)。mock,处理前对照;la,乳酸处理组。
图6.(a)22例不同ebv阳性与阴性b淋巴瘤患者外周血单核细胞中hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974的转录表达水平与乳酸ldh水平相关性分析;(b)5名淋巴瘤患者外周血单核细胞不同时间阶段hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974转录表达水平与ldh水平相关性分析。ave,正常乳酸平均水平(109-245u/l)。dead为患者死亡。
图7.ebv阳性b淋巴瘤细胞经乳酸处理前后转运rna切割蛋白ang和5'-trnahisgug的转录表达谱。
图8.22例不同ebv阳性与阴性b淋巴瘤临床样本中5'-trnahisgug和ang转录表达水平相关性分析。
图9.5'-trnahisgug促进ebv阳性b淋巴瘤细胞体外增殖(上图)并受反义rna结抗剂抑制(下图)。
图10.5'-trnahisgug反义rna结抗剂促进ebv阳性b淋巴瘤细胞g1期阻滞。
图11.转运rna切割蛋白ang敲减和5'-trnahisgug反义rna结抗剂抑制ebv阳性b淋巴瘤细胞体外克隆形成。
图12.mirna的检测-茎环法实时定量pcr原理示意图。
图13.5’-tirna定量pcr扩增原理图。
具体实施方式
本发明的实施例中:
1.mirna茎环法定量pcr引物设计原则:
茎环法定量pcr中共涉及三种引物:分别为逆转录引物、实时定量pcr上游引物和通用下游引物。
(1)逆转录引物组成:5’茎环状序列+3’mirna特异引物序列
其中茎环序列作用是延长mirna的长度,3’端特异序列是6个与成熟mirna3’端寡核苷酸反向互补的配对序列。茎环序列:5-gtcgtatccagtgcagggtccgaggtattcgcactggatacgac-3(seqidno26)
(2)实时定量pcr上游引物:gc碱基(调节tm值到60℃)+成熟mirna5’端特异寡核苷酸序列。
(3)通用pcr下游引物:与茎环序列互补。
表1.乳酸相应mirna成熟序列
表2.茎环实时定量pcr法逆转录引物序列
表3.茎环实时定量pcr法上下游引物序列
2.5’-tirna荧光定量pcr引物设计原则:
5’-tirna定量pcr中涉及到两种引物:pcr上下游引物,以及1种rnaadaptor。(1)3’-rnaadaptor:/5phos/gaacactgcgtttgctggctttgagagttctacagtccgacgatc/3ddc/(seqidno18)
rnaadaptor作用为延长tirna的长度,由于5'-trna的3'端带有环状磷酸酯(cp),t4pnk处理后5'-trna半分子的3'末端去磷酸化,可在t4rnaligase作用下与5'末端带有羟基的3'rnaadaptor连接。因此rnaadaptor的5'端磷酸化修饰,3'端双脱氧胞苷修饰,终止序列延伸。
(2)实时定量pcr上游引物:gc碱基(调节tm值到60℃)+成熟tirna5'端特异寡核苷酸序列。
(3)实时定量pcr下游引物:与(rnaadaptor5'端+tirna3'末端)反向互补的配对序列。
表4.5’-tirna实时定量pcr中引物序列
实施例1:乳酸微环境响应mirna分子的筛选和鉴定
采用茎环法qrt-pcr,在ebv阳性细胞系(lcl,b95.8)和ebv阴性细胞系(bjab)中,检测不同浓度乳酸处理下的mirna分子表达水平,筛选出一组对乳酸响应且变化趋势稳定的mirna表达谱。这组mirna为hsa-mirna-7974,hsa-mirna-7-5p,hsa-mir-4521,hsa-mirna-9-5p,hsa-mirna210-3p(图3)。
mirna的检测-茎环法实时定量pcr:每种mirna单独设计一种茎环状(stem-loop)逆转录引物,茎环rt引物5'端与mirna分子3'端特异性结合,在逆转录酶的作用下,获得加长的mirna第一链cdna。获得的逆转录产物,在qpcr特异上游引物和下游引物作用下,进行qpcr反应。
具体操作如下:
1.totalrna提取(trizol法)
1)收集24hr或48hr,0mm,5mm,10mm,15mm乳酸处理的状态良好的悬浮细胞,1200rpm3min离心,弃上清。手轻轻弹动,混匀细胞。
2)加1mltrizol置于rnasefreeep管中,冰上裂解3-5min,进行下步实验,或-80℃保存。
3)加200μl氯仿,迅速颠倒混匀15次左右。静置3-5min。
4)13000rpm4℃离心,10min。分层rna溶解在水相,位于最下层。dna在中间
5)将上清转移到新的ep管中,切勿吸收到白色dna层。
6)加500μl异丙醇,立刻颠倒混匀15次左右,静置3-5min。
7)13000rpm.4度离心10min。
8)弃上清,加1ml75%乙醇(vortex3s)
9)13000rpm4度离心5-10min,弃上清。倒扣于滤纸上10min。
10)加20-50μlrnafreewater溶解,吹打混匀,获得rna样品。
11)nandrop2000测rna质量及浓度,-80℃保存。
2.mirna逆转录
于-80℃取出适量rna样品,使用茎环法逆转录试剂盒(mirna1ststrandcdnasynthesiskit,vazyme),逆转录合成第一链cdna。
1)基因组dna去除
在rnase-free离心管中配制如下体系混合液:
反应条件:42℃2min
2)第一链cdna合成
在rnase-free离心管中配制如下体系混合液:
按照下列条件进行第一链cdna合成反应:25℃5min;50℃15min;85℃5min.
产物可立即用于定量pcr反应,或保存于-20℃,cdna应避免反复冻融。
3.定量pcr检测mirna表达水平
1)在pcr管中配制如下体系混合液:
u6作为内参,体系同上,引物换为u6-f,u6-r,其余同上。混匀,避免有气泡。
2)pcr反应条件
实验结果的计算:目标基因相对量=2-△ct(目标基因-内参基因)。
实施例2:乳酸微环境响应5'-tirnahisgug的筛选和鉴定
采用荧光定量pcr方法在ebv阳性细胞系(lcl1和b95.8)中,筛选出一种5'-trna半分子:5'-trnahisgug,其表达随乳酸浓度升高有一定的变化趋势,同时检测切割trna上游的ang分子表达水平,结果显示ang表达水平也随乳酸浓度升高而变化(图7)。这提示5'-trnahisgug在乳酸促进b淋巴瘤的发生中发挥一定作用,在ebv相关b细胞淋巴瘤的诊断及预后中有潜在的临床价值。
trna-半分子的检测及定量分析:5-tirna的结构特征为3'末端有2',3'-环磷酸基团。第一步t4pnk处理总rna使5'-trna半分子的3'末端去磷酸化,随后在t4rnaligase作用下与5'末端带有羟基的3'rnaadaptor连接,在逆转录酶作用下获得加长的5'tirna第一链cdna。获得的逆转录产物,在qpcr特异上游引物和下游引物作用下,进行qpcr反应。
具体操作如下:
1.totalrna提取(trizol法):步骤同上
2.t4pnk去磷酸化处理
反应条件:37度,30min;75度,10min
3.5'-trna半分子去磷酸化后与3'rnaadaptor连接
反应条件:37度,30min;70度,10min
4.逆转录试剂盒合成第一链cdna,
transscript:first-strandcdnasynthesissupermix(at301)
反应条件:25℃10min;42℃30min;85℃5min
5.定量pcr检测5'-trna半分子表达水平
pcr反应条件
实验结果的计算:目标基因相对量=2-△ct(目标基因-内参基因)。
实施例3:8例淋巴瘤样本hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974表达水平的检测
收集来自上海市第一人民医院的8例ebv阴性和ldh(乳酸脱氢酶)水平正常(<200u/l)淋巴瘤等疾病临床样本(pbmc),置于冻存管中,液氮保存。使用trizol法提取totalrna,并初步检测提取rna质量(od260/od280)和浓度,茎环法实时定量pcr检测临床样本中hsa-mir-9-5p,hsa-mir-210-3p,hsa-mir-7-5p,hsa-mir4521,hsa-mir-7974的表达情况,具体操作步骤同上,检测结果如图7。
实施例4:22例淋巴瘤临床样本5'-trnahisgug和ang表达水平的检测
收集来自上海市第一人民医院的22例ebv阳性或阴性淋巴瘤等疾病临床样本(pbmc),置于冻存管中,液氮保存。使用trizol法提取totalrna,并初步检测提取rna质量(od260/od280)和浓度,实时荧光定量pcr方法检测临床样本中5'-trnahisgug及ang的表达情况,具体操作步骤同上。
根据临床样本中ldh(乳酸脱氢酶)水平及eb病毒载量高低,将22例患者分为三组:8例ebv-ldh-;6例ebv-ldh+;8例ebv+ldh+,检测结果如下图8。与ebv-ldh-组比较,ldh表达水平高,患者体内ang与5'-trnahisgug表达水平高,而乳酸水平与恶性程度呈正相关,这提示5'-trnahisgug在淋巴瘤等血液病中有一定的诊断及预后价值。
序列表
<110>复旦大学
<120>肿瘤乳酸微环境相关非编码小rna分子谱及其应用
<130>20191205
<160>31
<170>siposequencelisting1.0
<210>1
<211>12
<212>dna/rna
<213>artificial
<220>
- 还没有人留言评论。精彩留言会获得点赞!