本发明属于生物分析检测领域,具体涉及一种选择性抑制革兰氏阳性菌的抑菌方法。
背景技术:
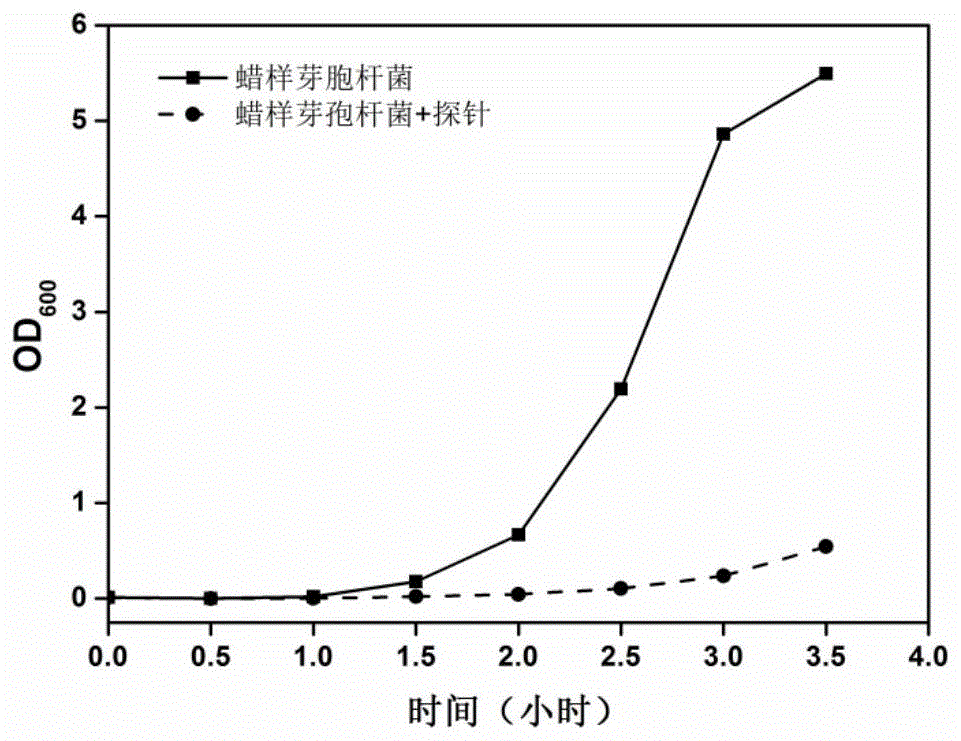
:抗生素是人类医学史上的一项伟大发现,它是人类抵抗由于致病微生物侵袭而造成的感染性疾病的重要工具。自世界上第一种抗生素-青霉素被发现以来,各种类的抗生素被相继发现和使用,例如四环素类、氯霉素类、单环β-内酰环类等。其作用机制包括抑制细菌细胞壁的合成、改变胞浆膜的通透性、抑制蛋白质的合成、干扰细菌dna复制等。抗生素已经成了医疗过程中不可或缺的药物,在全世界范围内广泛使用。然而,细菌适应能力极强,长期接触某种抗生素后可以通过改变细菌膜结构或者自身代谢途径等方式抵御抗生素的入侵而存活下来。发展中国家包括中国在内对抗菌药物的长期过度使用诱导了细菌的变异,产生各种耐药细菌,例如耐碳青霉烯类铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌、耐甲氧西林表皮葡萄球菌等。如今耐药细菌引起的各种医院感染人数已占住院患者病原菌感染总人数的30%左右。因此,科学家们致力于开发既具有超强杀菌能力且不易于产生耐药性的新药。万古霉素具有强大的抗菌作用,特别是对耐药性革兰氏阳性菌株的抑制作用使其一度被医生作为临床上对抗难治性细菌感染的最后防线。其在临床常被用于杀灭耐甲氧西林金黄色葡萄球菌(mrsa),mrsa具有广谱耐药性,是临床分离中常见的耐药性革兰氏阳性球菌,分离率高达50%以上。万古霉素主要是通过特异性结合细菌细胞壁前体五肽末端来抑制阳性菌细胞壁的生物合成,从而实现抗菌功能。万古霉素独特的抗菌机制决定了菌株不易对其产生耐药性,因此被称为对抗病原体的最后武器。尽管如此,万古霉素的最大缺点是其细胞毒性很强,极易产生不良反应如过敏、肾毒性、耳毒性等,这点大大的限制了它的应用。另外,目前临床上已经产生的耐万古霉素的金黄色葡萄球菌。因此,开发新的万能型抗生素势在必行。一般来说,阳离子抑菌剂在微生物中没有特定的靶标,而是通过静电相互作用在微生物膜中形成孔而破坏微生物膜。这种物理性质的作用可以阻止微生物对抑菌剂产生抗性。细菌细胞壁和细胞膜由磷脂双分子层组成,在中性条件下带负电荷,带正电荷的药物可以聚集在带负电的细菌表面,影响细菌的新陈代谢,从而抑制细菌的生长。已经设计出的几种类型的阳离子抗菌药物,包括抗菌肽、聚合物和纳米颗粒等,它们大多针对多重耐药菌株有很高效力,但是存在合成复杂、毒性强等缺点。本专利中,我们设计了一种阳离子抑菌剂pi-n,通过作用于细菌细胞壁能够选择性抑制革兰氏阳性菌,且不易产生耐药性。技术实现要素:本发明提供了一种抑菌剂,该抑菌剂结构为二联咪唑通过1-4个亚甲基与芘荧光团相连接,选择性地抑制革兰氏阳性菌的生长,具体结构式如下:其中,n=1、2、3、4,对应的抑菌分子分别为pi-1、pi-2、pi-3、pi-4。该化合物为二联咪唑两端分别连有一个芘荧光团,带有两个正电荷,可以高度聚集在细菌表面,抑制细菌生长。本发明提供了一种选择性抑制革兰氏阳性菌的抑菌方法,该方法应用小分子pi-n作为抑菌剂,其结构为二联咪唑通过1-4个亚甲基与芘荧光团相连接,可以选择性地抑制革兰氏阳性菌的生长,包括金黄色葡萄球菌、腐生葡萄球菌、粪肠球菌、蜡样芽胞杆菌、停乳链球菌等。特别是对临床常见的耐甲氧西林金黄色葡萄球菌(mrsa)有一定的抑制作用。性能优于部分已有的抗生素。具体按照如下步骤进行:(1)细菌在lb培养基中扩增培养;(2)加入一定量的抑菌剂分子;(3)37℃摇床震荡培养,通过测od600值确定细菌生长情况。所述的一种选择性抑制革兰氏阳性菌的抑菌方法,其特征在于:所述的革兰氏阳性病原菌包括金黄色葡萄球菌、腐生葡萄球菌、溶血葡萄球菌、人葡萄球菌、粪肠球菌、蜡样芽胞杆菌、停乳链球菌、无乳链球菌、枯草芽孢杆菌、表皮葡萄球菌、屎肠杆菌、头状葡萄球菌。所述的一种选择性抑制革兰氏阳性菌的抑菌方法,细菌的浓度小于108cfu/ml。所述的一种选择性抑制革兰氏阳性菌的抑菌方法,其特征在于:步骤(2)加入pi-n的终浓度为0.3μm到160μm。所述的一种选择性抑制革兰氏阳性菌的抑菌方法,其特征在于该方法可以用于抑制耐甲氧西林金黄色葡萄球菌。该方法作用机制为带正电荷的pi-n分子可以高度聚集在革兰氏阳性菌表面,在一定剂量pi-n的作用下,细菌细胞壁的通透性被改变,细菌肿胀破裂而死亡,从而起到杀菌作用。本发明的优点和有益效果为:由于细菌的细胞壁和细胞膜由磷脂双分子层组成,在中性条件下带负电荷,带正电荷的pi-n可以高度聚集在革兰氏阳性菌表面,影响细菌的新陈代谢,从而抑制革兰氏阳性菌的生长;在高剂量pi-n的作用下,细菌细胞膜的通透性可以被改变,使水分进入细菌内部使细菌肿胀破裂死亡,从而起到杀菌作用。而革兰氏阴性菌由于和革兰氏阳性菌存在结构上的差异,pi-n对革兰氏阴性菌没有明显的杀菌作用。附图说明图1为加入pi-2前后蜡样芽胞杆菌在lb培养基中的生长曲线图。图2为加入pi-2前后枯草芽孢杆菌在lb培养基中的生长曲线图。图3为加入pi-2前后阴沟肠杆菌在lb培养基中的生长曲线图。图4为加入pi-2前后大肠杆菌在lb培养基中的生长曲线图。图5为加入pi-3前后蜡样芽胞杆菌在lb培养基中的生长曲线图。图6为加入pi-3前后金黄色葡萄球菌在lb培养基中的生长曲线图。图7为加入pi-3前后肺炎克雷伯菌在lb培养基中的生长曲线图。图8为加入pi-3前后大肠杆菌在lb培养基中的生长曲线图。图9为用dapi/pi染色的加入pi-3前后的金黄色葡萄球菌的共聚焦显微镜图。图10为用dapi/pi染色的加入pi-3前后的大肠杆菌的共聚焦显微镜图。具体实施方式下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。实施例1pi-1对不同细菌生长的最低抑制浓度的测定分别从长有停乳链球菌、枯草芽孢杆菌、腐生葡萄球菌、人葡萄球菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,第二天将菌液转接于5mllb培养基,37℃摇床培养至菌液的od600==0.5,稀释100倍得到od600=0.005的菌液。分别取500μl菌液加入pi-1至其终浓度分别为40μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm,37℃摇床震荡培养,24小时后观察细菌生长情况。对于革兰氏阴性菌铜绿假单孢菌、副溶血弧菌,pi-1的终浓度分别为160μm、80μm、40μm、20μm、10μm、5μm、2.5μm、1.25μm。实验过程中,设两组平行实验,三组对照。对照组分别为:500μl菌液;500μl菌液中加dmso;500μllb培养基。实施例1测定的pi-1对不同细菌最低抑制浓度如表1所示,其对革兰氏阳性菌均有一定的抑制作用,对革兰氏阴性菌无抑制。表1pi-1对不同细菌的最低抑制浓度细菌种类革兰氏特性最低抑制浓度(μm)停乳链球菌革兰氏阳性5枯草芽孢杆菌革兰氏阳性5腐生葡萄球菌革兰氏阳性10人葡萄球菌革兰氏阳性5铜绿假单孢菌革兰氏阴性>160副溶血弧菌革兰氏阴性>160实施例2pi-2对蜡样芽胞杆菌抑制情况的研究5mllb培养基中加入50μl蜡样芽胞杆菌的菌液,过夜培养。取10mllb培养基加入菌液,调菌液的初始浓度为od600=0.01,然后分装进两个试管。其中一个试管加入pi-2(终浓度5μm),另一个试管加入同体积的dmso作为对照,37℃摇床培养,间隔半小时测菌液的od600值。通过监测蜡样芽胞杆菌的生长情况得到图1。图1中,蜡样芽胞杆菌在加入同体积dmso的情况下快速增殖,,而加入pi-2的细菌基本不增殖,表明pi-2的加入抑制了蜡样芽胞杆菌的生长。实施例3pi-2对枯草芽孢杆菌抑制情况的研究5mllb培养基中加入50μl枯草芽孢杆菌的菌液,过夜培养。取10mllb培养基加入菌液,调菌液的初始浓度为od600=0.01,然后分装进两个试管。其中一个试管加入pi-2(终浓度5μm),另一个试管加入同体积的dmso作为对照,37℃摇床培养,间隔半小时测菌液的od600值。通过监测枯草芽孢杆菌的生长情况得到图2。图2中的枯草芽孢杆菌在加入同体积dmso的情况下快速增殖,,而加入pi-2的细菌基本不增殖,表明pi-2的加入抑制了枯草芽孢杆菌的生长。实施例4pi-2对肺炎克雷伯菌抑制情况的研究5mllb培养基中加入50μl肺炎克雷伯菌的菌液,过夜培养。取10mllb培养基加入菌液,调菌液的初始浓度为od600=0.01,然后分装进两个试管。其中一个试管加入pi-2(终浓度5μm),另一个试管加入相应体积的dmso作为对照,37℃摇床培养,间隔30分钟测菌液的od600值。通过监测肺炎克雷伯菌的生长情况得到图3。图3中的肺炎克雷伯菌加入dmso的菌液与加入pi-2的菌液,随着时间的增长,细菌数量均以比较快的速度增殖,表明pi-2的加入没有抑制肺炎克雷伯菌的生长。实施例5pi-2对大肠杆菌抑制情况的研究5mllb培养基中加入50μl大肠杆菌的菌液,过夜培养。取10mllb培养基加入菌液,调菌液的初始浓度为od600=0.01,然后分装进两个试管。其中一个试管加入pi-2(终浓度5μm),另一个试管加入相应体积的dmso作为对照,37℃摇床培养,隔段时间测下菌液的od600值。通过监测大肠杆菌的生长情况得到图4。图4中大肠杆菌加入dmso的菌液与加入pi-2的菌液,随着时间的增长,细菌均以比较快的速度增殖,表明pi-2的加入没有抑制大肠杆菌的生长。实施例6pi-2对不同细菌生长的最低抑制浓度的测定分别从长有表皮葡萄球菌、枯草芽孢杆菌、头状葡萄球菌、溶血葡萄球菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,第二天将菌液转接于5mllb培养基,37℃摇床培养至菌液的od600==0.5,稀释100倍得到od600=0.005的菌液。分别取500μl菌液加入pi-2至其终浓度分别为40μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm,37℃摇床震荡培养,24小时后观察细菌生长情况。对于革兰氏阴性菌阴沟肠杆菌、肺炎克雷伯菌,pi-2的终浓度分别为160μm、80μm、40μm、20μm、10μm、5μm、2.5μm、1.25μm。实验过程中,设两组平行实验,三组对照。对照组分别为:500μl菌液;500μl菌液中加dmso;500μllb培养基。实施例6测定的pi-2对不同细菌最低抑制浓度如表2所示,其对革兰氏阳性菌均有一定的抑制作用,对革兰氏阴性菌无抑制。表2pi-2对不同细菌的最低抑制浓度细菌种类革兰氏特性最低抑制浓度(μm)表皮葡萄球菌革兰氏阳性5枯草芽孢杆菌革兰氏阳性5头状葡萄球菌革兰氏阳性5溶血葡萄球菌革兰氏阳性5阴沟肠杆菌革兰氏阴性>160肺炎克雷伯菌革兰氏阴性>160实施例7pi-3对蜡样芽胞杆菌抑制情况的研究从长有蜡样芽胞杆菌表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于20mllb培养基,调菌液的浓度为od600=0.01,然后分装于两个试管中,每个试管10ml。其中一个试管加入25μlpi-3,另一个试管加入25μldmso作为对照。然后在37℃摇床震荡培养,每半小时测下菌液的od600值。通过观测蜡样芽胞杆菌的生长情况得到图5。图5中的蜡样芽胞杆菌加入dmso的菌液随着时间的增长,细菌数量以比较快的速度逐渐增加,而加入pi-3的菌液的细菌浓度几乎没有增长,表明pi-3的加入抑制了蜡样芽胞杆菌的生长。实施例8pi-3对金黄色葡萄球菌抑制情况的研究从长有金黄色葡萄球菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于20mllb培养基,调菌液的浓度为od600=0.01,然后分装于两个试管中,每个试管10ml。其中一个试管加入25μlpi-3,另一个试管加入25μldmso作为对照。然后在37℃摇床震荡培养,每半小时测下菌液的od600值。通过观测金黄色葡萄球菌的生长情况得到图6。图6中的金黄色葡萄球菌加入dmso的菌液随着时间的增长,细菌数量以比较快的速度逐渐增加,而加入pi-3的菌液的细菌浓度几乎没有增长,表明pi-3的加入抑制了金黄色葡萄球菌的生长。实施例9pi-3对肺炎克雷伯菌抑制情况的研究从长有肺炎克雷伯菌的表面皿挑取单斑于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于20mllb培养基,调菌液的浓度为od600=0.01,然后分装于两个试管中,每个试管10ml。其中一个试管加入25μlpi-3,另一个试管加入25μldmso作为对照。然后在37℃摇床震荡培养,每半小时测下菌液的od600值。通过观测肺炎克雷伯菌的生长情况得到图7。图7中的肺炎克雷伯菌加入dmso的菌液和加入pi-3的菌液随着时间的增长,细菌数量均以比较快的速度逐渐增加,几乎没有明显差异,表明pi-3的加入没有抑制肺炎克雷伯菌的生长。实施例10pi-3对大肠杆菌抑制情况的研究从长有大肠杆菌的表面皿挑取单斑于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于20mllb培养基,调菌液的浓度为od600=0.01,然后分装于两个试管中,每个试管10ml。其中一个试管加入25μlpi-3,另一个试管加入25μldmso作为对照。然后在37℃摇床震荡培养,每半小时测下菌液的od600值。通过观测大肠杆菌的生长情况得到图8。图8中的大肠杆菌加入dmso的菌液和加入pi-3的菌液随着时间的增长,细菌数量均以比较快的速度逐渐增加,几乎没有明显差异,表明pi-3的加入没有抑制大肠杆菌的生长。实施例11pi-3对不同细菌生长的最低抑制浓度的测定分别从长有蜡样芽胞杆菌、金黄色葡萄球菌、腐生葡萄球菌、粪肠球菌、停乳链球菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,第二天将菌液转接于5mllb培养基,37℃摇床培养至菌液的od600=0.5,稀释100倍得到od600=0.005的菌液。分别取500μl菌液加入pi-3至其终浓度分别为40μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm,37℃摇床震荡培养,24小时后观察细菌生长情况。对于革兰氏阴性菌铜绿假单胞菌、大肠杆菌,pi-3的终浓度分别为160μm、80μm、40μm、20μm、10μm、5μm、2.5μm、1.25μm。实验过程中,设两组平行实验,三组对照。对照组分别为:500μl菌液;500μl菌液中加dmso;500μllb培养基。实施例11测定的pi-3对不同细菌最低抑制浓度如表3所示,其对革兰氏阳性菌均有一定的抑制作用,对革兰氏阴性菌无抑制。表3pi-3对不同细菌最低抑制浓度实施例12pi-3对临床耐甲氧西林金黄色葡萄球菌株(mrsa)生长的最低抑制浓度的测定分别从长有mrsa菌株的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于5mllb培养基,37℃摇床震荡培养至菌液的od600=1.0左右,调菌液的浓度为od600=0.5,稀释100倍得到od600=0.005的菌液。96孔板中每孔加入500μl菌液,将pi-3溶于dmso中配制成2mm的母液,然后按照浓度梯度为40μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm的浓度梯度加入pi-3,其中一个对照组加入1μldmso,另一个对照组只加入500μllb培养基。每种菌做两组平行实验。然后将菌液在37℃摇床震荡培养,24小时后观察细菌生长情况。表4是测定过程中所用的临床分离的6种耐甲氧西林金黄色葡萄球菌,通过对多种抗生素的最小抵抗浓度(mic)进行检测,得到其耐药性(s表示敏感、r表示耐药、i表示中间体),说明不同的金黄色葡萄球菌对抗生素的耐药性各不一样,所选的临床金黄色葡萄球菌具有多重耐药性,其中对照菌对抗生素的耐药数目相对于多重抗药菌的耐药数目少。表4临床分离的耐甲氧西林金黄色葡萄球菌对各种抗生素的耐药性数据。(r:耐药性;s:敏感性;i:中间体)实施例15测定的pi-3对不同临床mrsa菌株最低抑制浓度如表5所示,其对临床获得的mrsa菌株均有一定的抑制作用,最低一直浓度为1.25-5μm表5pi-3对不同细菌最低抑制浓度实施例13dapi/pi染色细菌观察pi-3对革兰氏阳性菌的抑制作用从长有金黄色葡萄球菌的表面皿挑取单斑于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于5mllb培养基,37℃摇床震荡培养至菌液的od600=1.0左右,调菌液的浓度为od600=0.5。取2ml菌液于ep管中,将pi-3溶于dmso中配制成2mm的母液,加入10μlpi-3于ep管中(终浓度10μm),对照组加入10μldmso,分别孵育0min、2min、5min、5h、12h后,4000rmp离心2min,弃去上清液。2mlpbs缓冲液(20mm,ph=7.4)中加入2μlpi和5μldapi分别染色对照组和实验组,避光染色10min。4000rmp离心2min,用pbs缓冲液(20mm,ph=7.4)洗3次,洗去多余的染料。再滴加20μl菌液在盖玻片上,盖上琼脂凝胶,在共聚焦显微镜下观察得到图9。由于dapi可以穿过任意细胞膜标记细胞核,而pi只能透过死细胞细胞膜标记细胞核,因此,能够被pi染料标记上的细菌一定是死细菌,而只被dapi标记而未被pi标记的细菌细胞为活细胞。因此观察到图9中加入pi-3的菌液孵育0min到12h均有一定数量的细菌被杀死,且随着孵育时间的增加,杀死的细菌数量也在增加。而对照组细菌状况良好,证明pi-3对革兰氏阳性菌有比较强的杀死作用。实施例14dapi/pi染色细菌观察pi-3对革兰氏阴性菌的抑菌作用从长有大肠杆菌的表面皿挑取单斑于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于5mllb培养基,37℃摇床震荡培养至菌液的od600=1.0左右,调菌液的浓度为od600=0.5。取2ml菌液于ep管中,将pi-3溶于dmso中配制成2mm的母液,加入10μlpi-3于ep管中(终浓度10μm),对照组加入10μldmso,分别孵育0min、2min、5min、5h、12h后,4000rmp离心2min,弃去上清液。2mlpbs缓冲液(20mm,ph=7.4)中加入2μlpi和5μldapi分别染色对照组和实验组,避光染色10min。4000rmp离心2min,用pbs缓冲液(20mm,ph=7.4)3次,洗去多余的染料。在滴加20μl菌液在盖玻片上,盖上琼脂凝胶,在共聚焦显微镜下观察得到图10。由于dapi可以穿过任意细胞膜标记细胞核,而pi只能透过死细胞细胞膜标记细胞核,因此,能够被pi染料标记上的细菌一定是死细菌,而只被dapi标记而未被pi标记的细菌细胞为活细胞。因此观察到图10中加入pi-3的菌液孵育0min到5h未发现细菌被杀死,而孵育12h组出现部分细菌被杀死,但对照组也有相应的死细菌,说明细菌的死亡并非pi-3的作用。因此证明pi-3对革兰氏阴性菌没有杀菌作用。实施例15pi-4对不同细菌生长的最低抑制浓度的测定分别从长有蜡样芽胞杆菌、溶血葡萄球菌、头状葡萄球菌、屎肠球菌、无乳链球菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于5mllb培养基,37℃摇床震荡培养至菌液的od600=1.0左右,调菌液的浓度为od600=0.5,稀释100倍得到od600=0.005的菌液。96孔板中每孔加入500μl菌液,将pi-4溶于dmso中配制成2mm的母液,然后按照浓度梯度为40μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm的浓度梯度加入pi-4。分别从长有副伤寒沙门菌、产酸克雷伯菌的表面皿挑取单斑分别于5mllb培养基中,37℃摇床震荡过夜培养,取部分菌液于5mllb培养基,37℃摇床震荡培养至菌液的od600=1.0左右,调菌液的浓度为od600=0.5,稀释100倍得到od600=0.005的菌液。96孔板中每孔加入500μl菌液,将pi-4溶于dmso中配制成2mm的母液,然后按照浓度梯度为160μm、80μm、40μm、20μm、10μm、5μm、2.5μm、1.25μm的浓度梯度加入pi-4。96孔板中每孔加入500μl菌液,设两组平行实验,其中一个对照组只加入500μl菌液,另一个对照组在菌液中加入dmso,一个空白对照只加入500μllb培养基。然后将96孔板在37℃摇床震荡培养,24小时后观察细菌生长情况。实施例15测定的pi-4对不同细菌最低抑制浓度如表6所示,其对革兰氏阳性菌均有一定的抑制作用,对革兰氏阴性菌无抑制。表6pi-4对不同细菌最低抑制浓度细菌种类革兰氏特性最低抑制浓度(μm)蜡样芽胞杆菌革兰氏阳性2.5溶血葡萄球菌革兰氏阳性5头状葡萄球菌革兰氏阳性5屎肠球菌革兰氏阳性2.5无乳链球菌革兰氏阳性5产酸克雷伯菌革兰氏阴性>160副伤寒沙门菌革兰氏阴性>160当前第1页12