改良六孔板及基于该六孔板的细胞免疫荧光染色方法与流程
本发明涉及生物医学设备技术领域,具体涉及一种改良六孔板及基于该六孔板的细胞免疫荧光染色方法。
背景技术:
免疫荧光技术是细胞、分子生物学常用的一种实验方法。该技术是通过用已标记荧光素的荧光抗体(抗原)作为探针,来检测组织或细胞内相应的抗原(抗体)。在组织或细胞中所形成的抗原-抗体复合物上沉着有荧光素,在荧光显微镜下观察样品,荧光素受激发光的照射而发出荧光,通过荧光所在的细胞或组织,实现对抗原或抗体的定位,同时还可利用定量技术对样本进行定量。荧光素既能标记抗体,也能标记抗原,但由于抗原结构和理化性质较复杂,荧光素标记的条件不易控制,通常用荧光素标记抗体,因此也称为荧光抗体技术。
按照抗体的使用,免疫荧光分析分为间接免疫荧光分析和直接免疫荧光分析两种。间接免疫荧光分析方法通过抗原特异性第一抗体(一抗)标记抗原,再用荧光分子耦联的第二抗体(二抗)特异性标记一抗,从而使抗原所在位点发出荧光。而直接免疫荧光分析是用荧光分子耦联的抗原特异性的抗体直接标记抗原的方法。无论是间接免疫荧光分析还是直接免疫荧光分析,基于细胞爬片的免疫荧光方法均适用。
目前国内主要基于免疫荧光技术研发了一些检测方法及产品或细胞培养相关工具,相关专利申请如专利申请号为cn201821041666.1的中国实用新型专利中公开的一种便于免疫荧光样品制备的玻底培养板,以及专利申请号为cn201810908228.9的中国发明专利申请中公开的一种检测her2抗原不同位点的免疫荧光试剂盒及应用。这些方法及装置都太过于复杂,不易操作,荧光背景较深。
传统的细胞免疫荧光染色方法主要包括以下步骤:
1、将细胞种植到铺有显微盖玻片的普通六孔板中。2、待细胞生长至满度达到显微盖玻片面积的70%左右时进行细胞爬片制备。3、吸弃培养基,用pbs溶液清洗显微盖玻片2次,向各培养孔中加入4%多聚甲醛溶液,室温固定细胞30分钟,然后吸弃六孔板中的固定液,用pbs溶液清洗显微盖玻片3次,每次5分钟,洗去多余的多聚甲醛。4、向每个培养孔中加入0.5%穿膜液(500μltritonx-100溶于100mlpbs中),室温孵育30分钟;穿膜结束后,吸弃0.5%穿膜液。5、用5%bsa封闭细胞1小时。6、用0.1%pbst溶液(100μltween-20溶于100mlpbs中)将兔来源的γ-h2ax一抗按照1:1000的倍数稀释,稀释后的抗体滴加到铺有封口膜的塑料板上,再用镊子把显微盖玻片夹出六孔板,使含有细胞的一面与抗体稀释液接触,倒扣于封口膜上,抗体与细胞室温孵育1.5小时。7、吸弃5%bsa后,用镊子把显微盖玻片夹回六孔板中,之后在摇床上用0.1%pbst溶液清洗显微盖玻片3次,每次5分钟。8、用0.1%pbst溶液将alexa488荧光标记的山羊抗兔二抗按照1:1000的倍数稀释,稀释后的抗体滴加到铺有封口膜的塑料板上,再用镊子把显微盖玻片夹出六孔板,使含有细胞的一面与抗体稀释液接触,倒扣于封口膜上,室温避光孵育1小时,然后用镊子把显微盖玻片夹回六孔板中,之后在摇床上用0.1%pbst溶液避光清洗3次,每次5分钟。9、用1μg/ml的hoechst33342避光染核8分钟,用pbs溶液避光清洗3次,每次5分钟。11、在载玻片上滴加一滴抗荧光淬灭封片剂,把经抗体标记的显微盖玻片中有细胞的一面倒扣于抗荧光淬灭封片剂上,-20℃保存。
作为培养基的基本容器,六孔板不仅广泛用于一般的细胞培养,而且在免疫荧光染色的细胞爬片中发挥重要作用。现有的六孔板一般由六孔板盒体、盖子和设在六孔板盒体上的培养孔组成。
在免疫荧光染色的细胞爬片过程中,常在六孔板中放入显微盖玻片进行细胞爬片后,加入dmem完全培养基,在显微盖玻片上进行细胞的培养,培养完成后须用镊子将显微盖玻片夹出,进行一抗和二抗的孵育,但是普通的六孔板由于底部是平的,显微盖玻片是平的,导致显微盖玻片紧紧贴合在六孔板圆孔底部平面内,不易取出,甚至出现碎片的情况,对实验结果造成不必要的影响。
在进行一抗和二抗孵育时,显微盖玻片要频繁取出放回,浪费时间与精力,而传统的免疫荧光染色方法的缺点也较为明显,实验步骤需要大量时间、显微盖玻片容易破碎,容易导致实验失败。为此,提出一种改良六孔板及基于该六孔板的细胞免疫荧光染色方法。
技术实现要素:
本发明所要解决的技术问题在于:如何在提高免疫荧光染色质量的前提下,减少抗体孵育所花费的时间,减少抗体的使用量,并避免显微盖玻片取放过程中发生碎裂现象。
本发明是通过以下技术方案解决上述技术问题的,本发明包括培养板体与六个培养孔,六个所述培养孔的开口均向上,且其阵列分布在所述培养板体上,所述培养孔的底端表面上开设有开口向上的倒圆台形凹槽,显微盖玻片的直径大于所述倒圆台形凹槽的底端表面直径,小于所述倒圆台形凹槽的上端开口直径,所述倒圆台形凹槽的侧边缘开设有用于插入镊子的预留槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽的内部,培养结束后进行免疫荧光实验时,可以通过将镊子插入所述预留槽中将显微盖玻片夹起。通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中,且显微盖玻片的底面不会与倒圆台形凹槽的底面直接接触,减少了显微盖玻片与培养孔底面之间的接触力,避免了显微盖玻片与培养孔底面直接贴合时难以取出的麻烦,也避免了频繁取出放回可能会导致显微盖玻片碎裂的情况发生。
更进一步的,六个所述培养孔按两行三列阵列分布在所述培养板体上,相邻两个所述培养孔之间的距离相等。等距离均匀排列可以一定程度上增加六孔板的美观度。
更进一步的,所述六孔板还包括盖体,所述盖体设置在所述培养板体的上端,通过所述盖体可将所述培养板体的上部包裹覆盖,实现了对培养板体的密封。
更进一步的,所述预留槽为三角锥形凹槽,所述三角锥形凹槽沿所述倒圆台形凹槽的侧边缘向下延伸,至所述倒圆台形凹槽的底端表面截止。通过在倒圆台形凹槽的侧边缘设置预留槽,在进行免疫荧光实验过程中,对在显微盖玻片上的细胞进行抗体孵育时可以方便地通过镊子取放显微盖玻片,在倒圆台形凹槽内加入抗体稀释液,使显微盖玻片含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内。孵育结束后,将显微盖玻片含有细胞的一面朝上置于所述倒圆台形凹槽内,节省了实验人员的操作时间,从而使实验人员的工作效率得以提高。
更进一步的,所述预留槽为半圆锥形凹槽,所述半圆锥形凹槽沿所述倒圆台形凹槽的侧边缘向下延伸,至所述倒圆台形凹槽的底端表面截止。
更进一步的,所述改良六孔板还包括底板、圆形封盖,所述圆形封盖设置在各倒圆台形凹槽的底端并将其底端密封,所述底板插接在所述培养板体的下端,位于所述圆形封盖的下端,并向上挤压所述圆形封盖。
更进一步的,所述圆形封盖与所述培养板体之间设置有锯齿状槽,所述锯齿状槽分别设置在所述圆形封盖与所述培养板体上,所述圆形封盖上的所述锯齿状槽设置在其上端表面边缘,所述培养板体上的所述锯齿状槽设置在所述培养板体与所述圆形封盖连接处表面。
本发明还提供了一种基于改良六孔板的细胞免疫荧光染色方法,包括以下步骤:
s1:细胞爬片
在超净台中用镊子把显微盖玻片一片一片的放入倒圆台形凹槽中,之后,将1.2×105个hepg2细胞种植到含有显微盖玻片的改良六孔板中的倒圆台形凹槽内,让细胞在显微盖玻片上生长24小时;由于显微盖玻片的直径大于所述倒圆台形凹槽的底端表面直径,小于所述倒圆台形凹槽的上端开口直径,这样显微盖玻片才能方便地放入倒圆台形凹槽中,所述倒圆台形凹槽的侧边缘开设有用于插入镊子的预留槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽的内部,通过将镊子插入所述预留槽中可将显微盖玻片夹起。通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中;
s2:毒素处理
改良六孔板中的hepg2细胞连续培养24小时,待细胞生长至对数生长期后,将原培养基吸弃,再用含有不同浓度的微囊藻毒素-lr(mc-lr)的dmem完全培养基培养细胞24小时,对照组加入等体积的dmem完全培养基;配制mc-lr时,首先,取用3个5ml的离心管,分别对应1μm、0.1μm、0.01μm三个浓度,向三个离心管中分别加入2450、2250、2250μl的dmem完全培养基,取50μm的纯mc-lr储备液50μl加入到含有2450μldmem完全培养基的1μm处理组的离心管中,吹吸均匀;然后从1μm处理组的离心管中取250μl混合液加入到含有2250μldmem完全培养基的0.1μm处理组的离心管中,吹吸均匀;再从0.1μm处理组的离心管中取250μl混合液加入到0.01μm处理组的离心管中,吹吸均匀;最终配置得到2250μl的1μm、2250μl的0.1μm和2500μl的0.01μm的mc-lr工作液,各取2ml的不同浓度的mc-lr工作液加入到对应的培养孔中,毒素处理24小时;
s3:细胞固定
吸弃含毒素的dmem完全培养基,用pbs溶液清洗显微盖玻片2次,向各培养孔中加入1ml的3%戊二醛溶液,室温固定细胞10分钟,然后吸弃改良六孔板中的固定液,用pbs溶液清洗显微盖玻片3次,每次清洗时长为5分钟,洗去残余的戊二醛溶液;
s4:穿膜
向每个培养孔中加入1ml的1%穿膜液(1mltritonx-100溶于100mlpbs溶液中),室温孵育10分钟;穿膜结束后,吸弃1%穿膜液,用pbs溶液清洗1次;
s5:封闭
向每个培养孔中加入1ml的无蛋白快速封闭液(1x),封闭10分钟;
s6:一抗孵育
回收无蛋白快速封闭液(1x),用无蛋白快速封闭液(1x)将兔来源的γ-h2ax一抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿预留槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃孵育30分钟后,再用镊子沿预留槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的一抗稀释液吸弃,再用0.2%pbst溶液(200μltween-20溶于100mlpbs中)清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余一抗;
s7:二抗孵育
用无蛋白快速封闭液(1x)将alexa488荧光标记的山羊抗兔二抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿预留槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃避光孵育20分钟后,再用镊子沿预留槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的二抗稀释液吸弃,再用0.2%pbst溶液避光清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余二抗;
s8:细胞核复染
用1μg/ml的hoechst33342避光染核2分钟,用pbs溶液避光清洗5次,每次清洗时长为5分钟;
s9:显色
在载玻片上滴加抗荧光淬灭封片剂,然后把经抗体标记的显微盖玻片中有细胞的一面倒扣于抗荧光淬灭封片剂上,吸弃显微盖玻片周围多余的抗荧光淬灭封片剂,然后于荧光显微镜下观察荧光并拍照。
更进一步的,在所述步骤s1中,进行细胞爬片前,需要将显微盖玻片放入100mm直径的培养皿中,倒入纯度为75%的乙醇,在摇床上慢速摇晃24小时再放入紫外线中照射30分钟,最后用基本培养基清洗2次后放入含有基本培养基的100mm直径的培养皿中,用封口膜封住四周,放入4℃环境下浸泡6小时以上,保存备用。
更进一步的,在所述步骤s6和s7中,一抗孵育和二抗孵育的过程中抗体稀释液加入的量均为60μl。
本发明相比现有技术具有以下优点:
本发明的六孔板通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中,且显微盖玻片的底面不会与倒圆台形凹槽的底面直接接触,减少了显微盖玻片与培养孔底面之间的接触力,避免了显微盖玻片与培养孔底面直接贴合时难以取出的麻烦,也避免了频繁取出放回可能会导致显微盖玻片碎裂的情况发生;通过在倒圆台形凹槽的侧边缘设置预留槽,在进行免疫荧光实验时,可以方便地通过镊子取放显微盖玻片,节省了实验人员的操作时间,从而使实验人员的工作效率得以提高。
本发明的免疫荧光染色方法操作简便,容易掌握,减少了免疫荧光实验的整体时间;由于改良后的六孔板显著减少了一抗和二抗抗体的使用量,节约了成本;并且所用的3%戊二醛固定液对细胞的固定渗透效果较佳;无蛋白快速封闭液封闭效果好,封闭速度快,特别适合磷酸化抗原的封闭,节约时间,降低了荧光图片的背景;用回收的无蛋白快速封闭液(1x)稀释抗体,可以减少抗体的非特异性结合,并节约使用无蛋白快速封闭液(1x)的成本;相较于浓度为0.1%的pbst溶液,0.2%的pbst溶液对残余一抗和二抗的清洗效果更好;相较于浓度为0.5%的穿膜液,1%的穿膜液增加细胞膜通透性的效果更好。
附图说明
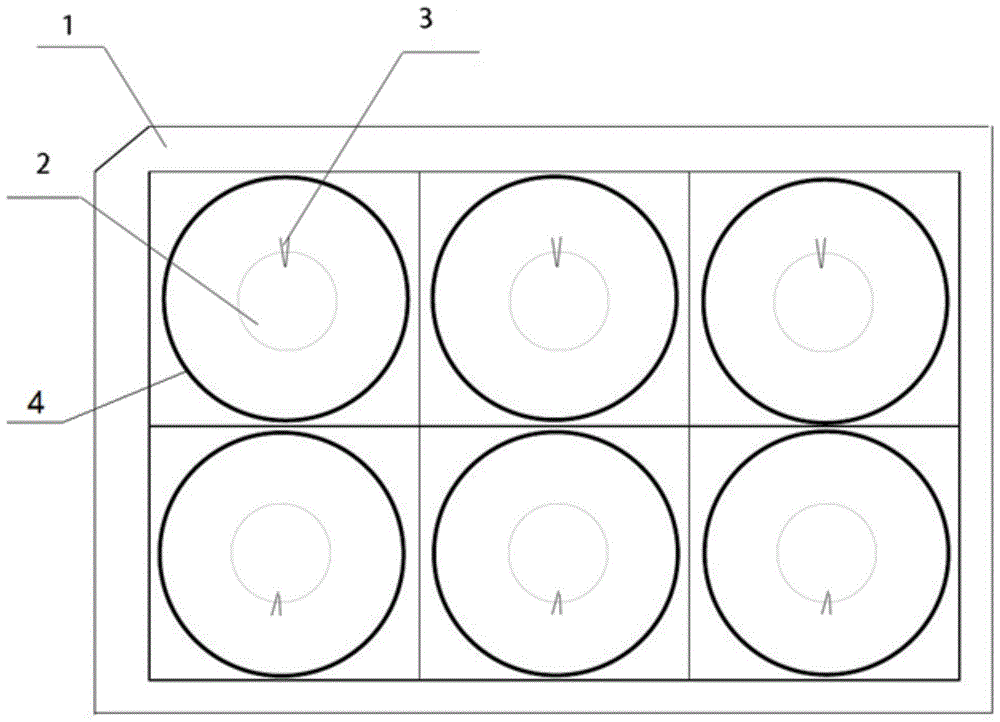
图1是本发明实施例一中培养板体的俯视图;
图2是本发明实施例一中倒圆台形凹槽与三角锥形凹槽的相结合示意图;
图3是本发明实施例一中底板与圆形封盖的相结合示意图;
图4是本发明实施例一中改良六孔板的仰视图;
图5是本发明实施例一中底板插入槽条时的局部示意图;
图6是本发明实施例一中圆形封盖与培养板体压合时的局部示意图;
图7是本发明基于改进六孔板的细胞免疫荧光染色方法的总体流程示意图。
图8是利用传统细胞免疫荧光染色方法,并使用hoechst33342染料对细胞核的染色图;
图9是利用传统细胞免疫荧光染色方法,并使用兔来源的γ-h2ax一抗和alexa488荧光标记的山羊抗兔二抗对细胞核中γ-h2ax损伤点的染色图;
图10是图8和图9的合成图;
图11是本发明实施例一中使用hoechst33342染料对细胞核的染色图;
图12是本发明实施例一中使用兔来源的γ-h2ax一抗和alexa488荧光标记的山羊抗兔二抗对细胞核中γ-h2ax损伤点的染色图;
图13是图11和图12的合成图。
图1~6中:1、培养板体;2、倒圆台形凹槽;3、三角锥形凹槽;4、培养孔;5、圆形封盖;51、锯齿状槽;6、槽条;7、底板;8、抠台。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例一
如图1~7所示,本实施例提供技术方案:改良六孔板,包括培养板体1与六个培养孔4,六个所述培养孔4的开口均向上,且其阵列分布在所述培养板体1上,所述培养孔4的底端表面上开设有开口向上的倒圆台形凹槽2,显微盖玻片的直径大于所述倒圆台形凹槽2的底端表面直径,小于所述倒圆台形凹槽2的上端开口直径,这样显微盖玻片才能方便地放入倒圆台形凹槽2中,所述倒圆台形凹槽2的侧边缘开设有用于插入镊子的预留槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽2的内部,通过将镊子插入所述预留槽中可将显微盖玻片夹起。通过在培养孔4的底端设置倒圆台形凹槽2,可以方便地将显微盖玻片放入其中,且显微盖玻片的底面不会与倒圆台形凹槽2的底面直接接触贴合,减少了显微盖玻片与培养孔4之间的接触力,避免了显微盖玻片与培养孔4底面直接贴合时难以取出的麻烦,也避免了频繁取出放回可能会导致显微盖玻片碎裂的情况发生。
六个所述培养孔4按两行三列阵列分布在所述培养板体1上,相邻两个所述培养孔4之间的距离相等。等距离均匀排列可以一定程度上增加六孔板的美观度。
所述六孔板还包括盖体,所述盖体设置在所述培养板体1的上端,通过所述盖体可将所述培养板体1的上部包裹覆盖,实现了对培养板体1的密封。
在本实施例中所述预留槽为三角锥形凹槽3,所述三角锥形凹槽3沿所述倒圆台形凹槽2的侧边缘向下延伸,至所述倒圆台形凹槽2的底端表面截止。
所述改良六孔板还包括底板7、圆形封盖5,所述圆形封盖5设置在各倒圆台形凹槽2的底端并将其底端密封,所述底板7插接在所述培养板体1的下端,所述培养板体1的下端两侧边缘和后边缘均设有槽条6,所述槽条6与培养板体1一体成型,所述槽条6的内部设有水平插槽,所述底板7的边缘便插在水平插槽内部,所述底板7的前端中部位置设有向下弯折的抠台8,用于方便将所述底板7拆装。
所述底板7位于所述圆形封盖5的下端,底板7的上表面靠近各圆形封盖5的位置均有一体成型的凸台,凸台与底板7之间的连接处光滑曲面过渡,这样在底板7插入时便会向上挤压所述圆形封盖5,将其压紧。
在使用完该六孔板后,可以将底板7抽出,然后将各个培养孔4下方的圆形封盖5取出,能够很方便地清洗倒圆台形凹槽2的内部,清洗得更加彻底。然后经过泡酸处理、再烘干并利用紫外线杀菌后,将六孔板组装完成后还可以在一些要求相对不高的基础实验中重复使用,可以节约一定的成本。
所述圆形封盖5与所述培养板体1之间设置有锯齿状槽51,所述锯齿状槽51分别设置在所述圆形封盖5与所述培养板体1上,所述圆形封盖5上的所述锯齿状槽51设置在圆形封盖5上端表面边缘,所述培养板体1上的所述锯齿状槽51设置在所述培养板体1与所述圆形封盖5连接处表面,在两条锯齿状槽51的相接面上放置有一密封胶垫,根据密封胶垫的使用状况可以定期更换。
本实施例还提供了一种细胞免疫荧光染色方法,包括以下步骤:
s1:细胞爬片
在超净台中用镊子把显微盖玻片一片一片的放入倒圆台形凹槽中,之后,将1.2×105个hepg2细胞种植到含有显微盖玻片的改良六孔板中的倒圆台形凹槽内,让细胞在显微盖玻片上生长24小时;由于显微盖玻片的直径大于所述倒圆台形凹槽的底端表面直径,小于所述倒圆台形凹槽的上端开口直径,这样显微盖玻片才能方便地放入倒圆台形凹槽中,所述倒圆台形凹槽的侧边缘开设有用于插入镊子的三角锥形凹槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽的内部,通过将镊子插入所述三角锥形凹槽中可将显微盖玻片夹起。通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中;
s2:毒素处理
改良六孔板中的hepg2细胞连续培养24小时,待细胞生长至对数生长期后,将原培养基吸弃,再用含有不同浓度的mc-lr的dmem完全培养基培养细胞24小时,对照组加入等体积的dmem完全培养基;配制mc-lr时,首先,取用3个5ml的离心管,分别对应1μm、0.1μm、0.01μm三个浓度,向三个离心管中分别加入2450、2250、2250μl的dmem完全培养基,取50μm的纯mc-lr储备液50μl加入到含有2450μldmem完全培养基的1μm处理组的离心管中,吹吸均匀;然后从1μm处理组的离心管中取250μl混合液加入到含有2250μldmem完全培养基的0.1μm处理组的离心管中,吹吸均匀;再从0.1μm处理组的离心管中取250μl混合液加入到0.01μm处理组的离心管中,吹吸均匀;最终配置得到2250μl的1μm、2250μl的0.1μm和2500μl的0.01μm的mc-lr工作液,各取2ml不同浓度的mc-lr工作液加入到对应的培养孔中,毒素处理24小时;
s3:细胞固定
吸弃含毒素的培养基,用pbs溶液清洗显微盖玻片2次,向各培养孔中加入1ml的3%戊二醛溶液,室温固定细胞10分钟,然后吸弃改良六孔板中的固定液,用pbs溶液清洗显微盖玻片3次,每次清洗时长为5分钟,洗去残余的戊二醛;
s4:穿膜
向每个培养孔中加入1ml的1%穿膜液,室温孵育10分钟;穿膜结束后,吸弃1%穿膜液,用pbs溶液清洗1次;
s5:封闭
向每个培养孔中加入1ml的无蛋白快速封闭液(1x),封闭10分钟;
s6:一抗孵育
回收无蛋白快速封闭液(1x),用无蛋白快速封闭液(1x)将兔来源的γ-h2ax一抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿三角锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃孵育30分钟后,再用镊子沿三角锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的一抗稀释液吸弃,再用0.2%pbst溶液清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余一抗;
s7:二抗孵育
用无蛋白快速封闭液(1x)将alexa488荧光标记的山羊抗兔二抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿三角锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃避光孵育20分钟后,再用镊子沿三角锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的一抗稀释液吸弃,再用0.2%pbst溶液避光清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余二抗;
s8:细胞核复染
用1μg/ml的hoechst33342避光染核2分钟,用pbs溶液避光清洗5次,每次清洗时长为5分钟;
s9:显色
在载玻片上滴加抗荧光淬灭封片剂,然后把经抗体标记的显微盖玻片中有细胞的一面倒扣于抗荧光淬灭封片剂上,吸弃显微盖玻片周围多余的抗荧光淬灭封片剂,然后荧光显微镜下观察荧光并拍照。
在所述步骤s1中,进行细胞爬片前,需要将显微盖玻片放入100mm直径的培养皿中,倒入纯度为75%的乙醇,在摇床上慢速摇晃24小时再放入紫外线中照射30分钟,最后用基本培养基清洗2次后放入含有基本培养基的100mm直径的培养皿中,用封口膜封住四周,放入4℃冰箱中浸泡6小时以上,保存备用。
在所述步骤s6和s7中,一抗孵育和二抗孵育的过程中抗体稀释液加入的量均为60μl。
实施例二
本实施例提供技术方案:改良六孔板,包括培养板体与六个培养孔,六个所述培养孔的开口均向上,且其阵列分布在所述培养板体上,所述培养孔的底端表面上开设有开口向上的倒圆台形凹槽,显微盖玻片的直径略大于所述倒圆台形凹槽的底端表面直径,小于所述倒圆台形凹槽的上端开口直径,所述倒圆台形凹槽的侧边缘开设有用于插入镊子的预留槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽的内部,通过将镊子插入所述预留槽中可将显微盖玻片夹起。通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中,且显微盖玻片的底面不会与倒圆台形凹槽的底面直接接触贴合,减少了显微盖玻片与培养孔底面之间的接触力,避免了显微盖玻片与培养孔底面直接贴合时难以取出的麻烦,也避免了频繁取出放回可能会导致显微盖玻片碎裂的情况发生。
六个所述培养孔按两行三列阵列分布在所述培养板体上,相邻两个所述培养孔之间的距离相等。等距离均匀排列可以一定程度上增加六孔板的美观度。
所述六孔板还包括盖体,所述盖体设置在所述培养板体的上端,通过所述盖体可将所述培养板体的上部包裹覆盖,实现了对培养板体的密封。
在本实施例中所述预留槽为半圆锥形凹槽,所述半圆锥形凹槽沿所述倒圆台形凹槽的侧边缘向下延伸,至所述倒圆台形凹槽的底端表面截止。通过在倒圆台凹形槽的侧边缘设置半圆锥形凹槽,在进行免疫荧光实验时,可以方便地通过镊子取放显微盖玻片,节省了实验人员的操作时间,从而使实验人员的工作效率得以提高。
所述改良六孔板还包括底板7、圆形封盖5,所述圆形封盖5设置在各倒圆台形凹槽2的底端并将其底端密封,所述底板7插接在所述培养板体1的下端,所述培养板体1的下端两侧边缘和后边缘均设有槽条6,所述槽条6与培养板体1一体成型,所述槽条6的内部设有水平插槽,所述底板7的边缘便插在水平插槽内部,所述底板7的前端中部位置设有向下弯折的抠台8,用于方便将所述底板7拆装。
所述底板7位于所述圆形封盖5的下端,底板7的上表面靠近各圆形封盖5的位置均有一体成型的凸台,凸台与底板7之间的连接处光滑曲面过渡,这样在底板7插入时便会向上挤压所述圆形封盖5,将其压紧。
在使用完该六孔板后,可以将底板7抽出,然后将各个培养孔4下方的圆形封盖5取出,能够很方便地清洗倒圆台形凹槽2的内部,经过泡酸处理、再烘干并利用紫外线杀菌后,将六孔板组装完成后还可以在一些要求相对不高的基础实验中重复使用,可以节约一定的成本。
所述圆形封盖5与所述培养板体1之间设置有锯齿状槽51,所述锯齿状槽51分别设置在所述圆形封盖5与所述培养板体1上,所述圆形封盖5上的所述锯齿状槽51设置在圆形封盖5上端表面边缘,所述培养板体1上的所述锯齿状槽51设置有所述培养板体1与所述圆形封盖5连接处表面。
本实施例还提供了一种细胞免疫荧光染色方法,包括以下步骤:
s1:细胞爬片
在超净台中用镊子把显微盖玻片一片一片的放入倒圆台形凹槽中,之后,将1.2×105个hepg2细胞种植到含有显微盖玻片的改良六孔板中的倒圆台形凹槽内,让细胞在显微盖玻片上生长24小时;由于显微盖玻片的直径大于所述倒圆台形凹槽的底端表面直径,小于所述倒圆台形凹槽的上端开口直径,这样显微盖玻片才能方便地放入倒圆台形凹槽中,所述倒圆台形凹槽的侧边缘开设有用于插入镊子的半圆锥形凹槽,在进行细胞培养时,显微盖玻片置于所述倒圆台形凹槽的内部,通过将镊子插入所述半圆锥形凹槽中可将显微盖玻片夹起。通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中;
s2:毒素处理
改良六孔板中的hepg2细胞连续培养24小时,待细胞生长至对数生长期后,将原培养基吸弃,再用含有不同浓度的mc-lr的dmem完全培养基培养细胞24小时,对照组加入等体积的dmem完全培养基,可以比较毒素处理组和对照组之间的差别;配制mc-lr时,首先,取用3个5ml的离心管,分别对应1μm、0.1μm、0.01μm三个浓度,向三个离心管中分别加入2450、2250、2250μl的dmem完全培养基,取50μm的纯mc-lr储备液50μl加入到含有2450μldmem完全培养基的1μm处理组的离心管中,吹吸均匀;然后从1μm处理组的离心管中取250μl混合液加入到含有2250μldmem完全培养基的0.1μm处理组的离心管中,吹吸均匀;再从0.1μm处理组的离心管中取250μl混合液加入到0.01μm处理组的离心管中,吹吸均匀;最终配置得到2250μl的1μm、2250μl的0.1μm和2500μl的0.01μm的mc-lr工作液,各取2ml不同浓度的mc-lr工作液加入到对应的培养孔中,毒素处理24小时;
s3:细胞固定
吸弃含毒素的培养基,用pbs溶液清洗显微盖玻片2次,向各培养孔中加入1ml3%戊二醛溶液,室温固定细胞10分钟,然后吸弃改良六孔板中的固定液,用pbs溶液清洗显微盖玻片3次,每次清洗时长为5分钟,洗去残余的戊二醛;
s4:穿膜
向每个培养孔中加入1ml的1%穿膜液,室温孵育10分钟;穿膜结束后,吸弃1%穿膜液,用pbs溶液清洗1次;
s5:封闭
向每个培养孔中加入1ml的无蛋白快速封闭液(1x),封闭10分钟;
s6:一抗孵育
回收无蛋白快速封闭液(1x),用无蛋白快速封闭液(1x)将兔来源的γ-h2ax一抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿半圆锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃孵育30分钟后,再用镊子沿半圆锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的一抗稀释液吸弃,再用0.2%pbst溶液清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余一抗;
s7:二抗孵育
用无蛋白快速封闭液(1x)将alexa488荧光标记的山羊抗兔二抗按照1:1000的倍数稀释,将抗体稀释液加到倒圆台形凹槽内部,用镊子沿半圆锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面与抗体稀释液接触,倒扣于倒圆台形凹槽内,在37℃避光孵育20分钟后,再用镊子沿半圆锥形凹槽伸入倒圆台形凹槽内把显微盖玻片夹起,使含有细胞的一面朝上,用移液器将倒圆台形凹槽内的一抗稀释液吸弃,再用0.2%pbst溶液避光清洗显微盖玻片6次,每次清洗时长为5分钟,以便去除残余二抗;
s8:细胞核复染
用1μg/ml的hoechst33342避光染核2分钟,用pbs溶液避光清洗5次,每次清洗时长为5分钟;
s9:显色
在载玻片上滴加抗荧光淬灭封片剂,然后把经抗体标记的显微盖玻片中有细胞的一面倒扣于抗荧光淬灭封片剂上,吸弃显微盖玻片周围多余的抗荧光淬灭封片剂,然后荧光显微镜下观察荧光并拍照。
在所述步骤s1中,进行细胞爬片前,需要将显微盖玻片放入100mm直径的培养皿中,倒入纯度为75%的乙醇,在摇床上慢速摇晃24小时再放入紫外线中照射30分钟,最后用基本培养基清洗2次后放入含有基本培养基的100mm直径的培养皿中,用封口膜封住四周,放入4℃冰箱中浸泡6小时以上,保存备用。
在所述步骤s6和s7中,一抗孵育和二抗孵育的过程中抗体稀释液加入的量均为60μl。
如图8~10所示,图8、图9和图10所示的是利用传统的细胞免疫荧光染色方法标记γ-h2ax损伤点的免疫荧光染色图,其中图8是hoechst33342染料对细胞核的染色图,可以看出细胞核轮廓不清晰,细胞核有重叠,图9是使用兔来源的γ-h2ax一抗和alexa488荧光标记的山羊抗兔二抗对细胞核中γ-h2ax损伤点的染色图,图中白色亮点均为含有γ-h2ax损伤点的细胞,图10是图8和图9的合成图,做成合成图后可以更好的定位γ-h2ax损伤点的位置是否在细胞核中。
图11、图12和图13所示的是本发明实施例一所提供的细胞免疫荧光染色方法标记γ-h2ax损伤点的免疫荧光染色图,其中图11是hoechst33342染料对细胞核的染色图,可以看出细胞核轮廓清晰,细胞核之间层次分明,图12是使用兔来源的γ-h2ax一抗和alexa488荧光标记的山羊抗兔二抗对细胞核中γ-h2ax损伤点的染色图,图中白色亮点均为含有γ-h2ax损伤点的细胞。图13是图11和图12的合成图,做成合成图后可以更好的定位γ-h2ax损伤点的位置是否在细胞核中。
由于实施例二与实施例一中的细胞免疫荧光染色方法和其中参数未作改变,因此实施结果与实施例一相同,请参照实施例一,此处不再赘述。
由以上实验可知,按照本发明的免疫荧光染色法的步骤s5、s6、s7,可以加快封闭及抗体孵育的实验操作速度,降低免疫荧光图背景的产生,且对细胞的染色效果好,能够根据计数后的细胞核数量精确判断细胞数量,且容易确定γ-h2ax损伤点的位置,定位受损伤的细胞。
综上所述,上述两组实施例中的六孔板通过在培养孔的底端设置倒圆台形凹槽,可以方便地将显微盖玻片放入其中,且显微盖玻片的底面不会与倒圆台形凹槽的底面直接接触,减少了显微盖玻片与培养孔底面之间的接触力,避免了显微盖玻片与培养孔底面直接贴合时难以取出的麻烦,也避免了频繁取出放回可能会导致显微盖玻片碎裂的情况发生;通过在倒圆台形凹槽的侧边缘设置预留槽,在进行免疫荧光实验时,可以方便地通过镊子取放显微盖玻片,节省了实验人员的操作时间,从而使实验人员的工作效率得以提高;上述两组实施例中免疫荧光染色方法操作简便,容易掌握,所用的3%戊二醛固定液对细胞的固定渗透效果较佳;所用的无蛋白快速封闭液封闭效果好,封闭速度快,特别适合磷酸化抗原的封闭,节约时间,降低了荧光图片的背景;用回收的无蛋白快速封闭液(1x)稀释抗体,可以减少抗体的非特异性结合,并节约使用无蛋白快速封闭液(1x)的成本;相较于浓度为0.1%的pbst溶液,0.2%的pbst溶液对残余一抗和二抗的清洗效果更好;相较于浓度为0.5%的穿膜液,1%的穿膜液增加细胞膜通透性的效果更好。
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!