一种乳糖的高灵敏度检测方法与流程
本发明涉及糖类分析检测技术领域,具体涉及一种乳糖的高灵敏度检测方法。
背景技术:
乳糖作为乳制品中主要组成成分,其含量的测定在乳制品等食品加工与质量控制领域非常重要。由于成年期乳糖酶缺乏所致的乳糖不耐症患者约占世界人口的65%。乳糖不耐症患者如果食用或饮用了含有乳糖的食品及乳制品后可能引起肠胃气胀、胃痛和腹泻等症状,影响身体健康。为了满足乳糖不耐受人群对钙和优质蛋白质的营养需求,系列无乳糖动物乳替代品及食品不断被开发,为确保无乳糖产品的安全性及乳糖不耐症患者的健康饮食,对食品及饮品中乳糖的测定有着迫切的需求,开发操作简便,高灵敏度的乳糖检测技术已成该领域的关注重点。
目前检测乳糖的方法主要有气相色谱法、超高效液相色谱-串联质谱法和核磁共振法等。然而,这些方法大多需要昂贵的设备和复杂的取样过程。荧光检测方法具有操作简便、快速、灵敏度高、选择性好、成本低等优点,具有较高的实用性和推广价值。然而,荧光检测的原理主要是基于酶的催化反应,所需葡萄糖氧化酶(gox),β-半乳糖苷酶及过氧化物酶存活的条件较为苛刻,需要低温保存在一定浓度的pbs溶液中,长时间暴露在室温或者较高温度下酶会以较快的速度失活分解,限制了酶的正常利用,而且葡萄糖氧化酶及β-半乳糖苷酶价格昂贵、制备复杂,在广泛的应用中存在着成本高、酶的稳定性差等致命缺点。因此,亟需开发成本低廉可以显著提高酶的稳定性,显著提高乳糖检测灵敏度的基于荧光检测原理的乳糖快速检测技术。
技术实现要素:
针对上述现有技术,本发明的目的是提供一种乳糖的高灵敏度检测方法,实现了对乳糖的高效、灵敏检测;有效解决了荧光检测乳糖的方法中所存在的酶用量多、酶易失活等问题。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种auncs/β-gal/gox@zif-8复合物,所述auncs/β-gal/gox@zif-8复合物由如下方法制备而成:
室温下将锕化锌{zn(ac)2}溶液、葡萄糖氧化酶(gox)溶液、β-半乳糖苷酶(β-gal)溶液、金纳米族(auncs)溶液和2-甲基咪唑溶液按体积比为1:(0.9-1.1):(1.4-1.6):(0.7-0.9):1混合,搅拌1-3min,然后静置8-12h;离心洗涤,制备得到auncs/β-gal/gox@zif-8复合物。
优选的,所述锕化锌溶液的浓度为150-170mmol/l;所述葡萄糖氧化酶溶液的浓度为0.4-0.6mg/ml;所述β-半乳糖苷酶溶液的浓度为0.3-0.5mg/ml;所述auncs溶液的浓度为0.6-0.9mg/ml;所述2-甲基咪唑溶液的浓度为0.13-0.17mol/l。
优选的,所述auncs溶液由如下方法制备而成:
(1)将haucl4水溶液加入到剧烈搅拌状态下的牛血清蛋白(bsa)溶液中,在35-40℃条件下持续搅拌3-8min;
(2)向步骤(1)获得的溶液中加入naoh溶液,在35-40℃条件下持续剧烈搅拌20-28h;
(3)将步骤(2)获得的溶液在超纯水中透析40-50h,制备得到auncs溶液。
更优选的,所述haucl4水溶液的浓度为8-12mmol/l;bsa溶液的浓度为40-60mg/ml;naoh溶液的浓度为0.5-1.5mol/l。
更优选的,haucl4水溶液、bsa溶液和naoh溶液加入的体积比为(4-6):(4-6):(0.4-0.6)。
本发明的第二方面,提供上述auncs/β-gal/gox@zif-8复合物在如下1)或2)中的用途:
1)乳糖检测;
2)制备定性或定量检测乳糖的试剂或试剂盒。
本发明的第三方面,提供一种乳糖的高灵敏度检测方法,包括以下步骤:
(1)将待测溶液、fe2+溶液和auncs/β-gal/gox@zif-8复合物溶液混合,作为检测体系,调节检测体系的ph为4-9;
(2)将检测体系水浴处理10-20分钟,在375nm激发下测定检测体系的荧光光谱及在650nm处荧光强度值,从而实现对待测溶液中乳糖的检测。
优选的,步骤(1)中,所述待测溶液、fe2+溶液和auncs/β-gal/gox@zif-8复合物溶液加入的体积比为(4-6):(40-60):(900-1000)。
更优选的,所述fe2+溶液的浓度为0.4-0.6mmol/l;所述auncs/β-gal/gox@zif-8复合物溶液的浓度为40-60mg/ml。
优选的,步骤(2)中,所述水浴处理的温度为30-40℃。
优选的,步骤(2)中,所述对待测溶液中乳糖的检测为定性检测或定量检测;
当为定性检测时,按照如下确定所述待测溶液中是否含有乳糖:
若加入待测溶液后所测定的荧光强度值低于对照值,则所述待测溶液中含有或候选含有乳糖;若加入待测溶液后所测定的荧光强度值高于或等于对照值,则所述待测溶液中不含乳糖;
所述对照值是用不含乳糖的溶液代替所述待测溶液进行步骤(1)-(2)所测得的荧光强度值。
当为定量检测时,按照如下确定所述待测溶液中乳糖的含量:根据所测得的荧光强度值计算荧光淬灭率,代入线性方程,从而计算出待测溶液中乳糖的含量;
进一步地,所述线性方程按照如下方法获得:用系列已知浓度的乳糖标准品代替所述待测溶液进行步骤(1)-(2),测得各浓度的乳糖标准品对应的荧光强度,计算荧光淬灭率,从而获得荧光淬灭率与乳糖浓度之间的线性方程。
本发明的有益效果:
(1)本发明首次选用具有强荧光活性的牛血清白蛋白稳定功能化的金纳米簇(auncs)作为荧光探针,选用葡萄糖氧化酶(gox)、β-半乳糖苷酶作为联酶,选用zif-8作为荧光探针及联酶的包覆材料,合成荧光联酶检测体系并应用于乳糖的检测。首次完成了荧光联酶检测体系auncs/β-gal/gox@zif-8的绿色制备。解决了色谱法存在的样品预处理程序繁琐和仪器昂贵,传统酶法荧光检测成本高,酶用量多,酶不稳定易于失活等问题。
其中,咪唑分子筛骨架(zif-8)独特的结构特点在提高酶的适用性方面具有独有的优势。一方面,zif-8可以实现葡萄糖氧化酶(gox)、β-半乳糖苷酶及auncs的共包覆,其包覆可以显著提高酶的稳定性。另一方面,由于联酶体系集中包封于zif-8内,zif-8将两种酶包在一起,使两种酶的距离拉近,一种酶生成的产物是另一种酶的反应物,因为两种酶距离较近且zif8包封,生成的中间物基本都被留在了zif-8中,所以浓度较高,因此初级酶促反应产物集中于zif-8内,为下一级联酶反应提供较高反应物的浓度,从而显著提升多酶级联反应的催化效率。
auncs作为zif-8的客体材料具有体积小、合成路线简单、生物相容性好、稳定性高等优点。此外,牛血清白蛋白稳定功能化的auncs,其表面牛血清白蛋白能有效促进其与葡萄糖氧化酶(gox)以及β-半乳糖苷酶的结合,促进auncs/gox/β-gal的表面迅速形成zif-8外壳涂层。本研究发现auncs/gox/β-gal被zif-8包裹后,过氧化物酶及葡萄糖氧化酶活性稳定,储存期较长,并可反复使用(样品检测完毕可立刻收集,用于再次使用)。
本发明提供的auncs/β-gal/gox@zif-8,与auncs、gox及β-gal溶液的均匀混合物相比较,荧光消减速率提高了3.4倍,且具有较高的长期贮存稳定性和抗消化酶及螯合物的稳定性。
(2)本发明采用auncs/β-gal/gox@zif-8对乳糖进行检测,其检测条件温和,auncs/β-gal/gox@zif-8可以反复使用,在检测完成可以对auncs/β-gal/gox@zif-8进行收集并再次使用,大大降低了检测成本。
(3)本发明的检测方法可迅速检测到样品中是否含有乳糖,检测限为10.12μmol/l,操作简便、灵敏性高、靶向性强,可以准确用于乳制品及食品中乳糖含量的检测,适于推广应用。
附图说明
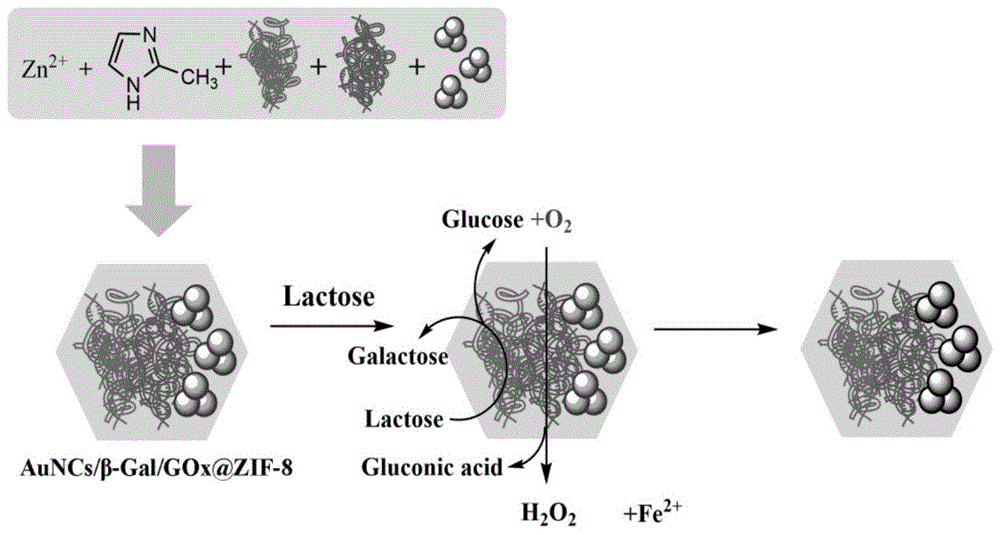
图1:本发明检测乳糖的原理图。
图2:本发明auncs/β-gal/gox@zif-8复合物的合成效果表征;其中,a:zif-8和本发明合成auncs/β-gal/gox@zif-8复合物的xrd图谱,b:zif-8和本发明合成auncs/β-gal/gox@zif-8复合物的红外光谱图。
图3:zif-8对auncs和酶的不同包封形式荧光淬灭效果比较。
图4:fe2+对auncs/β-gal/gox@zif-8荧光联酶检测体系优化效果。
图5:不同检测条件对auncs/β-gal/gox@zif-8荧光联酶检测体系检测效果的影响;其中,a:ph;b:反应时间。
图6:auncs/β-gal/gox@zif-8复合物与游离auncs/β-gal/gox的稳定性比较;(a)室温下ph7.4磷酸盐缓冲盐水中培养的auncs/β-gal/gox@zif-8复合物与游离auncs/β-gal/gox长期储存稳定性比较。(b)室温下在含0.25wt%胰蛋白酶或1wt%的edta的ph7.4磷酸盐缓冲盐水中培养的auncs/β-gal/gox@zif-8与游离auncs/β-gal/gox的稳定性比较。
图7:不同浓度乳糖的检测结果及荧光消减速率与乳糖浓度间的线性关系,(a)不同浓度乳糖的荧光光谱图;(b)荧光消减速率与乳糖浓度之间的线性关系。
图8:本发明构建的auncs/β-gal/gox@zif-8荧光联酶检测体系对乳糖的靶向性考察。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
术语说明:
本发明中的“室温”,是指温度为15-30℃。
正如背景技术部分所介绍的,荧光法检测乳糖具有操作简便、快速、选择性好、成本低等优点。然而,荧光检测的原理主要是基于酶的催化反应,所需葡萄糖氧化酶(gox),β-半乳糖苷酶及过氧化物酶存活的条件较为苛刻,需要低温保存在一定浓度的pbs溶液中,长时间暴露在室温或者较高温度下酶会以较快的速度失活分解。另外,由于酶易失活,需重新配制,所需酶的量较多,检测成本较高。
基于此,本发明的目的在于构建一种新的乳糖高灵敏度检测方法,有效解决了荧光法测定乳糖所存在的酶用量多、酶易失活等问题。
本发明在室温下将auncs、β-gal、gox、zn2+和2-甲基咪唑简单地混合得到auncs/β-gal/gox@zif-8复合材料,并构建了一种高灵敏度、高靶向性乳糖的检测方法。
本发明检测乳糖的原理如图1所示,咪唑分子筛骨架(zif-8)特有的晶体结构在提高酶的适用性、稳定性及催化活性方面具有独特的优势,bsa稳定的荧光金纳米团簇auncs由于其极小的尺寸和表面覆有的bsa,可以在室温下与葡萄糖氧化酶(gox)和β-半乳糖苷酶(β-gal)共同包封于zif-8涂层外壳中形成auncs/β-gal/gox@zif-8复合材料。auncs/β-gal/gox@zif-8溶液在375nm的激发下,在650nm处表现出良好的发射峰。而当乳糖存在于该体系时,首先通过β-gal将乳糖分解为半乳糖和葡萄糖,然后在空气中o2的参与下gox将葡萄糖分解成葡萄糖酸和h2o2。进一步地,h2o2在fe2+的作用下产生羟基自由基,导致auncs的荧光淬灭。据于此实现对乳制品及食品中乳糖的检测。
在本发明的检测乳糖的auncs/β-gal/gox@zif-8检测体系中,催化酶的选择,auncs/β-gal/gox@zif-8体系的纯度、分散性、稳定性,zif-8的晶体结构,auncs/β-gal/gox是否以复合物的形式呈现,以及检测体系ph值,fe2+添加量,级联反应时间等都会影响到荧光检测效果。
为确保本发明的auncs/β-gal/gox-zif-8检测体系能够实现对乳糖的高灵敏性和专一性检测。本发明首先对auncs/β-gal/gox@zif-8复合物的制备条件进行了优化处理。
本发明是通过在室温下简单混合锕化锌{zn(ac)2}溶液、葡萄糖氧化酶(gox)溶液、β-半乳糖苷酶(β-gal)溶液、auncs溶液和2-甲基咪唑溶液,并经离心及去离子水洗涤,获得用于乳糖检测的auncs/β-gal/gox@zif-8复合物。根据最适荧光强度,本发明将zn(ac)2溶液浓度确定为150-170mmol/l,用量为1ml;gox溶液浓度确定为0.4-0.6mg/ml,用量900-1100μl;β-gal溶液浓度确定为0.3-0.5mg/ml,用量1400-1600μl;auncs溶液的用量确定为700-900μl;2-甲基咪唑溶液浓度确定为0.13-0.17mol/l,用量为1m。
本发明对auncs/β-gal/gox@zif-8的合成效果进行了表征:用扫描电镜对auncs/β-gal/gox@zif-8的形貌进行了表征,发现该新型复合材料为棒状结构,平均尺寸为0.7×9.2μm,分散性良好。比较了纯zif-8和auncs/β-gal/gox@zif-8的xrd图谱,发现auncs/β-gal/gox@zif-8的xrd图谱与zif-8的一致,证明auncs/β-gal/gox的引入对zif-8的晶体结构几乎没有影响(图2a)。复合材料的荧光显微镜图像证明在紫外激发下,复合材料呈红色,表明新合成的复合材料存在auncs,进一步地本发明采用kbr微丸技术,在美国thermo-nicolet-380红外分光光度计上获得了400-4000cm-1范围内的傅里叶变换红外光谱(ft-ir),ft-ir光谱(图2b)证明复合材料中存在auncs、gox和β-gal,并且1640-1660cm-1处的峰对应于c=o拉伸,更进一步的证明复合物中存在bsa、β-gal和gox。据于此,证明本发明合成方法效果优良,实现了bsa对auncs的稳定化,实现了zif-8对auncs/β-gal/gox的成功包覆。
进一步地,本发明用zif-8采用不同包封形式对auncs,β-gal,gox进行包覆,并对含有auncs/β-gal/gox@zif-8,auncs+β-gal/gox@zif-8,auncs+β-gal@zif-8+gox@zif-8,auncs+β-gal+gox四种不同复合材料的检测体系在乳糖存在时的荧光图谱与对照组auncs进行了比较(图3),其中,“auncs/β-gal/gox@zif-8”即为本发明的方案,表示auncs/β-gal/gox以复合物的形式存在,并由zif-8对复合物进行包覆;“auncs+β-gal/gox@zif-8”表示auncs以游离状态存在,β-gal和gox以复合物的形式由zif-8进行包覆;“auncs+β-gal@zif-8+gox@zif-8”表示auncs以游离状态存在,β-gal和gox分别由zif-8进行包覆;“auncs+β-gal+gox”表示auncs、β-gal和gox均以游离状态存在并进行混合。
结果发现,本发明合成的auncs/β-gal/gox@zif-8新型乳糖荧光检测体系荧光淬灭率最高,达到62.4%,是auncs+β-gal+gox游离体系(18.20%)的3.43倍;是auncs和β-gal/gox@zif-8混合物体系(21.84%)的2.86倍;是auncs、β-gal@zif-8和gox@zif-8混合物体系(7.52%)的8.30倍;证明本发明设计方案最佳。
本发明首次利用温和环保的方式制备具有高催化能力,高荧光淬灭率的复合酶级联反应体系,构建了一种低成本新型乳糖荧光检测体系,实现了乳糖的高效、灵敏检测。
进一步地,本发明对检测体系的检测条件进行了优化,比较了auncs/β-gal/gox@zif-8,auncs/β-gal/gox@zif-8+乳糖(lac),auncs/β-gal/gox@zif-8+乳糖(lac)+fe2+,三种溶液的荧光检测结果(图4),证明检测体系中在fe2+存在下,fe2+与h2o2之间的fenton反应产生的·oh与h2o2相比具有更强的氧化能力,可显著提升体系的荧光淬灭速率,因此本发明在检测体系中引入fe2+以增强检测效率。对于fe2+的来源本发明不做特别的限定,常规的可以提供fe2+的溶液均可,例如fecl2等。
本发明还比较了体系ph值对检测效果的影响(图5a),证明ph值可以影响bsa和酶的构象,从而影响检测体系荧光强度及乳糖存在时的荧光消减速率,ph值为4-9时乳糖的淬灭效果较明显,因此将体系ph值定为4-9。比较了体系与乳糖的反应时间对检测效果的影响(图5b),发现荧光淬灭反应在15-20分钟就可完成,因此将检测反应时间范围定为15-20分钟。
另外,本发明还对auncs/β-gal/gox@zif-8的稳定性进行了表征:酶在生物系统中的长期稳定性对于乳糖检测的实用性至关重要,本发明比较了室温下在ph=7.4磷酸盐缓冲盐水溶液中孵育的auncs/β-gal/gox游离酶与auncs/β-gal/gox@zif-8复合物的长期稳定性如图6a,室温下存储3天后,gox&auncs@zif-8可保持初始总活性的76.36%,是活性游离酶系统auncs/β-gal/gox(3.64%)的27.26倍;本发明还在含有0.25wt%胰蛋白酶或1wt%edta的ph=7.4磷酸盐缓冲盐水溶液中孵育的auncs/β-gal/gox游离酶与auncs/β-gal/gox@zif-8复合物的稳定性,如图6b所示,同样证明auncs/β-gal/gox@zif-8具有优异的储存稳定性,由于酶与zif-8支持物的交联作用使得在37℃下胰蛋白酶消化30分钟后,auncs/β-gal/gox@zif-8的初始活性保持率为95%,较auncs/β-gal/gox游离酶混合物高30%,而在1wt%edta存在下的auncs/β-gal/gox@zif-8复合物相对活性为80.25%,较auncs/β-gal/gox游离酶混合物高70%,证明zif-8包封对酶起到优异的保护效果。
不仅如此,本发明还验证了auncs/β-gal/gox@zif-8作为乳糖荧光探针的选择性,研究了其他糖(甘露糖、木糖、果糖、麦芽糖、核糖、海藻糖、蔗糖、纤维二糖和蜜二糖)对乳糖检测的影响(图8)。发现两倍于乳糖浓度的甘露糖、木糖、果糖、麦芽糖等对乳糖的荧光检测效果几乎没有影响,从而证明了auncs/β-gal/gox@zif-8对乳糖具有较高的靶向性。
综上,本发明首次使用高孔隙率的2-甲基咪唑锌盐maf-4(zif-8)包裹牛血清白蛋白稳定功能化的金纳米簇(auncs),葡萄糖氧化酶(gox)及β-半乳糖苷酶(β-gal)合成auncs/β-gal/gox@zif-8乳糖荧光检测联酶系统,可用于对样品中乳糖的高效、灵敏检测。本发明的制备方法温和环保,室温下即可进行,检测方法对于检测样本无特殊要求,样本前处理简单,液体样本过滤后即可检测,固体样本配制成溶液后进行检测,操作简便。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的未进行具体说明试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
本发明实施例中所用的溶剂均使用双重去离子水,双重去离子水是去离子水经过双重蒸馏获得。
实施例1:auncs/β-gal/gox@zif-8的合成
(1)auncs的合成:
37℃,将10ml浓度为10mmol/l的haucl4水溶液,10ml浓度为50mg/ml的bsa溶液温度剧烈搅拌混合。5分钟后,加入浓度为1.0mol/lnaoh溶液1ml,混合物溶液稳定在37℃下持续剧烈搅拌24小时。当体系的颜色从浅黄色变为深棕色时搅拌停止,将溶液在超纯水中透析48小时以除去未反应的杂质,得到auncs。
(2)auncs/β-gal/gox@zif-8的合成:
室温下,将1ml浓度0.04mmol/l的2-甲基咪唑溶液,800μl的auncs,1500μl浓度为0.4mg/mlβ-半乳糖苷酶溶液,1000μl浓度为0.5mg/ml的gox溶液及1ml浓度0.16mmol/l的zn(ac)2溶液混合并持续反应9小时,之后通过3000rpm离心15分钟并用去离子水洗涤三次,得到auncs/β-gal/gox@zif-8。
实施例2:建立荧光淬灭率与乳糖的浓度之间的线性方程
(1)室温配制浓度为50mg/ml的auncs/β-gal/gox@zif-8(实施例1制备)溶液与浓度为0μmol/l、50μmol/l、125μmol/l、250μmol/l、375μmol/l、500μmol/l、625μmol/l、750μmol/l、875μmol/l、1000μmol/l以及1125μmol/l的乳糖标准溶液。
(2)将945μl步骤(1)获得的auncs/β-gal/gox@zif-8溶液、5μl步骤(1)获得的乳糖标准溶液及50μl浓度为0.5mmol/l的fe2+溶液混合,调ph值为7。
(3)步骤(2)获得溶液37℃水浴15分钟,在375nm激发下测定了溶液的荧光光谱及在650nm处荧光强度值(图7a)。
(4)将步骤(3)获得荧光强度值代入公式
(5)根据步骤(4)获得荧光淬灭率绘制乳糖浓度与荧光淬灭率的线性关系图(图7b),建立线性方程:
i=5.2370×10-4c+0.0168(r2=0.9990)
其中,c是乳糖浓度,单位为μmol/l,检出限为10.12μmol/l。
实施例3:样品中乳糖含量的检测
(1)将待测溶液进行微孔膜过滤,调溶液ph值为7。
(2)室温配制浓度为50mg/ml的auncs/β-gal/gox@zif-8(实施例1获得)。
(3)将945μl步骤(2)获得的auncs/β-gal/gox@zif-8溶液,5μl步骤(1)获得的待测溶液及50μl浓度为0.5mmol/l的fe2+溶液混合,调ph值为7。
(4)步骤(3)溶液37℃水浴15分钟,在375nm激发下测定650nm处荧光强度值。
(4)根据公式
i=5.2370×10-4c+0.0168(r2=0.9990)
其中c是乳糖浓度,单位为μmol/l,计算溶液的乳糖含量,完成检测。
实施例4:检测方法对乳糖的靶向性考察
为了验证本发明的auncs/β-gal/gox@zif-8检测体系的选择性,研究了其他糖对乳糖检测的影响。分别在检测体系中加入5μl浓度为1500μmmol/l的甘露糖、木糖、果糖、麦芽糖、核糖、海藻糖、蔗糖、纤维二糖和蜜二糖以及浓度为750μmmol/l乳糖,并在37℃水浴中反应15分钟。然后,在375nm激发下测定各试验组650nm处的荧光强度值,结果如图8,与对照组相比只有乳糖组具有显著的荧光淬灭率,证明本发明乳糖检测体系对乳糖具有较高的靶向性。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!