一种高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株及其应用的制作方法
本发明涉及微生物技术领域,特别涉及一种高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株及其应用。
背景技术:
湖北麦冬多糖,是国家地理标志产品、湖北道地中药材植物——湖北麦冬liriopespicatavar.proliferay.t.ma块根的主要活性成分之一,研究表明:湖北麦冬多糖具有抗心肌缺血、抗血栓、耐缺氧、抗衰老、降血糖等多方面的药理作用,此外,它对改善机体免疫系统、增进胃肠运动机能等方面都有着积极的影响,最新的研究表明它还具有抗肿瘤作用。
现有的湖北麦冬多糖生产,主要是通过直接分离块根提取物获得。但是,在湖北麦冬实际生产中,存在着诸如受连作障碍导致种植面积相对较小、受气候条件影响较大、块根生产周期长、湖北麦冬多糖提取成本高等问题,导致湖北麦冬多糖的市场受到限制。因此,亟需找到一种干扰因素少、产量稳定的湖北麦冬多糖的制备方法。
技术实现要素:
本发明的主要目的是提出一种高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株及其应用,旨在提供一种能够稳定且大量生产出湖北麦冬多糖的青霉属菌菌株。
为实现上述目的,本发明利用产自湖北省襄阳市欧庙镇湖北麦冬gap基地生产的湖北麦冬,从其新鲜活体块根中分离纯化得到一株青霉属菌(penicilliumsp.strain)ef051。本发明分离纯化得到的高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株已在中国典型培养物保藏中心(保藏单位简称cctcc)保藏,保藏地址:中国.武汉.武汉大学,分类名为青霉属菌(penicilliumsp.strain)ef051,其保藏编号为cctccno:m2018783,保藏时间为2018年11月12日。
可选地,所述高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株的18srrna基因序列如seqidno:1所示。
本发明还提出一种如上所述的青霉属菌(penicilliumsp.strain)ef051的分离纯化方法,包括以下步骤:
将新鲜湖北麦冬块根清洗干净,依次分别用体积分数为70%乙醇和有效氯含量为4%~6%次氯酸钠溶液进行浸泡,再除去表面水分得干净湖北麦冬块根,所述浸泡时间为1~3min;
将所述干净湖北麦冬块根除去褐变部分后切成薄片,将所述薄片置于pda培养基上,于25~30℃下密封培养5~7天至所述薄片周边长出菌丝,形成颜色和形状均不相同的多个菌落,所述pda培养基还包括终浓度为50μg/ml的氨苄青霉素;
在所述多个菌落中挑取中间橄榄绿色、边缘白色的菌落的菌丝尖端,转移到新的pda培养基上纯化培养,获得青霉属菌(penicilliumsp.strain)ef051。
本发明还提出一种如上所述的高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株在制备湖北麦冬多糖中的应用,使用所述青霉属菌(penicilliumsp.strain)ef051通过液体发酵制备得到湖北麦冬多糖。
可选地,使用所述青霉属菌(penicilliumsp.strain)ef051通过液体发酵制备得到湖北麦冬多糖的步骤,包括:
在无菌条件下将青霉属菌(penicilliumsp.strain)ef051接种至pda培养基,在28℃下活化培养72h,得活化菌种;
将所述活化菌种接种至马铃薯液体培养基,在28℃、180rpm下震荡培养72h,得种子液;
按照10%的接种量,将种子液接入液体发酵培养基中,在28℃、180rpm下震荡培养7天,得发酵混合物;
将所述发酵混合物冷冻干燥后粉碎成粉末,用95%的乙醇洗涤、烘干,得干粉;
对所述干粉进行热水浸提后浓缩成浸膏,再进行醇沉处理,得沉淀物;
依次用无水乙醇、丙酮、乙醚对所述沉淀物进行洗涤,然后干燥获得湖北麦冬多糖。
可选地,所述液体发酵培养基的配方为:每1000ml蒸馏水中添加200g土豆和20g葡萄糖。
本发明提供的湖北麦冬内生青霉属菌(penicilliumsp.strain)ef051,通过培养、筛选以及纯化等步骤,从湖北麦冬块根中分离筛选得到,该菌株可自身代谢产生湖北麦冬多糖,因此可应用于通过微生物液体发酵来制备湖北麦冬多糖,由于液体发酵的方式受外界环境的干扰较小,且发酵生产的产率较高,通过对青霉属菌ef051进行液体发酵,即可快速稳定且大量地生产湖北麦冬多糖,而且,相较传统的化学提取工艺,液体发酵工艺对环境的污染小,使得湖北麦冬多糖的生产更加环保。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
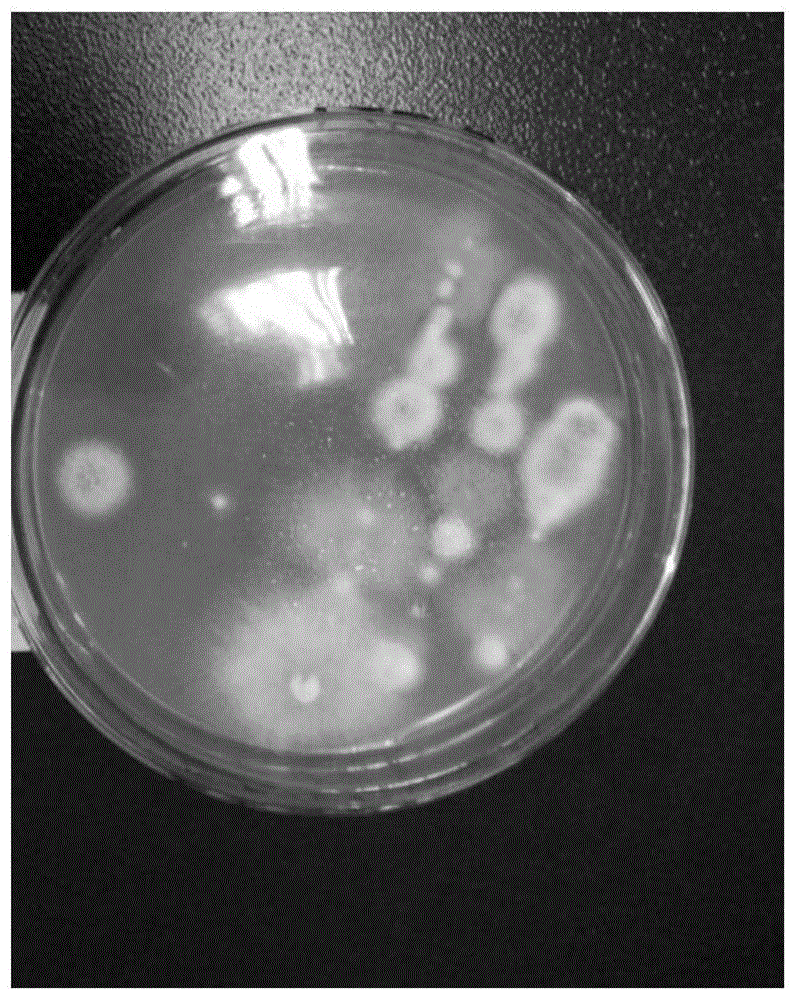
图1为本发明实施例1中青霉属菌ef051在pda培养基上的形态图;
图2为阳性对照湖北麦冬块根提取的湖北麦冬多糖的酸解液的hplc检测结果图;
图3为实施例2制得的青霉属菌ef051的菌产多糖提取物的酸解液的hplc检测结果图;
图4为实施例2制得的青霉属菌ef051的菌产多糖提取物对oh、o2-、dpph、abts自由基的清除活性测试结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
现有的湖北麦冬多糖生产,主要是通过直接分离块根提取物获得。但是,在湖北麦冬实际生产中,存在着诸如受连作障碍导致种植面积相对较小、受气候条件影响较大、块根生产周期长、湖北麦冬多糖提取成本高等问题,导致湖北麦冬多糖的市场受到限制。
鉴于此,本发明利用产自湖北省襄阳市欧庙镇湖北麦冬gap基地生产的湖北麦冬(liriopespicatavar.proliferay.t.ma),从其新鲜活体块根中分离纯化得到一株青霉属菌(penicilliumsp.strain)ef051。本发明分离纯化得到的所述湖北麦冬内生青霉属菌菌株已在中国典型培养物保藏中心(保藏单位简称cctcc)保藏,保藏地址:中国.武汉.武汉大学,分类名为青霉属菌(penicilliumsp.strain)ef051,其保藏编号为cctccno:m2018783,保藏时间为2018年11月12日。
将本发明提供的青霉属菌ef051在马铃薯葡萄糖琼脂(pda)培养基上,28℃培养,得到的菌落生长特性如图1所示,单菌落呈圆形,中间呈橄榄绿色、边缘白色。
所述青霉属菌ef051经过18srrna基因序列鉴定属于青霉属(penicilliumsp),其基因序列如seqidno:1所示,将测序结果与ncbi网站(http://blast.ncbi.nlm.nih.gov/blast.cgi)进行序列比对,同penicilliumsp,kp872506.1,同源性99%。
本发明提供的湖北麦冬内生青霉属菌ef051,通过培养、筛选以及纯化等步骤,从湖北麦冬块根中分离筛选得到,该菌株可自身代谢产生湖北麦冬多糖,因此可应用于通过微生物液体发酵来制备湖北麦冬多糖,由于液体发酵的方式受外界环境的干扰较小,且发酵生产的产率较高,通过对青霉属菌ef051进行液体发酵,即可快速稳定且大量地生产湖北麦冬多糖,而且,相较传统的化学提取工艺,液体发酵工艺对环境的污染小,使得湖北麦冬多糖的生产更加环保。
在发明还提供如上所述的青霉属菌ef051的筛选方法,包括如下步骤:
步骤s10、将新鲜湖北麦冬块根清洗干净,依次分别用体积分数为70%乙醇和有效氯含量为4%~6%次氯酸钠溶液进行浸泡,再除去表面水分得干净麦冬块根,所述浸泡时间为1~3min。
以下给出步骤s10的一具体实施例:使用大量自来水充分清洗新鲜湖北麦冬植物块根表面泥土,然后装入干净的烧杯中,加入去离子水,置于超声波清洗器中反复清洗,直至清洗后的水变得极为清澈;用无菌滤纸蘸干湖北麦冬块根表面的水分后,先用体积分数为75%的乙醇浸泡块根2min,用无菌水漂洗3次;再用有效氯含量4~6%的次氯酸钠溶液浸泡2min,后用大量无菌水连续漂洗4次,再用无菌滤纸蘸干水分,得到干净湖北麦冬块根。
步骤s20、将所述干净湖北麦冬块根除去褐变部分后切成薄片,将所述薄片置于pda培养基上,于25~30℃下密封培养5~7天至所述薄片周边长出菌丝,形成颜色和形状均不相同的多个菌落,所述pda培养基还包括终浓度为50μg/ml的氨苄青霉素。
以下给出步骤s20的一具体实施例:取上述干净湖北麦冬块根,无菌条件下剪去块根两头褐变部分,剩余部分用解剖刀片切割成0.5cm×0.5cm组织小片(横向切片或纵向切片),尽可能切割薄一些以便其能与培养基表面充分接触,有利于真菌从培养基中吸收养分,置于pda培养基(含氨卞青霉素,终浓度为50μg/ml)上,用镊子均匀的在组织小片上轻轻压一压,使其紧紧贴服于平板上,每皿植入2片,并设五个重复,最后用parafilm封口膜将培养皿密封后置于28℃恒温培养5~7天,至块根薄片周边长出菌丝,形成颜色和形状均不相同的多个菌落。
步骤s30、在所述多个菌落中挑取中间橄榄绿色、边缘白色的菌落的菌丝尖端,转移到新的pda培养基上纯化培养,获得青霉属菌ef051。
以下给出步骤s30的一具体实施例:每天观察样品真菌生长的情况,5~7天后块根薄片周边有菌丝长出,形成颜色和形状均不相同的多个菌落,挑取所述多个菌落的菌丝尖端转移至新鲜的pda培养基上分别进行多次纯化培养,直至仅生长出单一的纯菌落,然后选择其中中间呈橄榄绿色、边缘白色的菌落,挑取菌丝尖端转移到新的pda培养基上纯化培养,即分离纯化出所述青霉属菌ef051。所述青霉属菌ef051经过分子生物学鉴定为青霉属(penicilliumsp)。
本发明进一步提出一种如上所述的湖北麦冬内生青霉属菌菌株在的制备湖北麦冬多糖中的应用,使用所述青霉属菌ef051通过液体发酵制备得到湖北麦冬多糖。
在本发明提供的一具体实施例中,上述使用所述青霉属菌ef051通过液体发酵制备得到湖北麦冬多糖的步骤,包括:
步骤a、在无菌条件下将青霉属菌ef051接种至pda培养基,在28℃下活化培养72h,得活化菌种;
步骤b、将所述活化菌种接种至马铃薯液体培养基,在28℃、180rpm下震荡培养72h,得种子液;
步骤c、按照10%的接种量,将种子液接入液体发酵培养基中,在28℃、180rpm下震荡培养7天,得发酵混合物;
步骤d、将所述发酵混合物冷冻干燥后粉碎成粉末,用95%的乙醇洗涤、烘干,得干粉;
步骤e、对所述干粉进行热水浸提后浓缩成浸膏,再进行醇沉处理,得沉淀物;
步骤f、依次用无水乙醇、丙酮、乙醚对所述沉淀物进行洗涤,然后干燥获得湖北麦冬多糖。
其中,步骤c中采用的所述液体发酵培养基的配方为:每1000ml蒸馏水中添加200g土豆和20g葡萄糖。
以下给出发酵制备湖北麦冬多糖的一具体实施例:取青霉属菌ef051,在无菌条件下,用接种针挑取少量菌丝,接入已灭菌的pda培养基试管,于28℃活化培养72小时;取活化培养后的菌种,在无菌条件下,转接入已灭菌的马铃薯液体培养基(pda)中,在28℃下180rpm振荡培养72小时,得种子液;将配制好的液体发酵培养基(每1000ml蒸馏水中添加有200g土豆和20g葡萄糖)分别装入250ml的三角瓶中,每瓶约100ml,灭菌处理,冷却备用;之后在无菌条件下按照10%的接种量,向液体发酵培养基中接入种子液,在28℃下180rpm振荡培养7天;发酵完毕后,将发酵得到的固液混合物置于超低温冰箱中快速冷冻成固态后,使用小型冷冻干燥机进行低温冷冻干燥处理,得到干燥的发酵产物;将低温冷冻干燥的菌株发酵产物研成粉末,然后加入100ml体积分数为95%的乙醇,重复三次,对粉碎物进行洗涤后烘干;再向烘干后的产物中按照1∶10(g/ml)的固液比加入蒸馏水,并在80℃下水浴2h后过滤,对滤渣再重复上述操1次进行二次提取;然后合并提取液,离心后取上清液透析48h;透析后收集截留液,经过减压浓缩制成浸膏,再用100ml体积分数为95%的乙醇对所述浸膏进行醇沉处理,并收集醇沉处理得到的沉淀物;依次使用无水乙醇、丙酮、乙醚对得到的沉淀物进行洗涤,然后干燥获得湖北麦冬多糖。
使用本发明提供的青霉属菌ef051,通过液体发酵的方式制备湖北麦冬多糖,能够“快速化”、“工厂化”的大量生产湖北麦冬多糖,可以避免通过化学合成方法制备湖北麦冬多糖对环境造成的污染,是一种更为环保的制备湖北麦冬多糖的方法。
以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1青霉属菌ef051的筛选
(1)使用大量自来水充分清洗新鲜湖北麦冬植物块根表面泥土,然后装入干净的烧杯中,加入去离子水,置于超声波清洗器中反复清洗,直至清洗后的水变得极为清澈;用无菌滤纸蘸干湖北麦冬块根表面的水分后,先用体积分数为75%的乙醇浸泡块根2min,用无菌水漂洗3次;再用有效氯含量4~6%的次氯酸钠溶液浸泡2min,后用大量无菌水连续漂洗4次,再用无菌滤纸蘸干水分,得到干净湖北麦冬块根。
(2)取上述干净湖北麦冬块根,无菌条件下剪去块根两头褐变部分,剩余部分用解剖刀片切割成0.5cm×0.5cm组织小片(横向切片或纵向切片),尽可能切割薄一些以便其能与培养基表面充分接触,有利于真菌从培养基中吸收养分,置于pda培养基(含氨卞青霉素,终浓度为50μg/ml)上,用镊子均匀的在组织小片上轻轻压一压,使其紧紧贴服于平板上,每皿植入2片,并设五个重复,最后用parafilm封口膜将培养皿密封后置于28℃恒温培养5~7天。
(3)每天观察样品真菌生长的情况,5~7天后块根薄片周边有菌丝长出,形成颜色和形状均不相同的多个菌落,挑取所述多个菌落的菌丝尖端转移至新鲜的pda培养基上分别进行多次纯化培养,直至仅生长出单一的纯菌落,然后选择其中中间呈橄榄绿色、边缘白色的菌落,挑取菌丝尖端转移到新的pda培养基上纯化培养,即筛选出青霉属菌ef051。
对实施例1筛选出的青霉属菌ef051进行菌落形态和18srrna基因序列鉴定,方法和结果如下:
将筛选出的青霉属菌ef051在马铃薯葡萄糖琼脂(pda)培养基上,28下℃培养,得到的菌落生长特性如图1所示,单菌落呈圆形,且中间呈橄榄绿色、边缘白色。
所述青霉属菌ef051经过18srrna基因序列鉴定属于青霉属(penicilliumsp),其基因序列如seqidno:1所示,将测序结果与ncbi网站(http://blast.ncbi.nlm.nih.gov/blast.cgi)进行序列比对,同penicilliumsp,kp872506.1,同源性99%。
实施例2青霉属菌ef051的液体发酵
(1)取实施例筛选出的青霉属菌ef051,在无菌条件下,用接种针挑取少量菌丝,接入已灭菌的pda培养基试管,于28℃活化培养72小时;取活化培养后的菌种,在无菌条件下,转接入已灭菌的马铃薯液体培养基(pda)中,在28℃下180rpm振荡培养72小时,得种子液;将配制好的液体发酵培养基(每1000ml蒸馏水中添加有200g土豆和20g葡萄糖)分别装入250ml的三角瓶中,每瓶约100ml,灭菌处理,冷却备用;之后在无菌条件下按照10%的接种量,向液体发酵培养基中接入种子液,在28℃下180rpm振荡培养7天;发酵完毕后,得到固液混合的发酵产物;
(2)将步骤(1)得到的发酵产物置于超低温冰箱中快速冷冻成固态后,使用小型冷冻干燥机进行低温冷冻干燥处理,得到干燥的发酵产物;将低温冷冻干燥的菌株发酵产物研成粉末,然后加入100ml体积分数为95%的乙醇,重复三次,对粉碎物进行洗涤后烘干;再向烘干后的产物中按照1∶10(g/ml)的固液比加入蒸馏水,并在80℃下水浴2h后过滤,对滤渣再重复上述操1次进行二次提取;然后合并提取液,离心后取上清液透析48h;透析后收集截留液,经过减压浓缩制成浸膏,再用100ml体积分数为95%的乙醇对所述浸膏进行醇沉处理,并收集醇沉处理得到的沉淀物;依次使用无水乙醇、丙酮、乙醚对得到的沉淀物进行洗涤,然后进行干燥,获得青霉属菌ef051的菌产多糖提取物。
对实施例2制得的青霉属菌ef051的菌产多糖提取物进行相关性能检测,方法和结果如下:
(1)菌产多糖提取物的颜色反应
采用以下两种颜色反应方法进行检测:
(a)萘酚-浓硫酸反应方法:取200μl青霉属菌ef051的菌产多糖提取物溶液样品溶于400μl、15%的1-萘酚中,加入浓硫酸100μl,呈蓝紫色为阳性。
(b)蒽酮-浓硫酸反应方法:取400μl青霉属菌ef051的菌产多糖提取物溶液样品,加入300ulμl的蒽酮硫酸溶液,呈蓝绿色为阳性。
青霉属菌ef051的菌产多糖提取物的两种颜色反应结果均呈阳性,表明本发明提供的青霉属菌ef051经过发酵能够产生多糖。
(2)薄层色谱检测(tlc)
取20mg实施例2制得的青霉属菌ef051的菌产多糖提取物,加入5ml纯水进行溶解,再加入0.25ml的12mol/l的hcl,然后置于120~126℃的环境中反应4h,反应完毕后中和、透析后稀释至10ml,制得青霉属菌ef051的菌产多糖提取物的酸解液。
以湖北麦冬块根提取的湖北麦冬多糖的酸解产物为阳性对照,对青霉属菌ef051的菌产多糖提取物的酸解液进行薄层层析。展开剂为正丁醇:无水乙醇:冰醋酸:纯水=2:3:1:1(v/v/v/v/v),显色剂为4g二苯胺、量取4ml苯胺及20ml的85%磷酸溶液溶于200ml丙酮所得,在105℃烘箱中加热3min,直至显出清晰红色斑点为止。
阳性对照湖北麦冬块根提取的湖北麦冬多糖和青霉属菌ef051的菌产多糖提取物的酸解产物的tcl检测结果为:青霉属菌ef051的菌产多糖提取物的酸解单糖与阳性对照酸解单糖有相似的rf值,表明本发明提供的青霉属菌ef051发酵能够产生湖北麦冬多糖。
(3)高效液相色谱检测(hplc)
取20mg实施例2制得的青霉属菌ef051的菌产多糖提取物,加入5ml纯水进行溶解,再加入0.25ml的12mol/l的hcl,将其置于120~126℃环境中反应4h,反应完毕后中和、透析后稀释至10ml,制得青霉属菌ef051发酵产物的酸解液。
以湖北麦冬块根提取的湖北麦冬多糖的酸解产物为阳性对照,取上述制备的青霉属菌ef051的菌产多糖提取物的酸解液1ml置于离心管中,加1ml、0.5mol/ml的pmp-甲醇溶液及0.3mol/l的naoh溶液,涡旋1min,70℃水浴60min冷却至室温,取1ml0.3mol/l的hcl溶液中和,氯仿2ml萃取3次,合并水层,水系滤膜过滤,使用前超声0.5h。
hplc色谱条件:色谱仪岛津lc-20高效液相色谱仪(检测器:spd-m20a,柱温箱:cto-20a并配真空脱气机dgu-20a3,色谱柱inertsustainc18);利用乙腈:磷酸盐缓冲溶液(ph=5.0)=20:80进行等度洗脱,流速1ml/min;光谱数据采集通道:ch1(250nm);进样量10μl;记录30min数据;信号强度单位为mau。
图2为阳性对照湖北麦冬块根提取的湖北麦冬多糖酸解液的hplc检测结果图,图3为青霉属菌ef051的菌产多糖提取物的酸解液的hplc检测结果图,对比图2和图3可以得出,本发明提供的青霉属菌ef051经过发酵能够产生湖北麦冬多糖。
(4)菌产多糖提取物抗氧化性测定
采用α-脱氧核糖法、邻苯三酚自氧化法、dpph法和abts法,分别测试青霉属菌ef051的菌产多糖提取物对oh、o2-、dpph、abts自由基的清除活性。
图4是青霉属菌ef051的菌产多糖提取物对oh、o2-、dpph、abts自由基的清除活性测试结果图。由图4可知,由本发明提供的青霉属菌ef051经过发酵制得的菌产多糖提取物,对四种自由基(dpph、o2-、oh、abts)均具有一定的体外清除活性,且抗氧化能力与浓度呈正相关。
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之类,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
sequencelisting
<110>湖北文理学院
<120>一种高产湖北麦冬多糖的湖北麦冬内生青霉属菌菌株及其应用
<130>20191213
<160>1
<170>patentinversion3.5
<210>1
<211>1563
<212>dna
<213>penicilliumsp
<400>1
tagtgcagtctagtatagcaacttgtactgtgaactgcgaatggctcattaaatcagtta60
tcgtttatttgatagtaccttactacatggatacctgtggtaattctagagctaatacat120
gctaaaaaccccgacttcaggaaggggtgtatttattagataaaaaaccaacgcccttcg180
gggctccttggtgaatcataataacttaacgaatcgcatggccttgcgccggcgatggtt240
cattcaaatttctgccctatcaactttcgatggtaggatagtggcctaccatggtggcaa300
cgggtaacggggaattagggttcgattccggagagggagcctgagaaacggctaccacat360
ccaaggaaggcagcaggcgcgcaaattacccaatcccgatacggggaggtagtgacaata420
aatactgatacggggctcttttgggtctcgtaattggaatgagaacaatttaaatccctt480
aacgaggaacaattggagggcaagtctggtgccagcagccgcggtaattccagctccaat540
agcgtatattaaagttgttgcagttaaaaagctcgtagttgaaccttgggcctggctggc600
cggtccgcctcaccgcgagtactggtccggctgggcctttccttctggggaacctcatgg660
ccttcactggctgtggggggaaccaggacttttactgtgaaaaaattagagtgttcaaag720
caggcctttgctcgaatacattagcatggaataatagaataggacgtgtggttctatttt780
gttggtttctaggaccgccgtaatgattaatagggatagtcgggggcgtcagtattcagc840
tgtcagaggtgaaattcttggatttgctgaagactaactactgcgaaagcattcgccaag900
gatgttttcattaatcagggaacgaaagttaggggatcgaagacgatcagataccgtcgt960
agtcttaaccataaactatgccgactagggatcggacgggattctataatgacccgttcg1020
gcaccttacgagaaatcaaagtttttgggttctggggggagtatggtcgcaaggctgaaa1080
cttaaagaaattgacggaagggcaccacaaggcgtggagcctgcggcttaatttgactca1140
acacggggaaactcaccaggtccagacaaaataaggattgacagattgagagctctttct1200
tgatcttttggatggtggtgcatggccgttcttagttggtggagtgatttgtctgcttaa1260
ttgcgataacgaacgagacctcggcccttaaatagcccggtccgcatttgcgggccgctg1320
gcttcttaaggggactatcggctcaagccgatggaagtgcgcggcaataacaggtctgtg1380
atgcccttagatgttctgggccgcacgcgcgctacactgacagggccagcgagtacatca1440
ccttaaccgagaggtttgggtaatcttgttaaaccctgtcgtgctggggatagagcattg1500
caattattgctcttcaacgaggaatgcctagtaggcacgagtcatcagctcgtgccgatt1560
act1563
- 还没有人留言评论。精彩留言会获得点赞!