基于LAMP快速检测水稻恶苗病病原菌藤仓镰孢菌的引物组合物及方法与流程
本申请涉及藤仓镰孢菌分子检测技术领域,具体涉及一种基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的引物组合物及方法。
背景技术:
水稻恶苗病是水稻上重要的种传病害之一。该病害自从第一次在日本发现以来,已传播到亚洲、非洲、北美地区。恶苗病的典型症状就是过度生长、叶片发黄、退绿、矮化、根和冠腐,甚至死亡。苗期病害发生会导致水稻产量减产10%至30%,严重会达到50%以上的产量损失,对水稻作物生产构成了严重威胁。一些研究表面,虽然镰刀菌属的4个种【藤仓镰孢菌(fusarium.fujikuroi)、层出镰孢(f.proliferatum)、拟轮枝镰(f.verticillioides)和f.andiyazi】能引起不同程度水稻恶苗病症状,但只有藤仓镰孢菌是最主要的强致病菌,引起典型症状。目前研究证实,仅赤霉素ga1、ga3、ga4和ga7对植物具有生物活性。藤仓镰孢菌是唯一产生具有活性赤霉素的种,而其它种中,不具有赤霉素产物和基因表达,可能由于基因突变,或启动子损伤。赤霉素是植物激素,促进苗的徒长。所以,恶苗病过度生长的症状与真菌分泌赤霉素密切相关。
依据发明人对浙江、安徽和江西主要水稻栽培品种上分离镰刀菌属种的结果表明,从24品种上,共获得的414个分离系中。形态学和分子形态学鉴定表明,它们被划分到6个种中,分别为藤仓镰孢菌,占81.4%;层出镰孢(f.proliferatum),占8.44%;f.equiseti,占6.03%;f.asiaticum,占0.5%,f.incarnatum,占2.66%,f.andiyazi,占0.97%。显示了藤仓镰孢菌在南方3个省的水稻栽培区是引起水稻恶苗病的最主要病原菌。
随着分子生物学技术的发展,越来越多的分子生物学技术应用到植物病原病的检测,如普通pcr和实时荧光定量pcr技术已广泛应用病原菌检查,但这些技术需要依赖精密且昂贵的温度循环装置,反应试剂昂贵,而且需要专门的人员操作,检测过程复杂,因此不能满足快速检测的要求。为了解决该问题,日本学者发明了一种称为环介导等温扩增技术(loopmediatedisothermalamplification,lamp),该方法需要设计能够识别保守序列6特异性位点的3个条引物对,然后用dna聚合酶(bstdnapolymerase)进行等温扩增,通过直接观察管内颜色变化,判断病原菌是否存在。管内颜色变化是由于反应前向反应管内加入高灵敏的dna荧光染料。依据染料特性,判断样本病原菌存在。该技术具有灵敏度高、特异性强、扩增条件简单,产物可视化等特点,已广泛应用到大豆疫霉菌、稻瘟病菌和黑白轮枝菌检测。然而,lamp技术的关键是引物的特异性和灵敏性。基因组分析发现,在藤仓镰孢菌中与真菌毒素代谢相关的聚酮体合成酶基因(polyketidesynthasegene)和非核糖体肽合成酶基因(non-ribosomalpeptidesynthetasegene,nrps31)是独特的。最近,基于nrps31基因开发了lamp检测技术,以及基于核糖体特异性片段开发了lamp检测技术。但这些不相关于赤霉素代谢途径。
通过基因组分析,分析赤霉素代谢途径上把赤霉素ga4转换为ga7(随后合成ga3)的去饱和酶基因启动子区域与其它种的同源序列有很多差异,因而设计lamp引物并建立lamp检测技术体系,不仅可具有特异性强,能快速、准确鉴定该病原菌的存在,也很好预测该菌能产生赤霉素ga4、ga7、ga3的产生。
技术实现要素:
本申请提供一种基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的引物组合物、试剂盒及方法,本申请的检测方法中,引物组合物的特异性好,灵敏度高。
基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的引物组合物,包括:正向内引物fip、反向内引物bip、正向外引物f3、反向外引物b3、正向环引物lf和反向环引物lb;碱基序列如下:
fip:5′-ctaccaaggtaaggtatctgctaagttgtttgtcggctgatc-3′(seqidno:1);
bip:5′-gcttcactggccttggagtcataaggtttatggagacgcac-3′(seqidno:2);
f3:5′-ttgacaaagttcggtgcc-3′(seqidno:3);
b3:5′-tctgacttgattcacagatg-3′(seqidno:4);
lf:5′-ggcgttcataccacgacct-3′(seqidno:5);
lb:5′-gtacggtatcaccgttgcatt-3′(seqidno:6)。
本申请还提供基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的试剂盒,包含所述的引物组合物。
可选的,包含:3.2mm正向内引物fip和3.2mm反向内引物bip;0.2mm正向外引物f3和0.2mm反向外引物b3;0.4mm正向环引物lf和0.4mm反向环引物lb。
可选的,还包含:10×thermopol缓冲液、1.4mmdntps、0.8m甜菜碱、bstdna聚合酶和10000×染料。
可选的,所述试剂盒的反应体系为25μl,包括:3.0μl10×thermopol缓冲液、3.5μl10mmdntps、4.0μl5m甜菜碱、lamp检测引物、2μldna模板、1.0μlbstdna聚合酶和0.25μl10000×染料,超纯水定容;
其中lamp检测引物包括:2.0μl40mm正向内引物fip、2.0μl40mm反向内引物bip;0.5μl10mm正向外引物f3和0.5μl10mm反向外引物b3;1.0μl10mm正向环引物lf和1.0μl10mm反向环引物lb。
本申请还提供基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的方法,包括:
提取待测样品的基因组dna,以提取的基因组dna为dna模板、所述的引物组合物为引物,进行lamp反应。
以下还提供了若干可选方式,但并不作为对上述总体方案的额外限定,仅仅是进一步的增补或优选,在没有技术或逻辑矛盾的前提下,各可选方式可单独针对上述总体方案进行组合,还可以是多个可选方式之间进行组合。
可选的,所述lamp反应的体系为25μl;包括:3.0μl10×thermopol缓冲液、3.5μl10mmdntps、4.0μl5m甜菜碱、lamp检测引物、2μldna模板、1.0μlbstdna聚合酶和0.25μl10000×染料,超纯水定容;
其中lamp检测引物包括:2.0μl40mm正向内引物fip、2.0μl40mm反向内引物bip;0.5μl10mm正向外引物f3和0.5μl10mm反向外引物b3;1.0μl10mm正向环引物lf和1.0μl10mm反向环引物lb。
可选的,所述lamp反应的程序为:60℃~67℃反应30~75min。可选的,65℃,55min。
可选的,还包括:根据反应液颜色变化判断检测结果。以sybrgreeni为染料,绿色表示阳性结果;橙色表示阴性结果。
可选的,所述待测样品为水稻种子或水稻幼苗。
与现有技术相比,本申请至少具有如下有益效果:
(1)本申请提供的lamp检测引物及方法具有很强的特异性,可与镰刀菌属的种以及其它真菌易于区分,尤其重复性好。
(2)本申请提供的lamp检测引物及方法具有很高的灵敏度,高于普通pcr检测10000倍。
(3)本申请提供的lamp检测引物及方法可用于带病种子检测,试验步骤包括种子研磨、基因组dna提取、lamp检测和检测体系中的颜色变化反应,判断种子是否携带病原菌。
(4)本申请提供的lamp检测技术可用于早期诊断藤仓镰孢菌引起的水稻恶苗病。采集无症状的水稻苗(可能携带病原菌),用植物dna提取试剂盒(2×t5directpcrkit)提取基因组dna,用lamp检测对病原菌进行现场检测。
附图说明
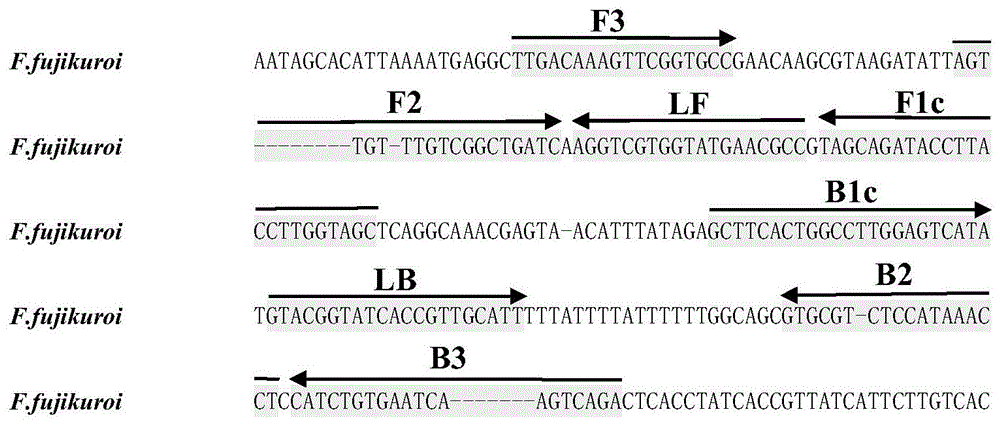
图1为lamp检测引物在去饱和酶基因启动子部分序列上的位置。
图2为基于lamp检测藤仓镰孢菌的结果与普通pcr扩增产物电泳结果的比较(图中箭头标示为绿色)。
图3为lamp检测藤仓镰孢菌的灵敏度测定的结果(图中箭头标示为绿色)。
图4为用lamp和普通pcr方法检测带菌水稻种子的结果(图中箭头标示为绿色)。
图5为基于lamp检测人工接种病组织和相应普通pcr检测结果(图中箭头标示为绿色)。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
除非另有定义,本文所使用的所有的技术和科学术语与属于本申请的技术领域的技术人员通常理解的含义相同。本文中在本申请的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本申请。
实施例1藤仓镰孢菌lamp检测引物设计和特异性评价
(1)lamp检测引物设计
通过查阅镰刀菌属真菌分类和代谢途径文献,结合基因组比较分析,尤其比较了赤霉素相关的基因组序列,从去饱和酶基因启动子区域获得了同源序列,依据种间碱基序列差异,设计了lamp检测引物(图1)。
引物序列包括:正向内引物fip、反向内引物bip、正向外引物f3、反向外引物b3、正向环引物lf和反向环引物lb;具体序列如下:
fip:5′-gctaccaaggtaaggtatctgctaagttgtttgtcggctgatc-3′
bip:5′-gcttcactggccttggagtcataaggtttatggagacgcac-3′
f3:5′-ttgacaaagttcggtgcc-3′
b3:5′-tctgacttgattcacagatg-3′
lf:5′-ggcgttcataccacgacct-3′
lb:5′-gtacggtatcaccgttgcatt-3′。
(2)lamp检测体系构成
lamp检测体系构成为:总的反应体系是25μl,包括3.0μl10×thermopol缓冲液(200mmtris-hcl(ph8.8)、100mmkcl、100mm(nh4)2so4、20mmmgso4和1%tritonx-100)、3.5μl10mmdntps、4.0μl5m甜菜碱、lamp检测引物(2.0μl40mm正向内引物fip、2.0μl40mm反向内引物bip;0.5μl10mm正向外引物f3和0.5μl10mm反向外引物b3;1.0μl10mm正向环引物lf和1.0μl10mm反向环引物lb)、dna模板、1.0μlbstdna聚合酶(8u/μl)和0.25μl10000×染料(sybrgreeni),最后用超纯水定容。
lamp反应程序为:60℃~67℃,30~75min。
lamp反应液颜色变化作为检测结果标记:黄绿色表示阳性结果;橙黄色表示阴性结果。
(3)测试的菌株
为了比较引物的特异性,选择藤仓镰孢菌zj01作为阳性对照,选择分离于水稻上病原菌镰刀菌和镰刀菌属的其它种共13种,以及10个水稻上的病原菌以及它类群株系(见表1)
表1.选择的株系和用lamp和pcr扩增的比较
(4)dna的提取
将上述23个菌株接种至pda平板上,25℃黑暗培养3d,从菌落边缘切取菌饼(直接0.5mm)转移至pdb培养液中,25℃下振荡培养3至5天(150rpm),过滤收集菌丝,然后在液氮中研磨成粉末,采用真菌粗提试剂盒(生工公司)提取每个样品中的基因组dna(具体步骤参照说明书)。获得的dna溶解在te缓冲液中,分别测定dna浓度。
(5)lamp特异性的分析
在上述建立的lamp检测体系中,在加入bstdna聚合酶前,分别加入上述23个测试株系的dna模板2μl和一个对照(水)。lamp反应程序为:65℃、55min。
测定结果如图2中a所示,1号管子呈现绿色(阳性),是藤仓镰孢菌zj01;2号管呈橙色(阴性),为用水的对照;3-24号为供试参考病原菌都呈橙色(阴性),3-24号分别是:3号层出镰孢菌f.proliferatum、4号木贼镰刀菌f.equiseti、5号尖孢镰刀菌f.oxysporum、6号燕麦镰刀菌f.avenaceum、7号亚洲镰刀菌f.asiaticum、8号禾谷镰刀菌f.graminearum、9号茄镰孢菌f.solani、10号拟轮枝镰孢f.verticillioides、11号f.incarnatum、12号f.commune、13号f.andiyazi、14号f.boothii、15号美味黑粉菌ustilagoesculentaj26、16号美味黑粉菌u.esculentaj6、17号大丽轮枝菌verticilliumdahlia086、18号大丽轮枝菌v.dahliabp2、19号稻瘟病菌pyriculariaoryzae、20号稻曲病菌ustilaginoideaoryzae、21号油菜菌核病菌sclerotiniasclerotiorum,22号辣椒疫霉菌phytophthoracapsica、23号棉帚霉菌scopulariopsisgossypii和24号烟草疫霉菌p.nicotianae。
lamp检测结果表明(图2),本申请的引物组合物仅藤仓镰孢菌(fusarium.fujikuroi)检测结果呈绿色(阳性),而其余都呈橙色(阴性),说明该引物组合具有强的特异性。
进一步用普通pcr进行验证,其反应体系为:25μl反应体系包括25μl体系包括12.5μl2xtaqmaster混合液(包括taqdnapolymerase,mgcl2,datp,dctp,dgtp,dttp)(上海惠凌生物技术有限公司),1.0μl10mm反向外引物b3和1.0μl10mm反向外引物b3,2.0μl供试菌株的基因组dna,8.5μl去超纯水。
pcr程序为:94℃预变性3min;然后进入循环,94℃变性1min,54℃退火1min,72℃延伸1min,共35个循环;最后72℃延长10min。
反应结束后取3μl扩增产物在1.0%琼脂糖凝胶中进行电泳、拍照,结果如图2中b所示,泳道1是藤仓镰孢pcr产物条带(234bp);泳道2是水的对照,无条带;而3-24泳道为供试参考病原菌(同上)。pcr扩增结果表明(图2中b),仅含有藤仓镰孢菌的基因组的样品中扩增出条带,与lamp检测结果完全一致。
实施例2lamp反应灵敏性的检测
为了确定lamp检测方法的灵敏度,并与普通pcr扩增产物进行了灵敏度比较分析。用上述藤仓镰孢菌zj01提取的基因组dna作为模板,用分光光度计测定浓度为94.0ng/μl,然后将其进行系列稀释为9.4ng、0.94ng、94pg、9.4pg、0.94pg、94fg、9.4fg和0.94fg。分别吸取系列稀释的dna2.0μl加入上述lamp检测体系中。lamp反应程序为:65℃,55min。ck是阴性对照(无dna)。
测定结果如图3所示,图3中a:1-9号管中的基因组模板dna浓度分别为94ng、9.4ng、0.94ng、94pg、9.4pg、0.94pg、94fg、9.4fg、0.94fg。ck是阴性对照(无dna)。其中1到7号管显示绿色,为阳性,8,9,ck为橙色,是阴性。能检测到94fg以上的模板浓度。
图3中b为lamp反应后产物的电泳图,能检测到0.94pg以上的模板浓度;c为与lamp检测模板浓度相同的pcr扩增产物电泳图。能检测到0.94ng以上的模板浓度。
测定结果显示,lamp检测能达到94fg以上的模板浓度,而普通pcr扩增能检测到0.94ng以上的模板浓度。显示lamp检测灵敏度高于普通pcr10000倍。
实施例3水稻种子带菌检测
从3块田间采集具有水稻恶苗病典型症状植株上的种子和相应无症状植株上的种子,按照种子的收获程序晒干保存。为了检测种子带菌,分别取每块田中病株和健株上的种子各10粒,每个样品分别在液氮中研磨成粉末,采用使用ezup柱式真菌基因组dna抽提试剂盒(上海生工生物工程股份有限公司)提取基因组dna(具体步骤参照说明书),溶解在te缓冲液中。
在实施例1建立的lamp检测体系中,在加入bstdna聚合酶前,分别加入每个测试样品的dna模板2μl。每个田块样品中,病株种子样品重复6次,对照(健株种子样品)重复4次。lamp反应程序为:65℃,55min。
测定结果如图4所示,1号管是阳性对照(dna来自菌落),显示绿色;2号管是阴性对照(无dna),显示橙色;来自田块1的样品中,4、6-9、12管,来自病株种子样品,显示绿色,为阳性;3、5、10、11管,来自健株样品种子,显示橙色,为阴性;来自田块2的样品中,13、15、18、20、21-22管来自病株种子样品,显示绿色,为阳性;14、16、17、19管来自健株种子样品,显示为橙黄色,为阴性;来自田块1的样品中,26-27、29-32管来自病株种子样品,为阳性,23-25,28管来自健株样品种子,为阴性,显示为橙黄色。
测定结果显示(图4中a),仅在病株种子样品中反应管里均呈现绿色,为阳性,而在健株种子样品中反应管中为阴性。
用实施例2的方法,进一步进行普通pcr扩增,pcr产物电泳结果显示(图4中b),仅含有藤仓镰孢菌的基因组的样品中扩增出条带,一致于lamp检测结果。
实施例4水稻幼苗带菌检测
为了检测感染恶苗病的水稻植株,将水稻种子(金早47品种)用浓度为106个/ml的藤仓镰孢菌的分生孢子悬浮液人工浸泡36小时。将接种的种子播种在10×10×10cm的塑料盆中,并置于28℃光照培养箱中进行培养。种子在灭菌水浸泡36小时的处理作为对照。播种15天后,用0.2-2mm打孔器切取还无症状不同处理苗的茎秆。为了进行现场检测,采用试剂盒2×t5directpcrkit(plant)(上海生工生物工程股份有限公司)提取基因组dna。茎秆样品放入离心管并加入30mllysisbuffera,95℃加热10min。静置后,取上清液2μl作为lamp反应体系的模板。灭菌水处理对照用相同的方法获得基因组dna。lamp反应程序为:65℃,55min。
测定结果如图5所示,1号管是阳性对照(dna来自菌落)显示为绿色;2号管是阴性对照(接种无菌水),显示为橙色;3-5、8-10、12-15、17、20和23管中的dna模板来源于接种藤仓镰孢菌的植物组织,显示为黄绿色,为阳性。6-7、11、16、18、19、21-22管是来自健康的对照组织,显示为橙色,为阴性。
测定结果显示(图5中a),所有种子接种病原菌的苗样品,都显示阳性,而灭菌水处理的苗样品,都显示阴性。
用上实施例1的方法,进行普通pcr扩增的方法,图5中b是普通pcr检测的结果,测定结果显示,所有种子接种病原菌的苗样品,都显示阳性,而灭菌水处理的苗样品,都显示阴性,一致于lamp检测结果。
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准。
sequencelisting
<110>浙江大学
<120>基于lamp快速检测水稻恶苗病病原菌藤仓镰孢菌的引物组合物及方法
<130>
<160>6
<170>patentinversion3.3
<210>1
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>1
ctaccaaggtaaggtatctgctaagttgtttgtcggctgatc42
<210>2
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>2
gcttcactggccttggagtcataaggtttatggagacgcac41
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttgacaaagttcggtgcc18
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
tctgacttgattcacagatg20
<210>5
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggcgttcataccacgacct19
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
gtacggtatcaccgttgcatt21
- 还没有人留言评论。精彩留言会获得点赞!