醛酮还原酶突变体、编码基因及其在合成(S)-TCPE中的应用的制作方法
本发明属于生物合成技术领域,尤其涉及醛酮还原酶突变体、编码基因及其在合成(s)-tcpe中的应用。
背景技术:
卢立康唑是一种新型咪唑类抗真菌剂,通过抑制真菌细胞中的甾醇14α-脱甲基酶从而干扰麦角甾醇的生物合成,同时卢立康唑显示出广谱性的抗真菌活性。作为手性来源,(s)-tcpe是卢立康唑最关键的中间体。然而,已有的(s)-tcpe化学合成路线效率低,反应条件苛刻,并需要昂贵的起始手性材料,并不利于工业化生产。醛酮还原酶(akred),具有不对称催化含羰基(或醛基)有机物(如芳基酮、脂肪酮和各种醛有机物)得到相应的手性醇的能力,是生物催化中最常用的酶种之一。但是当前开发的akred种类很大程度上满足不了当今的醛酮底物的还原氧化反应,尤其是高立体选择性和区域选择性的akred的开发,广底物谱的akred也还有待进一步开发;其次,akred的催化活性比较低,活性低带来催化目标底物浓度较低、所需的反应周期长,设备占用周期长,时空产率较低,应用于工业生产的akred还有待进一步开发。目前,尚未有相关文献报道应用醛酮还原酶制备(s)-tcpe。
技术实现要素:
有鉴于此,本发明的目的在于提供一种醛酮还原酶突变体、编码基因及其在合成(s)-tcpe中的应用;所述醛酮还原酶突变体在合成中的区域选择性以及立体选择性好;同时催化效率更高,成本更低。
利用本发明提供的利用醛酮还原酶突变体合成(s)-tcpe反应条件温和,对环境友好;在醛酮酶反应中,需要用到辅酶,而辅酶十分昂贵;本发明提供的利用醛酮还原酶突变体合成(s)-tcpe的方法中,使用异丙醇,实现了辅酶的循环利用,进一步降低生产成本。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种醛酮还原酶突变体,将野生型的akred-lk中以下位点中的一个或几个进行突变:
将a94突变为s94;
将e145突变为a145、l145或c145;
将s96突变为e96。
优选的,所述醛酮还原酶突变体的氨基酸序列如seqidno.1所示。
本发明提供了所述的醛酮还原酶突变体的编码基因,所述编码基因的核苷酸序列如seqidno.2所示。
本发明提供了包括所述的醛酮还原酶突变体的编码基因的重组载体。
本发明提供了包括所述的醛酮还原酶突变体的编码基因的重组菌株。
本发明提供了所述的醛酮还原酶突变体在合成(s)-tcpe中的应用。
本发明提供了一种利用所述的醛酮还原酶突变体在合成(s)-tcpe的方法,包括以下步骤:
将反应原料混合获得合成体系;
将所述合成体系置于28~32℃反应8~12h;
所述合成体系如下:
优选的,所述合成体系如下:
优选的,所述反应的温度为30℃,所述反应的时间为10h。
优选的,所述pb缓冲液的浓度为0.08~0.12mol/l,所述pb缓冲液的ph为7.4~7.6。
本发明的有益效果:本发明提供的醛酮还原酶突变体,通过将氨基酸a94、s96和e145中的一个或几个位点进行突变获得,所述醛酮还原酶突变体在合成中的区域选择性以及立体选择性好;同时催化效率更高,成本更低。
利用本发明提供的利用醛酮还原酶突变体合成(s)-tcpe反应条件温和,对环境友好;在醛酮酶反应中,需要用到辅酶,而辅酶十分昂贵;本发明提供的利用醛酮还原酶突变体合成(s)-tcpe的方法中,使用异丙醇,实现了辅酶的循环利用,进一步降低生产成本。
进一步的,三突变的醛酮还原酶突变体的酶活力较单突变酶活力提高6倍左右,具有良好的工业应用前景。
附图说明
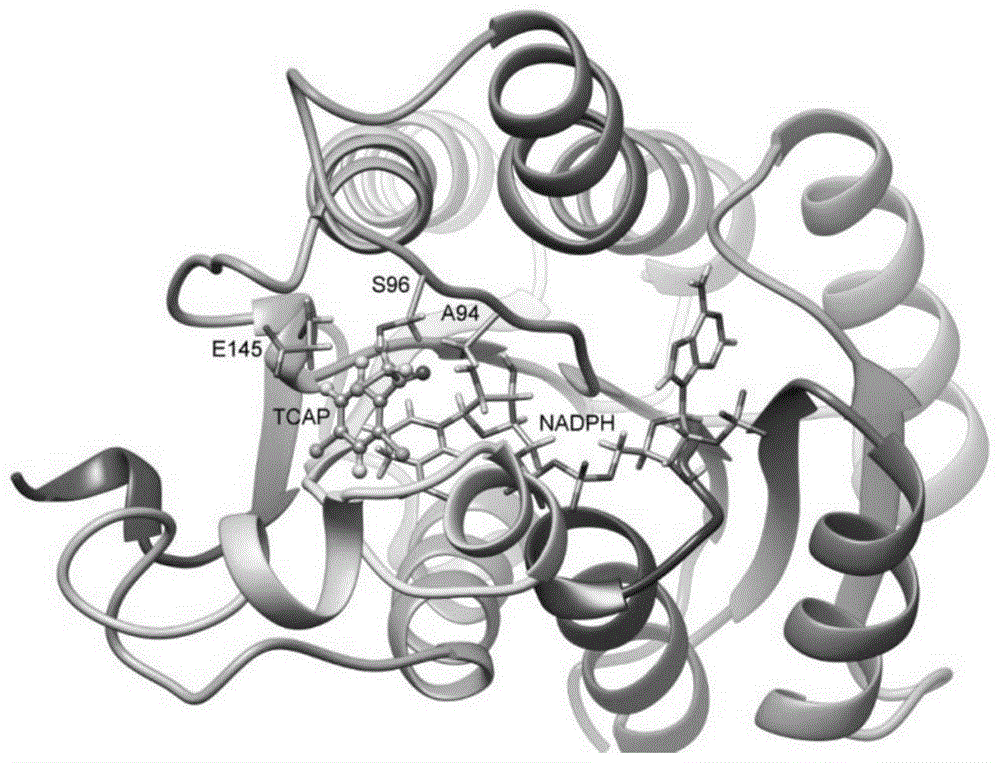
图1为akred-lk与tcap、nadph的三元复合物的稳定结合构象;
图2为akred-lk-nadph-tcap三元复合物稳定构象;
图3为pet-28a-akred-lk双酶切验证电泳图;
图4为野生型及各突变体蛋白纯化图;
图5为kred-lk的a94位点突变体对tcap的活性结果;
图6为kred-lk-s的e145位点突变体对tcap的活性结果;
图7为kred-lk-sa的s96位点突变体对tcap的活性结果。
具体实施方式
本发明提供了一种醛酮还原酶突变体,将野生型的akred-lk中以下位点中的一个或几个进行突变:将a94突变为s94;将e145突变为a145、l145或c145;将s96突变为e96。
在本发明中,所述野生型的akred-lk是来源于乳酸杆菌(lactobacilluskefiridsm20587);所述野生型akred-lk的氨基酸序列如seqidno.1所示,所述野生型akred-lk的编码基因的核苷酸序列如seqidno.2所示。在本发明中,所述野生型akred-lk对于底物tcap几乎没有任何活性。
在本发明中,将野生型的akred-lk中的a94突变为s94,即将第94位的丙氨酸突变为丝氨酸后,对底物tcap的活力大幅提高。在本发明中,野生型的akred-lk中的a94突变为s94后的突变体氨基酸序列如seqidno.3所示,所述a94突变为s94后的突变体的编码基因如seqidno.4所示。
在本发明中,可选的将野生型的akred-lk中的e145位点的突变,将e突变为丙氨酸、亮氨酸以及半胱氨酸时,对底物的活力均有明显提高,其中突变为丙氨酸时,活力最高。在本发明中,将e145突变为a145后的突变体氨基酸序列如seqidno.5所示,所述将e145突变为a145后的突变体的编码基因如seqidno.6所示。
在本发明中,可选的将野生型的akred-lk中的将s96突变为e96后,对底物的活力有明显提高。
在本发明中,优选的将野生型的akred-lk中的a94突变为s94,将e145突变为a145,并将s96突变为e96获得最优的醛酮还原酶突变体akred-lk-sae,所述醛酮还原酶突变体akred-lk-sae的氨基酸序列如seqidno.7所示。
本发明提供了所述的醛酮还原酶突变体akred-lk-sae的编码基因,所述编码基因的核苷酸序列如seqidno.8所示。本发明对上述述醛酮还原酶突变体akred-lk-sae的编码基因的制备方法没有特殊限定,采用人工合成即可。
本发明提供了包括所述的醛酮还原酶突变体的编码基因的重组载体。在本发明中,所述重组载体以pet-28a(+)表达载体为初始载体,将所述醛酮还原酶突变体的编码基因连接到所述pet-28a(+)表达载体上获得重组载体;在本发明中,所述醛酮还原酶突变体的编码基因优选的连接至xhoι和ndeι酶切位点之间。本发明对所述重组载体的制备方法没有特殊限定,采用本领域常规的重组载体制备方法即可。
本发明提供了包括所述的醛酮还原酶突变体的编码基因的重组菌株。在本发明中,所述重组菌株优选的通过将所述重组载体转入原始菌株中制备获得重组菌株。在本发明中,所述原始菌株优选为大肠杆菌jm109(de3)。本发明对所述重组菌株的制备方法没有特殊要求,采用本领域常规的制备方法即可。
本发明提供了所述的醛酮还原酶突变体在合成(s)-tcpe中的应用。在本发明中,所述醛酮还原酶突变体对底物tcap具有显著的活力,能够催化底物tcap合成(s)-tcpe。
本发明提供了一种利用所述的醛酮还原酶突变体在合成(s)-tcpe的方法,包括以下步骤:将反应原料混合获得合成体系;将所述合成体系置于28~32℃反应8~12h;
在本发明中,所述合成体系如下:
优选的如下:
在本发明中,所述反应的温度优选为30℃,所述反应的时间优选为10h。
在本发明中,所述pb缓冲液的浓度优选为0.08~0.12mol/l,更优选为0.1mol/l,所述pb缓冲液的ph优选为7.4~7.6,更优选为7.5。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
合成的基因akred-lk需要换到表达载体上(pet-28a(+)),使其可以在大肠杆菌jm109(de3)中表达。
实验操作流程大致如下:
a)使用相同的限制性内切酶对目的基因和表达载体pet-28a(+)进行双酶切以得到粘性末端片段,37℃酶切100min后与10x的loadingbuffer,吹打均匀后跑琼脂糖胶,20μl的酶切体系见表1。
表1限制性内切酶酶切体系
b)使用dna胶回收试剂盒纯化回收akred-lk基因片段和pet-28a(+)载体片段,具体操作步骤见说明书;
c)使用ligationhigh(购自东洋纺生物科技有限公司)将回收产物连接成环形质粒,16℃连接3h,连接体系见表2。
表2粘性末端片段的连接体系
d)12μl的连接产物转化至大肠杆菌jm109(de3),活化抗性菌后提取pet-28a-akred-lk质粒并进行双酶切验证,如图3;验证后的质粒pet-28a-akred-lk转化至jm109(de3),挑斑活化和扩大培养后,添加诱导剂iptg诱导醛酮还原酶akred-lk蛋白表达,实验操作流程大致如下:
a1)保藏于超低温冰箱的感受态细胞悬液置于冰上解冻后加入2μl质粒或10μl的连接产物,冰上静置30min让质粒附集在细胞表面;
a2)42℃水浴热击55s增加细胞通透性,促使质粒进入细胞;热激后立即在冰上静置3min;
a3)吸取0.8mllb培养基(无抗性)加入,37℃条件振荡复苏1h;
a4)吸取200μl复苏液在平板(kan抗性)上涂布出单菌落,37℃恒温培养箱倒置培养(过夜),若来不及复苏1h,可将复苏液低速离心(1000×g)1min后上清弃去大部,余下的重悬后涂板。
用灭菌的牙签蘸取单菌落,置于在5mllb培养液中,35℃条件振荡复苏培养过夜,菌液和80%(w/w)灭菌甘油按8:2的比例保菌,于-20℃条件下保存。
挑取单菌落至5mllb培养液(含0.1%kan抗性),37℃条件下振荡(180rpm)复苏10h,转接至50mllb培养液,37℃条件下振荡培养至光密度值达到0.5~0.6后,按0.1%的比例加入iptg母液至其工作浓度为0.1μm,25℃低温条件下振荡培养过夜,诱导akred-lk蛋白表达。发酵液高速(5000×g)离心8min后收集沉淀,用5mlpb缓冲液(0.1m,ph7.5)重悬,细胞重悬液置于冰水中,185w超声波破碎8.8min后,11000×g离心8.8min收集上清液,上清液即包含了工程菌所表达的目的蛋白(粗酶液),置于-20℃冰箱保藏。
醛酮还原酶akred-lk的定点突变
根据所设计的pcr定点突变引物的tm值确定退火温度大约为55℃,总共循环数为25个,延伸温度68℃、时间3.5min。反向pcr定点突变体系如表3所示。
表3反向pcr定点突变体系
引物序列如下:
a94位点
反向位点aattccggcattgttgacaaccgtggta(seqidno.9)
正向位点nnkgtcagcaagagtgttgaagatacca(seqidno.10)
e145
反向gatagatgacatattgatgattgatgct(seqidno.11)
正向nnkggttttgttggtgatccaactctgggtg(seqidno.12)
s96
反向gacgctaattccggcattgttgacaacc(seqidno.13)
正向nnkaagagtgttgaagataccacaactg(seqidno.14)
pcr产物中含有野生型质粒pet-28a-akred-lk,50μl扩增好的体系中加入1μldpni(10u/μl),混匀后37℃反应1.5h,消化分解模板质粒pet-28a-akredlk,pcr产物pcrcleaning试剂盒清洗,将之前体系内的上下游引物、被分解的模板残余片段、mg2+和dntp等各种杂质去除,以保证下一步骤的pnk激酶连接的效率。
将连接有pcr产物的质粒转化大肠杆菌jm109(de3),平板培养后,挑选长出的单克隆送测序,验证序列正确,得到了含有突变体的大肠杆菌。转化步骤如上所述。
连接。
t4连接酶buffer中含有atp,融化时需置于冰上,预混液每7μl冰上分装,-20℃条件保存。预混液体系如表4所示:
表4定点突变一步法预混液配置
取3μlpcr产物与7μl的预混液缓慢吹打混匀,室温(25℃~30℃)静置1h后,用移液枪吸取全部10μl转化,转化与质粒转化操作一致,步骤如上所述。
醛酮还原酶akred-lk突变体的自诱导表达及筛选
突变体首先挑斑37℃培养过夜活化,在扩大培养的同时用80%的甘油保存一份菌种,每块突变平板挑取三个单板进行筛选以保证假阳性的干扰。依据上述比例在超净台中配置自诱导培养基,分别按照1%和0.1%的量加入表达突变体重组菌的种子液和抗生素母液,在28℃摇床中振荡(180rpm)培养48h。发酵液高速(5000×g)离心8min后收集沉淀,用pb缓冲液(0.1mol/l,ph7.5)重悬细胞,而后将细胞重悬液置于冰水中,185w超声波破碎8min后,高速离心(12000rpm)收集上清液,上清液即包含了工程菌所表达的突变蛋白(粗酶液),置于-20℃冰箱保藏。akred-lk突变体催化tcap筛选反应的体系如表5所示:
表5akred-lk突变体催化tcap筛选反应的体系
以不加醛酮还原酶akred-lk的反应做为空白对照,以不加底物tcap的反应做为背景对照。30℃条件180rpm反应10h后,吸取50μl反应液用1ml正己烷萃取后,震荡混匀高速离心(12000×g)后,吸取上清液用hplc检测。液相筛选出的最佳突变体提取质粒,送至基因测序服务公司检测相应位点是否突变成功。
蛋白纯化
以缓冲液a先平衡蛋白质ni+柱后,加入步骤7制备的粗酶液,充分摇荡30min,放掉废液,以缓冲液a冲洗三次后,加入缓冲液b充分摇荡均匀20min,后收集流出液,流出液中加入过量硫酸铵至无法溶解,离心3000rpm,10min,收集沉淀,沉淀中加入质量浓度15%甘油水溶液溶解,获得蛋白溶液;蛋白溶液过以g25为填料的层析柱脱盐,检测流出液的a280吸收值,收集a280吸收值大于0.1的部分,获得纯酶;缓冲液a:nacl140mmol/l,kcl2.7mmol/l,na2hpo410mmol/l,kh2po41.8mmol/l,以5mnaoh调节ph值至8.0,溶剂为水;缓冲液b:nah2po4·2h2o50mm,nacl300mm,咪唑(imidazole)500mm,以5m盐酸溶液调节ph值至8.0,溶剂为水,蛋白纯化结果如图3。
实施例2
底物tcap和产物(s)-tcpe的酶催化反应体系hplc分析方法:检测分析柱:大赛璐手性色谱ad-h柱(250mm×4.6mm);洗脱液配比:正己烷/异丙醇=90%/10%(v/v),含0.1%三氟乙酸;洗脱速度:0.8ml/min;手性柱柱温:35℃;紫外测量波长:λ=205nm。醛酮还原酶催化tcap的反应体系见表6。
表6akred-lk催化底物tcap的反应体系
以不加醛酮还原酶akred-lk的反应做为空白对照,以不加底物tcap的反应做为背景对照。30℃摇床180rpm条件反应10h后,取50μl反应液用1ml正己烷萃取,震荡混匀高速离心后,吸取上清液用hplc检测。akred-lk对tcap每个酶活力单位(u)指的是单位时间(1min)催化产生1μmol产物的酶量(酶液体积或蛋白质量)。
来自lactobacilluskefir的野生型醛酮还原酶(genbankaccessionno.:aap94029),经分光光度计检测对底物的活力时,基本上没有活力,但是利用hplc筛选时,可以看到非常低的相对活力,与a94s相比,活力基本可忽略不计。a94s的活力虽较野生型醛酮还原酶高,但是其比活仍不能很好地满足工业应用的要求。
由计算机模拟结果筛选出的位点a94,e145,s96中,先对a94进行饱和突变发现,akred-lk-s对tcap的活力提高,但是单突变的比活达不到工业生产要求,进而在单突变基础上,再对e145进行饱和突变,其结果如图6,其中将谷氨酸突变为丙氨酸、亮氨酸、半胱氨酸时,对tcap活力显著提高,其中突变为丙氨酸活力最高。
在前面两轮突变最优结果的基础上,对筛选出来的s96位点再次进行饱和突变,结果如图7,发现大部分突变的氨基酸对底物的活性均有所提高,但是将丝氨酸突变为谷氨酸时,其对底物的相对活力最高,且经酶活检测发现,其比活力也是最高,较野生型提高了6倍左右,具有工业生产的潜力。
实施例3
akred-lk对tcap每个酶活力单位(u)指的是单位时间(1min)催化还原1μmoltcap的酶量(酶液体积或蛋白质量)。
酶活计算公式为:酶活(u)=ew*v/(ε*l);
ew:1min内的测量的吸光值变动;
v:反应液的体积(ml);
ε:摩尔消光系数6.2(l*mmol-1*cm-1);
l:光程距离(cm)
对经步骤8纯化后三种突变体蛋白进行酶活力测定。反应体系:10μl纯化的酶溶液,2890μlpb(0.1m,ph7.5),50μl用dmso溶解的底物,和50μlnadph(10mg/ml)。所有实验重复三次。酶活力如表7。
表7不同突变体的酶活
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!