一种软骨的再生方法与流程
本发明涉及再生医学技术领域,尤其涉及一种基于基因转染的软骨再生方法。
背景技术:
目前软骨再生方法主要通过体外添加生长因子促其生长扩增达到再生目的,但生长因子存在不确定性,有致瘤等风险;添加的生长因子需要多种,并达到一定浓度才能满足细胞增长的需求;外源性生长因子存在诸多不确定性,有致瘤等风险;生长因子作用效应短暂,一过性;生长因子也可能同时作用于其它细胞,产生不可控的结果。
因此,亟需提供一种基于基因转染的软骨再生方法,以解决上述问题,达到高效促进软骨再生的目的。
技术实现要素:
本发明的目的在于,提供一种软骨的再生方法,尤其是基于基因转染的软骨再生方法,将目的基因hsa-mir-193b-3p成功转染至人软骨细胞内,从再生所需的细胞源头进行干预,增强细胞扩增及分泌细胞外基质的能力并尽可能减少副反应。
为了实现上述目的,本发明提供了一种软骨的再生方法,所述再生方法包括将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤。
在本发明一实施例中,在所述将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤中,由慢病毒载体将目的基因转染至软骨细胞内,于35~39℃和4~6%co2的培养箱条件中孵育48~72小时。
在本发明一实施例中,慢病毒载体将目的基因转染至软骨细胞内,于37℃和5%co2的培养箱中孵育60小时。
在本发明一实施例中,所述目的基因含gfp荧光,以检测目的基因是否成功转染至软骨细胞中。
在本发明一实施例中,所述再生方法还包括:检测是否转染成功的步骤。
在本发明一实施例中,在所述检测是否转染成功的步骤中,于荧光显微镜下通过荧光显色检测是否转染成功。
在本发明一实施例中,所述再生方法还包括:将转染后的软骨细胞体外培养的步骤。
在本发明一实施例中,在所述将转染后的软骨细胞体外培养的步骤中,将转染成功后的软骨细胞进行体外常规培养,形成软骨膜片,即获得软骨再生材料。
在本发明一实施例中,所述软骨细胞的获取包括如下步骤:
取手术中废弃的残耳软骨,将软骨切成碎片,胶原酶消化后,过滤离心,获得原代软骨细胞;
将所述原代软骨细胞于dmem培养基中,并在加湿的35~39℃和4~6%co2的培养箱中培养;所述dmem培养基含有8~12%胎牛血清、90~110u/ml青霉素和90~110μg/ml链霉素。
在本发明一实施例中,在所述软骨细胞的获取步骤中,所述dmem培养基每两天更换一次。
在本发明一实施例中,在所述软骨细胞的获取步骤中,将所述原代软骨细胞于dmem培养基中,并在加湿的37℃和5%co2的培养箱中培养;所述dmem培养基(hyclone,logancity,ut,美国)含有10%胎牛血清(fbs,gibco,美国)、100u/ml青霉素和100μg/ml链霉素。
本发明中,所述目的基因(hsa-mir-193b-3p)的碱基序列为aacuggcccucaaagucccgcu。
本发明中,所述软骨细胞体外培养采用本领域常规体外培养细胞的方法。
本发明中,可通过qrcr手段定量检测目的基因的转染效率。
本发明的有益效果在于:
通过将基因hsa-mir-193b-3p至转染至人软骨细胞,可以从源头上改进软骨细胞的特性,以增强细胞扩增及分泌细胞外基质的能力,并尽可能减少现有技术中因生长因子的不确定性而导致的致瘤风险。
本发明从所需作用的细胞源头进行干预,改变了软骨细胞的性能,并增强了细胞扩增及分泌细胞外基质的能力;有效减少副反应,降低致瘤风险;本发明转染的软骨细胞的效应持久,并可传给子代。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
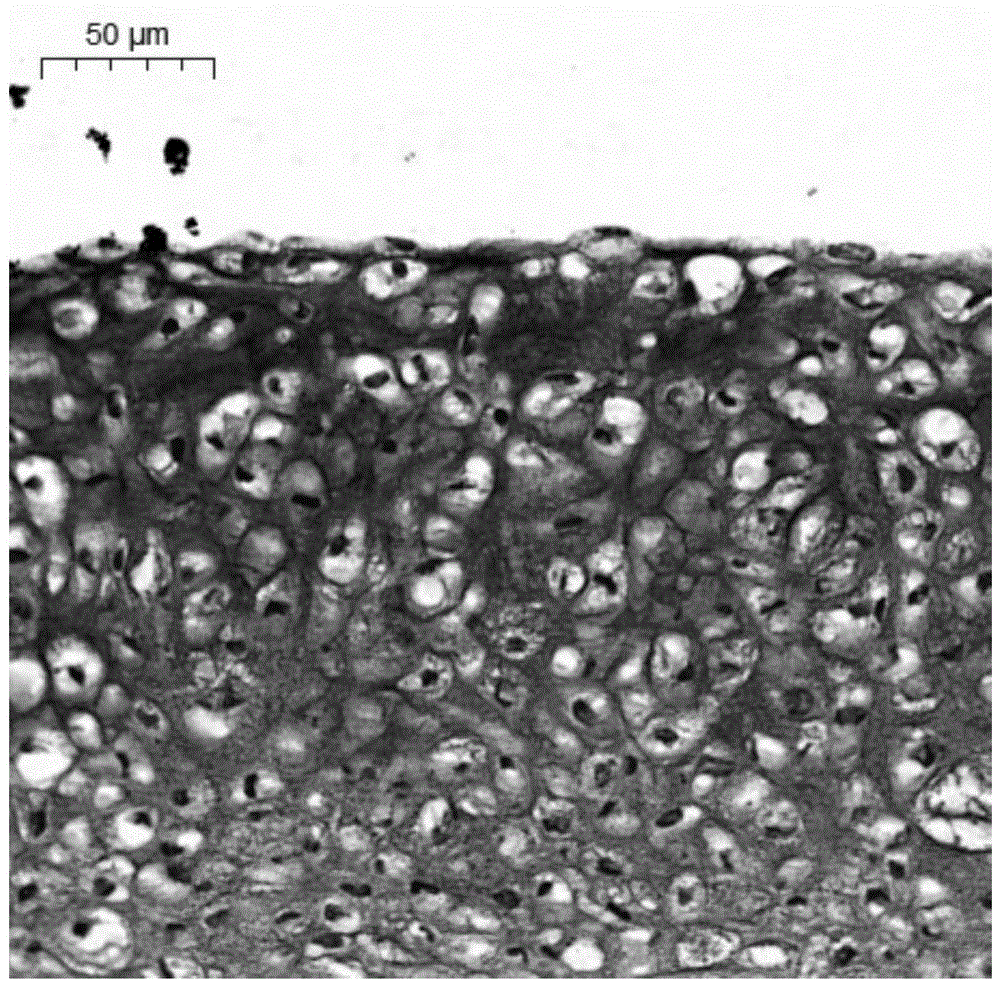
图1为本发明试验例1中得到的软骨组织的he染色图。
图2为本发明试验例2中的实验组与对照组的软骨组织的he染色图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例提供了一种软骨的再生方法,是一种基于基因转染的软骨再生方法,所述再生方法包括将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤。
在所述将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤中,由慢病毒载体将目的基因转染至软骨细胞内,于35~39℃和4~6%co2的培养箱条件中孵育48~72小时。
所述再生方法还包括:将转染后的软骨细胞体外培养的步骤。在所述将转染后的软骨细胞体外培养的步骤中,将转染成功后的软骨细胞进行体外常规培养,形成软骨膜片,即获得软骨再生材料。
所述软骨细胞的获取包括如下步骤:
取手术中废弃的残耳软骨,将软骨切成碎片,胶原酶消化后,过滤离心,获得原代软骨细胞;
将所述原代软骨细胞于dmem培养基中,并在加湿的35~39℃和4~6%co2的培养箱中培养;所述dmem培养基(hyclone,logancity,ut,美国)含有8~12%胎牛血清(fbs,gibco,美国)、90~110u/ml青霉素和90~110μg/ml链霉素。
实施例2
本实施例提供了一种软骨的再生方法,所述再生方法包括将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤。
在所述将目的基因hsa-mir-193b-3p转染至软骨细胞的步骤中,由慢病毒载体将目的基因转染至人软骨细胞内,于37℃和5%co2的培养箱中孵育60小时。
所述再生方法还包括:将转染后的软骨细胞体外培养的步骤。
在所述将转染后的软骨细胞体外培养的步骤中,将转染成功后的软骨细胞进行体外常规培养4周,形成软骨膜片,即获得软骨再生材料。
所述目的基因含gfp荧光,用以检测目的基因是否成功转染至软骨细胞中。
所述软骨细胞的获取包括如下步骤:
取手术中废弃的残耳软骨,将软骨切成碎片,胶原酶消化后,过滤离心,获得原代软骨细胞;
将所述原代软骨细胞于dmem培养基中,并在加湿的37℃和5%co2的培养箱中培养;所述dmem培养基(hyclone,logancity,ut,美国)含有10%胎牛血清(fbs,gibco,美国)、100u/ml青霉素和100μg/ml链霉素。在所述软骨细胞的获取步骤中,所述dmem培养基每两天更换一次。
试验例1
将本发明实施例1得到软骨再生材料移植裸鼠皮下,8周后在其体内取材进行组织学检测,以检测软骨再生情况:采用he染色对取材进行检测,观察并记录实验结果,如图1所示。
根据图1可知,利用本发明的方法得到的软骨再生材料,组织中软骨细胞密集,生长良好,可见明显的软骨陷窝。
试验例2
将本发明实施例2得到软骨再生材料移植裸鼠皮下,8周后在其体内取材,作为实验组,进行组织学检测,以比较软骨再生情况;以植入未进行转染的软骨细胞体外培养得到的软骨再生材料为实验组,其他条件完全相同,采用he染色分别对实验组与对照组的组织取材进行检测,观察并记录实验结果,如图2所示。
根据图2可知,实验组的再生作用明显优于对照组。可见利用本发明的基于基因转染的软骨再生方法,软骨再生作用明显;实验组软骨细胞外基质(ecm)合成分泌丰富,且较对照组软骨质量更优。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!