一种l-鸟氨酸盐的制备方法
技术领域
1.本发明涉及一种l-鸟氨酸盐的制备方法。
背景技术:
2.l-鸟氨酸(ornithine,orn)是一种非蛋白氨基酸,学名为α,δ-二氨基戊酸,分子式为c5h
12
n2o2,l-鸟氨酸难以结晶,通常是浆状物,易溶于水、乙醇,微溶于乙醚。通常作为试剂使用的是其盐。
3.l-鸟氨酸对氨态氮的排出及解除氨中毒有重要的作用,可用于功能性饮料、减肥保健产品及护肝抗癌药品等,例如l-鸟氨酸l-门冬氨酸复合盐和l-鸟氨酸苯乙酸盐可以降低异常的氨态氮浓度,参与肝脏解毒,有效进行肝脏保护和肝脏疾病治疗。德国麦氏大药厂(merz pharma gmbh&co.,kgaa)以l-鸟氨酸为原料制备的l-鸟氨酸l-门冬氨酸注射剂(ornithine aspartate for injection,商品名:雅博司),以及武汉启瑞药业有限公司以l-鸟氨酸为原料制备的l-鸟氨酸l-门冬氨酸颗粒剂(ornithine aspartate granules,商品名:瑞甘),在肝硬化、高血氨症和肝性脑病中得到临床肯定。另外,l-鸟氨酸-α-酮戊二酸盐是很好的临床营养剂,用于外伤和烧伤的恢复;l-鸟氨酸盐酸盐是细胞生长因子聚胺合成的前体,有助于美肤作用。在欧洲,l-鸟氨酸盐作为膳食药物来销售,日本将l-鸟氨酸盐与肉碱、谷氨酸等作为食品调料来看待。因此l-鸟氨酸盐作为医药原料和中间体,以及多功能的保健作用而引起特别关注。
4.目前,制备l-鸟氨酸单盐(l-鸟氨酸盐酸盐、l-鸟氨酸硫酸盐等)的方法主要有化学合成法、酶法和生物发酵法。其中,生物发酵法以葡萄糖为原料,目前还未大量应用于工业化生产;现在,工业化生产采用的是化学法与酶法,均以精氨酸为原料,经碱法水解或利用精氨酸酶水解得到等摩尔的l-鸟氨酸盐与尿素,后续再利用l-鸟氨酸单盐不溶于乙醇、尿素溶于乙醇的性质,使用大量的乙醇试剂从尿素溶液中提取l-鸟氨酸单盐,由于用到了大量的乙醇,安全与环保压力均较大。
5.cn104830922b公开了一种l-鸟氨酸酶法转化制备方法,以精氨酸为底物配制酶转化液,加入具有精氨酸酶活性的菌体细胞或粗酶液催化水解,利用等电点结晶和离子交换相结合的方法分离制备转化产物l-鸟氨酸盐酸盐。其中,使用了乙醇析晶,并且需要使用氨水或无机酸调节ph值,造成耗酸碱量和有机溶剂量大的问题,产生废盐,污染大。
6.cn102277395a公开了一种制备l-鸟氨酸硝酸盐的方法,以精氨酸为底物,利用硝酸调节ph,利用固定化酶转化生成l-鸟氨酸硝酸盐后,采用乙醇析晶提取l-鸟氨酸硝酸盐。其中也使用了传统的乙醇析晶从尿素与l-鸟氨酸盐溶液中提取l-鸟氨酸盐,化生产成本高,安全风险大。
7.cn102234624b和cn102191291b中均公开了制备精氨酸酶以及利用该精氨酸酶制备l-鸟氨酸盐酸盐的方法,其中同样使用了大量的乙醇,生产存在安全隐患。
8.另外,现有技术cn104193632b公开了一种鸟氨酸盐酸盐的制备方法,其中,利用精氨酸酶水解得到鸟氨酸与尿素,再使用截留分子量为300~1000da的纳滤膜和截留分子量
为50~100da的纳滤膜先后处理,分离得到鸟氨酸和尿素。其中,纳滤膜主要依靠孔径大小进行物质分离,而纳滤膜的膜孔本身的尺寸大小并不是一致,鸟氨酸分子量(132)与尿素分子量(60)差距较小,分离效果较差,且纳滤膜废水量较大、产物浓度低,后续浓缩成本较大。
9.目前制备l-鸟氨酸单盐方面,主要面临的问题是:1)现有的制备方法中大多使用乙醇溶剂或者是酸碱试剂,而乙醇易燃,存在较大的安全隐患;2)l-鸟氨酸盐与尿素不易分离,导致分离效果较差,产物收率低。
10.cn102373245b公开了一种制备l-鸟氨酸-α-酮戊二酸的方法,使用固定化酶转化精氨酸底物,采用乙酸调节ph值,转化完毕后,加入α-酮戊二酸,再加入醇类析晶。其中,使用了乙酸调ph、会产生大量废盐,使用了醇类分离尿素与l-鸟氨酸-α-酮戊二酸,有机溶剂量大,污染大,生产成本高。
11.cn108440318a公开了一种制备门冬氨酸鸟氨酸的工艺方法,以l-精氨酸为起始原料,滴加盐酸和氢氧化锂,加热反应后,降温浓缩,制备得到鸟氨酸盐酸盐,再将鸟氨酸盐酸盐上阳离子交换树脂,用氨水洗脱后,减压浓缩,得到游离鸟氨酸,再加入门冬氨酸成盐。该技术方法使用了传统的离子交换树脂法,整个工艺均使用了大量的酸与碱,周期长,污染大。
12.cn106699586b以l-鸟氨酸醋酸盐和l-门冬氨酸为起始原料,加入缚酸剂碳酸铵中和l-鸟氨酸醋酸盐的醋酸根,最终制得纯的门冬氨酸鸟氨酸。该方法使用了缚酸剂碳酸铵,残留的铵根离子难以除去,且会产生废盐醋酸铵。
13.cn104058981a公开了一种门冬氨酸鸟氨酸的制备方法。将鸟氨酸盐溶于水,用碱液调节ph值8~11,利用电渗析方法,获得游离鸟氨酸,再用门冬氨酸调节溶液ph值7~9,经浓缩后,直接加入甲醇溶液析晶。该方法需要用大量的碱液调节鸟氨酸盐溶液的ph,且获得游离鸟氨酸后,会产生相应的废盐。
14.现有技术中l-鸟氨酸复合盐的制备方法主要存在的技术问题是需要用到大量的酸碱、产生大量废盐、废水,环保压力大。
15.因此,亟需一种环保高效的新工艺解决上述技术问题。
技术实现要素:
16.本发明要解决的技术问题是克服现有技术的制备方法污染严重、存在安全隐患以及分离效率低的缺陷而提供一种l-鸟氨酸盐的制备方法。
17.本发明是通过下述技术方案来解决上述技术问题的:
18.本发明提供了一种l-鸟氨酸盐的制备方法,其包括以下步骤:
19.(1)将精氨酸溶液与精氨酸酶混合反应,获得转化液;调节所述转化液的ph值至酸性,即得l-鸟氨酸盐与尿素的混合溶液;
20.(2)以所述l-鸟氨酸盐与尿素的混合溶液为原料,通过电渗析装置分离之后分别获得l-鸟氨酸盐溶液和尿素溶液;
21.(3)所述l-鸟氨酸盐溶液结晶即可获得l-鸟氨酸盐。
22.步骤(1)中,所述精氨酸溶液可为精氨酸和反渗透水的混合液。
23.步骤(1)中,所述精氨酸溶液的浓度可为本领域常规,较佳地为0.2~2.5mol/l,例如0.2mol/l、1.5mol/l或2.5mol/l。
24.步骤(1)中,所述精氨酸酶与所述精氨酸溶液中精氨酸的质量比较佳地为1:10~50,例如1:50、1:25或1:10。
25.步骤(1)中,较佳地,所述精氨酸溶液的ph值为8.0~10.0,例如ph值为8.0、8.7或9.7。
26.步骤(1)中,本领域技术人员均知晓,所述精氨酸溶液与所述精氨酸酶混合之后发生酶促反应。
27.步骤(1)中,所述混合反应的温度较佳地为30~50℃,例如30℃、35℃、38℃或48℃。
28.步骤(1)中,所述混合反应的时间较佳地为3~5小时,例如4小时。
29.其中,一般通过检测所述转化液中的精氨酸与所述精氨酸溶液中的精氨酸的质量比控制所述混合反应的进程。较佳地,当所述转化液中的精氨酸与所述精氨酸溶液中的精氨酸的质量比小于0.2%~0.3%时,停止所述混合反应,例如小于0.2%,停止所述混合反应。
30.所述检测的手段可为本领域常规,一般为药典通则0502中记载的薄板层析法。所述薄板层析法中所用的展层剂配比可为本领域常规,例如,按体积比,正丁醇:丙酮:浓氨水:水=10:10:5:2。
31.步骤(1)中,一般将所述转化液进行过滤处理,以除去所述精氨酸酶。
32.其中,所述过滤一般通过酶过滤器实现。
33.步骤(1)中,所述转化液中一般含有等摩尔比的l-鸟氨酸与尿素。
34.其中,较佳地,所述l-鸟氨酸与所述精氨酸溶液中精氨酸的摩尔比相当。
35.步骤(1)中,调节所述转化液的ph值至酸性后一般即可获得l-鸟氨酸盐。
36.步骤(1)中,所述ph值较佳地为3.0~7.0,例如ph值为5.0、5.5、6.0、6.5或7.0。
37.本发明中,所述精氨酸溶液的ph值的调节剂的种类与所述转化液的ph值调节剂的种类一致。所述精氨酸溶液的ph值的调节剂或者所述转化液的ph值调节剂的种类可为本领域常规的有机酸或者无机酸,较佳地为盐酸、硫酸、硝酸、醋酸、l-门冬氨酸、α-酮戊二酸、r-(+)-硫辛酸、牛磺酸或阿魏酸。
38.步骤(1)中,当所述转化液的ph值的调节剂为无机酸时,所述混合溶液中的l-鸟氨酸盐(即步骤(3)中结晶获得的l-鸟氨酸盐)为单盐,例如,当无机酸为盐酸、硫酸、硝酸或醋酸时,步骤(3)中结晶获得的l-鸟氨酸盐分别为l-鸟氨酸盐酸盐、l-鸟氨酸硫酸盐、l-鸟氨酸硝酸盐或l-鸟氨酸醋酸盐。
39.步骤(1)中,当所述转化液的ph值的调节剂为有机酸时,所述混合溶液中的l-鸟氨酸盐(即步骤(3)中结晶获得的l-鸟氨酸盐)为复合盐,例如,当有机酸为l-门冬氨酸、α-酮戊二酸、r-(+)-硫辛酸、牛磺酸或阿魏酸时,步骤(3)中结晶获得的l-鸟氨酸盐分别为l-鸟氨酸-l-门冬氨酸盐、l-鸟氨酸-α-酮戊二酸盐(摩尔比1:1)、l-鸟氨酸-r-(+)-硫辛酸盐、l-鸟氨酸牛磺酸盐或l-鸟氨酸阿魏酸盐。
40.步骤(1)中,较佳地,将所述l-鸟氨酸盐与尿素的混合溶液依次进行脱色、过滤处理。
41.其中,所述脱色的操作和步骤可为本领域常规,一般通过加入活性炭进行脱色。所述活性炭的用量可为本领域常规,较佳地,所述活性炭的用量占所述精氨酸溶液中精氨酸
的比例为0.5~1wt%,例如0.5%、0.51%或1.0%。所述脱色时间可为本领域常规,例如脱色30min。所述过滤的方式可为本领域常规,一般通过板框过滤来实现过滤至滤液清亮。
42.步骤(2)中,所述电渗析装置可为本领域常规的电渗析装置。
43.步骤(2)中,所述电渗析装置中采用的阳极膜可为阳离子交换膜。所述电渗析装置中采用的阴极膜可为阳离子交换膜或者阴离子交换膜。
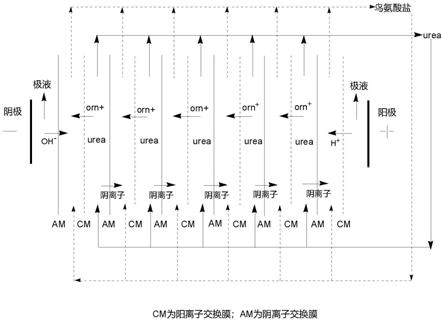
44.步骤(2)中,所述电渗析装置中采用的阳离子交换膜或阴离子交换膜可为本领域常规,较佳地为均相膜和/或非均相膜。
45.步骤(2)中,所述电渗析装置中采用的阴电极和阳电极的材料可为本领域常规,一般为耐腐蚀的材料,例如常规市售的ti、pt和ir的合金材料或ni材料。
46.步骤(2)中,根据本领域常识可知,所述电渗析装置中的阳极室和/或阴极室中含有电解质溶液,较佳地含有强电解质溶液。
47.其中,所述强电解质溶液的体积浓度较佳地为1~3%;例如1%、2%或3%。
48.其中,所述强电解质的种类可为化学领域常规的在水溶液中几乎完全发生电离的电解质,较佳地为硫酸、盐酸、硝酸、氢氧化钠、氢氧化钾、氯化钠、硫酸钠、硝酸钠、硫酸钾、硝酸钾、硫化钾或硫酸铵,例如,硫酸、氢氧化钠或氢氧化钾。
49.步骤(2)中,所述电渗析装置两端一般具有恒压直流电。
50.其中,所述恒压直流电的参数较佳地为:电压为220v;电流密度为100~700a/m2,例如200a。
51.步骤(2)中,所述电渗析装置中膜堆排列方式可以为任何合理的方式,较佳地,所述电渗析装置中膜堆排列方式为:阳电极-阳极室-阳极膜-[浓室-阴离子交换膜-淡化室-阳离子交换膜]
n-浓室-阴极膜-阴极室-阴电极,其中n为重复单元数且取值范围为1~100之间的整数,例如100。其中,淡化室均含有步骤(1)中的所述l-鸟氨酸盐与尿素的混合溶液,浓室均含有反渗透水。
[0052]
步骤(2)中,所述电渗析装置中膜堆排列方式较佳地还可以为:阳电极-阳极室-阳极膜-[浓室-阴离子交换膜-淡化室-阳离子交换膜]
n-浓室-阴离子交换膜-淡化室-阴极膜-阴极室-阴电极,其中n为重复单元数且取值范围为1~100之间的整数,例如100。其中,淡化室均含有步骤(1)中的所述l-鸟氨酸盐与尿素的混合溶液,浓室均含有反渗透水。
[0053]
步骤(2)中,一般通过检测所述电渗析装置中淡化室的电导率和电流控制反应进程。较佳地,所述淡化室的电导率降至0.1~3.0ms/cm以下,且电流降低至0.2~0.5a以下时停止步骤(2)中的反应,例如所述淡化室的电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。
[0054]
步骤(2)中,所述l-鸟氨酸盐溶液的浓度较佳地为0.9~3mol/l,例如0.9mol/l、1mol/l、1.1mol/l、1.7mol/l或3mol/l。所述尿素溶液的浓度为0.2~2.5mol/l,例如0.2mol/l、1.5mol/l或2.5mol/l。
[0055]
步骤(2)中,电渗析装置的运行过程一般为:1)向电渗析装置的阴极室和阳极室分别通入强电解质的溶液;向淡化室通入步骤(1)中的l-鸟氨酸盐与尿素的混合溶液;向浓室通入反渗透水;2)启动各隔室(例如,淡化室和浓室)的循环泵,使各料液在对应的隔室之间循环流动起来,待排除气泡后,调整各隔室流速,使各隔室压力相当。然后在电渗析装置的两端施加直流电;3)在电场作用下,淡化室内的l-鸟氨酸盐的阴离子透过阴离子交换膜迁
移到浓室,淡化室内的l-鸟氨酸阳离子透过阳离子交换膜迁移到浓室,阴、阳离子在浓室内重新结合生成l-鸟氨酸盐,淡化室内的尿素不带电,将继续留在淡化室,实验运行完毕,浓室得到l-鸟氨酸盐溶液,淡化室得到尿素溶液。
[0056]
步骤(3)中,所述结晶的步骤和条件可根据所述l-鸟氨酸盐溶液为单盐或者复合盐进行本领域常规选择。
[0057]
当所述l-鸟氨酸盐溶液为单盐溶液,例如l-鸟氨酸盐酸盐溶液、l-鸟氨酸硫酸盐溶液、l-鸟氨酸硝酸盐溶液或l-鸟氨酸醋酸盐溶液时,所述结晶的过程较佳地包括下述步骤:所述l-鸟氨酸盐溶液真空浓缩、降温、离心甩料和烘干即可获得l-鸟氨酸盐。
[0058]
其中,所述真空浓缩的操作可为本领域常规,较佳地,所述真空浓缩的真空度为0.08~0.1mpa。所述真空浓缩进行至晶体大量析出即可,获得结晶混合物,例如所述真空浓缩进行至所述结晶混合物中水分为20%~40%即可,例如20%、30%或40%。所述降温一般是指降温至本领域常规的温度,例如0℃。所述离心甩料和所述烘干的操作均可为本领域常规。
[0059]
较佳地,收集经所述离心甩料后的母液。较佳地,将所述母液进行脱色、真空浓缩、降温、再次离心甩料和烘干即可获得l-鸟氨酸盐。
[0060]
其中,所述脱色的操作和步骤可为本领域常规,一般通过加入活性炭进行脱色。所述活性炭的用量可为本领域常规,较佳地,所述活性炭的用量占所述精氨酸溶液中精氨酸的比例为0.5~1wt%,例如0.5%、0.51%或1.0%。所述脱色时间可为本领域常规,例如脱色30min。所述真空浓缩、所述降温、所述再次离心甩料和所述烘干均如上所述。
[0061]
当所述l-鸟氨酸盐溶液是复合盐溶液,例如l-鸟氨酸l-门冬氨酸盐溶液、l-鸟氨酸α-酮戊二酸盐(摩尔比1:1)溶液、l-鸟氨酸r-(+)-硫辛酸盐溶液、l-鸟氨酸牛磺酸盐溶液或l-鸟氨酸阿魏酸盐溶液时,所述结晶的方法可为本领域常规,例如结晶工艺中溶析剂的常规加入方式有正流加或者反流加。
[0062]
本领域技术人员均知晓,正流加是逐渐向溶液中流加溶析剂,从而使过饱和度缓慢地产生。对于本发明来说,采用正流加的结晶工艺,随着过饱和度的逐渐增加,溶液中会先产生油相,一段时间后,油相在容器壁上转变为固相,容易产生结块现象,最终得到的产品是水合物。
[0063]
本领域技术人员均知晓,反流加是将溶液加入溶析剂中,让溶液瞬间产生过饱和度,直接越过油相这一步,析出固相晶体,但在析出固相晶体之前产生的晶体仍然有结块现象产生。
[0064]
其中,所述结晶的方法较佳地按下述步骤进行:所述l-鸟氨酸盐溶液、溶析剂和所述l-鸟氨酸盐的晶种混合。更佳地按下述步骤进行:将所述l-鸟氨酸盐溶液加入至“所述l-鸟氨酸盐的晶种与溶析剂”的混合溶液中即可。
[0065]
发明人通过创造性的劳动发现,在现有技术反流加工艺的基础上,通过添加晶种,将溶液加入至“晶种+溶析剂”的混合溶液中不仅能够消除上述结块现象,而且所得到的晶体的晶形更加均一、规则,水分含量也更低。
[0066]
较佳地,先将所述l-鸟氨酸盐溶液浓缩,再加入至所述混合溶液中即可。经所述浓缩后的l-鸟氨酸盐溶液的浓度较佳地为1~3.4mol/l,例如2.5mol/l或3.33mol/l。
[0067]
其中,将所述l-鸟氨酸盐溶液加入至所述混合溶液的速度一般为50l/min。一般
地,所述l-鸟氨酸盐的晶种与所述溶析剂混合之后,开启搅拌。其中,较佳地,在所述l-鸟氨酸盐的晶种与所述溶析剂混合之前,将所述溶析剂加热至40~60℃,例如40℃或60℃。一般地,在将所述l-鸟氨酸盐溶液加入所述混合溶液中之后,保温快速搅拌30min,降温至常温,离心甩料,烘干即得到l-鸟氨酸盐。
[0068]
其中,所述溶析剂的种类可为本领域常规,较佳地为甲醇、乙醇和丙酮,及它们水溶液中的任意一种,例如乙醇。其中,所述溶析剂的加入量可为本领域常规,较佳地,所述溶析剂与所述精氨酸溶液中精氨酸的质量比为1:4~9,例如1:4或1:9。
[0069]
其中,较佳地,所述l-鸟氨酸盐的晶种的用量占所述溶析剂的比例为1~4wt%,例如1wt%或4wt%。
[0070]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0071]
本发明所用试剂和原料均市售可得。
[0072]
本发明的积极进步效果在于:1)采用本发明的方法制备l-鸟氨酸盐,零排放,无废盐和废水等污染,绿色、环保;
[0073]
2)当l-鸟氨酸盐为单盐时,经过两次结晶,收率高;当l-鸟氨酸盐为复合盐时,本发明的结晶方法对溶析剂要求较低,晶形较好,不需要精制工艺,且产品水分含量低。
附图说明
[0074]
图1为实施例1~2中电渗析设备的膜堆排列方式,其中orn+代表l-鸟氨酸阳离子,urea代表尿素。
[0075]
图2为实施例3~6中电渗析设备的膜堆排列方式,其中orn+代表l-鸟氨酸阳离子,urea代表尿素。
[0076]
图3为实施例2中l-鸟氨酸盐酸盐的xrd图谱。
[0077]
图4为实施例4中l-鸟氨酸-l-门冬氨酸盐的xrd图谱。
[0078]
图5为实施例5中l-鸟氨酸-l-门冬氨酸盐的xrd图谱。
[0079]
图6为实施例4~5中l-鸟氨酸-l-门冬氨酸盐的sem图。
[0080]
图7为实施例2的高效液相色谱图。
[0081]
图8为实施例5的高效液相色谱图。
具体实施方式
[0082]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0083]
实施例1 l-鸟氨酸盐酸盐的制备
[0084]
(1)在反应釜中加入2000l反渗透水,投入70kg精氨酸,配成0.2mol/l的底物溶液,加入盐酸调节ph值8.0,向精氨酸底物溶液中加入1.4kg精氨酸酶,反应釜升温至38℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应;转化液经酶过滤器过滤精氨酸酶,过滤精氨酸酶后的转化液继
续加入盐酸调节ph值5.0,所得溶液即为0.2mol/l的l-鸟氨酸盐酸盐与0.2mol/l的尿素的混合溶液,加入0.35kg活性炭脱色30min,板框过滤至滤液清亮。
[0085]
(2)安装如图1所示的均相膜电渗析装置,膜堆排列方式为:阳电极-阳极室-阳极膜-[浓室-阴离子交换膜-淡化室-阳离子交换膜]
100-浓室-阴极膜-阴极室-阴电极,其中100为重复单元数。阴、阳电极为耐腐蚀的ti、pt和ir的合金材料,膜与膜间的隔室垫有对应流道的格网及密封垫,所有浓室或淡化室通过相同的流道串联起来。将膜堆安装到电渗析设备中,将阳极极板连接正极电源,阴极极板连接负极电源,将各隔室及循环泵连接起来,启动循环泵10min排除气泡后,设置流速200l/h,检查膜堆无渗漏即膜堆安装完成。
[0086]
(3)将步骤(1)中的滤液加入到淡化室中,将100l的反渗透水加入浓室中,将浓度为1%的氢氧化钠溶液和硫酸1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室之间循环流动起来,循环流动10min排除气泡后,调整各隔室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流上限设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸盐酸盐的体积含量降至0.1%以下,浓室体积为400l,l-鸟氨酸盐酸盐浓度达到1mol/l,尿素的体积含量低于0.3%,尿素分离率达到95%。
[0087]
效果数据1:淡化室的尿素溶液中l-鸟氨酸盐酸盐的体积含量降至0.1%以下;浓室的l-鸟氨酸盐酸盐浓度达到1mol/l,尿素的体积含量低于0.3%;尿素分离率达到95%。
[0088]
(4)将淡化室的尿素溶液和浓室的l-鸟氨酸盐酸盐溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸盐酸盐溶液在0.08mpa以上的真空下浓缩至84.48kg(大量晶体析出,水分占20%)。将结晶混合物降温至0℃,离心甩料,烘干即得l-鸟氨酸盐酸盐成品45.5kg;将甩料之后的母液再收集,加入0.35kg活性炭脱色30min,板框过滤至滤液清亮,滤液在0.08mpa以上的真空下浓缩至30kg(大量晶体析出,水分占30%)。将结晶混合物降温至0℃,离心甩料,烘干即得第二批l-鸟氨酸盐酸盐17.86kg,合并两次产品,产品总收率为94.29%。
[0089]
效果数据2:l-鸟氨酸盐酸盐的总收率为94.29%。
[0090]
实施例2 l-鸟氨酸盐酸盐的制备
[0091]
采用与实施例1相同的膜堆排列方式,如图1所示。
[0092]
(1)在反应釜中加入1000l的反渗透水,投入435kg精氨酸,配成2.5mol/l的底物溶液,加入盐酸调节ph值9.7,向精氨酸底物溶液中加入43.5kg精氨酸酶,反应釜升温至48℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应;转化液经酶过滤器过滤精氨酸酶,过滤精氨酸酶后的转化液继续加入盐酸调节ph5.5,所得溶液即为2.5mol/l的l-鸟氨酸盐酸盐与2.5mol/l的尿素混合溶液,加入2.2kg活性炭脱色30min,板框过滤至滤液清亮。
[0093]
(2)将步骤(1)中的滤液加入到电渗析膜堆淡化室中,将100l的反渗透水加入浓室中,将浓度为2%的氢氧化钾溶液和盐酸溶液1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室之间循环流动起来,循环流动10min排除气泡后,调整各隔
室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸盐酸盐的体积含量降至0.1%以下,浓室体积为833.3l,l-鸟氨酸盐酸盐的浓度达到3mol/l,尿素的体积含量低于0.846%,尿素分离率达到95.3%。
[0094]
效果数据1:淡化室的尿素溶液中l-鸟氨酸盐酸盐的体积含量降至0.1%以下;浓室的l-鸟氨酸盐酸盐的浓度达到3mol/l,尿素的体积含量低于0.846%;尿素分离率达到95.3%。
[0095]
(3)将淡化室的尿素溶液与浓室的l-鸟氨酸盐酸盐溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸盐酸盐溶液在0.08mpa以上的真空下浓缩至600kg(晶体大量析出,水分占30%),将结晶混合物降温至0℃,离心甩料,烘干得到l-鸟氨酸盐酸盐成品243.6kg;将甩料之后的母液再收集,加入2.2kg活性炭脱色30min,板框过滤至滤液清亮,滤液在0.08mpa以上的真空下浓缩至252kg(晶体大量析出,水分占30%),将结晶混合物降温至0℃,离心甩料,烘干得到第二批l-鸟氨酸盐酸盐成品155.4kg,收率95%。
[0096]
效果数据2:l-鸟氨酸盐酸盐的总收率为95%。
[0097]
实施例3 l-鸟氨酸醋酸盐的制备
[0098]
(1)在反应釜中加入1000l反渗透水,投入261kg精氨酸,配成1.5mol/l的底物溶液,加入醋酸调节ph值8.0,向精氨酸底物溶液中加入10.44kg精氨酸酶,反应釜升温至38℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应;转化液经酶过滤器过滤精氨酸酶,过滤精氨酸酶后的转化液继续加入醋酸调节ph6.5,所得溶液即为1.5mol/l的l-鸟氨酸醋酸盐与1.5mol/l的尿素的混合溶液,加入2kg活性炭脱色30min,板框过滤至滤液清亮。
[0099]
(2)安装如图2所示的均相膜电渗析装置,膜堆排列方式为:阳电极-阳极室-阳极膜-[浓室-阴离子交换膜-淡化室-阳离子交换膜]
100-浓室-阴离子交换膜-淡化室-阴极膜-阴极室-阴电极,其中100为重复单元数。阴、阳电极为耐腐蚀的ti、pt和ir材料,膜与膜间的隔室垫有对应流道的格网及密封垫,所有浓室或淡化室通过相同的流道串联起来。将膜堆安装到电渗析设备,将阳极极板连接正极电源,阴极极板连接负极电源,将各隔室及循环泵连接起来,储备桶内装入一定量的反渗透水,启动循环泵10min排除气泡后,设置流速200l/h,检查膜堆无渗漏即膜堆安装完成。
[0100]
(3)将步骤(1)中的滤液加入到淡化室中,将100l的反渗透水加入浓室中,将浓度为3%的硫酸1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室之间循环流动起来,循环流动10min排除气泡后,调整各隔室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸醋酸盐的体积含量降至0.1%以下,浓室体积为882l,l-鸟氨酸盐酸盐浓度达到1.7mol/l,尿素的体积含量低于0.9%,尿素分离率达到
91.18%。
[0101]
效果数据1:淡化室的尿素溶液中l-鸟氨酸醋酸盐的体积含量降至0.1%以下;浓室的l-鸟氨酸盐酸盐浓度达到1.7mol/l,尿素的体积含量低于0.9%;尿素分离率达到91.18%。
[0102]
(4)将淡化室的尿素溶液和浓室的l-鸟氨酸醋酸盐溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸醋酸盐溶液在0.08mpa以上的真空下浓缩至480.53kg(大量晶体析出,水分占40%)。将结晶混合物降温至0℃,离心甩料,烘干即得l-鸟氨酸醋酸盐成品143.55kg;将甩料之后的母液再收集,加入2kg活性炭脱色30min,板框过滤至滤液清亮,滤液在0.08mpa以上的真空下浓缩至155kg(大量晶体析出,水分占30%)。将结晶混合物降温至0℃,离心甩料,烘干即得第二批l-鸟氨酸醋酸盐82.2kg,合并两次产品,产品总收率为90.1%。
[0103]
效果数据2:l-鸟氨酸醋酸盐的总收率为90.1%。
[0104]
实施例4 l-鸟氨酸-l-门冬氨酸盐的制备(正流加结晶法)
[0105]
采用与实施例3相同的膜堆排列方式,如图2所示。
[0106]
(1)在反应釜中加入1000l的反渗透水,投入261kg精氨酸,配成1.5mol/l的底物溶液,加入l-门冬氨酸调节ph值8.7,向精氨酸底物溶液中加入26.1kg精氨酸酶,反应釜升温至30℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应,转化液经酶过滤器过滤酶,过滤酶后的转化液继续加入l-门冬氨酸调节ph值6.0,所得溶液即为1.5mol/l的l-鸟氨酸-l-门冬氨酸盐与1.5mol/l的尿素混合溶液,加入2.61kg活性炭脱色30min,板框过滤至滤液清亮。
[0107]
(2)将步骤(1)中的滤液加入到淡化室中,将200l的反渗透水加入浓室中,将浓度为2%的硫酸溶液1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室和储存桶之间循环流动起来,循环流动10min排除气泡后,调整各隔室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸-l-门冬氨酸盐的体积含量降至0.1%以下,浓室体积为1363.6l,l-鸟氨酸-l-门冬氨酸盐的浓度达到1.1mol/l,尿素的体积含量低于0.42%,尿素分离率达到93.64%。
[0108]
效果数据1:淡化室的尿素溶液中l-鸟氨酸-l-门冬氨酸盐的体积含量降至0.1%以下;浓室的l-鸟氨酸-l-门冬氨酸盐的浓度达到1.1mol/l,尿素的体积含量低于0.42%;尿素分离率达到93.64%。
[0109]
(3)将淡化室的尿素溶液和浓室的l-鸟氨酸l-门冬氨酸盐溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸l-门冬氨酸溶液在0.08mpa以上的真空下浓缩至450l,浓度为3.33mol/l。将2349kg乙醇(精氨酸:乙醇=9:1)以50l/min的速度流加入浓缩液中,随着乙醇的加入,溶液中产生油相,油相在一段时间后在容器壁上转变为固相,产生结块现象,将结块的固体收集,离心甩料,烘干得到l-鸟氨酸-l-门冬氨酸盐350.595kg,收率为88.2%。
[0110]
效果数据2:l-鸟氨酸-l-门冬氨酸盐的总收率为88.2%。
[0111]
实施例5 l-鸟氨酸-l-门冬氨酸盐的制备(改进的反流加结晶法)
[0112]
采用与实施例3相同的膜堆排列方式,如图2所示。
[0113]
(1)在反应釜中加入1000l的反渗透水,投入261kg精氨酸,配成1.5mol/l的底物溶液,加入l-门冬氨酸调节ph值8.7,向精氨酸底物溶液中加入26.1kg精氨酸酶,反应釜升温至30℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应,转化液经酶过滤器过滤酶,过滤酶后的转化液继续加入l-门冬氨酸调节ph6.0,所得溶液即为1.5mol/l的l-鸟氨酸-l-门冬氨酸盐与1.5mol/l的尿素混合溶液,加入2.61kg活性炭脱色30min,板框过滤至滤液清亮。
[0114]
(2)将步骤(1)中的滤液加入到淡化室中,将200l的反渗透水加入浓室中,将浓度为2%的硫酸溶液1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室和储存桶之间循环流动起来,循环流动10min排除气泡后,调整各隔室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸-l-门冬氨酸盐的体积含量降至0.1%以下,浓室体积为1363.6l,l-鸟氨酸-l-门冬氨酸盐的浓度达到1.1mol/l,尿素的体积含量低于0.42%,尿素分离率达到93.64%。
[0115]
效果数据1:淡化室的尿素溶液中l-鸟氨酸-l-门冬氨酸盐的体积含量降至0.1%以下;浓室的l-鸟氨酸-l-门冬氨酸盐的浓度达到1.1mol/l,尿素的体积含量低于0.42%;尿素分离率达到93.64%。
[0116]
(3)将淡化室的尿素溶液和浓室的l-鸟氨酸l-门冬氨酸盐溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸l-门冬氨酸溶液在0.08mpa以上的真空下浓缩至450l,浓度为3.33mol/l。在结晶罐内加入2349kg乙醇(精氨酸:乙醇=9:1),添加乙醇质量1%的l-鸟氨酸l-门冬氨酸晶种23.49kg,开启搅拌,升温至40℃,将l-鸟氨酸l-门冬氨酸浓缩液流加至含有晶种的乙醇中,流加速度为50l/min,全部流加完毕,降温至常温,离心甩料,烘干即得到l-鸟氨酸l-门冬氨酸成品373.65kg,收率94%。
[0117]
效果数据2:l-鸟氨酸l-门冬氨酸的总收率为94%。
[0118]
实施例6 l-鸟氨酸-α-酮戊二酸盐(1:1)的制备(改进的反流加结晶法)
[0119]
采用与实施例3相同的膜堆排列方式,如图2所示。
[0120]
(1)在反应釜中加入1000l的反渗透水,投入261kg精氨酸,配成1.5mol/l的底物溶液,加入α-酮戊二酸调节ph值8.7,向精氨酸底物溶液中加入26.1kg精氨酸酶,反应釜升温至35℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应,转化液经酶过滤器过滤酶,过滤酶后的转化液继续加入α-酮戊二酸调节ph6.0,所得溶液即为1.5mol/l的l-鸟氨酸-α-酮戊二酸盐(1:1)与1.5mol/l的尿素混合溶液,加入2.61kg活性炭脱色30min,板框过滤至滤液清亮。
[0121]
(2)将步骤(1)中的滤液加入到淡化室中,将200l的反渗透水加入浓室中,将浓度
为2%的硫酸溶液1000l分别加入到阴、阳极室中,启动各对应的循环泵,使各料液在对应的隔室和储存桶之间循环流动起来,循环流动10min排除气泡后,调整各隔室流速,使隔室压力相当;待隔室液体在电渗析膜堆内循环流动10min后,启动膜堆电源,设置膜堆电压为220v,电流设置为200a。实验过程中监控淡化室液面及电导率,若淡化室液面下降,则补充100l的反渗透水使液面与实验开始持平;若淡化室电导率降至0.1ms/cm以下,且电流降低至0.2a以下时实验停止。此时,淡化室的尿素溶液中l-鸟氨酸-α-酮戊二酸盐(1:1)的体积含量降至0.1%以下,浓室体积为1666.7l,l-鸟氨酸-α-酮戊二酸盐(1:1)的浓度达到0.9mol/l,尿素的体积含量低于0.45%,尿素分离率达到91.67%。
[0122]
效果数据1:淡化室的尿素溶液中l-鸟氨酸-α-酮戊二酸盐(1:1)的体积含量降至0.1%以下;浓室的l-鸟氨酸-α-酮戊二酸盐(1:1)的浓度达到0.9mol/l,尿素的体积含量低于0.45%;尿素分离率达到91.67%。
[0123]
(3)将淡化室的尿素溶液和浓室的l-鸟氨酸-α-酮戊二酸盐(1:1)溶液放出,淡化室的尿素溶液减压浓缩后得到尿素肥料,浓室的l-鸟氨酸-α-酮戊二酸盐(1:1)溶液在0.08mpa以上的真空下浓缩至600l,浓度为2.5mol/l。在结晶罐内加入1044kg乙醇(精氨酸:乙醇=4:1),添加乙醇质量4%的l-鸟氨酸-α-酮戊二酸盐(1:1)晶种41.76kg,开启搅拌,升温至60℃,将l-鸟氨酸-α-酮戊二酸盐(1:1)浓缩液流加至含有晶种的乙醇中,流加速度为50l/min,全部流加完毕,降温至常温,离心甩料,烘干即得到l-鸟氨酸-α-酮戊二酸盐(1:1)成品378.16kg,收率90.6%。
[0124]
效果数据2:l-鸟氨酸-α-酮戊二酸盐(1:1)的收率90.6%。
[0125]
对比例1 l-鸟氨酸盐酸盐的制备(非电渗析装置法分离尿素)
[0126]
(1)在反应釜中加入2000l反渗透水,投入70kg精氨酸,配成0.2mol/l的底物溶液,加入盐酸调节ph值8.0,向精氨酸底物溶液中加入1.4kg精氨酸酶,反应釜升温至38℃开始酶解转化,反应4h后取样,利用薄板层析法(其中薄板层析法所用的展层剂配比为,正丁醇:丙酮:浓氨水:水=10:10:5:2)检测剩余的精氨酸,当剩余的精氨酸与投料量中精氨酸质量比小于0.2%时,停止反应;转化液经酶过滤器过滤精氨酸酶,过滤精氨酸酶后的转化液继续加入盐酸调节ph值5.0,所得溶液即为0.2mol/l的l-鸟氨酸盐酸盐与0.2mol/l的尿素的混合溶液,加入0.35kg活性炭脱色30min,板框过滤至滤液清亮。
[0127]
(2)将滤液在0.08mpa以上的真空下浓缩至110l,加入70kg的乙醇,搅拌均匀,降温至0℃,离心甩料,用70kg的乙醇洗涤尿素两次并甩干,烘干即得l-鸟氨酸盐酸盐成品42kg,将甩料之后的母液及洗涤液270l收集,加入0.35kg活性炭脱色30min,板框过滤至滤液清亮,滤液在0.08mpa以上的真空下浓缩至44l,加入28kg的乙醇,搅拌均匀,降温至0℃,离心甩料,用28kg的乙醇洗涤尿素两次并甩干,烘干即得第二批l-鸟氨酸盐酸盐成品15.6kg,合并两次产品,产品总收率为85.7%。
[0128]
效果实施例
[0129]
(1)核磁测定:采用(bruker-avanceiii-400)对实施例1~2的l-鸟氨酸盐酸盐进行测定,核磁数据如下:
[0130]
1hnmr(dmso)12.39(1h,s),8.76(2h,s),8.31(3h,s),3.40(1h,m),3.31(2h,m),2.01(2h,m),1.85(1h,m),1.76(1h,m)。
[0131]
对实施例4~5的l-鸟氨酸-l-门冬氨酸盐进行测定,核磁数据如下:
[0132]
nmr(400mhz,dmso)8.76(2h,s),8.31(3h,s),4.66(1h,m),3.56(1h,t),3.39(1h,m),3.31(1h,t),2.63(2h,m),1.82(2h,m),1.53(2h,m),1.5(2h,m)。
[0133]
对实施例3的l-鸟氨酸醋酸盐进行测定,核磁数据如下:
[0134]
1hnmr(dmso)12.39(1h,s),11.0(1h,s),3.40(1h,m),2.63(2h,m),2.10(3h,s),1.76(2h,m),1.53(2h,m),1.50(2h,t)。
[0135]
对实施例6的l-鸟氨酸-α-酮戊二酸盐(1:1)进行测定,核磁数据如下:
[0136]
1hnmr(dmso)12.56(1h,s),12.39(1h,s),12.18(1h,s),8.76(2h,s)3.79(2h,t),3.4(1h,m),2.63-2.65(4h,m),1.76(2h,m),1.50-1.53(4h,m)。
[0137]
(2)高效液相色谱测定:参照中国药典2015年版高效液相色谱法(通则0512),用氨基键合硅胶填充剂;以0.02mol/l磷酸二氢钾缓冲液(取磷酸二氢钾2.72g,加水500ml溶解,加入浓氨溶液5ml,用水稀释至1000ml,混匀后用磷酸调ph至5.60
±
0.05)-乙腈(40:60)为流动相;检测波长为205nm;流速为每分钟1.3ml;柱温为30℃。采用高效液相色谱仪(型号:thermo u3000)对实施例2的l-鸟氨酸盐酸盐进行检测以及实施例5的l-鸟氨酸-l-门冬氨酸盐。实施例2的高效液相色谱图如图7所示,数据分析如下表1和表2所示:
[0138]
表1
[0139]
样品内酰胺%未知%arg%总杂%实施例20.0050.0740.0040.083
[0140]
表2
[0141][0142]
如以上色谱图数据所示,本发明制备的l-鸟氨酸盐纯度较高,相关杂质低,总杂仅为0.083%。
[0143]
实施例5的l-鸟氨酸-l-门冬氨酸盐的高效液相色谱图如图8所示,数据分析如下表3和表4所示:
[0144]
表3
[0145]
样品杂质i%未知%fum%arg%总杂%主峰面积比实施例50.0170.0030.0010.0470.0952.90
[0146]
表4
[0147][0148]
如以上色谱图数据所示,本发明制备的l-鸟氨酸-l-门冬氨酸盐纯度较高,相关杂质低,总杂仅为0.095。
[0149]
(3)晶形xrd测定:采用x射线衍射仪(型号:xpert pro)对实施例2制备的l-鸟氨酸盐酸盐以及实施例4和实施例5制备的l-鸟氨酸-l-门冬氨酸盐进行xrd晶形测定。实施例2中l-鸟氨酸盐酸盐的xrd图谱如图3所示,特征衍射角(2θ)、晶面间距(d值)和强度(%)的数据分析如下表5所示:
[0150]
表5
[0151]
2θ角实测值d实测值强度(%)8.9019.9267100.017.8324.970027.221.0224.222458.223.9703.709510.126.8963.312117.328.6373.11466.629.1653.059470.736.1272.48426.837.9032.37189.838.4612.33867.5
[0152]
如以上xrd检测数据所示,本发明制备的l-鸟氨酸盐酸盐与报道的l-鸟氨酸盐酸盐数据一致。
[0153]
实施例4制备的l-鸟氨酸-l-门冬氨酸盐的xrd图谱如图4所示,特征衍射角(2θ)、晶面间距(d值)和强度(%)的数据分析如下表6所示:
[0154]
表6
[0155]
[0156][0157]
如以上xrd检测数据所示,本发明中实施例4制备的l-鸟氨酸-l-门冬氨酸盐为含水物。
[0158]
实施例5制备的l-鸟氨酸-l-门冬氨酸盐的xrd图谱如图5所示,特征衍射角(2θ)、晶面间距(d值)和强度(%)的数据分析如下表7所示:
[0159]
表7
[0160]
2θ角实测值d实测值强度(%)7.26312.161413.58.2410.720733.119.3214.590217.719.8444.470523.721.7644.080270.622.4743.952910024.0753.693560.224.5733.619713.427.1483.28219.127.5652.233215.528.8773.089312.431.3492.851140.336.182.480720.837.8092.377515.238.1222.358612.339.232.294623.541.0912.194910.4
[0161]
如以上xrd检测数据所示,本发明中实施例5制备的l-鸟氨酸-l-门冬氨酸盐为无水物。
[0162]
(4)晶形sem测定:采用扫描式电子显微镜(型号:quanta)对实施例4~5的产品晶体进行sem测定,如图6所示,使用传统的正流加方法结晶得到的产品为片状晶型,晶型不均一、不规则(实施例4),使用本发明中添加晶种的结晶方法所得到的产品(实施例5)为针柱状晶型,晶型均一、规则。
[0163]
(5)水分测定:参照中国药典2015年版第四部附录的0831干燥失重测定法,取本品1g,在120℃下恒温干燥至恒重,减失重量不超过3.0%的为无水物。
[0164]
对实施例4~5的产品进行水分测定,结果如下:
[0165]
编号水分%实施例46.88实施例51.07
[0166]
由以上检测数据可知,采用本发明添加晶种反向流加的结晶方法制备的l-鸟氨酸-l-门冬氨酸盐产品水分含量更低。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:苏海霞;熊宗华;朱程军;杨磊;鲁凡;邢盼盼;皮莉;舒敏;黄佳琪;梅雪臣;何嘉俊;郭丽平;王炯;李敬;左江;黄治华
- 技术所有人:武汉远大弘元股份有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....