具有溶藻活性的假单胞菌及其应用的制作方法
本发明属于微生物控藻领域,具体涉及一种具有溶藻活性的假单胞菌及其在控制蓝藻水华中的应用。
背景技术:
近二十年来,我国淡水水体蓝藻水华整体呈现高生物量、大范围、高频次、高危害的特征。形成水华的蓝藻种类主要有微囊藻(microcystis)、长孢藻(dolichospermum)、束丝藻(aphanizomenon)、浮丝藻(planktothrix)、节球藻(nodularia)、颤藻(oscillatoria)等,微囊藻水华是我国最主要的水华类型,长孢藻水华和束丝藻水华次之。
蓝藻水华的肆意暴发直接或间接地影响人类健康,并引起水体生态系统结构和功能的失衡,俨然已成为我国当前乃至今后长时期内面临和亟待解决的重大水环境问题。研究和发展控藻抑藻关键技术,促进湖泊向健康稳定方向发展具有重要的理论和现实意义。与常规物理法、化学法控藻技术相比,基于现代生态环保理念的微生物控藻技术具有具有经济、特异、安全、维持水体生态平衡的优势,是一种利用细菌、放线菌、真菌、原生动物及病毒等生物控制藻华以解决水环境问题的生态修复技术。合理利用微生物法控制水华蓝藻,对改善水质、缓解水华危害有着十分重要的意义。
纵观国内外的研究,微生物控藻法中报道最多的是利用溶藻细菌控制蓝藻水华。但鉴于其实际溶藻效果易受水体生态系统中各种生物因子、非生物因子影响,且有些微生物的生态安全性有待进一步的科学论证,目前对于溶藻细菌的研究主要集中于分离鉴定、溶藻现象的描述及其溶藻方式、机理方面,对其野外应用方法的研究尚处于初级阶段,少有关于其成功应用的案例。因此,筛选出具有高效溶藻效能的溶藻细菌并初步尝试其实际应用的方法,对水体水华的治理有着十分重要的意义。
技术实现要素:
本发明的目的在于提供一种具有溶藻活性的假单胞菌,该菌株具有较高的溶藻效率,将其制成菌体包埋小球用于控制蓝藻水华也具有较好的效果,使用寿命较长,可反复使用,安全环保。
为了实现上述目的,本发明采用以下技术方案:
发明人从发生蓝藻水华的太湖采集水样,经分离纯化培养及溶藻效率筛选,得到一株溶藻细菌thw7,为g-菌,短杆状或略弯,长约1.0-8.0μm,宽约0.3-1.0μm。在lb固体平板上形成的菌落呈中央略微凸起的圆球状,乳白色,质地较疏松,易被接种环挑起,表面光滑、不透明、较湿润,边缘整齐。通过16srdna测序和形态学鉴定,该菌株属于假单胞菌属(pseudomonas),命名为假单胞菌(pseudomonassp.)thw7,已于2019年12月18日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m20191065。
假单胞菌(pseudomonassp.)thw7在控制蓝藻水华中的应用,其方法如下:
(1)收集假单胞菌菌体,洗涤后用无菌水重悬;
(2)将假单胞菌重悬液加入3%-4%的海藻酸钠溶液中,搅拌混匀后将混合液逐滴加入3.5%-4.5%的氯化钙溶液,交联反应后获得包埋小球,表面光滑,直径4-6mm;
(3)将假单胞菌菌体包埋小球后投入蓝藻水华水体中,并在水体中添加1.0-1.2g/l葡萄糖。
与现有技术相比,本发明具有以下优点及有益效果:
针对利用溶藻细菌实际控藻中培养耗费大且实际应用时对水体生态系统造成的额外营养负荷问题,本发明利用廉价易获得的海藻酸钠和氯化钙交联将菌体包埋,再辅加一定浓度的葡萄糖作为能源补充,投入藻液中进行溶藻实验,不仅对单细胞的铜绿微囊藻具有非常明显的溶藻效果,而且也能够使蓝藻水华显著下沉,是一种有效治理蓝藻水华的方法,提供了治理蓝藻水华的新思路。这种包埋小球收放自如,使用寿命较长,可反复使用,一方面简化了控藻操作流程,降低菌种培养耗费等成本,另一方面减少溶藻过程本身给水体带来的额外营养负荷,相对环保。
附图说明
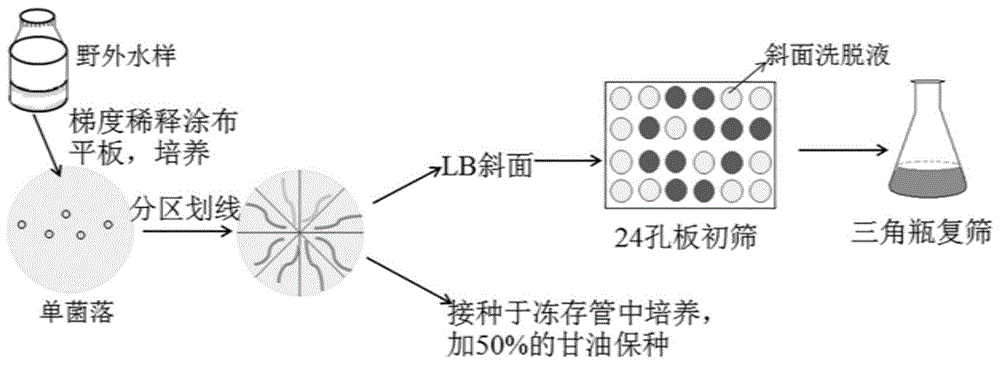
图1为溶藻细菌的分离纯化流程图。
图2为菌株thw7在lb固体平板上的菌落照片。
图3为菌株thw7的透射电镜照片。
图4为菌株thw7的16srdna序列通过blast比对,相关序列于bioedit7.0.9.1进行序列比对分析,最后用mega6.0、采用邻接法(neighbor-joining,重复度f1000)构建的系统发育树。
图5为菌株thw7的生长曲线。
图6为thw7菌体的包埋小球照片。
图7为单细胞铜绿微囊藻中投加thw7菌体的包埋小球后,第10d三角瓶中藻液的照片。
图8为thw7菌体的包埋小球对单细胞铜绿微囊藻的溶藻效率柱状统计图。
图9为野外群体藻样中投加thw7菌体的包埋小球后,藻液叶绿素a浓度变化的柱状图。
图10为野外群体藻样中投加thw7菌体的包埋小球后,三角瓶中藻液在7d时的照片。
图11为野外群体藻样中投加thw7菌体的包埋小球后,三角瓶中藻液在20d时的照片。
具体实施方式
以下结合附图对本发明的具体实施方法进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。本发明所述技术方案,如未特别说明,均为本领域的常规方案。所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1:假单胞菌(pseudomonassp.)thw7的分离纯化及培养
1.假单胞菌thw7的分离纯化与保藏
溶藻细菌的分离纯化流程如图1所示。从太湖采集蓝藻水华水样,经0.8μm的滤膜(millipore)过滤,上清用无菌水进行10倍梯度稀释(稀释级别视具体情况而定),取100μl各梯度的稀释液均匀涂布于lb固体平板,每个梯度三个平行,写上对应编号,于生化培养箱中30℃倒置培养48h。选取菌落分布较为均匀的平板,挑取不同形态的单菌落在lb固体平板分区划线分离纯化两次,得到纯培养的菌株,用甘油保藏法保存在-80℃冰箱。
挑取单克隆接种于lb固体斜面,待细菌菌落长出,用无菌水冲刷,吹打均匀制成菌苔洗脱液。以10%的体积比添加菌苔洗脱液到铜绿微囊藻(microcystisaeruginosapcc7806)藻液中,空白对照组藻液中加入等体积的无菌水,于24孔板中进行共培养。置于光照培养箱中,培养温度为25℃、光强为25μe、光暗周期比为12h∶12h。5d后观察,若藻液黄化则该菌为溶藻菌。
根据初筛结果,挑取溶藻菌的单克隆接种于lb液体培养基,于控温摇床中30℃、140rpm培养48h,以10%的体积比将细菌培养物添加到铜绿微囊藻(microcystisaeruginosapcc7806)藻液中,以加入等体积的无菌水作为空白对照组,于100ml三角瓶中进行共培养。置于光照培养箱中,培养条件同上,6d后测定其叶绿素a的含量,计算溶藻效率。溶藻效率的计算公式如下:
溶藻效率(%)=[(c0-c)/c0]×100%
公式中c0为处理组初始的叶绿素a浓度,c为处理组测定时的叶绿素a浓度。
通过以上方法,筛选出一株溶藻效率较高的菌株,该菌株在第6天的溶藻效率为84.61%,编号thw7。菌株thw7在lb固体平板上的菌落形态如图2所示。菌株thw7在lb固体平板上形成的菌落呈中央略微凸起的圆球状,乳白色,质地较疏松,易被接种环挑起,表面光滑、不透明、较湿润,边缘整齐。菌株thw7的透射电镜照片如图3所示,呈短杆状或略弯,长约1.0-8.0μm,宽约0.3-1.0μm。
设计引物扩增其16srrna基因进行测序,然后进行blast比对,采用邻接法(neighbor-joining,重复度f1000)构建系统发育树如图4所示,菌株thw7与蒂氏假单胞菌pseudomonasteessideatypestrainpr65t(am419154.2)的亲缘关系最近,16srdna基因相似性为99.79%。从系统发育树可以看出,pseudomonas属为独立分支,分子生物学鉴定菌株thw7属于假单胞菌(pseudomonas)。
该菌株保藏于-80℃甘油中,命名为假单胞菌thw7,拉丁学名为pseudomonassp.thw7(以下简称菌株thw7),已于2019年12月18日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m20191065。
2.假单胞菌thw7的培养
挑取单克隆于新鲜无菌lb培养基(表1)中扩大培养。扩大培养后的菌液再接种到新鲜lb液体培养基中,控制其初始od600nm为0.088,在30℃,140rpm条件下培养,定时取样,用分光光度计测定其od600nm。绘制的生长曲线如图5所示,菌株thw7的生长分为三个阶段,分别为停滞期(0-1h),对数期(1-24h),稳定期(24-34h)。34h之后,菌株thw7进入衰亡期。
表1lb培养基成分
实施例2:假单胞菌thw7在控制蓝藻水华中的应用
取对数期(20h,od600nm=1.8)的菌液室温离心(5000rpm,6min),收集菌体,用无菌水清洗2-3次以洗去菌体表面的lb培养基。所获菌体加入无菌水(体积尽可能小)重悬,制得菌体重悬液备用。
将菌体重悬液加入到灭菌后的质量浓度为3%的海藻酸钠溶液中,用洁净玻璃棒搅拌混匀后用注射器将该混合液逐滴打入质量浓度为4%的氯化钙溶液中,交联30min。无菌水清洗包埋小球3-5次洗去表面的氯化钙溶液,制得直径约为4-6mm的菌体包埋小球备用,如图6所示。
将对数生长期的铜绿微囊藻(microcystisaeruginosapcc7806)藻液分装于250ml三角瓶中,每瓶150ml,共9瓶,3瓶为一组,分别为空白对照组、葡萄糖组、菌体包埋小球组。取浓度为30g/l的葡萄糖溶液加入到葡萄糖组和菌体包埋小球组的藻液中,使其终浓度为1g/l,将菌体包埋小球投至对应实验组的藻液中,置于光照培养箱中培养,培养条件同上。10d后测定其叶绿素a的含量,计算溶藻效率。第10d三角瓶中藻液的照片如图7所示,葡萄糖对藻无影响,葡萄糖组同空白对照组的藻生长状况良好,藻液浓度升高并且颜色保持绿色,而菌体包埋小球组藻生长受到严重抑制,藻液浓度降低,颜色泛白,藻细胞大量死亡。实验中所用的葡萄糖对藻生长无影响且满足了菌体生长所需能源的需求,同时,比起蛋白胨、酵母粉或牛肉膏等富营养的菌体培养液成分,葡萄糖相对寡营养,是一种相对简单且环境友好型添加物。
一轮溶藻实验结束后,收获菌体包埋小球,用无菌水清洗小球表面4-5次,留待下一轮溶藻实验,实验步骤同上。重复此过程至菌体包埋小球无溶藻活性或溶藻效率不佳时为止。分析菌体包埋小球每次溶藻效能的变化及使用寿命。一共做了六次溶藻实验,每次的溶藻效率柱状统计图如图8所示。前四次溶藻效果呈现一个略微上升的趋势,但无显著性差异,溶藻效率在45%-65%之间,其中第四次溶藻效率为62.85%。第五次、第六次溶藻效率和第四次相比均有不同程度的下降,但仅第六次时的降低具有显著性,溶藻效率降至37.32%。由此看来,菌体被包埋成这种小球后,可反复收获用于溶藻,利用1-5次效果最佳,第6次开始溶藻效率显著性降低,以第一次溶藻实验开始至第五次实验结束的这段时间作为包埋小球的使用寿命,为68天。
采集野外蓝藻水华水样,分装至洁净无菌的1l三角瓶中,每瓶装600ml,共6瓶,3瓶为一组,分别为对照组、处理组。实验初始,向处理组投加菌体包埋量为40ml的thw7菌体包埋小球,7d后观察实验现象,并取样测定叶绿素a浓度。与此同时,补加一定体积的葡萄糖溶液,使其终浓度为1g/l,继续观察实验过程中藻的变化情况,20d时取样测定叶绿素a浓度,分析溶藻效果。图9为向野外群体藻样中投加thw7菌体的包埋小球后,藻液叶绿素a浓度变化的柱状图,图10、图11为向野外群体藻样中投加thw7菌体的包埋小球后,三角瓶中藻液在不同时间点(7d、20d)的照片。实验发现在不添加任何能源的条件下,菌体包埋小球对野外群体藻无溶藻效果,但培养过程中可见部分藻下沉至底部的现象,还有一部分藻贴在三角瓶瓶壁。补给葡萄糖后,处理组藻群体几乎全部沉至底部,漂浮在水表面的群体极少。水体叶绿素a含量开始降低,同第7d相比,20d时处理组叶绿素a浓度降低了31.50%。这表明,该菌体包埋小球在野外水样藻华控制中具有较好的效果,实用性较强,尤其是在使大量群体藻下沉方面效果显著。同时,该菌体包埋小球可收放自如,使用寿命较长,可反复使用,一方面简化了控藻操作流程,降低菌种培养耗费等成本,另一方面减少溶藻过程本身给水体带来的额外营养负荷,相对环保。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!