1.本发明是关于一种活菌菌粉微粒,其包含一菌种、一第一包覆层以及一第二包覆层,其中,第一包覆层位于该菌种的细胞膜及细胞壁之间,且该菌种分散于第二包覆层中。本发明也关于一种制备活菌菌粉微粒的方法,包括:(a)对一菌种进行三阶段的发酵培养,以获得一发酵菌液;(b)将该发酵菌液进行离心浓缩,以获得一浓缩菌液;(c)将该浓缩菌液与保护剂混合,以获得一混合物;以及,(d)将该混合物进行干燥处理,以获得一活菌菌粉微粒。
背景技术:2.随着人们对于益生菌的了解及其对人体健康作用的认识,益生菌的相关产品与日俱增。基于维持益生菌活性的需求,含活菌的产品在保存上有诸多限制,例如:需储存于冷藏或冷冻的温度下、需使用气调包装(modified atmosphere packaging)等。此外,基于运输及保存的便利性,益生菌产品常以菌粉的形式提供。
3.喷雾干燥法及冷冻干燥法乃菌粉制备过程中的常见的冷冻方法,然而,喷雾干燥法因必须在较高的温度下实施,可能导致细菌因高温而死亡;冷冻干燥法则可能温度下降过程中形成冰晶而造成菌体受损,导致菌粉中的活菌含量减少。因此,业界目前仍致力于发展出可以提供高活菌含量的菌粉的制备方法。
4.有鉴于上述技术问题,发明人研究发现一种提供高活菌浓度的菌液的方法、一种制备活菌菌粉微粒的方法以及一种具高活菌含量及低水分残留特性的菌粉微粒。
技术实现要素:5.本发明的一目的,在于提供一种提供高活菌浓度的菌液的方法,包括:
6.(a)对一菌种依序进行以下三阶段的发酵培养以获得一发酵菌液:
7.一第一阶段培养,历时t1小时,
8.一第二阶段培养,历时t2小时,以及
9.一第三阶段培养,历时t3小时,
10.其中:
11.t
1-2≦t1≦t1+2,
12.t
1-2≦t2≦t1+2,
13.t
2-2≦t3≦t2+2,
14.t1、t2及t3皆不小于0.5,
15.t1是该菌种的生长对数期的起始时间点,
16.t2是该菌种的生长稳定期的起始时间点,
17.且其中第二阶段的发酵菌液总体积为第一阶段的发酵菌液总体积的10倍至35倍,第三阶段的发酵菌液总体积为第二阶段的发酵菌液总体积的10倍至35倍;以及,
18.(b)对(a)所提供的发酵菌液进行离心浓缩,以获得一浓缩菌液。
19.本发明的另一目的,在于提供一种制备活菌菌粉微粒的方法,包括:
20.(a)对一菌种依序进行以下三阶段的发酵培养以获得一发酵菌液:
21.一第一阶段培养,历时t1小时,
22.一第二阶段培养,历时t2小时,以及
23.一第三阶段培养,历时t3小时,
24.其中:
25.t
1-2≦t1≦t1+2,
26.t1-2≦t2≦t1+2,
27.t2-2≦t3≦t2+2,
28.t1、t2及t3皆不小于0.5,
29.t1是该菌种的生长对数期的起始时间点,
30.t2是该菌种的生长稳定期的起始时间点,
31.且其中第二阶段的发酵菌液总体积为第一阶段的发酵菌液总体积的10倍至35倍,第三阶段的发酵菌液总体积为第二阶段的发酵菌液总体积的10倍至35倍;
32.(b)对(a)所提供的发酵菌液进行离心浓缩,以获得一浓缩菌液;
33.(c)将该浓缩菌液与保护剂混合,以获得一混合物;以及,
34.(d)对该混合物进行干燥处理,以获得一活菌菌粉微粒。
35.于上述提供高活菌浓度的菌液的方法及制备活菌菌粉的方法中,较佳地,t
1-1≦t1≦t1+1,t
1-1≦t2≦t1+1,且t
2-2≦t3≦t2。
36.本发明的又一目的,在于提供一种活菌菌粉微粒,其是通过如上述的制备方法而提供。
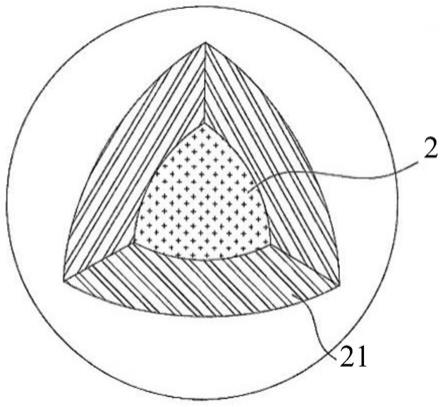
37.本发明的再一目的,在于提供一种活菌菌粉微粒,其包含一菌种、一第一包覆层以及一第二包覆层,其中,第一包覆层位于该菌种的细胞膜及细胞壁之间,且该菌种分散于第二包覆层中。较佳地,该活菌菌粉微粒还包含一第三包覆层,其中该第三包覆层位于第二包覆层外侧。
38.根据本发明所提供的活菌菌粉微粒中,第一包覆层含有以下的至少一个:异麦芽寡糖、乳糖、海藻糖、半乳糖、果糖、葡萄糖、麦芽糖、蔗糖、果寡糖、鼠李糖及棉子糖;第二包覆层含有以下的至少一个:麦芽糊精、脱脂奶粉、菊糖、及淀粉;以及,第三包覆层含有以下的至少一个:麦芽糊精、阿拉伯胶、巧克力及脱脂奶粉。
39.本发明的详细技术内容及部分具体实施方案,将描述于以下内容中,以供本发明所属领域技术人员据以明了本发明的特征。
附图说明
40.图1是本发明活菌菌粉微粒中第一包覆层与菌种的细胞膜及细胞壁的相对位置的示意图;
41.图2是本发明活菌菌粉微粒的一实施方案的示意图;
42.图3是本发明活菌菌粉微粒的另一实施方案的示意图;
43.图4是胚芽乳酸杆菌(lactobacillus plantarum)的生长曲线图;
44.图5是由本发明方法获得的浓缩菌液与冻干保护剂的混合物的扫描式电子显微镜
照片(放大倍率:3000倍)。
45.附图标记说明
46.1:菌种
47.11:细胞膜
48.12:第一包覆层
49.13:细胞壁
50.14:第二包覆层
51.2:菌粉微粒
52.21:第三包覆层。
具体实施方式
53.以下将描述根据本发明的部分具体实施方案;但是,在不背离本发明精神下,本发明还可以多种不同形式的方案来实践,不应将本发明保护范围解释为限于说明书所具体陈述的内容。
54.除非文中有另外说明,于本说明书中(尤其是在权利要求书中)所使用的“一”、“该”及类似用语应理解为包含单数及复数形式;所谓“低聚糖”是指具有二至十个单糖分子的糖类;所谓“多聚糖”是指具有超过十个的单糖分子的糖类;所谓“低水分残留”是指以菌粉微粒的总重量计,其水分残留量小于10重量%;所谓“个体”是指人类或非人的哺乳动物(例如:狗、猫)。
55.本文中所使用的数值范围(例如5至100)应理解为包含在该范围中的所有有理数以及在该范围中的任何有理数所组成的范围,因此,本说明书中所使用的数值范围包含介于所列举的最低值与最高值之间的数值的所有可能组合。另外,当本文于数值前使用“约”时,是指所述数值可以所属技术领域中技术人员认知为一般且合理的大小的量增加或减少,举例言之,当本文于数值前使用“约”时,实质上代表与所述数值相差在10%以内,较佳在5%以内。
56.本文中虽涉及使用“第一包覆层”、“第二包覆层”及“第三包覆层”等用语,但此用语仅用于区隔的目的,所描述的包覆层并不受这些用语限制。
57.已知细菌的生长周期依其生长速率变化可分为迟滞期(lag phase)、对数期(logarithmic phase)、稳定期(stationary phase)及衰退期(decline/death phase)。经发明人研究发现,通过在细菌发酵期间对其生长周期进行控制,可显著缩短细菌扩大发酵的耗时,从而在短时间内提供高活菌浓度的菌液;发明人还发现,将本发明所提供的高活菌浓度的菌液与保护剂混合且进一步浓缩干燥,可获得一具高活菌含量及低水分残留量特性的菌粉微粒。因此,本发明是关于菌粉微粒及其制备方法,包括一种提供高活菌浓度的菌液的方法、一种制备活菌菌粉微粒的方法以及一种活菌菌粉微粒。
58.所谓“生长对数期”是指在微生物生长周期中,微生物数量急速成长的期间,而“生长稳定期”是指微生物数量维持恒定、不再上升的期间。于本发明中,是通过微生物生长曲线图来判断生长对数期的起始时间点(于本文中称为“t
1”)及生长稳定期的起始时间点(于本文中称为“t
2”),其中,当一时间点的切线斜率大于或等于前一小时的切线斜率的三倍时,即判定该时间点为t1;而当一时间点的切线斜率为零时,即判定该时间点为t2。
59.1.提供高活菌浓度的菌液的方法
60.本发明提供一种提供高活菌浓度的菌液的方法,包括:
61.(a)对一菌种依序进行以下三阶段的发酵培养以获得一发酵菌液:
62.一第一阶段培养,历时t1小时,
63.一第二阶段培养,历时t2小时,以及
64.一第三阶段培养,历时t3小时,
65.其中:
66.t
1-2≦t1≦t1+2,
67.t
1-2≦t2≦t1+2,
68.t
2-2≦t3≦t2+2,
69.t1、t2、及t3皆不小于0.5,
70.t1是该菌种的生长对数期的起始时间点,
71.t2是该菌种的生长稳定期的起始时间点,
72.且其中第二阶段的发酵菌液总体积为第一阶段的发酵菌液总体积的10倍至35倍,第三阶段的发酵菌液总体积为第二阶段的发酵菌液总体积的10倍至35倍;以及,
73.(b)对(a)所提供的发酵菌液进行离心浓缩,以获得一浓缩菌液。
74.本发明的提供高活菌浓度的菌液的方法可适用于任何适宜的菌种,例如嗜热链球菌(streptococcus thermophiles)、长双歧杆菌(bifidobacterium longum)、胚芽乳酸杆菌(lactobacillus plantarum)、凝结芽孢杆菌(bacillus coagulans)、干酪乳杆菌(lactobacillus casei)、瑞士乳酸杆菌(lactobacillus helveticus)、加氏乳酸杆菌(lactobacillus gasseri)、乳双歧杆菌(bifidobacterium lactis)、约氏乳杆菌(lactobacillus johnsonii)、乳酸片球菌(pediococcus acidilactici)、发酵乳酸杆菌(lactobacillus fermentum)、鼠李糖乳酸杆菌(lactobacillus rhamnosus)、啤酒酵母菌(saccharomyces cerevisiae)、副干酪乳杆菌(lactobacillus paracasei)、肠膜明串珠菌(leuconostoc mesenteroides)、唾液乳酸杆菌(lactobacillus salivarius)、戴白氏乳酸杆菌(lactobacillus delbrueckii)、及短毛乳酸杆菌(lactobacillus brevis),但不以此为限。于本发明的一具体实施方案中,是通过上述方法提供一高浓度的胚芽乳酸杆菌活菌的菌液。
75.于步骤(a)中,t1介于所欲培养的菌种的生长对数期的起始时间点前后2小时的范围内(即,t
1-2≦t1≦t1+2),t2介于生长对数期的起始时间点前后2小时的范围内(即,t
1-2≦t2≦t1+2),t3则介于生长稳定期的起始时间点前后2小时的范围内(即,t
2-2≦t3≦t2+2),且t1、t2及t3皆不小于0.5;较佳地,t1介于所欲培养的菌种的生长对数期的起始时间点前后1小时的范围内(即,t
1-1≦t1≦t1+1),t2介于生长对数期的起始时间点前后1小时的范围内(即,t
1-1≦t2≦t1+1),t3则介于生长稳定期的起始时间点前2小时至该起始时间点的范围内(即,t
2-2≦t3≦t2),且t1、t2、及t3皆不小于0.5。于本发明的一具体实施方案中,是通过上述方法提供一高浓度的胚芽乳酸杆菌活菌的菌液,其中,经计算胚芽乳酸杆菌的生长曲线的切线斜率之后,判断t1为2、且t2为8,故0.5≦t1≦4,0.5≦t2≦4,且6≦t3≦10。较佳地,于根据本发明的提供高浓度的胚芽乳酸杆菌活菌的菌液的方法中,第一阶段培养历时2至3小时,第二阶段培养历时2至4小时,第三阶段培养历时6至8小时。
76.根据本发明的提供高活菌浓度的菌液的方法中,较佳地,第二阶段的发酵菌液总体积为第一阶段的发酵菌液总体积的10倍至25倍,第三阶段的发酵菌液总体积为第二阶段的发酵菌液总体积的10倍至30倍。
77.于步骤(a)中,可依所欲培养的菌种而调整培养温度及发酵培养基。举例言之,嗜热链球菌、凝结芽孢杆菌及戴白氏乳酸杆菌可于42℃
±
5的温度下进行发酵培养;啤酒酵母菌及肠膜明串珠菌可于30℃
±
5的温度下进行发酵培养;嗜热链球菌、长双歧杆菌、胚芽乳酸杆菌、干酪乳杆菌、瑞士乳酸杆菌、加氏乳酸杆菌、乳双歧杆菌、约氏乳杆菌、乳酸片球菌、发酵乳酸杆菌、鼠李糖乳酸杆菌、副干酪乳杆菌、唾液乳酸杆菌及短毛乳酸杆菌则可于37℃
±
5的温度下进行发酵培养。至于发酵培养基,以胚芽乳酸杆菌为例,可使用纯水作为发酵培养基的基底,在每公升纯水中加入20至40克的酵母浸粉、10至30克的酵母蛋白胨、1至3克的磷酸氢二钾、0.5至1.5克的硫酸镁、0.5至1.5克的聚山梨醇酐脂肪酸酯八十、10至30克的葡萄糖、及10至30克的10n氢氧化钠来提供。
78.于步骤(b)中,可采用任何适宜的离心设备对步骤(a)所提供的发酵菌液进行离心浓缩,并无特别限制,只要能有效减少发酵菌液的总体积且有效保留菌液中的活菌含量即可。较佳地,是使发酵菌液的总体积达到至少10倍浓缩(即,浓缩菌液的总体积不大于发酵菌液的总体积的十分之一)。举例言之,是将500公升的发酵菌液离心浓缩至总体积约为30至50公升的浓缩菌液。
79.2.制备活菌菌粉微粒的方法
80.本发明还提供一种制备活菌菌粉微粒的方法,其包含对上述“1.提供高活菌浓度的菌液的方法”提供的浓缩菌液进行以下处理:
81.(c)将该浓缩菌液与保护剂混合,以获得一混合物;以及
82.(d)对该混合物进行干燥处理,以获得一活菌菌粉微粒。
83.步骤(c)的目的在于,通过添加保护剂以避免浓缩菌液中的活菌含量因为活菌在后续步骤(d)的干燥处理中死亡而减少。因此,步骤(c)所使用的保护剂并无特殊限制,只要可以有效保护浓缩菌液中的活菌不因干燥处理而死亡即可。适用于步骤(c)的保护剂的例子包括异麦芽寡糖、乳糖、海藻糖、半乳糖、果糖、葡萄糖、麦芽糖、蔗糖、果寡糖、鼠李糖、棉子糖、麦芽糊精、脱脂奶粉、菊糖、淀粉、阿拉伯胶、巧克力、脱脂奶粉,但不以此为限。
84.较佳地,步骤(c)中所使用的保护剂包含至少一种对于菌体具有半穿透性(semi-permeable;即,可穿透细菌细胞壁,但不穿透细菌细胞膜)的低聚糖(例如异麦芽寡糖、乳糖、海藻糖、半乳糖、果糖、葡萄糖、麦芽糖、蔗糖、果寡糖、鼠李糖、及棉子糖)以及至少一种多聚糖(例如麦芽糊精、菊糖、及淀粉)或蛋白质(例如脱脂奶粉)。更佳地,步骤(c)中所使用的保护剂还包含至少一种防潮剂(例如麦芽糊精、阿拉伯胶、巧克力及脱脂奶粉)。举例言之,步骤(c)中所使用的保护剂包含乳糖、菊糖、及麦芽糊精,或者,该保护剂包含乳糖、麦芽糊精及脱脂奶粉。
85.于步骤(d)中,可采用任何适宜的干燥方法对步骤(c)提供的混合物进行干燥处理,例如:喷雾干燥及冷冻干燥,但不以此为限。于本发明的一具体实施方案中,是于步骤(d)使用冷冻干燥以对步骤(c)所提供的混合物进行干燥处理,以获得一活菌菌粉微粒。
86.3.活菌菌粉微粒
87.本发明也关于一种活菌菌粉微粒,其可通过本发明方法而提供。如本文的图1及图
2所示,本发明的活菌菌粉微粒2包含一菌种1、一第一包覆层12、以及一第二包覆层14,其中,第一包覆层12位于菌种1的细胞膜11及细胞壁13之间,且菌种1分散于第二包覆层14中。此外,如本文的图2及图3所示,本发明的活菌菌粉微粒还可以包含一第三包覆层21,其中第三包覆层21位于第二包覆层14外侧。
88.较佳地,第一包覆层含有以下的至少一个:异麦芽寡糖、乳糖、海藻糖、半乳糖、果糖、葡萄糖、麦芽糖、蔗糖、果寡糖、鼠李糖及棉子糖。于本发明的一具体实施方案中,第一包覆层含有乳糖。
89.较佳地,第二包覆层含有以下的至少一个:麦芽糊精、脱脂奶粉、菊糖、及淀粉。于本发明的一具体实施方案中,第二包覆层含有麦芽糊精。
90.较佳地,第三包覆层含有以下的至少一个:麦芽糊精、阿拉伯胶、巧克力及脱脂奶粉。更佳地,第三包覆层含有麦芽糊精或脱脂奶粉或其组合。于本发明的一具体实施方案中,第三包覆层含有脱脂奶粉。
91.根据本发明所提供的活菌菌粉微粒的保存条件并无特别限制,可依运输、保存或使用上的需求进行调整。举例言之,可将本发明的活菌菌粉微粒置于一密封包装中,储存于室温(25℃)、冷藏(4℃)或冷冻(-20℃)环境下。
92.现以下列实施例进一步例示说明本发明。其中这些实施例仅提供作为说明,而非用以限制本发明的保护范围。本发明保护范围如权利要求书所示。
93.4.实施例
94.4.1实验方法及材料
95.4.1.1活菌含量检测方法
96.取50克的菌粉(或50毫升的菌液)为样品,加入450毫升的稀释液中并均匀混合,以获得10倍稀释样品(可视需要进行10倍序列稀释,以使稀释样品的浓度降低)。将1毫升的稀释样品涂布于琼脂培养基,然后置于37℃下进行厌氧培养,历时72小时。观察培养基,选取菌落数介于25至250个之间的区域进行菌落数计数,以回推该菌粉(或菌液)样品中的活菌含量(单位:cfu/克、或cfu/毫升)。
97.4.1.2发酵培养条件
98.1.气流:每分钟3公升。
99.2.转速:100rpm。
100.3.溶氧量:不小于40%。
101.4.1.3发酵培养基
102.以纯水为基底,于每公升纯水中加入30克的酵母浸粉、20克的酵母蛋白胨、2克的磷酸氢二钾、1克的硫酸镁、1克的聚山梨醇酐脂肪酸酯八十、20公克的葡萄糖及20克的10n氢氧化钠,均匀混合后,进行灭菌,以提供一发酵培养基;ph 5.5
±
0.1。
103.4.1.4冻干保护剂
104.以6:1:33(乳糖:麦芽糊精:脱脂奶粉)的重量比将乳糖、麦芽糊精及脱脂奶粉均匀混合,以提供一冻干保护剂。
105.4.2制备实施例
106.4.2.1菌种的准备
107.取胚芽乳酸杆菌的冷冻保存管,解冻后,以1%(v/v)的植菌量接种至150毫升(ml)
的mrs培养液(购自thermo fischer scientific;产品名称:bd difco lactobacilli mrs broth)中,于37℃下培养约16小时,以提供一含菌量到达约1
×
109至1
×
10
10
cfu/毫升的菌液。
108.4.2.2生长曲线的绘制
109.将4.2.1提供的胚芽乳酸杆菌tci378接种至mrs培养基,于37℃下培养,且于培养期间每间隔1小时以4.1.1的检测方法检测培养基中的活菌含量,以绘制胚芽乳酸杆菌tci378的生长曲线。结果示于图4。
110.使用excel的slope公式计算图4的生长曲线中各时间点的切线斜率,以评估胚芽乳酸杆菌tci378的生长对数期的起始时间点(即,t1)以及生长稳定期的起始时间点(即,t2)。由下表1可知,胚芽乳酸杆菌tci378于培养2小时的切线斜率已大于培养1小时的切线斜率的三倍,因此,胚芽乳酸杆菌tci378的t1为2。此外,由图4可知,培养约8小时的切线斜率为零,因此,胚芽乳酸杆菌tci378的t2为8。
111.表1
112.时间(小时)菌数(cfu/ml)切线斜率02.5
×
107–
15
×
1072.6
×
10721
×
1088.7
×
1073.36
×
1083.7
×
10841
×
1099.1
×
108113.4.3实施例1
114.4.3.1高活菌浓度的菌液的制备
115.1.以5%(v/v)的植菌量将4.2.1提供的菌种接种至4.1.3提供的发酵培养基中,使总体积到达约3公升,进行发酵培养2.5小时,以提供一含菌量约5
×
108至5
×
109cfu/毫升的第一菌液;
116.2.以6%(v/v)的植菌量将第一菌液接种至4.1.3提供的发酵培养基中,使总体积到达约50公升,进行发酵培养3小时,以提供一含菌量约5
×
108至5
×
109cfu/毫升的第二菌液;以及
117.3.以10%(v/v)的植菌量将第二菌液接种至4.1.3提供的发酵培养基中,使总体积到达约500公升,进行发酵培养7小时,以提供一含菌量约5
×
109至5
×
10
10
cfu/毫升的高活菌浓度的菌液。
118.4.3.2活菌菌粉微粒的制备
119.以连续式固液分离机对4.3.1提供的高活菌浓度的菌液(总体积:500公升)进行离心浓缩,以获得一浓缩菌液(总体积:40公升)。其后,将该浓缩菌液、纯水及冻干保护剂以2:1:1(浓缩菌液:纯水:冻干保护剂)的重量比均匀混合,以获得一混合物,并使用扫描式电子显微镜对该混合物进行拍摄(放大倍率:3000倍),结果示于图5。如图5所示,前述混合物形成微粒结构。
120.另一方面,对上述浓缩菌液、纯水与冻干保护剂的混合物进行两阶段的真空冷冻干燥,其中,第一阶段于10至30℃下进行约15小时;第二阶段于30至40℃下进行约3小时,以获得一活菌菌粉微粒。前述菌粉微粒的结构如图1至图3所示。
121.4.4实施例2
122.4.4.1菌粉活菌含量检测
123.使用40目的筛网对4.3.2所提供的活菌菌粉微粒进行一过筛处理,使单颗活菌菌粉微粒的重量为0.0000111181573828125克(40目的筛网孔径体积为0.000022597880859375立方厘米;活菌菌粉微粒的密度为0.492公克/立方厘米),并推算单颗活菌菌粉微粒的活菌含量为1.11
×
108cfu。
124.此外,也使用4.1.1的方法检测4.3.2所提供的菌粉微粒中的活菌含量。结果显示,4.3.2所提供的菌粉微粒中的活菌含量高达为1.3
×
10
12
cfu/克。此说明,根据本发明所提供的活菌菌粉微粒中的活菌含量极高。
125.4.4.2菌粉水分残留检测
126.使用水活性检测仪(购自rotronic公司;型号:hp23-aw-a-set-40)对4.3.2所提供的菌粉微粒进行水分残留量检测。结果显示,以4.3.2所提供菌粉微粒的总重量计,其水分残留量小于1重量%。此说明,根据本发明所提供的活菌菌粉微粒具有低水分残留的特性。
127.上述实验结果表示,通过本发明的方法可在短时间内提供一高活菌浓度的菌液,且可由该活菌菌液进一步提供一具有高活菌含量且低水分残留特性的活菌菌粉微粒。
