Ⅱ型胶原蛋白的提取方法及用途与流程
本发明涉及胶原蛋白提取领域。更具体地说,本发明涉及一种ⅱ型胶原蛋白的提取方法及用途。
背景技术:
软骨是肉品加工过程中的主要副产物,可以用作提取胶原蛋白的原料。但是,现有的提取方法产率较低,且得到的ⅱ型胶原蛋白热稳定性较差,发泡性、乳化性等理化性质较弱,应用前景小。因此,亟需设计一种能够一定程度克服上述缺陷的提取方法。
技术实现要素:
本发明的一个目的是提供一种ⅱ型胶原蛋白的提取方法及用途,相比于现有技术,本发明的方法大幅度提升了ⅱ型胶原蛋白的纯度和产率,得到的ⅱ型胶原蛋白可作为发泡剂和乳化剂用于食品、医药、化妆品的制备。
为了实现本发明的以上提到的目的及其它优点,本发明提供了ⅱ型胶原蛋白的提取方法,包括:
步骤一、将软骨、胃蛋白酶、醋酸溶液混合,用功率为900~1000w的超声波处理24~36分钟;
步骤二、将步骤一得到的混合液离心,取上清液;
步骤三、调节上清液的ph为7,然后加入氯化钠进行盐析并收集蛋白沉淀;
步骤四、将步骤三得到的蛋白沉淀用醋酸溶液溶解,然后用蒸馏水透析。
优选的是,所述的ⅱ型胶原蛋白的提取方法,在步骤一之前,还包括:
步骤a、将软骨切碎,置入氯化钠溶液内,搅拌,洗去油脂和气泡;
步骤b、依次加入碳酸钠溶液、乙二胺四醋酸二钠溶液,并且间隔一段时间更换溶剂;
步骤c、用蒸馏水洗涤步骤b得到的软骨,至洗涤后的蒸馏水的ph为7。
优选的是,所述的ⅱ型胶原蛋白的提取方法,所述步骤一中,加入醋酸溶液保持ph为2.8。
优选的是,所述的ⅱ型胶原蛋白的提取方法,所述步骤一中,在冰浴中进行超声波处理,超声波的频率为20~25khz,振幅为φ10。
优选的是,所述的ⅱ型胶原蛋白的提取方法,超声波处理采用脉冲模式,运行时间与暂停时间之比为2:3。
优选的是,所述的ⅱ型胶原蛋白的提取方法,
运行时间包括第一运行时间和第二运行时间,第一运行时间与第二运行时间交替出现;
在第一运行时间内,超声波的频率为20khz,功率为1000w,在第二运行时间内,超声波的频率为25khz,功率为900w;
暂停时间包括第一暂停时间和第二暂停时间,第一暂停时间与第二暂停时间交替出现;
在第一暂停时间内,向软骨、胃蛋白酶、醋酸溶液的混合物施加功率为900w的微波,在第二暂停时间内,向软骨、胃蛋白酶、醋酸溶液的混合物内鼓入氮气。
优选的是,所述的ⅱ型胶原蛋白的提取方法,鸡胸软骨按1:6的质量体积比加入至0.5m的醋酸溶液中。
优选的是,所述的ⅱ型胶原蛋白的提取方法,加入氯化钠至氯化钠的浓度为5m。
本发明还提供了ⅱ型胶原蛋白的提取方法的用途,用于制备发泡剂。
本发明还提供了ⅱ型胶原蛋白的提取方法的用途,用于制备乳化剂。
本发明至少包括以下有益效果:
本发明的提取方法相比于现有技术,产率和纯度更高,得到的ⅱ型胶原蛋白热稳定性更高、持水性更好、吸油性更强,并且具有作为发泡剂、乳化剂的应用前景。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为非超声处理和超声处理的鸡胸骨软骨中ⅱ型胶原蛋白的提取方法流程图;
图2为本发明的的基于湿重、干重和蛋白质重量计算的ii型胶原蛋白产率;
图3为本发明的ii型胶原蛋白的紫外吸收光谱;
图4为本发明ii型胶原蛋白的圆二色谱;
图5为本发明ii型胶原蛋白的傅里叶变换红外光谱;
图6为本发明ii型胶原蛋白的差示扫描量热法的测定结果;
图7为本发明ii型胶原蛋白的微观结构;
图8为超声处理时间对(a)发泡能力(fa)、(b)发泡稳定性(fs)的影响对比图;
图9为超声处理时间对(a)乳化活性指数(eai)、(b)乳化稳定性指数(esi)的影响对比图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
本发明提供了ⅱ型胶原蛋白的提取方法,包括:
步骤一、将软骨、胃蛋白酶、醋酸溶液混合,用功率为900~1000w的超声波处理24~36分钟;
步骤二、将步骤一得到的混合液离心,取上清液;
步骤三、调节上清液的ph为7,然后加入氯化钠进行盐析并收集蛋白沉淀;
步骤四、将步骤三得到的蛋白沉淀用醋酸溶液溶解,然后用蒸馏水透析。
本技术方案中超声波功率优选为950w,超声波处理优选时间为36分钟,离心优选采用电磁搅拌器,离心时间优选至少1小时,离心条件优选为13000g。优选采用氢氧化钠溶液将上清液的ph调节为7。后续采用常规盐析法析出ⅱ型胶原蛋白。沉淀优选用0.1m的醋酸溶解。优选在4℃下透析。本技术方案通过超声波处理过程,能够提升产率和ⅱ型胶原蛋白的理化性能。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,在步骤一之前,还包括:
步骤a、将软骨切碎,置入氯化钠溶液内,搅拌,洗去油脂和气泡;
步骤b、依次加入碳酸钠溶液、乙二胺四醋酸二钠溶液,并且间隔一段时间更换溶剂;
步骤c、用蒸馏水洗涤步骤b得到的软骨,至洗涤后的蒸馏水的ph为7。该技术方案为预处理步骤,优选地,采用20%(w/v)的nacl溶液,按1:10(w/v)的比例加入0.5mna2co3除去色素,按1:10(w/v)的比例加入0.3medta-na2,保持24h除去鸡胸软骨中的矿物质离子。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,所述步骤一中,加入醋酸溶液保持ph为2.8。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,所述步骤一中,在冰浴中进行超声波处理,超声波的频率为20~25khz,振幅为φ10。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,超声波处理采用脉冲模式,运行时间与暂停时间之比为2:3。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,
运行时间包括第一运行时间和第二运行时间,第一运行时间与第二运行时间交替出现;
在第一运行时间内,超声波的频率为20khz,功率为1000w,在第二运行时间内,超声波的频率为25khz,功率为900w;
暂停时间包括第一暂停时间和第二暂停时间,第一暂停时间与第二暂停时间交替出现;
在第一暂停时间内,向软骨、胃蛋白酶、醋酸溶液的混合物施加功率为900w的微波,在第二暂停时间内,向软骨、胃蛋白酶、醋酸溶液的混合物内鼓入氮气。
本技术方案在脉冲模式的超声波处理的基础上进一步改进,即在两种运行时间内,分别施加低频率、高功率的超声波和高频率、低功率的超声波,在两种暂停时间内,分别施加微波和鼓入氮气。本技术方案能够增强脉冲模式的超声波处理过程,进一步提升产率和ⅱ型胶原蛋白的理化性能。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,鸡胸软骨按1:6的质量体积比加入至0.5m的醋酸溶液中。
在另一种技术方案中,所述的ⅱ型胶原蛋白的提取方法,加入氯化钠至氯化钠的浓度为5m。
本发明还提供了基于该提取方法获得的ⅱ型胶原蛋白的用途,用于制备发泡剂。
本发明还提供了基于该提取方法获得的ⅱ型胶原蛋白的用途,用于制备乳化剂。
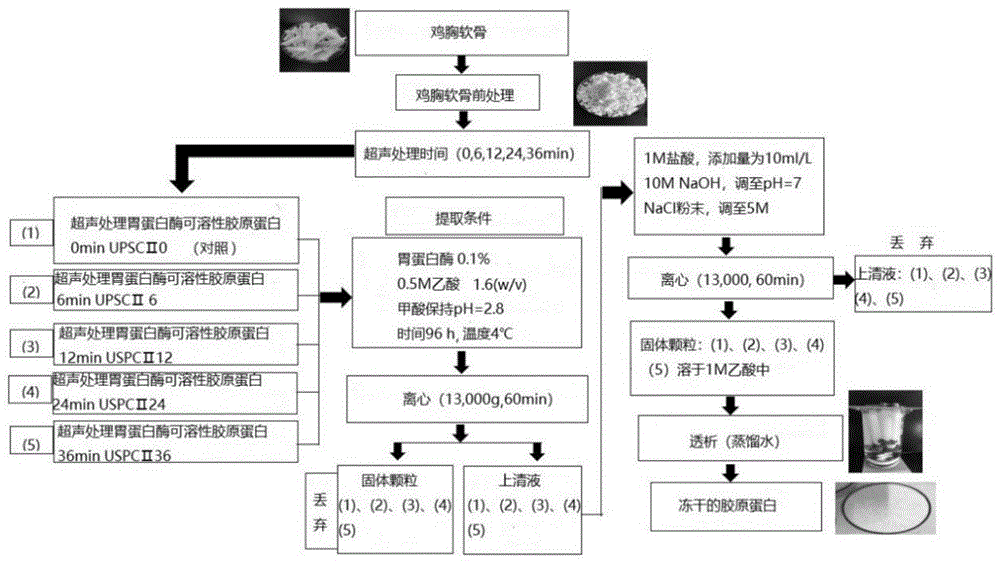
以下以鸡胸软骨为例具体说明本发明的提取方法,并与现有技术(本文称为“非超声处理)进行对比。
1、原材料和化学试剂:
鸡胸软骨,河南大用实业有限公司,中国,样品置于-20℃条件下储存;胃蛋白酶,西格玛奥德里奇,美国;化学试剂(包括醋酸,氯化钠,羟脯氨酸标准品)均为分析纯
2、前处理:
配制含有20%(w/v)的nacl溶液,随后加入鸡胸软骨碎片,按1:10(w/v)的比例加入0.05m盐酸使ph保持在7.5,用磁力搅拌器搅拌过夜,用蒸馏水洗去油脂和气泡。按1:10(w/v)的比例加入0.5mna2co3除去色素。随后在ph=7.4的条件下按1:10(w/v)的比例加入0.3medta-na2,保持24h除去鸡胸软骨中的矿物质离子(溶剂每8h更换一次)。用蒸馏水洗涤碎片至ph=7.0。经过前处理的鸡胸软骨碎片用混匀机混匀,置于-20℃条件下储藏,待用。
鸡胸软骨原料和经过处理后的鸡胸软骨的主要组成分析结果已在表1中列出,原料中的水分含量最高,为74.32%。相比之下,脂肪、灰分、蛋白质和碳水化合物的含量分别为0.17%、2.30%、12.70%和10.51%。
在前处理的鸡胸软骨中,水分含量显著增加,为81.76%。然而脂肪、灰分和碳水化合物的含量显著降低,含量分别为:0.10%、0.43%、4.57%,蛋白质含量为13.53%。这些结果表明:前处理对鸡胸软骨原料有显著影响,可以有效去除非胶原蛋白和色素,有利于胶原蛋白的高效提取和进一步分析。
表1鸡胸骨软骨(csc)的成分。
数值以平均值±sd(n=3)表示,同行内不同字母(a、b)表示样本差异显著(独立样本t检验)。
3、提取方法:
非超声处理:
现有技术提取的ⅱ型胶原蛋白在本文中统称为非超声处理(upscii0,超声处理0min)的ⅱ型胶原蛋白的提取方法。将经过前处理的鸡胸软骨按1:6(w/v)的比例加入0.5m的醋酸中,加入胃蛋白酶,用醋酸调节ph使其保持在2.8,然后在4℃条件下用电磁搅拌器搅拌96h,将样品在13,000g的条件下离心1h。采用盐析法,每1l上清液加入1m盐酸10ml,再加入10mnaoh使ph=7.0,随后边搅拌边向上清液中缓慢加入nacl粉末直至浓度为5m,速度保持恒定。所得沉淀物在13,000g条件下离心1h,收集固体颗粒并溶解于0.1m的醋酸中。样品在4℃下蒸馏水透析后进行冻干。然后置于-20℃条件下储藏,待用。
本发明的方法:
用带有探头的超声波均质机对胶原蛋白进行超声提取,按1:6(w/v)的比例将经过前处理的鸡胸软骨样品加入0.5m的醋酸中,充分混匀。体积为300ml的样品所能承受超声波均质机的最大输出功率950w,频率为20-25khz,振幅为φ10。样品在装有冰套的玻璃烧杯中超声处理。选用的超声脉冲模式为运行2s、暂停3s,处理时间分别为6,12,24,36min,依次用upscii6、upscii12、upscii24、upscii36表示。超声处理过程中,将直径6mm的高级钛合金探头浸泡在样品溶液中,深度为离底部3cm。超声处理后,用醋酸保持溶液ph=2.8,然后将超声处理后的样品置于4℃的电磁搅拌器中搅拌96h,不同样品中的搅拌速度保持一致。后续步骤按照非超声处理ⅱ型胶原蛋白操作。
4、产率
合理的超声处理时间有利于胶原蛋白的提取(图2)。不同超声处理时间(0,6,12,24,36min),ⅱ型胶原蛋白产率分别为1.730g,2.395g,2.861g,3.177g和3.367g。结果表明随着超声处理时间的延长,获得的ⅱ型胶原蛋白的量显著增加。根据预处理后鸡胸软骨的蛋白含量计算ⅱ型胶原蛋白的产率。用蛋白质重量表示产率时,超声处理比湿重法和干重法提取的ⅱ型胶原蛋白产量更高。结果表明:用上述三种方法计算时,相对于非超声处理组,upscii36组产率最大,并且存在upscii36>upscii24>upscii12>upscii6>upscii0的规律。
5、紫外吸收法测定
胶原蛋白的多肽链中的-conh2,-cooh和-c=o等功能基团,可产生紫外吸收效应。因此,紫外吸收光谱被用来判断胶原蛋白品质和测定胶原蛋白的浓度,ⅱ型胶原蛋白标准品的最大吸收波长在217.8-218.6nm之间。非超声处理的ⅱ型胶原蛋白的最大吸收值在216.9-217.9nm之间,而超声处理的ⅱ型胶原蛋白的最大吸收值在217.4nm到218.1nm之间(图3)。胶原蛋白浓度的增加通常会引起紫外吸收峰的上移。本发明中超声处理和非超声处理得到的ⅱ型胶原蛋白与标准品有相似的吸收峰。说明该方法能够从鸡胸软骨中高效提取ⅱ型胶原蛋白。非超声处理的ⅱ型胶原蛋白和超声处理后的ⅱ型胶原蛋白在280nm处均没有出现最大吸收峰,这表明提取的ⅱ型胶原蛋白纯度较高,没有非胶原蛋白干扰。
6、氨基酸含量测定
胶原蛋白的理化性质直接受氨基酸分布和交联能力的影响,胶原蛋白中氨基酸含量以残基数/1000个氨基酸残基表示。本发明中,ⅱ型胶原蛋白的提取方法总氨基酸含量随超声时间呈递增趋势:upscii0<upscii6<upscii12<upscii24≥upscii36(表2)。提取的ⅱ型胶原蛋白富含甘氨酸、谷氨酸、丙氨酸、脯氨酸和羟脯氨酸。upscii0、upscii6、upscii12、upscii24和upscii36中的甘氨酸含量依次为223.62、281.16、293.40、312.87和302.88个残基/1000个氨基酸残基,表明在提取的ⅱ型胶原蛋白中甘氨酸的含量最丰富。upscii0、upscii6、upscii12、upscii24和upscii36的脯氨酸含量依次为108.96、115.94、124.44、107.37和126.44个残基/1000个氨基酸残基,羟脯氨酸含量则依次为119.40、118.31、117.84、125.31和142.74个残基/1000个氨基酸残基。与非超声处理提取的胶原蛋白相比,超声处理提取显著提高了ⅱ型胶原蛋白中脯氨酸和羟脯氨酸的含量。脯氨酸和羟脯氨酸的含量与ⅱ型胶原蛋白热稳定性呈正相关,因此超声法提取的胶原蛋白具有良好的热稳定性和结构完整性。
另外,在超声处理提取的胶原蛋白中,甲硫氨酸、组氨酸、酪氨酸的含量较低。这是由于使用胃蛋白酶消化和超声波共同作用去除了非胶原蛋白的结果。不同超声时间影响了鸡胸软骨来源的ⅱ型胶原蛋白的理化性质,对于ⅱ型胶原蛋白的保存和修饰具有重要意义。
表2upscii0、upscii6、upscii12、upscii24、upscii36不同超声处理时间鸡胸骨软骨ⅱ型胶原蛋白的氨基酸谱(残基/1000个氨基酸残基)。
数值以均数±标准差(n=3)表示,同行内不同字母表示差异显著;(p<0.05)。
7、ⅱ型胶原蛋白的二级结构测定
圆二色谱法分析
圆二色谱可以检测蛋白质的二级结构。胶原蛋白的圆二色谱具有正带和负带,成年石首鱼两条带的波长分别为197nm和199nm,鸡骨为221nm和197nm,鳗鱼皮胶原蛋白为230nm和204nm。在本研究中,upscii0、upscii6、upscii12、upscii24和upscii36的圆二色谱分别在221.69nm、221.65nm、221.77nm、221.89nm和221.89nm波长处表现出最大旋转度(正波段),在198.32nm、198.96nm、199.08nm、204.05nm和209.73nm处显示出最小旋转度(负波段)。交点(零波段)大约位于214.74nm波长处(图4)。这说明提取的蛋白呈三螺旋结构,具有胶原蛋白的典型特征。超声处理后的鸡胸软骨ⅱ型可溶性胶原蛋白的三螺旋结构没有完全被胃蛋白酶水解和也没有被不同时间的超声处理所破坏。
但是,经过超声处理的ⅱ型胶原蛋白具有较高的氨基酸含量,其三重螺旋结构由于分子内和分子间的交联而更加稳定。结果表明,经不同时间(0,6,12min)超声处理的胶原蛋白用胃蛋白酶消化后三重螺旋结构仍然保持稳定,而超声处理24min和36min的胶原蛋白的三股螺旋结构部分发生变性,原因可能是胃蛋白酶消化和长时间的超声处理协同作用的结果。
傅里叶变换红外光谱分析
用傅里叶变换红外光谱分析ⅱ型胶原蛋白时,主要包括以下几个吸收峰:酰胺a、酰胺b、酰胺i、酰胺ii和酰胺iii(图5)。upscii0,upscii6,upscii12,upscii24和upscii36的酰胺a吸收峰分别位于3307.71cm-1,3307.93cm-1,3301.71cm-1,3300.93cm-1和3311.04cm-1。与其它蛋白的波数相比(3400-3440cm-1),这些蛋白的波数略有降低。这可能是由于n-h基团和其他功能基团形成氢键。upscii0,upscii6,upscii12,upscii24和upscii36酰胺b峰的位置分别降至2923.79cm-1和2933.90cm-1。这些峰的出现是因为-ch2、-ch3和-c-h的不对称拉伸导致的。酰胺a和酰胺b的吸收峰的升高可能与蛋白质含量的增加以及胶原蛋白分子内部氢键相交联有关。
upscii0、upscii6、upscii12、upscii24和upscii36的酰胺i峰分别位于1633.74cm-1、1629.86cm-1、1636.85cm-1、1633.96cm-1和1637.63cm-1处。酰胺ⅱupscii0、upscii6、upscii12、upscii24和upscii36的吸收峰位于1550.54cm-1、1546.65cm-1、1543.54cm-1、1549.76cm-1和1547.43cm-1处,n-h弯曲耦合c-n拉伸振动。酰胺ⅲupscii0、upscii6、upscii12、upscii24和upscii36的吸收峰分别位于1452.56cm-1、1452.56cm-1、1452.56cm-1、1453.56cm-1和1456.45cm-1处,是胶原蛋白三股螺旋结构的特征吸收峰。吸收峰的细微差异是由于提取过程中受到超声处理时间和胃蛋白酶消化的影响。当胃蛋白酶破坏原胶原蛋白的端肽时,超声处理提取的ⅱ型胶原蛋白也会发生部分二级结构的转变。位于1200cm-1和1400cm-1区域胶原蛋白的峰可能是在1396.57cm-1处-ch2的弯曲,-co-o-c不对称拉伸;-cn的拉伸以及-nh在1236.39cm-1处的形变。傅里叶变换红外光谱研究表明,非超声和超声处理提取的ⅱ型胶原蛋白保持了稳定的三螺旋结构。
8、热稳定性测定
差示扫描量热法测定ⅱ型胶原蛋白热稳定性时,非超声提取的ⅱ型胶原蛋白的出现两个吸热峰,分别表示热降解温度(td)和熔化温度(tm)(图6)。本研究中,upscii0、upscii6、upscii12、upscii24和upscii36组中tm值分别为50.91℃、55.90℃、57.54℃、59.17℃和54.18℃,td值分别为44.83℃、46.99℃、52.21℃、53.51℃和44.97℃。与非超声处理相比,超声处理胶原蛋白具有更高的热稳定性,随着超声处理时间的增加,tm明显升高。结果表明,胶原蛋白热稳定性的差异与超声处理过程中的物化转变有关,这种转变是由于水合作用导致。长时间(36min)的超声处理改变了胶原蛋白的部分共价交联,所以upscii36的tm值为54.18℃,而upscii24的tm值为59.17℃。
不同来源胶原蛋白的td值差异很大,例如小牛胶原蛋白、褐条竹鲨胶原蛋白、鳗鱼鱼皮胶原蛋白、猪皮胶原蛋白、银鲨胶原蛋白、鲸鲨胶原蛋白、鸡关节胶原蛋白和鸡软骨胶原蛋白分别为40.8℃、36.7℃、35.0℃、37.0℃、30.0℃、31.0℃、47.0℃和43.8℃。胶原蛋白的热稳定性是由氨基酸组成决定的,氨基酸含量决定了蛋白质的结构、三螺旋结构的链间氢键和蛋白质热变性。超声处理的胶原蛋白具有较高的热稳定性,td值与氨基酸谱相关,并与羟脯氨酸和脯氨酸的含量相对应。此外,td值还表示蛋白质螺旋结构展开向无规卷曲转变,从而改变了蛋白质的理化特性。超声处理后的ⅱ型胶原蛋白的热稳定性对生物医学、营养食品、化妆品和生物材料产品的生产具有潜在的应用价值。
9、微观结构测定结果
实验提取的ⅱ型胶原蛋白是一种疏松的海绵片状物。利用扫描电镜(sem)观察经超声处理的鸡胸软骨的ⅱ型胶原蛋白的微观结构(图7a、7b、7c、7d、7e)发现(upscii0)呈多层聚集结构,网状纤维少,纤维状长丝数量少,螺旋状纤维被胃蛋白酶破坏。球表面结构与胶原蛋白的脱水有关。而upscii6、upscii12、upscii24和upscii36具有大量多孔、疏松的截面,且具有相互连接的纤维网络孔结构。随着超声处理时间的延长,胶原蛋白的孔洞和纤维样结构网络更加清晰。延长超声处理时间(upscii36)影响纤维的长度和结构。与常规方法相比,超声提取的海洋胶原蛋白的显微结构具有疏松、多孔和均匀的特点。显微结构的改变更多地与胶原蛋白的功能特性有关。超声处理后ⅱ型胶原蛋白的微观结构表明,由于超声波的机械振荡和空化作用,胶原蛋白呈现出多孔、疏松、长纤维网络的形态。本研究认为超声处理时间可能导致鸡胸软骨的ⅱ型胶原蛋白的微观结构发生明显的物理变化。这些结构变化可以进一步与功能特性相关。
10、ⅱ型胶原蛋白的功能特性测定结果
持水性测定结果:
持水性是蛋白质重要的功能性质之一。本研究中,upscii0、upscii6、upscii12、upscii24和upscii36的whc值分别为562.19%、566.11%、576.29%、595.11%和572.23%。超声处理后胶原蛋白的whc明显升高,高于蒸馏水的whc(539.07%),但低于甘油(623.90%)。由于离子强度、蛋白浓度和结合能力等各种因素的作用,whc值会发生波动。在本研究中,超声处理会增加胶原蛋白的保水能力和表面疏水性。超声处理的ⅱ型胶原蛋白的提取方法在医药、食品、化妆品等行业具有良好的应用前景。
表3ⅱ型胶原蛋白的持水能力(whc)、吸水能力(wac)和吸油能力(oac)
非超声处理胶原蛋白upscii0与超声处理胶原蛋白upscii6、upscii12、upscii24、upscii36的比较。蒸馏水为阴性对照,甘油为阳性对照。数值用均数±sd(n=3)表示,同一列内不同字母(a-e)表示差异有统计学意义(p<0.05)
吸水性测定结果:
upscii0、upscii6、upscii12、upscii24和upscii36处理的ⅱ型胶原蛋白的wac值分别为101.39%、124.06%、144.77%、150.34%和130.90%(表3)。随着超声处理时间的延长,wac明显升高。高亲水基团与水形成氢键,表现出良好的吸水保水能力。但超声时间超过36分钟后,与其他超声处理的胶原样品相比,其wac值降低。超声处理提取的ⅱ型胶原蛋白是一种合适的补水材料。
吸油性测定结果:
不同超声时间提取的ⅱ型胶原蛋白的oac值分别为172.93%、177.33%、191.47%、194.93%和130.90%(如表3),可能是由于来源(原料)、蛋白质类型、脯氨酸水解程度,加工方法,非极性侧链和油种类的不同所导致。结果表明,超声处理ⅱ型胶原蛋白的oac不同值是不同产品成分的一个重要性质,这与肉类和糖果行业产品的风味和质构保持有关。
发泡性测定结果:
发泡能力(fa)和发泡稳定性(fs)是蛋白质的功能特性。在ph=4,7,10的条件下ⅱ型胶原蛋白的提取方法在不同超声处理时间的fa值分别为upscii0:139.7%、130.7%、137.8%;upscii6:149.3%,135.7%,151.0%;upscii12:160.8%,151.3%,166.5%;upscii24:169.4%,158.6%,173.1%;upscii36:150.0%,130.5%,144.5%。结果表明,与ph值7相比,ph值10和ph值4时fa值显著升高(p<0.05),受超声处理和ph值的影响较大(图7a和7b)。
fs值也受ph和超声处理时间的影响,在ph=4,7,10的条件下ⅱ型胶原蛋白在不同超声处理时间的fs值分别为upscii0:126.6%,124.0%,121.1%;upscii6:132.9%,113.9%,142.7%;upscii12:137.5%,129.9%,142.7%;upscii24:154.9%,128.7%,153.9%和upscii36:135.9%,116.9%,129.5%。在ph=4,10时,upscii24的fs值显著高于upscii0,upscii6,upscii12和upscii36(图7a)。
以上表明,ph和超声处理时间对鸡胸软骨ⅱ型胶原蛋白fa和fs的影响显著(p<0.05)。随着处理时间的增加,fa值和fs值也显著增加,这是因为在超声波作用下,电荷密度增加,蛋白质在界面展开和重新排列也增加。在碱液诱导的气-水界面中,蛋白的展开、界面蛋白形成的变化表现出疏水性,增强了气泡的封闭性。超声处理对于液体的影响主要是通过超声波诱导产生了空穴效应,空穴效应再诱导产生物理学上的作用力。蛋白质和水的相互作用对于泡沫的形成和稳定很重要,鸡胸软骨中经超声处理的ⅱ型胶原蛋白的提取方法在食品中可作为发泡剂。
乳化性测定结果:
超声处理和ph都可以对鸡胸软骨提取的ⅱ型胶原蛋白的乳化活性指数(eai)和乳化稳定性指数(esi)产生显著影响(p<0.05)。乳化性可因超声空化强度的改变发生变化,ph是影响蛋白质功能特性的重要因素。在ph=4,7,10的条件下分别比较不同超声处理时间下的eai值,结果表明upscii0:32.71m2/g,25.62m2/g,43.51m2/g;upscii6:36.52m2/g,32.53m2/g,53.25m2/g;upscii12:48.92m2/g,42.17m2/g,65.29m2/g;upscii24:61.04m2/g,51.92m2/g,71.80m2/g;upscii36:46.48m2/g,41.20m2/g,62.90m2/g(figure8a,and8b)。与ph=7相比,ph=4和10时eai值随超声处理时间的增加而增加。结果表明蛋白质在水相和油相中都有被吸收的潜能。超声处理的ⅱ型胶原蛋白的提取方法有高度的表面疏水性,能够提升乳化活性,增加分子自由度和表面疏水性。
胶原蛋白的esi值可以用来估计乳化后在水中的蛋白质进入油-水界面的能力。这表明其对超声处理过程中ph和物化特性的改变的抵抗能力。当ph=4,7,10时,不同超声处理时间的esi值分别为upscii0:37.60min,22.25min和44.40min,upscii6:43.98min,35.36min和53.16min;upscii12:50.10min,43.62min和68.75min;upscii24:64.77min,44.97min和74.01min,upscii36:51.27min,33.25min和55.09min。与从海洋生物提取的胶原蛋白的乳化性能进行比较发现:与ph=7时相比,在ph=4和ph=10时,超声处理的胶原蛋白的esi值高于非超声处理胶原蛋白,但是长时间超声处理(>24分钟)会降低胶原蛋白的esi值,这可能会改变胶原蛋白的亲脂-亲水排列、分子大小和长度。乳化性能使得鸡胸软骨中ⅱ型胶原蛋白的提取方法可作为工业生产的乳化剂,超声波的应用对乳化性能的影响很大。
这里说明的设备数量和处理规模是用来简化本发明的说明的。对本发明ⅱ型胶原蛋白的提取方法的应用、修改和变化对本领域的技术人员来说是显而易见的。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!