一种HBV基因组扩增的研究方法与流程
本发明涉及细胞生物学领域,尤其涉及一种hbv基因组扩增的研究方法。
背景技术:
乙型肝炎病毒(hepatitisbvirus,hbv)简称乙肝病毒,属嗜肝双链dna病毒,hbv基因组在宿主细胞中可合成共价闭合环状dna(covalentlyclosedcircular,cccdna),作为乙肝病毒扩增模板稳定的存在,同时也是hbv持续感染的关键因素;hbv病毒与慢性肝炎、肝硬化、肝细胞癌等多种疾病相关,据估计,全球有3.5-4亿人感染hbv,每年有50万~120万人死于hbv感染导致的肝衰竭、肝硬化、原发性肝癌等肝脏疾病;目前,hbv的致病机制尚不完全清楚,在其扩增周期中,hbvcccdna作为一个独特的扩增中间体,是乙肝病毒扩增水平最特异的指标,它既能转录产生3.5kb前基因组mrna,又能转录出病毒mrna并翻译产生包括hbsag在内的病毒蛋白,然而hbvcccdna并不通过类似半保留扩增的方式进行自主扩增,而是由rcdna这一逆转录产物转变而成,这种特殊逆转录形式对hbvdna的扩增至关重要;然而,现有抗病毒治愈方法不能根除hbv扩增周期中的cccdna,这也是临床上慢性乙型肝炎经久不愈的根本原因,因此,认识hbv的致病机制,寻找新的治愈方法迫在眉睫;在潘万龙,方岩,许舸等,结构特异性核酸酶fen1对hbv扩增的影响[j]中,提到了fen1可将rcdna修复成cccdna,以此促进hbvdna的扩增,但其具体调控机制仍不甚明了;
mirna是一种高度保守,长度为20-25nt的内源性非编码rna,参与转录后基因表达调控;目前研究表明,部分mirna能调节hbv的扩增周期,如mir-146a,mir-122,mir-548ah;其中,mir-146a是一种与炎症关系密切的mirna,其对固有免疫应答、炎症反应及调控hbv扩增起到重要的作用;
另外,研究显示,ago2可作为载体协同mirna发挥功能作用,其不同于传统的ago蛋白家族(ago1-4)与mirna形成免疫复合物促进mirna的加工及成熟作用,但ago2在mir-146a发挥调控作用不甚明确,因此,对于ago2在mir-146a中发挥的调控功能的研究变成了一个重要的研究课题,其研究结果对于乙肝病毒的防治有着重要作用。
技术实现要素:
针对上述现有技术存在的问题,本发明旨在提供一种hbv基因组扩增的研究方法,通过应用过表达及干扰mir-146a观察fen1及hbvdna水平,得到ago2协同mir-146a通过下游靶基因irak1/traf6调控fen1蛋白基因的转录,从而促进hbv基因组的扩增;通过ago2sirna及ago2rip来分析其具体功能机制,得到ago2以载体形式协同mir-146a发挥调控作用,从而促进基因组的扩增,为理解hbv发病机制并开拓新的治愈靶点及方案提供理论依据,并为清除细胞内cccdna库,完全阻断hbv扩增这一治愈目标创造条件。
为了实现上述目的,本发明所采用的技术方案如下:
一种hbv基因组扩增的研究方法,该研究方法的具体步骤包括:
步骤一:通过mir-146a调控hbv基因组扩增的研究,得到mir-146a通过下游靶基因irak1/traf6调控fen1蛋白基因的转录,从而促进hbv扩增;
步骤二:在步骤一的基础上,利用ago2作为载体协同mir-146a调控hbv基因组扩增的研究,得到并证实了一种新的mir-146a→fen1→hbvdna调节轴。
进一步的,步骤一所述的mir-146a调控hbv基因组扩增的研究的具体步骤包括:
s1.在hepg2细胞系和hbv稳定扩增细胞系hepg2.2.15中,采用逆转录定量pcr技术检测mir-146a在亲本细胞hepg2和hbv稳定扩增细胞系hepg2.2.15细胞中的表达水平差异;
s2.在hepg2.2.15细胞中分别转染mir-146amimic和mir-146ainhibitor,48小时后,采用实时定量pcr方法检测hbvdna的表达水平,westernblot方法检测结构特异性核酸内切酶的表达水平;
s3.提取hbv扩增中间体,将步骤s2经mir-146amimic和mir-146ainhibitor转染后的hepg2.2.15分别收集后,加入hbv病毒核心颗粒dna提取液400ul,37℃孵育15min,15000g×,离心3min后,将上清转移至新ep管中,加入peg8000200ul冰上静置40min,12000g×,4℃离心7min,弃去上清加入消化液400ul、蛋白酶k15ul,45℃消化过夜;酚氯仿抽提dna,利用异丙醇和乙醇对其进行沉淀,定容hbvdna;
s4.实时定量pcr检测,以上述s3样本为模板,利用ultrasybrgreen试剂盒说明书配置标准pcr反应体系,所述pcr反应条件为:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环,进行溶解曲线分析;
s5.westernblot检测,利用ripa蛋白提取试剂裂解上述步骤s2的hepg2.2.15细胞,沉淀提取总蛋白,12000g×,离心3min,收集上清;将提取的总蛋白在12%sds-page的缓冲液中电泳,电转至pvdf膜,5%脱脂牛奶封闭3h,分别加入小鼠抗人fen1、鼠抗人ago2和鼠抗β-actin单抗,4℃过夜,利用tbst缓冲溶液洗膜后,再加入抗鼠igg,利用tbst缓冲溶液洗膜后,ecl试剂盒化学发光,凝胶成像系统显影;
s6.在步骤s2所述的hepg2.2.15细胞中外源性转入fen1质粒,48小时后分别检测hbvdna载量以及mir-146a水平;
s7.在步骤s2所述的hepg2.2.15细胞中分别转染mir-146amimic和mir-146ainhibitor后,利用生物信息学软件筛选分析mir-146a的下游潜在靶基因irak1和traf6,采用逆转录定量pcr技术检测irak1和traf6的表达水平。
进一步的,经mir-146a调控hbv基因组扩增的研究得到:
(1)mir-146a可以促进hbv基因组的扩增和表达;
(2)mir-146a能促进fen1扩增和翻译,同时fen1可促进mir-146a水平和hbv-dna扩增;
(3)mir-146a可以抑制hbv基因组细胞中下游靶基因irak1/traf6的表达水平。
进一步的,步骤二所述的ago2作为载体协同mir-146a调控hbv基因组扩增的研究的具体步骤包括:
s1.取hepg2.2.15和hepg2进行培养,将hepg2细胞培养于含10%胎牛血清的dmem培养基中,hepg2.2.15细胞培养于含10%胎牛血清的dmem培养基中,在培养基中另外再加入筛选的抗生素g418对hepg2.2.15细胞进行培养;
s2.利用ago2sirna转染s1培养的hepg2.2.15细胞24小时后,继而转染外源性mir-146amimic,24h后,采用逆转录定量pcr和westernblot技术检测ago2蛋白水平;ago2经rip技术处理后,利用逆转录定量pcr检测mir-146a的表达水平;ago2sirna转染mir-146amimic后,检测fen1及hbvdna表达水平;
s3.提取hbv扩增中间体,将步骤s2处理的hepg2.2.15收集后,加入hbv病毒核心颗粒dna提取液400ul,37℃孵育15min,15000g×,离心3min后,将上清转移至新ep管中,加入peg8000200ul冰上静置40min,12000g×,4℃离心7min,弃去上清加入消化液400ul、蛋白酶k15ul,45℃消化过夜;酚氯仿抽提dna,利用异丙醇和乙醇对其进行沉淀,定容hbvdna;
s4.实时定量pcr检测,以上述s3样本为模板,利用ultrasybrgreen试剂盒说明书配置标准pcr反应体系,所述pcr反应条件为:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环,进行溶解曲线分析;
s5.westernblot检测,利用ripa蛋白提取试剂裂解上述步骤s2的hepg2.2.15细胞,沉淀提取总蛋白,12000g×,离心3min,收集上清;将提取的总蛋白12%sds-page电泳,电转至pvdf膜,5%脱脂牛奶封闭3h,分别加入小鼠抗人fen1、鼠抗人ago2和鼠抗β-actin单抗,4℃过夜,利用tbst缓冲溶液洗膜后,再加入抗鼠igg,利用tbst缓冲溶液洗膜后,ecl试剂盒化学发光,凝胶成像系统显影;
s6.rip检测,上述步骤s2中48小时后收集经ago2sirna转染hepg2.2.15的细胞,采用magnarip试剂盒,首先裂解细胞,然后应用免疫磁珠包被ago2抗体,4℃与样本孵育过夜,利用磁力架分离共沉淀ago2结合的rna,最后trizol提取分离样本中的rna,逆转录成cdna,以cdna为模板荧光定量pcr检测mir-146a的表达,反应条件:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环;
s7.统计学处理采用spss22.0统计软件,每组实验至少重复3次,实验数据以
进一步的,经ago2协同mir-146a调控hbv基因组扩增的研究得到:
(1)ago2协同mir-146a调控hbv扩增;
(2)ago2作为重要的辅助成分在mir-146a功能调节中起作用。
本发明的有益效果是:本发明公开了一种hbv基因组扩增的研究方法,与现有技术相比,本发明的改进之处在于:
1.本发明所述hbv基因组扩增的研究方法,包括mir-146a调控hbv基因组扩增的研究和ago2作为载体协同mir-146a调控hbv基因组扩增的研究,证明ago2协同mir-146a通过下游靶基因irak1/traf6调控fen1蛋白基因的转录,从而促进hbv复制的作用;
2.通过hbv基因组扩增的研究方法,在hbv扩增感染中得到并证实了一种新的mir-146a→fen1→hbvdna调节轴,该调节轴对hbv基因组扩增提供了必要条件,进一步说明了hbvdna复制的具体分子机制,为理解hbv发病机制并开拓新的治愈靶点及方案提供理论依据;为今后深入细致的研究可彻底阐明hbv复制的分子机制,并为清除细胞内cccdna库,完全阻断hbv复制这一治愈目标创造了条件。
附图说明
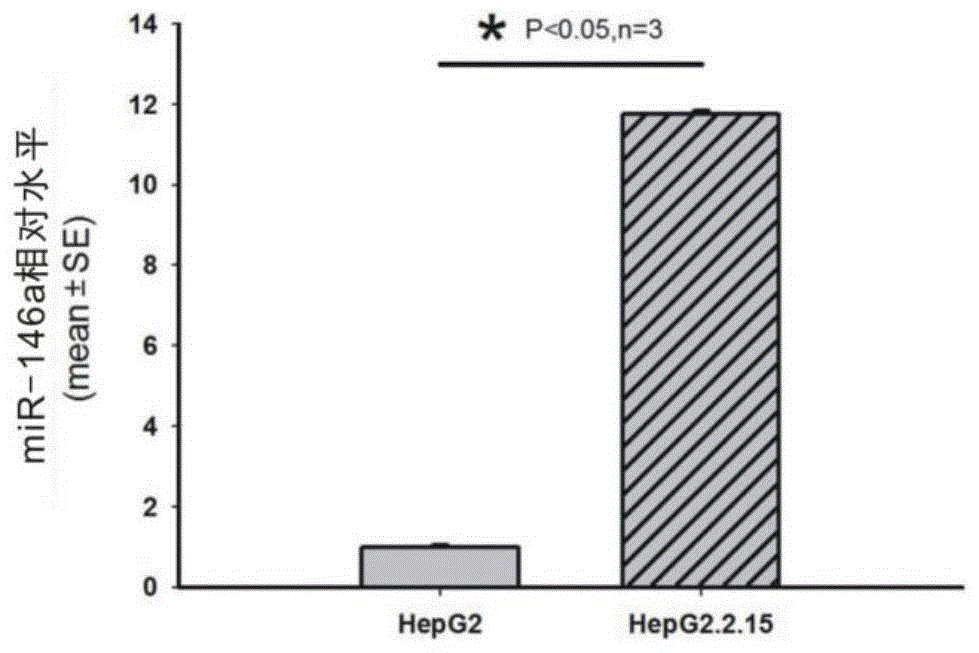
图1为本发明hepg2.2.15与hepg2细胞中的mir-146a表达水平的差异性分析的柱状图。
图2为本发明mir-146a促进hbv的扩增的柱状图。
图3为本发明hepg2.2.15细胞转染mir-146amimic和mir-146ainhibitor后对fen1扩增水平的影响的柱状图。
图4-1为本发明hepg2.2.15细胞中转染fen1后对mir-146a水平影响的柱状图。
图4-2为本发明hepg2.2.15细胞中转染fen1后对hbvdna载量影响的柱状图。
图5-1为本发明hepg2.2.15细胞中转染mir-146amimic和mir-146ainhibitor后对itak1的表达水平的影响的柱状图。
图5-2为本发明hepg2.2.15细胞中转染mir-146amimic和mir-146ainhibitor后对traf6的表达水平的影响的柱状图。
图6为本发明逆转录定量pcr和westernblot检测hepg2.2.15细胞中转染mir-146amimic和ago2sirna对ago2表达水平的影响的柱状图。
图7为本发明hepg2.2.15细胞中转染mir-146amimic和ago2sirna,rip技术分离ago2后,mir-146a表达水平的柱状图。
图8-1为本发明ago2sirna及mir-146a转染hepg2.2.15细胞后fen1表达水平的柱状图。
图8-2为本发明ago2sirna及mir-146a转染hepg2.2.15细胞后hbv-dna拷贝数的柱状图。
图9为本发明mir-146a→fen1→hbvdna调节示意图。
具体实施方式
为了使本领域的普通技术人员能更好的理解本发明的技术方案,下面结合附图和实施例对本发明的技术方案做进一步的描述。
参照附图1、图2、图3、图4-1、图4-2、图5-1、图5-2、图6、图7、图8-1、图8-2和图9所示的一种hbv基因组扩增的研究方法,所述该研究方法的具体步骤包括:
步骤一:通过mir-146a调控hbv基因组扩增的研究,得到mir-146a通过下游靶基因irak1/traf6调控fen1蛋白基因的转录,从而促进hbv扩增;
步骤二,在步骤一的基础上,利用ago2作为载体协同mir-146a调控hbv基因组扩增的研究,得到并证实了一种新的mir-146a→fen1→hbvdna调节轴,更进一步说明了hbvdna复制的具体分子机制,为理解hbv发病机制并开拓新的治愈靶点及方案提供理论依据;为今后深入细致的研究可彻底阐明hbv复制的分子机制,并为清除细胞内cccdna库,完全阻断hbv复制这一治愈目标创造了条件。
步骤一所述mir-146a调控hbv基因组扩增的研究的具体步骤包括:
s1.为验证mir-146a在hbv扩增中的作用,在hepg2细胞系和hbv稳定扩增细胞系hepg2.2.15中,采用逆转录定量pcr技术检测mir-146a在亲本细胞系hepg2与hbv稳定扩增细胞系hepg2.2.15细胞中的表达水平差异,判断hbv稳定细胞系hepg2.2.15与亲本细胞hepg2间的差异性,研究结果如附图1所示,mir-146a水平在hepg2.2.15中相对表达量为11.755±0.069,mir-146a水平在亲本细胞hepg2中相对表达量为1.000±0.038,可以看出hbv稳定扩增细胞系hepg2.2.15中mir-146a呈高水平表达,mir-146a在hepg2.2.15细胞中相对表达量较hepg2组明显升高,其升高倍数为11,差异有统计学意义(p<0.05),hbv扩增与mir-146a水平相关;
s2.在hepg2.2.15细胞中分别转染mir-146amimic和mir-146ainhibitor,48小时后,采用实时定量pcr方法检测hbvdna的表达水平,westernblot方法检测结构特异性核酸内切酶(fen1)的表达水平;检测到的结果为:mir-146amimic组hbv-dna载量为3.215±0.001、mir-146ainhibitor组hbv-dna载量为2.623±0.083,较对照组2.813±0.015,mir-146amimic组hbv-dna载量明显升高,mir-146ainhibitor组hbv-dna载量明显降低,研究结果如附图2所示;mir-146amimic组结构特异性核酸内切酶(fen1)的表达水平为1.678±0.131,mir-146ainhibitor组结构特异性核酸内切酶(fen1)的表达水平为0.344±0.045,较对照组1.017±0.194,mir-146amimic组结构特异性核酸内切酶(fen1)的含量明显增高,二者间差异有统计学意义(p<0.05),mir-146ainhibitor组结构特异性核酸内切酶(fen1)含量明显降低,二者间差异有统计学意义(p<0.05),研究结果如附图3所示,结果显示mir-146a能促进hbv的扩增;
s3.提取hbv扩增中间体,将步骤s2处理的hepg2.2.15收集后,加入hbv病毒核心颗粒dna提取液400ul,37℃孵育15min,15000g×(15000g×表示离心转速,g表示重力加速度),离心3min后,将上清转移至新ep管中,加入peg8000200ul冰上静置40min,12000g×(12000g×表示离心转速,g表示重力加速度),4℃离心7min,弃去上清加入消化液400ul、蛋白酶k15ul,45℃消化过夜;酚氯仿抽提dna,利用异丙醇:乙醇对其进行沉淀,定容hbvdna;
s4.实时定量pcr检测,以上述s3样本为模板,利用ultrasybrgreen试剂盒说明书配置标准pcr反应体系,反应条件为:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环,进行溶解曲线分析;mir-146a及内参u6引物由成都优泰森生物工程有限公司设计合成,反应条件为:95℃预变性10min,95℃变性10s,52℃退火30s,60℃延伸30s,重复45个循环;每组设置3个复孔,重复三次实验,
s5.westernblot检测,利用ripa蛋白提取试剂裂解上述s2细胞沉淀提取总蛋白,12000g×(12000g×表示离心转速,g表示重力加速度),离心3min,收集上清(含蛋白质);将提取的总蛋白12%sds-page电泳,电转至pvdf膜,5%脱脂牛奶封闭3h,分别加入小鼠抗人fen1(1:5000)、鼠抗人ago2(1:5000)和鼠抗β-actin单抗(1:10000),4℃过夜,利用tbst缓冲溶液洗膜,再分别加入抗鼠igg(1:5000),利用tbst缓冲溶液洗膜后,ecl试剂盒化学发光,凝胶成像系统显影;
s6.在s2所述的hepg2.2.15细胞中外源性转入fen1质粒,48小时后分别检测hbvdna载量以及mir-146a水平;在s2所述的hepg2.2.15细胞中外源性转入fen1质粒,48小时后分别检测hbvdna载量以及mir-146a水平;检测到的结果为:hbv-dna载量为3.431±0.004、较对照组2.661±0.009明显升高,二者间差异有统计学意义(p<0.05);mir-146a相对表达水平为5.712±0.371,较对照组1.023±0.224明显升高,二者间差异有统计学意义(p<0.05),其结果如附图4-1和附图4-2所示,实验结果证明提示mir-146a能促进fen1扩增和翻译,同时fen1亦可促进mir-146a水平和hbv-dna扩增;
s7.将s2所述的hepg2.2.15细胞中分别转染mir-146amimic和mir-146ainhibitor后,利用生物信息学软件targetscan等筛选分析mir-146a的下游潜在靶基因irak1和traf6,在hepg2.2.15细胞中转染mir-146amimic,采用逆转录定量pcr技术检测irak1和traf6的表达水平;检测到的结果为:mir-146amimic组irak1和traf6相对表达水平分别为0.114±0.013、0.390±0.014,mir-146ainhibitor组irak1/traf6相对表达水平分别为1.222±0.073、2.145±0.271,较对照组irak1/traf6相对表达水平1.000±0.038、1.007±0.119,mir-146amimic组irak1/traf6相对表达水平明显降低,差异有统计学意义(p<0.05);mir-146ainhibitor组irak1/traf6相对表达水平明显伸高,差异有统计学意义(p<0.05),其结果如附图5-1和附图5-2所示,结果显示mir-146a通过下游靶基因irak1和traf6调控fen1表达,进而影响hbv的扩增。
经上述mir-146a调控hbv基因组扩增的研究得到:
(1)mir-146a可以促进hbv基因组的扩增和表达;
(2)mir-146a能促进fen1扩增和翻译,同时fen1可促进mir-146a水平和hbv-dna扩增;
(3)mir-146a可以抑制hbv基因组细胞中下游靶基因irak1/traf6的表达水平。
步骤二所述的ago2作为载体协同mir-146a调控hbv基因组扩增的研究的具体步骤包括:
s1.取hepg2.2.15和hepg2进行培养,将hepg2细胞培养于含10%胎牛血清的dmem培养基中,hepg2.2.15细胞培养于含10%胎牛血清的dmem培养基中,在培养基中另外再加入筛选的抗生素g418对hepg2.2.15细胞进行培养,加入g418主要是为维持hbv稳定复制细胞系hepg2.2.15中的病毒dna,故需持续性加入,细胞培养时间与后续实验应用有关,一般情况稳定培养3-5天即可;
s2.利用ago2sirna转染hepg2.2.15细胞24小时后,继而转染外源性mir-146amimic,24h后,采用逆转录定量pcr和westernblot技术检测ago2蛋白水平;ago2经rip后,利用逆转录定量pcr检测mir-146a的表达水平;ago2sirna转染mir-146amimic,检测fen1及hbvdna表达水平;
检测到ago2sirna组相对表达量(0.688±0.099)较对照组(1.002±0.069)降低,差异有统计学意义(p<0.05),其结果如附图6所示,结果显示ago2sirna沉默了ago2蛋白表达;
检测到mir-146a相对表达水平(0.105±0.002)较对照组(1.000±0.041)降低,差异有统计学意义(p<0.05),其结果如附图7所示,结果显示ago2可作为载体协同mir-146a调控hbv复制;
检测到ago2sirna组fen1表达水平(0.485±0.100)与对照组(1.000±0.023)比较,显著减少,差异有统计学意义(p<0.05),如附图8-1所示;ago2sirna组hbvdna拷贝数与对照组比较亦显著减少,差异有统计学意义,如附图8-2所示;结果显示若无ago2蛋白辅助,成熟mir-146a不发挥hbv复制调控作用,因此,ago2作为重要的辅助成分在mir-146a功能调节中起作用;
s3.提取hbv扩增中间体,将步骤s2处理的hepg2.2.15收集后,加入hbv病毒核心颗粒dna提取液400ul,37℃孵育15min,15000g×(15000g×表示离心转速,g表示重力加速度),离心3min后,将上清转移至新ep管中,加入peg8000200ul冰上静置40min,12000g×,4℃离心7min,弃去上清加入消化液400ul、蛋白酶k15ul,45℃消化过夜;酚氯仿抽提dna,利用异丙醇和乙醇对其进行沉淀,定容hbvdna;
s4.实时定量pcr检测,以上述s3样本为模板,利用ultrasybrgreen试剂盒说明书配置标准pcr反应体系,反应条件为:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环,进行溶解曲线分析;mir-146a及内参u6引物由成都优泰森生物工程有限公司设计合成,反应条件为:95℃预变性10min,95℃变性10s,52℃退火30s,60℃延伸30s,重复45个循环;每组设置3个复孔,重复三次实验,引物序列如下表1所示:
表1:表引物序列
s5.westernblot检测,利用ripa蛋白提取试剂裂解上述s2细胞沉淀提取总蛋白,12000g×(12000g×表示离心转速,g表示重力加速度),离心3min,收集上清(含蛋白质);将提取的总蛋白12%sds-page电泳,电转至pvdf膜,5%脱脂牛奶封闭3h,分别加入小鼠抗人fen1(1:5000)、鼠抗人ago2(1:5000)和鼠抗β-actin单抗(1:10000),4℃过夜,利用tbst缓冲溶液洗膜,再分别加入抗鼠igg(1:5000),利用tbst缓冲溶液洗膜后,ecl试剂盒化学发光,凝胶成像系统显影;
s6.rip检测,上述步骤s2中48小时后收集经ago2sirna转染的hepg2.2.15细胞,采用magnarip试剂盒,首先裂解细胞,然后应用免疫磁珠包被ago2抗体,4℃与样本孵育过夜,利用磁力架分离共沉淀ago2蛋白,最后利用trizol提取ago2蛋白样本中结合的rna(样本中加入0.7mltrizol,用量参考贴壁细胞提取总rna),孵育5min使充分裂解,按比例加入0.2ml氯仿(每1mltrizol裂解液),孵育2-3min,12000g×(12000g×表示离心转速,g表示重力加速度),4℃离心15min,小心转移上清水相至新的ep管中;按比例加入0.5ml异丙醇(每1mltrizol)于裂解液上方,室温孵育10min,12000g×,4℃离心10min,弃去上清,沉淀用75%乙醇洗涤,7500g×,4℃离心5min,弃去上清,干燥后定容,逆转录成cdna,以cdna为模板荧光定量pcr检测mir-146a的表达,反应条件:95℃预变性10min,95℃变性15s,60℃退火/延伸1min,重复37个循环;
s7.统计学处理采用spss22.0统计软件,每组实验至少重复3次,实验数据以
采用spss22.0统计软件具体处理数据指标包括:1.mir-146a在亲本细胞hepg2和hbv稳定扩增细胞系hepg2.2.15细胞中的表达;2.特异性核酸内切酶的表达水平;3.hbvdna病毒载量;4.irak1表达水平;5.traf6表达水平;6.ago2表达水平。
通过ago2协同mir-146a调控hbv基因组扩增的研究得到:
(1)ago2协同mir-146a调控hbv扩增;
(2)ago2作为重要的辅助成分在mir-146a功能调节中起作用。
通过上述hbv基因组扩增的研究方法得到:
(1)通过比对hepg2细胞系与hbv稳定复制细胞系hepg2.2.15中mir-146a表达水平,我们发现,在hepg2.2.15细胞系中mir-146a明显升高,提示mir-146a似能调控并促进hbvdna表达及复制;在此基础上,我们通过过表达与干扰hepg2.2.15细胞系中mir-146a,采用实时定量pcr检测hbvdna及逆转录定量pcr检测fen1的表达水平,显示mir-146amimic组hbvdna拷贝数及fen1表达水平均明显升高,表明mir-146a确能促进hbv的复制,并影响和调控fen1的表达;
(2)研究本研究方法发现,fen1是hbvdna复制中起调控作用的关键酶,而当mir-146a增强hbvdna复制的同时,fen1水平亦升高,这说明mir-146a是通过调控fen1这一关键酶来影响hbvdna复制的;
(3)fen1是一种结构特异性的金属核酸酶,存在于线粒体及细胞核中,fen1具有多种功能,包括促进dna的成熟与复制并调节蛋白质间代谢等作用,fen1促进hbvdna复制的原因是hbvrcdna到hbvcccdna结构修复及转化阶段,hbvrcdna负链为不闭合且5'及3'端含有冗余序列的dna结构,这一发夹结构必须被修复才能顺利完成复制,在形成cccdna中由于hbvrcdna负链的特殊结构,fen1发挥间隔依赖核酸内切酶活性,将hbvrcdna结构中两端各约9nt的冗余序列形成的发夹结构(即假“y”结构)剪切修复,并在聚合酶和连接酶作用下形成完整的闭合环状结构,从而促进了病毒dna的复制;另外,对于hbvrcdna正链5'端的rna引物,fen1亦可借助其5'-3'flap核酸内切酶活性将rna引物切除,进而延伸闭合,形成完整的共价闭合环状dna分子;因此,我们将外源性fen1质粒转入hepg2.2.15细胞系,观察mir-146a和hbvdna水平,发现两者均较对照组明显上升,说明fen1能升高mir-146a并促进hbvdna的复制;同时,过表达和干扰mir-146a,观察fen1的表达水平,发现mir-146a过表达组与干扰组较对照组明显升高与降低,说明mir-146a与fen1存在相互调控作用;因此,在hbv感染时,mir-146a水平表达上调,通过增强fen1表达,间接促进cccdna的形成,进而增强hbvdna复制,同时,mir-146a可能提供了一个更适合fen1发挥核酸内切酶活性的宿主环境,使其能够更有效的调控hbv复制;
与此同时,我们利用生物信息学软件分析发现,irak1/traf6是mirna-146a的潜在下游靶基因,逆转录定量pcr结果显示,在mir-146amimic和inhibitor作用于靶细胞后,irak1/traf6的相对表达水平较对照组明显降低或升高,即mir-146a通过抑制下游靶基因irak1/traf6的表达来促进hbvdna的复制;其原因是mir-146a基因的启动子区存在多个核因子-κb(nuclearfactor-kappab,nf-κb)结合位点,mir-146a可靶向抑制nf-κb之间的衔接分子白介素-1受体相关激酶-1(il-1receptor-associatedkinase1,irak1)和肿瘤坏死因子受体相关因子-6(tnfreceptor-associatedfactor6,traf6)表达,从而降低nf-κb的活性,防止过度免疫炎症反应的发生,并且通过研究分析表明,在nf-κb信号通路中,fen1显著富集,即其表达水平明显升高,这充分说明mir-146a抑制下游靶基因后通过nf-κb信号通路调控fen1的表达从而影响hbv复制;
ago2可作为载体协同mirna发挥功能作用,其不同于传统的ago蛋白家族(ago1-4)与mirna形成免疫复合物促进mirna的加工及成熟作用;因此,我们拟通过ago2sirna及ago2rip来分析其具体功能机制;我们在hepg2.2.15细胞系中过表达mir-146a,同时转入ago2sirna,48小时后,rip分离ago2蛋白,逆转录定量pcr检测mir-146a水平,发现ago2sirna组较正常对照组mir-146a水平显著下降,说明ago2确与mir-146a形成复合体发挥调控作用,当外源性调高mir-146a并干扰ago2蛋白时,fen1及hbvdna表达水平均显著降低,这充分说明ago2以载体形式协同mir-146a发挥调控作用;
总之,通过上述研究方法,我们在hbv扩增感染中发现并证实了一种新的mir-146a→fen1→hbvdna调节轴,如附图9所示,从而更进一步说明了hbvdna复制的具体分子机制,为理解hbv发病机制并开拓新的治愈靶点及方案提供理论依据;为今后深入细致的研究可彻底阐明hbv复制的分子机制,并为清除细胞内cccdna库,完全阻断hbv复制这一治愈目标创造了条件。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
序列表
<110>川北医学院
<120>一种hbv基因组扩增的研究方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>3215
<212>dna
<213>hepatitisbvirus
<400>1
ctccaccactttccaccaaactcttcaagatcccagagtcagggccctgtactttcctgc60
tggtggctccagttcaggaacagtgagccctgctcagaatactgtctctgccatatcgtc120
aatcttatcgaagactggggaccctgtaccgaacatggagaacatcgcatcaggactcct180
aggacccctgctcgtgttacaggcggggtttttcttgttgacaaaaatcctcacaatacc240
acagagtctagactcgtggtggacttctctcaattttctagggggaacacccgtgtgtct300
tggccaaaattcgcagtcccaaatctccagtcactcaccaacctgttgtcctccaatttg360
tcctggttatcgctggatgtgtctgcggcgttttatcatcttcctctgcatcctgctgct420
atgcctcatcttcttgttggttcttctggactatcacggtatgttgcccgtttgtcctct480
aattccaggatcatcaacaaccagcaccggaccatgcaaaacctgcacgactcctgctca540
aggaacctctatgtttccctcatgttgctgtacaaaacctacggacggaaactgcacctg600
tattcccatcccatcatcttgggctttcgcaaaatacctatgggagtgggcctcagtccg660
tttctcttggctcagtttactagtgccatttgttcagtggttcgtagggctttcccccac720
tgtctggctttcagttatatggatgatgtggtattgggggccaagtctgtacaacatctt780
gagtccctttatgccgctgttaccaattttcttttgtctttgggtatacatttaaaccct840
cataaaacaaaaagatggggatattcccttaacttcatgggatatgtaattgggtgttgg900
ggcacattgccacaggaacatattgtacaaaaaatcaaaatgtgttttaggaaacttcct960
gtaaacagacctattgattggaaagtatgtcaacgaattgttggtcttttggggtttgcc1020
gcccctttcacgcaatgtggatatcctgctttaatgcctttatatgcatgtatacaagca1080
aaacaggcttttactttctcgccaacttacaaggcctttctaagtaaacagtatctgaac1140
ctttaccccgttgctcggcaacggtctggtctgtgccaagtgtttgctgacgcaaccccc1200
actggttggggcttggccataggccatcagcgcatgcgtggaacctttgtgtctcctctg1260
ccgatccatactgcggaactcctagccgcttgttttgctcgcagcaggtctggggcaaaa1320
ctcatcgggactgacaattctgtcgtgctctcccgcaagtatacatcgttcccatggctg1380
ctaggctgtgctgccaactggatcctgcgcgggacgtcctttgtttacgtcccgtcggcg1440
ctgaatcccgcggacgacccctcccggggccgcttggggctctaccgcccgcttctccgc1500
ctgttgtaccgaccgaccacggggcgcacctctctttacgcggactccccgtctgtgcct1560
tctcatctaccggaccgtgtgcacttcgcttcacctctgcacgtcgcatggagaccaccg1620
tgaacgcccaccggaacctgcccaaggtcttgcataagaggactcttggactttcagcaa1680
tgtcaacgaccgaccttgaggcatacttcaaagactgtgtgtttactgagtgggaggagt1740
tgggggaggagattaggttaatgatctttgtactcggaggctgtaggcataaattggtgt1800
gttcaccagcaccatgcaactttttcacctctgcctaatcatctcatgttcatgtcctac1860
tgttcaagcctccaagctgtgccttgggtggctttggggcatggacattgacccgtataa1920
agaatttggagcttctgtggagttactctcttttttgccttctgacttctttccttctat1980
tcgagatctcctcgacaccgcctctgctctgtatcgggaggccttagagtctccggaaca2040
ttgttcacctcaccatacggcactaaggcaagctattctgtgttggggtgagttgatgaa2100
tctagccacctgggtgggaagtaatttggaagatccagcatccagggaattagtagtcag2160
ctatgtcaacgttaatatgggcctaaaaatcagacaactattgtggtttcacatttcctg2220
tcttacttttgggagagaaactgttcttgaatatttggtgtcttttggagtgtggattcg2280
cactcctcctgcatatagaccaccaaatgcccctatcttatcaacacttccggaaactac2340
tgttgttagacgaagaggcaggtcccctagaagaagaactccctcgcctcgcagacgaag2400
gtctcaatcgccgcgtcgcagaagatctcaatctcgggaatctcaatgttagtattcctt2460
ggacacataaggtgggaaactttacggggctttattcttctacggtaccttgctttaatc2520
ctaaatggcaaactccttcttttcctgacattcatttgcaggaggacattgttgatagat2580
gtaagcaatttgtggggccccttacagtaaatgaaaataggagactaaaattaattatgc2640
ctgctaggttttatcccaatgttactaaatatttgcccttagataaagggatcaaacctt2700
attatccagagcatgtagttaatcattacttccagacgagacattatttacacactcttt2760
ggaaggcgggtatcttatataaaagagagtccacacgtagcgcctcattttgcgggtcac2820
catattcttgggaacaagatctacagcatgggaggttggtcttcaaaacctcgaaaaggc2880
atggggacaaatctttctgtccccaatcccctgggattcttccccgatcatcagttggac2940
cctgcattcaaagccaactcagaaaatccagattgggacctcaacccgcacaaggacaac3000
tggccggacgccaacaaggtgggagtgggagcattcgggccagggttcatccctccccat3060
gggggactgttggggtggagccctcaggctcagggcatactcacaactgtgccagcagct3120
cctcctcctgcctccaccaatcggcagtcgggaaggcagcctactcccttatctccacct3180
ctaagggacactcatcctcaggccatgcagtggaa3215
- 还没有人留言评论。精彩留言会获得点赞!