一种用于酶底物法检测大肠杆菌的荧光信号增强方法与流程
本发明涉及大肠杆菌检测技术领域,具体涉及一种用于酶底物法检测大肠杆菌的荧光信号增强方法。
背景技术:
大肠杆菌作为粪源性污染的指示微生物,检出意义重大。基于代谢学检测大肠杆菌的方法,因具有检测范围广和准确性高的特点,被广泛采用。通过选择合适的酶底物,如利用e.coli可以产生β-葡萄糖醛酸酶,分解4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)生成具有荧光的4-甲基伞形酮(4-mu)进行检测。具有该代谢途径的大肠杆菌都可以被检出。目前,基于该酶底物法的大肠杆菌检测方法有两种实现方式。一种方式为,国标法(hj1001-2018)规定的多孔板方法,通过一定条件下,培养到底物充分反应的时间(mug几乎全部转化为4-mu),在紫外灯下计数有荧光的格子,然后查表得出样品中大肠杆菌的最大可能数mpn。但是该方法不能区分加入样品时,每个格子中大肠杆菌的数量差异,在反应的终点(一般为24-48h),可计数的只能是有荧光和无荧光的格子。另一种方式为,基于4-mu的产量与加样时样品中大肠杆菌浓度在一定时间内成线性关系的原理,建立4-mu的发射峰强度与大肠杆菌浓度的关系,从而检测大肠杆菌。该方法可以给出大肠杆菌的具体浓度值,但是由于底物mug在产物4-mu的发射峰位置也有荧光强度,所以当样品中大肠杆菌含量极少时,产生的4-mu的量很少,产物信号与底物信号不能分开。
技术实现要素:
本发明要解决现有技术中的技术问题,提供一种用于酶底物法检测大肠杆菌的荧光信号增强方法。
为了解决上述技术问题,本发明的技术方案具体如下:
本发明提供一种用于酶底物法检测大肠杆菌的荧光信号增强方法,该方法针对的酶底物是4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug);
其特征在于,
在大肠杆菌与酶底物培养基温育结束之后,测量产物荧光之前,增加一步操作;所述操作为以碱性试剂将溶液调节至ph≥9之后,再测量产物荧光。
在上述技术方案中,优选的是:调节溶液ph为9,10,11,或13。
在上述技术方案中,所述碱性试剂包括但不局限于naoh,koh,氨水等,优选的是:所述碱性试剂为naoh、koh、及氨水中的一种或多种。
在上述技术方案中,进一步优选的是:所述用于酶底物法检测大肠杆菌的荧光信号增强方法的一种具体实施方式为:
步骤1、配制含mug成分的培养液;
步骤2、将纯培养大肠杆菌逐级稀释得到的标准样品或者实际待测样品与步骤1的培养液混合;纯培养大肠杆菌标准样品的具体浓度用平板计数法(cfu)定量;
步骤3、将步骤2的培养液于35-44℃温育至产生4-甲基伞形酮;
步骤4、将温育结束后的培养液加碱性试剂调节至ph≥9;
步骤5、测量荧光强度,366nm激发,读取450nm处的发射峰峰值;
步骤6、利用纯培养大肠杆菌标准样品的浓度梯度,及步骤4的发射峰峰值绘制标准曲线;将步骤4中测得的实际待测样品在450nm处的发射峰峰值代入标准曲线,计算得出待测样品中大肠杆菌的浓度。
本发明的有益效果是:
本发明提供一种用于酶底物法检测大肠杆菌的荧光信号增强方法,通过对现有方法增加一步操作,即在大肠杆菌与酶底物培养基温育结束之后,测量产物荧光之前,使用碱性试剂调节溶液至ph≥9,再测量产物荧光;使用碱性试剂调节溶液至ph≥9,可以使产物4-mu的吸收峰明显增强,底物mug吸收峰变化很小,从而将产物信号与本底信号分开,达到使扣除空白的产物荧光强度差值增强5倍以上,适用于mug酶底物法检测大肠杆菌,对低浓度大肠杆菌检测效果好。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细说明。
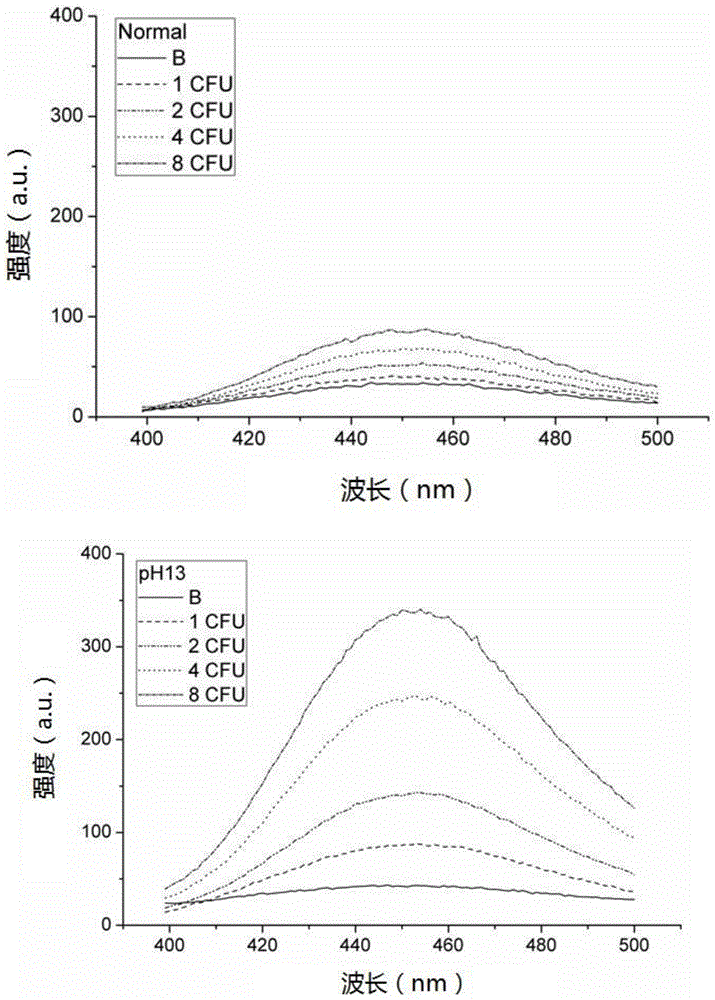
图1为用本发明实施例1的检测大肠杆菌的方法检测低浓度大肠杆菌不经过产物信号增强和naoh调节ph为13条件下的产物信号增强的对比图。
图2为用本发明实施例2的检测大肠杆菌的方法检测低浓度大肠杆菌不经过产物信号增强和naoh调节ph为10条件下的产物信号增强的对比图。
图3用本发明实施例3的检测大肠杆菌的方法检测低浓度大肠杆菌不经过产物信号增强和koh调节ph为11条件下的产物信号增强的对比图。
图4用本发明实施例4的检测大肠杆菌的方法检测低浓度大肠杆菌不经过产物信号增强和氨水调节ph为9条件下的产物信号增强的对比图。
具体实施方式
下面结合附图对本发明做以详细说明。
实施例1
步骤1.购买市售含mug酶底物培养基,1l培养基含以下试剂成分:
4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)75.0mg
胰蛋白胨10.0g
硫酸铵[(nh4)2so4]5.0g
硫酸锰(mnso4)0.5mg
硫酸锌(znso4)0.5mg
硫酸镁(mgso4)100.0mg
氯化钠(nacl)10.0g
氯化钙(cacl2)50.0mg
亚硫酸钠(na2so3)40.0mg
kh2po40.9g
na2hpo46.2g
步骤2.以无菌操作接种e.coliatcc25922于lb培养基中,培养至稳定期,37℃,220转/分钟条件下大约需要12h。将培养后的e.coli离心清洗3次,定量od600=0.2为菌液a,菌液a稀释105为菌液b。接种50μl菌液b,用平板计数法得到30±3cfu大肠杆菌。菌液b稀释十倍后,分别接种17μl,33μl,67μl,134μl于5ml培养基中,空白(b)加入50μl0.9%nacl溶液。由cfu定量结果计算依次含有大肠杆菌1,2,4,8cfu。
步骤3.将步骤2的培养液于37℃温育20h。
步骤4.步骤3的溶液每一管均分为两份,其中一份溶液加naoh调节至ph=13(标记为ph13),另一份溶液正常测荧光做对照(标记为normal)。
步骤5.步骤4所述两份溶液测量荧光强度。激发366nm,读取450nm处发射峰峰值。
步骤6.结果参见图1:由标记为normal和ph13的两个溶液荧光测量结果可见,相同浓度样品的扣除空白荧光强度值增加5倍,灵敏度显著提高。
实施例2
步骤1.购买市售na-mug培养基,并按照说明书配制溶液,1l含量:
牛肉浸膏3.0g
胰蛋白胨5.0g
mug100mg
步骤2.同实施例1步骤2所述。
步骤3.将步骤2的培养液于44℃温育12h。
步骤4.步骤3的溶液每一管均分为两份,其中一份溶液加naoh调节至ph=10(标记为ph10),另一份溶液正常测荧光做对照(标记为normal)。
步骤5.步骤4所述两份溶液测量荧光强度。激发366nm,读取450nm处发射峰峰值。
步骤6.结果参见图2:由标记为normal和ph10的两个溶液荧光测量结果可见,相同浓度样品的扣除空白荧光强度值增加近5倍,灵敏度显著提高。
实施例3
步骤1.购买市售mmo-mug培养基,并按照说明书配制溶液,1l含量:
硫酸铵5.0g
硫酸锰0.5mg
硫酸锌0.5mg
硫酸镁100mg
氯化钠10.0g
氯化钙50.0mg
亚硫酸钠40.0mg
onpg500mg
mug75mg
hepes6.9g
hepes钠盐5.3g
两性霉素b1.0mg
solanium萃取物500mg
步骤2.同实施例1的步骤2所述。
步骤3.将步骤2的培养液于35℃温育26h。
步骤4.步骤3的溶液每一管均分为两份,其中一份溶液加koh调节至ph=11(标记为ph11),另一份溶液正常测荧光做对照(标记为normal)。
步骤5.步骤4所述两份溶液测量荧光强度。激发366nm,读取450nm处发射峰峰值。
步骤6.结果参见图3:由标记为normal和ph11的两个溶液荧光测量结果可见,相同浓度样品的扣除空白荧光强度值增加5倍,灵敏度显著提高。
实施例4
步骤1.购买市售ec-mug培养基,并按照说明书配制溶液,1l含量:
乳糖5.0g
蛋白胨20.0g
氯化钠5.0g
mug50mg
kh2po41.5g
k2hpo44.0g
胆盐1.5g
步骤2.以无菌操作接种e.colidh5α于lb培养基中,培养至稳定期,37℃,220转/分钟条件下大约需要12h。将培养后的e.coli离心清洗3次,定量od600=0.2为菌液a,菌液a稀释105为菌液b。接种50μl菌液b,用平板计数法得到30±3cfu大肠杆菌。菌液b稀释十倍后,分别接种17μl,84μl,167μl于5ml培养基中,空白(b)加入50μl0.9%nacl溶液。由cfu定量结果计算依次含有大肠杆菌1,5,10cfu。
步骤3.将步骤2的培养液于37℃温育15h。
步骤4.步骤3的溶液每一管均分为两份,其中一份溶液加氨水调节至接近ph=9(标记为ph9),另一份溶液正常测荧光做对照(标记为normal)。
步骤5.步骤7所述两份溶液测量荧光强度。激发366nm,读取450nm处发射峰峰值。
步骤6.结果参见图4:由标记为normal和ph9的两个溶液荧光测量结果可见,相同浓度样品的扣除空白荧光强度值增加近5倍,灵敏度显著提高。
实施例5
步骤1.购买市售mug培养基,并按照说明书配制溶液,1l含量:
胨10.0g
硫酸锰0.5mg
硫酸锌0.5mg
硫酸镁0.1g
氯化钠5.0g
氯化钙50.0mg
磷酸二氢钾0.9g
磷酸氢二钠6.2g
亚硫酸钠40.0mg
去氧胆酸钠1.0g
mug75mg
步骤2.纯培养大肠杆菌标准样品:以无菌操作接种e.coliatcc25922于lb培养基中,培养至稳定期,37℃,220转/分钟条件下大约需要12h。将培养后的e.coli离心清洗3次,定量od600=0.2为菌液a,菌液a稀释105为菌液b。接种50μl菌液b,用平板计数法得到30±3cfu大肠杆菌。菌液b稀释十倍后,分别接种17μl,33μl,67μl,134μl,200μl于5ml培养基中,空白(b)加入50μl0.9%nacl溶液。由cfu定量结果计算依次含有大肠杆菌1,2,4,8,12cfu。
实际水样为自来水、花园土浸出液和游泳池水。调节ph至7,不做其他处理,取样后即刻检测。每个水样取平行样6份,每份体积为100ml,分为2组。其中一组处理为,每管水样经无菌滤器过滤后加入步骤1mug培养基5ml,另一组水样用于平板计数。
步骤3.将步骤2的培养液于37℃温育15h。
步骤4.步骤3的溶液每一管均分为2份,其中一份溶液加naoh调节至ph=10(标记为信号增强),另一份溶液不做信号增强做对照(标记为normal)。
步骤5.步骤4所述两份溶液测量荧光强度。激发366nm,读取450nm处发射峰峰值。
步骤6.结果:将步骤5中纯培养大肠杆菌标准样品的浓度与荧光峰值,绘制标准曲线。实际水样的荧光峰值带入标准曲线,换算得出实际水样样品的大肠杆菌浓度值,见列表。可见,针对极低浓度大肠杆菌检测,本实例中为游泳池水样,采用本发明提供的增加一步用碱性试剂调节至ph≥9的方法比没有此步骤的方法更灵敏。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!