金属有机框架材料及其制备方法、免疫传感器与流程
本发明涉及一种金属有机框架材料及其制备方法、免疫传感器,属于金属有机框架材料和生物传感器
技术领域:
。
背景技术:
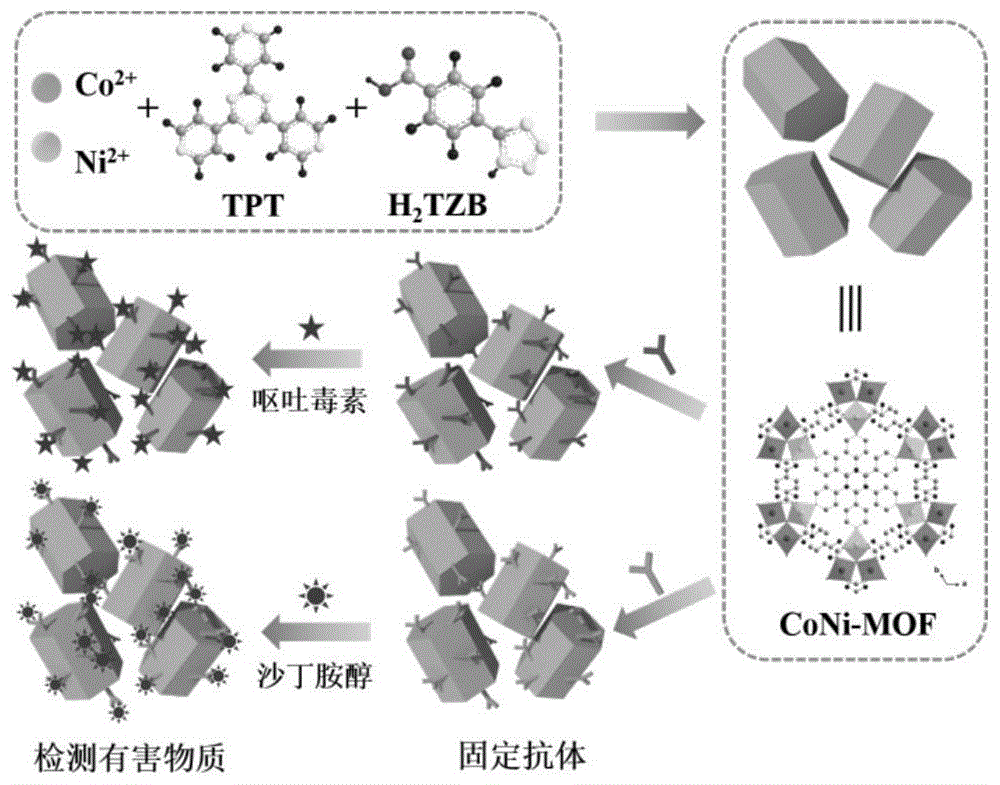
:免疫传感器发展很快,已逐渐应用于食品、工业、环境检测和临床医学等领域。免疫传感器作为一种新兴的生物传感器,以其鉴定物质的高度特异性、敏感性和稳定性受到青睐,它的问世使传统的免疫分析发生了很大的变化。它将传统的免疫测试和生物传感技术融为一体,集两者的诸多优点于一身,不仅减少了分析时间、提高了灵敏度和测试精度,也使得测定过程变得简单,易于实现自动化,有着广阔的应用前景。随着生物工程技术的发展,已经研制出能对各种微生物、细胞表面抗原或各种蛋白质抗原分泌单克隆抗体的融合细胞,由这些细胞产生的单克隆抗体,已广泛进入生物学及其他领域。免疫传感器主要由生物识别元件和信号传感器组成,其中传感器由修饰层、电极基片和电子检测系统组成。通常,有机分子和/或纳米材料(例如碳纳米材料,量子点,聚合物膜和有机纳米粒子)被用作连接抗体探针和基质的支撑材料。然而,大多纳米材料通常表现出相对较少的锚定位点和较低的检测灵敏度。基于这些材料的适体传感器在生物传感领域的应用受到了限制。mofs是金属有机框架材料(英文名称metalorganicframework)的简称,是由无机金属中心(金属离子或金属簇)与桥连的有机配体通过自组装相互连接,形成的一类具有周期性网络结构的晶态多孔材料。mofs是一种有机-无机杂化材料,也称配位聚合物(coordinationpolymer),它既不同于无机多孔材料,也不同于一般的有机配合物,兼有无机材料的刚性和有机材料的柔性特征,使其在现代材料研究方面呈现出巨大的发展潜力和诱人的发展前景,有望用作电化学免疫传感器的纳米材料。金属有机框架材料(mofs)与抗体结合可用于检测各种有害物质。比如,以呕吐毒素(don)和沙丁胺醇(sal)为例,对其检测需求进行说明。在世界范围内,食源性疾病由于发病率和死亡率的增加而受到广泛关注。许多物质,例如非法食品添加剂、霉菌毒素、重金属离子或有机污染物等,在食品生产过程中的任何步骤都可能成为污染物,从而威胁到人身安全。作为一种常见的霉菌毒素,呕吐毒素(don)对人体和动物都非常有害,因为它可通过与核糖体肽基转移酶结合来抑制dna、rna和蛋白质的合成,并产生一系列急性效应,例如恶心、呕吐、头晕和发烧等。欧洲委员会已经确定了don的最高含量(谷物中为1.25ppm;谷物类食品和婴儿食品为0.2ppm)。此外,作为β-兴奋剂家族的成员,沙丁胺醇(sal)被发现在畜牧业中非法用作生长促进剂,以提高饲料的效率并提高许多物种的瘦脂比,从而带来经济效益。sal的残留物留在动物组织中可能威胁到公众健康,包括心悸、心跳过速、神经过敏、肌肉震颤和其他中毒症状。因此,为了确保人类健康,避免食品安全恐慌并减少随后的经济损失,开发高灵敏度、高选择性和可靠的分析方法以便对这些痕量有害物质进行简便有效的识别和定量检测是至关重要的。目前,已经开发出了多种分析方法来检测食品中的don和sal,包括高效液相色谱(hplc)、高效薄层色谱(hp-tlc)、气相色谱-质谱(gc-ms)、液相色谱-质谱(lc-ms)、酶联免疫吸附测定法(elisa)、表面等离子体共振(spr)和电化学技术等。尽管已投入大量精力来使用传统方法从食品或环境中检测痕量有害物质,但是它们固有的缺点,如耗时、仪器昂贵、样品预处理步骤复杂、材料消耗大以及需要专业人员等,极大地限制了它们的广泛应用。在这些方法中,电化学技术显示出卓越的传感性能和优势,例如快速响应、简单、成本低以及与先进的微加工技术的出色兼容性等。迄今为止,已经开发出许多基于单克隆抗体、dna核酸适体和抗体片段的电化学免疫传感器,用于检测食品中的don和sal。然而,目前的电化学免疫传感器总是涉及复杂的构筑过程或采用夹心型结构,这使得对don和sal的检测更加耗时,且灵敏度较低。因此,如何可行地构筑具有高传感效率的电化学免疫传感器以灵敏性地识别痕量有害物质成为了一个巨大的挑战。技术实现要素:本发明的目的在于提供一种金属有机框架材料,具有良好的稳定性、生物相容性和电化学活性。本发明的另一个目的在于提供一种金属有机框架材料的制备方法。本发明目的还在于提供一种免疫传感器。本发明的技术方案如下:一种金属有机框架材料,所述金属有机框架材料包括金属离子和与金属离子进行配位的有机配体,所述有机配体为含苯甲酸基团的化合物和含吡啶基团的化合物;所述金属离子为二价软酸类金属离子。本发明的金属有机框架材料中,采用含苯甲酸基团的化合物和含吡啶基团的化合物作为有机配体,含苯甲酸基团的化合物中的苯甲酸基团可与抗体中的氨基发生静电相互作用,从而实现抗体在金属有机框架材料表面的大量固定,且该金属有机框架材料中的金属离子是在同一框架中占据不同节点形成真正的同构型双金属mofs,具有良好的稳定性、生物相容性和电化学活性。有机配体以金属离子为配位中心形成配位,含苯甲酸基团的化合物中羧基上的氧可与金属离子形成配位,一个羧基可提供一对可参与配位的孤对电子。含吡啶基团的化合物中的吡啶基上的氮可与金属离子形成配位,一个吡啶基可提供一对可参与配位的孤对电子。对于含苯甲酸基团的化合物的具体种类不作限定,只要能够提供可参与配位的苯甲酸基团即可,优选地,所述含苯甲酸基团的化合物为4-(1h-四唑-5-基)苯甲酸、4-氰基苯甲酸、对肼基苯甲酸或苯甲酸。这些有机配体可使得金属有机框架材料具有良好的稳定性、生物相容性和电化学活性。对于含吡啶基团的化合物的具体种类不作限定,只要能够提供可参与配位的吡啶基团即可,所述含吡啶基团的化合物为2,4,6-三(4-吡啶基)-1,3,5-三嗪、1,3,5-三(4-吡啶基)苯、1,4-二(对吡啶基)苯或2,6-二甲基吡啶。这些有机配体可使得金属有机框架材料具有良好的稳定性、生物相容性和电化学活性。为了进一步提高金属有机框架材料的稳定性、生物相容性和电化学活性,优选地,所述含苯甲酸基团的化合物中的羧基与含吡啶基团的化合物中的吡啶基的摩尔比为1:1~4:1。对于金属元素的具体种类不作限定,只要能够与含苯甲酸基团的化合物和含吡啶基团的化合物配位形成金属有机框架材料即可,优选地,所述金属有机框架材料中的金属离子为co2+、ni2+、fe2+、mn2+中的一种或两种以上。这些金属离子与含苯甲酸基团的化合物和含吡啶基团的化合物复合得到的金属有机框架材料具有良好的稳定性、生物相容性和电化学活性。可以理解的是,金属有机框架材料记为m-mof(一种金属离子)、m1m2-mof(两种金属离子),依次类推。优选地,所述金属有机框架材料中的金属离子为co2+和/或ni2+。对应的金属有机框架材料记为co-mof、ni-mof、coni-mof。优选地,所述金属有机框架材料中的金属离子为co2+和ni2+;所述co2+和ni2+的摩尔比为1:2~2:1。金属有机框架材料中的金属元素为钴离子和镍离子时,即为双金属有机框架材料,记为coni-mof,coni-mof与抗体之间存在π-π*堆积和多价态亲和作用,在使用电化学技术进行测定时,coni-mof对待测的分析物具有出色的生物传感能力。通过合理地调整和优化钴离子和镍离子的相对用量,得到具有良好稳定性、生物相容性和电化学活性的双金属有机框架材料coni-mof。应当理解的是,苯甲酸中羧基中的氧和吡啶基中的氮本身为电负性较强的元素,可以从相邻的碳元素那里吸引电子,使他们自身呈现富电子性,带负电,因此他们会提供孤对电子,与钴镍正离子相配位,从而使材料的整体价态为中性。一种金属有机框架材料的制备方法,包括以下步骤:对包含可溶性金属盐、含苯甲酸基团的化合物、含吡啶基团的化合物和有机溶剂的混合液进行加热反应,得到金属有机框架材料。应当理解的是,可溶性金属盐中的金属离子可以是一种,也可以是两种或两种以上,不论金属离子是一种,还是两种,金属离子均是在同一框架中占据不同节点形成真正的同构型双金属mofs。本发明的金属有机框架材料的制备方法中,直接将可溶性金属盐和有机配体加入有机溶剂中进行反应,有利于金属离子在同一框架中占据不同节点形成同构型双金属mofs。该方法可有效制得同构型双金属mofs,且制备方法简单易操作,可控性好。可以理解的是,可溶性金属盐中的金属离子与有机配体(含苯甲酸基团的化合物、含吡啶基团的化合物)的用量是刚好全部配位的。含苯甲酸基团的化合物中羧基上的氧可与金属离子形成配位,一个羧基可提供一对可参与配位的孤对电子。含吡啶基团的化合物中的吡啶基上的氮可与金属离子形成配位,一个吡啶基可提供一对可参与配位的孤对电子。优选地,所述可溶性金属盐为二价钴盐、二价镍盐、二价铁盐、二价锰盐中的一种或两种以上。对于可溶性金属盐的种类不作限定,只要能够溶解在体系中即可,优选地,所述可溶性金属盐为二价钴盐和/或二价镍盐;所述二价钴盐为硝酸钴、甲酸钴、乙酸钴、盐酸钴、硫酸钴;所述二价镍盐为硝酸镍、甲酸镍、乙酸镍、盐酸镍、硫酸镍。二价钴盐和/或二价镍盐可成功与含苯甲酸基团的化合物、含吡啶基团的化合物这两种有机配体进行配位。优选地,所述二价钴盐中的钴元素与二价镍盐中的镍元素的摩尔比为1-2:1-2。优选地,所述含苯甲酸基团的化合物为4-(1h-四唑-5-基)苯甲酸、4-氰基苯甲酸、对肼基苯甲酸或苯甲酸;优选地,所述含吡啶基团的化合物为2,4,6-三(4-吡啶基)-1,3,5-三嗪、1,3,5-三(4-吡啶基)苯、1,4-二(对吡啶基)苯或2,6-二甲基吡啶。优选地,所述含苯甲酸基团的化合物中的羧基与含吡啶基团的化合物中的吡啶基的摩尔比为1:1~4:1。为了提高制得的金属有机框架材料的纯度,优选地,所述混合液还包含四氟硼酸。为了进一步提高金属有机框架材料的纯度,优选地,所述四氟硼酸在混合液中的体积分数为12%~15%。优选地,所述反应的温度为120℃-150℃,所述反应的时间为12h-24h。通过合理调整和优化反应的温度和时间,可保证高效制得金属有机框架材料。优选地,所述有机溶剂为极性有机溶剂。优选地,所述极性有机溶剂为二甲基甲酰胺。二甲基甲酰胺简称为dmf。一种免疫传感器,所述免疫传感器包括电极、涂覆在电极表面的金属有机框架材料和锚定在金属有机框架材料表面的抗体;所述抗体为抗体;所述金属有机框架材料中的有机配体为含苯甲酸基团的化合物和含吡啶基团的化合物。本发明的免疫传感器,利用含苯甲酸基团的化合物和含吡啶基团的有机配体与金属离子形成的金属有机框架材料为电极材料,制得的免疫传感器具有良好的选择性、稳定性、重现性、再生性和适用性,且检测限低。以coni-mof为例,双金属coni-mof作为构筑电化学免疫传感器的平台,以检测don或sal为例,将基于coni-mof的免疫传感器用于检测痕量don或sal,由于4-(1h-四唑-5-基)苯甲酸(h2tzb)的羧基与抗体的氨基之间的静电相互作用,π-π*堆积力和范德华力等,don或sal的抗体可以吸附到coni-mof上以构筑免疫传感器。然后,吸附的抗体可以与don或sal进行特异性结合,从而识别灵敏性识别。coni-mof对抗体-靶标复合物表现出很高的稳定能力。对于抗体的种类不作限定,可根据要检测的物质种类,对应地选用本领域常规的抗体即可。优选地,所述抗体为呕吐毒素抗体或沙丁胺醇抗体。呕吐毒素简称为don,沙丁胺醇简称为sal。优选地,所述含苯甲酸基团的化合物为4-(1h-四唑-5-基)苯甲酸、4-氰基苯甲酸、对肼基苯甲酸或苯甲酸;所述含吡啶基团的化合物为2,4,6-三(4-吡啶基)-1,3,5-三嗪、1,3,5-三(4-吡啶基)苯、1,4-二(对吡啶基)苯或2,6-二甲基吡啶。优选地,所述含苯甲酸基团的化合物中的羧基与含吡啶基团的化合物中的吡啶基的摩尔比为1:1~4:1。优选地,所述金属有机框架材料中的金属离子为co2+、ni2+、fe2+、mn2+中的一种或两种以上。优选地,所述金属有机框架材料中的金属离子为co2+和/或ni2+。优选地,所述金属有机框架材料中的金属离子为co2+和ni2+;所述co2+和ni2+的摩尔比为1:2~2:1。优选地,所述电极为裸金电极或玻碳电极。以coni-mof为例,对coni-mof的性能进行说明,通过使用h2tzb和2,4,6-三(4-吡啶基)1,3,5-三嗪(tpt)作为混合有机配体,与钴离子和镍离子组装,合成出一种新型的coni基双金属mof,即coni-mof。然后,以检测don或sal为例,将coni-mof用作新型传感平台,用于分别结合don或sal的抗体以检测don或sal。双金属coni-mof对抗体显示出比单独的co-mof和ni-mof更强的亲和作用,从而显示出更高的检测灵敏度。与常规电化学传感器相比,基于coni-mof的免疫传感器明显具有两个优势:(i)由于coni-mof良好的生物相容性和对抗体的多价态亲和作用,抗体可通过静电相互作用或π-π*堆积作用来大量吸附在coni-mof上;(ii)由于抗体和靶向分子之间的特异性免疫识别,使得该传感器具有良好的生物传感性能,如高灵敏度、选择性和稳定性等。因此,基于coni-mof的传感器对不同分析物的检测限极低,并且具有高选择性、良好的重现性、可接受的稳定性以及在不同环境中的良好适用性。本发明为检测痕量有害物质提供了有效方式,拓宽了mofs材料的应用领域。附图说明图1为coni-mof(1:1)基免疫传感器用于检测呕吐毒素和沙丁胺醇的示意图;图2为试验例1中co-mof、ni-mof、coni-mof(1:1)、coni-mof(2:1)和coni-mof(1:2)的sem图;图3为试验例2中co-mof、ni-mof和coni-mof的xps全谱;图4为试验例2中co-mof、ni-mof和coni-mof的c1s、n1s和o1s化学成分的高分辨xps能谱;图5为试验例2中co-mof、ni-mof和coni-mof的高分辨xps能谱;图6为试验例3中(i)co-mof、(ii)ni-mof和(iii)coni-mof的xrd图谱和ft-ir光谱;图7为试验例4中coni-mof、co-mof和ni-mof对应的免疫传感器的cv曲线;图8为试验例4中eisnyquist图和等效电路;图9为试验例4中coni-mof(1:1)、co-mof、ni-mof、coni-mof(2:1)和coni-mof(1:2)对应的免疫传感器的eis曲线;图10为试验例4中基于co-mof、ni-mof和coni-mof的免疫传感器检测don时每个阶段的δrct值差异;图11为试验例4中coni-mof基免疫传感器的不同浓度的coni-mof、不同浓度的抗体溶液、不同孵育时间的影响;图11a为不同浓度的coni-mof对应的免疫传感器检测don时每个阶段的δrct值差异,图11b为不同浓度的抗体溶液对don检测的影响,图11c为coni-mof基免疫传感器在don溶液(10ng·ml-1)中孵育不同时间的eis谱图,图11d为coni-mof基免疫传感器在don溶液(10ng·ml-1)中孵育不同时间的δrct值;图12为试验例4中基于coni-mof(1:1)、coni-mof(2:1)和coni-mof(1:2)的免疫传感器的cv曲线和eis谱图;图13为试验例5中用于检测don的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性;图14为试验例5中用于检测sal的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性。具体实施方式下面结合具体实施方式对本发明作进一步说明。本发明的实施例中,以镍和钴为例,对金属有机框架材料的制备方法进行说明,本发明的试验例中,以镍和钴为例,对钴和/或镍对应的金属有机框架材料co-mof、ni-mof、coni-mof的制备方法和性能进行说明,在检测coni-mof基生物传感器的性能时,以检测don或检测sal为例,对coni-mof基生物传感器的各性能(选择性、稳定性、重现性、再生性和适用性等性能)进行说明。本发明实施例和试验例中所采用材料、化学品和各溶液的配制如下所示:1、材料和化学品co(no3)2·6h2o、ni(no3)2·6h2o、4-(1h-四唑-5-基)苯甲酸(h2tzb)、2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)和二甲基甲酰胺(dmf)购自国药集团化学试剂有限公司,材料纯度均为99%。强力霉素(dox)、氧氟沙星(oflx)、链霉素(stp)、黄曲霉毒素(aft)、青霉素(pnc)、盐酸克仑特罗(clb)、尿素、尿酸(ua)、don、sal、don的抗体(abdon)和sal的抗体(absal)购自索莱宝生命科学有限公司。所有实验均使用超纯水(18.2ω·cm-1)。所有其他试剂均为分析纯,无需进一步纯化即可直接使用。2、所有溶液的配制通过在超纯水中混合0.242gkh2po4、1.445gna2hpo4·12h2o,0.200gkcl和8.003gnacl制备1.0l磷酸盐缓冲溶液(pbs)。然后通过添加0.1mhcl溶液将pbs的ph调节至7.4。使用前,通过将1.650g的k3fe(cn)6和2.111g的k4fe(cn)6溶解在1.0l的pbs中制备电解液。分别添加9.9mlpbs(ph7.4)和100μlabdon或absal原液(10μm)来配制浓度为100nm的abdon或absal溶液。在0.01mpbs中配制不同浓度的don和sal溶液(即0.001、0.005、0.01、0.05、0.1和0.5ng·ml-1)。所有溶液在每次实验前新鲜配制,并保存在4℃下直至使用。一、本发明的金属有机框架材料的具体实施例如下:实施例1本实施例的金属有机框架材料co-mof,所述金属有机框架材料包括金属元素co和与金属元素co进行配位的有机配体,有机配体为4-(1h-四唑-5-基)苯甲酸(h2tzb)和2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)。其中,h2tzb与tpt的摩尔比为4:1。金属有机框架材料co-mof中的金属元素为钴元素,钴元素为co2+和/或co3+。钴元素与h2tzb、tpt的摩尔比为4:4:1。实施例2本实施例的金属有机框架材料ni-mof,所述金属有机框架材料包括金属元素ni和与金属元素ni进行配位的有机配体,有机配体为4-(1h-四唑-5-基)苯甲酸(h2tzb)和2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)。其中,h2tzb与tpt的摩尔比为4:1。金属有机框架材料ni-mof中的金属元素为镍元素,镍元素为ni2+和/或ni3+。镍元素与h2tzb、tpt的摩尔比为4:4:1。实施例3本实施例的金属有机框架材料coni-mof(1:1),所述金属有机框架材料coni-mof(1:1)包括金属元素(co和ni)和与金属元素(co和ni)进行配位的有机配体,有机配体为4-(1h-四唑-5-基)苯甲酸(h2tzb)和2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)。其中,h2tzb与tpt的摩尔比为4:1。金属有机框架材料coni-mof(1:1)中的金属元素为钴元素和镍元素,钴元素为co2+和/或co3+,镍元素为ni2+和/或ni3+。钴元素、镍元素的摩尔比为1:1,金属元素(钴元素、镍元素)、h2tzb、tpt的摩尔比为4:4:1。实施例4本实施例的金属有机框架材料coni-mof(2:1),所述金属有机框架材料coni-mof(2:1)包括金属元素(co和ni)和与金属元素(co和ni)进行配位的有机配体,有机配体为4-(1h-四唑-5-基)苯甲酸(h2tzb)和2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)。其中,h2tzb与tpt的摩尔比为4:1。金属有机框架材料coni-mof(2:1)中的金属元素为钴元素和镍元素,钴元素为co2+和/或co3+,镍元素为ni2+和/或ni3+。钴元素、镍元素的摩尔比为2:1,金属元素(钴元素、镍元素)、h2tzb、tpt的摩尔比为4:4:1。实施例5本实施例的金属有机框架材料coni-mof(1:2),所述金属有机框架材料coni-mof(1:2)包括金属元素(co和ni)和与金属元素(co和ni)进行配位的有机配体,有机配体为4-(1h-四唑-5-基)苯甲酸(h2tzb)和2,4,6-三(4-吡啶基)-1,3,5-三嗪(tpt)。其中,h2tzb与tpt的摩尔比为4:1。金属有机框架材料coni-mof(1:2)中的金属元素为钴元素和镍元素,钴元素为co2+和/或co3+,镍元素为ni2+和/或ni3+。钴元素、镍元素的摩尔比为1:2,金属元素(钴元素、镍元素)、h2tzb、tpt的摩尔比为4:4:1。二、本发明的金属有机框架材料的制备方法的具体实施例如下:实施例6本实施例的金属有机框架材料的制备方法,制得的是实施例1的金属有机框架材料co-mof,包括以下步骤:将co(no3)2·6h2o(29.1mg,0.1mol)、h2tzb(19mg,0.1mol)、tpt(7.8mg,0.025mol)、dmf(5ml)和hbf4(0.8ml)混合在一起并超声20min后完全溶解,得到均匀的混合液。然后将混合液密封在不锈钢反应釜中,并在烘箱中于120℃下反应24h。冷却至室温后,收集晶体并用dmf洗涤3次,得到的产品即为co-mof。实施例7本实施例的金属有机框架材料的制备方法,制得的是实施例2的金属有机框架材料ni-mof,包括以下步骤:将ni(no3)2·6h2o(29.1mg,0.1mol)、h2tzb(19mg,0.1mol)、tpt(7.8mg,0.025mol)、dmf(5ml)和hbf4(0.8ml)混合在一起并超声20min后完全溶解,得到均匀的混合液。然后将混合液密封在不锈钢反应釜中,并在烘箱中于120℃下反应24h。冷却至室温后,收集晶体并用dmf洗涤3次,得到的产品即为ni-mof。实施例8本实施例的金属有机框架材料的制备方法,制得的是实施例3的金属有机框架材料coni-mof(1:1),包括以下步骤:将co(no3)2·6h2o(14.55mg,0.05mol)、ni(no3)2·6h2o(14.55mg,0.05mol)、h2tzb(19mg,0.1mol)、tpt(7.8mg,0.025mol)、dmf(5ml)和hbf4(0.8ml)混合在一起并超声20min后完全溶解,得到均匀的混合液。然后将混合液密封在不锈钢反应釜中,并在烘箱中于120℃下反应24h。冷却至室温后,收集晶体并用dmf洗涤3次,得到的产品即为coni-mof(1:1)。实施例9本实施例的金属有机框架材料的制备方法,制得的是实施例4的金属有机框架材料coni-mof(2:1),包括以下步骤:将co(no3)2·6h2o(19.4mg,0.067mol)、ni(no3)2·6h2o(9.7mg,0.033mol)、h2tzb(19mg,0.1mol)、tpt(7.8mg,0.025mol)、dmf(5ml)和hbf4(0.8ml)混合在一起并超声20min后完全溶解,得到均匀的混合液。然后将混合液密封在不锈钢反应釜中,并在烘箱中于120℃下反应24h。冷却至室温后,收集晶体并用dmf洗涤3次,得到的产品即为coni-mof(2:1)。实施例10本实施例的金属有机框架材料的制备方法,制得的是实施例5的金属有机框架材料coni-mof(1:2),包括以下步骤:将co(no3)2·6h2o(9.7mg,0.033mol)、ni(no3)2·6h2o(19.4mg,0.067mol)、h2tzb(19mg,0.1mol)、tpt(7.8mg,0.025mol)、dmf(5ml)和hbf4(0.8ml)混合在一起并超声20min后完全溶解,得到均匀的混合液。然后将混合液密封在不锈钢反应釜中,并在烘箱中于120℃下反应24h。冷却至室温后,收集晶体并用dmf洗涤3次,得到的产品即为coni-mof(1:2)。三、本发明的免疫传感器的具体实施例如下:实施例11本实施例的免疫传感器,包括空白金电极、涂覆在空白金电极表面的金属有机框架材料和锚定在金属有机框架材料表面的don抗体。其中,金属有机框架材料为实施例1的金属有机框架材料co-mof。本实施例的免疫传感器的制备方法,包括以下步骤:(1)空白金电极的预处理使用前对直径为0.5mm的空白金电极(ae)进行清洁。用0.05μm的氧化铝浆料抛光ae,然后分别在混合溶液(v/v,3:1的h2so4/h2o2)、乙醇和水中超声处理15min。随后,通过在0.5mh2so4中从-0.2到1.6v的氧化和还原循环对ae进行电化学清洗,然后用超纯水冲洗,并在n2流下干燥。(2)涂覆金属有机框架材料将5μl的co-mof悬浮液(1mg·ml-1)涂在经过预处理的ae表面,并在n2流中干燥。其次,将co-mof修饰的ae浸入0.1m的pbs(ph=7.4)中,以除去结合较弱的材料,用于进一步的测试(记为co-mof/ae)。(3)锚定抗体在室温下将co-mof/ae在abdon溶液(10ng·ml-1)中孵育2h,以确保抗体锚定在电极表面上直至饱和(记为abdon/co-mof/ae)。然后,将abdon/co-mof/ae用pbs充分冲洗,并在温和的n2流中干燥。最后,得到abdon/co-mof/ae免疫传感器,并将其用于进一步的电化学测试。实施例12-实施例15实施例12-实施例15的免疫传感器,与实施例11的免疫传感器的不同之处仅在于,金属有机框架材料的种类不同,实施例12涉及的金属有机框架材料为实施例2的金属有机框架材料ni-mof,实施例13涉及的金属有机框架材料为实施例3的金属有机框架材料coni-mof(1:1),实施例14涉及的金属有机框架材料为实施例4的金属有机框架材料coni-mof(2:1),实施例15涉及的金属有机框架材料为实施例5的金属有机框架材料coni-mof(1:2),其它结构均同实施例11。相应地,涂覆有实施例12-实施例15的金属有机框架材料的修饰电极依次记为ni-mof/ae、coni-mof(1:1)/ae、coni-mof(2:1)/ae、coni-mof(1:2)/ae。锚定抗体后得到的实施例12-实施例15的免疫传感器依次记为abdon/ni-mof/ae、abdon/coni-mof(1:1)/ae、abdon/coni-mof(2:1)/ae、abdon/coni-mof(1:2)/ae。实施例12-实施例15的免疫传感器的制备方法,与实施例11的免疫传感器的制备方法的不同之处仅在于,金属有机框架材料的种类不同,实施例12涉及的金属有机框架材料为实施例2的金属有机框架材料ni-mof,实施例13涉及的金属有机框架材料为实施例3的金属有机框架材料coni-mof(1:1),实施例14涉及的金属有机框架材料为实施例4的金属有机框架材料coni-mof(2:1),实施例15涉及的金属有机框架材料为实施例5的金属有机框架材料coni-mof(1:2),各步骤和参数均同实施例11。实施例16-20实施例16的免疫传感器,与实施例11的免疫传感器的不同之处仅在于,抗体的种类不同,实施例16的抗体为sal抗体。相应地,涂覆有实施例1的金属有机框架材料的修饰电极记为co-mof/ae,锚定抗体后得到的免疫传感器记为absal/co-mof/ae。实施例17的免疫传感器,与实施例12的免疫传感器的不同之处仅在于,抗体的种类不同,实施例17的抗体为sal抗体。相应地,涂覆有实施例2的金属有机框架材料的修饰电极记为ni-mof/ae,锚定抗体后得到的免疫传感器记为absal/ni-mof/ae。实施例18的免疫传感器,与实施例13的免疫传感器的不同之处仅在于,抗体的种类不同,实施例18的抗体为sal抗体。相应地,涂覆有实施例3的金属有机框架材料的修饰电极记为coni-mof(1:1)/ae,锚定抗体后得到的免疫传感器记为absal/coni-mof(1:1)/ae。实施例19的免疫传感器,与实施例14的免疫传感器的不同之处仅在于,抗体的种类不同,实施例19的抗体为sal抗体。相应地,涂覆有实施例4的金属有机框架材料的修饰电极记为coni-mof(2:1)/ae,锚定抗体后得到的免疫传感器记为absal/coni-mof(2:1)/ae。实施例20的免疫传感器,与实施例15的免疫传感器的不同之处仅在于,抗体的种类不同,实施例20的抗体为sal抗体。相应地,涂覆有实施例5的金属有机框架材料的修饰电极记为coni-mof(1:2)/ae,锚定抗体后得到的免疫传感器记为absal/coni-mof(1:2)/ae。四、相关试验例本发明的试验例中,coni-mof是coni-mof(1:1)的简称。coni-mof(1:1)基免疫传感器用于检测呕吐毒素和沙丁胺醇的示意图如图1所示,图1中,包括(i)制备双金属coni-mof,(ii)固定抗体,以及(iii)检测有害物质。试验例1sem表征本试验例是对实施例1的co-mof、实施例2的ni-mof、实施例3的coni-mof(1:1)、实施例4的coni-mof(2:1)、实施例5的coni-mof(1:2)的性能(sem)进行表征。利用jsm-6490lv扫描电子显微镜(日本)对实施例1的co-mof、实施例2的ni-mof、实施例3的coni-mof(1:1)、实施例4的coni-mof(2:1)、实施例5的coni-mof(1:2)进行表征,得到扫描电子显微镜(sem)图像如图2所示,图2a为co-mof的sem图像,图2b为ni-mof的sem图像,图2c为coni-mof(1:1)的sem图像,图2d为coni-mof(2:1)的sem图像,图2e为coni-mof(1:2)的sem图像。由图2可知,co-mof(图2a)显示出飞碟状的十四面体结构,尺寸从几十到几百微米。ni-mof(图2b)显示出橄榄状的二十面体结构,尺寸从几十到几百微米。coni-mof(图2c)显示具有18个边的六边形棱柱结构。大多数晶体尺寸超过几十微米,分布均匀。与co-mof和ni-mof相比,coni-mof的每个维度的尺寸大小都在同一量级,而co-mof和ni-mof的尺寸在每个维度上都大不相同。这表明coni-mof可以被认为是各向同性的,但co-mof和ni-mof是各向异性的,将mofs作为电化学换能器时,这种性质会影响它们的电化学行为。试验例2xps表征本试验例是对实施例1的co-mof、实施例2的ni-mof、实施例3的coni-mof(1:1)的性能(xps)进行表征。axishis165光谱仪(英国曼彻斯特的kratosanalytical)与单色alkαx射线源(1486.71ev光子)进行xps表征,得到的x射线光电子能谱(xps)数据如图3~图5所示,图3为co-mof、ni-mof和coni-mof的xps全谱,图3中,(i)为co-mof的xps全谱,(ii)为ni-mof的xps全谱,(iii)为coni-mof(1:1)的xps全谱;图4为co-mof、ni-mof和coni-mof的c1s、n1s和o1s化学成分的高分辨xps能谱;图5为co-mof、ni-mof和coni-mof的高分辨xps能谱。在较宽的能量范围内对co-mof、ni-mof和coni-mof的xps能谱进行了扫描,得到如图3所示的xps全谱,这三个样品的xps全谱显示出与c、n和o的成分有关的显著峰以及弱的co和/或ni峰。c1s,n1s和o1s峰的存在源自于有机配体,co2p和ni2p峰源自于co(ii)和ni(ii)配位中心。图4为co-mof、ni-mof和coni-mof的c1s、n1s和o1s化学成分的高分辨xps能谱。如图4a1所示,co-mof的核心层c1sxps能谱分为三个主要部分,即位于284.4、285.1和285.9ev处的峰,分别对应于c-c、c-n和c-o,以及其它两个在287.7(-coo-)和291.9ev(π-π*)处的弱峰,这表明co-mof具有π共轭结构,此外,某些h2tzb的羧基没有与金属离子进行配位反应,并且在合成过程中被部分保留,这些羧基将与抗体的氨基产生静电相互作用,从而实现抗体的固定化。对于ni-mof,c1sxps能谱(图4b1)被解卷积为位于284.3、285.0、285.8、287.7和292.0ev处的五个峰,分别对应于c-c、c-n、c-o、-coo-和π-π*。同样地,coni-mof(图4c1)在284.3、284.9、285.8、287.7和291.4ev处显示出相同的峰,只是峰强度发生了一些变化。此外,与co-mof和ni-mof相比,coni-mof(图4c1)显示出较强的-coo-峰强度,因此可以固定更多的抗体。co-mof的n1s核心层xps能谱(图4a2)被拟合为两个主要部分,即在399.4和400.3ev处的峰,它们分别对应于tpt和h2tzb配体的吡啶氮和吡咯氮。对于ni-mof(图4b2)和coni-mof(图4c2),这两个峰分别在399.3/400.2ev和399.4/400.2ev处观察到,并具有不同的峰强度。对于co-mof的o1s核心层xps能谱(图4a3),在531.2、531.8和533.4ev处得到三个峰,分别对应于o-h、c=o和c-o。它表明氧元素是由h2tzb引入的,证实了co与有机配体之间的成功配位。对于ni-mof(图4b3),o1s核心层xps能谱在530.7、531.4和532.8ev处显示相同的峰,也证明了ni与有机配体之间的成功配位。同样,coni-mof的o1s核心层xps能谱(图4c3)在531.2、531.8和532.8ev处显示相同的峰。所有这些结果表明,coni-mof显示出与co-mof和ni-mof相同的结构和组成,这进一步证明了这三个mofs的同构性质,这也由xrd图谱得到证实。特别地,对于coni-mof(图4c3),与co-mof和ni-mof相比,c=o峰显示出明显较高的强度。由于c=o源自于h2tzb的羧基,这表明在coni-mof的合成过程中h2tzb的羧基大部分被保留,并且羧基越多意味着抗体的固定化程度越高,这有利于进一步的电化学测试。如上所述,c1s核心层xps能谱(图4a1、b1和c1)也验证了这一结果。此外,还研究了co-mof和ni-mof的高分辨co2p和ni2pxps能谱,并将其与coni-mof进行对比。co-mof的co2p核心层xps能谱(图5a)包括在780.9和782.7ev处的峰,分别对应于co2p3/2的co3+和co2+,而其他两个在796.8和798.7ev处的峰分别对应于co2p1/2的co3+和co2+。此外,还观察到两个小的峰值,分别为786.0和802.3ev,对应于co3+的伴随卫星峰,而另外两个峰值为788.8和805.3ev,对应于co2+的伴随卫星峰。对于ni-mof的ni2p核心层xps能谱(图5b),ni2p3/2信号的曲线拟合显示出不同的种类的ni。考虑了伴随峰后,在855.6和856.8ev处的结合能分别对应于ni2p3/2的ni2+和ni3+,而在873.3和875.3ev处的高结合能归因于ni2p1/2的ni2+和ni3+。伴随卫星峰的结合能分别为860.5/862.9ev(ni2p3/2)和878.8/881.4ev(ni2p1/2),分别对应于ni2+和ni3+。其中,检测出的co3+和ni3+,是由于在反应过程中,高温条件下,co2+和ni2+发生了部分氧化。使用xps来研究样品的化学组成和环境。coni-mof的高分辨co2p和ni2p能谱如图5c和5d所示。coni-mof的co2p核心层xps能谱(图5c)包括在780.8和782.5ev处的峰,分别对应于co2p3/2的co3+和co2+,而其他两个在796.6和798.1ev处的峰分别对应于co2p1/2的co3+和co2+。此外,还观察到两个小的峰值,分别为785.3和801.8ev,对应于co3+的伴随卫星峰,而另外两个峰值为788.3和804.8ev,对应于co2+的伴随卫星峰。对于coni-mof的ni2p核心层xps能谱(图5d),ni2p3/2信号的曲线拟合显示出不同的种类的ni。考虑了伴随峰后,在855.8和857.1ev处的结合能分别对应于ni2p3/2的ni2+和ni3+,而在873.4和875.2ev处的高结合能归因于ni2p1/2的ni2+和ni3+。伴随卫星峰的结合能分别为860.6/862.9ev(ni2p3/2)和878.1/881.3ev(ni2p1/2),分别对应于ni2+和ni3+。结果表明,coni-mof中共存有co2+/co3+和ni2+/ni3+,证明了样品的多价态特性。这种多价态性质有助于提高电化学活性,并可以为抗体锚定提供足够的活性位点。试验例3xrd表征和ft-ir表征本试验例是对实施例1的co-mof、实施例2的ni-mof、实施例3的coni-mof(1:1)的性能(xrd和ft-ir)进行表征。x射线衍射(xrd)的测试是在rigakud/max-2500x射线衍射仪上使用cukα辐射记录的。使用nicolet850光谱仪(thermoelectroncorporation,马萨诸塞州,美国),通过傅里叶变换红外光谱(ft-ir)分析纳米材料的化学结构,得到的结果如图6所示,图6为(i)co-mof、(ii)ni-mof和(iii)coni-mof的xrd图谱和ft-ir光谱。图6a显示了co-mof,ni-mof和coni-mof的xrd图谱。这三个mofs的xrd衍射图谱在2θ=6.05°、7.78°、9.30°、10.61°、14.03°、15.39°、18.76°、21.49°和23.22°处显示出9个强烈的衍射峰,分别对应于(100)、(101)、(002)、(2-10)、(2-12)、(202)、(301)、(2-14)和(4-22)晶面。此外,尖锐的衍射峰表明样品的结晶度很高,证明成功合成了三个mofs。而且三个mofs显示出相同的衍射图谱,说明三个mofs实际上是同构mof。(i)co-mof、(ii)ni-mof和(iii)coni-mof的ft-ir光谱如图6b所示,在1603和1521cm-1处的特征吸收带对应于苯环中c=c基团的骨架振动,在3420cm-1处的吸收带对应于n-h的拉伸振动。在1105、1060和1009cm-1处的吸收带归因于c-n基团的拉伸振动,1393、804、746和664cm-1处的吸收带归因于c-h基团的面外弯曲振动,而在1662cm-1处的吸收带是由c=o基团的拉伸振动引起的。所有这些官能团均来自用于合成三个mofs的有机配体。试验例4co-mof、ni-mof、coni-mof(1:1)对don和sal检测的电化学生物传感性能本发明所有电化学测试,包括电化学阻抗谱(eis)和循环伏安法(cv),均在solartronanalytical电化学工作站(英国)上进行。使用常规的三电极体系,该体系包括直径为3mm的ae作为工作电极,ag/agcl(饱和kcl)电极作为参比电极,以及铂片作为对电极。在含有0.1mkcl的0.5mm[fe(cn)6]3-/4-中得到eis曲线(eis参数:电位,0.21v;频率范围,100khz至0.1hz;振幅,5mv)。使用zview2软件分析eis数据,其中eis光谱使用等效电路模拟,该等效电路包括溶液阻抗(rs),电荷转移阻抗(rct),恒相位元件(cpe)和warburg阻抗(wo)(图s1)。使用非线性最小二乘法拟合确定等效电路中各元件的参数。每次测试至少重复三遍。采用了多种电化学技术,包括cv和eis,研究了co-mof、ni-mof、coni-mof(1:1)修饰电极的电化学响应,可对所开发的免疫传感器的构筑和传感过程进行监测,从而对工作电极的整个构筑过程提供重要信息。图7为分别使用开发的基于(a)coni-mof(1:1),(b)co-mof和(c)ni-mof的免疫传感器,在含有0.14mnacl和0.1mkcl的5mm[fe(cn)6]3-/4-中,通过cv曲线跟踪检测don的整个过程。图7a中,(i)对应ae,(ii)对应coni-mof/ae,(iii)对应abdon/coni-mof/ae,(iv)对应don/abdon/coni-mof/ae;图7b中,(i)对应ae,(ii)对应co-mof/ae,(iii)对应abdon/co-mof/ae,(iv)对应don/abdon/co-mof/ae;图7c中,(i)对应ae,(ii)对应ni-mof/ae,(iii)对应abdon/ni-mof/ae,(iv)对应don/abdon/ni-mof/ae。图7为coni-mof(1:1)、co-mof和ni-mof对应的免疫传感器的cv曲线,图7a为coni-mof(1:1)基免疫传感器的cv曲线,空白ae显示出一对明晰的可逆氧化还原峰,其峰间电位差(δep)值为227mv(曲线i)。对于coni-mof/ae(曲线ii),δep增加到321mv,并伴随氧化还原峰值电流的减小,这表明在coni-mof涂覆到空白ae上后导电性降低。当don的抗体(abdon)固定在coni-mof/ae表面上(曲线iii)时,abdon/coni-mof/ae的δep增加到484mv。随后,当使用abdon/coni-mof/ae检测don(don/abdon/coni-mof/ae)时,δep进一步增加到510mv(曲线iv),这表明abdon/coni-mof/ae可成功检测到don。类似地,对co-mof和ni-mof的cv曲线进行了对比研究(图7b和c)。co-mof的四个ae的δep为234、436、527和542mv,而ni-mof的四个修饰ae的δep为238、304、389和435mv。所有结果表明,δep和氧化还原峰值电流的变化具有相似的趋势。当空白ae表面连续固定上mofs,abdon和don之后,δep值和氧化还原峰值电流分别连续增加和减少,说明三种mofs基免疫传感器的电化学响应是相应降低的。使用eis来研究coni-mof、co-mof和ni-mof基免疫传感器对don检测的整个过程。使用zview2软件对eis谱图进行分析。使用非线性最小二乘法来拟合和确定等效电路中元件的参数(如图8所示,图8为eisnyquist图和等效电路),图9为coni-mof(1:1)、co-mof、ni-mof、coni-mof(2:1)和coni-mof(1:2)对应的免疫传感器的eis曲线。图9为分别使用开发的基于(a)coni-mof(1:1)、(b)co-mof、(c)ni-mof、(d)coni-mof(2:1)和(e)coni-mof(1:2)的免疫传感器,在含有0.14mnacl和0.1mkcl的5mm[fe(cn)6]3-/4-中,通过eis谱图跟踪检测don的整个过程,图9a中,(i)对应ae,(ii)对应coni-mof(1:1)/ae,(iii)对应abdon/coni-mof(1:1)/ae,(iv)对应don/abdon/coni-mof(1:1)/ae;图9b中,(i)对应ae,(ii)对应co-mof/ae,(iii)对应abdon/co-mof/ae,(iv)对应don/abdon/co-mof/ae;图9c中,(i)对应ae,(ii)对应ni-mof/ae,(iii)对应abdon/ni-mof/ae,(iv)对应don/abdon/ni-mof/ae;图9d中,(i)对应ae,(ii)对应coni-mof(2:1)/ae,(iii)对应abdon/coni-mof(2:1)/ae,(iv)对应don/abdon/coni-mof(2:1)/ae;图9e中,(i)对应ae,(ii)对应coni-mof(1:2)/ae,(iii)对应abdon/coni-mof(1:2)/ae,(iv)对应don/abdon/coni-mof(1:2)/ae。对于coni-mof基免疫传感器的eis谱图(图9a),空白ae在高频下(曲线i)显示出清晰的小半圆,电荷转移阻抗(rct)值为124.4ω。用coni-mof修饰空白ae后(曲线ii),阻抗曲线由较大的半圆组成,其rct值显著增大,为381.6ω。该值表明coni-mof表现出相对较差的导电性。当abdon固定在coni-mof/ae表面上(曲线iii)时,rct值进一步增加至779.1ω,表明abdon已成功固定在电极表面上。这主要是因为蛋白质膜阻碍了电解质溶液和电极之间的电子转移。在检测don时(曲线iv),don/abdon/coni-mof/ae的rct值为1197.5ω。修饰电极表面rct值的持续增大表明高度特异性的免疫识别会阻碍电子导电性。作为对比,还研究了co-mof和ni-mof的电化学性能(图9b和c)。co-mof的四个ae的rct值分别为73.4、1577.6、2575.7和2785.0ω,而ni-mof的四个修饰ae的rct值分别为70.5、782.6、940.3和1297.4ω。此外,还研究了不同比例的coni-mof的电化学性能(图9d和e)。coni-mof(2:1)的四个ae的rct值分别为124.5、388.2、485.9和544.4ω,而coni-mof(1:2)的四个修饰ae的rct值分别为123.4、357.6、459.2和542.5ω。从eis谱图可以看出,在空白ae上连续固定mofs,abdon和don后,rct值持续增加。rct的变化趋势与上述cv曲线一致。总的来说,所有结果都表明成功构筑出了mofs基电化学免疫传感器,并对抗原分子具有出色的识别能力。结合图9,对co-mof、ni-mof和coni-mof(1:1)基免疫传感器对don检测的每个步骤的rct值的变化(δrct)进行分析,得到的结果如图10所示,图10为基于co-mof、ni-mof和coni-mof的免疫传感器检测don时每个阶段的δrct值差异。δrct可以代表相应的结合量。将mofs修饰到ae表面引起的co-mof、ni-mof和coni-mof基免疫传感器的δrct值分别为1504.2、712.1和257.2ω。其中,coni-mof/ae的δrct值最小,表明coni-mof的电子导电性最佳。在固定抗体后,三种修饰ae的δrct值也有所不同(988.1、157.7和397.5ω),这说明三个mofs与抗体之间的吸附量不同。对于don检测,三种免疫传感器显示出不同的检测效率,δrct值分别为209.3、357.2和418.4ω。由图可知,abdon/coni-mof/ae具有中等的δrct值(397.5ω),但对don显示出最高的检测效率(δrct值为418.4ω),这与之前的报道略有不同。这很可能因为,对于co-mof和ni-mof,由于其单金属性质,与coni-mof相比,它们与抗体间的相互作用相对较弱,尽管可以将更多的抗体吸附锚定在框架表面,但形成的abdon-don复合物将很容易从宿主框架上脱落并释放到溶液中。因此,选择coni-mof作为构筑免疫传感器的最佳材料。图11中,(a)使用浓度为0.1、0.2、0.5、1.0和2.0mg·ml-1的coni-mof基免疫传感器检测don时每个阶段的δrct值差异。(b)不同浓度的抗体溶液对don检测的影响。coni-mof基免疫传感器在don溶液(10ng·ml-1)中孵育不同时间的(c)eis谱图和(d)相应的δrct值。为了得到coni-mof基免疫传感器对don检测的最适宜测试参数,我们研究了coni-mof的用量对传感性能的影响,如图11a所示,在相同条件下,使用0.1、0.2、0.5、1.0和2.0mg·ml-1的coni-mof,制备了5个免疫传感器,并用eis对don进行检测。随着coni-mof的浓度从0.1增加至2.0mg·ml-1,δrct(rct,mofs-rct,ae)值在浓度为1.0mg·ml-1时达到最小值,说明此时的电子导电性最佳。相应地,固定抗体时的δrct(rct,ab-rct,mofs)值和检测don时的δrct(rct,don-rct,ab)值在浓度为1.0mg·ml-1时均达到最大值,说明此时对抗体的吸附量最大,对don的检测效率最高。因此,选择浓度为1.0mg·ml-1的coni-mof来构筑免疫传感器,并用于随后的电化学测试。此外,在检测don前,coni-mof基免疫传感器在不同浓度(1、2、5、10、20和50ng·ml-1)的抗体溶液中进行孵育,并用eis对don进行检测(图11b)。检测don时的δrct值随着抗体浓度的增加而增大,直到抗体浓度为10ng·ml-1时接近稳定。因此,选择浓度为10ng·ml-1的抗体溶液来测试免疫传感器的电化学传感性能。我们还对在don溶液中的孵育时间对传感性能的影响进行了评估(图11c和11d)。从0到40min时,δrct值显著增大,说明与don的最佳结合时间为40min。利用coni-mof(1:1)、coni-mof(2:1)和coni-mof(1:2)基检测体系对sal进行检测,得到图12所示的基于coni-mof的免疫传感器的cv曲线和eis谱图,使用基于coni-mof(1:1)、coni-mof(2:1)和coni-mof(1:2)的免疫传感器,在含有0.14mnacl和0.1mkcl的5mm[fe(cn)6]3-/4-中,得到(a)coni-mof(1:1)的cv曲线、(b)coni-mof(1:1)的eis谱图跟踪检测sal的整个过程、(c)coni-mof(2:1)的eis谱图跟踪检测sal的整个过程、(d)coni-mof(1:2)的eis谱图跟踪检测sal的整个过程,图12a和12b中,(i)对应ae,(ii)对应coni-mof(1:1)/ae,(iii)对应absal/coni-mof(1:1)/ae,(iv)对应sal/absal/coni-mof(1:1)/ae;图12c中,(i)对应ae,(ii)对应coni-mof(2:1)/ae,(iii)对应absal/coni-mof(2:1)/ae,(iv)对应sal/absal/coni-mof(2:1)/ae;图12d中,(i)对应ae,(ii)对应coni-mof(1:2)/ae,(iii)对应absal/coni-mof(1:2)/ae,(iv)对应sal/absal/coni-mof(1:2)/ae。在cv曲线中(图12a),随着检测过程的进行,观察到δep值的持续增加和峰值电流的持续减少。coni-mof的四种ae的δep值分别为263、386、398和406mv。absal的吸附以及抗体和sal之间的生物结合作用导致每个步骤的相应rct值不断增加(图12b)。coni-mof的四种ae的rct值分别为120.5、390.6、790.9和1018.1ω。这些数据同样证明了抗体的吸附和sal的检测会阻碍电极表面与电解质溶液之间的电子转移。所有这些结果表明,开发的coni-mof基电化学免疫传感器可用于监测环境保护领域,并可作为检测食品安全性的潜在策略。作为对比,还研究了不同比例的coni-mof的电化学性能(图12c和d)。coni-mof(2:1)的四个ae的rct值分别为124.5、368.2、528.9和697.4ω,而coni-mof(1:2)的四个修饰ae的rct值分别为123.4、374.6、721.2和872.5ω。试验例5用于检测don和sal的coni-mof(1:1)基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性1、检测方法(1)灵敏性测试为了对don的检测限进行评估,将abdon/coni-mof/ae浸入不同浓度的don溶液(记为don/abdon/coni-mof/ae)中30min,并用eis进行测试。每个检测步骤后,将电极用pbs彻底冲洗,以除去结合较弱的分子。值得注意的是,每次进行五个平行实验,并且在本研究中使用平均值。对sal的检测限的评估与上述方法类似,使用不同浓度的sal溶液进行测试,修饰ae表示为sal/absal/coni-mof/ae。(2)选择性测试对可能与don共存的其他干扰物,包括强力霉素(dox)、氧氟沙星(oflx)、链霉素(stp)、黄曲霉素(aft)和青霉素(pnc),以及don与其他干扰物的混合物进行了电化学测试,以验证abdon/coni-mof/ae对don的选择性。干扰物的浓度是don的1000倍。其他共存干扰物,如盐酸克仑特罗(clb)、尿素、k+、na+和尿酸(ua)等用于对sal的选择性进行评估。干扰物的浓度是sal浓度的1000倍。(3)稳定性测试为了评估所开发的免疫传感器的稳定性,abdon/coni-mof/ae在干燥状态下于4℃存放15天,每天使用eis研究don的响应。以相同的方式对absal/coni-mof/ae用于检测sal进行稳定性评估。(4)重现性测试在相同条件下制备5个abdon/coni-mof/ae,记录它们在pbs中对添加don引起的δrct值变化并进行比较,由此评价重现性。以相同的方式对absal/coni-mof/ae用于检测sal进行重现性评估。(5)再生性测试室温下,将结合有don的abdon/coni-mof/ae浸入0.1mhcl中5min,然后用大量milli-q水进行冲洗。之后,将处理过的电极再次浸入don溶液中。再生运行进行多次循环,以评估构筑的coni-mof基免疫传感器对don的再生性。以相同的方式对absal/coni-mof/ae用于检测sal进行再生性评估。2、用于检测don的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性对用于检测don的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性进行表征,得到的结果如图13所示,图13中,(a)abdon/coni-mof/ae对不同浓度的don(0、0.001、0.005、0.01、0.05、0.1和0.5ng·ml-1)的eis响应。(b)δrct对don浓度的依赖性。校准曲线的线性部分显示在(b)的插图中。(c)coni-mof基电化学免疫传感器对分别添加的干扰物(浓度为1ng·ml-1的dox、oflx、stp、aft和pnc)、don(浓度为0.001ng·ml-1),以及它们的混合物的δrct值。(d)coni-mof基电化学免疫传感器在15天内检测don(0.001ng·ml-1)的稳定性。(e)coni-mof基免疫传感器检测浓度为0.001ng·ml-1的don的重现性。(f)coni-mof基免疫传感器检测浓度为0.001ng·ml-1的don的再生性。(1)用于检测don的coni-mof基免疫传感器的灵敏度将abdon/coni-mof/ae与不同浓度的don溶液一起孵育,然后使用eis在[fe(cn)6]3-/4-溶液中进行测试,以评估所开发的免疫传感器的分析性能。图13a为abdon/coni-mof/ae用于检测不同浓度的don时的nyquist图。rct值随着don浓度的增加在0.001至0.5ng·ml-1范围内逐渐增加。这种趋势是免疫传感器对don进行高效免疫识别的结果,通过don浓度的增加,在don和修饰电极表面上的抗体之间形成的abdon-don复合物逐渐增加。这种情况进一步导致rct值的增加。当将所开发的免疫传感器在don检测之前和之后的δrct值作为检测信号时,δrct与don浓度的对数值(logcondon)在-3至-0.301的范围内成正比(图13b)。线性回归方程为δrct(kω)=1.34+0.31logcondon(ng·ml-1),相关系数(r2)为0.9906。根据langmuir吸附方程,在信噪比(s/n)为3时,检测限(lod)估算为0.05pg·ml-1,相对标准偏差(rsd)为2.16%。与其他已报道的don检测技术相比(表1),本发明中的coni-mof基免疫传感器具有出色的传感性能,并且lod较低。coni-mof的π共轭结构和羧基可以通过π-π*堆积和静电相互作用来固定大量抗体。该框架独特的化学结构可以稳定抗体和don之间形成的抗原-抗体复合物,从而实现对don的灵敏性检测。coni-mof的高电化学活性还可以增强所得电极的电化学活性,并放大其输出信号。所有这些特性赋予coni-mof基免疫传感器在检测痕量分析物时出色的传感性能。表1本发明与其他已报道的don检测技术相比(2)用于检测don的coni-mof基免疫传感器的选择性我们进一步测试了coni-mof基电化学免疫传感器对don的选择性,如图13c所示。干扰物的浓度(1ng·ml-1)是don(0.001ng·ml-1)的1000倍。与在don检测中观察到的δrct值的显著响应相比,在添加其他干扰物的情况下获得的响应变化可忽略不计。此外,在0.001ng·ml-1don和1ng·ml-1的其他干扰物的混合物中也观察到了δrct值的明显响应,这主要是由于don的存在,还包括其他干扰物的轻微影响。因此,该结果表明,由于don及其对应的探针抗体之间具有高度的特异性免疫识别,电化学免疫传感器对don的选择性高于其他干扰物。(3)用于检测don的coni-mof基免疫传感器的稳定性在评估构筑的免疫传感器在食品安全和生物监测中的可能应用时,还应该研究其稳定性。如图13d所示,coni-mof基免疫传感器对0.001ng·ml-1don的电化学响应(δrct)在15天内保留了其原始响应的94.9%,这表明该免疫传感器具有良好的稳定性。(4)用于检测don的coni-mof基免疫传感器的重现性通过检测室温下pbs中添加don(0.001ng·ml-1)引起的δrct值,来测试coni-mof基免疫传感器的重现性(图13e)。用于don检测的5个abdon/coni-mof/ae的δrct值的rsd为2.48%。这表明所开发的免疫传感器不仅表现出可接受的稳定性,而且具有极好的传感器间重现性。(5)用于检测don的coni-mof基免疫传感器的再生性通过对0.001ng·ml-1don进行若干次循环再生运行,来评估所构筑的coni-mof基免疫传感器的再生性。图13f显示在前八次再生运行期间,所开发的免疫传感器的δrct值没有实质变化。该观察结果表明免疫传感器可以很容易地再生。所有结果表明,所构筑的免疫传感器表现出高灵敏度、优异的选择性、良好的稳定性、可接受的重现性和出色的再生性。3、用于检测sal的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性对用于检测sal的coni-mof基免疫传感器的灵敏度、选择性、稳定性、重现性和再生性进行检测,得到的结果如图14所示,图14中,(a)absal/coni-mof/ae对不同浓度的sal(0、0.001、0.005、0.01、0.05、0.1和0.5ng·ml-1)的eis响应。(b)δrct对sal浓度的依赖性。校准曲线的线性部分显示在(b)的插图中。(c)coni-mof基电化学免疫传感器对分别添加的干扰物(浓度为1ng·ml-1的clb、尿素、k+、na+和ua)、sal(浓度为0.001ng·ml-1),以及它们的混合物的δrct值。(d)coni-mof基电化学免疫传感器在15天内检测sal(0.001ng·ml-1)的稳定性。(e)coni-mof基免疫传感器检测浓度为0.001ng·ml-1的sal的重现性。(f)coni-mof基免疫传感器检测浓度为0.001ng·ml-1的sal的再生性。(1)用于检测sal的coni-mof基免疫传感器的灵敏度同样,将absal/coni-mof/ae与不同浓度的sal溶液一起孵育,以评估coni-mof基电化学免疫传感器的灵敏度。对于sal的检测(图14a),rct值在0.001-0.5ng·ml-1范围内随着sal浓度的增加而显著增加,这是由免疫传感器对sal的特异性免疫识别作用所致。线性回归方程为δrct(kω)=0.10+0.26logconsal(ng·ml-1),r2为0.9989(图14b)。在信噪比为3时,lod计算为0.30pg·ml-1,rsd为1.75%。表s1还显示,构筑的免疫传感器是超灵敏和快速检测sal的极佳候选者。(2)用于检测sal的coni-mof基免疫传感器的选择性如图14c所示,电化学免疫传感器对sal的检测强于其他干扰物,如clb、尿素、k+、na+和ua等。(3)用于检测sal的coni-mof基免疫传感器的稳定性免疫传感器还具有长期存储稳定性,在15天内保留了其原始响应的约94.0%(图14d)。(4)用于检测sal的coni-mof基免疫传感器的重现性对于重现性测试(图14e),五个用于sal检测的免疫传感器的δrct值几乎没有差异,rsd为1.43%。(5)用于检测sal的coni-mof基免疫传感器的再生性图14f显示,在用于检测sal的前七个再生运行期间,所开发的免疫传感器的δrct值没有实质性变化,表明其良好的可再生性。与其他已报道的sal检测技术相比(表2),本文中的coni-mof基免疫传感器具有出色的传感性能,并且lod较低。表2本发明其他已报道的sal检测技术相比试验例6真实样品分析实际样品分析:选择从超市购买的牛奶和猪肉来分析所构筑的免疫传感器的实际应用性。将生牛奶(1ml)转移到15ml离心管中,加入0.2mlnaoh(0.1m)和0.8ml乙腈。然后将试管剧烈摇动5min。在室温下以5000rpm离心5min后,收集上清液,并用pbs(10mm,ph7.4)稀释50倍。精确称量10.0g的猪肉样品并切碎,加入适量的1.0pg·ml-1的sal标准溶液。将最多20.0ml的乙酸乙酯和1.0ml的4mk2co3溶液添加到猪肉样品中。通过超声处理将溶液剧烈摇动1h。通过离心收集上清液,然后在40℃下干燥。之后,将固体残余物溶于1.0ml的50%甲醇溶液中,并在pbs(10mm,ph7.4)中重构以准备使用。将不同浓度的don或sal(0.005、0.01、0.05、0.1和0.5ng·ml-1)加入到预处理的牛奶或猪肉溶液中以进行真实样品分析。通过检测牛奶中的don和猪肉样品中的sal,研究了所开发的电化学免疫传感器在实际样品中检测don或sal的实际应用性。该实验将验证所开发的传感平台的适用性。将不同的don或sal浓度加入到处理过的牛奶或猪肉样品中。通过上述电化学传感方法,使用coni-mof基免疫传感器检测并分析了don或sal的存在。根据图13b和14b的标准曲线获得结果。表3显示用于检测don的免疫传感器的回收率范围为95.7%至102.6%,rsd的范围为1.7%至3.4%(<5%),而表4显示用于检测sal的免疫传感器的回收率范围为91.4%至107.4%,rsd的范围为1.2%至3.2%(<5%)。这些结果表明这种新型传感平台对在真实样品中快速检测don或sal具有很高的重现性、准确性和可行性。表3通过开发的免疫传感器检测牛奶样品中的don表4通过开发的免疫传感器检测猪肉样品中的sal加入(ng·ml-1)检出(ng·ml-1)回收率(%)rsd(%,n=3)0.0010.001072107.22.60.0050.00478695.51.20.010.010233102.32.70.050.04570991.42.20.10.100000100.02.30.50.537032107.43.2实验结果表明,通过使用混合有机配体h2tzb和tpt,我们成功合成了一种新型的双金属coni-mof,并用于构筑高灵敏度电化学免疫传感器的生物平台,来检测痕量的有害小分子(don和sal)。通过与单独的co-mof和ni-mof对比,双金属coni-mof由混合金属离子组成,具有丰富的氨基和较小的纳米尺寸。这些特性赋予双金属coni-mof良好的电化学活性和对don的出色的传感性能。在大量吸附abdon后,所开发的coni-mof基免疫传感器对don的检测表现出从0.001到0.5ng·ml-1的较宽线性范围,以及极低的lod,为0.05pg·ml-1。此外,coni-mof还显示出高选择性、优异的重现性、稳定性、再生性和在真实牛奶样品中的适用性。这种基于双金属coni-mof的传感策略可以进行扩展,当固定absal时,可建立另一种传感体系,同样对sal的检测表现出较低的lod(0.30pg·ml-1)和显著的检测性能,表明coni-mof具有灵敏度高、选择性好和操作简单等优点,这种coni-mof在简便有效地检测食品中的有毒有害残留物等领域具有巨大潜力。这项工作为环境监测和食品安全领域的生物传感器建立了一个新的mof基平台。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1