细胞分离装置的制作方法
本申请涉及生物技术领域,特别是涉及一种细胞分离装置。
背景技术:
淋巴细胞(lymphocyte)是白细胞的一种,是体积最小的白细胞,由淋巴器官产生,是机体免疫应答功能的重要细胞成分。淋巴细胞是一类具有免疫识别功能的细胞系,按其发生迁移、表面分子和功能的不同,可分为t淋巴细胞(又名t细胞)、b淋巴细胞(又名b细胞)和自然杀伤(nk)细胞等。t细胞和b细胞都是抗原特异性淋巴细胞,它们的最初来源是相同的,都来自造血组织。t淋巴细胞随血循环到胸腺,在胸腺激素等的作用下成熟,而b细胞在骨髓中分化成熟。
当受抗原刺激后,t淋巴细胞即转化为淋巴母细胞,再分化为致敏t淋巴细胞,参与细胞免疫,其免疫功能主要是抗胞内感染、瘤细胞与异体细胞等;而b淋巴细胞是先转化为浆母细胞,再分化为浆细胞,产生并分泌免疫球蛋白(抗体),参与体液免疫,其功能是产生抗体,提呈抗原,以及分泌细胞内因子参与免疫调节;nk细胞不依赖抗原刺激而自发地发挥细胞毒效应,具有杀伤靶细胞的作用。
二十年前,随着以重组激素、可溶性受体和抗体为基础的生物制剂的出现,长期被作为支柱的小分子药物统治下的制药工业,出现了一次重要革命。现在,随着微生物和人体细胞治疗多潜能性的发掘,生物医药也被推到了风口浪尖,引发了新的一轮革命。细胞工程学的不断进步,对开发出安全的、可预测的细胞治疗提供了一个系统性框架。微生物和人体细胞也被用作治疗的实体,有潜力解决一些重要的、目前无法满足的需求,治疗某些最致命的疾病,包括癌症、自身免疫性疾病等。
美国加州大学旧金山分校的研究人员在《科学-转化医学》(sciencetranslationalmedicine)杂志上《perspective》栏目下发表了一篇有关细胞治疗前景概述的文章。文章称,细胞治疗未来将成为“医学第三大支柱”,会像现在用工程蛋白质、抗体或更小的化学物质制成的药品一样,普遍用于治疗患者。研究人员比喻到,如果小分子和生物制品是工具,那么细胞就是木匠、建筑师和工程师。细胞能够完成小分子药物和靶向性药物无法实现的一些功能。举例来说,细胞的适应性强,它们能够移行至特定的部位,比当前的药物更好地感知周围的环境,然后自己做出正确的决定,改变自身的反应,更好地适应生理条件。
首先,细胞天生就承担了很多治疗的任务,如巨噬细胞吞噬病原体,招募适应性免疫细胞,造血干细胞生成髓系和淋巴谱系细胞,软骨细胞产生软骨细胞外基质等。
其次,细胞的行为具有选择性。对于小分子和生物制剂来说,它们没有开关,只要其与标靶结合,就发挥其生物学效应。但细胞却能感知周围环境,只有触发特定的信号分子时才发挥作用。因此,细胞治疗能更好的避免脱靶效应,也正因为如此,细胞治疗能起到更好的投递作用,是其他治疗的一个好的载体。
第三,细胞治疗能更好的适应人的基因多样性。比如由于个体差异,药物在人体的代谢不同,疗效也不尽相同。但是通过改造细胞,使之能像电阻电路一样,自动调节浓度变化,适应不同宿主的代谢,从而发挥更好的疗效。
最后,可以通过改变细胞基因来调节细胞的功能。比如通过生物合成技术修饰t淋巴细胞,使之能够感应血糖并分泌胰岛素,解除1型糖尿病患者对血糖的依赖;针对癌症的免疫反应往往较弱,但是通过操纵和培育一些能靶向癌细胞上特异分子的免疫细胞群,则可提高抗肿瘤反应。这些新实验的研究,对于临床治疗都是巨大的突破。
随着细胞治疗技术的不断成熟,大批量的淋巴细胞分离是其中一个关键环节。
目前细胞分离技术比较成熟且应用较广泛的主要有:密度梯度离心法、免疫磁珠法和流式技术等。其中,密度梯度离心法是根据细胞的密度来实现特定类型细胞的分离,其操作简单,成本低,但只能对细胞群体进行粗略的分离,不能满足临床和科研上复杂的细胞分离需要;免疫磁珠法和流式细胞分离法都是基于抗体捕获细胞的原理,利用细胞表面特定的标志物,结合其他技术实现特定类型的细胞分离,这两种技术分离的细胞可以是具体亚群,较为准确且纯度较高。
免疫磁珠法分离细胞采用的磁珠有大磁珠(0.1mm~0.45mm)和小磁珠(约50nm~5000nm)之分。目前市面上采用大磁珠分离细胞的方法操作简单,分离速度快、成本低,但纯度低,对细胞造成机械压力,影响细胞生物学活性,不利于分离后培养,分离后的大磁珠必须通过一定的方法使细胞从磁珠分离;小磁珠分离细胞的方法基本是采用分离柱的方式,其分离纯度高,细胞活性好,磁珠不用剪切,可直接上流式;但分离速度慢,分离柱为一次性使用,成本高,过柱后需对分离柱进行阴性细胞及阳性细胞洗脱,操作较为繁琐。
现有的细胞分离装置存在结构复杂,成本高以及分离速度慢的问题。
技术实现要素:
本申请提出一种细胞分离装置,以解决前面所述现有技术中的细胞分离装置存在结构复杂,成本高以及分离速度慢的问题。
为解决以上问题,本申请提供一种细胞分离装置,细胞分离装置包括分离座、至少一个分离杯以及至少一个磁铁,分离杯用于容纳带磁珠的细胞混合液,分离杯可拆卸式设于分离座上,磁铁设于分离座上并且磁铁设于分离杯的下方,用于将磁珠吸附至分离杯的底部。
其中,分离杯的纵截面呈v型。
其中,相邻的两个分离杯结合形成分离杯组件,分离杯组件一体成型。
其中,分离座包括隔板,隔板的下方设有多个容置槽,用于容纳磁铁,隔板的上方设有与隔板垂直的导板组件,导板组件包括平行间隔设置的第一导板和第二导板;分离杯组件包括第一分离杯、第二分离杯以及衔接第一分离杯和第二分离杯的衔接块,衔接块呈倒v型,衔接块分别与第一分离杯和第二分离杯的衔接处设有第一卡接槽和第二卡接槽,第一卡接槽与第一导板卡接,第二卡接槽与第二导板卡接。
其中,分离座还包括侧板,侧板设于隔板的一侧,并与隔板以及导板组件垂直,侧板上设有限位孔,衔接块向外突设有限位杆,限位孔与限位杆适配。
其中,分离杯组件的侧面均呈平面状,第一分离杯和第二分离杯的底部呈平面状以与隔板抵接。
其中,第一导板和第二导板的上端面均经过导圆角处理,第一卡接槽和第二卡接槽均通过导圆角处理。
其中,分离座还包括封装板,封装板与侧板平行,用于封装磁铁。
其中,相邻的三个分离杯结合形成分离杯组件,分离杯组件一体成型。
其中,分离座包括隔板,隔板的下方设有多个容置槽,用于容纳磁铁,隔板的上方设有与隔板垂直的第一导板组件和第二导板组件,第一导板组件包括平行间隔设置的第一导板和第二导板,第二导板组件包括平行间隔设置的第三导板和第四导板;分离杯组件包括第一分离杯、第二分离杯、第三分离杯、第一衔接块和第二衔接块,第一衔接块衔接于第一分离杯和第二分离杯之间,第二衔接块衔接于第二分离杯和第三分离杯之间,第一衔接块和第二衔接块均呈倒v型,第一衔接块分别与第一分离杯和第二分离杯的衔接处设有第一卡接槽和第二卡接槽,第一卡接槽与第一导板卡接,第二卡接槽与第二导板卡接,第二衔接块分别与第二分离杯和第三分离杯的衔接处设有第三卡接槽和第四卡接槽,第三卡接槽与第三导板卡接,第四卡接槽与第四导板卡接。
本申请的细胞分离装置包括分离座、分离杯以及磁铁,分离座可重复使用,分离杯内的目的细胞可被磁铁吸附,从而实现细胞分离。本申请的细胞分离装置结构简单、成本低、分离效率高。
附图说明
图1是本申请的细胞分离装置一实施例的结构示意图;
图2是图1所示的细胞分离装置另一视角的结构示意图;
图3是图1所示的细胞分离装置的分离杯组件一实施例的结构示意图;
图4是本申请细胞分离方法第一实施方式的流程示意图。
具体实施方式
本申请的细胞分离装置包括分离座、至少一个分离杯以及至少一个磁铁,分离杯用于容纳带磁珠的细胞混合液,分离杯可拆卸式设于分离座上,磁铁设于分离杯的下方,用于将磁珠吸附至分离杯的底部。其中,带磁珠的细胞混合液可为偶联有目的细胞对应抗体的磁珠及细胞样本液,在其他实施例中,也可为偶联有能够与目的细胞特异性结合物质的磁珠及细胞样本液。分离杯能够使得吸附有目的细胞的磁珠被牢牢吸附在分离杯的底部而不挂壁从而提高得率。
本申请的细胞分离装置包括分离座、分离杯以及磁铁,分离座可重复使用,分离杯优选为一次性使用,分离杯内的目的细胞可被磁铁吸附,从而实现细胞分离。本申请的细胞分离装置结构简单、成本低、分离效率高。
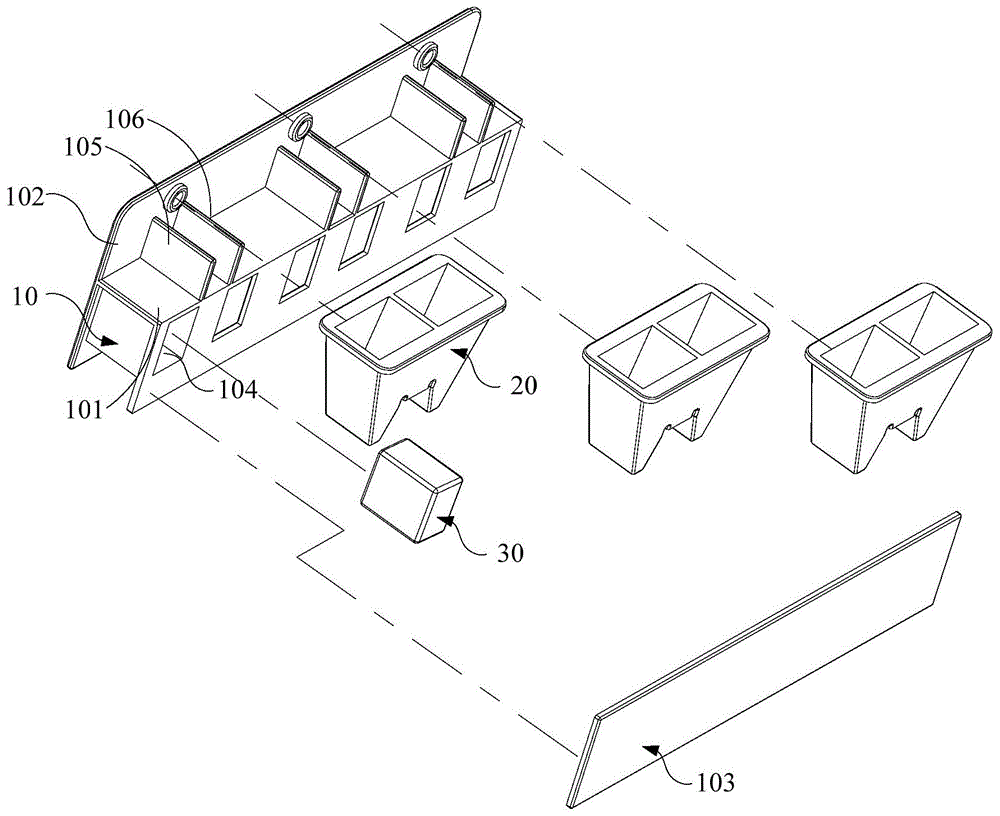
请结合参阅图1-图3,图1是本申请的细胞分离装置一实施例的结构示意图;图2是图1所示的细胞分离装置另一视角的结构示意图;图3是图1所示的细胞分离装置的分离杯组件一实施例的结构示意图。在本实施例中,细胞分离装置包括分离座10、分离杯组件20以及磁铁30。
分离座10包括隔板101、侧板102以及封装板103,隔板101为水平状板体,隔板101的下方设有多个容置槽104,用于容纳磁铁30,多个容置槽104沿隔板101的长度方向间隔设置,并且每一磁铁30与分离杯组件20的分离杯对应。优选地,容置槽104呈方形,磁铁30为方形磁铁30,是一种表面镀锌的钕铁硼,等级为n35,尺寸为7mm×10mm×10mm。优选地,分离座10为白色abs材料形成。
隔板101的上方设有与隔板101垂直的导板组件,导板组件包括平行间隔设置的第一导板105和第二导板106,导板组件包括平行间隔设置的第一导板105和第二导板106。
侧板102设于隔板101的一侧,并与隔板101以及导板组件垂直,侧板102上设有限位孔107。
封装板103与侧板102平行,用于封装磁铁30。当磁铁30装入容置槽104后,即可用封装板103封住,避免磁铁30掉出,封装板103可粘接或卡接在容置槽104的开口一面。
分离杯组件20用于容纳带磁珠的细胞混合液,分离杯组件20可拆卸式设于分离座10上,磁铁30与分离杯组件20底部的分离杯一一对应。其中,带磁珠的细胞混合液可为偶联有目的细胞对应抗体的磁珠及细胞样本液,磁珠的直径优选为500纳米~5000纳米,在其他实施例中,也可为偶联有能够与目的细胞特异性结合物质的磁珠及细胞样本液。分离杯组件20能够使得吸附有目的细胞的磁珠被牢牢吸附在分离杯组件20的底部而不挂壁从而提高得率。具体而言,分离杯组件20由相邻的两个分离杯结合而成,分离杯组件20优选一体成型。分离杯组件20包括第一分离杯201、第二分离杯202以及衔接第一分离杯201和第二分离杯202的衔接块203,衔接块203呈倒v型,衔接块203分别与第一分离杯201和第二分离杯202的衔接处设有第一卡接槽204和第二卡接槽205,第一卡接槽204与第一导板105卡接,第二卡接槽205与第二导板106卡接。在本实施例中,第一分离杯201、第二分离杯202以及衔接块203为一体成型,一体成型的分离杯组件20能够降低加工成本,增加结构稳定性及封闭性。衔接块203向外突设有限位杆206,限位孔107与限位杆206适配。第一卡接槽204和第一导板105的配合以及第二卡接槽205和第二导板106的配合能够使得分离杯组件20在隔板101长度方向上进行限位,限位孔107和限位杆的配合能够使得分离座10和分离杯组件20整体倒置的时候不分离。当然,在其他实施例中,也可采用卡接或粘接的方式将分离杯组件20和分离座10可拆卸式连接。需要说明的是限位杆206也可设置在第一分离杯201和/或第二分离杯202上,在侧板102上的限位孔107与限位杆206一一对应。本实施例的这种三点定位结构能够平稳地将分离杯组件20固定于分离座10上。
本领域技术人员还容易想到以上定位结构的等同实施方式,该等同实施方式应属于本申请的保护范围内。如在侧板102设置限位杆,在衔接块203上设置限位孔。
其中,在本实施例中,磁铁30采用可取出或置入的方式,在其他实施例中,也可将磁铁30与分离座10一体成型,增加结构的稳定性。
优选地,分离杯组件20的侧面均呈平面状,第一分离杯201和第二分离杯202的底部呈平面状以与隔板101抵接。平面与平面的接触能够使得分离杯组件20更平稳地卡置在隔板101上。
在本实施例中,分离杯组件20为透明pc材料,透明pc材料有利于对分离杯内的细胞混合液进行观察,优选每个分离杯的容量为1ml。
优选地,第一导板105和第二导板106的上端面均经过导圆角处理,第一卡接槽204和第二卡接槽205均通过导圆角处理。通过导圆角处理能够使得卡接槽与导板更好地配合,并且减小加工难度。
值得一提的是,在本实施例中,共设有三个分离杯组件20,共六个容器,一次可分离六种细胞。在其他实施例中,本领域技术人员可根据实际情况设置多组分离杯组件20,本申请对此不做限定。
本实施例的细胞分离装置具有以下优点:
1.分离杯组件呈类w型,磁铁可将吸附有目的细胞的磁珠牢牢吸附在分离杯底部而不挂壁,从而提高得率;
2.分离座可重复使用,分离杯一次性使用,成本相对现有技术一次性使用的分离柱而言,大大降低;
3.分离程序与现有小磁珠分离技术相比减少了对磁珠分离柱的润洗、3次反复冲洗、目的细胞冲洗、离心的步骤,与大磁珠相比减少了磁珠细胞分离、含目的细胞上清的吸取、离心的步骤,缩短反应时间,降低人工、物品、时间成本;
4.细胞分离的整个程序均在一个杯子中完成,减少现有技术中分离过程中换试管或容器的交叉污染;
5.整个装置结构简单,拆装方便,易于清洁和消毒。
需要说明的是,上述实施例是将相邻的两个分离杯进行组合形成分离杯组件,在其他实施例中,也可根据实际情况对三个或四个分离杯进行组合,相应的设置多个导板组件进行卡接配合,只要是在分离杯呈v型设置的范畴内,均应属于本申请的保护范围。以下简单说明三个分离杯结合形成分离杯组件的情况。
相邻的三个分离杯结合形成分离杯组件,分离杯组件一体成型。
分离座包括隔板,隔板的下方设有多个容置槽,用于容纳磁铁,隔板的上方设有与隔板垂直的第一导板组件和第二导板组件,第一导板组件包括平行间隔设置的第一导板和第二导板,第二导板组件包括平行间隔设置的第三导板和第四导板;分离杯组件包括第一分离杯、第二分离杯、第三分离杯、第一衔接块和第二衔接块,第一衔接块衔接于第一分离杯和第二分离杯之间,第二衔接块衔接于第二分离杯和第三分离杯之间,第一衔接块和第二衔接块均呈倒v型,第一衔接块分别与第一分离杯和第二分离杯的衔接处设有第一卡接槽和第二卡接槽,第一卡接槽与第一导板卡接,第二卡接槽与第二导板卡接,第二衔接块分别与第二分离杯和第三分离杯的衔接处设有第三卡接槽和第四卡接槽,第三卡接槽与第三导板卡接,第四卡接槽与第四导板卡接。
在一实施方式中,利用上述分离装置分离细胞的步骤如下:
将偶联有目的细胞对应抗体的磁珠和细胞样本液的混合液在2~8℃条件下孵育10~40分钟,如在冰上孵育30min。优选地,孵育温度为3℃~8℃,更优选的孵育温度为4℃。
将孵育好的磁珠和细胞样本液的混合液加入到分离杯中,将分离杯卡入分离座上方,室温静置1-3min,此时偶联有目的细胞的磁珠在磁场在作用沉淀到分离杯底部。
在生物安全柜上铺上无菌纱布,将分离杯和分离座整体倒置,利用纱布的吸水性将分离杯中的溶液吸干。相比于用移液器吸取上清液,该步骤尽可能的将分离杯中的上清液吸出,提高了目的细胞的纯度。
取下分离杯,沉淀在分离杯中的磁珠偶联的阳性细胞可直接用于下一步操作。
通过该实施方式的实施,分离过程相对利用分离柱分离的方法,减少了小磁珠分离柱的润洗、3次反复冲洗、目的细胞冲洗、离心的步骤。与大磁珠分离方法相比减少了磁珠剪切、含目的细胞上清的吸取、离心的步骤。能够缩短分离时间,降低人工、物品、时间成本。且装置简单、易于清洁和消毒。同时分离座可以重复使用,更加灵活。
为提高细胞纯度,还可以向沉淀的磁珠及偶联的细胞中加50~500μl的细胞培养液,重新悬浮磁珠和细胞,重复上述步骤。即可完成洗涤步骤。可选择洗涤1~3次,该洗涤步骤可使细胞纯度提高5%。
在另一实施方式中,利用上述分离装置分离细胞的步骤如下:
将一种或多种偶联有非目的细胞对应抗体的磁珠和细胞样本液的混合液在2~8℃条件下孵育10~40分钟,如在冰上孵育30min。优选地,孵育温度为3℃~8℃,更优选的孵育温度为4℃。
将孵育好的磁珠和细胞样本液的混合液加入到分离杯中,将分离杯卡入分离座上方,室温静置1-3min,此时偶联有非目的细胞的磁珠在磁场在作用沉淀到分离杯底部。
回收分离杯中的上清液中的细胞,丢弃由于磁吸附作用吸附在磁珠上沉淀在分离杯底部的非目的细胞。用移液器在不触碰磁珠的前提下小心将上清吸出,移至另一分离杯(或无菌容器)。上清中所含细胞即为目的细胞。
同样地,为了提高细胞纯度,还可以再次向上清液中加入偶联有非目的细胞对应抗体的磁珠,重复上述步骤,即可完成洗涤步骤。可选择洗涤1~3次。
请参阅图4,图4是本申请细胞分离方法第一实施方式的流程示意图。在该实施方式中,细胞分离方法采用上述任一实施例或实施方式的细胞分离装置进行分离,包括如下步骤:
s410:提供细胞样本液,细胞样本液至少包括第一类细胞。
细胞样本液可以是通过对采集的生物样本进行处理得到的,不同的生物样本均可以按照已有的对应处理方法进行处理,在此不做限定。
s420:将细胞样本液和第一类磁珠混合于分离杯中,第一类磁珠上偶联有第一类抗体,以用于与第一类细胞相结合。
其中,第一类磁珠的直径为500~5000纳米。如500纳米、1000纳米、1500纳米、2000纳米、4000纳米等。该方法中,所用磁珠粒径中等、不损伤细胞、分离纯度高。
s430:将带有第一类磁珠和细胞样本液的分离杯置于带有磁体的分离座的上方,以使磁体将第一类磁珠吸附至分离杯的底部。
第一类磁珠利用第一类抗体与第一细胞结合。
s440:分离第一类磁珠与细胞上清液。
其中,利用磁场吸附磁珠,以将与磁珠结合的细胞与其他细胞分离,可以采用直接倾倒的方式去除细胞上清液。
通过该实施方式的实施,利用小磁珠分离细胞时,不再使用分离柱,而是直接分离磁珠与细胞上清液,能够提高分离速度、降低分离成本,提高分离纯度。
其中,分离第一类磁珠与细胞上清液后,即可获得第一目的细胞,第一目的细胞为沉淀在分离杯中的偶联有第一类磁珠的第一类细胞,偶联有第一类磁珠的第一类细胞可直接用于下一步操作。具体将分离杯从分离座上移开,向分离杯中加入细胞培养液,得到第一目的细胞样本液,第一目的细胞样本液可直接用于下一步操作。当然也可以将第一类磁珠与第一类细胞分离后再用于下一步操作。
在一实施方式中,可以将细胞样本液加入分离杯中,向细胞样本液中加入0.3~2.0倍的第一类磁珠,在分离杯中混合得到细胞混合液。也可以先将细胞样本液与0.3~2.0倍的第一类磁珠进行混合,得到细胞混合液,再将细胞混合液加入到分离杯中,在此不做限定。
在一实施方式中,在向细胞样本液中加入第一类磁珠之后,可以利用振荡器或者混匀器使第一类磁珠与第一类细胞充分混合结合,提高分离效率。在混合过程中应控制振荡或者混匀速度,确保细胞不受损坏。将第一类磁珠与第一类细胞充分混合后,再将容纳有细胞混合液的分离杯放入至分离座上。
在一实施方式中,第一类磁珠的加入量是细胞样本液的0.3~2.0倍,如0.3、0.5、1.0、1.3、1.8、2.0等。该方法所用磁珠粒径小,吸附能力强,因此所用磁珠量较小,降低磁珠用量,降低成本。
在一实施方式中,在去除细胞上清液后,还可以向第一类磁珠中加入细胞培养液,对第一类细胞进行清洗。如加入细胞培养液,重新悬浮磁珠和细胞,然后再放入磁场吸附、去除清液,完成洗涤步骤。可洗涤1~3次。通过洗涤可提高分离细胞纯度,至少能够使分离纯度提高5%。
洗涤结束后,再向第一类磁珠中加入细胞培养液;重新悬浮磁珠和细胞,获得第一类细胞。磁珠采用无毒性的氧化铁和多聚糖组成,可生物降解,因此可以不用分离直接进行后续操作。
在一实施方式中,该方法可用于分离阳性细胞,此时所用磁珠为带有与阳性细胞相对应的抗体的磁珠。当然也可以用来分离阴性细胞。可以采用直接磁性细胞标记的方式,使磁珠与目的细胞结合。也可以采用间接磁性细胞标记,磁珠结合不需要的细胞,此时,目的细胞在细胞上清液中,可对细胞上清液继续分选得到目的细胞。还可以对细胞上清液中的细胞进行再次分选,具体地,细胞样本液中还包括第二类细胞,将细胞上清液和第二类磁珠混合于另一分离杯中,第二类磁珠上偶联有第二类抗体,以用于与第二类细胞相结合;将带有第二类磁珠和细胞上清液的分离杯置于带有磁体的分离座的上方;分离第二类磁珠与细胞上清液;将分离杯从分离座上移开,获得第二目的细胞,第二目的细胞为沉淀在分离杯中的偶联有第二类磁珠的第二类细胞,此时获得的第二目的细胞可直接用于细胞应用等操作。
以上所述仅为本申请的实施方式,并非因此限制本申请的专利范围,凡是利用本申请说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本申请的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!