用于表面结合寡核苷酸的化学裂解和脱保护的组合物和方法与流程
通过参考优先权申请的并入本申请要求2018年5月15日提交的美国临时申请号62/671,816、2019年1月3日提交的62/788,045的优先权,其每一个在此通过引用整体并入。电子格式的序列表本申请与电子序列表一起通过efs-web提交为ascii文本文件。电子序列表提供为名为illinc363woseqlist.txt的文件,创建并最后保存于2019年5月10日,大小为2,806字节。电子序列表中的信息通过引用整体并入本文。
背景技术:
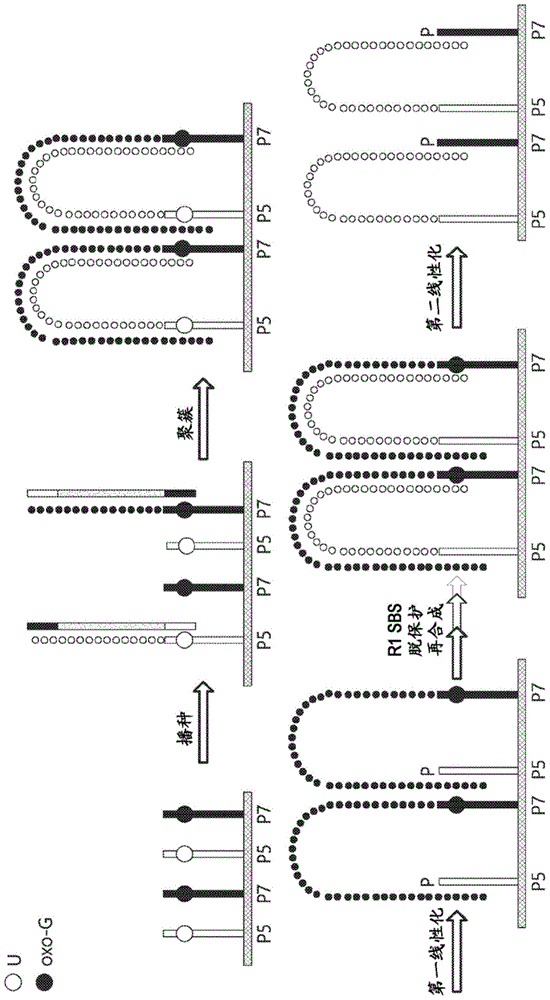
:本公开的实施方案涉及用于多核苷酸测序的模板的制备方法。特别地,本公开涉及通过化学裂解固定在固体载体上的双链多核苷酸的一个或多个第一链而将为测序制备的聚簇多核苷酸线性化,其在某些情况下通过在过渡金属络合物(例如钯络合物或镍络合物)存在下反应来进行。此外,本公开涉及固体载体上经修饰引物的化学介导的脱保护。各种核酸测序方法是本领域已知的。美国专利号5,302,509描述了一种用于测序多核苷酸模板的方法,其涉及实施使用dna聚合酶或dna连接酶以连续地掺入与模板链互补的被标记的多核苷酸的多个延长反应。在这种“边合成边测序”(sbs)反应中,通过连续掺入与模板链互补的各个核苷酸,在5'至3'方向上建立了与模板链碱基成对的新多核苷酸链。测序反应中使用的底物核苷三磷酸酯在3'位标记有不同的3'标记,从而允许确定加入连续核苷酸后所掺入核苷酸的鉴定。为了使核酸测序反应的通量最大化,有利的是能够并行测序多个模板分子。多个模板的并行处理可以通过使用核酸阵列技术来实现。这些阵列通常由固定在固体载体上的多核苷酸的高密度基质组成。在本领域中已经描述了用于制造固定的核酸测定的阵列的各种方法。wo98/44151和wo00/18957均描述了核酸扩增的方法,该方法允许将扩增产物固定于固体载体,以形成包含由多个相同的固定多核苷酸链和多个相同的固定互补链形成的簇或“集落(colony)”。这种类型的阵列在本文中称为“聚簇阵列”。根据这些方法制备的聚簇阵列上的dna集落中存在的核酸分子可以提供用于测序反应的模板,例如如wo98/44152中所述。如在wo98/44151和wo00/18957中描述的固相扩增反应的产物是所谓的“桥连”结构,其通过对固定的多核苷酸链与固定的互补链的配对进行退火而形成,两条链均在5'端附接到固体载体。为了提供用于核酸测序提供更合适的模板,优选去除“桥连”结构中的固定链之一的基本上全部或至少一部分,以产生至少部分为单链的模板。作为单链的模板的部分将因此可用于与测序引物杂交。去除“桥连”双链核酸结构中的一个固定链的全部或一部分的方法被称为“线性化”。存在各种各样的方式进行线性化,包括但不限于酶促裂解、光化学裂解或化学裂解。线性化方法的非限制性示例被公开在pct公开号wo2007/010251、和美国专利公开号2009/0088327、和美国专利公开号2009/0118128中,其整体通过参考合并于此。已知酶促方法促进寡核苷酸或多核苷酸的有效位点特异性裂解,以线性化双链dna簇并脱保护表面结合的引物。目前,在各种测序应用中,酶已广泛用于这两种类型的反应中。然而,该酶促途径存在特定问题,包括酶的稳定性、酶生产的成本、具体存储和处理要求、酶活性的变动、和测序读出中的高背景强度。因此,需要开发用于有效dna测序的替代线性化和脱保护方法。然而,在该语境中可以用于线性化步骤的反应类型方面存在许多限制,其理由在于,试剂、条件、和副产物(a)必须与上游和下游反应相容,包括寡核苷酸的杂交和去杂交、引物pcr延长、和dna合成;(b)必须在酸性、碱性和氧化条件下显示出良好的稳定性;(c)必须进行快速且清洁的化学反应;并且(d)不能干扰核苷酸检测方法。本公开描述了化学裂解和脱保护步骤,其是满足上述限制的有效替代方案。技术实现要素:本公开的一些实施方案涉及将多个固定的双链多核苷酸线性化的方法,其包括:提供包含双链多核苷酸的固体载体,其中每个双链多核苷酸包含第一链和第二链,其中第一链和第二链各自在其5'端固定于固体载体,并且其中每个第一链包含能够在过渡金属络合物存在下进行化学裂解的第一裂解位点,其中过渡金属络合物是钯络合物或镍络合物;使双链多核苷酸与过渡金属络合物的水溶液接触,从而在第一裂解位点裂解一个或多个第一链,并产生一个或多个裂解的第一核酸和裂解的固定的第一链;以及,从固体载体上去除裂解的第一核酸。在这样的方法中,在从固体载体上去除裂解的第一核酸之后,固定的第二链保留在固体载体上,并且与裂解的固定的第一链保持杂交。在一些实施方案中,钯(pd)络合物是pd(0)络合物。在一些实施方案中,镍(ni)络合物是ni(0)络合物。在一些实施方案中,第一裂解位点包含烯丙基官能度。在一些其他实施方案中,第一裂解位点还包含磷酸酯部分。在一些实施方案中,第一裂解位点是包含磷酸烯丙酯部分的经修饰的核苷或核苷酸。本公开还涉及固体载体上的寡核苷酸的化学脱保护的方法,其包括:提供固体载体,其具有固定在其上的多个寡核苷酸,其中寡核苷酸各自在3'羟基上包含保护基,例如含有能够进行化学脱保护的磷酸酯基的经修饰的核苷酸或核苷、或者经修饰的3'末端磷酸酯部分;和,使所述寡核苷酸与脱保护试剂反应,从而裂解保护基(如修饰的3'末端磷酸酯部分),以产生固定的寡核苷酸与游离的3'羟基。在一些方面,保护基是具有式(i)的结构的3'末端磷酸酯部分:其中磷酸酯部分是固定的寡核苷酸的3'末端处的磷酸酯;r1为-nh2、-oh、-nhc(o)ora或-och2osi(rb)3;其中ra为c1-4烷基、叔丁基、烯丙基、苄基或9-芴基甲基;并且每个rb独立地选自c1-4烷基和苯基;并且r2为h、c1-4烷基、任选取代的四氢呋喃、或核苷酸。在式(i)的一些方面,r1是-nhc(o)ora。在一些方面,ra为9-芴基甲基、苄基或烯丙基。在一些方面,r1是-och2osi(rb)3。在一些方面,每个rb为异丙基。在一些方面,每个rb独立地为甲基、乙基、叔丁基或苯基。在一些方面,所述脱保护试剂是氟离子(例如tbaf、hf或csf)或温和碱(例如氢氧化钠)。在一些方面,固定的寡核苷酸是通过本文所述的第一链的化学裂解产生的裂解的固定的第一链。因此,在一些方面,第一链包含经修饰的核苷酸,其在裂解并从固体载体上去除裂解的第一核酸后存在于裂解的固定的第一链中。本文所述的方法包括:在read1完成后去除裂解的固定的第一链的3'羟基保护基。在一些实施方案中,裂解的固定的第一链包含末端磷酸酯基。在其它方面,所述方法包括:在裂解并从固体载体上去除裂解的第一核酸后对裂解的固定的第一链的3'末端磷酸酯进行封端。在某些方面,封端通过下述方式进行:在固定的第二链测序之前使3'末端磷酸酯与封端基团反应,并根据本文所述的化学裂解方法,在read1完成后去除封端基团以生成3'羟基。在脱保护反应期间和之后,第二链的3'端与固定的裂解的第一链保持杂交。在其他方面,3'羟基保护基是磷酸酯基或部分,其在第一裂解后存在于裂解的固定的第一链中,且所述方法包括在去磷酸化酶、例如t4pnk存在下去除磷酸酯基或部分。在酶促脱保护反应期间和之后,第二链的3'末端与固定的裂解的第一链保持杂交。在一些实施方案中,所述方法进一步包括在从固体载体上去除裂解的第一核酸后对固定的第二链进行测序。在一些方面,测序包括连续掺入与固定的第二链互补的被标记的核苷酸,并在每次连续掺入之后检测被标记的核苷酸。在配对末端测序中,双链核酸的两条链最终都被测序,并且在这种情况下,固定的第二条链的测序在本文中称为“read1”。在其他实施方案中,每个固定的第二链包含能够进行化学裂解的第二裂解位点。在一些方面,在对第二链进行测序(read1),并从固定的裂解的第一链上去除3'羟基保护基之后,所述方法进一步包括合成固定的第二链的互补序列以产生衍生的双链多核苷酸,其中各衍生物双链多核苷酸包含第二链和衍生第一链,其中,所述衍生第一链和第二链各自在其5'端固定于固体载体。本公开的方法包括:在第二裂解位点裂解一个或多个第二链,从而产生一个或多个裂解的第二核酸和裂解的固定的第二链;和,从固体载体上去除裂解的第二核酸。在这样的方法中,固定的衍生第一链在从固体载体上去除裂解的第二核酸之后保留在固体载体上,并且与裂解的固定的第二链保持杂交。在一些这样的实施方案中,第二链的第二裂解位点能够进行化学裂解,并且第二链是通过化学反应而裂解。例如,第二裂解位点包含一个或多个连位二醇连接(可以通过氧化而裂解,例如用高碘酸盐试剂处理)、二硫醚连接(可裂解,例如在还原条件下、如dtt,或者在膦存在下)、邻硝基苄基(可裂解,例如通过光解)、偶氮苯连接(可裂解,例如在na2s2o4存在下)、烷基-硒连接(可裂解,例如通过氧化、如过氧化氢)、甲硅烷基醚连接(可裂解,例如通过氟离子、酸或碱)、或氨基甲酸烯丙酯连接(可裂解,例如在钯络合物存在下)。在一些方面,选择连接使得第二裂解释放羟基部分。在一些方面,裂解去除了接头反应位点(例如,连位二醇的氧化留下两个分离的羰基化合物,并且不再存在二醇)。在一些方面,第二裂解位点在沿着第二链的任何位置处,但是优选在第二链的5'端附近(例如,在与固体载体的附接点附近)附接在骨架上。在一些实施方案中,用于裂解第一链和第二链的化学裂解条件是不同的,并且第一链和第二链可以不通过相同的裂解条件裂解(例如裂解位点是正交的)。在一些方面,两个裂解步骤不必都是化学裂解步骤。例如,第一链可通过酶促反应裂解,而第二链可通过化学反应裂解,或第一链可通过化学反应裂解,而第二链可通过酶促反应裂解。本公开的一些附加实施方案涉及将多个固定的双链多核苷酸线性化的方法,其包括:提供包含双链多核苷酸的固体载体,其中每个双链多核苷酸包含第一链和第二链,其中第一链和第二链各自在其5'端固定于固体载体,并且其中每个第一链包含第一裂解位点,并且每个第二链包含含有偶氮苯接头的第二裂解位点;在第一裂解位点裂解一个或多个第一链,并产生一个或多个裂解的第一核酸和裂解的固定的第一链;从固体载体上去除裂解的第一核酸;对固定的第二链进行测序;再合成与第二链互补的衍生第一链;并且,在第二裂解位点裂解一个或多个第二链,并产生一个或多个裂解的第二核酸和裂解的固定的第二链。在此类方法的某些方面,固定的衍生第一链在从固体载体上去除裂解的第二核酸后仍保留在固体载体上,并与裂解的固定的第二链保持杂交。在一些方面,所述方法进一步包括:在从固体载体上去除裂解的第二核酸之后对固定的衍生第一链进行测序。在一些方面,测序包括连续掺入与固定的衍生第一链互补的被标记的核苷酸,并在每次连续掺入之后检测标记的核苷酸。在配对末端测序中,双链核酸的两条链最终都被测序,在这种情况下,固定的衍生第一链的测序在本文中称为“read2”。本公开的一些实施方案涉及制备3'封端部分的方法,所述3'封端部分可以在配对末端测序方法(美国公开号2009/0088327中描述,其通过引用而整体合并于此)中通过化学反应而被去除。所述方法包括:提供包含双链多核苷酸的固体载体,每个双链多核苷酸包含第一链和第二链,其中第一链和第二链在其5'端固定于固体载体,其中每个第一链包含第一裂解位点;在第一裂解位点裂解一个或多个第一链,以产生一个或多个裂解的第一核酸和固定的裂解的第一链;和,向裂解的固定的第一链的3'端引入3'封端部分,其中3'封端部分可以通过化学反应而被去除。在一些其他实施方案中,替代向裂解的固定的第一链的3'端引入3'封端部分,而是在所述裂解步骤之后由第一裂解位点产生3'封端部分。在一些实施方案中,3'封端部分包含含有磷酸酯部分的经修饰的核苷或核苷酸。在一个这样的实施方案中,3'封端部分包含经修饰的核苷,所述经修饰的核苷在核苷的5'位含有额外的-ch2oh或被保护的-ch2oh。在另一个这样的实施方案中,3'封端部分包含经修饰的核苷,所述经修饰的核苷在核苷的5'位含有额外的-ch2nh2或被保护的-ch2nh2。在一些实施方案中,所述方法进一步包括在化学反应中,例如在包含氟化物试剂或碱的水溶液中,去除3'封端部分。本公开的一些实施方案涉及一种固体载体,其包括固定在其上的多个第一链多核苷酸,每个第一链多核苷酸包括能够通过钯络合物或镍络合物进行化学裂解的第一裂解位点,其中多个第一链多核苷酸在其5'端固定于固体载体。在一些实施方案中,固体载体还包含固定在其上的多个第二链多核苷酸,每个第二链多核苷酸包含第二裂解位点,其中多个第二链多核苷酸在其5'端固定于固体载体。在一些实施方案中,钯络合物是钯(0)络合物。在一些实施方式中,第一裂解位点包含一个烯丙基官能度。在一个实施方案中,第一裂解位点包含烯丙基dt。在一些其他实施方案中,第一裂解位点还包含磷酸酯部分,其在化学裂解后保留在裂解的固定的第一链上。在一个实施方案中,磷酸酯部分包含式(i)的结构。在一些实施方案中,第二裂解位点可以通过选自化学裂解、光裂解、酶促裂解或它们的组合中的方法而裂解。在一个实施方案中,第二裂解位点通过化学裂解反应而裂解。在一些这样的实施方案中,第二裂解位点可包含如下所述的式(viii)或(viiia)的二醇接头、或式(x)的偶氮苯接头。本公开还涉及经修饰的核苷或核苷酸和寡核苷酸、以及制备此类化合物的方法。在一个方面,经修饰的核苷或经修饰的核苷酸包含式(ii)的结构:其中r为h、oh或opg;r1为h或pg;r2为h、pg,或-or2为磷酸酯基;pg是羟基保护基;碱基是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些实施方案中,磷酸酯基可以带负电荷(例如-po4-)。在一个方面,经修饰的核苷或核苷酸具有式(iia)的结构:在一个方面中是经修饰的核苷或核苷酸,其当式(ii)的经修饰的核苷或核苷酸被掺入寡核苷酸或多核苷酸中时,其包括式(ii')的结构,其中烯丙基修饰的核苷或核苷酸的3'氧共价附接到另一个核苷酸的5'端(结构未显示):在一些实施方案中,磷酸酯基可以带负电荷(例如-po4-)。在另一方面是寡核苷酸,其包含烯丙基核苷或核苷酸,其中寡核苷酸为式(iii)的化合物:其中每个碱基独立地是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物;且所述寡核苷酸任选地结合于固体载体。在一些实施方案中,磷酸酯基可以带负电荷(例如-po4-)。在一些方面,寡核苷酸的5'端(在星号处)结合于固体载体。另外的公开涉及用于将烯丙基核苷酸掺入多核苷酸中的化学试剂,其中该化学试剂为式(iv)的化合物:其中pg为h或羟基保护基;并且碱基是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些方面,pg是在温和酸性条件下可裂解的保护基。在一些方面,pg是三苯基甲基或二甲氧基三苯基甲基(dmt)。在某些方面,是一种制备式(iv)的化合物的方法,其包括:使式a的化合物与乙烯基格氏试剂(例如乙烯基mgcl或乙烯基mgbr)反应,任选在室温下,以形成式b的化合物:在一些方面,所述方法包括氧化式c的化合物(任选地经由pfitzner-moffatt氧化,或使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)、或n,n'-二环己基碳二亚胺(dcc)、二氯乙酸(dca)和dmso):从而形成式a化合物。在一些方面,所述方法包括使式d的化合物:在碱(例如咪唑)存在下与tbdpscl(叔丁基二苯基甲硅烷基氯)反应,然后在不分离双保护的中间体的情况下,通过一锅法与温和酸(例如ptsa(对甲苯磺酸))反应,从而形成式c的化合物。另一方面是3'封端部分的核苷或核苷酸,其包含式(i)的结构:其中r1为-nh2、-oh、-nhc(o)ora或-och2osi(rb)3;ra为c1-4烷基、叔丁基、烯丙基、苄基或9-芴基甲基;每个rb独立地选自c1-4烷基和苯基;并且r2为h、c1-4烷基、任选取代的四氢呋喃、或核苷酸。在一些实施方案中,磷酸酯基可以带负电(例如po4-)。在另一个方面中,是3'磷酸酯修饰的核苷或核苷酸,其包含式(v)的结构:其中r1为-nh2、-oh、-nhc(o)ora或-och2osi(rb)3;ra为c1-4烷基、叔丁基、烯丙基、苄基或9-芴基甲基;每个rb独立地选自c1-4烷基和苯基;且碱基是任选被保护的腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些实施方案中,磷酸酯基可以带负电(例如po4-)。在一些实施方案中,式(v)的化合物可以由式(v')的化合物制备:其中x是o或nh;r1'是被保护的oh(即-o-tom、-o-三苯基甲基、-o-dmt、-otms、-o-tbdms、-o-tips、-obz)或被保护的nh2(即-nh-boc、-nh-fmoc、-nh-cbz、-nh-alloc);r1为nh2或oh。在另一方面,是包含式(v)的3'磷酸酯修饰的核苷酸的寡核苷酸,其中寡核苷酸是式(vi)的化合物:其中r1为-nh2、-oh、-nhc(o)ora或-och2osi(rb)3;ra为c1-4烷基、叔丁基、烯丙基、苄基或9-芴基甲基;每个rb独立地选自c1-4烷基和苯基。每个碱基独立地是任选被保护的腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些实施方案中,寡核苷酸任选地结合于固体载体。在一些实施方案中,磷酸酯基可以带负电(例如po4-)。在一些实施方案中,式(vi)的化合物可以由式(vi')的化合物制备:其中x是o或nh;r1'是被保护的oh(即-o-tom、-o-三苯基甲基、-o-dmt、-otms、-o-tbdms、-o-tips、-obz)或被保护的nh2(即-nh-boc、-nh-fmoc、-nh-cbz、-nh-alloc);r1为nh2或oh。在式(v)或(vi)的某些方面,r1为-nhc(o)ora。在一些方面,ra为9-芴基甲基、苄基或烯丙基。在一些方面,r1是-och2osi(rb)3。在一些方面,每个rb为异丙基。在一些方面,每个rb独立地为甲基、乙基、叔丁基或苯基。本公开还涉及一种用于引入3'磷酸酯修饰的核苷酸到多核苷酸中的化学试剂,其中化学试剂是式(vii)的化合物:其中r1如上所定义;pg为h或羟基保护基;且碱基是任选被保护的腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在式(vii)的一些方面,r1是-nhc(o)ora。在一些方面,ra为9-芴基甲基、苄基或烯丙基。在一些方面,r1是-och2osi(rb)3。在一些方面,每个rb为异丙基。在一些方面,每个rb独立地为甲基、乙基、叔丁基或苯基。本公开还涉及制备用于掺入多核苷酸的二醇接头的方法。在一些方面,所述二醇接头是在美国专利号8,715,966中描述的二醇接头。在一些方面,二醇接头具有式(viii)的结构:其中r是2、3、4、5或6;s是2、3、4、5或6;“a”氧是第一核苷酸的3'羟基氧;且“b”氧是第二核苷酸的5'羟基氧。在一些方面,二醇接头具有式(viiia)的结构:其中“a”和“b”如上定义。本公开涉及制备用于将式(viii)或(viiia)的接头掺入多核苷酸中的化学试剂的方法,其中化学试剂为式(ix)的化合物:其中r为2、3、4、5或6(在某些方面,r为5);s是2、3、4、5或6(在某些方面,s是3);并且pg是在弱酸性条件下可去除的保护基(例如三苯基甲基或二甲氧基三苯基甲基)。附图说明图1示出了illumina的边合成边测序(sbs)化学的工作流程的实施方案。图2a示出用pd(0)络合物处理前和处理后的非图案化高引物密度流动池表面的typhoon图像,其中流动池表面接枝有烯丙基修饰的引物。图2b是显示在图2a中pd(0)处理后的引物密度变化的柱状图,其相比于接枝有对照引物而不具有烯丙基官能度的流动池表面。图3a是显示来自非图案化高引物密度引流动池的tet染料表面荧光qc测定(tet-qc)结果的柱状图,所述流动池接枝有烯丙基改性的p5引物和标准p7引物(通道1-4),相比于接枝有标准p5/p7引物(通道5-8)的流动池。图3b示出图3a中描述的tet-qc后的流动池表面的typhoon图像。图4说明了使用标准流动池和新型流动池的2通道仪器上测序数据的%错误率。图5a示出在1至10当量thp(10mg/ml,每种条件下n=4)存在下从pd(c3h5)cl)2分离的制剂的p15裂解活性,其相比于(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)(n=2)的制剂。图5b示出了包含[pd(c3h5)(thp)2]cl和1当量或更多当量thp(12mmpd,对于每个条件n=2)的制剂的p15裂解活性,其相比于(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)(n=2)的制剂。图6a显示了与原位产生的pd(0)试剂相比,10mmpd(thm)4的novaseqtm平均read1强度。图6b显示了与原位产生的pd(0)试剂相比,10mmpd(thm)4的novaseqtm平均phix错误率。图7显示了pd(thp)2-4(10mg/ml)的p15裂解活性,其相比于(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)的制剂。图8是用pd-thp或ni-thp处理后接枝有p15/p7引物的流动池的荧光强度的柱状图。具体实施方式非酶促化学线性化策略是用于在每次测序读出之前裂解桥连的双链多核苷酸结构的有吸引力的替代方案。特别地,化学品通常可以存储在室温下长时间,并且与酶相比相对便宜。本申请涉及用于生成测序用模板的固定在固体载体上的双链多核苷酸簇的化学线性化方法。每个双链多核苷酸包含第一链和第二链。第一链通过延长固定于固体载体的第一延长引物产生,并且第二链通过延长固定于固体载体的第二延长引物产生。第一链和第二链中的每一个都包含裂解位点。在一些实施方案中,第一链包含能够通过钯络合物或镍络合物、例如钯(0)络合物或ni(0)络合物裂解的裂解位点。在一个特定的实施方案中,裂解位点位于第一链的第一延长引物部分中。在另一个实施方案中,裂解位点包含具有烯丙基官能度的胸腺嘧啶核苷或核苷酸类似物。在一些实施方案中,第二链包含裂解位点,所述裂解位点包括能够通过化学试剂、例如na2s2o4裂解的偶氮苯接头。替代地,第二链包含裂解位点,所述裂解位点包括能够通过高碘酸盐、例如naio4裂解的二醇接头。本文所述的方法可以用作在诸如illumina(sandiego,ca)的或系统的系统上的边合成边测序(sbs)反应的一部分。图1描述了illuminasbs化学的标准工作流程的一个实施方案。首先,提供固体载体,其包含固定在该固体载体表面上的多个p5/p7引物。每个p5和p7引物在序列内具有裂解位点。在一个实施方案中,p5引物上的裂解位点是脱氧尿苷(u)。在一个实施方案中,p7引物上的裂解位点是8-氧代鸟嘌呤核苷酸(oxo-g)。待测序的一组靶dna分子被杂交到固定的p5/p7引物。杂交后,原始靶dna分子被去除,仅留下含有p5/p7引物的延长多核苷酸的互补拷贝。此步骤也称为“播种”步骤。然后,将延长的p5/p7多核苷酸通过被称为“桥式扩增”的方法扩增,形成双链簇,其中两条链在5'端被附接到固体载体。在“聚簇”步骤之后,实施第一线性化以去除所述含有p5引物的延长多核苷酸的一部分。在一个实施方案中,这种去除通过使用酶user以裂解p5引物上的u位的酶促裂解反应而得到促进。在第一轮的sbs(读出1)后,实施再合成,以再次形成双链多核苷酸。然后,实施第二线性化以去除含有p7引物的延长多核苷酸的一部分。在一个实施方案中,这种去除通过使用酶fpg以裂解p7引物上的oxo-g位的酶促裂解反应而得到促进。然后进行第二轮sbs(read2)以测序靶dna。p5和p7引物在illumina,inc.出售的商用流动池的表面上用于在和genome平台上测序。引物序列中被描述于美国专利公开号2011/0059865a1,其通过引用以其整体并入本文。用于配对末端测序的标准p5和p7引物序列包括:p5:配对末端5'→3'aatgatacggcgaccaccgagauctacac(seqidno.1)p7:配对末端5'→3'caagcagaagacggcatacgag*at(seqidno.2)其中g*是8-氧代-鸟嘌呤。任选地,p5和p7引物之一或两者可以包含多t尾。多t尾通常位于上述序列的5'端,但是在某些情况下可以位于3'端。多t序列可以包含任何数目的t核苷酸,例如2至20。在带有多t间隔子的涂有pazam的流动池上使用的标准p5和p7引物序列包括:p5引物,具有多t间隔子:5'-炔-ttttttttttaatgatacggcgaccaccgagauctacac(seqidno.3)p7引物,具有多t间隔子:5'-炔-ttttttttttcaagcagaagacggcatacgag*at(seqidno:4)其中g*是8-氧代-鸟嘌呤。其他引物序列包括用于单读出sbs的一组p5和p7引物:p5:单读出5'→3'aatgatacggcgaccaccga(seqidno.7)p7:单读出5'→3'caagcagaagacggcatacga(seqidno.8)如本文使用的,当标准p5/p7引物或寡核苷酸被修饰以掺入能够进行化学裂解的第一裂解位点或第二裂解位点(例如通过pd络合物或ni络合物)时,p5/p7引物的修饰可能是指p5/p7序列中现有核苷酸(或核苷)被不同的化学实体(例如,具有特定官能度的经修饰核苷酸或核苷类似物)取代或替换,以实现位点特异性化学裂解。修饰还可以指将新化学实体插入现有的p5/p7序列中,其中新化学实体能够进行位点特异性化学裂解。在一些实施方案中,经修饰的p5/p7引物分别称为p15/p17引物,包括以下:p15引物5'→3'5'-炔-ttttttaatgatacggcgaccaccgagaxctacac(seqidno.5)如方案1所示,其中x=烯丙基t核苷。p17引物5'→3'5'-炔-ttttttyyycaagcagaagacggcatacgagat(seqidno.6)其中y是受到化学裂解的二醇接头,所述化学裂解例如用试剂如高碘酸盐氧化,如在美国公开号2012/0309634中公开的,其通过引用而整体并入本文。在一些实施方案中,二醇接头包含本文所述的式(viii)或(viiia)。定义在此使用的章节标题仅用于行文目的,而不应被解释为限制所描述的主题。除非另有定义,否则本文中使用的所有技术和科学术语具有与本领域普通技术人员通常所理解的相同含义。术语“包括(including)”以及其他形式(例如“包括(include)”、“包括(includes)”和“包括(included)”)的使用不是限制性的。术语“具有(having)”以及其他形式(例如“具有(have)”、“具有(has)”和“具有(had)”)的使用不是限制性的。如在本文中所使用的,无论是在过渡性短语中还是在权利要求的主体中,术语“包含(comprise(s))”和“包含(comprising)”均应被解释为具有开放式含义。也就是说,以上术语将与短语“至少具有”或“至少包括”同义地解释。例如,当在方法的语境中使用时,术语“包含”是指方法至少包括所述步骤,但是可以包括其他步骤。当在化合物、组合物或装置的语境中使用时,术语“包含”是指该化合物、组合物或装置至少包括所列举的特征或组分,但是也可以包括其他特征或组分。如本文所用,常见的有机缩写定义如下:ac乙酰基ac2o乙酸酐alloc烯丙氧基羰基aq.水性的boc或boc叔丁氧基羰基bz苄基℃温度(摄氏度)cbz苄氧基羰基cvd化学气相沉积datp三磷酸脱氧腺苷dctp三磷酸脱氧胞苷dgtp三磷酸脱氧鸟苷dttp三磷酸脱氧胸腺嘧啶ddntp脱氧核苷酸dcm二氯甲烷dmf二甲基甲酰胺dmt或dmtr二甲氧基三苯基甲基etoac乙酸乙酯fc流动池fmoc芴基甲氧基羰基g克h或hr小时ipa异丙醇lcms液相色谱-质谱ml毫升ni镍pe石油醚pazam任何丙烯酰胺与azapa比的聚(n-(5-叠氮基乙酰胺基戊基)丙烯酰胺-共-丙烯酰胺)pd钯rt室温sbs边合成边测序tbaf四正丁基氟化铵tbdms三丁基二甲基甲硅烷基tea三乙胺tfa三氟乙酸tert,t叔thf四氢呋喃thm三(羟基甲基)膦thp三(羟基丙基)膦tips三异丙基甲硅烷基tlc薄层色谱tms三甲基甲硅烷基tom三异丙基甲硅烷氧基甲基trityl三苯基甲基μl微升如本文所用,术语“共价连接”或“共价键合”是指化学键的形成,其特征在于原子之间电子对的共享。例如,共价附接的聚合物涂层是指与通过其他方式、例如粘附或静电相互作用而附接至表面相比,与基底的官能化表面形成化学键的聚合物涂层。如本文所用,术语“延长引物”是指固定在固体载体上的寡核苷酸或多核苷酸,其中寡核苷酸或多核苷酸能够特异性地结合于靶单链核酸分子的序列。在杂交过程之后,寡核苷酸或多核苷酸被延长以包含与靶核酸分子互补的序列。在某些情况下,术语“延长引物”可与“扩增引物”互换使用。如本文所用,术语“核酸”和“核苷酸”旨在与它们在本领域中的使用一致,并且包括天然存在的物种或其功能类似物。核酸的特别有用的功能类似物能够以序列特异性方式与核酸杂交,或者能够用作复制特定核苷酸序列的模板。天然存在的核酸通常具有包含磷酸二酯键的骨架。类似物结构可具有替代的骨架连接,包括本领域已知的各种骨架。天然存在的核酸通常具有脱氧核糖(例如在脱氧核糖核酸(dna)中发现)或核糖(例如在核糖核酸(rna)中发现)。核酸可包含具有本领域已知的这些糖部分的多种类似物中的任何类似物的核苷酸。核酸可包括天然或非天然核苷酸。在这方面,天然脱氧核糖核酸可以具有选自腺嘌呤、胸腺嘧啶、胞嘧啶或鸟嘌呤中的一种或多种碱基,而核糖核酸可以具有选自尿嘧啶、腺嘌呤、胞嘧啶或鸟嘌呤中的一种或多种碱基。可以包含在核酸或核苷酸中的有用的非天然碱基是本领域已知的。当用于核酸时,术语“探针”或“靶”旨在在本文阐述的方法或组成的语境中作为核酸的语义标识符,并且不一定限制核酸的结构或功能,除非另有明确说明。术语“探针”和“靶”可以类似地应用于其他分析物,例如蛋白质、小分子、细胞等。如本文所用,术语“多核苷酸”通常是指核酸,包括dna(例如基因组dnacdna)、rna(例如mrna)、合成的寡核苷酸和合成的核酸类似物。多核苷酸可以包括天然的或非天然的碱基、或它们的组合;以及天然或非天然骨架连接,例如硫代磷酸酯、pna或2'-o-甲基-rna、或它们的组合。在一些情况下,术语“多核苷酸”、“寡核苷酸”或“寡核苷酸(oligo)”可互换使用。本文中所用的“裂解位点”是指在多核苷酸序列上的位置,在此多核苷酸的一部分可以通过裂解反应而去除。裂解位点的位置优选是预定的,这意味着裂解反应发生的位置是预定的,而不是在事先不知道其位置的随机位点进行裂解。如本文所用,术语“固体载体”是指不溶于水性液体的刚性基材。基底可以是无孔的或多孔的。基底可以任选地能够吸收液体(例如由于孔隙),但是通常将具有足够的刚性,以使基底在吸收液体时基本上不溶胀,并且在通过干燥去除液体时基本上不收缩。无孔固体载体通常是液体或气体不可渗透的。示例性的固体载体包括但不限于:玻璃和改性或官能化的玻璃、塑料(例如丙烯酸树脂、聚苯乙烯和苯乙烯与其它材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflontm、环烯烃、聚酰亚胺等)、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物。对于某些实施方案特别有用的固体载体是位于流动池仪器内的流动池的组件。固体载体可以具有平坦的表面,例如流动池;或具有非平坦的表面,例如珠。每当取代基被描述为双自由基(即,具有与分子其余部分的两个连接点)时,应理解的是,除非另有说明,否则该取代基可以以任何定向构型连接。因此,例如表示为-ae-或的取代基包括取向以使得a连接在分子的最左侧连接点的取代基、以及a连接在分子的最右侧连接点的情况。钯(pd)或镍(ni)辅助的第一化学线性化方法本公开的一些实施方案涉及将多个固定的双链多核苷酸线性化的方法,其包括:提供包含双链多核苷酸的固体载体,其中每个双链多核苷酸包含第一链和第二链,其中第一链和第二链各自在其5'端固定于固体载体,并且其中每个第一链包含能够在裂解试剂存在下进行化学裂解的第一裂解位点;使双链多核苷酸与裂解试剂接触,从而在第一裂解位点裂解一个或多个第一链,并产生一个或多个裂解的第一核酸和裂解的固定的第一链;以及,从固体载体上去除裂解的第一核酸。在一些方面,裂解位点能够在pd络合物或ni络合物存在下进行裂解。在一些方面,裂解试剂是pd络合物或ni络合物的水溶液。在一些方面,裂解试剂是原位制备的。在本文所述的pd/ni线性化方法的一些实施方案中,每个第一链从固定于固体载体的第一延长引物延长。在一些这样的实施方案中,第一延长引物包含核苷酸序列,其是本文公开的p5或p7序列、或与p5或p7互补的序列。在一个实施方案中,第一延长引物包含p5核苷酸序列(seqidno.1)。在另一个实施方案中,第一延长引物包含多t间隔子p5核苷酸序列(seqidno.3)。在一个实施方案中,第一延长引物是p5引物。在另一个实施方案中,第一延长引物是多t间隔子p5引物。在进一步的实施方案中,第一延长引物包含核苷酸序列,所述核苷酸序列是本文公开的p5或p7序列、或与p5或p7互补的序列,其中该序列的一个核苷酸被易感于在钯络合物存在下的裂解的经修饰的核苷酸替代。在一些方面,第一延长引物包含本文所述的p15的核苷酸序列(seqidno.5)。在本文所述的pd/ni线性化方法的一些实施方案中,第一延长引物包含第一裂解位点。在一些其他实施方案中,第一裂解位点包含能够例如通过钯络合物进行化学裂解的经修饰的核苷酸或核苷。在一些实施方案中,经修饰的核苷或核苷酸具有式(ii)的结构:其中r为h、oh或opg;r1为h或pg;r2为h、pg或-or2为磷酸酯基;pg是羟基保护基;碱基是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些实施方案中,磷酸酯基可以带负电荷(例如-po4-)。在一方面,经修饰的核苷或核苷酸具有式(iia)的结构:在一些实施方案中,掺入经修饰的核苷或核苷酸部分的第一裂解位点包含式(ii')的结构,其中烯丙基修饰的核苷或核苷酸的3'氧共价附接到另一个核苷酸的5'端(结构未显示):在一些实施方案中,磷酸酯基可以带负电荷(例如-po4-)。在一些其他实施方案中,经修饰的核苷酸或核苷可以进一步用可检测标记、例如荧光标记来进行标记。在一些实施方案中,经修饰的核苷酸在核苷酸或核苷的5'碳处包含乙烯基取代基,从而形成相对于5'羟基的烯丙基部分。在一些实施方案中,5'羟基连接至第二核苷酸的3'磷酸酯,使得二核苷酸单元包含具有磷酸烯丙酯部分的裂解位点。在一些实施方案中,经修饰的核苷酸或核苷是胸腺嘧啶(t)核苷或核苷酸类似物。在一些进一步的实施方案中,3'羟基保护(或封端)的基团、例如磷酸酯部分(如式(ii')示出)在第一链的化学裂解之后保留在裂解的固定的第一链上。在一个这样的实施方案中,第二核苷酸的3'磷酸酯部分共价附接至经修饰的核苷类似物的5'-碳位(即,磷酸酯基包括经修饰的核苷酸的5'羟基)。在一些实施方案中,裂解位点位于第一延长引物的3'端附近,例如在距第一延长引物的3'端1、2、3、4、5、6、7、8、9或10个核苷酸的距离内。在一些其他实施方案中,裂解位点位于第一延长引物的5'端附近,例如在距第一延长引物的5'端1、2、3、4、5、6、7、8、9或10个核苷酸的距离内。在一些情况下,为了确保有效的dna再合成,裂解位点优选地位于朝向第一引物的3'端,例如2至8、或3至7、或4至6个核苷酸的距离。在一个实施方案中,第一延长引物是p5引物,并且第一裂解位点位于p5引物序列中(例如,通过添加到或替换一个核苷酸,将经修饰的核苷酸掺入到p5引物序列)。因此,本文公开的p5序列(seqidno.1或seqidno.3)被修饰为包括能够通过pd/ni络合物进行化学裂解的第一裂解位点,从而形成经修饰的p5引物。在一个实施方案中,经修饰的p5引物包含或为本文公开的p15引物(seqidno.5)。钯试剂在本文所述的pd线性化方法的一些实施方案中,在化学线性化方法中使用的pd络合物是水溶性的。在一些这样的实施方案中,pd络合物是pd(0)络合物。在某些情况下,pd(0)络合物可以通过诸如烯烃、醇、胺、膦或金属氢化物的试剂还原pd(ii)络合物而原位生成。合适的钯源包括na2pdcl4、(pdcl(c3h5))2、[pd(c3h5)(thp)]cl、[pd(c3h5)(thp)2]cl、pd(oac)2、pd(ph3)4、pd(dba)2和pd(tfa)2。在一个这样的实施方案中,从na2pdcl4原位产生pd(0)络合物。在另一个实施方案中,钯源是烯丙基氯化钯(ii)二聚体[(pdcl(c3h5))2]。在一些实施方案中,通过将pd(ii)络合物与膦混合,在水溶液中产生pd(0)络合物。合适的膦包括水溶性膦,例如三(羟基丙基)膦(thp)、三(羟基甲基)膦(thm)、1,3,5-三氮杂-7-磷杂金刚烷(pta)、双(对磺酰基苯基)苯基膦二水合物钾盐、三(羧基乙基)膦(tcep)和三苯基膦-3,3',3”-三磺酸三钠盐。在一些实施方案中,通过将pd(ii)络合物[(pdcl(c3h5))2]与thp原位混合来制备pd(0)。pd(ii)络合物与thp的摩尔比约为1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10。在一些其他实施方案中,可以添加一种或多种还原剂,例如抗坏血酸或其盐(例如抗坏血酸钠)。在一些实施方案中,通过混合pd(ii)前催化剂、例如[pd(c3h5)(thp)]cl、[pd(c3h5)(thp)2]cl与额外的thf来制备pd(0)。[pd(c3h5)(thp)]cl和[pd(c3h5)(thp)2]cl可以通过使(pdcl(c3h5))2与1-5当量的thp反应制得,并且可以在用于化学线性化反应之前将其分离。在一些其他实施方案中,pd(0)络合物为pd(thm)4、pd(thp)2、pd(thp)3或pd(thp)4或其组合。镍试剂在本文所述的ni线性化方法的一些实施方案中,化学线性化方法中使用的ni络合物是水溶性的。在一些这样的实施方案中,ni络合物是ni(0)络合物。在某些情况下,ni络合物可通过诸如烯烃、醇、胺、膦或金属氢化物之类的试剂将ni(ii)化合物还原而原位产生。在一些实施方案中,ni(ii)化合物是nicl2。合适的膦包括水溶性膦,例如三(羟基丙基)膦(thp)、三(羟基甲基)膦(thm)、1,3,5-三氮杂-7-磷杂金刚烷(pta)、双(对磺酰基苯基)苯基膦二水合物钾盐、三(羧基乙基)膦(tcep)和三苯基膦-3,3',3”-三磺酸三钠盐。在一个实施方案中,通过将nicl2与1至10当量的thp混合来制备ni络合物。本公开的一些实施方案涉及将多个固定的双链多核苷酸线性化的方法,其包括:提供包含双链多核苷酸的固体载体,每个双链多核苷酸包含第一链和第二链,其中每个第一链从固定于固体载体的经修饰的p5引物延长,每个第二链从固定于固体载体的p7引物延长,第一链和第二链均在其5'端固定于固体载体,其中每个经修饰的p5引物包含能够通过pd(0)络合物进行化学裂解的第一裂解位点;使双链多核苷酸与pd(0)络合物的水溶液接触,从而在第一裂解位点裂解一个或多个第一链,并产生一个或多个裂解的第一核酸和裂解的固定的第一链;和,从固体载体上去除裂解的第一核酸。在一些实施方案中,第一裂解位点包含具有烯丙基官能度的经修饰的t核苷或核苷酸。裂解位点可进一步包括3'封端部分,例如磷酸酯部分,其在pd裂解反应后保留在第一链上,以封端裂解的固定的第一链的3'-oh。在一些实施方案中,3'封端部分包含含有磷酸酯基的经修饰的核苷或核苷酸,所述磷酸酯基可以通过化学反应或通过酶促反应脱保护。在一个实施方案中,经修饰的p5引物包含或为p15。3'-脱保护本公开的一些实施方案涉及从寡核苷酸上去除3'端保护基的方法,其包括:提供固体载体,其包含在其5'端固定在所述固体载体上的多个寡核苷酸,其中寡核苷酸各自包含具有本文所述的式(i)的结构的3'端保护基;和,使寡核苷酸与脱保护试剂接触,从而裂解3'端保护基,以产生各自具有游离3'端羟基的寡核苷酸。具有式(i)结构的3'端修饰的磷酸酯部分:其中,r1是-nh2、-oh、-nhc(o)ora或-och2osi(rb)3;ra为c1-4烷基、叔丁基、烯丙基、苄基或9-芴基甲基;每个rb独立地选自c1-4烷基和苯基;且r2为h、c1-4烷基、任选取代的四氢呋喃、或核苷酸。在一些其他实施方案中,保护基包含式(v)的结构:其中碱基是任选被保护的腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶、或其衍生物。在一些实施方案中,式(i)或(v)中的一个或多个磷酸酯基可以带负电(例如po4-)。在式(i)或(v)的一些实施方案中,r1是-nhc(o)ora。在一些实施方案中,ra为9-芴基甲基、苄基或烯丙基。在一些实施方案中,r1为-och2osi(rb)3。在一些实施方案中,每个rb为异丙基。在一些实施方案中,每个rb独立地为甲基、乙基、叔丁基或苯基。在一些实施方案中,式(i)或(v)的经修饰的磷酸酯基可以通过化学脱保护试剂、例如含氟化物的试剂、或碱来去除。非限制性示例包括四正丁基氟化铵(tbaf)、hf、nh4f、csf、naoh和koh、和其组合。在本文所述的pd/ni线性化方法的一些实施方案中,在第一线性化后,固定的第一链的其余部分具有未保护的3'端羟基,并且所述方法进一步包括:在pd/ni裂解反应后封端裂解的固定的第一链的其余部分的3'末端。在一个此类实施方案中,封端包括磷酸化的裂解的固定的第一链的3'端为3'羟基保护基。在一些其它实施方案中,每个裂解的固定的第一链的3'端包含保护基。在一些这样的实施方案中,封端效果可以通过在裂解反应后保留在裂解的固定的第一链上的磷酸酯部分或经修饰的磷酸酯部分而实现,其作为对裂解的固定的第一链的3'-oh的封端基团。在一些实施方案中,经修饰的磷酸酯部分包含本文所述的式(i)或(v)的结构。在dna再合成之前,去除磷酸酯基或经修饰的磷酸酯基以产生与固定的第二链互补的衍生第一链。在一些实施方案中,3'端保护基是磷酸酯基,其可以被磷酸酶、例如t4pnk去除。在一些其他实施方案中,3'端保护基是式(i)或(v)的经修饰的磷酸酯基,其可以通过含氟化物的试剂或碱、例如氟化四正丁基铵(tbaf)、hf、nh4f、csf、naoh或koh或其组合而去除。第二线性化方法在本文所述的pd/ni线性化方法的一些实施方案中,每个第二链从固定于固体载体的第二延长引物延长,并且每个第二链包含第二裂解位点。在一些这样的实施方案中,第二延长引物包含选自本文所公开的p5或p7序列、或与p5或p7互补的序列中的核苷酸序列。在一个实施方案中,第二延长引物包含p7核苷酸序列(seqidno.2)。在另一个实施方案中,第二延长引物包括多t间隔子p7核苷酸序列(seqidno.4)。在一些方面,第二延长引物包含作为p5或p7的核苷酸序列,其中掺入有经修饰的核苷酸(具有3'羟基保护基的碱基添加或取代序列中的碱基)。在另一个实施方案中,第二延长引物包含p17引物(seqidno.6)。在一个实施方案中,第二延长引物是p7引物。在另一个实施方案中,第二延长引物是多t间隔子p7引物。在另一个实施方案中,第二延长引物是p17引物。在本文所述的pd/ni线性化方法的一些实施方案中,第二延长引物包含第二裂解位点。在一些这样的实施方案中,第二裂解位点不能通过钯络合物或镍络合物而进行化学裂解。在一些方面中,第二裂解位点可以通过选自化学裂解、光裂解、酶促裂解、或它们的组合中的方法而裂解。在一个实施方案中,第二裂解位点可以通过酶促裂解反应而裂解。在一个实施方案中,第二延长引物是本文公开的p7引物(seqidno.2或seqidno.4),并且第二裂解位点是oxo-g。在一些这样的实施方案中,用于裂解反应的酶是fpg。在一些其他实施方案中,第二裂解位点可以通过化学裂解反应而裂解。在一个这样的实施方案中,第二延长引物包含或为p7引物,其被修饰为包括根据本文所述的模式易于化学裂解的经修饰的核苷酸。在一些实施方案中,第二延长引物包含或为本文公开的p17引物(seqidno.6),并且第二裂解位点包含一个或多个二醇连接,其可以通过用高碘酸盐、例如高碘酸钠处理而裂解。在一些这样的实施方案中,二醇接头包含式(viii)的结构:其中r是2、3、4、5或6;s是2、3、4、5或6;“a”氧是第一核苷酸的3'羟基氧;且“b”氧是第二核苷酸的5'羟基氧。在一些实施方案中,二醇接头具有式(viiia)的结构:其中“a”和“b”如上定义。在一些其他实施方案中,第二裂解位点包含偶氮苯接头,其可以被化学裂解试剂、例如na2s2o4裂解。在一些这样的实施方案中,偶氮苯接头包含式(x)的结构:其中r1为h、羟基或被保护的羟基;r2为h、c1-6烷基或c1-6烷氧基;每个r3和r4独立地为h、卤素、-c(o)or5或-c(o)nhr6;每个r5和r6独立地为h、c1-6烷基或c6-10芳基;x为-c(o)-、-ch2-或-c(o)nh-;并且每个m1、m2和m3独立地是1、2、3、4、5、或6。在一些方面,r1是羟基。在另一些方面,r1是被保护的羟基,例如-obz。在某些方面,r3为-c(o)or5。在某些方面,r3为-c(o)nhr6。在一些这样的方面,r5和r6独立地为c1-6烷基,例如甲基、乙基、异丙基或叔丁基。在其他方面,r3为h。在某些方面,r2为h。在某些方面,r4为h。在某些方面,x为-ch2-。在一些其他方面,x为-c(o)nh-。在某些方面,m1是2、3或4。在某些方面,m2是1、2或3。在某些方面,m3是1、2或3。在式(x)的偶氮苯接头的一些实施方案中,一个端氧原子进一步连接至磷酸酯基,例如具有式(xa)或式(xb)的结构:在一些方面,“a”氧是第一核苷酸的3'羟基氧。在一些方面,“b”氧是第二核苷酸的5'羟基氧。在一些其他方面,“b”氧是第一核苷酸的3'羟基氧。在一些其他方面,“a”氧是第二核苷酸的5'羟基氧。式i的偶氮苯接头(xa)或(xb)可以通过化学试剂掺入寡核苷酸或多核苷酸,其中化学试剂是式(xia)或(xib)的亚磷酰胺化合物:其中r1-r4、x、m1、m2和m3在(x)中定义;且pg是在弱酸性条件下可去除的保护基(例如三苯基甲基或二甲氧基三苯基甲基)。本公开的一些另外的实施方案涉及将多个固定的双链多核苷酸线性化的方法,其包括:提供包含双链多核苷酸的固体载体,每个双链多核苷酸包含第一链和第二链,其中第一链和第二链在其5'端固定于固体载体,其中每个第一链包含第一裂解位点,并且每个第二链包含含有偶氮苯接头的第二裂解位点;在第一裂解位点裂解一个或多个第一链,并产生一个或多个裂解的第一核酸和裂解的固定的第一链;从固体载体上去除裂解的第一核酸;对固定的第二链进行测序;再合成与第二链互补的衍生第一链;并且,在第二裂解位点裂解一个或多个第二链,并产生一个或多个裂解的第二核酸和裂解的固定的第二链。在此类方法的一些实施方案中,每个第一链从固定于固体载体的第一延长引物延长,并且其中第一延长引物包含第一裂解位点。在此类方法的一些实施方案中,第一裂解位点可以通过选自化学裂解、光裂解、酶促裂解及其组合中的方法而裂解,例如,第一裂解位点可以通过本文所述的pd/ni方法、或酶促方法(例如udg)而裂解。在一些这样的实施方案中,第一延长引物包含p5、经修饰的p5或p15。在一些实施方案中,每个第二链从固定于固体载体的第二延长引物延长,并且其中第二延长引物包含第二裂解位点。在一些这样的实施方案中,偶氮苯接头包含本文所述的式(x)、(xa)或(xb)的结构。在一些实施方案中,偶氮苯接头通过na2s2o4而裂解。在一些实施方案中,固定的第二链的测序包括连续掺入与固定的第二链互补的被标记的核苷酸并检测被标记的核苷酸。在一些实施方案中,每个裂解的固定的第一链的3'端包含保护基,例如磷酸酯基或包含本文所述的式(i)或(v)的结构的经修饰的磷酸酯部分。保护基可通过酶促反应(例如酶t4pnk)或化学脱保护而被去除,例如,本文所述的含氟化物的试剂或碱,其用于将包含式(i)或(v)的结构的经修饰的磷酸酯部分脱保护。在一些实施方案中,该方法进一步包括从固体载体上去除裂解的第二核酸,并对衍生第一链进行测序。在一些实施方案中,在从固体载体上去除裂解的第二核酸之后,固定的衍生第一链保留在固体载体上,并保持与裂解的固定的第二链杂交。在本文所述的第一和第二线性化方法的一些实施方案中,通过共价键合将双链多核苷酸固定于固体载体。在一个实施方案中,双链多核苷酸共价键合至固体载体上的水凝胶或聚合物涂层。在一个实施方案中,水凝胶或聚合物涂层包含pazam。在一些实施方案中,水凝胶或聚合物涂层也例如通过与沉积在表面上的官能化硅烷反应而共价附接到固体载体的表面。在一个实施方案中,官能化硅烷是降冰片烯衍生的硅烷。在美国公开号2014/0079923和2015/0005447中公开了硅烷化的固体载体上的水凝胶或聚合物涂层的非限制性示例、以及将多核苷酸或引物接枝到水凝胶或聚合物涂布的固体载体上的方法,其通过引用整体并入本文。用于pd线性化的接枝的固体载体本公开的一些实施方案涉及固体载体,其包含固定在其上的多个第一链多核苷酸,每个第一链多核苷酸包含能够进行化学裂解(例如通过本文所述的钯络合物或镍络合物)的第一裂解位点,其中,多个第一链多核苷酸在其5'端固定于固体载体。在本文的固体载体的一些实施方案中,每个第一链包含固定于固体载体的第一延长引物或从其延长。在一些这样的实施方案中,第一延长引物包含选自本文所公开的p5或p7序列、或与p5或p7互补的序列中的核苷酸序列。在一个实施方案中,第一延长引物包含p5核苷酸序列(seqidno.1)。在另一个实施方案中,第一延长引物包含多t间隔子p5核苷酸序列(seqidno.3)。在一个实施方案中,第一延长引物是p5引物。在另一个实施方案中,第一延长引物是多t间隔子p5引物。在一些实施方案中,p5或p7序列被修饰为包括形成裂解位点的至少一部分的经修饰的核苷或核苷酸。在本文的固体载体的一些实施方案中,第一延长引物包含第一裂解位点。在一些其他实施方案中,第一裂解位点包含能够例如通过钯络合物或镍络合物进行化学裂解的经修饰的核苷酸或核苷。在一些这样的实施方案中,经修饰的核苷酸或核苷是t核苷或核苷酸类似物。在一个这样的实施方案中,裂解位点包含t核苷类似物,其包含烯丙基官能度,例如,在t核苷类似物的5'-碳位处包含乙烯基取代,从而形成相对于5'羟基的烯丙基部分。在一些这样的实施方案中,经修饰的核苷或核苷酸包含本文所述的式(ii)的结构。在一些实施方案中,5'羟基连接至第二核苷酸的3'磷酸酯,使得二核苷酸单元包含具有磷酸烯丙酯部分的裂解位点。在一些这样的实施方案中,经修饰的核苷或核苷酸包含本文所述的式(ii')的结构。在一些实施方案中,第一延长引物包含或为p15引物。在一些进一步的实施方案中,在第二核苷酸上,裂解位点也包含3'保护(或封端)部分,例如磷酸酯部分。在第一链的化学裂解之后,封端部分保留在裂解的固定的第一链上。在一个实施方案中,第二核苷酸的3'磷酸酯部分共价附连到经修饰的核苷类似物的的5'-碳位(即,磷酸酯基包括经修饰的核苷酸的5'羟基)。在一些实施方案中,保留在裂解的固定的第一链上的封端基团包含本文所述的式(i)或式(v)的结构,其可以在化学脱保护试剂、如含氟化物的化合物或碱中被去除。在一些实施方案中,保留在裂解的固定的第一链上的封端基团是磷酸酯基,其可以通过磷酸酶(例如t4pnk)而被去除。在一些实施方案中,裂解位点位于第一延长引物的3'端附近,例如在距第一延长引物的3'端1、2、3、4、5、6、7、8、9或10个核苷酸的距离内。在一些其他实施方案中,裂解位点位于第一延长引物的5'端附近,例如在距第一延长引物的5'端1、2、3、4、5、6、7、8、9或10个核苷酸的距离内。在某些情况下,为了确保有效的dna再合成,裂解位点优选地位于朝向第一引物的3'端,例如2至8、或3至7、或4至6个核苷酸的距离。在一个实施方案中,第一延长引物是p5引物,并且第一裂解位点位于p5引物序列中(例如,通过添加到或替换一个核苷酸,将经修饰的核苷酸掺入到p5引物序列)。因此,本文公开的p5序列(seqidno.1或seqidno.3)被修饰为包括能够通过pd/ni络合物进行化学裂解的第一裂解位点,从而形成经修饰的p5引物。在一个实施方案中,经修饰的p5引物包含或为本文公开的p15引物(seqidno.5)。在一些其他实施方案中,经修饰的核苷酸或核苷可以进一步用可检测标记、例如荧光标记来进行标记。可检测标记能够在接枝反应完成后立即直接定量接枝反应。在本文的固体载体的一些实施方案中,化学线性化方法中使用的pd络合物是水溶性的。在一些这样的实施方案中,pd络合物是pd(0)络合物。在某些情况下,pd(0)络合物可以通过诸如烯烃、醇、胺、膦或金属氢化物的试剂还原pd(ii)络合物而原位生成。合适的钯源包括na2pdcl4、(pdcl(c3h5))2、[pd(c3h5)(thp)]cl、[pd(c3h5)(thp)2]cl、pd(oac)2、pd(ph3)4、pd(dba)2和pd(tfa)2。在一个这样的实施方案中,从na2pdcl4原位产生pd(0)络合物。在另一个实施方案中,钯源是烯丙基氯化钯(ii)二聚体[(pdcl(c3h5))2]。在一些实施方案中,通过将pd(ii)络合物与膦混合,在水溶液中产生pd(0)络合物。合适的膦包括水溶性膦,例如三(羟基丙基)膦(thp)、三(羟基甲基)膦(thm)、1,3,5-三氮杂-7-磷杂金刚烷(pta)、双(对磺酰基苯基)苯基膦二水合物钾盐、三(羧基乙基)膦(tcep)和三苯基膦-3,3',3”-三磺酸三钠盐。在一些实施方案中,通过将[(pdcl(c3h5))2]与thp原位混合来制备pd(0)。可以添加一种或多种还原剂,例如抗坏血酸或其盐(例如抗坏血酸钠)。在一些实施方案中,pd(0)络合物为pd(thm)4、pd(thp)2、pd(thp)3或pd(thp)4或其组合。在本文的固体载体的一些实施方案中,在化学线性化中使用的ni络合物是水溶性的。在一些这样的实施方案中,ni络合物是ni(0)络合物。在某些情况下,ni络合物可通过类似于在本文所述的将pd(ii)还原为pd(0)中使用的那些试剂将ni(ii)化合物(例如nicl2)还原而原位产生。在一个实施方案中,通过将nicl2与1至10当量的thp混合来制备ni络合物。在本文的固体载体的一些实施方案中,固体载体还包含固定在其上的多个第二链多核苷酸,每个第二链多核苷酸包含第二裂解位点,其中多个第二链多核苷酸在其5'端固定于固体载体。在一些这样的实施方案中,每个第二链多核苷酸包含固定于固体载体的第二延长引物或从其延长。在一些这样的实施方案中,第二延长引物包含选自本文所公开的p5或p7序列、或与p5或p7互补的序列中的核苷酸序列。在一个实施方案中,第二延长引物包含p7核苷酸序列(seqidno.2)。在另一个实施方案中,第二延长引物包含多t间隔子p7核苷酸序列(seqidno.4)。在另一个实施方案中,第二延长引物包含p15序列(seqidno.6)。在一个实施方案中,第二延长引物是p7引物。在另一个实施方案中,第二延长引物是多t间隔子p7引物。在一些实施方案中,p7引物或多t间隔子p7引物修饰为去除8-氧代-鸟嘌呤并插入化学可裂解的接头,例如一个或多个二醇单元。在另一个实施方案中,第二延长引物是p17引物。在一些实施方案中,第二延长引物包含第二裂解位点。在一些这样的实施方案中,p5,p7或p17序列被修饰为包括具有可裂解的接头的经修饰的核苷酸。在一些进一步的实施方案中,第二裂解位点不能通过在第一化学线性化反应中使用的钯络合物或镍络合物而进行化学裂解。第二裂解位点可以通过选自化学裂解、光裂解、酶促裂解、或它们的组合中的方法而裂解。在一个实施方案中,第二裂解位点可以通过酶促裂解反应而裂解。在一个这样的实施方案中,第二延长引物是本文公开的p7引物(seqidno.2或seqidno.4),并且第二裂解位点是oxo-g。在另一个实施方案中,第二裂解位点可以通过化学裂解反应而裂解。例如,第二裂解位点可以包含一个或多个连位二醇连接(可以通过氧化而裂解,例如用高碘酸盐试剂处理)、二硫醚连接(可裂解,例如在还原条件下、如dtt,或者在膦存在下)、邻硝基苄基(可裂解,例如通过光解)、偶氮苯连接(可裂解,例如在na2s2o4存在下)、烷基-硒连接(可裂解,例如通过氧化、如过氧化氢)、甲硅烷基醚连接(可裂解,例如通过氟离子、酸或碱)、或氨基甲酸烯丙酯连接(可裂解,例如在钯络合物存在下)。这些连接能够在化学裂解后产生至少一个游离羟基。在一个这样的实施方案中,第二延长引物包含或为本文公开的p17引物(seqidno.6),并且第二裂解位点包含一个或多个可以通过氧化(例如通过用高碘酸钠处理)而裂解的二醇连接。在一些实施方案中,二醇接头包含本文所述的式(viii)或(viiia)的结构。在一些实施方案中,偶氮苯接头包含本文所述的式(x)、(xa)或(xb)的结构。本公开的一些实施方案涉及固体载体,其包含固定在其上的多个第一链多核苷酸和多个第二链多核苷酸,每个第一链多核苷酸中从固定于固体载体的经修饰的p5引物延长,经修饰的p5引物包含第一裂解位点;每个第二链多核苷酸中从固定于固体载体的p7引物延长,p5引物包含第二裂解位点;其中第一链和第二链多核苷酸两者在其5'端固定于固体载体,并且其中第一裂解位点能够通过pd络合物或ni络合物、如钯(0)络合物或ni(0)络合物进行化学裂解。在一些实施方案中,第一裂解位点包含具有本文所述的烯丙基官能度的经修饰的t核苷。所述裂解位点可以进一步包括可以用作3'端封端部分的部分,例如磷酸酯或经修饰的磷酸酯部分,其在pd/ni裂解反应后保留在第一链多核苷酸上以封端裂解的固定的第一链多核苷酸的3'-oh。在本文的固体载体的一些实施方案中,第一链和第二链多核苷酸通过与固体载体表面上的聚合物或水凝胶涂层共价键合而固定于固体载体。在一个实施方案中,水凝胶或聚合物涂层包含pazam。在一些实施方案中,水凝胶或聚合物涂层也例如通过与沉积在表面上的官能化硅烷反应而共价附接到固体载体的表面。在一个实施方案中,官能化硅烷是降冰片烯衍生的硅烷。在一个实施方案中,固体载体包括或为流动池。固体载体表面在一些实施方案中,在引物接枝之前,固体载体的表面包括涂布有官能化分子的区域和没有涂层的惰性区域。在一些这样的实施方案中,官能化的分子涂层是水凝胶或聚合物涂层。涂布区域可包括反应性位点,并且因此可以用于通过化学键合或其他分子相互作用、例如杂交或共价反应而附接分子。在一些实施方案中,涂布区域(例如,反应性特征、通道、垫、珠或孔)和惰性区域(称为间隙区域)可以交替,以形成图案或栅格。这样的图案可以是一维或二维的。在一些实施方案中,惰性区域可以选自玻璃区域、金属区域、掩模区域或间隙区域、或其组合。替代地,这些材料可以形成反应区域。惰性或反应性将取决于基底上使用的化学和工艺。在一个实施方案中,固体载体的表面包括玻璃区域。在另一个实施方案中,表面包括金属区域。在一些实施方案中,本文的固体载体形成流动池的至少一部分或位于流动池中。在一些这样的实施方案中,流动池还包含经由官能化的分子涂层、例如聚合物或水凝胶涂层而附接到固体载体表面的多核苷酸。在一些实施方案中,多核苷酸以多核苷酸簇的形式存在于流动池中,其中多核苷酸簇的多核苷酸经由水凝胶或聚合物涂层而附接到流动池的表面。在这样的实施方案中,多核苷酸所附接的流动池主体的表面被认为是固体载体。在其他实施方案中,将具有水凝胶或聚合物涂布的表面的单独固体载体插入流动池主体中。在优选的实施方案中,流动池是被分成多个泳道或多个扇区的流动室,其中多个泳道或多个扇区中的一个或多个包括涂布有共价附接的本文所述的水凝胶或聚合物的表面。在本文所述的流动池的一些实施方案中,单个多核苷酸簇内的附接多核苷酸具有相同或相似的核苷酸序列。在本文所述的流动池的一些实施方案中,不同多核苷酸簇的附接多核苷酸具有不同或不相似的核苷酸序列。可以用于本文阐述的方法或组合物的示例性流动池和用于制造流动池的基底包括但不限于可购自illumina公司(sandiego,ca)、或在美国公开号2010/0111768a1和2012/0270305中描述的那些,其各自通过引用合并于此。pazam固体载体表面的水凝胶或聚合物涂层的一个实施方案包含pazam,聚丙烯酰胺共聚物包含以下两个重复单元:在一些实施方案中,pazam是线性聚合物。在一些其他实施方案中,pazam是轻度交联的聚合物。pazam可以被官能化或修饰以用于本文阐述的组合物或方法中。pazam和其类似物的制备公开在美国专利号9,012,022中,其在此通过引用以其整体并入本文。3'封端基团在sbs循环过程中,为了确保只有单个掺入发生,添加结构修饰(“保护基”)至每个被标记的核苷酸,所述核苷酸被添加到生长中的链上,以确保只有一个核苷酸掺入。在具有保护基的核苷酸已被添加后,然后在不干扰所测序的dna的完整性的条件下去除保护基。然后,测序循环可以继续掺入下一个被保护的、被标记的核苷酸。为了在dna测序中有用,核苷酸、更通常是三磷酸核苷酸通常需要3'-羟基保护基,以防止用于将其掺入多核苷酸链中的聚合酶在添加核苷酸上的碱基时继续复制。在可以添加到核苷酸上并且仍然合适的基团种类方面存在许多的限制。保护基应当防止另外的核苷酸分子被添加到多核苷酸链中,同时可以容易地从糖部分上去除而不会对多核苷酸链造成破坏。此外,经修饰的核苷酸需要被用于将其掺入多核苷酸链的聚合酶或其他合适的酶所耐受。理想的保护基因此表现出中长期稳定性,可以有效地通过聚合酶酶掺入,造成封端二次或进一步的核苷酸掺入,且能够在不会对多核苷酸结构造成破坏的温和条件、优选在水性温和条件下被去除。先前已经报道了可逆保护基。例如,metzkeretal.,(nucleicacidsresearch,22(20):4259-4267,1994)公开了八种3'-修饰的2-脱氧核糖核苷5'-三磷酸酯(3'-修饰的dntp)的合成和用途,并在两种dna模板测定中测试掺入活性。wo2002/029003描述了一种测序方法,该方法可以包括使用烯丙基保护基以在聚合酶反应中对生长中的dna链的3'-oh基团进行封阻。其他可逆的保护基和在dna相容条件下将它们脱保护的方法包括叠氮基甲基或经修饰的叠氮基甲基,其公开于国际申请公开号wo2004/018497和wo2014/139596中,并且通过引用以其整体并入本文中。本文所述的3'-oh保护基的一个实施方案是磷酸酯基,其可以被磷酸酶去除。可检测标记本文所述的一些实施方式涉及使用可检测标记。可以通过任何合适的方法进行检测,包括荧光光谱法或通过其他光学手段。优选的标记是荧光团,其在吸收能量后发射确定波长的辐射。许多合适的荧光标记是已知的。例如,welchetal.(chem.eur.j.5(3):951-960,1999)公开了可以在本发明中使用的丹磺酰基官能化的荧光部分。zhuetal.(cytometry28:206-211,1997)描述了荧光标记cy3和cy5的使用,它们也可用于本发明。合适使用的标记也公开在proberetal.(science238:336-341,1987);connelletal.(biotechniques5(4):342-384,1987);ansorgeetal.(nucl.acidsres.15(11):4593-4602,1987);和smithetal.(nature321:674,1986)中。其他可商购的荧光标记包括但不限于荧光素、若丹明(包括tmr、德克萨斯红和rox)、alexa、bodipy、吖啶、香豆素、苯并芘、苯并蒽和花青素。在一些实施方案中,可检测标记可用于在本文所述的方法和固体载体中能够进行pd裂解的多核苷酸的第一裂解位点。特别地,第一裂解位点可以包含被标记的经修饰的核苷酸或核苷。这种方法可以进一步简化当前的illumina制造工作流程。在一个实施方案中,本文所述的烯丙基修饰的p5引物可以被修饰为包括荧光标签,其使得能够在完成接枝反应之后立即直接对直接定量接枝反应,从而消除了进行这种定量步骤的单独杂交测定的需要。可检测标记的接头在本文所述的一些实施方案中,经修饰的核苷酸或核苷的核苷碱基可如上所述连接至可检测标记。在一些这样的实施方案中,使用的接头是可裂解的。使用可裂解接头确保在检测后可以将标记去除(如果需要),避免与随后掺入的任何被标记的核苷酸或核苷产生任何干扰信号。在一些其他实施方案中,所使用的接头是不可裂解的。由于在掺入本发明的被标记的核苷酸的各情况中,没有核苷酸需要被随后掺入,因此标记不需要从核苷酸上去除。可裂解的接头是本领域已知的,并且可以应用常规化学将接头附接至核苷酸碱基和标记。接头可以通过任何合适的方法裂解,包括暴露于酸、碱、亲核试剂、亲电试剂、自由基、金属、还原剂或氧化剂、光、温度、酶等。如本文讨论的接头也可利用用于裂解3'-o-保护基键的相同催化剂裂解。合适的接头可以从如greene&wuts,protectivegroupsinorganicsynthesis,johnwiley&sons中公开的归一化学保护基改编。用于固相合成的其他合适的可裂解的接头在guillieretal.(chem.rev.100:2092-2157,2000)中公开。术语“可裂解的接头”的使用不意味着暗示需要将整个接头从例如核苷酸碱基上去除。在可检测标记附接于碱基的情况下,核苷裂解位点可位于接头上的位置,该位置确保接头的一部分在裂解后仍保持附接于核苷酸碱基。在可检测标记附接于碱基的情况下,只要仍可以进行watson-crick碱基配对,则接头可以附接在核苷酸碱基上的任何位置。在嘌呤碱基的情况下,优选通过嘌呤或优选的脱氮嘌呤类似物的7-位、通过8-修饰的嘌呤、通过n-6修饰的腺苷、或n-2修饰的鸟嘌呤来附接接头。对于嘧啶,优选通过胞嘧啶、胸腺嘧啶或尿嘧啶上的5-位、和胞嘧啶上的n-4位来附接。在一些实施方案中,接头可以由与3'-oh保护基相似的官能度组成。这将使脱保护和脱保护方法更有效,因为将只需要单一处理以去除标记和保护基两者。特别优选的接头是含有膦可裂解的叠氮化物的接头。裂解方法在线性化步骤中,可使用各种裂解方法裂解双链核酸分子中的一个或两个链,例如用于本文所述的第二链多核苷酸的裂解。合适的裂解方法的优选但非限制性的实施方案在下面进一步详细讨论。a)化学裂解术语“化学裂解”涵盖利用非核酸和非酶化学试剂以促进/实现双链核酸分子中的一个或两个链的裂解的任何方法。如果需要,双链核酸分子中的一个或两个链可包括一个或多个非核苷酸化学部分、和/或非天然核苷酸、和/或非天然骨架连接,以允许在特异性裂解位点、优选预定的裂解位点进行化学裂解反应。在一个非限制性实施方案中,双链核酸分子中的一个链可以包括二醇连接,其允许通过用高碘酸盐(例如高碘酸钠)处理而裂解。二醇连接可位于裂解位点,其精确位置可由使用者选择。应当理解的是,在裂解位点可以包含多于一个二醇。合适于掺入到多核苷酸链的基于亚磷酰胺化学的二醇接头单元可商购自fidelitysystems,inc.(gaithersburg,md,usa)。可以使用用于自动化化学dna合成的标准方法将一个或多个二醇单元掺入多核苷酸中。为了将二醇接头放置在距固体载体的最佳距离处,可以在二醇接头与固体载体的附接位点之间包含一个或多个间隔子分子。间隔子分子可以是非核苷酸化学部分。用于与二醇接头结合的基于亚磷酰胺化学的合适间隔子单元也由fidelitysystems,inc.提供。通过用“裂解试剂”处理而裂解二醇接头,所述试剂可以是任何促进二醇裂解的物质。优选的裂解试剂是高碘酸盐,优选高碘酸钠(naio4)水溶液。用裂解试剂(例如高碘酸盐)处理以裂解二醇后,可以用“封阻剂”处理裂解的产物,以中和裂解反应中产生的反应性物质。为此目的合适的封阻剂包括胺,例如乙醇胺。有利地,封阻剂(例如乙醇胺)可以与裂解试剂(例如高碘酸盐)包括在混合物中,使得反应性物质一形成就被封阻。二醇连接和裂解试剂(例如高碘酸盐)的组合实现双链核酸分子中的一个链的裂解,对于在固体载体的聚丙烯酰胺水凝胶上的核酸分子的线性化是优选的,其理由在于,用高碘酸盐处理相容于核酸完整性和水凝胶表面的化学。然而,二醇法也可用于固定在其他表面上的核酸的线性化,包括涂布有官能化硅烷的载体。在另一个实施方案中,要裂解的链(或如果通过固相扩增制备,则为衍生出该链的扩增引物)可以包括二硫醚基,其允许用化学还原剂、例如三(2-羧基乙基)磷酸酯盐酸盐(tcep)裂解。b)双链分子中的无碱基位点的裂解“无碱基位点”被定义为以从其中去除了碱基组分的多核苷酸链中的核苷位置。无碱基位点可以在生理条件下通过核苷残基的水解而天然存在于dna中,但也可以在人工条件下或通过酶的作用以化学方式形成。一旦形成,无碱基位点可被裂解(例如通过用核酸内切酶或其他单链裂解酶处理、暴露于热或碱),从而提供了用于多核苷酸链的位点特异性裂解的手段。在一个非限制性实施方案,无碱基位点可以在双链多核苷酸中的一个链上的预定的位置处生成,然后通过第一掺入脱氧尿苷(u)在双链核酸分子中的预定的裂解位点处裂解。这可以例如通过在用于通过固相pcr扩增制备双链核酸分子的引物之一中包括u来实现。然后可以使用酶尿嘧啶dna糖基化酶(udg)去除尿嘧啶碱基,从而在一个链上产生无碱基位点。包括无碱基位点的多核苷酸链然后可以通过用核酸内切酶(例如endoiv内切核酸酶、ap裂解酶、糖基化酶fpg/ap裂解酶、endoviii糖基化酶/ap裂解酶)处理、热或碱而在无碱基位点裂解。可以使用无碱基位点来产生游离的3'-羟基部分以用作测序引物。如果两种扩增引物都经修饰使得它们可以被顺序裂解,则第二裂解可以用于从表面上裂解第一链。第一(或第二)引物可以包含尿嘧啶碱基,其可以被一种酶(udg)裂解,并且第二(或第一)引物可以包含8-氧代-鸟嘌呤碱基,其可以被第二个正交酶、fpg糖基化酶裂解。第二无碱基位点的裂解可用于使测序引物附接在表面上,从而将g碱基掺入作为测序的第一循环,或者可对裂解的双链进行变性以允许测序引物在溶液中杂交。c)核糖核苷酸的裂解将一种或多种核糖核苷酸掺入否则包含脱氧核糖核苷酸的多核苷酸链中(具有或不具有另外的非核苷酸化学部分、非天然碱基或非天然骨架连接)可提供用于裂解的位点,所述裂解使用能够选择性地裂解脱氧核糖核苷酸和核糖核苷酸之间的磷酸二酯键的化学试剂,或使用核糖核酸酶(rnase)。因此,本发明进一步涵盖通过使用这样的化学裂解试剂或rna酶在含有一个或多个连续核糖核苷酸的位点处裂解(双链核酸分子中的)一个链来产生测序模板。优选地,待裂解的链含有单个核糖核苷酸,以提供用于化学裂解的预定位点。能选择性裂解脱氧核糖核苷酸和核糖核苷酸之间的磷酸二酯键的合适的化学裂解试剂包括金属离子,例如稀土金属离子(特别是la3+,特别是tm3+、yb3+、或lu3+(chenetal.,biotechniques,2002,32:518-520;komiyamaetal.chem.commun.1999,1443-1451))、fe(3)或cu(3),或暴露于升高的ph,例如用诸如氢氧化钠碱处理。“脱氧核糖核苷酸和核糖核苷酸之间的磷酸二酯键的选择性裂解”是指化学裂解试剂不能在相同条件下裂解两个脱氧核糖核苷酸之间的磷酸二酯键。一个或多个核糖核苷酸的碱基组成一般不重要,但可以被选择优化化学(或酶促)裂解。举例来说,如果要通过暴露于金属离子、特别是稀土金属离子进行裂解,则通常优选rump或rcmp。一个或多个核糖核苷酸通常将被掺入到双链核酸分子中的一个链中,并且当双链分子的两条互补链被退火时可以位于单链区域中(即在5'悬臂部分中)。特别地,如果使用正向和反向扩增引物通过固相pcr扩增制备双链核酸分子,所述引物之一包含至少一个核糖核苷酸,则用于pcr扩增的标准dna聚合酶不能复制核糖核苷酸模板。因此,固相pcr反应的产物将包含悬臂5'区域,其包含一个或多个核糖核苷酸、以及一个或多个核糖核苷酸上游的扩增引物的任何残留物。核糖核苷酸和脱氧核糖核苷酸之间或两个核糖核苷酸之间的磷酸二酯键也可以被rna酶裂解。任何具有适当底物特异性的内吞核糖核酸酶均可用于此目的。如果在双链分子的两条互补链退火时一个或多个核糖核苷酸存在于单链区域中(即在5'悬臂部分中),则rna酶将是对含有核糖核苷酸的单链具有特异性的核酸内切酶。为了用核糖核酸酶促裂解,优选包括两个或更多个连续的核糖核苷酸,并且优选2至10个、或5至10个连续的核糖核苷酸。核糖核苷酸的精确序列通常不重要,除了某些rna酶对特定残基后的裂解具有特异性。合适的rna酶包括例如rna酶a,其在c和u残基之后裂解。因此,当用rna酶a裂解时,裂解位点必须包括至少一个c或u的核糖核苷酸。掺入一个或多个核糖核苷酸的多核苷酸可以使用合适的核糖核苷酸前体使用用于寡核苷酸化学合成的标准技术容易地合成。如果通过固相核酸扩增制备双链核酸分子,则将一个或多个核糖核苷酸掺入要用于扩增反应的引物之一是方便的。d)光化学裂解术语“光裂解”或“光化学裂解”涵盖利用光能以实现双链核酸分子中的一个或两个链的裂解的任何方法。可以通过在双链分子的链之一中的非核苷酸化学间隔子单元提供光化学裂解的预定位点。合适的光化学可裂解间隔子包括pc间隔子亚磷酰胺(4-(4,4'-二甲氧基三苯基甲氧基)丁酰胺基甲基)-1-(2-硝基苯基)-乙基]-2-氰基乙基-(n,n-二异丙基)-亚磷酰胺),由glenresearch,sterling,virginia,usa提供。间隔子单元可通过暴露于uv光源而裂解。可以使用用于寡核苷酸的化学合成的标准技术,将间隔子单元附接于多核苷酸的5'端,以及允许附接于固体表面的硫代磷酸酯基。方便地,间隔子单元可被掺入用于通过固相扩增合成可光裂解的双链核酸分子的正向或反向扩增引物中。e)pcr阻塞子在另一个实施方案中,双链核酸可通过固相扩增使用正向和反向引物来制备,引物之一含有“pcr阻塞子”。“pcr阻塞子”是防止用于扩增的聚合酶读取通过以使得其不能超过该点复制的任何部分(核苷酸或非核苷酸)。结果是,通过延长含有pcr阻塞子的引物而衍生的扩增链将包含5'悬臂部分。该5'悬臂(除了pcr阻塞子本身)可以由天然存在的脱氧核糖核苷酸组成,主要具有天然骨架连接,即它可以简单地是单链dna的拉伸。然后可以使用裂解试剂(例如酶)在5'悬臂区域裂解分子,所述裂解试剂对裂解单链dna而不是裂解双链dna具有选择性,例如绿豆核酸酶。pcr阻塞子可以是基本上防止用于扩增反应的聚合酶的读取通过的任何部分。合适的pcr阻塞子包括但不限于六甘醇(heg)、无碱基位点以及防止聚合酶通读的任何非天然或经修饰的核苷酸,包括诸如肽核酸(pna)的dna类似物。稳定的无碱基位点可以在化学寡核苷酸合成过程中使用含有稳定的无碱基位点的合适间隔子单元引入。举例来说,可从glenresearch,sterling,virginia,usa商购的无碱基呋喃(5'-o-二甲氧基三苯基甲基-1',2'-二脱氧核糖-3'-[(2-氰基乙基)-(n,n-二异丙基)]-亚磷酰胺)间隔子可以在化学寡核苷酸合成过程中掺入以引入无碱基位点。这样的位点因此可以容易地引入用于固相扩增的寡核苷酸引物中。如果将无碱基位点掺入正向或反向扩增引物中,则所得扩增产物将在包括无碱基位点(以单链形式)的一个链上具有5'悬臂。然后可通过合适的化学试剂(例如,暴露于碱)或酶(例如ap-核酸内切酶vi,shidaelal.,nucleicacidsresearch,1996,vol.24,4572-4576)的作用而裂解单链无碱基位点。f)肽接头的裂解还可以通过制备其中肽分子连接至核酸分子中的一个链的缀合物结构,将裂解位点引入双链核酸分子中的一个链。肽分子随后可以被具有适当特异性的肽酶裂解,或者被非酶化学或光化学裂解中的任何其他适当方式裂解。通常,肽和核酸之间的缀合物将通过将肽仅与双链核酸分子中的一个链共价连接而形成,其中肽部分缀合至该链的5'端,邻近于对固体表面的附接点。如果双链核酸是通过固相扩增制备的,则肽缀合物可以在扩增产物之一的5'端掺入。显然,该引物的肽成分在pcr扩增过程中不会被复制。因此,“桥连”扩增产物将在一个链上包含可裂解的5'肽“悬臂”。其中肽缀合于核酸的5'端的肽和核酸之间的缀合物可以使用本领域通常已知的技术来制备。在一种这样的技术中,所需氨基酸和核苷酸序列的肽和核酸组分可以例如通过标准的自动化的化学合成技术而合成分别,然后在水/有机溶液中缀合。举例来说,可从glenresearch商购的opectm系统基于n末端硫酯官能化的肽与5'-半胱氨酸寡核苷酸的“天然连接”。五氟苯基s-苄基硫代琥珀酸酯用于标准的基于fmoc的固相肽组装的最终偶联步骤。用三氟乙酸脱保护,在溶液中产生被n端s-苄基硫代琥珀酰基取代的肽。在标准亚磷酰胺固相寡核苷酸组装的最后偶联步骤中,使用o-反式-4-(n-a-fmoc-s-叔丁基亚磺酰基-1-半胱氨酰基)氨基环已基o-2-氰基乙基-n,n-二异丙基亚磷酰胺。用氨水溶液脱保护在溶液中产生5'-s-叔丁基亚磺酰基-l-半胱氨酰基官能化的寡核苷酸。通过使用苯硫酚将经修饰的肽的硫代苄基末端转化为硫代苯基类似物,而使用三(羧基乙基)膦将修饰的寡核苷酸肽还原。这两个中间体偶联,然后是“天然连接”步骤,导致寡核苷酸-肽缀合物的形成。可以使用与所选表面相容的本领域已知的任何合适的共价键合技术,将包含肽和核酸的缀合链共价附接到固体载体。例如,可以通过在肽组分的“游离”端(即未与核酸缀合的端)上包括硫代磷酸酯基来实现共价附接到固体载体的聚丙烯酰胺水凝胶表面。如果肽/核酸缀合物结构是用于固相pcr扩增的扩增引物,则与固体载体的附接必须使核酸成分的3'端保持游离。肽组分可以被设计成可被任何所选择的肽酶裂解,许多肽酶在本领域中已知。肽酶的性质没有特别限制,仅需使肽酶在肽组分中的某处裂解即可。类似地,除了需要所选择的肽酶“裂解”之外,肽组分的长度和氨基酸序列没有特别限制。核酸组分的长度和精确序列也没有特别限制,它可以具有任何期望的序列。如果核酸组分在固相pcr中起引物的作用,则将选择其长度和核苷酸序列以使得能够退火为待扩增模板。变性在用于裂解的方法的任何实施方案中,可以使裂解反应的产物经受变性条件,以去除未附接至固体载体的一个或多个裂解的链的一个或多个部分。参考标准分子生物学流程,合适的变性条件对于本领域读者是显而易见的(sambrooketal.,2001,molecularcloning,alaboratorymanual,3rded,coldspringharborlaboratorypress,coldspringharborlaboratorypress,ny;currentprotocols,eds.,ausubeletal.)。变性(和随后的裂解链的再退火)导致产生部分或基本上单链的测序模板。然后可以通过将测序引物与模板的单链部分杂交来引发测序反应。在其他实施方案中,测序可以在裂解步骤之后直接开始,而无需变性以去除部一个或多个裂解的链的一部分。如果裂解步骤在仍与互补链杂交的一个裂解链上产生游离的3'羟基、则可以从这一点开始使用链置换聚合物酶进行测序,而无需进行初始变性步骤。特别地,链置换测序可与通过切口内切核酸酶裂解或通过用内切核酸酶水解无碱基位点、加热或碱处理的模板生成结合使用。测序方法在一些实施方案中,本文的固体载体和方法可用于确定多核苷酸的核苷酸序列。在这样的实施方案中,该方法可包括以下步骤:(a)使多核苷酸聚合酶与附接至基底表面的脱线性多核苷酸簇接触(例如,通过本文所述的聚合物或凝胶涂层中任一者);(b)提供核苷酸至基底表面,使得当多核苷酸聚合酶利用一个或多个核苷酸时产生可检测的信号;(c)检测一个或多个附接的多核苷酸(或由附接的多核苷酸产生的一个或多个簇)的信号;(d)重复步骤(b)和(c),从而确定基底附接的多核苷酸的核苷酸序列。核酸测序可用于通过本领域已知的各种方法确定多核苷酸的核苷酸序列。在优选的方法中,利用边合成边测序(sbs)来确定附接于基底表面的多核苷酸的核苷酸序列(例如,通过本文所述的任何一种聚合物涂层)。在这样的方法中,一个或多个核苷酸被提供到与多核苷酸聚合酶缔合的模板多核苷酸。多核苷酸聚合酶将一个或多个核苷酸掺入与多核苷酸模板互补的新合成的核酸链中。合成从寡核苷酸引物开始,该寡核苷酸引物与模板多核苷酸的一部分或与在模板多核苷酸的一端共价结合的通用或不变核酸的一部分互补。当针对模板多核苷酸掺入核苷酸时,产生可检测的信号,该信号允许确定在测序过程的每个步骤中已掺入了哪种核苷酸。以这种方式,可以产生与模板多核苷酸的至少一部分互补的核酸的序列,从而允许确定模板多核苷酸的至少一部分的核苷酸序列。流动池为容纳通过本公开的方法产生的且经受边合成边测序(sbs)或涉及循环重复递送试剂的其他检测技术的阵列提供方便的形式。例如,为了启动第一个sbs循环,可将一个或多个被标记的核苷酸、dna聚合酶等流入/流过容纳通过本文所述方法制备的核酸阵列的流动池。可以检测出引物延长导致被标记的核苷酸要参入的那些阵列位点。任选地,核苷酸可以进一步包括可逆的终止特性,其一旦将核苷酸添加到引物中,则终止进一步的引物延长。例如,可以将具有可逆终止子部分的核苷酸类似物添加至引物,使得随后的延长直到递送解封端剂以去除该部分才发生。因此,对于使用可逆终止的实施方案,可以(在检测之前或之后)将解封端剂递送至流动池。可以在各个输送步骤之间进行洗涤。然后可以重复该循环n次以将引物延长n个核苷酸,从而检测长度为n的序列。例如,在bentleyetal.,nature456:53-59(2008);wo04/018497;us7,057,026;wo91/06678;wo07/123744;us7,329,492;us7,211,414;us7,315,019;us7,405,281;和us2008/0108082中描述了可以容易地适于与通过本公开的方法产生的阵列一起使用的示例性sbs程序、流体系统和检测平台,其通过引用整体合并于此。在采用流动池的上述方法的一些实施方案中,在单个流动步骤期间,仅单一类型核苷酸存在于流动池中。在这样的实施方案中,核苷酸可以选自datp、dctp、dgtp、dttp及其类似物。在采用流动池的上述方法的其他实施方式中,在单个流动步骤期间,流动池中存在多种不同类型的核苷酸。在这样的方法中,核苷酸可以选自datp、dctp、dgtp、dttp及其类似物。通过检测在多核苷酸模板处或附近产生的信号,可以确定在对于流动池中存在的基底表面上的聚合物涂层上的一个或多个多核苷酸的每个流动步骤期间掺入的核苷酸或核苷。在上述方法的一些实施方案中,可检测信号包括光信号。在其他实施方案中,可检测信号包括非光信号。在这样的实施方案中,非光学信号包括在一个或多个多核苷酸模板处或附近的ph变化。本文已经就核酸举例说明了本公开的基底的应用和用途。然而,将理解其他分析物可以附接至本文阐述并进行分析的基底。一种或多种分析物可以存在于本公开的基底内或之上。本公开的基底对于检测分析物或与分析物进行合成反应是特别有用的。因此,要被检测、表征、修饰、合成等的各种分析物中的任何一种都可以存在于本文阐述的基底之中或之上。示例性分析物包括但不限于核酸(例如,dna、rna或其类似物)、蛋白质、多糖、细胞、抗体、表位、受体、配体、酶(例如激酶、磷酸酶或聚合酶)、小分子候选药物等。基底可以包括来自分析物文库的多种不同物质。例如,物种可以是抗体文库中的不同抗体、核酸文库中具有不同序列的核酸、蛋白质文库中具有不同结构和/或功能的蛋白质、小分子组合文库中的候选药物等。在一些实施方案中,分析物可以分布到基底上的特征,使得它们可以被单独分辨。例如,每个分析物的单个分子可以存在于每个特征处。替代地,分析物可以作为集落或种群存在,使得不必分辨单个分子。就仅包含单一种类的分析物(尽管有多个拷贝)而言,集落或种群可以是同质的。以核酸为例,基底上的每个特征可以包括核酸的集落或种群,并且集落或种群中的每个核酸可以具有相同的核苷酸序列(单链或双链)。这样的集落可以通过如本文先前阐述的簇扩增或桥扩增来产生。靶序列的多个重复可以存在于单个核酸分子中,例如使用滚环扩增程序产生的连接体。因此,基底上的特征可以包含单个种类的分析物的多个拷贝。替代地,具有特征的分析物的集落或种群可以包括两个或更多个不同的物种。例如,基底上的一个或多个孔可各自包含具有两种或更多种不同核酸物种(即,具有不同序列的核酸分子)的混合集落。混合集落中的两种或更多种核酸物种可以以不可忽略的量存在,例如允许在混合集落中检测到一种以上的核酸。实施例在以下实施方案中进一步详细公开了另外的实施方案,其不以任何方式限制权利要求的范围。通用表面处理流程清洁的流动池的硅烷化降冰片烯官能化的流动池是使用yes(yieldengineeringsystems)硅烷化室或干燥器通过化学气相沉积(cvd)方法生产的。cvd工艺通常在60℃下进行1-24小时。pazam偶联然后可以使用多种工具选项对硅烷化流动池进行涂布和接枝。例如,cbot全自动克隆簇生成系统用于illumina测序(可从illumina公司)可用于实施这些操作。在典型的方法中,流动池最初用ipa/h2o(1:1;100μl/分钟,2分钟)冲洗。接下来,将去离子水冲洗通过通道(100μl/min,2分钟)。制备一份等份的0.5wt%pazam(aq.)溶液(足够用于8个通道)。聚合物流入通道中(100μl/min,2分钟)。pazam偶联步骤在60℃下经过1小时完成。在完成该步骤之后,用水冲洗通道,以准备进行后续的接枝步骤。完成聚合物涂布步骤后,可以将流动池在4℃下载缓冲液(例如,盐水-柠檬酸钠(ssc)缓冲液)中存储。或者,可以在pazam涂层后立即完成接枝步骤。pazam涂布的流动池的接枝和qc该流程描述了用于使用cbot系统(ilmn)的接枝流动池的程序。接枝程序抛光了流动池表面,其中烯丙基修饰的p5序列寡核苷酸引物和二醇修饰的p7序列引物以大约1:1的比例共价附接到pazam表面。按照标准illumina程序制备典型的接枝混合物,并取决于要使用的引物浓度。使用的典型引物浓度约为1-20μm,靶引物密度为20-250000单位(荧光计数)。按照标准illumina程序,使用cbot系统实施qc步骤,然后在typhoon(荧光平板扫描仪)上成像。qc之后,用5xssc(60μl/min,总体积=300μl/流动池)冲洗流动池的通道,以去除氢氧化钠(用于进行脱杂化步骤)。然后,将接枝的流动池在用于下游生物化学过程(聚簇、测序)之前存储在4℃下实施例1在该实施例中,包含经修饰的胸腺嘧啶核苷类似物的经修饰的寡核苷酸被用作要在生物学条件下被化学试剂有效裂解的特异性位点,而不会干扰双链配对特性和pcr延长特性。特别地,寡核苷酸包含单个修饰的t-核苷,其在5'-c位附接枝有乙烯基。当用na2pdcl4或(pdallylcl)2和thp在水性缓冲液中的溶液处理(原位产生钯(0)络合物)时,寡核苷酸在经修饰的t位裂解,所得较短寡核苷酸在3'-端含有磷酸酯基。该反应在下述方案1中示出,其中nu代表亲核试剂。方案1在方案2中描述了经修饰的t核苷亚磷酰胺的合成。原料是可商购的。大多数反应步骤得到>70%收率。还报告了包含经修饰的t核苷的最终dna寡核苷酸的优异收率。方案25'-o-二甲氧基三苯基甲基-胸腺嘧啶-3'-o-tbdps(2)。将5'-o-二甲氧基三苯基甲基-胸腺嘧啶(1)(15g,1eq,27.54mmol)在高真空下干燥1h。在n2下加入无水dcm(300ml)。向该溶液中首先加入固体形式的咪唑(4.69g,2.5eq,69mmol),然后加入叔丁基二苯基甲硅烷基氯(91ml,1.3eq,35.8mmol)。将反应混合物在室温下在n2下搅拌1h。通过tlc检查反应的完成。用饱和nahco3溶液(100ml)淬灭反应,并搅拌5min。将dcm(100ml)加入到反应混合物中,并将水层用dcm萃取两次。有机相用饱和nahco3(200ml)、然后盐水(200ml)洗涤。用mgso4干燥合并的有机物后,真空去除溶剂,并在真空下充分干燥,得到白色/浅黄色泡沫的2。化合物2在下一步骤中用作粗产物。lc-ms(es和ci):(-ve)m/z782(m-h+),(-ve)m/z817(m+cl-)。1hnmr(cdcl3)δ0.99(s,9h,tbu),1.27(s,3h,me),1.96-2.06(m,1h,h-2'),2.25-2.35(m,1h,h-2'),2.80(dd,j=4,12hz,1h,h-5'),3.15(dd,j=4,12hz,1h,h-5'),3.71(s,6h,ome),3.96-4.01(m,1h,h-4'),4.45-4.50(m,1h,h-3'),6.42(dd,j=8,12hz,1h,h-1'),6.79-6.72(m,4h,芳族化合物),7.68-7.00(m,24h,芳族化合物+ch),8.01(s,1h,nh)。3'-o-tbdps-胸腺嘧啶(3)。将粗5'-o-二甲氧基三苯基甲基-胸腺嘧啶-3'-o-tbdps(2)(最大27.54mmol)在n2下溶解在无水meoh(300ml)中。添加tfa(10体积%,30ml),并将该反应在室温下在n2下搅拌2小时30分钟。通过tlc追踪反应完成。用饱和nahco3(200ml)小心淬灭反应,并在室温下搅拌10min。真空去除meoh。残余混合物用dcm(300ml)稀释,并用饱和nahco3分配。用dcm将水相萃取两次,然后将有机相用饱和nahco3洗涤。用mgso4干燥并真空浓缩。粗物质通过柱纯化(biotage,100gultra-si,pe/etoac),得到白色泡沫的化合物3(13.15g,99%)。lc-ms(es和ci):(-ve)m/z479(m-h+),(+ve)m/z481(m+h+)。1hnmr(d6dmso)δ1.46(s,9h,tbu),2.15(s,3h,me),2.35-2.53(m,2h,h2'),3.57-3.67(m,1h,h5'),3.77-3.87(m,1h,h5'),4.30-4.36(m,1h,h4'),4.80-4.86(m,1h,h3'),5.41(t,j=5.2hz,1h),6.72(dd,j=8.7,5.7hz,1h),7.82-7.94(m,6h,芳族化合物+ch),8.00-8.05(m,5h,芳族化合物),11.73(s,1h,nh)。化合物(3)的替代合成。5'-o-二甲氧基三苯基甲基-胸腺嘧啶(140g,73.4mmol)在室温下用tbdpscl(1.3eq.)和咪唑(2.5eq.),在dcm(0.127m)中在进行2h处理,随后通过ptsa(3eq.)在甲醇(0.097m)中处理1h,从而以一锅法制备以收率100%提供化合物(3)。甲硅烷基化步骤后无需后处理,去除溶剂蒸发和过夜干燥步骤,并且反应在暴露于空气的情况下进行。代替tfa使用ptsa减少了胸腺嘧啶核苷核糖的酸催化重排。3'-o-tbdps-5'醛-胸腺嘧啶(4)。3'-o-tbdps胸腺嘧啶(3)(5.16g,1eq,10.75mmol)在高真空泳道以及ms下过夜干燥。然后在n2下将无水dcm(250ml)加入化合物3和ms中,然后用冰批冷却至4℃。dess-martin高碘烷是分部分在n2(3×1.823g,1.2eq,12.9mmol)下加入,并将反应物在4℃下在n2下搅拌1小时30分钟。通过lcms检查反应。使反应在室温下温热,并将反应在n2下搅拌4h,或直至反应完成。一旦完成,将na2so3溶液添加至反应(100ml)中,并在室温下搅拌10分钟。分离两相,并将水相用dcm萃取两次。然后将有机相用na2co3和饱和nahco3洗涤,用mgso4干燥并真空浓缩。将粗物质在高真空下干燥过夜,以备下一步骤使用。也可以与甲苯共蒸发以提高干燥度。lc-ms(es和ci):(-ve)m/z477(m-h+),(-ve)m/z513(m+cl-),(+ve)m/z479(m+h+),(+ve)m/z501(m+na+);(-ve)m/z495(水合物-h+),(+ve)m/z519(水合物+na+).醛(4)的替代合成。化合物(3,0.5g)用edc(3eq.)和dca(0.5eq.)在dmso中在室温下处理6h,以通过pfitzner-moffat氧化而提供化合物(4),而没有在用dess-martin高碘烷法观察到的过度氧化为羧酸(在随后的步骤中需要添加大量过量的grignard试剂以淬灭羧酸污染物)。3'-o-tbdps-5'乙烯基-胸腺嘧啶(5)。将3'-o-tbdps-5'醛-胸腺嘧啶(4)(5.16g,1eq,10.75mmol)以及4ams在高真空下干燥过夜。然后在n2下将无水thf(150ml)加入到化合物3和4ams中。在室温下用30分钟非常缓慢地加入1m乙烯基溴化镁在thf中的溶液(21.5ml,2eq,21.5mmol)。将反应物在室温下在n2下搅拌2h,并通过lcms检查。如果需要,可以滴加一些额外的乙烯基溴化镁(0.3eq,3.22ml),并将反应搅拌另外1h。一旦完成,将1macoh在水中的溶液(60ml,ph=6)加入反应中,并在室温下搅拌10分钟。用dcm稀释反应物,并分离两相。将水相用dcm萃取两次。然后将有机相用饱和nahco3洗涤2次,用mgso4干燥,并在真空下浓缩。残留物通过柱纯化(biotage,100gkpsi,pe/etoac),得到乳白色泡沫物的化合物5(2.01g,37%,历经2个步骤)。lc-ms(es和ci):(-ve)m/z505(m-h+),(-ve)m\z541(m+cl-),(+ve)m/z507(m+h+).1hnmr(400mhz,氯仿-d)δ1.01(d,j=10.1hz,9h,tbu),1.80(s,3h,me),2.02-2.22(m,2h,h2’),3.48-3.54(m,0.6h,h5’),3.81(t,j=2.2hz,0.6h,h4’),3.97-4.02(m,0.4h,h4’),4.13-4.22(m,0.4h,h5’),4.33-4.50(dm,1h,h3’),4.82-5.17(m,2h,ch2=ch-),5.24-5.43(m,0.4h,ch2=ch-),5.52-5.75(m,0.6h,ch2=ch-),6.04-6.29(ddd,j=21.2,8.3,6.0hz,1h,h1’),7.26-7.46(m,7h,arom+ch),7.50-7.66(m,4h,arom),8.23(s,1h,nh).烯丙醇(5)的替代合成。醛(4)是在室温下在thf中用乙烯基氯化镁(2.5eq.)处理,以提供化合物(5)。使用氯化物试剂代替溴化物减少了所需产物的溴化类似物的产生(上述方法中为14%),而没有引入所需产物的氯化物变体。3'-o-tbdps-5'乙烯基-5'dmt-胸腺嘧啶(6)。将3'-o-tbdps-5'乙烯基-胸腺嘧啶(5)(2.01g,1eq,3.97mmol)在高真空泳道下干燥过夜。加入agno3,并将固体在高真空下再干燥30分钟。无水dcm在n2下加入到反应中,然后加入固体三甲基吡啶(1.05ml,2eq,7.94mmol)和最后的dmt-cl(上2.02g,1.5eq,5.96mmol)。将反应物在室温下在n2下搅拌3h;然后在室温下搅拌3小时。通过tlc(pe/etoac,6:4+1%net3)检查是否完成。然后将反应物用dcm稀释并过滤到硅藻土上,并将固体用更多的dcm洗涤。然后将溶液用1%h2so4(60ml)分配,并用dcm萃取。将有机相用饱和nahco3洗涤2次,用mgso4干燥,真空浓缩,得到泡沫的粗产物6。无需进一步纯化即可用于下一步骤。lc-ms(es和ci):(-ve)m/z807(m-h+),(+ve)m/z809(m+h+).替代流程:将化合物(5,6.7g,13.2mmol)和2,3,5-三甲基吡啶在无水dcm中的溶液在分子筛上干燥30分钟。然后将所得溶液加到含有4,4'-二甲氧基三苯基甲基氯(6.7g)和分子筛的烧瓶中。加入agno3并将反应搅拌1小时。将所得混合物用dcm(40ml)稀释,并通过硅藻土过滤,用dcm(3×40ml)冲洗。将meoh(240ml)加入滤液中,并将混合物搅拌10分钟,然后转移至分液漏斗,用饱和nahco3水溶液(2x400ml)洗涤,干燥(na2so4),并真空浓缩,从而得到粗产物,为黄色泡沫。5'乙烯基-5'dmt-胸腺嘧啶(7)。将3'-o-tbdps-5'烯丙基-5'dmt-胸腺嘧啶(6)(1eq,来自先前步骤的3.97mmol)在高真空泳道下干燥。将无水thf(12ml)中在n2下加入,并冷却至4℃。将1mtbaf在thf中的溶液(4.37ml,1.1eq,4.37mmol)在4℃下逐滴加入。在4℃下5分钟后,将反应混合物在室温加热,并在n2下搅拌3h。通过tlc(pe/etoac,3:7+1%net3)跟踪反应完成。用etoac稀释反应,并用饱和nahco3分配。用etoac萃取水相,然后用饱和nahco3、然后用盐水洗涤有机相,用mgso4干燥并在真空下浓缩。残留物通过柱纯化(biotage,25gkpsi,pe/etoac+1%net3),得到化合物7,为白色泡沫(1.81g,80%,历经2个步骤)。lc-ms(es和ci):(-ve)m/z569(m-h+),(+ve)m/z571(m+h+).1hnmr(400mhz,dmso-d6)δ1.46(s,1h,me),1.65(s,2h,me),1.97-2.13(m,2h,h2’),3.64(m,1h,h4’),3.85(dd,j=8.0,4hz,0.4h,h5’),3.92(dd,j=8.0,4hz,0.6h,h5’),4.31-4.45(m,1h,h3’),4.55-4.86(m,2h,ch=ch2-),5.27(dd,j=7.4,4.8hz,1h,oh),5.52-5.71(m,1h,ch=ch2-),6.11(dt,j=8.1,5.8hz,1h,h1’),6.86(dd,j=8,4hz,4h,arom.),7.13-7.35(m,7h,arom.+ch),7.40-7.50(m,3h,arom.),11.35(s,1h).5'乙烯基-5'dmt-胸腺嘧啶-亚磷酰胺(8)。将5'乙烯基-5'dmt-胸腺嘧啶(800mg,1.4mmol在高真空泳道下干燥。将无水dcm(7ml)在n2下加入,并与分子筛在室温下搅拌10分钟。向该溶液中加入hunig碱(0.74ml,4.2mmol),然后加入2-氰基乙基n,n-二异丙基氯亚磷酰胺(407ul,0.52mmol)。将反应在室温下在n2下搅拌3h。通过tlc(pe/etoac,4:6)跟踪反应完成。将反应真空浓缩。将残留物通过柱纯化(biotage,25gkpsi,pe/etoac+1%net3),得到化合物8,为白色泡沫(930mg)。lc-ms(es和ci):(-ve)m/z770(m-h+),(+ve)m/z771(m+h+).1hnmr(400mhz,dmso-d6)δ0.96-1.27(m,21h),1.50(d,j=5.9hz,1h),1.66(s,3h),2.02-2.37(m,3h),2.58-2.74(m,2h),2.78(td,j=5.8,3.9hz,1h),3.46-3.69(m,6h),3.76-3.93(m,2h),3.96-4.10(m,2h),4.61(ddd,j=17.5,14.2,8.6hz,2h),4.68-4.98(m,3h),5.43-5.79(m,1h),6.04(dt,j=9.6,5.1hz,1h),6.13(dt,j=10.7,6.9hz,0h),6.85(ddt,j=8.2,5.2,2.4hz,6h),7.09-7.34(m,11h),7.34-7.50(m,4h),11.37(d,j=6.1hz,1h).31pnmr(162mhz,dmso)δ147.94,147.16,147.03.裂解效率分析在高引物密度pazam(40-60k)表面上评估裂解效率。(非图案化)流动池按照本文所描述的标准程序制备。降冰片烯衍生的硅烷用cvd方法沉积在基底表面上,随后通过聚合物(pazam)点击偶联到基底表面,接着第二点击偶联流程以用经修饰的p7寡核苷酸接枝聚合物表面,所述寡核苷酸含有烯丙基t核苷类似物(5'-炔-ttttttttttxcaagcagaagacggcatacgagat,其中x表示掺入上述经修饰的t核苷的位点)。将经修饰的p7寡核苷酸接枝于pazam流动池,其具有与标准p7寡核苷酸相似的密度。经修饰的p7寡核苷酸的接枝效率为与标准的5'-官能化p5和p7寡核苷酸相似。流动池表面用在1xea掺入混合物(含有50mm乙醇胺-hcl(ph9.9)、50mm的nacl和0.05%chaps)中的1mm的na2pdcl4、10mmthp在60°下处理10分钟。tet-qc测定用于证明在用原位产生的钯(0)络合物处理后烯丙基t修饰的p5寡核苷酸从表面上成功裂解。图2a示出了在pd(0)处理之前和之后的流动池表面的typhoon图像。图2b显示了在用pd(0)处理之前和之后的引物密度的变化,将用修饰的p5寡核苷酸处理的流动池表面与标准对照进行了比较。在低引物密度和高引物密度范围两者中,接枝有经修饰的p5寡核苷酸的pd(0)处理的流动池表面显示荧光强度的实质性变化。结果表明,使用该方法非常有效的裂解(-95%,荧光测定)。相比之下,标准p5寡核苷酸接枝的流动池表面在荧光强度上没有显示太多变化,表明标准p5寡核苷酸没有被pd(0)络合物裂解。测序运行结果分析通过实施短测序运行,进一步分析上述经修饰的烯丙基t核苷进行有效裂解的能力。在该实验中,按照上述类似方法制造了流动池。因此,将烯丙基t修饰的p5炔寡核苷酸和标准p7炔寡核苷酸以各种表面引物密度接枝到pazam涂布的流动池上。为了确保有效的再合成,将烯丙基修饰的位置进一步移向经修饰的p5寡核苷酸的3'端。用于sbs流动池制造的接枝引物的序列如下:p5:5'-炔-ttttttttttaatgatacggcgaccaccgagaxctacacp7:5'-炔-ttttttttttcaagcagaagacggcatacga(8-oxog)atx=烯丙基修饰,如方案1中所述。典型的裂解条件包括将烯丙基-p5接枝的表面用na2pdcl4/thp溶液在60℃下孵育10分钟。将pd(0)处理的pazam表面在这些条件下是稳定的,并且可以继续以支持测序的几百次循环。此外,未检测到其他副反应,随后通过pet再合成间接确定了p7寡核苷酸裂解仍未受到影响,证实了烯丙基方法的正交性和特异性。图3a是显示来自非图案化高引物密度引流动池的tet染料表面荧光qc测定(tet-qc)结果的柱状图。在通道1-4中,表面接枝有烯丙基修饰的p5寡核苷酸和标准p7寡核苷酸。在通道5-8中,表面接枝有标准p5/p7寡核苷酸。在修饰的和标准的p5寡核苷酸之间结果是可比的。图3b示出图3a中描述的tet-qc后的流动池表面的typhoon图像。再次,未识别出通道之间的可见差异,因为两者均未显示可检测到的信号。初步数据表明,在簇密度方面,经修饰的p5寡核苷酸与标准p5寡核苷酸之间没有特殊的区别。另外还观察到,含有na2pdcl4/thp的裂解溶液当在室温下储存数天时稳定,并且老化的混合物仍可使用于裂解烯丙基修饰的p5寡核苷酸。实施例2在该示例中,本文所述的钯(0)线性化方法和二醇裂解方法在接枝有p15/p17底物的新型流动池上测试,并且(配置为2通道仪器)上的测序数据被收集并与接枝有p5/p7引物的标准流动池进行比较,并使用图1中描述的酶促线性化。新流动池和标准流动池均涂布有pazam聚合物,并且两种类型的引物的表面引物密度均目标为约200k。使用novaseqtm掺入混合物对两个流动池进行测序,并在20℃下进行成像。在每个线性化步骤(read1和read2)之前,对流动池进行外切处理,以去除过量的未使用的表面引物。对于标准表面,在read1中使用user酶(lmx1)在38℃下进行20分钟孵育,并且在read2中使用fpg酶在40℃下进行20分钟孵育,从而完成引物(p5/p7)线性化。对于新p15/p17表面,在read1中使用含有thf和抗坏血酸钠(6mm/60mm/6mm)的钯混合物在60℃下进行2分钟孵育,并且在read2中使用高碘酸钠混合物在20℃下冲洗10分钟,从而完成引物线性化。这些数据中显示的测序文库为phix,运行为2x151个周期。测序结果总结在下表中。测序数据表明,钯(0)辅助化学线性化在测序中工作良好,并且主指标相比于标准而言非常相似。对于p5/p7和p15/p17表面引物两者,簇通滤波器(%pf)、定相/预定相、%对齐均等效。所述%误差在p15/p17接枝流动池的read1中略高,但仍然相当了良好(如图4所示),并且流动池到流动池的变化也可能会发生。read2中的%错误率是可比的。另外,在使用新型流动池时,线性化所需的时间对于read2减少了2倍,并且对于read1减少了10倍。实施例3在该实施例中,实施例1中所述的烯丙基t核苷可以进一步用可检测标记(即,荧光标记)标记,以进一步简化当前的illumina生产工作流程。一旦染料标记的烯丙基t核苷掺入到p5寡核苷酸中,则能够在完成后立即直接定量接枝反应。在当前方法中,这一步骤是作为一个单独的杂交测定而实施的。使用类似于之前实施例中描述的合成方法,在方案3中说明了使用染料标记的经修饰的t核苷酸的pd(0)裂解反应。方案3实施例4在该实施例中,如方案4所示制备二醇接头试剂。该方法改进了美国专利号8,715,966中描述的合成。方案4二醇-1。本方法在合成二醇-1中去除了作为溶剂的dmf。dmf会由于形成乳液和不希望的产品分配进入水相而使水性萃取变得复杂,并且在先前报告的方法中,在后处理之前将其去除是很费时的。将先前的dmf/dcm混合物替换为etoac,将处理时间从3天减少至1-2天(包括色谱法)。另外,在现有方法中双(三苯基甲基)化副产物的形成降低了收率。将试剂的添加顺序从将固体dmtr-cl的分部分添加到己二醇/dipea的混合物改为将液体dipea滴加到己二醇/dmtr-cl的混合物中,提高了所需产物的反应选择性大约10%。在一些实施方案中,该反应的产物可以粗制使用,而无需色谱去除dmtr-oh和双(三苯基甲基)化副产物。二醇-3。先前使用tpap/cat的氧化方法。nmo导致过度氧化为相应的羧酸,需要长达3-4天的时间。在此,在dcm和nahco3水溶液的双相混合物中,用tempo/漂白剂代替了tpap/nmo。将漂白剂滴加到剩余试剂的混合物中,一旦完成漂白剂的添加,反应就完成了。通过水性萃取分离产物,具有最小的过氧化和66-92%的收率,以及更快的整个过程(1.5天)。在另一个实施方案中,可以错开dio-3和dio-4的合成以去除中间色谱步骤。可能需要过量的tbuok才能中和起始原料中的任何羧酸物质。二醇-2。先前合成二醇-2的方法包括48小时回流,并在36小时进行一些操作以确保反应完全。增加反应浓度可使回流时间从48小时减少至12-24小时。在先前的方案中,将粗二醇-2萃取到水中。需要去除水(因为随后的步骤对水分敏感),这在规模化时非常耗时。通过将二醇-2萃取到dcm中并用nahco3水溶液洗涤从而去除任何乙酸并最小化溶剂去除时间,从而改善该步骤。整个处理时间从3天减少到2天。将产物作为储备溶液存储在dcm中。在二醇-4反应之前,将溶液在3a分子筛上储存过夜。替代地,可以将二醇-2水解为相应的醇以简化纯化。然后将该醇用于后续步骤中,直接提供二醇-4。二醇-5。去除色谱纯化步骤,节省了1天的处理时间。此外,dmf可以切换为dcm,以通过在水性后处理过程中减少溶剂/洗涤液体积来提高工艺效率。二醇-6。可以去除色谱纯化步骤。二醇-7。二醇-7的合成涉及两个错开方法,即,酯化和与tbaf甲硅烷基化。在先前报道的方法中,在与tbaf进行甲硅烷基化的过程中观察到了明显的1,4-乙酰基迁移,导致形成了大量不需要的副产物二醇-7m:该材料降低了二醇-7的总体收率和纯度。此外,一直携带二醇-7m到随后的步骤产生二醇-8m,其亚磷酰胺在仲醇而非伯醇上。掺入引物中将导致无法裂解的接头。在本方法中,tbaf步骤用acoh缓冲,以从商业tbaf批次中去除不希望的naoh。过多的acoh会导致dmtr保护基的丧失。反应以1.75当量acoh、以及在暴露起始原料之前将tbaf和acoh预混合而进行。另外,现有方法包括在后处理之前蒸发thf;目前的方法去除了该蒸发步骤,并且包括小心地将水相中和至ph7以减少碱诱导的产物降解。最后,酯化步骤之后的色谱纯化已被去除。替代地,可以错开二醇-5至二醇-7合成流程,从而省去了额外的色谱步骤。总之,该方法可以运行以包括三个色谱步骤而不是六个色谱步骤,并且粗材料将在二醇-4、二醇-7和二醇-8阶段进行纯化。实施例5该实施例描述了a-tom单体的合成,其是用作羟基保护基的经修饰的3'磷酸酯部分。(tom=三异丙基甲硅烷氧基甲基)步骤1.dmt腺苷(a-obz)的苯甲酰化。在室温下将n6-苯甲酰基-2'-脱氧-5'-odmt-d-腺苷(11.2g,17mmol)和溶剂(吡啶/dcm混合物,以1:3的比例,11ml吡啶,33mldcm)混合给出溶液。将反应烧瓶冷却至0℃,并向其中加入dmap(0.41g,3.41mmol)和苯甲酰氯(3.9g(3.2ml),34.1mmol)。在加热至室温过夜的同时搅拌(tlc监测反应进程),得到非常浅橙色的混合物,带有一些白色固体沉淀。在<40℃的温度下真空去除溶剂。将残留物用acoet(-500ml)稀释,用饱和碳酸氢钠水溶液(2×250ml)、水(250ml)洗涤两次,并用mgso4干燥。蒸发溶剂并与甲苯共蒸发后,获得白色泡沫并真空干燥至恒重。该物质无需纯化即可用于下一步骤。步骤2.去三苯基甲基化(a-oh)。将a-obz(13.69g,未纯化,17mmol)溶解于二氯甲烷/甲醇混合物(1:1,300ml)中,并在氮气下冷却至0℃。通过注射器加入三氟乙酸(2.75ml,36mmol)。搅拌反应,同时温热至室温1小时。通过tlc监控反应进程。通过添加固体nahco3(3g,36mmol)在0℃下淬灭反应。在<40℃的温度下真空去除溶剂,并将残留物用acoet(-800ml)稀释,并用水(5x250ml)洗涤五次。用mgso4干燥有机层,过滤并真空干燥,得到白色泡沫。通过柱色谱法纯化(用1:1石油醚/乙酸乙酯至乙酸乙酯梯度洗脱),得到目标产物,为白色粉末。(5.0g,60%收率(2步),rf=0.35在100%乙酸乙酯中)1hnmr(400mhz,dmso-d6)δ11.25(s,1h),8.78(s,1h),8.75(s,1h),8.07(ddt,j=10.1,7.0,1.4hz,4h),7.75-7.68(m,1h),7.68-7.62(m,1h),7.62-7.51(m,4h),6.64(dd,j=8.6,5.9hz,1h),5.68(dt,j=6.1,1.9hz,1h),5.28(t,j=5.7hz,1h),4.31(td,j=4.4,1.8hz,1h),3.72(tdd,j=11.8,6.4,4.7hz,2h),3.19(ddd,j=14.4,8.7,6.1hz,1h),2.75(ddd,j=14.1,5.9,1.8hz,1h).。步骤3.氧化在氮气下,将a-oh(1.0g,2.18mmol)在含有分子筛的二氯甲烷(50ml)中的溶液冷却至0℃。在另外的烧瓶中,通过分子筛将dess-martin高碘烷(1.11g,2.61mmol)溶解于二氯甲烷(10ml)中。将dess-martin溶液添加到a-oh中,使其温热至室温。用lcms监测反应,一小时后,反应用饱和碳酸氢钠溶液淬灭。将淬灭的混合物用二氯甲烷(-250ml)稀释,并用碳酸氢钠溶液(100ml)和水(2×100ml)洗涤。用mgso4干燥有机层,过滤并真空干燥,得到白色泡沫,其无需进一步纯化即可用于下一步骤。步骤4.wittig反应(a-ch=ch2)。将甲基三苯基溴化磷鎓((5.83g,16mmol)与干燥的thf(40ml)在烘箱中干燥的两颈圆底烧瓶中混合,该烧瓶容纳搅拌棒、分子筛和氮气管线。烧瓶的一个颈部将叔丁醇钾保存在固体加料管中。将该溶液冷却至0℃。叔丁醇钾通过在接头处转动加料管添加,允许固体落入搅拌的溶液中不暴露于空气或打开系统添加。溶液从浑浊的白色变为黄色。在0℃下搅拌1小时。注意:该步骤的所有固体试剂在五氧化二磷存在下在高真空下干燥过夜。注射器、针头、搅拌棒、活化的分子筛也在同一罐中干燥。经由宽针头和注射器,在0℃下将黄色固体加入到a-cho(2.5g,5.44mmol)在thf(15ml)中的溶液。颜色从黄色变为橙色。在0℃下搅拌3小时,通过lcms监测。在0℃下将后处理反应物倒入容纳水(300ml)和acoet(300ml)的1l烧杯中。搅拌十分钟,然后转移到分液漏斗中。有机层用饱和碳酸氢钠溶液(3×100ml)和盐水(100ml)洗涤。用mgso4干燥有机层,过滤并真空干燥,得到棕黄色泡沫。通过柱色谱法纯化(用二氯甲烷至5%甲醇/dcm的梯度洗脱),得到目标产物,为乳白色泡沫物。(2.59g,rf=0.53,在5%meoh/dcm中)1hnmr(400mhz,dmso-d6)δ11.21(s,1h),8.77(s,1h),8.66(s,1h),8.05(d,j=7.2hz,2h),7.65(t,j=7.4hz,1h),7.57(q,j=7.9,7.3hz,3h),6.50(t,j=6.7hz,1h),6.06(ddd,j=17.2,10.4,6.7hz,1h),5.55(d,j=4.4hz,1h),5.29-5.10(m,2h),4.42(p,j=4.2hz,1h),4.30(dd,j=6.7,3.6hz,1h),2.94(dt,j=13.1,6.4hz,1h),2.40(ddd,j=13.3,6.5,4.3hz,1h)。步骤5.二醇氧化(a-ohoh)。在氮气下,将a-ch2ch2(0.68g,1.49mmol)在thf(7ml)中的溶液置于装有搅拌棒的烧瓶中。称出固体4-甲基吗啉n-氧化物(0.262g,2.235mmol),并加入到反应烧瓶中。还加入水(7ml)。向反应烧瓶中加入四氧化锇(4%水溶液,285μl,0.045mmol)。将反应在40℃下加热过夜。tlc和lcms监测反应进程。加入硫代硫酸钠固体淬灭反应。将混合物搅拌30分钟,然后在乙酸乙酯(150ml)和碳酸氢钠溶液中进行后处理。有机层用饱和碳酸氢钠溶液(3×100ml)洗涤3次。用mgso4干燥有机层,过滤并真空干燥,得到灰白色缓慢结晶的固体。通过柱色谱法纯化(用二氯甲烷梯度洗脱至10%甲醇/dcm),得到目标产物,为无色油状物。(0.13g,19%收率,在5%meoh/dcm中的rf=0.28)1hnmr(400mhz,dmso-d6)δ11.25(s,1h),8.78(s,1h),8.73(s,1h),8.07(ddt,j=9.6,7.2,1.4hz,4h),7.74-7.68(m,1h),7.68-7.62(m,1h),7.62-7.47(m,5h),6.62(dd,j=8.9,5.8hz,1h),5.82(dt,j=5.8,1.5hz,1h),5.48(d,j=5.1hz,1h),4.69(t,j=5.5hz,1h),4.31(dd,j=5.0,1.5hz,1h),3.81(p,j=5.3hz,1h),3.48(dh,j=22.3,5.5hz,2h),3.18(ddd,j=14.4,9.0,5.9hz,1h),2.70(ddd,j=14.4,6.0,1.5hz,1h).步骤6.甲硅烷基化(a-ohtom)。将a-ohoh(0.128g,0.262mmol)在dcm中的溶液在包含搅拌棒和氮气管线的烧瓶中溶解在dcm(1.5ml)中。在室温下,在30分钟内加入二叔丁基二氯化锡(80mg,0.262mmol)和n,n-二异丙基乙胺(182μl,1.05mmol)。经由微量移液管添加三异丙基甲硅烷基氧基甲基氯(tom-cl,79μl,0.341mmol)。tlc和lcms监测反应进程。反应在室温下放置过夜。反应后处理在乙酸乙酯(200ml)中进行。用饱和碳酸氢钠溶液(3×100ml)洗涤。用mgso4干燥有机层,过滤并真空干燥,得到黄色/棕色油。通过柱色谱法纯化(用二氯甲烷至8%甲醇/dcm梯度洗脱),得到目标产物,为黄白色泡沫物(0.14g,79%收率,在5%meoh/dcm中的rf=0.5)1hnmr(400mhz,dmso-d6)δ11.25(s,1h),8.76(s,1h),8.73-8.65(m,1h),8.06(tt,j=7.5,1.4hz,4h),7.76-7.62(m,2h),7.62-7.46(m,4h),6.61(dd,j=8.9,5.7hz,1h),5.82(d,j=5.7hz,1h),5.65(d,j=5.3hz,1h),4.84(s,2h),4.27(dd,j=5.4,1.5hz,1h),4.06-3.93(m,1h),3.62(ddd,j=42.1,10.3,5.2hz,2h),3.22(ddd,j=14.7,9.1,5.8hz,1h),2.74-2.65(m,1h),0.94(m,21h,tom).步骤7.三苯基甲基化(a-tom-dmt)。将干燥的a-ohtom(0.14g,0.207mmol)、(4,4'-二甲氧基三苯基甲基氯(dmt-cl,0.105g,0.311mmol)和硝酸银(53mg,0.311mmol)置于具有干燥的dcm(1.5ml)和三甲基吡啶(2,4,6-三甲基吡啶)(55μl,0.414mmol)的烧瓶中,在室温下搅拌反应3小时。tlc和lcms监测反应进程,将反应混合物用dcm(100ml)稀释,并用烧结剥离漏斗过滤。dcm溶液用饱和碳酸氢钠溶液(5×100ml)洗涤。dcm层用mgso4干燥,过滤并真空干燥,得到黄色/棕色油状物。用柱色谱法纯化(梯度洗脱)。用二氯甲烷洗脱至10%甲醇/dcm)得到目标产物,为粘稠的黄色油状物(0.17g,85%收率,在5%meoh/dcm中的rf=0.46)。步骤8(a-3'oh)。将a-tom-dmt(56mg,56μmol)在甲醇和thf(4:5,总计0.9ml)的混合物中的溶液冷却至0℃。加入氢氧化钠(4m,0.1ml,过量)并在0℃下搅拌15分钟。通过tlc和lcms监测反应。用乙酸(1m,0.5ml)淬灭反应,确保ph不低于ph8。用乙酸乙酯(ea,100ml)稀释反应混合物,并用饱和碳酸氢钠溶液(3×50ml)洗涤溶液。用mgso4干燥ea层,过滤并真空干燥。通过柱色谱法(用ea/石油醚(25%)至100%ea的梯度洗脱)纯化残留物,得到白色泡沫(0.02g,40%收率,在100%ea中的rf=0.38)。步骤9.亚磷酰胺的形成(atom单体)。将a-3'oh(92mg,105μmol)放入容纳分子筛和磁力搅拌棒的烧瓶中,然后在室温下在氮气下加入thf(干燥,0.2ml)。将n,n-二异丙基乙胺(110μl,630μmol)加入到thf溶液中。最后,通过微量移液管加入2-氰基乙基n,n-二异丙基氯代亚磷酰胺(38μl,169μmol)。在室温下在氮气下搅拌反应。通过tlc监测反应。反应完成后,真空去除溶剂。残留物在室温下用石油醚(3×20ml)洗涤。然后将残留物溶解在dcm中并过滤以去除分子筛。在真空下再次干燥,然后通过柱色谱纯化(用ea/石油醚(20%)至75%ea梯度洗脱),提供粘稠的无色油状物(80mg,70%收率)1hnmr(400mhz,dmso-d6)δ11.17(s,1h),8.57(s,1h),8.39(s,1h),8.06-7.99(m,2h),7.64(td,j=7.1,1.2hz,1h),7.58-7.46(m,4h),7.36(ddd,j=15.4,9.0,2.8hz,4h),7.29(t,j=7.4hz,2h),7.27-7.17(m,1h),6.92-6.83(m,4h),6.34(dd,j=9.0,5.9hz,1h),4.78-4.71(m,1h),4.68(q,j=6.6,4.6hz,1h),4.52(dd,j=8.5,4.9hz,1h),4.27(d,j=7.1hz,1h),3.85-3.69(m,8h),3.62(dp,j=10.4,6.7hz,1h),3.34-3.22(m,1h),2.78(td,j=5.8,1.9hz,2h),2.64(td,j=8.8,4.7hz,1h),2.26-2.16(m,1h),2.08(d,j=0.7hz,6h),1.21(dd,j=15.4,5.6hz,9h),1.12(d,j=6.7hz,6h),0.99-0.88(m,2h),0.83(dd,j=6.3,4.5hz,18h).实施例6模型二核苷酸(c-tom-a)的合成。将化合物c-amidite(125mg,0.15mmol)和a-oh-tom(64mg,0.1mmol)用p2o5真空干燥过夜,并溶于无水乙腈(1ml)。在n2下,加入乙硫基四唑(ett,32.5mg,0.25mmol)。将混合物在室温下搅拌15分钟。tlc和lc-ms表明原料a-oh-tom已完全消耗。将t-buooh在癸烷(5m,0.1ml)和dcm(1ml)中的溶液加入到反应混合物中,并在室温下搅拌15分钟。将反应混合物倒入nahco3水溶液中,并将水相用etoac萃取。蒸发合并的有机相,并在室温下用naoh(0.1m,1ml在h2o/thf/meoh=1/4/5v/v中)处理1小时。然后将混合物用hcl(1m)的thf/meoh(5ml/4ml)溶液处理0.5小时。将反应混合物浓缩并分配在h2o和etoac中。从水溶液中回收所需产物。并用rphplc(teab0.1m/ch3cn)进一步纯化。对模型化合物c-tom-a的裂解研究在各种脱保护条件下处理c-tom-a的原液。通过rphplc监测反应进程。中间体c-a是其中tom基团已从c-tom-a中去除但磷酸酯键合尚未裂解的化合物。下表1总结了在各种反应条件和脱保护试剂下的脱保护结果。表1。条件结果0.5mmc-tom-a,0.5mtbaf,1:1thf/h2o,ph-760%中间体c-a/2.5小时0.5mmc-tom-a,0.5met3n-3hf,et3n,ph-7100%中间体c-a/2.5小时0.5mmc-tom-a,0.25mnh4f,ph-780%中间体c-a/2.5小时0.5mmc-tom-a,0.25mcsf,tris-hcl,ph7.470%中间体c-a/2.5小时0.5mmc-tom-a,0.25mcsf,tris-hcl,ph970%中间体c-a/2.5小时0.5mmc-tom-a,0.5met3n-3hf,ph-180%中间体c-a+20%产物/1小时0.33mmc-tom-a,0.17mnh4f,0.33mnaoh、ph-1450%中间体c-a+50%产物/1小时0.33mmc-tom-a,0.33mcsf,0.33mnaoh、ph-141小时完成0.5mmc-tom-a,1mnaoh,ph1420分钟完成实施例7在该实施例中,描述了替代的方法用于产生pd(0)络合物,并且将它们的化学裂解活性与实施例1所述的从烯丙基氯化钯(ii)二聚物(pd(c3h5)cl)2和thp原位产生的钯(0)络合物进行了比较。与原位产生的pd(0)络合物相反,在用于化学线性化反应、例如p15引物的化学裂解之前已制备并分离了一些钯(ii)前催化剂。这些pd(ii)前催化剂在分离的形式中是无活性的,但是可以在thp存在下方便地原位还原为活性pd(0)。这些替代的pd前催化剂可改善产品稳定性并延长货架期。制备方法(pd(c3h5)cl)2在氮气下溶解在干燥、脱气的四氢呋喃中,并用1-10当量的thp以四氢呋喃溶液形式添加处理。观察到出油,并通过倒出上清液分离出油。将该材料在真空下干燥以获得黄至棕色或橙色的粘性油。这些材料高度溶于水。当添加1-2当量的thp时,分离出[pd(c3h5)(thp)]cl和[pd(c3h5)(thp)2]cl的混合物,两者均为pd(ii)络合物。当添加5当量的thp时,获得[pd(c3h5)(thp)2]cl的干净样品。分离并表征了这两种pd(ii)络合物。当添加10当量的thp时,获得对p15线性化具有活性的pd(0)材料。[pd(c3h5)(thp)]cl:31pnmr(162mhz,d2o):d14(s)ppm.13cnmr(101mhz,d2o):d118.7(d,j=5.0hz),81.7(d,j=29hz),62.1(d,j=15hz),26.5(s),20.5(d,j=25.0hz)ppm.lc-ms:[allylpd(thp)]+;预测值:355da,实测值:355da.[pd(c3h5)(thp)2]cl:31pnmr(162mhz,d2o):d10(s)ppm.13cnmr(101mhz,d2o):d122.7(t,j=5.3hz),71.2(t,j=14hz),61.8(t,j=7.6hz),26.7(s),22.1(t,j=13hz)ppm.lc-ms:[allylpd(thp)2]+;预测值:563da,实测值:563da.用于p15裂解从用1、2、5和10当量thp对pd(pd(c3h5)cl)2进行处理中分离材料,以10mg/ml配制在水性缓冲液中。使用基于hplc的测定评估这些制剂对p15裂解的活性。在该测定中,p15引物的溶液(10μm)用每个制剂的10%v/v处理,在38℃下孵育10分钟,然后通过稀释和自旋柱处理淬灭,并通过hplc分析。裂解百分比是根据p15与裂解产物峰面积之比计算得出的。[pd(c3h5)(thp)]cl和[pd(c3h5)(thp)2]cl的水性制剂(由将(pd(c3h5)cl)2与1至5当量thp混合而得到)在没有其他添加剂的情况下对p15裂解无活性。然而,从将(pd(c3h5)cl)2与10当量thp混合并从中分离的材料的水性制剂提供可比于从(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)原位制备的pd混合物的p15裂解活性。结果示于图5a。据观察,钯(ii)前催化剂[pd(c3h5)(thp)]cl和[pd(c3h5)(thp)2]cl在制备过程中或在用额外的thp水溶液处理后的使用时点被方便地原位激活。[pd(c3h5)(thp)2]cl被证明在用1或更多当量thf处理时在配制为水溶液(12mmpd)时变得具有活性。p15的裂解性能超过参考样品,即从(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)的混合物原位制备的pd(0)混合物的点(图5b)。实施例8在该示例中,通过使用膦配体三(羟基甲基)膦(thm)制备了替代的可分离的pd(0)络合物pd(thm)4。将其裂解活性与如实施例1所述的从烯丙基氯化钯(ii)二聚体(pd(c3h5)cl)2和thp原位产生的pd(0)络合物进行比较。制备:使用ellis,etal.,inorg.chem.,1992,31,14所描述的方案,制备和分离pd(thm)4。水溶液配制为10mm的浓度,并且其性能相对于使用(pd(c3h5)cl)2(10mm)和thp(100mm)原位产生的pd(0)进行评估。为了证明pd(0)诱导的线性化,在novaseqtm仪器上使用接枝有p15/p7表面引物的s4流动池(2x151,具有双索引周期)进行测序。xp工作流程与纳米(泳道1和3)和无pcr(泳道2和4)文库(450bp插入片段)一起使用。在read1sbs化学之前,使用由(pd(c3h5)cl)2(10mm)、thp(100mm)和抗坏血酸钠(10mm)组成的pd混合物[在泳道1-2];或使用pd(thm)4(10mm)的水溶液[在泳道3-4中]实施线性化。使用含有fpg酶的试剂进行read2线性化。据观察,两种pd线性化方法的测序指标通常是可比的。pd(thm)4的高read1强度和再合成百分比表明实现了成功的线性化(图6a)。两种方法的人错误率和phix错误率均相当(图6b)。测序结果总结在下表中(表2)。表2实施例9在该实施例中,描述了用于制备活性pd(0)络合物的替代途径。通过在配体交换反应中使pd(pph3)4与thp反应来制备和分离pd(thp)2-4。将其裂解活性与如实施例1所述的从烯丙基氯化钯(ii)二聚体(pd(c3h5)cl)2和thp原位产生的pd(0)络合物进行比较。制备方法在氮气下,将pd(pph3)4溶解在干燥、脱气的二氯甲烷中,得到黄色溶液。添加thp水溶液(4.1eq.)以获得两相混合物,将其搅拌2.5小时。黄色从有机层转移到水层。通过虹吸去除有机层并用另外的dcm冲洗水相来对反应进行后处理。将水相在减压下干燥,并用四氢呋喃共蒸发,并且将所得橙色油在高真空下干燥。收率几乎是定量的。产物lc-ms分析表明存在pd(thp)2[pd(thp)2+h+。预测值:523da,实测值:523da]。用于p15线性化在水性缓冲液中以10mg/ml配制pd(thp)2-4,并使用基于板的测定评估其p15裂解活性。该测定利用接枝有p15/p17表面引物的96孔板。插入荧光染料可用于定量read1线性化前后的双链dna;裂解百分数可从剩余的双链dna的量计算。对于pd(thp)2-4的制剂,p15的裂解活性与由(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)原位制备的pd混合物相当(图7)。据观察,两种方法具有相当的裂解性能。实施例10在该实施例中,制备了替代的基于镍的化学裂解试剂,并在含有烯丙基dt核苷酸的dna链的裂解中进行了测试。首先,在制备镍络合物中,thp和thm膦配体都以各种当量与nicl2反应。ni-thp(1:4或1:10的比例)产生的裂解产物与实施例1中所述的含钯试剂相同。有趣的是,ni-thm的膦配体具有较短的烷基链(因此锥角较小),在与镍复合时,没有显示出相同的裂解活性。测试了ni-thp在表面的裂解活性,并将其与pd-thp的裂解活性进行了比较。实验在接枝有p15/p7引物和示踪剂寡核苷酸的hiseqtm流动池中进行。示踪寡核苷酸在序列中具有四个烯丙基dt和3'荧光标记。通过ni-thp或pd-thp络合物裂解烯丙基dt后,来自流动池的荧光信号将被消除。流动池是用1.1μmp15/p7和额外的5%至40%的示踪剂寡核苷酸接枝的,然后在typhoon上扫描确认接枝的成功。在60℃下实施化学线性化10分钟。泳道1-4用pd-thp络合物处理(由(pd(c3h5)cl)2(6mm)、thp(60mm)和抗坏血酸钠(6mm)原位产生)作为对照,泳道5~8用10mmni-thp(1:10)络合物处理。然后在typhoon上获得荧光强度,以评估化学线性化的程度。泳道布局:5%示踪剂=55nm(泳道1,5);10%示踪剂=110nm(泳道2,6);20%示踪剂=220nm(泳道3,7);40%示踪剂=440nm(泳道4,8)。图8显示了在裂解之前和之后的归一化中值荧光强度,并且ni-thp已显示出与pd-thp相当的有效裂解活性。实施例11在该实施例中,描述了替代的基于偶氮-芳烃的接头作为利用连二亚硫酸钠(na2s2o4)水溶液的化学线性化的生物正交可裂解的接头。方案5和6分别说明了偶氮-亚磷酰胺1和2的制备。方案5化合物5。在n2中,将2-氨基-5-碘苯甲酸甲酯(4)(20.77g,10mmol)、pd(pph3)4(1.159mg,1mmol)、cui(381mg,2mmol)、et3n(4.2ml,30mmol)和炔丙醇(1.75ml,30mmol)在dmf(20ml)中的悬浮液在室温下搅拌15h。tlc分析(石油醚:乙酸乙酯1:1)表明原料被完全消耗。用200ml饱和nacl溶液淬灭反应。将乙酸乙酯:石油醚1:1(200ml)加入到该混合物中,并用乙酸乙酯:石油醚1:1萃取水层三次。用mgso4干燥合并的有机物后,将溶液浓缩并通过硅胶色谱法纯化(石油醚:乙酸乙酯80:20至乙酸乙酯),得到化合物5,为黄色油状物(1.88g,92%)。1hnmr(cdcl3)δ3.78(s,3h),4.25(s,2h,≡cch2),7.27-7.36(m,2h,arom.h),7.58-7.65(m,1h,arom.h)。化合物6。在n2下,向化合物5(1.88mg,9.2mmol)和咪唑(1.83g,27.6mmol)在干燥dmf(25ml)中的溶液加入叔丁基二苯基甲硅烷基氯(1.06g,12mmol)。通过tlc跟踪反应,并在室温下搅拌1小时后完成。用饱和nahco3溶液淬灭反应。用乙酸乙酯:石油醚1:1(2x)萃取。用mgso4干燥合并的有机物后,在真空下去除溶剂。然后将粗混合物溶解在etoh中,并用etsih和pd-c(10%)处理。将反应混合物在n2下回流16小时。tlc分析(石油醚:乙酸乙酯8:2)表明原料被完全消耗。过滤反应混合物,浓缩并通过硅胶色谱法纯化(石油醚至石油醚:乙酸乙酯1:1),得到化合物6,为黄色油状物(3.37g,82%)。1hnmr(cdcl3)δ1.04(s,9h,3xch3),1.70-1.77(m,2h,ch2),2.56(t,2h,ch2),3.58(t,2h,och2),3.60(s,3h,och3),6.62-6.65(m,1h,arom.h),7.03-7.06(m,1h,arom.),7.27-7.63(m,11h,arom.h).化合物8。在n2下向间苯二酚(2.2g,20mmol)和k2co3(2.76g,20mmol)在dmf(40ml)中的悬浮液加入4-溴丁酸叔丁酯(2.2g,10mmol)。将反应混合物在室温下搅拌15小时。tlc分析(石油醚:乙酸乙酯7:3)表明90%的原料间苯二酚被消耗。用300ml饱和nacl溶液淬灭反应。向反应混合物中加入乙酸乙酯:石油醚1:1(300ml),水层用乙酸乙酯:石油醚1:1萃取3次。用mgso4干燥合并的有机物后,溶液浓缩并通过硅胶柱色谱纯化(石油醚至石油醚:乙酸乙酯50:50),得到化合物8,为黄色油(2.2g,88%)。1hnmr(cdcl3)δ1.27(s,9h),1.91-1.98(m,2h,ch2),2.22(t,2h,ch2),3.27(t,2h,och2),6.36-6.46(m,3arom.h),7.09(t,1arom.h)化合物9。将化合物5(450mg,1mmol)溶解于丙酮/水(1:1)(2.5ml)的溶液中。将混合物冷却至0℃,并加入浓hcl(0.5ml)。5分钟后,逐滴加入亚硝酸钠(93mg,1.2mmol)的水(1ml)溶液,并将混合物在0℃下搅拌1小时。同时,将化合物8(252mg,1mmol)、na2co3(210mg,2mmol)和naoh(160mg,4mmol)溶解在丙酮/水的溶液(1:1)(3ml)中。在0℃下在第二溶液中滴加第一溶液。加完后,将混合物温热至室温,再搅拌1小时。将反应混合物用1m-hcl中和,然后用dcm(3x50ml)萃取。有机相用mgso4干燥,浓缩并通过硅胶色谱法纯化(石油醚至石油醚:乙酯乙酸乙酯1:1)。得到化合物9,为橙色/红色油状物(400mg,56%)。1hnmr(400mhz,dmso-d6)δ1.02(s,9h,3xch3),1.27(s,9h),δ1.69-1.76(m,ch2),1.91-1.97(m,2h,ch2),2.20(t,2h,ch2),2.53(t,2h,ch2),3.34(t,2h,och2),3.54(t,2h,och2),3.62(s,3h,och3),6.36-6.46(m,4arom.h),7.00-7.06(m,1h,arom.h),7.09(t,1arom.h),7.27-7.63(m,11h,arom.h).化合物11。将化合物9(3.55g,5mmol)溶于dcm(50ml)。将该溶液在室温下用tfa(10ml)处理并搅拌过夜。然后tfa的混合物在减压和与甲苯共蒸发下去除。将残留物在nacl和dcm之间分配。将水层用dcm萃取3次。合并的有机层用mgso4干燥并浓缩。将粗产物溶解于thf(15ml)中,并用tbaf(1m,5ml)处理。通过tlc(dcm/meoh90:10)监测反应。减压去除溶剂,并将残留物在nacl和dcm(+10%meoh)之间分配。将水层用dcm(+10%meoh)萃取3次。合并的有机层用mgso4干燥并浓缩。将残留物与吡啶共蒸发3次。将残留物溶解在py/ch3cn(10/10ml)中,并加入hunig碱(3.7ml,15mmol)、dmt-cl(5.07g,15mmol)。将混合物在室温下搅拌2小时。tlc(dcm:meoh95:5)表明反应完成。将混合物浓缩,溶解在dcm中,并用na2co3洗涤。合并的有机层用mgso4干燥,浓缩并通过硅胶色谱法纯化(石油醚:乙酸乙酯8:2至乙酸乙酯+1%net3)。得到化合物11,为橙色/红色油(2.37g,66%)。1hnmr(400mhz,dmso-d6)δ1.70-1.79(m,2h,ch2),1.90-1.97(m,2h,ch2),2.24(t,2h,ch2),2.54(t,2h,ch2),3.26(t,2h,och2),3.58(t,2h,och2),3.63(s,3h,och3),3.71(s,6h,ome),6.79-6.89(m,4h,aromatics),7.03-7.06(m,1h,arom.h),7.10(t,1arom.h),7.13-7.63(m,13h,arom.h).化合物12。在n2下将化合物11(1.05g,1.46mmol)和dmap(18mg,0.15mmol)溶解于7ml无水吡啶中。然后将反应混合物冷却至0℃,并逐滴加入苯甲酰氯(0.5ml,4.4mmol)。将反应混合物缓慢加热至室温并搅拌1小时,在此期间溶液变浑浊。tlc分析表明原料完全消耗。用饱和nahco3溶液淬灭反应。将水层用dcm萃取3次。该合并的有机层用mgso4干燥,浓缩并通过硅胶色谱法纯化(石油醚:乙酸乙酯8:2至乙酸乙酯+1%的net3),得到化合物12,为黄色油状物(930mg,78%)。1hnmr(400mhz,dmso-d6)δ1.69-1.76(m,2h,ch2),1.91-1.97(m,2h,ch2),2.20(t,2h,ch2),2.53(t,2h,ch2),3.24(t,2h,och2),3.54(t,2h,och2),3.62(s,3h,och3),3.71(s,6h,ome),6.79-6.86(m,4h,aromatics),7.01(t,1arom.h),7.04-7.11(m,3h,arom.h),7.13-7.63(m,13h,arom.h),7.94-8.36(m,3h,arom.h).化合物13。在n2下将化合物12(340mg,0.5mmol)溶于3ml无水dmf中,并加入hunig碱(0.26ml,1.5mmol)。然后将反应混合物用tstu(196mg,0.65mmol)处理并保持在室温下30分钟后,tlc分析(etoac)表明反应完成。然后将3-氨基丙醇(38μl,0.5mol)加入反应混合物中,并在室温下搅拌4h。tlc分析表明原料完全消耗。用饱和nahco3溶液淬灭反应。将水层用dcm萃取3次。将合并的有机层用mgso4干燥,浓缩,与二甲苯共蒸发(3×),并通过硅胶色谱法纯化(石油醚:乙酸乙酯8:2至乙酸乙酯+1%的etn3),以得到化合物13,为橙色油状物(320mg,73%)。1hnmr(400mhz,dmso-d6)δ1.67-1.79(m,4h,ch2),1.91-1.97(m,2h,ch2),2.20(t,2h,ch2),2.53(t,2h,ch2),3.24(t,2h,och2),3.45(t,2h,och2),3.51(t,2h,nch2),3.54(t,2h,och2),3.69(s,3h,och3),3.71(s,6h,ome),6.79-6.86(m,4h,aromatics),7.01(t,1arom.h),7.04-7.11(m,3h,arom.h),7.13-7.69(m,13h,arom.h),7.94-8.40(m,3h,arom.h).化合物1。将化合物13(320mg,0.36mmol)在高真空下干燥。在n2下加入无水dcm(2ml)并用分子筛在室温下搅拌10分钟。向溶液中,加入hunig碱(0.19ml,1.1mmol),并接着加入2-氰基乙基n,n-二异丙基氯代亚磷酰胺(102mg,0.43mmol)。将反应在室温下在n2下搅拌3h。该反应用tlc(石油醚/乙酸乙酯,8:2)追踪。反应在真空下浓缩成糖浆。残留物通过柱纯化(石油醚:乙酸乙酯8:2至乙酸乙酯,pe/etoac+1%net3),得到化合物1,为橙色油状物(190mg,50%)。产物在柱上部分分解。1hnmr(400mhz,dmso-d6)δ0.96-1.27(m,12h),1.68-1.79(m,4h,ch2),1.91-1.97(m,2h,ch2),2.20(t,2h,ch2),2.53(t,2h,ch2),2.58-2.74(m,2h,ch2cn),3.24(t,2h,och2),2.93(m,2h,nch),3.44(t,2h,nch2),3.42-3.54(m,4h,och2),3.69(s,3h,och3),3.71(s,6h,ome),6.79-7.01(m,5h,aromatics),7.04-7.11(m,3h,arom.h),7.13-7.69(m,13h,arom.h),7.94-8.40(m,3h,arom.h).方案6化合物15。在n2下,向化合物14(3.6g,20mmol)和咪唑(3.72g,60mmol)的无水dmf(25ml)溶液,加入叔丁基二苯基甲硅烷基氯(2.3g,26mmol)。通过tlc追踪反应,并在室温下搅拌1小时后完成。用饱和nahco3溶液淬灭反应,并用乙酸乙酯:石油醚1:1(2x)萃取。用mgso4干燥合并的有机层后,将反应混合物过滤,浓缩并通过硅胶色谱纯化(石油醚至石油醚:乙酸乙酯1:1),得到化合物15,为米黄色油(7.19g,86%)。1hnmr(dmso-d6)δ0.99(s,9h,3xch3),3.38-3.46(m,2h,nch2),3.92(t,2h,och2),5.59(s,2h,nh2),6.50-6.54(d,2h,arom.h),7.37-7.66(m,13h,arom.h),8.05(d,1h,nh).化合物16。在n2下,在0℃下向化合物15(840mg,2mmol)在无水dcm(10ml)中的溶液,加入四氟硼酸亚硝酰基酯(234mg,2mmol)。通过tlc跟踪反应后,在0℃下搅拌1小时后原料消失。然后将化合物8(756mg,3mmol)加入到反应混合物中。将反应混合物缓慢加热至室温,并搅拌4小时。通过tlc追踪反应。完成后,将反应用饱和nahco3溶液淬灭,并用dcm萃取(2x)。用mgso4干燥该合并的有机层后,将反应混合物过滤,浓缩并通过硅胶色谱法(石油醚纯化至石油醚:乙酸乙酯1:1),得到化合物16,为橙色油状物(1.12g,82%)。1hnmr(dmso-d6)δ0.99(s,9h,3xch3),1.27(s,9h,3xch3),1.91-1.98(m,2h,ch2),2.22(t,2h,ch2),3.27(t,2h,och2),3.38-3.46(m,2h,nch2),3.92(t,2h,och2),6.36-6.46(m,3arom.h),6.50-6.56(d,2h,arom.h),7.10(t,1arom.h),7.37-7.66(m,13h,arom.h),8.06(d,1h,nh).化合物17。在n2下,将化合物16(1.1g,1.64mmol)和dmap(20mg,0.16mmol)溶解于8ml无水吡啶中。然后将该混合物冷却至0℃,并滴加苯甲酰氯(0.17ml,1.5mmol)。将反应混合物缓慢加热至室温并搅拌1小时,在此期间溶液变浑浊。tlc分析表明原料完全消耗。用饱和nahco3溶液淬灭反应。用dcm萃取水层3次。将该合并的有机层用h2so4洗涤、用mgso4干燥,并浓缩。将得到的粗混合物溶解在dcm(14ml)中。将该溶液在室温下用tfa(1.4ml)处理并搅拌过夜。通过tlc(石油醚:乙酸乙酯1:1)监测反应。将tfa在减压下和与甲苯共蒸发而去除。将残留物在nacl和dcm之间分配。将水层用dcm萃取3次。合并的有机层经mgso4干燥并浓缩。将粗产物溶于thf(8ml)中,并用tbaf(1m,1.6ml)处理。通过tlc(dcm/meoh9:11)监测反应。减压去除溶剂,并将残留物在nacl和dcm(+10%meoh)之间分配。将水层用dcm(+10%meoh)萃取3次。合并的有机层经mgso4干燥,浓缩并通过硅胶色谱法纯化(dcm至dcm:meoh9:1)。得到化合物17,为橙色/红色油状物(515g,64%)。1hnmr(400mhz,dmso-d6)δ1.56-1.64(m,2h,ch2),2.01(t,2h,ch2),3.24(t,2h,nch2),3.52(t,2h,och2),4.25(t,2h,och2),6.79-6.89(m,1h,arom.h),7.03-7.06(m,1h,arom.h),7.13-7.63(m,10h,arom.h),8.56(t,1h,nh).化合物18。将化合物17(500mg,1mmol)溶解在py/ch3cn(5/5ml)中,并加入hunig碱(0.87ml,5mmol)、dmt-cl(1g,3mmol)。将混合物在室温下搅拌2小时。tlc(dcm:meoh95:5)表明反应完成。将混合物浓缩,溶解在dcm中,并用na2co3洗涤。将合并的有机层经mgso4干燥,浓缩并通过硅胶色谱法纯化(石油醚:乙酯乙酸8:2至乙酸乙酯+1%的net3)。得到化合物18,为橙色/红色油状物(653mg,83%)。1hnmr(400mhz,dmso-d6)δ1.16-1.24(m,2h,ch2),2.01(t,2h,ch2),3.24(t,2h,nch2),3.52(t,2h,och2),3.69(s,6h,ome),4.25(t,2h,och2),6.76-6.89(m,4h,arom.h),7.03-8.23(m,21h,arom.h),8.86(t,1h,nh).化合物19。在n2下将化合物18(350mg,0.5mmol)溶于3ml无水dmf中,并加入hunig碱(0.26ml,1.5mmol)。然后将反应混合物用tstu(196mg,0.65mmol)处理并保持在室温。30分钟后,tlc分析(石油醚:etoac2:8)表明反应完成。然后将3-氨基丙醇(38μl,0.5mol)加入反应混合物中,并在室温下搅拌4小时。tlc分析表明原料完全消耗。用饱和nahco3溶液淬灭反应。用dcm萃取水层3次。将合并的有机层用mgso4干燥,浓缩,与二甲苯共蒸发(3×),并通过硅胶色谱法纯化(石油醚:乙酸乙酯8:2至乙酸乙酯+1%的net3),得到化合物19,为橙色油(223mg,52%)。1hnmr(400mhz,dmso-d6)δ1.67-1.79(m,4h,ch2),1.91-1.97(m,2h,ch2),2.05(t,2h,ch2),2.53(t,2h,ch2),3.24(t,2h,och2),3.45(t,2h,och2),3.51(t,2h,nch2),3.57(t,2h,och2),3.71(s,6h,ome),6.79-6.86(m,4h,aromatics),7.01(t,1arom.h),7.04-7.11(m,3h,arom.h),7.13-7.69(m,13h,arom.h),7.74-8.40(m,4h,arom.h),8.76(t,1h,nh).化合物2。将化合物19(223mg,0.26mmol)在高真空下干燥。在n2下加入无水dcm(1.5ml),并用分子筛在室温下搅拌10分钟。向溶液中加入hunig碱(0.14ml,0.78mmol),然后加入2-氰基乙基n,n-二异丙基氯代亚磷酰胺(76ul,0.34mmol)。将反应在室温下在n2下搅拌3h。该反应用tlc(石油醚/乙酸乙酯,2:8)追踪。反应在真空下浓缩成糖浆。将残留物通过柱纯化(石油醚:乙酸乙酯8:2至乙酸乙酯+1%的net3),得到化合物2,为橙色油状物(152mg,56%)。产物在柱上部分分解。1hnmr(400mhz,dmso-d6)δ0.96-1.27(m,12h),1.68-1.79(m,4h,ch2),1.91-1.97(m,2h,ch2),2.19-2.22(m,2h,ch2),2.51-2.54(m,2h,ch2),2.58-2.74(m,2h,ch2cn),3.22-3.26(m,2h,och2),2.93(m,2h,nch),3.44(t,2h,nch2),3.42-3.54(m,4h,och2),3.71(s,6h,ome),6.79-7.01(m,5h,aromatics),7.04-7.11(m,3h,arom.h),7.13-7.69(m,13h,arom.h),7.94-8.40(m,3h,arom.h),8.76(t,1h,nh).然后,分别掺入有两种偶氮-亚磷酰胺化合物1和2的两种短寡核苷酸(寡核苷酸偶氮-1和寡核苷酸偶氮-2)被合成以评价裂解效率。寡核苷酸偶氮-1在450nm具有吸收并为橙色。在裂解后,偶氮键被破坏,导致失去橙色。在室温下添加0.1mna2s2o4溶液后,该寡聚物溶液的橙色立即消失,这表明偶氮键的裂解非常有效。寡核苷酸偶氮-1和裂解产物的hplc分析也证实了相同的结果。寡核苷酸偶氮-2裂解试验的hplc分析表明,在室温下用0.1mna2s2o4溶液处理的偶氮键干净且立即裂解。寡核苷酸偶氮-1:5'-gax1cta-3'寡核苷酸偶氮-2:5'-gax2cta-3'此外,寡核苷酸偶氮-1与sbs测序试剂的相容性也进行了测试。首先,将10μm寡核苷酸偶氮-1(10μl)中在90μl的掺入混合物(imx)、裂解混合物(cms)和扫描混合物(usm)中在60℃下孵育60分钟。hplc分析表明寡核苷酸偶氮-1在imx中是完全稳定的,90%寡核苷酸偶氮-1在cms中分解,50%寡核苷酸偶氮-1在usm中保留。对于寡核苷酸偶氮-2观察到小改进。当两种寡核苷酸在60℃下在cms溶液(10μl)中孵育60分钟时,寡核苷酸偶氮-2的降解降低至44%,与寡核苷酸偶氮-1的66%降解相对。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1