PCBP1用于治疗过度增殖性疾病的用途的制作方法
相关申请的交叉引用本申请要求于2018年2月5日提交的美国临时申请第62/626,424号的权益,所述美国临时申请的内容出于所有目的通过全文引用的方式并入。本公开涉及用于抑制细胞迁移和癌症转移以及减少肿瘤负荷的组合物和方法。具体地,本公开提供了用于转导癌细胞以抑制癌细胞迁移和癌症发展和/或转移的方法和组合物。所述组合物可以在体外、体内、离体或原位施用。以电子方式提交的文本文件的描述与本申请一起以电子方式提交的文本文件的内容通过全文引用的方式并入本文:序列表的计算机可读格式副本(文件名:ibex-003/01wo_seqlist_st25.txt,记录日期:2019年2月5日,文件大小:15千字节)。
背景技术:
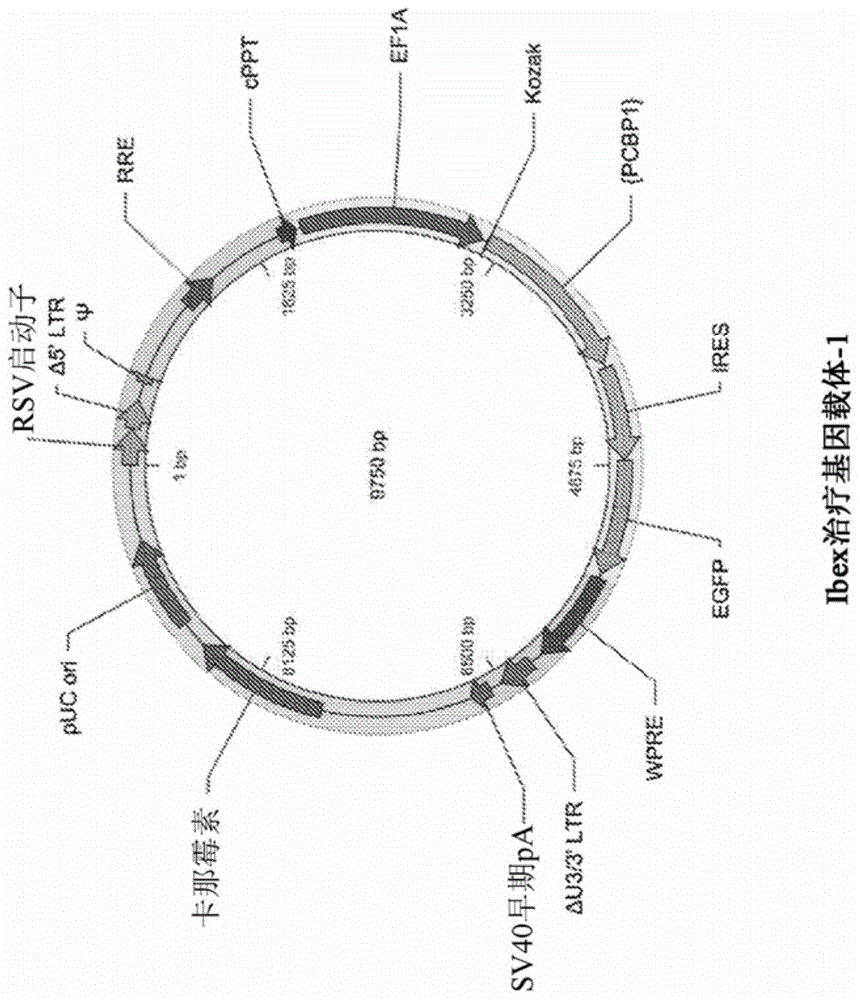
:再生肝磷酸酶3(prl-3)是致癌因子,其激活通常与肿瘤发生和转移相关联。先前的研究表明,聚(rc)结合蛋白(pcbp1)减少prl-3的表达并且可以能够抑制癌发生的发展。为了实现对癌症的新型基因治疗的希望,必须对癌细胞进行操纵,使得减少或防止癌症发展以及与肿瘤发生和转移相关联的生物标志物的表达。这将防止癌细胞的发展和/或防止其转移并最大限度地减少对全身组织和器官的侵袭。技术实现要素:本公开提供了通过使用基因治疗用对pcbp1多肽、其突变体和/或变体进行编码的组合物转染和/或转导癌细胞来抑制肿瘤发展、生长、细胞迁移和/或转移的方法。在一些方面,本公开提供了抑制、预防或减少细胞迁移的方法,所述方法包括将包括pcbp1或突变pcbp1核酸序列的载体引入到细胞中。在一些实施例中,所述细胞迁移是转移。在一些方面,本公开提供了治疗癌症的方法,所述方法包括将包括pcbp1或突变pcbp1核酸序列的载体引入到癌细胞中。在一些实施例中,所述方法在体外执行。在一些实施例中,所述方法离体执行。在一些实施例中,所述方法在体内执行。在一些实施例中,所述细胞是哺乳动物细胞。在一些实施例中,所述哺乳动物细胞是人类细胞。在一些实施例中,所述哺乳动物细胞是器官细胞、组织细胞或血液细胞。在一些实施例中,所述哺乳动物细胞是癌细胞。在一些实施例中,所述癌细胞是来自黑色素瘤、前列腺癌、胰腺癌、胶质母细胞瘤、视网膜母细胞瘤或乳腺癌的细胞。在一些实施例中,与野生型pcbp1相比,所述突变pcbp1核酸序列对不能磷酸化或不能完全磷酸化的多肽进行编码。在一些实施例中,突变pcbp1未被p21激活激酶(pak)磷酸化或未被pak完全磷酸化。在一些实施例中,与野生型pcbp1(seqidno:1)相比,突变pcbp1核酸包括一种、两种、三种、四种,或五种或更多种突变。在一些实施例中,所述突变pcbp1核酸与野生型pcbp1(seqidno:1)具有至少75%的一致性百分比。在一些实施例中,突变pcpb1核酸包括seqidno:3的序列。在一些实施例中,所述突变pcbp1核酸包括seqidno:5的序列。在一些实施例中,所述载体包括对突变pcbp1多肽进行编码的突变pcbp1核酸序列。在一些实施例中,与野生型pcbp1相比,所述突变pcbp1多肽未磷酸化或未完全磷酸化。在一些实施例中,所述突变pcbp1多肽未被p21激活激酶-1(pak1)磷酸化或未被pak1完全磷酸化。在一些实施例中,所述突变pcbp1抑制或防止磷酸化pcbp1产生。在一些实施例中,与野生型pcbp1(seqidno:2)相比,所述突变pcbp1多肽包括一种、两种、三种、四种、五种或更多种突变。在一些实施例中,所述突变pcbp1多肽与野生型pcbp1(seqidno:2)具有至少75%的一致性百分比。在一些实施例中,突变pcpb1多肽包括seqidno:4的序列。在一些实施例中,所述突变pcbp1多肽包括seqidno:6的序列。在一些实施例中,所述细胞表达野生型或突变pcbp1核酸序列的多个拷贝。在一些实施例中,所述细胞表达野生型或突变pcbp1多肽的多个拷贝。附图说明图1a示出了含有野生型或突变pcbp1序列的代表性慢病毒载体。在此载体中,pcbp1由ef1a启动子并且随后由含有ires-gfp报告基因盒的二级表达盒驱动。图1b示出了含有野生型或突变pcbp1序列的代表性aav载体。在此载体中,pcbp1序列的表达由ef1a启动子并且随后由含有ires-gfp报告基因盒的二级表达盒驱动。此载体可以含有在gfp序列之后插入以增强一个或多个转基因的表达的wpre片段。图2a示出了对用本公开的组合物转染的黑色素瘤细胞中的基因表达的qrt-pcr分析,所述分析分别测量了各组之间的倍数变化(ddct):仅gfp相对于gfp加野生型pcbp1(wpcbp1_0)示出pcbp1表达上调高4.012倍;仅gfp相对于gfp加pcbp1s223l(mpcbp1_1)示出pcbp1表达高3.97;并且仅gfp相对于gfp加pcbp1t60a和t127a(mpcbp1_2)示出pcbp1表达高4.02倍;(*p<0.01)。管家基因是gapdh。图2b示出了在体外转染本公开的治疗性基因载体后黑色素瘤细胞中的gfp表达。(a):仅gfp;(b):wpcbp1_0-ires-gfp;(c):mpcbp1_1-ires-gfp;(d):mpcbp1_2-ires-gfp。(比例尺:200μm)。图3示出了通过对黑色素瘤细胞中不同形式的pcbp1(野生型和突变体)基因进行编码的基因治疗载体进行处理后通过蛋白质印迹法分析得出的prl-3蛋白表达。泳道1:仅gfp;泳道2:mpcbp1_1+gfp;泳道3:wpcbp1_0+gfp;泳道4:pcbp1_2+gfp。β-肌动蛋白是对照组。图4a示出了圆形检测区(cdz)中的净细胞计数差异的比较,作为相比于孔中的所有细胞的迁移细胞百分比,以展现转染的黑色素瘤细胞的迁移。gfp组(11.33)的迁移细胞百分比(每孔)显著高于wpcbp1_0(野生型pcbp1,在本文中也被称为“pcbp1”)、mpcbp1_1和mpcbp1_2。在这三个组中,mpcbp1_2在每孔中的迁移细胞百分比最低(1.82)。(*p<0.05)。图4b示出了细胞迁移测定。在第1天和第5天读取细胞迁移测定,并在荧光显微镜(绿色滤光片)下进行观察。顶行示出了来自第1天和第5天的wpcbp1_0的细胞迁移;中间行示出了mpcbp1_2和mpcbp1_1,并且底行示出了gfp组。a列是第1天的细胞迁移孔(白色虚线圆圈为圆形检测区,或称为cdz);b列是第5天的细胞迁移孔(其中cdz呈白色虚线);c列是放大的b列cdz。图4c示出了圆形检测区(cdz)迁移测定中的净细胞计数差异,作为从第1天到第5天cdz中的净细胞计数的差异的比较。通过gfp、wpcbp1_0、mpcbp1_1或mpcbp1_2转染黑色素瘤细胞。图5示出了乳腺癌(bc)细胞系(mcf-7)中pcbp1mrna水平的倍数变化。所述图示出了转染到mcf-7中的pcbp1(wt/突变体)或仅gfp载体中的pcbp1mrna倍数变化的qrt-pcr结果。与仅gfp组相比,所有pcbp1+gfp组(wt和突变体)均示出了乳腺癌细胞中的pcbp1mrna表达水平显著增加(图中指示的倍数变化,*p<0.01)。(gfp:绿色荧光蛋白载体;wpcbp1_0-gfp载体;mpcbp1_1(一个位点突变(c668t));mpcbp1_2(两个位点突变(a178g和a379g)))。图6示出了对用载体处理后转化的乳腺癌(mcf-7)细胞中的prl3蛋白水平的蛋白质印迹法分析,所述载体对仅gfp(泳道1)、wpcbp1_0(泳道2)、mpcbp1_1(泳道3)和mpcbp1_2(泳道4)进行编码。图7a示出了在圆形检测区(cdz)中计数的净细胞的差异与每孔总的细胞的荧光强度的比较比率。图7b示出了乳腺癌细胞(mcf-7)迁移测定。在第1天和第5天读取细胞迁移测定,并在荧光显微镜(绿色滤光片)下进行观察。(gfp:绿色荧光蛋白;wpcbp1_0-gfp载体;mpcbp1_1(一个位点突变(c668t))-gfp载体;mpcbp1_2(两个位点突变(a178g和a379g))-gfp载体)。图7c示出了对通过gfp、wpcbp1_0、mpcbp1_1或mpcbp1_2转染的乳腺癌细胞(mcf-7)的细胞迁移测定。图8a-e示出了pcbp1(野生型/突变体)或gfp(对照组)转染后的乳腺癌(mcf-7)死细胞测定。通过去除上清液并应用商业活/死细胞测定试剂盒来测量死细胞。a:gfp转染后的乳腺癌细胞密度和通过亮视野显微术进行的观察。b:野生型pcbp1转染后的乳腺癌细胞密度和通过亮视野显微术进行的观察。c:mpcbp1_1(一个位点突变)转染后的乳腺癌细胞密度和通过亮视野显微术进行的观察。d:mpcbp1_2(两个位点突变)转染后的乳腺癌细胞密度和通过亮视野显微术进行的观察。e:在通过pcbp1(野生型/突变体)和/或gfp载体转染后使用酶标仪通过荧光强度测量进行的乳腺癌细胞的死细胞计数。gfp:绿色荧光蛋白转染的细胞。wp:野生型pcbp1转染的细胞。p1:mpcbp1_1(一个位点突变)转染的细胞。p2:mpcbp1_2(两个位点突变)转染的细胞。图9a-b示出了用本公开的组合物之一转染后胰腺癌细胞中的pcbp1表达。所述图示出了将含有野生型pcbp1(处理)或gfp(癌细胞)的载体转染到胰腺癌细胞中后的pcbp1mrna倍数变化的qrt-pcr结果。与gfp组相比,pcbp1组示出了胰腺癌细胞中的pcbp1mrna水平显著增加(图9a中指示的倍数变化)。与pcbp1组相比,gfp组也示出了高prl3mrna表达(图9b所指示的倍数变化)。图10示出了与gfp组(对照组)相比,前列腺癌细胞系(du-145)中具有野生型pcbp1和pcbp1突变体的处理组中的pcbp1mrna表达水平的倍数变化。所述图示出了展现了用含有pcbp1(wt/突变体)+gfp或仅gfp的载体转染的癌细胞(du-145)中的pcbp1mrna倍数表达变化的qrt-pcr结果。与gfp组相比,所有pcbp1组(wt和突变体)均展现了前列腺癌细胞中的pcbp1mrna水平显著增加(图中指示的倍数变化,*p<0.01)。(gfp:绿色荧光蛋白载体;wpcbp1_0-gfp载体;mpcbp1_1(一个位点突变);mpcbp1_2(两个位点突变))。图11示出了通过qrt-pcr对胶质母细胞瘤细胞系相对于皮质神经元细胞系(hcn-2)中的prl3mrna表达水平的测量。与正常脑皮质细胞系相比,prl3mrna在测试的所有六种胶质母细胞瘤细胞系中均过表达。图12示出了在细胞特异性启动子的控制下表达pcbp1(野生型或突变体)的aav载体的示意图。在此,pcbp1序列(wt、mpcbp1_1或mpcbp1_2)的表达由如胶质纤维酸性蛋白(gfap)启动子等细胞特异性启动子驱动,以治疗脑中的胶质母细胞瘤。gfp或lacz是用于说明特定细胞类型中的治疗性蛋白(例如,pcbp1)和标志物蛋白表达的共定位的报告基因。图13a-b示出了对胶质母细胞瘤(脑)细胞中的由特异性启动子驱动的转基因表达的体外检测。通过免疫组织化学分析用phgfap-lacz载体转染的ln229胶质母细胞瘤细胞。通过亮视野显微术观察癌细胞(ln299)(图a)。通过抗β-半乳糖苷酶抗体a11132(以1:700稀释)检测到由特异性启动子驱动的lacz基因表达的蛋白质。(图b)。使用northernnightstm557缀合的抗兔抗体(nl004,r&d系统公司(r&dsystem))作为产生红色荧光信号的二级抗体(稀释度为1:200)。放大率为20x。图14a-b示出了对胶质母细胞瘤(脑)细胞中的由特异性启动子驱动的转基因表达的体外检测。通过免疫组织化学分析用phgfap-lacz载体转染的u87胶质母细胞瘤细胞。通过亮视野显微术观察癌细胞(u87)(图a)。通过抗β-半乳糖苷酶抗体a11132(以1:700稀释)检测到由特异性启动子驱动的lacz基因表达的蛋白质。(图b)。使用northernnightstm557缀合的抗兔抗体(nl004,r&d系统公司)作为产生红色荧光信号的二级抗体(稀释度为1:200)。放大率为20x。图15a-b示出了对肾脏细胞中的由特异性启动子驱动的转基因表达的体外检测。通过免疫组织化学分析用phgfap-lacz载体转染的293ft肾脏细胞。通过亮视野显微术观察293ft肾脏细胞(图a)。通过抗β-半乳糖苷酶抗体a11132(以1:700稀释)未检测到由特异性启动子驱动的lacz基因表达的蛋白质。(图b)。使用northernnightstm557缀合的抗兔抗体(nl004,r&d系统公司)作为二级抗体(稀释度为1:200),如果β-半乳糖苷酶在这些细胞中表达,则所述二级抗体将会产生红色荧光信号。放大率为20x。图16a-b示出了对眼细胞中的由特异性启动子驱动的转基因表达的体外检测。通过免疫组织化学分析用phgfap-lacz载体转染的arpe-19眼细胞。通过亮视野显微术观察arpe-19眼细胞(图a)。通过抗β-半乳糖苷酶抗体a11132(以1:700稀释)未检测到由特异性启动子驱动的lacz基因表达的蛋白质。(图b)。使用northernnightstm557缀合的抗兔抗体(nl004,r&d系统公司)作为二级抗体(稀释度为1:200),如果β-半乳糖苷酶在这些细胞中表达,则所述二级抗体将会产生红色荧光信号。放大率为20x。图17示出了通过qrt-pcr对不同细胞类型中的由phgfap启动子驱动的laczmrna表达的检测。在hgfap的控制下用含有lacz的载体转染不同细胞(ln229、u87、arpe-19和293ft)后,对这些细胞中的laczmrna表达水平进行监测。将倍数变化与作为对照组的aav-gfp载体进行比较(*p<0.05)。这些数据证实lacz蛋白在hgfap启动子下在胶质母细胞瘤(脑)细胞(例如,u87和nl229细胞)中表达,但在其它细胞类型(例如,arpe-19和293ft细胞)中不表达。图18a-b示出了用含有仅gfp、野生型pcbp1(wp)、mpcbp1_1(p1)或mpcbp1_2(p2)的aav载体转染后胶质母细胞瘤细胞系ln229和u87细胞的细胞活力。图a示出了ln229胶质母细胞瘤细胞的活力。图b示出了u87胶质母细胞瘤细胞的活力。(*相对于gfp,p<0.05)。图19a-b示出了用对照载体或含有pcbp-1的载体转染后u87胶质母细胞瘤细胞中的活/死细胞信号。用aav-gfp、aav-pcbp1(wp)、aav-pcbp1_1(p1)或aav-pcbp1_2(p2)转染细胞,并且在四天后测试细胞活力。用钙黄绿素am对活细胞进行染色(图a),并且用ethd-1对死细胞进行染色(图b)。与用gfp对照载体转染的细胞相比,用含有pcbp1的载体转染后,死细胞显著增加。*p<0.05图20a-d示出了通过aav-gfp(图a)、aav-pcbp1(图b(wp))、aav-pcbp1_1(图c(mu1))或aav-pcbp1_2(图d(mu2))转染后对活的和死的u87胶质母细胞瘤细胞的染色。图21示出了用aav-gfp(泳道1)、aav-pcbp1(泳道2)、aav-pcbp1_1(泳道3)或aav-pcbp1_2(泳道4)转染的u87胶质母细胞瘤细胞中的prl3表达水平。使用蛋白质印迹法测试prl3蛋白水平。使用β肌动蛋白作为内部负载对照组。图22a-b示出了用对照载体或含有pcbp-1的载体转染后ln229胶质母细胞瘤细胞中的活/死细胞信号。用aav-gfp、aav-pcbp1(wp)、aav-pcbp1_1(p1)或aav-pcbp1_2(p2)转染细胞,并且在四天后测试细胞活力。用钙黄绿素am对活细胞进行染色(图a),并且用ethd-1对死细胞进行染色(图b)。与用gfp对照载体转染的细胞相比,用含有pcbp1的载体转染后,死细胞显著增加。*p<0.05图23a-d示出了通过aav-gfp(图a)、aav-pcbp1(图b(wp))、aav-pcbp1_1(图c(mu1))或aav-pcbp1_2(图d(mu2))转染后对活的和死的ln229胶质母细胞瘤细胞的染色。图24示出了用aav-gfp(泳道1)、aav-pcbp1(泳道2)、aav-pcbp1_1(泳道3)或aav-pcbp1_2(泳道4)转染的ln229胶质母细胞瘤细胞中的prl3蛋白水平。使用蛋白质印迹法测试prl3蛋白水平。使用β肌动蛋白作为内部负载对照组。图25a-b示出了通过aav-gfp和aav-pcbp1以及突变体转染后对胶质母细胞瘤m059j细胞系的活/死分析。wp=野生型pcbp1;p1=mpcbp1_1;p2=mpcbp1_2。*与gfp相比,p<0.05。图26a-b示出了通过aav-gfp和aav-pcbp1以及突变体转染后对胶质母细胞瘤m059k细胞系的活/死分析。wp=野生型pcbp1;p1=mpcbp1_1;p2=mpcbp1_2。*与gfp相比,p<0.05。图27a-b示出了通过aav-gfp和aav-pcbp1以及突变体转染后对胶质母细胞瘤u118mg细胞系的活/死分析。wp=野生型pcbp1;p1=mpcbp1_1;p2=mpcbp1_2。*与gfp相比,p<0.05。图28a-b示出了通过aav-gfp和aav-pcbp1以及突变体转染后对胶质母细胞瘤u138mg细胞系的活/死分析。wp=野生型pcbp1;p1=mpcbp1_1;p2=mpcbp1_2。*与gfp相比,p<0.05。图29示出了在pcbp1转染的u87胶质母细胞瘤细胞中通过蛋白质印迹法对pstat3(y705)蛋白水平的测量。用aav-gfp(泳道1)、aav-pcbp1(泳道2)、aav-mpcbp1_1(泳道3)或aav-mpcbp1_2(泳道4)转染细胞。通过所有形式的pcbp1的处理下调了胶质母细胞瘤细胞中的stat3水平,其中mpcbp1_2示出了最显著的效果。β肌动蛋白充当内部对照组。图30a-b示出了在pcbp1转染的ln299胶质母细胞瘤细胞中通过蛋白质印迹法对pstat3(y705)蛋白水平的测量。用aav-gfp(泳道1)、aav-pcbp1(泳道2)、aav-mpcbp1_1(泳道3)或aav-mpcbp1_2(泳道4)转染细胞。通过所有形式的pcbp1的处理下调了胶质母细胞瘤细胞中的stat3水平,其中mpcbp1_2示出了最显著的效果。(图a)。图b示出了对图a中的泳道1和泳道2的重复蛋白质印迹法测量。β肌动蛋白充当内部对照组。图31a-b示出了用pcbp1或突变体转染后卵巢skov3细胞的细胞增殖和计数。gfp=对照载体;野生型pcbp=pcbp1;pcbp1突变-1=mpcbp1_1;pcbp1突变-2=mpcbp1_2;图a示出了对用每孔0.5μg或2.0μg载体转染的细胞的显微观察。图b示出了通过酶标仪计数的细胞数量。图32示出了处理后在skov3卵巢细胞中通过qrt-pcr对pcbp1和prl3的mrna表达水平的检测。所述图示出了对处理组和对照组中的mrna水平(通过qrt-pcr测定)的倍数变化的比较。在所有pcbp1处理组中,pcbp1mrna表达水平均显著增加,包含野生型(增加11.5倍)、mpcbp1_1(增加11.3倍)和mpcbp1_2(增加11.4倍)。相比之下,prl3mrna水平降低:野生型(降低1.403倍)、mpcbp1_1(降低1.978倍)和mpcbp1_2(降低1.988倍)。gfp=对照载体;野生型pcbp=pcbp1;pcbp1突变-1=mpcbp1_1;pcbp1突变-2=mpcbp1_2;图33示出了野生型和突变pcbp1过表达对du145前列腺癌细胞系增殖的影响。gfp=无pcbp1处理组;wp=野生型pcbp1;p1=mpcbp1_1;p2=mpcbp1_2。与对照组相比,pcbp1或突变形式的过表达显著抑制了前列腺癌细胞的增殖。图34示出了在pcbp1转染的du145前列腺癌细胞中通过蛋白质印迹法对prl3蛋白水平的测量。用aav-gfp(泳道1)、aav-pcbp1(泳道2)、aav-mpcbp1_1(泳道3)或aav-mpcbp1_2(泳道4)转染细胞。通过所有形式的pcbp1的处理下调了前列腺癌细胞中的prl3水平,其中mpcbp1_2示出了最显著的效果。β肌动蛋白充当内部对照组。图35示出了对正常脑细胞系hcn-2的细胞毒性(ldh)测定。用aav-gfp、aav-pcbp1(wp)、aav-mpcbp1_1(p1)或aav-mpcbp1_2(p2)转染hcn-2细胞。尽管观察到了向下趋势,但是处理组中的乳酸脱氢酶(ldh)与gfp对照组相比无显著差异(p>0.05)。通过裂解缓冲液来处理阳性对照组中的细胞以引发最大ldh释放(左栏)。实验一式三份地执行。图36a-b示出了对正常乳腺细胞系mcf10a的细胞毒性(ldh)测定。用aav-gfp、aav-pcbp1(wp)、aav-mpcbp1_1(p1)或aav-mpcbp1_2(p2)转染mcf10a细胞。处理组中的乳酸脱氢酶(ldh)与gfp对照组相比无显著差异(p>0.05)。(图a)。如通过anova所测试的,在这四个组中未观察到显著差异(p>0.05)。(图b)。用野生型pcbp1、mpcbp1_1或mpcbp1_2进行处理对此正常乳腺细胞系无细胞毒性。具体实施方式已发现在转移癌(包含卵巢癌、前列腺癌和胃癌)中prl-3表达升高,并且prl-3的过表达与较差的肝癌预后相关(bardelli等人,2003;polato等人,2005;peng等人,2004)。先前已示出pcbp1的过表达会减少prl-3表达(wang等人,2010)。本公开提供了新型pcbp1突变和/或过表达的pcbp1,所述新型pcbp1突变和/或过表达的pcbp1与野生型pcbp1多肽或表达水平相比更大程度地减少了prl-3表达并因此减少了细胞致瘤性和迁移。因此,本文公开的组合物和方法包含用突变pcbp1或过表达的pcbp1进行遗传修饰(例如,通过转染或转导)以减少或防止细胞迁移和/或转移的细胞。将突变pcbp1序列并入到基因治疗的载体系统中,以直接防止、抑制、减少或延迟细胞迁移,从而治疗疾病。聚(rc)-结合蛋白1(pcbp1)在一些方面,本公开提供了含有可以抑制或延迟肿瘤发生和/或防止细胞生长或转移的转录因子聚(rc)结合蛋白1(pcbp1,也称为hnrnp-e1和αcp1)的载体。在一些实施例中,pcbp1是哺乳动物pcbp1。在一些实施例中,pcbp1是人pcbp1、其突变体、片段或变体。在一些实施例中,pcbp1突变体、其片段或变体防止或减少所表达蛋白的磷酸化。在一些实施例中,pcbp1是本文公开的突变体pcbp1_1或pcbp1_2。在一些实施例中,pcbp1减少细胞增殖或迁移。在一些实施例中,pcbp1减少细胞活力。在一些实施例中,pcbp1增加细胞死亡。在一些实施例中,pcbp1影响免疫细胞的生长和/或增殖。在一些实施例中,pcbp1治疗炎症。在一些实施例中,炎症与癌症相关联。在一些实施例中,pcbp1治疗癌症。在一些实施例中,pcbp1通过改变与肿瘤发生或转移相关联的癌症生物标志物的表达和/或翻译来治疗癌症。在一些实施例中,pcbp1减少与肿瘤发生或转移相关联的癌症生物标志物的表达和/或翻译。在一些实施例中,癌症生物标志物包含但不限于prl-3、cd44变体、e-钙粘蛋白、stat-3和波形蛋白。在一些实施例中,与转移相关联的癌症生物标志物是prl-3。在一些实施例中,pcbp1是抑制prl-3的mrna表达的过表达的野生型pcbp1或突变的pcbp1。在一些实施例中,pcbp1是抑制prl-3的蛋白表达的过表达的野生型pcbp1或突变的pcbp1。在一些实施例中,pcbp1减少经过遗传修饰的(例如,经过转染的或经过转导的)细胞中的细胞迁移。在一些实施例中,所述细胞迁移是转移。在一些实施例中,突变pcbp1没有或减少了磷酸化。在一些实施例中,突变pcbp1没有或减少了pak磷酸化。在一些实施例中,所述突变pcbp1抑制或防止磷酸化pcbp1产生。在一些实施例中,pcbp1是过表达的野生型pcbp1。在一些实施例中,细胞用野生型pcbp1的一个或多个拷贝转导。在一些实施例中,pcbp1是突变体。在一些实施例中,突变pcbp1是单突变体。在一些实施例中,突变pcbp1是双突变体。在一些实施例中,突变pcbp1是三突变体。在一些实施例中,突变pcbp1多肽包括s223l突变、t60a突变和/或t127a突变或其组合。在一些实施例中,单pcbp1突变多肽是s223l突变体(在本文中被称为mpcbp1_1)。在一些实施例中,双pcbp1突变多肽是t60a和t127a突变体(在本文中被称为mpcbp1_2)。在一些实施例中,pcbp1是核酸。在一些实施例中,核酸是dna。在一些实施例中,核酸是rna。在一些实施例中,核酸是mrna。在一些实施例中,核酸是cdna。在一些实施例中,pcbp1含有seqidno:1的核酸序列或其突变体。在一些实施例中,pcbp1是seqidno:1的全长核酸序列或其突变体。在一些实施例中,pcbp1是seqidno:1的核酸序列的片段或其突变体。在一些实施例中,pcbp1是seqidno:1的核酸序列的变体或其突变体。在一些实施例中,突变pcbp1核酸包括c668t突变、a178g突变和/或a379g突变或其组合。在一些实施例中,单pcbp1突变核酸是c668g突变体(在本文中被称为mpcbp1_1)。在一些实施例中,双pcbp1突变核酸是a178g和a379g突变体(在本文中被称为mpcbp1_2)。不受理论束缚,已示出pcbp1内的kh结构域中的每个kh结构域与不同蛋白质的mrna结合,并且使用一个或多个kh结构域可以选择性地抑制给定蛋白质的翻译。在一些实施例中,pcbp1核酸对所有三个k同源性(kh)结构域进行编码。在一些实施例中,pcpb1核酸对两个kh结构域进行编码。在一些实施例中,pcpb1核酸对一个kh结构域进行编码。进一步地,核定位信号的突变可以改变pcbp1易位到细胞核中的能力,并且因此影响后来的基因表达。在一些实施例中,pcbp1含有一个或两个核定位信号的突变。在一些实施例中,一个或两个核定位信号的变化抑制pcbp1易位到细胞核中的能力。磷酸化也在pcbp1的活性中起作用(例如,未磷酸化的pcbp1可能缺乏活性或展现出更高的活性)。在一些实施例中,pcbp1核苷酸序列含有影响pcbp1多肽被磷酸化的能力的一种或多种突变。在一些实施例中,一种或多种pcbp1核苷酸序列突变防止pcbp1多肽磷酸化。在一些实施例中,未磷酸化的pcbp1或未完全磷酸化的pcbp1多肽在野生型水平没有活性。在一些实施例中,pcbp1多肽由多顺反子mrna转录物表达。在一些实施例中,pcbp1多肽由双顺反子mrna转录物表达。在一些实施例中,pcbp1多肽被表达成融合蛋白。在一些实施例中,相对于野生型pcbp1(seqidno:1),pcbp1核苷酸序列含有一种或多种点突变。在一些实施例中,pcpb1核苷酸序列含有影响磷酸化的一种或多种点突变。在一些实施例中,pcbp1点突变增加磷酸化。在一些实施例中,pcbp1点突变减少磷酸化。在一些实施例中,pcbp1核苷酸序列含有可以影响核膜易位的一种或多种突变。在一些实施例中,pcbp1核苷酸序列含有表1中公开的一种或多种点突变。在一些实施例中,点突变选自包含但不限于以下的群组:g13a、g128c、a178g、t299c、t299a、g326a、a379g、g527a、c652t、c688t、g676a、g700a、g781t、t808g、g814t、a871g、c947t、g1033c、c1034t、g1048c和/或a127g或其组合。在一些实施例中,增加磷酸化的点突变选自包含但不限于以下的群组:g13a、a178g、t299c、t299a、g326a、a379g、g527a、c652t、g781t、g814t、c947t、g1033c、c1034t、g1048c和/或g1067t或其组合。在一些实施例中,减少磷酸化的点突变选自包含但不限于以下的群组:c688t、a127g或g128c、a178g和/或a379g或其组合。在一些实施例中,点突变是c668t、a178g和/或a379g或其组合。表1a-brown,a(2016);b-qingchangmeng等人。在一些实施例中,本公开提供了pcbp1(seqidno:1)的模拟物、类似物、衍生物、变体或突变体。在一些实施例中,与天然pcbp1的核酸序列相比,模拟物、类似物、衍生物、变体或突变体含有一个或多个核酸取代。在一些实施例中,1到20个核酸被取代。在一些实施例中,与天然pcbp1(例如,seqidno:1)的核酸序列相比,模拟物、类似物、衍生物、变体或突变体含有约1个、约2个、约3个、约4个、约5个、约6个、约7个、约8个、约9个或约10个核酸取代。在一些实施例中,与天然pcbp1(例如,seqidno:1)的核酸序列相比,模拟物、类似物、衍生物、变体或突变体含有一个或多个核酸缺失。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:3(mpcbp1_1(c668t))。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:5(mpcbp1_2(a178g和a379g)。在一些实施例中,与天然pcbp1(例如,seqidno:1)的核酸序列相比,缺失1到20个核酸残基。在一些实施例中,与天然pcbp1(例如,seqidno:1)的核酸序列相比,模拟物、类似物、衍生物、变体或突变体具有约1个、约2个、约3个、约4个、约5个、约6个、约7个、约8个、约9个或约10个核酸残基缺失。在一些实施例中,与天然pcbp1(例如,seqidno:1)的核酸序列相比,在任一端缺失一到十个核酸残基。在一些实施例中,与天然pcbp1的核酸序列相比,从两端缺失一到十个核酸残基。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的核酸序列与天然pcbp1的核酸序列至少约70%相同。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的核酸序列与天然pcbp1(例如,seqidno:1)的核酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同。可以使用比对程序embossneedle计算一致性百分比。在一些实施例中,pcbp1是多肽。在一些实施例中,pcbp1含有seqidno:2的氨基酸序列。在一些实施例中,pcbp1是seqidno:2的全长氨基酸序列。在一些实施例中,pcbp1是seqidno:2的氨基酸序列的片段。在一些实施例中,pcb1是seqidno:2的氨基酸序列的变体。在一些实施例中,pcbp1变体包含seqidno:4(mpcbp1_1(s223l))的氨基酸序列。在一些实施例中,pcbp1变体包含seqidno:6(mpcbp1_2,t60a和t127a)的氨基酸序列。在一些实施例中,pcbp1是seqidno:2的氨基酸序列的功能片段或变体。在一些实施例中,pcbp1多肽含有所有三个k同源性(kh)结构域。在一些实施例中,pcpb1多肽含有两个kh结构域。在一些实施例中,pcpb1多肽含有一个kh结构域。在一些实施例中,pcbp1多肽含有一个突变的k同源性(kh)结构域。在一些实施例中,pcbp1多肽含有两个突变的k同源性(kh)结构域。在一些实施例中,pcbp1多肽含有三个突变的k同源性(kh)结构域。在一些实施例中,一个或多个kh结构域的突变影响rna结合。在一些实施例中,相对于野生型pcbp1(seqidno:2),pcbp1多肽序列含有氨基酸突变。在一些实施例中,pcpb1多肽序列含有影响磷酸化的氨基酸突变。在一些实施例中,氨基酸突变选自包含但不限于以下的群组:v5m、s43a、t60a、l100p、l100q、c109y、a127g、g128c、t237a、g176e、p218s、g226r、d234n、d261y、y270d、a272s、i291v、a316v、a345p、a345v、e350q、s356i或其组合。在一些实施例中,增加磷酸化的突变选自包含但不限于以下的群组:v5m、l100p、l100q、c109y、g176e、d261y、a272s、a316v、a345p、a345v和/或e350q或其组合。在一些实施例中,减少磷酸化的突变选自包含但不限于以下的群组:s43a、t60a、t127a和/或s223l,或其组合。在一些实施例中,氨基酸突变是t60a、s223l、s43a和/或t127a。在一些实施例中,本公开提供了pcbp1(seqidno:2)的模拟物、类似物、衍生物、变体或突变体。在一些实施例中,与天然pcbp1的氨基酸序列相比,模拟物、类似物、衍生物、变体或突变体含有一个或多个氨基酸取代。在一些实施例中,多于20个氨基酸被取代。在一些实施例中,1到20个氨基酸被取代。在一些实施例中,与天然pcbp1(seqidno:2)的氨基酸序列相比,模拟物、类似物、衍生物、变体或突变体含有约1个、约2个、约3个、约4个、约5个、约6个、约7个、约8个、约9个或约10个氨基酸取代或更多个。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:4。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:6。在一些实施例中,与天然治疗肽剂的氨基酸序列相比,模拟物、类似物、衍生物、变体或突变体含有一个或多个缺失。在一些实施例中,缺失多于20个氨基酸。在一些实施例中,与天然蛋白剂的氨基酸序列相比,缺失1到20个氨基酸。在一些实施例中,与天然pcbp1(seqidno:2)的氨基酸序列相比,模拟物、类似物、衍生物、变体或突变体具有约1个、约2个、约3个、约4个、约5个、约6个、约7个、约8个、约9个或约10个氨基酸缺失或更多个。在一些实施例中,与天然pcbp1(seqidno:2)的氨基酸序列相比,在任一端缺失一到十个氨基酸。在一些实施例中,与天然pcbp1(seqidno:2)的氨基酸序列相比,从两端缺失一到十个氨基酸。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的氨基酸序列至少约70%相同。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同,并且保留了天然pcbp1的全部或大部分生物活性。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同,并且具有与天然pcbp1相比降低或改变的活性。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的一个或多个结构域的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的一个或多个结构域的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同,并且保留了天然pcbp1的全部或大部分生物活性。在一些实施例中,模拟物、类似物、衍生物、变体或突变体的氨基酸序列与天然pcbp1(seqidno:2)的一个或多个结构域的氨基酸序列约70%、约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%相同,并且具有与天然pcbp1相比降低或改变的活性。可以使用比对程序embossneedle计算一致性百分比。以下默认参数可以用于成对比对:蛋白质权重矩阵=blosum62;空位开放=10;空位延伸=0.1。载体和质粒高效地将治疗基因递送到靶组织或靶细胞是成功进行基因治疗的最重要障碍。由于裸dna在体内被吞噬免疫细胞或细胞外核酸酶快速清除或降解,因此可能需要保护转基因的手段。此外,由于自发的dna摄取效率低下,因此还需要用于实现组织或细胞进入的载体。因此,dna通常与某种类型的基因递送载体(通常称为载体)组合,以保护和介导感兴趣基因的有效组织或细胞进入。基因递送系统可以分为非生物的(例如,将质粒dna引入到哺乳动物细胞的化学和物理方法)或生物的(例如,病毒和细菌)。非病毒基因传递系统通常涉及质粒dna上携带的转移基因。所采用的质粒通常不会在哺乳动物细胞中复制。最常见的是使用重组病毒或裸dna或dna复合物。例如,可以在实验室中对病毒进行修饰,以提供将经过矫正的治疗性dna携带到细胞中的载体,在所述细胞中,可以将所述dna整合到基因组中以改变异常的基因表达并矫正遗传疾病。可替代地,载体可以保持在染色体外并瞬时表达。在一些方面,本公开提供了使用病毒载体的基因治疗的方法。可以在基因治疗中使用的病毒包含但不限于慢病毒、逆转录病毒、腺病毒、腺相关病毒、有复制能力的载体、牛痘病毒和单纯疱疹病毒。可以在基因治疗中使用的病毒载体包含但不限于慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体(aav)、有复制能力的载体、牛痘病毒载体和单纯疱疹病毒载体。在一些方面,本公开提供了使用非病毒载体的基因治疗方法。在一些方面,本公开提供了使用细菌载体的基因治疗方法。在一些实施例中,基因治疗方法涉及注射裸核酸(例如,dna或rna)。这可以使用本领域已知的任何合适的手段来执行。在一些方面,本公开提供了使用细菌递送系统的基因治疗方法。在一些实施例中,细菌细胞是活的、经过减毒的或经过杀灭的。在一些实施例中,细菌递送系统利用细胞粘附到哺乳动物细胞或分泌系统的能力将核酸和/或蛋白质递送到靶哺乳动物细胞。在一些实施例中,细菌递送系统选自但不限于伤寒沙门氏菌(salmonellatyphi)、双歧杆菌属物种(bifidobacteriumspp.)、猪霍乱沙门氏菌(salmonellacholeraesuis)、霍乱弧菌(vibriocholera)、单核细胞增生李斯特菌(listeriamonocytogenes)、大肠杆菌(escherichiacoli)、酿脓链球菌(streptococcuspyogenes)和粘质沙雷氏菌(serratiamarcescens)。在一些方面,本公开提供了使用非病毒且非细菌载体的基因治疗方法。在一些实施例中,非病毒且非细菌载体是真核载体。在一些实施例中,真核载体包含转座子系统、crispr系统、锌指核酸酶系统或talen(转录激活因子样效应核酸酶)。在一些实施例中,转座子系统选自但不限于睡美人(sleepingbeauty)或piggybac或转座子系统。在一些实施例中,可以使用其它核酸递送方法,如富精氨酸肽或声孔效应。在一些方面,本公开提供了使用纳米颗粒的基因治疗方法。在一些实施例中,纳米颗粒是基于脂质的纳米颗粒。在一些实施例中,基于脂质的纳米颗粒是固体脂质纳米颗粒(sln)。在一些实施例中,基于脂质的纳米颗粒是非结构化脂质载剂(nlc)。在一些实施例中,纳米颗粒是基于聚合物的纳米颗粒。在一些实施例中,基于聚合物的纳米颗粒是纳米球或纳米囊。基于质粒dna的载体通常在基因治疗中使用,并且可以容纳大的dna区段,并允许操纵影响基因转移和表达的各种调节元件。最基本的是,表达质粒含有表达盒和主链。表达盒是含有感兴趣的一个或多个基因以及在靶细胞中表达所需的任何调节序列的转录单位。主链可以含有可选择标志物(例如,抗生素抗性基因或营养缺陷型选择基因)和在细菌中产生质粒所需的复制起点。在本文公开的方法中可以使用任何合适的质粒。在一些实施例中,质粒是慢病毒载体。在一些实施例中,质粒是腺相关病毒(aav)质粒。在一些实施例中,代表性质粒在图1a-b中公开。任何合适的启动子都可以用于驱动表达盒中的基因的表达。在一些实施例中,质粒含有逆转录病毒启动子。在一些实施例中,质粒含有病毒启动子。在一些实施例中,质粒含有哺乳动物启动子。在一些实施例中,哺乳动物启动子是人类启动子。在一些实施例中,启动子具有组织或细胞特异性。在一些实施例中,组织特异性启动子选自人转导性α-亚单位启动子、gant2、vmd2、人irbp、k14、irs2和胶质纤维酸性蛋白(gfap)启动子。所选启动子可以用作嵌合启动子(例如,与光感受器间维生素a类结合蛋白(irbp)启动子一起)。在一些实施例中,组织特异性或细胞特异性启动子对胰腺细胞、胰腺β细胞、皮肤细胞、角质细胞、光感受器细胞、上皮细胞、内皮细胞和/或癌细胞(例如,乳腺癌细胞、前列腺癌细胞、白血病细胞、淋巴瘤细胞、神经癌细胞、胶质母细胞瘤等)具有特异性。在一些实施例中,启动子对视网膜或眼组织或细胞具有特异性。在一些实施例中,启动子对造血细胞具有特异性。在一些实施例中,启动子对肝组织或细胞具有特异性。在一些实施例中,启动子对肺组织或细胞具有特异性。在一些实施例中,启动子对肌肉组织或细胞具有特异性。在一些实施例中,启动子对hiv感染的细胞具有特异性。在一些实施例中,启动子是诱导型启动子。在一些实施例中,启动子由任何合适的组合物或刺激物诱导,所述合适的组合物或刺激物包含但不限于多西环素、四环素、iptg、蜕皮激素或雷帕霉素。在一些实施例中,诱导型启动子选自本领域技术人员已知的任何启动子,包含但不限于tre3g、四环素、lac、蜕皮激素和雷帕霉素启动子。在一些实施例中,启动子是组成型的。在一些实施例中,启动子是合成启动子或含有增强子元件。在一些实施例中,启动子是杂合启动子。在一些实施例中,杂合启动子含有基因的调节区。在一些实施例中,启动子选自包含但不限于以下的群组:ef1a、cag、sv40、cmv、rsv、oct4、rex1、nanog、gant2、vmd2、hirbp、tet启动子、caat盒、gc盒、gt-1基序、i盒、富at序列、rbcs1、tre3g、gal1、lap267、雷帕霉素、cd11a、cd11b、cd18、β-珠蛋白启动子/lcr、免疫球蛋白启动子、pepck启动子、白蛋白启动子、haat、spc、sp-a、mck、vlc1、hiv-ltr、tat/rev响应元件、tat诱导元件以及fmr1。在一些实施例中,质粒含有要通过基因治疗引入的所有基因。在一些实施例中,质粒含有pcbp1。在一些实施例中,pcbp1是突变pcbp1。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:3。在一些实施例中,模拟物、类似物、衍生物、变体或突变体包括seqidno:5。在一些实施例中,pcbp1模拟物、类似物、衍生物、变体或突变体对包括seqidno:4或seqidno:6的氨基酸序列的多肽进行编码。在一些实施例中,引入本公开的载体增加了细胞中的基因拷贝数。在一些实施例中,引入本公开的载体增加了细胞中的基因表达。在一些实施例中,引入本公开的载体增加了细胞中的多肽表达。在一些实施例中,基因是pcbp1或其突变体。疾病和病症可以对任何合适的细胞或组织类型采用本文公开的组合物和方法。在一些实施例中,本文公开的方法在体外执行。在一些实施例中,本文公开的方法离体执行。在一些实施例中,本文公开的方法对分离的细胞执行。在一些实施例中,本文公开的方法对细胞培养物执行。在一些实施例中,分离的细胞或细胞培养细胞从受试者中取出并且然后在转染或转导后植入。在一些实施例中,细胞是癌细胞。在一些实施例中,在体内采用本文公开的组合物和方法。在一些实施例中,原位采用本文公开的方法。在一些实施例中,本文公开的方法用于减少身体任何合适部位的细胞迁移,包含但不限于:眼、视网膜、心脏、血液、白细胞、红细胞、血小板、玻璃体液、巩膜、视网膜、虹膜、角膜、骨骼肌、心肌、平滑肌、软骨、腱、骨、表皮、器官、肝、心脏、肾、肺、胃、胃肠道、结肠、膀胱、卵巢、睾丸、胰腺、骨髓、脑、神经元和/或腺。本文公开的组合物和方法可以用于治疗、预防、改善或延迟任何合适的疾病。例如,可以被治疗、预防、改善或延迟的疾病具有细胞迁移的特征。在一些情况下,本文公开的组合物和方法可以用于治疗癌症或不受控制的细胞生长。在一些实施例中,本文公开的组合物和方法用于预防、抑制、改善或减少转移或不受控制的细胞迁移。在一些实施例中,癌症是实体癌(solidcancer)。在一些实施例中,癌症是非实体癌。在一些实施例中,本公开涉及包含但不限于以下的癌症:急性淋巴细胞白血病(all)、急性髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、肛门癌、阑尾癌、星形细胞瘤(例如,儿童小脑或大脑星形细胞瘤)、基底细胞癌、胆管癌、膀胱癌、骨肿瘤(例如,骨肉瘤、恶性纤维组织细胞瘤)、脑干神经胶质瘤、脑癌、脑肿瘤(例如,胶质母细胞瘤、小脑星形细胞瘤、脑星形细胞瘤/恶性神经胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤、视觉通路和下丘脑神经胶质瘤)、乳腺癌、支气管腺瘤/类癌、伯基特氏淋巴瘤(burkitt'slymphoma)、类癌肿瘤、中枢神经系统淋巴瘤、小脑星形细胞瘤、宫颈癌、慢性淋巴细胞白血病(cll)、慢性骨髓性白血病(cml)、慢性骨髓增殖性病症、结肠癌、皮肤t细胞淋巴瘤、促纤维增生性小圆细胞肿瘤、子宫内膜癌、室管膜瘤、食道癌、尤因氏肉瘤(ewing'ssarcoma)、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌、胆囊癌、胃癌(gastriccancer)(胃癌(stomachcancer))、胃肠道间质瘤(gist)、生殖细胞瘤(例如,颅外、性腺外、卵巢生殖细胞瘤)、妊娠滋养细胞瘤、神经胶质瘤(例如,脑干、大脑星形细胞瘤、视觉通路和下丘脑神经胶质瘤)、胃类癌、头颈癌、心癌、肝细胞(肝)癌、下咽癌、下丘脑和视觉通路神经胶质瘤、眼内黑色素瘤、胰岛细胞癌(内分泌胰腺癌)、肾癌(肾细胞癌)、喉癌、白血病(例如,急性淋巴细胞白血病、急性骨髓性白血病、慢性淋巴细胞白血病、慢性髓性白血病、毛细胞白血病)、唇和口腔癌、脂肪肉瘤、肝癌、肺癌(例如,非小细胞肺癌、小细胞肺癌)、淋巴瘤(例如,aids相关淋巴瘤淋巴瘤、伯基特氏淋巴瘤、皮肤t细胞霍奇金(hodgkin)淋巴瘤、非霍奇金淋巴瘤、原发性中枢神经系统淋巴瘤)、髓母细胞瘤、黑色素瘤、默克尔细胞癌(merkelcellcarcinoma)、间皮瘤、转移性鳞状头颈癌、口癌、多发性内分泌肿瘤综合征、多发性骨髓瘤、蕈样肉芽肿、骨髓增生异常综合征、骨髓增生异常/骨髓增殖性疾病、骨髓性白血病、髓性白血病、髓性白血病、骨髓增殖性病症、慢性鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、骨肉瘤、卵巢癌、胰腺癌、副鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤和/或生殖细胞瘤、松果体母细胞瘤和幕上原始神经外胚层肿瘤、垂体腺瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌(肾癌)、肾盂和输尿管癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤(例如,尤因氏家族肉瘤、卡波西肉瘤(kaposisarcoma)、软组织肉瘤、子宫肉瘤)、塞扎里综合征(sézarysyndrome)、皮肤癌(例如,非黑色素瘤、黑色素瘤、默克尔细胞癌)、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、鳞状颈癌、胃癌、幕上原始神经外胚层肿瘤、t细胞淋巴瘤、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、滋养细胞肿瘤、输尿管和肾盂癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、视觉通路和下丘脑神经胶质瘤、外阴癌、瓦尔登斯特伦巨球蛋白血症和威尔姆氏瘤(wilmstumor)。在一些实施例中,用本公开的组合物转染或转导的细胞是从这些癌症类型中的一种或多种获得的。施用本公开的组合物可以通过任何合适的手段施用。在一些实施例中,核酸施用途径为经皮、注射、肌内、皮下、口服、经鼻、阴道内、直肠、经粘膜、经肠、胃肠外、局部、硬膜外、大脑内、脑室内、动脉内、关节内、皮内、病变内、眼内、骨内、腹膜内、鞘内、子宫内、静脉内、膀胱内输注或玻璃体内。在一些实施例中,使用本文公开的方法用组合物转染或转导的组合物或细胞被施用于患者。在一些实施例中,用使用本文公开的方法产生的组合物转染或转导的组合物或细胞被施用于患者,以治疗、预防、改善或延迟疾病或病症的发作。在一些实施例中,施用本文公开的组合物预防、减少、改善或延迟受试者的细胞迁移。在一些实施例中,施用本文公开的组合物预防、减少、改善或延迟受试者的细胞迁移并治疗、预防、改善或延迟疾病或病症的发作。在一些实施例中,疾病或病症是癌症或转移癌。在一些实施例中,施用本文公开的组合物减少受试者的肿瘤质量/负荷。在一些实施例中,本文公开的载体、核酸或细胞向患者施用一次。在一些实施例中,本文公开的载体、核酸或细胞向患者施用约2次、约3次、约4次、约5次、约6次、约7次、约8次、约9次、约10次、约20次、约40次或更多次。施用本文公开的载体、核酸或细胞,直到疾病或病症症状改善。在一些实施例中,与未处理的患者或处理前的同一患者相比,施用本文公开的载体或核酸预防、改善、减少或延迟经过处理的患者的细胞迁移或增殖。在一些实施例中,在第1天与第10年之间,经过处理的患者的细胞迁移或增殖被阻止、改善、减少或延迟。在一些实施例中,与未处理的患者或处理前的同一患者的细胞迁移或增殖相比,施用本文公开的质粒或载体在以下时间预防、改善、减少或延迟细胞迁移或增殖:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与未处理的患者或处理前的同一患者的细胞迁移或增殖相比,施用本文公开的核酸或载体防止、改善、减少或延迟细胞迁移或增殖,持续约1天、约1周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与用其它细胞迁移或增殖抑制方法处理的对照组或患者或体外细胞相比,细胞迁移或增殖减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它细胞迁移或增殖抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使细胞迁移或增殖减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它细胞迁移或增殖抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞使细胞迁移或增殖减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与未处理的患者或处理前的同一患者相比,施用本文公开的载体或核酸减少经过处理的患者的肿瘤质量或负荷。在一些实施例中,在第1天与第10年之间,经过处理的患者的肿瘤质量/负荷减少。在一些实施例中,与未处理的患者或处理前的同一患者的肿瘤质量或负荷相比,施用本文公开的质粒或载体在以下时间减少肿瘤质量或负荷:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与未处理的患者或处理前的同一患者的肿瘤质量或负荷相比,施用本文公开的核酸或载体减少肿瘤质量/负荷,持续约1天、约1周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与用其它肿瘤质量或负荷减少方法处理的对照组或患者或体外细胞相比,肿瘤质量或负荷减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它肿瘤质量或负荷减少方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使肿瘤质量或负荷减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它肿瘤质量或负荷减少方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞使肿瘤质量或负荷减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,本文公开的载体、核酸或细胞降低了经过处理的体外细胞中的癌症生物标志物表达。在一些实施例中,施用本文公开的载体、核酸或细胞降低了经过处理的患者的癌症生物标志物表达。在一些实施例中,施用本文公开的载体、核酸或细胞在第1天与第10年之间降低了经过处理的患者或体外细胞中的癌症生物标志物表达。在一些实施例中,与用其它癌症生物标志物表达抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞在以下时间降低癌症生物标志物表达:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与用其它癌症生物标志物表达抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的质粒、载体或细胞降低癌症生物标志物的表达,持续约1天、2天、3天、4天、5天、6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与用其它癌症生物标志物表达抑制方法处理的对照组或患者或体外细胞相比,癌症生物标志物表达降低约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它癌症生物标志物表达抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使癌症生物标志物表达降低约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它癌症生物标志物表达抑制方法处理的对照组或患者或体外细胞相比,施用本文公开的核酸、载体或细胞使癌症生物标志物表达降低约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,施用本文公开的载体、核酸或细胞减少体外或离体器官或组织中的转移。在一些实施例中,施用本文公开的载体、核酸或细胞减少组织、器官或经过处理的患者中的转移。在一些实施例中,施用本文公开的载体、核酸或细胞在第1天与第10年之间减少经过处理的患者或体外或离体器官或组织中的转移。在一些实施例中,与用其它转移抑制方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞在以下时间减少转移:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与用其它转移抑制方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞减少转移或肿瘤发生,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与用其它转移抑制方法处理的对照组或患者相比,转移减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它转移抑制方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使转移减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它转移抑制方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞使转移减少约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,施用本文公开的载体、核酸或细胞增加组织、器官或经过处理的患者中的细胞死亡。在一些实施例中,施用本文公开的载体、核酸或细胞在第1天与第10年之间增加经过处理的患者或体外或离体器官或组织中的细胞死亡。在一些实施例中,与用其它细胞杀伤方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞在以下时间减少转移:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与用其它细胞杀伤方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞增加细胞死亡,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与用其它细胞杀伤方法处理的对照组或患者相比,细胞死亡增加约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它细胞杀伤方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使细胞死亡增加约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与用其它细胞杀伤方法处理的对照组或患者或体外或离体器官或组织相比,施用本文公开的核酸、载体或细胞使细胞死亡增加约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与未处理的患者或处理前的同一患者相比,施用本文公开的核酸、载体或细胞减轻经过处理的患者的疾病或病症症状。在一些实施例中,在第1天与第10年之间测量经过处理的患者的疾病或病症症状。在一些实施例中,与未处理的患者或处理前的同一患者的疾病或病症症状相比,施用本文公开的核酸、载体或细胞以下时间减轻疾病或病症症状:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与未处理的患者或处理前的同一患者的疾病或病症症状相比,施用本文公开的核酸、载体或细胞减轻疾病或病症症状,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与未处理的患者或处理前的同一患者的疾病或病症症状相比,疾病或病症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与未处理的患者或处理前的同一患者的疾病或病症症状相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使疾病或病症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与未处理的患者或处理前的同一患者的疾病或病症症状相比,施用本文公开的核酸、载体或细胞使疾病或病症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与未处理的患者或处理前的同一患者相比,施用本文公开的载体或核酸减轻了经过处理的患者的癌症症状。在一些实施例中,在第1天与第10年之间测量经过处理的患者的癌症症状。在一些实施例中,与未处理的患者或处理前的同一患者的癌症症状相比,施用本文公开的核酸、载体或细胞在以下时间减轻癌症症状:约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年。在一些实施例中,与未处理的患者或处理前的同一患者的癌症症状相比,施用本文公开的核酸、载体或细胞减轻癌症症状,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,与未处理的患者或处理前的同一患者的癌症症状相比,癌症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与未处理的患者或处理前的同一患者的癌症症状相比,施用本文公开的核酸、载体或细胞在约第1天、约第2天、约第3天、约第4天、约第5天、约第6天、约第1周、约第2周、约第3周、约第4周、约第5周、约第6周、约第7周、约第8周、约第9周、约第10周、约第20周、约第30周、约第40周、约第50周、约第60周、约第70周、约第80周、约第90周、约第100周、约第1年、约第2年或约第3年使癌症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在一些实施例中,与未处理的患者或处理前的同一患者的癌症症状相比,施用本文公开的核酸、载体或细胞使癌症症状减轻约1%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%,持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年或约10年或更久。在一些实施例中,本公开提供了精确追踪用本公开的组合物转染的细胞的方法。在一些实施例中,对这些细胞进行跟踪以确定细胞的行为。在一些实施例中,对这些细胞进行跟踪以确定其迁移。在一些实施例中,对这些细胞进行跟踪以确定其转移(或缺乏转移)。在一些实施例中,对这些细胞进行跟踪以确定其对在体外或体内施用的任何药物的反应。在一些实施例中,细胞还暴露于治疗剂。在一些实施例中,治疗剂是化学治疗剂。在一些实施例中,细胞在体外暴露于治疗剂。在一些实施例中,细胞在体内暴露于治疗剂。共施用在一些实施例中,对患者进行另外的疗法。在一些实施例中,用本公开的组合物对患者进行处理,作为抗癌疗法的一部分。在一些实施例中,抗癌疗法选自但不限于放射疗法、化学疗法、免疫疗法、激素疗法、干细胞移植和car-t疗法。抗癌疗法可以在施用本公开的组合物之前、同时或之后实施。试剂盒本公开还提供了用于减少、预防、改善或延迟细胞迁移或转移的试剂盒。在一些实施例中,试剂盒包含本公开的载体或核酸。试剂盒可以进一步包含指示所描述的试剂的使用的标签或印刷的说明书。试剂盒可以进一步包含要测试的处理。试剂盒应用于体外和体内细胞迁移或转移预防、减少、改善或延迟。除非另外定义,否则本文中所有技术和科学术语均具有与本公开所属领域中的普通技术人员通常所理解的含义相同的含义。尽管在本公开的实践或测试中可以使用类似于或等同于本文所描述的那些方法和材料的任何方法和材料,但是本文描述了优选的方法和材料。如本文所使用的,“抗癌基因”是指阻止、延迟、抑制或以其它方式改变癌基因的表达或活性的任何基因。在一些实施例中,抗癌基因是肿瘤抑制基因。在一些实施例中,抗癌基因减少了与转移相关联的癌症生物标志物的表达。应当理解,为了方便起见,贯穿本申请使用了如“一个(a)”、“一种(an)”和“所述(the)”等单数形式,然而,除非上下文或明确陈述另有指示,否则单数形式旨在包含复数形式。所有数值范围应当被理解为包含数值范围内的每一个数值点并且应当被解释为单独列举每一个数值点。针对相同组分或性质的所有范围的端点是包含性的并且旨在可独立组合。如本文所使用的,词语“包含(include)”和其变体旨在是非限制性的,使得列表中项的列举不是用于排除在本发明技术的材料、组合物、装置和方法中也可能有用的其它类似项。类似地,术语“可以(can)”和“可以(may)”以及其变体旨在是非限制性的,使得实施例可以或可以包括某些要素或特征的叙述不排除本发明技术的不包含这些要素或特征的其它实施例。尽管开放式术语“包括(comprising)”作为如包含(including)、含有(containing)或具有(having)等术语的同义词在本文中用于描述和要求保护本公开,但是本发明技术或其实施例可以可替代地使用如“由所述成分组成”或“基本上由所述成分组成”等更具限制性的术语来描述。如在本文中用于指数值数量的术语“约(about)”包含所提及数字指示的“精确地”加或减最多10%。当术语“约”用于指值的范围时,术语“约”指所述范围的最小值和最大值(例如,“约1-50μm”意指“约1μm到约50μm”)。如在本文中用于描述组合物的两种或更两种组分之间的空间关系的术语“密切相关联的”是指例如在混合物、涂层和基质中密切混合的组分。术语“转导”和“转染”在本文中可互换使用并且指将遗传物质引入到细胞中。本公开设想了任何合适的遗传修饰手段。本公开通过以下非限制性实例进一步说明。实例实例1-表达pcbp1突变多肽的载体的构建研究表明,转移癌(包含卵巢癌、胃癌)中prl-3的mrna表达升高,并且prl-3的过表达与肝癌预后呈负相关(bardelli等人,2003;polato等人,2005;peng等人,2004)。已知pcbp1调节prl-3表达,其中pcbp1表达与prl-3表达之间成反比关系,这表明pcbp1可以抑制prl-3mrna翻译。prl-3的下调伴随着akt(pser473)磷酸化活性形式的下调(wang等人,2010)。例如,示出akt-2(pser474)磷酸化增加的癌细胞还示出pcbp1表达显著降低(brown等人,2016年)。如图1a和1b所示,分别产生了含有pcbp1基因的慢病毒基因治疗载体(lvv)或/和aav系统。此载体系统含有人延伸因子-1α(ef1a)启动子和从mrna分子内部开始蛋白质翻译的ires元件。因此产生了双顺反子mrna,其中ires基序可以从单个pcbpc-ires-gfpmrna开始对第二基因的独立且单独的翻译。基于下表2中的策略构建了被设计成减少pak1对蛋白质的磷酸化的几个pcbp1突变体。将pcbp1突变核苷酸序列克隆到图1a-b所示的载体中,以产生载体a(mpcbp1_1,s223l)和载体b(mpcbp1_2,t60a和t127a)。每个pcbp1突变体中的突变阻止pak1对pcbp1磷酸化。由一个或多个合适的启动子驱动不同基因的启动。在pak1在氨基酸60和127处对pcbp1进行磷酸化时,这些位点处的突变阻止pak1对pcbp1磷酸化。表2.突变pcbp1的设计实例2-在高于内源野生型的水平下表达pcbp1突变体为了测试pcbp1s223l以及pcbp1t60a和t127a突变是否影响转录水平,通过qrt-pcr测定了黑色素瘤细胞中的pcbp1表达。图2示出了对各组之间的倍数变化(ddct)的分析。gfp表达与野生型pcbp1表达(wpcbp1_0)的比较表明,pcbp1表达水平高了4.012倍。gfp表达与pcbp1s223l(mpcbp1_1)表达的比较表明,pcbp1s223l表达水平高了3.97倍。gfp表达与pcbp1s223l突变体表达的比较表明,pcbp1t60a和t127a(mpcbp1_2)表达高了4.02倍。野生型pcbp1和两种突变形式显示出类似的mrna表达。此测定中使用的管家基因是gapdh。实例3-pcbp1在黑色素瘤细胞中的表达黑色素瘤细胞被分成四组,并且每组用含有以下的载体在体外转染:a)仅gfp;b)野生型pcbp1(wpcbp1_0-ires-gfp);以及3)pcbp1s223l和gfp(mpcbp1_1-ires-gfp);或d)pcbp1t60a和t127a(mpcbp1_2-ires-gfp)。在使用脂质体转染胺试剂盒(lipofectaminekit)(英杰公司(invitrogeninc.))转染含有野生型pcbp1或突变pcbp1的慢病毒载体后24-48小时,观察gfp的表达(图2)。转染率各自为约90%(数据未示出)。gfp表达水平的变化可能是由于不同的载体。不受理论的缚,在载体中,pcbp1在gfp上游。当pcbp1效率为100%时,下游基因(gfp)将示出较低的表达效率(例如,约60%-80%)。由于对照载体仅含有gfp并且不含pcbp1序列,因此gfp表达效率较高。没有证据表明pcbp1和gfp彼此相互作用。关于蛋白质印迹法,简而言之,在pcpb1处理之后,将细胞培养皿放置在冰上,并且用冰冷的pbs洗涤细胞三次。然后将冰冷的裂解缓冲液(含有蛋白酶抑制剂)添加到细胞中。从培养皿上刮下粘附细胞,并且将细胞悬浮液转移到预先冷却的微量离心试管中,将所述预先冷却的微量离心试管在4℃下持续搅拌30分钟并且然后离心。离心后,将试管放置在冰上,将上清液吸取到新试管中,并且丢弃沉淀物。蛋白定量后,通过添加等体积的2xlaemmli样品缓冲液来测定每个细胞裂解物的蛋白浓度。在100℃下将样品在此样品缓冲液中煮沸5分钟。将来自处理组和对照组的等量的蛋白质与分子量标志物一起装载到sds-page凝胶的每个孔中。从细胞裂解物或组织匀浆中测试的蛋白浓度的范围为约20-30μg,或者为约10-100ng纯化蛋白。将凝胶在100v下电泳1-2小时。然后使用转移缓冲液和bio-rad半转移系统(加利福尼亚州伯乐公司(bio-rad,ca))将凝胶上的蛋白质转移到活性硝酸纤维素膜上。使用封闭缓冲液将膜在室温下封闭1小时或在4℃下封闭过夜并且然后在开始抗体染色前用tbst缓冲液洗涤3次(每次洗涤5分钟)。然后将膜与化学发光底物一起温育约5分钟,以按照试剂盒制造商的建议可视化蛋白信号(参见图3和图6)。图3示出了用对不同形式的pcbp1进行编码的基因治疗载体转染的细胞中的prl-3蛋白表达。如图3所示,与仅gfp载体相比,用含有野生型pcbp1的载体转染黑色素瘤细胞减少了prl-3表达。用含有pcbp1突变体中的任一突变体的载体转染细胞进一步减少了prl-3表达,其中双pcbp1t60a和t127a突变体与用单pcbp1s223l突变体转染相比更大程度地减少了prl-3表达。实例4-用突变pcbp1转染减少了黑色素瘤细胞迁移使用细胞迁移测定测试突变的、去磷酸化的pcbp1突变体对细胞迁移的影响。简而言之,在转染后五天观察用仅gfp、野生型pcbp1(wpcbp1_0-ires-gfp)和gfp或pcbp1t60a和t127a(mpcbp1_2-ires-gfp)转染的黑色素瘤细胞。将来自每个处理组或/和对照组的相同数量的细胞接种到24(或6)孔板上以用于使用脂质体转染胺试剂盒(英杰公司)通过对标志蛋白(即,gfp)进行编码的载体来转染。然后通过含有胰蛋白酶(0.1%)的培养液来悬浮用gfp转染的细胞,并用培养基洗涤。然后,将相同数量的细胞数(例如,来自每个单独组的约80,000个细胞)重新放置并均匀分布在oris迁移测定板(oris细胞迁移测定试剂盒)上,其中在96孔板的每个孔中装载体积100μl含有相同数量的细胞数。然后,将含有oristm细胞接种塞(ocs)的培养皿的每个孔在加湿室(37℃,5%co2)中温育5到10小时(取决于细胞系),以允许细胞附着。在对细胞进行计数之前,通过使用oristm塞工具将ocs去除,以产生被称为“圆形检测区(cdz)”的区域,以用于检测迁移到此cdz内部作为新迁移细胞的任何新细胞。然后,使用酶标仪(分子器件有限责任公司(moleculardevices,llc))或/和在荧光显微镜(bd生物科学公司(bdbiosciences))下在每个时间点对在cdz中表达gfp的那些细胞进行计数。通过荧光显微术来可视化和分析细胞的gfp表达。gfp反映了基因在每个转染细胞中的表达,但是gfp的强度可以随着时间的推移而降低强度水平,尽管如结果所示,在5天内没有损失太多荧光强度。在相同的时间(天)点(例如,第0天或第5天)测量每个孔的总细胞显示强度。由于带有gfp的细胞是由对包含gfp的基因进行编码的载体转导,而非通过用荧光染料进行免疫染色进行转导,因此荧光信号不会从底物分离。未显示荧光信号的那些细胞不用本公开的载体转染并且因此在此分析中未进行计数和限制。此细胞迁移测定的结果在图4a-c中展现。在图4b中,白色虚线圆圈是圆形检测区(cdz)。a列是第1天;b列是第5天的细胞迁移孔(其中cdz呈白色虚线);c列是放大的b列cdz。表3示出了细胞迁移测定的定量数据,所述定量数据表明与野生型pcbp1和仅gfp细胞相比,双t60a和t127a突变体展现出在cdz中的净细胞迁移减少。表3-黑色素瘤细胞向cdz的净细胞迁移的计算载体cdz中的净细胞迁移标准(std)gfp1387.071wpcbp1_0607.778mpcbp1_1(s223l)392.828mpcbp1_2(t60a和t127a)276.364图4a-4c示出了调整到每孔细胞百分比的细胞迁移。gfp组(11.076)的(每孔)迁移细胞百分比显著高于野生型pcbp1(wpcbp1_0)以及pcbp1t60a和t127a(mpcbp1_2)的迁移细胞百分比。在这三组中,mpcbp1_2显示出最低的每孔迁移细胞百分比(2.082)。这些值计算如下:在每个时间点,通过酶标仪检测总细胞(作为基本分母)。还对圆形检测区(cdz)的区域中的细胞进行计数,作为每个时间点的迁移细胞(作为分子)。根据如下文所示的公式计算cdz中经过调整的净细胞差异:实例5-用突变pcbp1转染减少了乳腺癌细胞迁移将来自mcf-7细胞系的乳腺癌细胞用含有仅gfp、野生型pcbp1(wpcbp1_0-ires-gfp)和gfp或pcbp1t60a和t127a(mpcbp1_2-ires-gfp)的载体转染,并在转染后观察五天。如上文详细描述地观察这些细胞的迁移。表4示出了不同转染细胞在cdz中的净细胞迁移。图7a-c示出了调整到每孔细胞百分比的细胞迁移。gfp组的(每孔)迁移细胞百分比显著高于野生型pcbp1(wpcbp1_0)以及pcbp1t60a和t127a(mpcbp1_2)的迁移细胞百分比。在这三组中,mpcbp1_2显示出最低的每孔迁移细胞百分比。表4-黑色素瘤细胞向cdz的净细胞迁移的计算载体cdz中的净细胞迁移标准gfp56.54.950wpcbp1_018.54.950mpcbp1_1(s223l)112.828mpcbp1_2(t60a和t127a)51.414实例6-pcbp1突变体用于抑制肿瘤转移的用途用于研究癌症基因治疗的动物模型的设计:实验设计:癌细胞系(即,mcf-7,乳腺癌模型-bc的atcc)在小鼠中是致瘤的并且可以用于研究免疫缺陷动物(即,裸鼠株:来自北卡罗来纳州查尔斯河实验室(charlesriverlab,nc)的balb/c)中的乳腺癌(bc)肿瘤生长。这些细胞将用于开发用于测试治疗功效的体内精确方法。最初,将制备通过具有标记基因(即,对红色荧光蛋白(rfp)进行编码)的载体稳定地转导的可注射癌细胞系。这将允许监测通过荧光生物成像系统或荧光显微镜展示或监测的癌细胞的生长和迁移。癌细胞制备好之后,一周后将癌细胞皮下注射到小鼠体内以产生乳腺癌肿瘤。通过使用此新方法,在如aav-pcbp1m等基因治疗载体的处理后,将在癌细胞转移期间对癌细胞进行精确的追踪和研究。将以bc研究为例如下执行程序:(1)将rfp递送到bc细胞系(mcf-7,atcc)中,如通过使用慢病毒主链将rfp基因整合到细胞基因组中以用于稳定且长期地表达rfp报告基因。在确认成功地将rfp转导到细胞中(通过使用荧光显微镜或facs)之后,将对bc细胞进行选择和注射。(2)将小鼠分成四组(n=6)。在所有组中,在相同的条件下(相同的细胞计数、注射时间)将rfp-bc细胞注射到小鼠的侧腹。每天一次或每周两次评估和记录bc肿瘤大小。实验设计和预期成果将如下表5所描述的:表5:被设计成将bc植入小鼠中的体内实验的实例。含有治疗基因的载体将被直接注射到肿瘤中。处理后3周处死小鼠以用于组织学研究。将提取肿瘤组织以用于rfp、gfp、prl-3、pcbp1和sox2(bc细胞标志物)的免疫组织化学(ihc)测定。将在这些组织上检测rfp和gfp,以确认bc细胞生长和载体递送,如上表所描述的。将提取另外的组织(包含肺、肝、脑和胰腺)以用于致瘤性和转移研究。将在这些组织中对rfp和gfp进行检测,以监测bc是否迁移到这些组织中。还将执行qrt-pcr、wb和ihc。将通过双向凝胶电泳结合质谱技术进行蛋白质组学研究,以比较具有对照物相对于pcbp1突变体转导的小鼠中的蛋白质表达。将使用学生t检验比较实验组之间的差异。将测定统计显著性为p<0.05。(3)可以如以下表6预期对处理后的结果的成果分析:表6:体外实验设计和预期结果实例7-通过在肿瘤细胞中表达pcbp1对胶质母细胞瘤的处理发现胶质母细胞瘤细胞中的prl3mrna水平升高。如图11所示,与正常脑皮质细胞系中的表达相比,在六种不同的胶质母细胞瘤细胞系(u138mg、m059k、m059j、u118mg、u87和ln229)中检测到升高的prl-3表达。细胞系u87和ln229示出prl-3mrna表达的增加最大并且被选择用于进一步的测试。野生型或突变pcbp1的过表达减少了胶质母细胞瘤细胞中的prl3表达如之前所展现的,野生型或突变pcbp1的表达减少了与转移相关联的基因prl-3的表达并抑制了细胞迁移。为了测试pcbp1序列的过表达的影响,在实现ap-pcbp1在胶质母细胞瘤细胞中的表达的胶质母细胞瘤细胞特异性启动子胶质纤维酸性蛋白(gfap)的控制下,用含有本公开的野生型或突变pcbp1序列的raav9表达载体转染了六种不同的胶质母细胞瘤细胞系(参见图12)。图13-16展现了此载体胶在胶质母细胞瘤细胞中的特异性。图13示出了用phgfap-lacz载体处理的ln299胶质母细胞瘤细胞的免疫组织化学分析。图14示出了用phgfap-lacz载体处理的ln299胶质母细胞瘤细胞的免疫组织化学分析。如图13b和14b所示,在两种转染的胶质母细胞瘤细胞系中,由抗β-半乳糖苷酶特异性抗体a11132(赛默飞世尔公司(thermofisher),在1:700的稀释度下)检测由gfap启动子驱动的lacz基因。然而,在肾脏(图15)或眼(图16)细胞中未检测到β-半乳糖苷酶,从而表明此载体将仅在胶质母细胞瘤细胞中表达其运载物。图17中示出了对laczmrna表达水平的比较。将含有1)仅gfp、2)野生型pcbp1、3)mpcbp1_1或4)mpcbp1_2的两微克aav载体转染到ln229和u87胶质母细胞瘤细胞系中,并且使用vybrantmtt试剂盒测试细胞增殖。如图18a-b所示,与未用aav-gfp载体对照物处理相比,野生型pcbp1或任一突变体的过表达显著抑制了胶质母细胞瘤细胞的增殖。进一步地,pcbp1mrna的过表达增加了培养物中死细胞的数量,如图19和20所示。在通过aav-gfp和aav-pcbp1以及突变体转染后,使用live/deadtm活力试剂盒(赛默飞世尔公司)分析死的和活的u87胶质母细胞瘤细胞。图19a示出了相比于用含有野生型或突变pcpb1序列的载体转染的细胞,经过对照物处理的细胞培养物含有显著更多的活细胞,并且图19b示出了相比于经过对照物处理的细胞培养物,这些pcbp1细胞培养物含有显著更多的死细胞。图20a-d示出了用gfp对照载体或含有pcbp1序列的载体转染后对活/死u87细胞的染色。如图21所示,通过所有形式的pcbp1的处理下调了u87胶质母细胞瘤细胞系中的prl3蛋白表达,其中在用mpcbp1_2处理的细胞中观察到prl3表达的最大减少。这些结果不是u87细胞系所特有的,而是还展现在其它胶质母细胞瘤细胞系中。用野生型或突变pcbp1转染ln299胶质母细胞瘤细胞增加了细胞培养物中死细胞的数量(图22和23)并且降低了prl3蛋白表达水平(图24)。同样,用mpcbp1_2处理示出了prl3蛋白表达的最大减少低(图24)。在m059j(图25)、m059k(图26)、u118mg(图27)和u138mg(图28)胶质母细胞瘤细胞系中观察到了对细胞活力的相同影响。野生型或突变pcbp1的过表达减少了胶质母细胞瘤细胞中的stat3表达。像prl3一样,在用含有野生型或突变pcbp1序列的载体转染的胶质母细胞瘤细胞中,癌症标志物stat3的表达减少。图29和30示出了用野生型pcbp1、mpcbp1_1或mpcbp1_2转染的u87和ln299胶质母细胞瘤细胞中stat3蛋白表达水平降低,其中经过mpcbp1_2处理的细胞展现出stat3蛋白水平的最大降低。实例8-通过在肿瘤细胞中表达pcbp1对卵巢癌和前列腺癌的处理为了证明pcbp1过表达的影响不限于胶质母细胞瘤细胞,用含有野生型或突变pcbp1序列的载体转染skov3卵巢癌细胞系。用0.5μg或2.0μg含有gfp、pcbp1、mpcbp1_1或mpcbp1_2的慢病毒载体转染skov3细胞。使用mtt(赛默飞世尔公司)测定细胞增殖。如图31所示,转染所有三种含有pcbp1的载体以剂量依赖性方式增加了对细胞增殖的抑制。进一步地,图32展现了用野生型或突变pcbp1序列转染减少了prl3mrna表达。在用含有野生型或突变pcbp1序列的载体转染的du145前列腺癌细胞中观察到类似的结果。图33展现了与对照细胞相比,过度表达pcbp1的细胞示出了细胞增殖显著减少。图34示出了prl3蛋白表达水平类似地降低,其中mpcbp1_2突变体示出最大降低。实例9-野生型或突变pcbp1的过表达对非癌细胞没有毒性为了证明pcbp1的过表达对非癌细胞没有毒性,用含有野生型或突变pcbp1的载体转染两种正常细胞类型,并且执行乳酸脱氢酶(lh)测定。将乳酸脱氢酶从受损细胞释放到培养基中,并且因此lh水平的增加是细胞毒性和细胞溶解的生物标志物。正常脑细胞(hcn-2)和正常乳腺细胞(mcf10a)各自用含有1)仅gfp(例如,无pcbp1处理)、2)野生型pcbp1、3)mpcbp1_1和4)mpcbp1_2的载体进行转染。图33-34展现了用pcbp1处理对正常的脑和乳腺细胞没有显著的杀伤。通过引用的方式并入出于所有目的,引用的所有参考文献、申请、出版物、专利和专利出版物均通过全文引用的方式并入本文。参考文献1.j.krausewilliam(2005-07-01).《医学生用克劳斯基本人类组织学(krause'sessentialhumanhistologyformedicalstudents)》.波卡拉顿通用出版社(bocaraton:universalpublishers).isbn9781581124682.2.https://hive.biochemistry.gwu.edu/cgibin/prd/biomuta/servlet.cgi?gpageid=11&searchfield1=gene_name&searchvalue1=pcbp1).3.ghanem,l.r.等人聚(c)结合蛋白pcbp2以及其逆转座衍生物pcbp1对于小鼠发育是独立必需的(thepoly(c)bindingproteinpcbp2,anditsretrotransposedderivativepcbp1,areindependentlyessentialtomousedevelopment).《(分子与细胞生物学(mol.cell.biol.)》36,mcb.00936-15(2015).4.basak,s.等人转移相关基因prl-3是参与细胞周期调节的p53靶标(themetastasis-associatedgeneprl-3isap53targetinvolvedincell-cycleregulation).《分子细胞(mol.cell)》30,303-14(2008).5.lai,z.、han,i.、zirzow,g.、brady,ro和reiser,j.,通过慢病毒载体使用单纯疱疹病毒vp22融合蛋白进行的细胞间蛋白递送(intercellularproteindeliverybylentivirusvectorsusingaherpessimplexvirusvp22fusionprotein)《美国国家科学院院刊(proc.natl.acad.sci.usa.)》2000;97:11297-11302.6.chaudhurya、chanderp、howeph(2010),细胞过程中的异质核核糖核蛋白(hnrnp):专注于hnrnpe1的多功能调节作用(heterogeneousnuclearribonucleoproteins(hnrnps)incellularprocesses:focusonhnrnpe1'smultifunctionalregulatoryroles).《rna》16(8):1449-14627.laiz.,2002:用于检测哺乳动物细胞中的发育调节基因的基于hiv-1慢病毒的基因捕获载体的设计(designofanhiv-1lentiviral-basedgene-trapvectortodetectdevelopmentallyregulatedgenesinmammaliancells).《美国国家科学院院刊》第99卷,第6期(2002年3月19日),第3651-3656页.8.wangh.等人pcbp1抑制转移相关prl-3磷酸酶的翻译(pcbp1suppressesthetranslationofmetastasis-associatedprl-3phosphatase).《癌细胞(cancercell)》2010年7月13日:18(1):52-62.doi:10.1016/j.ccr.2010.04.028.9.reiser,j.、lai,z.、zhang,x.y.和brady,r.o.,多基因和调节的慢病毒载体的开发(developmentofmultigeneandregulatedlentivirusvectors).《病毒学杂志(j.virol.)》74,10589-99(2000)10.lai,z.和brady,r.o.,使用重组慢病毒载体向中枢神经系统的体内基因转移(genetransferintothecentralnervoussysteminvivousingarecombinanatlentivirusvector)《神经科学研究杂志(j.neurosci.res.)》67,363-371(2002)11.lai,z.、han,i.、park,m.和brady,r.o.,用于检测哺乳动物细胞中的发育调节基因的基于hiv-1慢病毒的基因捕获载体的设计.《美国国家科学院院刊》99,3651-6(2002).12.bardelli,s.、saha,j.a.、sager,k.e.、romans,b.、xin,s.d.、markowitz,c.、lengauer,v.e.、velculescu,k.w.、kinzler,b.、vogelstein(2003),转移癌中的prl-3表达(prl-3expressioninmetastaticcancers).《临床癌症研究(clin.cancerres.)》9,第5607-5615页.13.f.polato、a.codegoni、r.fruscio、p.perego、c.mangioni、s.saha、a.bardelli、m.broggini(2005),prl-3磷酸酶与卵巢癌生长有关(prl-3phosphataseisimplicatedinovariancancergrowth).《临床癌症研究》11,第6835-6839页.14.l.peng、j.ning、l.meng、c.shou(2004),蛋白酪氨酸磷酸酶prl-3蛋白的表达水平与大肠癌患者的肝转移和预后的关联性(theassociationoftheexpressionlevelofproteintyrosinephosphataseprl-3proteinwithlivermetastasisandprognosisofpatientswithcolorectalcancer),《癌症研究和临床肿瘤学杂志(j.cancerres.clin.oncol.)》130,第521-526页.15.wang,haihe等人(2010)pcbp1抑制转移相关prl-3磷酸酶的翻译(pcbp1suppressesthetranslationofmetastasis-associatedprl-3phosphatase).《癌细胞》,第18卷,第1期,第52-62页.16.pcbp1突变数据库:https://hive.biochemistry.gwu.edu/cgi-bin/prd/biomuta/servlet.cgi?gpageid=11&searchfield1=gene_name&searchvalue1=pcbp1.17.qingchangmeng等人转录、剪接和翻译的信号依赖性且协调性调节存在于单个共调节子pcbp1中(signaling-dependentandcoordinatedregulationoftranscription,splicing,andtranslationresidesinasingleco-regulator,pcbp1).《美国国家科学院院刊》5866-5871.doi:10.1073/pnas.070106510418.brown,a(2016).hnrnpe1翻译沉默基序的鉴定和表征(identificationandcharacterizationofanhnrnpe1translationalsilencingmotif).《核酸研究(nucleicacidsresearch.)》第5892-5907页.2016,第44卷,第12期,doi:10.1093/nar/gkw241.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1