产生吗啡喃生物碱及衍生物的方法与流程
交叉引用
本申请要求于2018年2月8日提交且代理人案卷号为47840-708.801的美国临时申请62/628,264的权益。该申请涉及:美国专利申请序列号14/211,611,现在公开为us2014-0273109,该申请于2014年3月14日提交,代理人案卷号为stan-1018;pct申请序列号pct/us2014/027833,现在公开为wo2014/143744,该申请于2014年3月14日提交,代理人案卷号为stan-1018wo;美国专利申请序列号15/031,618,该申请于2016年4月22日提交,代理人案卷号为stan-1078;申请序列号pct/us2014/063738,现在公开为wo2015/066642,该申请于2014年11月3日提交,代理人案卷号为stan-1078wo;美国临时专利申请序列号62/080,610,该申请于2014年11月17日提交,代理人案卷号为stan-1169prv;美国临时专利申请序列号62/107,238,该申请于2015年1月23日提交,代理人案卷号为stan-1169prv2;申请序列号pct/us2015/060891,该申请于2015年11月16日提交,代理人案卷号为stan-1169wo;美国临时专利申请序列号62/156,701,该申请于2015年5月4日提交,代理人案卷号为stan-1221prv;申请序列号pct/us2016/030808,该申请于2016年5月4日提交,代理人案卷号为stan-1221wo;2016年5月9日提交的申请序列号pct/us2016/031506;2017年10月18日提交的申请序列号pct/us2017/057237;申请序列号62/541,038,该申请于2017年8月3日提交;申请序列号pct/us2018/045222,该申请于2018年8月3日提交;以及申请序列号16/149,025,该申请于2018年10月1日提交;这些申请的公开内容通过引用并入本文。
技术实现要素:
本公开提供了在工程化宿主细胞中产生多种苄基异喹啉生物碱(bia)的方法。本公开进一步提供了在工程化宿主细胞中产生的多种生物碱的组合物。另外,本公开提供了在工程化宿主细胞中产生蒂巴因合酶的方法。在特定情况下,本公开提供了通过在工程化宿主细胞中将原吗啡喃生物碱转化为吗啡喃生物碱来产生多种生物碱产物的方法。在进一步的特定情况下,本公开提供了通过将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因来产生多种生物碱产物的方法。
本发明的一个方面提供了相对于非工程化细胞具有提高的酪氨酸羟化酶活性的工程化非植物细胞。本发明的另一方面提供了相对于表达野生型tyrh的细胞具有提高的酪氨酸羟化酶活性的工程化非植物细胞。本发明的另一方面提供了相对于表达野生型tyrh而没有如本文所提供的提高酪氨酸羟化酶活性的突变的细胞具有提高的酪氨酸羟化酶活性的工程化非植物细胞。特别是,所述工程化非植物细胞具有至少一个选自下组的修饰:底物抑制缓解突变;产物抑制缓解突变;以及辅因子回收促进机制。
本发明的一个方面提供了相对于非工程化细胞具有提高的酪氨酸羟化酶活性的工程化植物细胞。本发明的另一方面提供了相对于表达野生型tyrh的细胞具有提高的酪氨酸羟化酶(tyrh)活性的工程化植物细胞。本发明的另一方面提供了相对于表达野生型tyrh而没有如本文所提供的提高酪氨酸羟化酶活性的突变的细胞具有提高的酪氨酸羟化酶活性的工程化植物细胞。特别是,所述工程化植物细胞具有至少一个选自下组的修饰:底物抑制缓解突变;产物抑制缓解突变;以及辅因子回收促进机制。
在一些实施方案中,本公开提供了通过在工程化宿主细胞中经由工程化的差向异构酶将(s)-1-苄基异喹啉生物碱差向异构化为(r)-1-苄基异喹啉生物碱来增加多种生物碱产物产量的方法。在进一步的实施方案中,本公开提供了与通过经由野生型差向异构酶将(s)-牛心果碱差向异构化为(r)-牛心果碱产生多种生物碱产物相比,通过经由工程化的差向异构酶将(s)-牛心果碱差向异构化为(r)-牛心果碱来增加多种生物碱产物产量的方法,所述工程化的差向异构酶包含两种单独的编码氧化酶和还原酶的酶。
尽管工程化的拆分差向异构酶可以由源自亲本或野生型差向异构酶的单独的氧化酶和还原酶组成,但是工程化的差向异构酶也可以包含源自单独的亲本或野生型差向异构酶的单独的氧化酶和还原酶。具有氧化酶和还原酶组分的亲本差向异构酶的实例包含选自下组的氨基酸序列:seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15和16,如表1所列。
在一些实施方案中,本公开提供了通过在工程化宿主细胞中经由蒂巴因合酶将原吗啡喃生物碱转化为吗啡喃生物碱来增加多种生物碱产物产量的方法。在进一步的实施方案中,本公开提供了通过经由蒂巴因合酶将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因来增加多种生物碱产物产生的方法。亲本蒂巴因合酶的实例包含选自下组的氨基酸序列:seqidno:30、31、32、33、34、35、36和37,如表2所列。
在一些实施方案中,本公开提供了通过在工程化宿主细胞中经由工程化的蒂巴因合酶将原吗啡喃生物碱转化为吗啡喃生物碱来增加多种生物碱产物产量的方法。在进一步的实施方案中,本公开提供了经由经工程化的蒂巴因合酶将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因来增加多种生物碱产物产量的方法。
在一些实施方案中,所述工程化的蒂巴因合酶是融合酶。在进一步的实施方案中,所述蒂巴因合酶与乙酰基转移酶融合。在进一步的实施方案中,所述蒂巴因合酶在乙酰基转移酶内编码。在其他实施方案中,所述蒂巴因合酶与还原酶融合。
在一些实例中,工程化非植物细胞包含多个编码序列,每个编码序列编码选自表3中列出的酶的酶。在一些实例中,异源编码序列可以可操作地连接。可操作地连接的异源编码序列可以在经由蒂巴因合酶活性或工程化的蒂巴因合酶活性产生特定苄基异喹啉生物碱产物的相同途径内。
在一些实施方案中,本公开提供了一种将四环原吗啡喃前体转化为蒂巴因的方法,其包括使四环原吗啡喃前体与至少一种酶接触,其中四环原吗啡喃前体与所述至少一种酶的接触将所述四环原吗啡喃前体转化为蒂巴因。在一些情况下,通过培养具有编码所述至少一种酶的编码序列的工程化非植物细胞来产生所述至少一种酶。在一些情况下,该方法进一步包括将四环原吗啡喃前体加入细胞培养物中。在一些情况下,该方法进一步包括从细胞培养物中回收蒂巴因或其衍生物。在一些情况下,所述至少一种酶包括蒂巴因合酶。在一些情况下,所述蒂巴因合酶包含选自seqidno:30、31、32、33、34、35、36和37的氨基酸序列。在一些情况下,所述蒂巴因合酶是betv1折叠蛋白。
援引并入
本说明书中所提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述和附图,将会获得对本发明的特征和优点的更好的理解,在这些附图中:
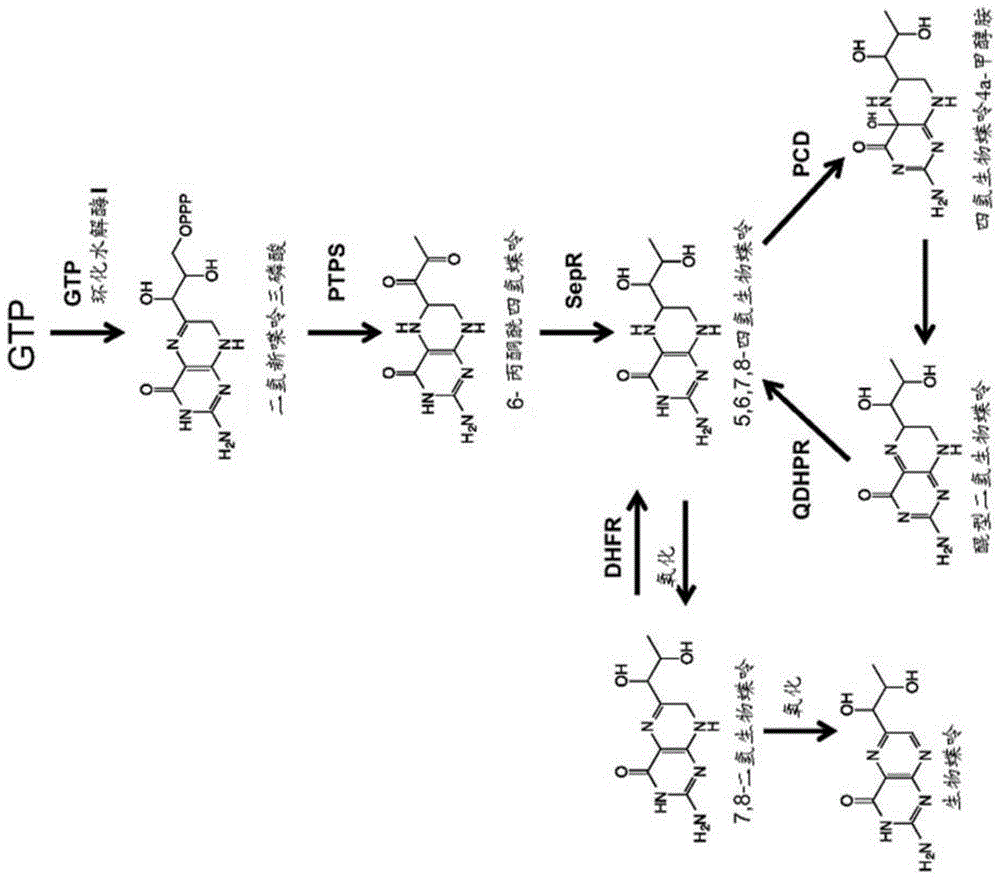
图1示出了根据本发明的实施方案,四氢生物蝶呤的合成、再循环和补救途径的示例。
图2示出了根据本发明的实施方案,用于将葡萄糖转化为4-hpa、多巴胺和3,4-dhpa的生物合成方案。
图3示出了根据本发明的实施方案,(r)-1-苄基异喹啉生物碱形成的示意性示例。
图4示出了根据本发明的实施方案,亲本drs-drr酶的氨基酸序列。
图5分别示出了根据本发明的实施方案,衍生自图4所示的亲本融合酶的drs酶和drr酶的氨基酸序列。
图6示出了根据本发明的实施方案,具有阿片样物质3-o-脱甲基酶活性的酶。
图7示出了根据本发明的实施方案,具有阿片样物质n-脱甲基酶活性的酶。
图8示出了根据本发明的实施方案,具有n-甲基转移酶活性的酶。
图9示出了根据本发明的实施方案,bm3变体的功能表达。
图10示出了根据本发明的实施方案,用于在微生物细胞中将l-酪氨酸转化为去甲阿片样物质或nal-阿片样物质的生物合成方案。
图11示出了根据本发明的实施方案,用于酶表达和工程化的质粒/yac载体。
图12示出了根据本发明的实施方案,用于通过去甲乌药碱(norcoclaurine)将l-酪氨酸转化为牛心果碱(reticuline)的生物合成方案。
图13示出了根据本发明的实施方案,用于通过全去甲劳丹碱(norlaudanosoline)将l-酪氨酸转化为牛心果碱的生物合成方案。
图14示出了根据本发明的实施方案,用于将l-酪氨酸转化为吗啡喃生物碱的生物合成方案。
图15示出了根据本发明的实施方案,用于产生半合成的阿片样物质的生物合成方案。
图16示出了根据本发明的实施方案,用于产生阿片样物质的生物合成方案。
图17示出了根据本发明的实施方案,pbdrs-drr、prdrs和prdrr之间的比对。
图18示出了根据本发明的实施方案,用于从l-酪氨酸产生牛心果碱的酵母平台菌株。
图19示出了根据本发明实施方案,用于从l-酪氨酸生产蒂巴因和氢可酮的酵母菌株。
图20示出了根据本发明的实施方案,将四环支架转化为五环支架的一般闭环反应。
图21示出了根据本发明的实施方案,通过吗啡喃生物碱产生酶的生物信息学搜索而产生的系统树。
图22示出了根据本发明的实施方案,由工程化酵母菌株从糖和l-酪氨酸产生吗啡喃生物碱蒂巴因。
图23示出了根据本发明的实施方案,由工程化酵母菌株从糖和l-酪氨酸产生原吗啡喃生物碱和吗啡喃生物碱蒂巴因。
具体实施方式
本公开提供了在工程化宿主细胞中产生多种苄基异喹啉生物碱(bia)的方法。本公开进一步提供了在工程化宿主细胞中产生的多种生物碱的组合物。另外,本公开提供了在工程化宿主细胞中产生蒂巴因合酶的方法。另外,本公开提供了在工程化宿主细胞中产生工程化蒂巴因合酶的方法。在特定情况下,本公开提供了通过增加工程化宿主细胞中原吗啡喃生物碱向吗啡喃生物碱的转化来产生原吗啡喃、吗啡喃、nal-阿片样和去甲阿片样生物碱产物的方法。在进一步的特定情况下,本公开提供了通过增加工程化宿主细胞中原吗啡喃生物碱向吗啡喃生物碱的转化来产生吗啡喃、nal-阿片样和去甲阿片样生物碱产物的方法。在进一步的特定情况下,本公开提供了通过增加原吗啡喃生物碱向吗啡喃生物碱的转化来产生多种生物碱产物的方法。
感兴趣的苄基异喹啉生物碱(bia)
提供了产生感兴趣的bia的宿主细胞。在一些实例中,宿主细胞的工程化菌株如本文所讨论的实施方案的工程化菌株可提供用于产生跨越若干结构种类的感兴趣的苄基异喹啉生物碱及其修饰物的平台,所述种类包括但不限于前体bia、苄基异喹啉类、原吗啡喃类(promorphinans)、吗啡喃类、nal-阿片样物质和去甲阿片样物质等。这些种类中的每一种可包括可产生该种类的成员的工程化宿主细胞生物合成途径的任何适宜成员的生物合成前体、中间体及其代谢物。对于这些结构种类中的每一种,在下文给出化合物的非限制性实例。在一些情况下,给定实例的结构本身可以表征为或可以不表征为苄基异喹啉生物碱。在一些情况下,本发明的化学实体可包括所有可能的异构体,包括单一对映体、外消旋混合物、光学纯形式、非对映体的混合物和中间体混合物。
bia前体可包括但不限于去甲乌药碱(nc)和全去甲劳丹碱(nl),以及nc和nl前体,如酪氨酸、酪胺、4-羟基苯乙醛(4-hpa)、4-羟基苯丙酮酸(4-hppa)、l-3,4-二羟基苯丙氨酸(l-dopa)、3,4-二羟基苯乙醛(3,4-dhpa)和多巴胺。在一些实施方案中,一种或多种bia前体为3,4-二羟基苯乙醛(3,4-dhpa)和多巴胺。在某些情况下,一种或多种bia前体为4-羟基苯乙醛(4-hpa)和多巴胺。具体地讲,nl和nc可通过pictet-spengler缩合反应由前体分子分别合成,其中反应可自发发生或者可通过任何适宜的酶催化。
苄基异喹啉类可包括但不限于去甲乌药碱、全去甲劳丹碱、乌药碱、3’-羟基乌药碱、4’-o-甲基全去甲劳丹碱、4’-o-甲基-全劳丹碱、n-甲基去甲乌药碱、全劳丹碱(laudanosoline)、n-甲基乌药碱、3’-羟基-n-甲基乌药碱、牛心果碱、去甲牛心果碱、罂粟碱、劳丹碱、劳丹素、四氢罂粟碱、1,2-二氢罂粟碱和东罂粟灵(orientaline)。
原吗啡喃类可包括但不限于沙罗泰里啶、沙罗泰里啶醇和沙罗泰里啶醇-7-o-乙酸。
吗啡喃类可包括但不限于蒂巴因、可待因酮、可待因、吗啡、吗啡酮、东罂粟碱、尼奥品酮(neopinone)、尼奥品、尼奥吗啡(neomorphine)、氢可酮、二氢可待因、14-羟基可待因酮、羟考酮、14-羟基可待因、吗啡酮、氢吗啡酮、二氢吗啡、二氢埃托啡、乙基吗啡、埃托啡、美托酮、丁丙诺啡、福尔可定、异可待因(heterocodeine)和羟吗啡酮。特别是,蒂巴因可以由沙罗泰里啶醇-7-o-乙酸合成,其中该反应可以自发发生或者可以被任何适宜的酶催化。
nal-阿片样物质可包括但不限于纳曲酮、纳洛酮、纳美芬、纳洛芬、烯丙吗啡、nalodeine、naldemedine、纳洛昔醇、6β-纳曲醇、纳曲吲哚、甲基纳曲酮、methylsamidorphan、爱维莫潘、axelopran、bevenpran、二烟酸酯、左洛啡烷、samidorphan、丁丙诺啡、地佐辛、依他佐辛、布托啡诺、左啡诺、纳布啡、喷他佐辛、非那佐辛、norbinaltorphimine和二丙诺啡。
去甲阿片样药物可包括但不限于去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮或去甲-14-羟基-吗啡酮。
在某些实施方案中,本发明的工程化菌株可提供用于产生与四氢生物蝶呤合成有关的化合物的平台,所述化合物包括但不限于二氢新蝶呤三磷酸、6-丙酮酰四氢蝶呤、5,6,7,8-四氢生物蝶呤、7,8-二氢生物蝶呤、四氢生物蝶呤4a-甲醇胺、醌型二氢生物蝶呤和生物蝶呤。
宿主细胞
可在主题宿主细胞和方法中利用任何适宜的细胞。在一些情况下,宿主细胞为非植物细胞。在一些情况下,宿主细胞可表征为微生物细胞。在某些情况下,宿主细胞为昆虫细胞、哺乳动物细胞、细菌细胞或酵母细胞。任何适宜类型的宿主细胞可被用于产生主题bia产生细胞,参见例如,us2008/0176754和us2014/0273109,其公开内容通过引用以其全文并入。感兴趣的宿主细胞包括但不限于细菌细胞(其可以是革兰氏阳性细菌细胞或革兰氏阴性细菌细胞),昆虫细胞如黑腹果蝇(drosophilamelanogaster)s2和草地夜蛾(spodopterafrugiperda)sf9细胞,以及酵母细胞如酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)和巴斯德毕赤酵母(pichiapastoris)细胞。细菌细胞的非限制性实例包括枯草芽孢杆菌(bacillussubtilis)、大肠杆菌(escherichiacoli)、链霉菌属(streptomyces)、鱼腥蓝细菌属(anabaena)、节杆菌属(arthrobacter)、醋杆菌属(acetobacter)、醋酸杆菌属(acetobacterium)、芽孢杆菌属(bacillus)、双歧杆菌属(bifidobacterium)、短状杆菌属(brachybacterium)、短杆菌属(brevibacterium)、肉杆菌属(carnobacterium)、梭菌属(clostridium)、棒杆菌属(corynebacterium)、肠杆菌属(enterobacter)、埃希氏菌属(escherichia)、葡糖酸醋酸杆菌属(gluconacetobacter)、葡糖杆菌属(gluconobacter)、哈夫尼菌属(hafnia)、盐单胞菌属(halomonas)、克雷伯氏菌属(klebsiella)、考克氏菌属(kocuria)、乳杆菌属(lactobacillus)、明串珠菌属(leucononstoc)、巨球菌属(macrococcus)、甲基单胞菌属(methylomonas)、甲基细菌属(methylobacter)、甲基细胞菌属(methylocella)、甲基球菌属(methylococcus)、微杆菌属(microbacterium)、微球菌属(micrococcus)、微囊蓝细菌属(microcystis)、穆尔氏菌属(moorella)、酒球菌属(oenococcus)、片球菌属(pediococcus)、原绿球蓝细菌属(prochlorococcus)、丙酸杆菌属(propionibacterium)、变形菌属(proteus)、假交替单胞菌属(pseudoalteromonas)、假单胞菌属(pseudomonas)、嗜冷杆菌属(psychrobacter)、红细菌属(rhodobacter)、红球菌属(rhodococcus)、红假单胞菌属(rhodopseudomonas)、沙雷氏菌属(serratia)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、链霉菌属(streptomyces)、聚球蓝细菌属(synechococcus)、集胞蓝细菌属(synechocystis)、四联球菌属(tetragenococcus)、魏斯氏菌属(weissella)、发酵单胞菌属(zymomona)和鼠伤寒沙门氏菌(salmonellatyphimuium)细胞。在一些实例中,宿主细胞为酵母细胞或大肠杆菌细胞。在一些情况下,宿主细胞为酵母细胞或大肠杆菌细胞。在一些情况下,宿主细胞为酵母细胞。在一些情况下,宿主细胞来自被工程化为产生感兴趣的bia如吗啡喃生物碱的酵母菌株。在一些情况下,宿主细胞来自被工程化以产生感兴趣的酶的酵母菌株。在一些情况下,宿主细胞来自被工程化以产生蒂巴因合酶的酵母菌株。
相对于自发反应,蒂巴因合酶可能能够更有效地将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因。在一些情况下,宿主细胞来自被工程化以产生工程化蒂巴因合酶的酵母菌株。在一些实施方案中,工程化的蒂巴因合酶可以是工程化的融合酶。另外,相对于蒂巴因合酶,工程化的蒂巴因合酶可能能够更有效地将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因。在一些实施方案中,蒂巴因合酶可以是野生型蒂巴因合酶。在一些实施方案中,蒂巴因合酶可以与野生型蒂巴因合酶基本相似。在一些情况下,与野生型蒂巴因合酶基本相似的蒂巴因合酶可以具有与野生型蒂巴因合酶的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相似的氨基酸序列。可以将工程化的蒂巴因合酶工程化为与另一种酶的融合酶,以相对于蒂巴因合酶更有效地将沙罗泰里啶醇-7-o-乙酸转化为蒂巴因。
smolke等人的us2008/0176754和us2014/0273109中所述的任何宿主细胞可适用于主题细胞和方法。在某些实施方案中,酵母细胞可以是酿酒酵母(s.cerevisiae)种。在某些实施方案中,酵母细胞可以是粟酒裂殖酵母种。在某些实施方案中,酵母细胞可以是巴斯德毕赤酵母种。酵母作为感兴趣的宿主细胞是因为细胞色素p450蛋白能够正确地折叠到内质网膜中,使得它们的活性得以保持。在实例中,细胞色素p450蛋白参与一些感兴趣的生物合成途径。在另外的实例中,细胞色素p450蛋白参与感兴趣的bia的产生。在进一步的实例中,细胞色素p450蛋白参与感兴趣的酶的产生。
可用于本发明的感兴趣的酵母菌株包括但不限于:cen.pk(基因型:mata/αura3-52/ura3-52trp1-289/trp1-289leu2-3_112/leu2-3_112his3δ1/his3δ1mal2-8c/mal2-8csuc2/suc2)、s288c、w303、d273-10b、x2180、a364a、∑1278b、ab972、sk1和fl100。在某些情况下,酵母菌株是以下中的任一种:s288c(matα;suc2malmelgal2cup1flo1flo8-1hap1)、by4741(matα;his3δ1;leu2δ0;met15δ0;ura3δ0)、by4742(matα;his3δ1;leu2δ0;lys2δ0;ura3δ0)、by4743(mata/matα;his3δ1/his3δ1;leu2δ0/leu2δ0;met15δ0/met15;lys2/lys2δ0;ura3δ0/ura3δ0)以及wat11或w(r),w303-b菌株(mata;ade2-1;his3-11、-15;leu2-3、-112;ura3-1;canr;cyr+)的衍生物,两者分别表达拟南芥(arabidopsisthaliana)nadph-p450还原酶atr1和酵母nadph-p450还原酶cpr1。在另一个实施方案中,酵母细胞是w303α(matα;his3-11,15trp1-1leu2-3ura3-1ade2-1)。另外的感兴趣的酵母菌株的身份和基因型可见于euroscarf(web.uni-frankfurt.de/fb15/mikro/euroscarf/col_index.html)。
在一些情况下,宿主细胞是真菌细胞。在某些实施方案中,真菌细胞可以是曲霉属(aspergillus)的种,并且菌株包括黑曲霉(aspergillusniger)(atcc1015、atcc9029、cbs513.88)、米曲霉(aspergillusoryzae)(atcc56747、rib40)、土曲霉(aspergillusterreus)(nih2624、atcc20542)和构巢曲霉(aspergillusnidulans)(fgsca4)。
在某些实施方案中,异源编码序列可针对在曲霉属的种中的表达进行密码子优化,并由适当的启动子表达。在某些实施方案中,启动子可选自磷酸甘油酸激酶启动子(pgk)、mbfa启动子、细胞色素c氧化酶亚单位启动子(coxa)、srpb启动子、tvda启动子、苹果酸脱氢酶启动子(mdha)、β-甘露糖苷酶启动子(manb)。在某些实施方案中,终止子可选自葡糖淀粉酶终止子(glaa)或trpc终止子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到宿主的基因组中。在某些实施方案中,可用抗生素选择如潮霉素或者氮源利用如使用乙酰胺作为唯一的氮源进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可使用已建立的转化方法如原生质体转化、乙酸锂或电穿孔将dna构建体引入宿主细胞中。在某些实施方案中,在进行或不进行选择的情况下,可以在液体me或固体mea(3%麦芽提取物、0.5%蛋白胨和±1.5%琼脂)中或在vogel基本培养基中培养细胞。
在一些情况下,宿主细胞是细菌细胞。细菌细胞可选自任何细菌属。细菌细胞可来自的属的实例包括鱼腥蓝细菌属(anabaena)、节杆菌属(arthrobacter)、醋杆菌属(acetobacter)、醋酸杆菌属(acetobacterium)、芽孢杆菌属(bacillus)、双歧杆菌属(bifidobacterium)、短状杆菌属(brachybacterium)、短杆菌属(brevibacterium)、肉杆菌属(carnobacterium)、梭菌属(clostridium)、棒杆菌属(corynebacterium)、肠杆菌属(enterobacter)、埃希氏菌属(escherichia)、葡糖酸醋酸杆菌属(gluconacetobacter)、葡糖杆菌属(gluconobacter)、哈夫尼菌属(hafnia)、盐单胞菌属(halomonas)、克雷伯氏菌属(klebsiella)、考克氏菌属(kocuria)、乳杆菌属(lactobacillus)、明串珠菌属(leucononstoc)、巨球菌属(macrococcus)、甲基单胞菌属(methylomonas)、甲基细菌属(methylobacter)、甲基细胞菌属(methylocella)、甲基球菌属(methylococcus)、微杆菌属(microbacterium)、微球菌属(micrococcus)、微囊蓝细菌属(microcystis)、穆尔氏菌属(moorella)、酒球菌属(oenococcus)、片球菌属(pediococcus)、原绿球蓝细菌属(prochlorococcus)、丙酸杆菌属(propionibacterium)、变形菌属(proteus)、假交替单胞菌属(pseudoalteromonas)、假单胞菌属(pseudomonas)、嗜冷杆菌属(psychrobacter)、红细菌属(rhodobacter)、红球菌属(rhodococcus)、红假单胞菌属(rhodopseudomonas)、沙雷氏菌属(serratia)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、链霉菌属(streptomyces)、聚球蓝细菌属(synechococcus)、集胞蓝细菌属(synechocystis)、四联球菌属(tetragenococcus)、魏斯氏菌属(weissella)和发酵单胞菌属(zymomona)。可与本公开的方法一起使用的细菌物种的实例包括烟草节杆菌(arthrobacternicotianae)、醋化醋杆菌(acetobacteraceti)、阿氏节杆菌(arthrobacterarilaitensis)、蜡状芽孢杆菌(bacilluscereus)、凝结芽孢杆菌(bacilluscoagulans)、地衣芽孢杆菌(bacilluslicheniformis)、短小芽孢杆菌(bacilluspumilus)、球形芽孢杆菌(bacillussphaericus)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、枯草芽孢杆菌(bacillussubtilis)、青春双歧杆菌(bifidobacteriumadolescentis)、奶酪发酵小短状杆菌(brachybacteriumtyrofermentans)、扩展短杆菌(brevibacteriumlinens)、广布肉杆菌(carnobacteriumdivergens)、微黄棒杆菌(corynebacteriumflavescens)、屎肠球菌(enterococcusfaecium)、欧罗巴葡糖酸醋酸杆菌(gluconacetobactereuropaeus)、约翰娜葡糖酸醋酸杆菌(gluconacetobacterjohannae)、氧化葡糖杆菌(gluconobacteroxydans)、蜂房哈夫尼菌(hafniaalvei)、伸长盐单胞菌(halomonaselongata)、嗜根考克氏菌(kocuriarhizophila)、酸粉乳杆菌(lactobacillusacidifarinae)、詹氏乳杆菌(lactobacillusjensenii)、乳酸乳球菌(lactococcuslactis)、果汁乳杆菌(lactobacillusyamanashiensis)、柠檬明串珠菌(leuconostoccitreum)、溶酪巨球菌(macrococcuscaseolyticus)、叶片微杆菌(microbacteriumfoliorum)、里拉微球菌(micrococcuslylae)、酒酒球菌(oenococcusoeni)、乳酸片球菌(pediococcusacidilactici)、产丙酸丙酸杆菌(propionibacteriumacidipropionici)、普通变形菌(proteusvulgaris)、荧光假单胞菌(pseudomonasfluorescens)、速生嗜冷杆菌(psychrobacterceler)、调料葡萄球菌(staphylococcuscondimenti)、唾液链球菌嗜热亚种(streptococcusthermophilus)、灰色链霉菌(streptomycesgriseus)、嗜盐四联球菌(tetragenococcushalophilus)、食窦魏斯氏菌(weissellacibaria)、高丽魏斯氏菌(weissellakoreensis)、运动发酵单胞菌(zymomonasmobilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、两岐/短/长双岐杆菌(bifidobacteriumbifidum/breve/longum)、浅青紫链霉菌(streptomyceslividans)、天蓝色链霉菌(streptomycescoelicolor)、植物乳杆菌(lactobacillusplantarum)、清酒乳杆菌(lactobacillussakei)、干酪乳杆菌(lactobacilluscasei)、柠檬假交替单胞菌(pseudoalteromonascitrea)、恶臭假单胞菌(pseudomonasputida)、扬氏/醋酸/丙酮丁醇/拜氏/丁酸梭菌(clostridiumljungdahlii/aceticum/acetobutylicum/beijerinckii/butyricum)和热纤/热醋穆尔氏菌(moorellathemocellum/thermoacetica)。
在某些实施方案中,细菌细胞可以是大肠杆菌菌株。在某些实施方案中,大肠杆菌菌株可选自bl21、dh5α、xl1-blue、hb101、bl21和k12。在某些实施方案中,异源编码序列可针对在大肠杆菌中的表达进行密码子优化,并由适当的启动子表达。在某些实施方案中,启动子可选自t7启动子、tac启动子、trc启动子、四环素诱导型启动子(tet)、lac操纵子启动子(lac)、laco1启动子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到基因组中。在某些实施方案中,质粒选自puc19或pbad。在某些实施方案中,可用抗生素选择如卡那霉素、氯霉素、链霉素、壮观霉素、庆大霉素、红霉素或氨苄青霉素进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可以使用已建立的转化方法如缀合、热休克化学转化或电穿孔将dna构建体引入宿主细胞中。在某些实施方案中,可在有或没有抗生素的情况下,在约37℃下在液体luria-bertani(lb)培养基中培养细胞。
在某些实施方案中,细菌细胞可以是枯草芽孢杆菌菌株。在某些实施方案中,枯草芽孢杆菌菌株可选自1779、gp25、ro-nn-1、168、bsn5、best195、1a382和62178。在某些实施方案中,异源编码序列可针对在芽孢杆菌属的种中的表达进行密码子优化,并由适当的启动子表达。在某些实施方案中,启动子可选自grac启动子、p43启动子或trnq启动子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到基因组中。在某些实施方案中,质粒选自php13、pe194、pc194、pht01或pht43。在某些实施方案中,整合载体如pdg364或pdg1730可用于将表达盒整合到基因组中。在某些实施方案中,可用抗生素选择如红霉素、卡那霉素、四环素和壮观霉素进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可使用已建立的转化方法如自然感受态、热休克或化学转化将dna构建体引入宿主细胞中。在某些实施方案中,可在37℃下在液体luria-bertani(lb)培养基中或在m9培养基加葡萄糖和色氨酸中培养细胞。
对宿主细胞的遗传修饰
宿主细胞可被工程化以包含一个或多个修饰(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多修饰),其提供感兴趣的bia的产生。另外地或备选地,宿主细胞可被工程化以包含一个或多个修饰(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多修饰),其提供感兴趣的酶的产生。在一些情况下,修饰为遗传修饰,如基因或其片段的突变、添加或缺失,或者基因或其片段的转录调节。如本文所用的,术语“突变”是指相对于参考序列或基序,氨基酸残基或核苷酸残基的缺失、插入或置换。突变可作为原始基因座处的天然基因的定向突变而并入。在一些情况下,突变可作为在单独基因座处作为遗传整合引入的基因的另外拷贝或者作为附加型载体如2μ或着丝粒质粒上的另外拷贝而并入。在某些情况下,酶的底物抑制性拷贝处于天然细胞转录调节下。在一些情况下,通过将酶的底物抑制性拷贝置于合成启动子的控制下,从而在工程化的蛋白质表达的组成型或动态调节的情况下引入所述拷贝。在一些实例中,一个或多个修饰的对象可以是天然基因。在一些实例中,一个或多个修饰的对象可以是非天然基因。在一些实例中,非天然基因可插入宿主细胞中。在进一步的实例中,可在非天然基因插入宿主细胞中之前通过一个或多个修饰改变非天然基因。
工程化宿主细胞可过量产生一种或多种感兴趣的bia。过量产生意指,相对于对照细胞(例如,未修饰的细胞),细胞具有改善或增加的感兴趣的bia分子的产生。改善或增加的产生意指以下两种情况:在对照不产生感兴趣的bia的情况下产生一定量的感兴趣的bia,以及在其中对照具有一些感兴趣的bia产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种(s)-1-苄基异喹啉生物碱。在一些情况下,工程化宿主细胞可在对照不产生(s)-1-苄基异喹啉生物碱的情况下产生一定量的感兴趣的(s)-1-苄基异喹啉生物碱,以及在其中对照具有一些感兴趣的(s)-1-苄基异喹啉生物碱产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生一种或多种(r)-1-苄基异喹啉生物碱。在一些情况下,工程化宿主细胞可在对照不产生(r)-1-苄基异喹啉生物碱的情况下产生一定量的感兴趣的(r)-1-苄基异喹啉生物碱,以及在对照具有一些感兴趣的(r)-1-苄基异喹啉生物碱产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生一种或多种吗啡喃生物碱。在一些情况下,工程化宿主细胞可在对照不产生吗啡生物碱的情况下产生一定量的感兴趣的吗啡生物碱,以及在对照具有一些感兴趣的吗啡喃生物碱产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。工程化宿主细胞可进一步过量产生一种或多种原吗啡喃、去甲阿片样或nal-阿片样生物碱。
在一些情况下,相对于缺乏一个或多个修饰(例如,如本文所述)的对照宿主细胞,工程化宿主细胞能够产生增加量的(r)-牛心果碱。在一些情况下,相对于具有融合差向异构酶的宿主细胞,具有工程化的拆分差向异构酶的工程化宿主细胞能够产生增加量(r)-牛心果碱。在一些情况下,相对于缺乏对工程化差向异构酶的氧化酶部分的一个或多个修饰的对照宿主细胞,具有对工程化差向异构酶的氧化酶部分的修饰的工程化宿主细胞能够产生增加量的(r)-牛心果碱。在某些情况下,(r)-牛心果碱增加的量为相对于对照宿主细胞约10%或更多,诸如相对于对照宿主细胞约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、约2倍或更多、约5倍或更多乃至约10倍或更多。在一些情况下,(r)-牛心果碱是工程化宿主细胞内的差向异构化反应的产物。在一些情况下,(r)-牛心果碱是由工程化宿主细胞内的至少一种工程化差向异构酶催化的差向异构反应产物。在这些情况下,(s)-牛心果碱可以是差向异构化反应的底物。
在一些情况下,相对于缺乏一个或多个修饰(例如,如本文所述)的对照宿主细胞,工程化宿主细胞能够产生增加量的蒂巴因。在一些情况下,相对于缺乏蒂巴因合酶的宿主细胞,具有蒂巴因合酶的工程化宿主细胞能够产生增加量的蒂巴因。在一些情况下,相对于具有非工程化蒂巴因合酶(例如,如本文所述)的宿主细胞,具有工程化蒂巴因合酶的工程化宿主细胞能够产生增加量的蒂巴因。在某些情况下,蒂巴因的增加量为相对于对照宿主细胞约10%或更多,诸如相对于对照宿主细胞约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、约2倍或更多、约5倍或更多乃至约10倍或更多。在一些情况下,蒂巴因是工程化宿主细胞内的蒂巴因合酶反应的产物。在一些情况下,蒂巴因是由工程化宿主细胞内的至少一种工程化蒂巴因合酶催化的蒂巴因合酶反应的产物。在这些情况下,沙罗泰里啶醇-7-o-乙酸可以是蒂巴因合酶反应的底物。
另外,工程化宿主细胞可过量产生一种或多种感兴趣的酶。过量产生意指,相对于对照细胞(例如,未修饰的细胞),细胞具有改善或增加的感兴趣的酶的产生。改善或增加的产生意指以下两种情况:在对照不产生的情况下产生一定量的感兴趣的酶,以及在其中对照具有一些感兴趣的酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种drs-drr酶。在一些情况下,工程化宿主细胞可在对照不产生drs-drr酶的情况下产生一定量的drs-drr酶,以及在其中对照具有一些drs-drr酶产生的情况下,增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种工程化的drs-drr酶。在一些情况下,工程化宿主细胞可在对照不产生drs-drr酶的情况下,或者在与野生动物相比,对照具有相同水平的野生型差向异构酶产生的情况下,产生一定量的工程化的drs-drr酶,以及在其中对照具有一些drs-drr酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。在一些情况下,工程化drs-drr差向异构酶可以是工程化的融合差向异构酶。
工程化宿主细胞可进一步过量产生衍生自drs-drr酶的一种或多种酶。在一些情况下,工程化宿主细胞可在对照不产生衍生自drs-drr酶的酶的情况下产生一定量的衍生自drs-drr酶的酶,以及在对照具有一些衍生自drs-drr酶的酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生一种或多种蒂巴因合酶。在一些情况下,工程化宿主细胞可在对照不产生蒂巴因合酶的情况下产生一定量的蒂巴因合酶,以及在对照具有一些蒂巴因合酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种工程化蒂巴因合酶。在一些情况下,工程化宿主细胞可在对照不产生蒂巴因合酶的情况下或者在对照与工程化宿主细胞相比具有一定水平的野生型蒂巴因合酶产生的情况下产生一定量的工程化蒂巴因合酶,以及在对照具有一些蒂巴因合酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。在一些情况下,工程化蒂巴因合酶可以是工程化的融合酶。
工程化宿主细胞可进一步过量产生一种或多种衍生自蒂巴因合酶的酶。在一些情况下,工程化宿主细胞可在对照不产生衍生自蒂巴因合酶的酶的情况下产生一定量的衍生自蒂巴因合酶的酶,以及在对照具有一定的衍生自蒂巴因合酶的酶的产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
在一些情况下,所述一个或多个(如两个或更多个、三个或更多个或者四个或更多个)修饰可选自:生物合成酶基因中的底物抑制缓解突变;生物合成酶基因中的产物抑制缓解突变;辅因子回收促进机制;生物合成酶基因中的反馈抑制缓解突变;生物合成酶基因中的转录调节修饰;酶基因中的失活突变;差向异构化修饰;以及编码酶的异源编码序列。包含一个或多个修饰的细胞可称为工程化细胞。
在一些情况下,所述一个或多个(如两个或更多个、三个或更多个或者四个或更多个)修饰可选自:定位突变;细胞色素p450还原酶相互作用突变;可及性突变;活性增强突变;工程化的融合蒂巴因合酶修饰和工程化的拆分差向异构酶修饰。包含一个或多个修饰的细胞可称为工程化细胞。
底物抑制缓解突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个底物抑制缓解突变(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用的,术语“底物抑制缓解突变”是指缓解细胞的底物抑制控制机制的突变。
缓解底物抑制的突变相对于对照细胞减少感兴趣的细胞中受调节的酶的抑制,并且提供水平增加的受调节的化合物或其下游生物合成产物。在一些情况下,缓解受调节的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多乃至更多。水平增加意指该水平为对照细胞中受调节的化合物或其下游产物的水平的110%或更高,诸如工程化宿主细胞中受调节的化合物或其下游产物的120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如至少3倍或更高、至少5倍或更高、至少10倍或更高乃至更高。
工程化宿主细胞中针对感兴趣的bia或其前体的水平的调节的多种底物抑制控制机制和生物合成酶可被靶向以供底物抑制缓解。工程化宿主细胞可在一个或多个生物合成酶基因中包含一个或多个底物抑制缓解突变。一个或多个突变可位于其中生物合成酶受到调节控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因编码一种或多种酪氨酸羟化酶。在某些情况下,一个或多个底物抑制缓解突变存在于生物合成酶基因tyrh中。在一些实施方案中,工程化宿主细胞可在一个或多个生物合成酶基因(如表3中所述的那些基因之一)中包含一个或多个底物抑制缓解突变。
在某些实施方案中,一个或多个底物抑制缓解突变存在于tyrh基因中。tyrh基因编码酪氨酸羟化酶,该酪氨酸羟化酶是将酪氨酸转化为l-dopa的酶。然而,tyrh受其底物酪氨酸的抑制。诸如在人或大鼠中所见的哺乳动物酪氨酸羟化酶活性可通过缓解底物抑制的tyrh基因的突变来改善。具体而言,可通过tyrh基因中的点突变w166y缓解由酪氨酸造成的底物抑制。tyrh基因中的点突变w166y还可改善酪氨酸羟化酶的辅底物bh4的结合,以催化酪氨酸到l-dopa的反应。tyrh的突变体当在酵母菌株中表达以由糖产生bia时(如美国临时专利申请序列号61/899,496中所述的那些)可显著改善bia的产生。
可利用任何适宜数目和类型的突变来缓解底物抑制控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个乃至15个或更多个底物抑制缓解突变,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个底物抑制缓解突变。
辅因子回收促进机制
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一种或多种辅因子回收促进机制(如两种或更多种、三种或更多种、四种或更多种、五种或更多种乃至更多种)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用的,术语“辅因子回收促进机制”是指促进细胞的辅因子回收控制机制的机制。
工程化宿主细胞中针对感兴趣的bia或其前体的水平调节的多种辅因子回收控制机制和生物合成酶可被靶向以供辅因子回收促进。工程化宿主细胞可在一个或多个生物合成酶基因中包含一种或多种辅因子回收促进机制。在实例中,工程化宿主细胞可包含编码二氢叶酸还原酶(dhfr)的异源编码序列。当表达dhfr时,其可将7,8-二氢生物蝶呤(bh2)转化为四氢生物蝶呤(bh4),从而回收bh4作为tyrh辅底物。在一些实例中,工程化宿主细胞可在一个或多个生物合成酶基因(如表2中所述的那些基因之一)中包含一种或多种辅因子回收促进机制。
可利用任何适宜数目和类型的机制来促进辅因子回收控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、11种或更多种、12种或更多种、13种或更多种、14种或更多种乃至15种或更多种辅因子回收促进机制,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15种辅因子回收促进机制。
产物抑制缓解突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个产物抑制缓解突变(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用的,术语“产物抑制缓解突变”是指缓解工程化宿主细胞的短期和/或长期产物抑制控制机制的突变。短期产物抑制是其中在辅底物结合位点处存在竞争性结合的细胞的控制机制。长期产物抑制是其中存在化合物远离期望途径的不可逆结合的细胞的控制机制。
缓解产物抑制的突变相对于对照细胞减少感兴趣的细胞中受调节的酶的抑制,并且提供水平增加的受调节非化合物或其下游生物合成产物。在一些情况下,缓解受调节的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多乃至更多。水平增加意指该水平为对照细胞中受调节的化合物或其下游产物的110%或更高,诸如工程化宿主细胞中受调节的化合物或其下游产物的120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如至少3倍或更高、至少5倍或更高、至少10倍或更高乃至更高。
工程化宿主细胞中针对感兴趣的bia的水平的调节的多种产物抑制控制机制和生物合成酶可被靶向以供产物抑制缓解。工程化宿主细胞可在一个或多个生物合成酶基因中包含一个或多个产物抑制缓解突变。突变可位于其中生物合成酶受到调节控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因编码一种或多种酪氨酸羟化酶。在某些情况下,一个或多个产物抑制缓解突变存在于生物合成酶基因tyrh中。在一些实施方案中,工程化宿主细胞在一个或多个生物合成酶基因(如表3中所述的那些基因之一)中包括一个或多个产物抑制缓解突变。
在某些实施方案中,一个或多个产物抑制缓解突变存在于tyrh基因中。tyrh基因编码酪氨酸羟化酶,该酪氨酸羟化酶为将酪氨酸转化为l-dopa的酶。tyrh需要四氢生物蝶呤(bh4)作为辅底物来催化羟化反应。一些微生物菌株,如酿酒酵母,不在天然情况下产生bh4,但是可被工程化为通过四酶合成和再循环途径产生该底物,如图1中所示。图1示出了根据本发明的实施方案,四氢生物蝶呤的合成、再循环和补救途径的实例。图1提供了以下酶的使用:ptps,丙酮酰四氢蝶呤合酶;sepr,墨蝶呤还原酶;pcd,蝶呤4a-甲醇胺脱水酶;qdhpr,二氢蝶啶还原酶;和dhfr,二氢叶酸还原酶。在图1所示的酶中,酵母合成内源性gtp环化水解酶i。gtp和二氢新蝶呤三磷酸在酵母中天然合成。另外,图1中的其他代谢物不在酵母中天然产生。
tyrh受到其产物l-dopa以及其他儿茶酚胺(特别是多巴胺)的抑制。诸如来自人或大鼠的哺乳动物酪氨酸羟化酶活性可通过缓解产物抑制的突变得到改善。例如,短期产物抑制,如在辅底物结合位点处的竞争性结合,可通过tyrh基因上的点突变w166y缓解。具体而言,tyrh基因上的点突变w166y可改善辅底物的结合。另外,用来缓解辅底物结合位点处的竞争性结合的短期产物抑制可通过tyrh基因上的点突变s40d得到改善。短期产物抑制也可通过tyrh基因上的r37e、r38e的联合突变得到改善。具体地讲,r37e、r38e突变可在多巴胺的存在下一起特定改善酪氨酸羟化酶活性。
另外,长期产物抑制可通过tyrh基因上的点突变得到缓解。长期产物抑制缓解可包括儿茶酚胺与铁在活性位点中的不可逆结合,使得存在较少的儿茶酚胺充当酪氨酸羟化酶活性的产物抑制剂。长期产物抑制可分别通过tyrh基因中的突变e332d和y371f得到缓解。
可对突变进行组合(如同时两个或三个或更多个突变)来缓解多种类型的底物和产物抑制,从而进一步改善tyrh的活性。tyrh的突变体当在酵母菌株中表达以由糖产生bia时(如美国临时专利申请序列号61/899,496中所述的那些)可显著改善bia的产生。
可利用任何适宜数目和类型的突变来缓解产物抑制控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个乃至15个或更多个产物抑制缓解突变,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个产物抑制缓解突变。
反馈抑制缓解突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个反馈抑制缓解突变(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个)的细胞。在一些情况下,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。另外地或备选地,在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用的,术语“反馈抑制缓解突变”是指缓解工程化宿主细胞的反馈抑制控制机制的突变。反馈抑制是其中受调节的化合物的合成途径中的酶在所述化合物积累到一定水平时受到抑制,从而平衡细胞中的化合物的量的细胞控制机制。缓解反馈抑制的突变相对于对照细胞减少工程化宿主细胞中受调节的酶的抑制。以这种方式,工程化宿主细胞提供水平增加的受调节的化合物或其下游生物合成产物。在一些情况下,缓解受调节的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多乃至更多。水平增加意指该水平为对照细胞中受调节的化合物或其下游产物的110%或更高,诸如120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如宿主细胞中受调节的化合物或其下游产物的至少3倍或更高、至少5倍或更高、至少10倍或更高乃至更高。
针对感兴趣的bia的水平调节的多种反馈抑制控制机制和生物合成酶可被靶向以供宿主细胞中的缓解。宿主细胞可在细胞天然的一个或多个生物合成酶基因中包含一个或多个反馈抑制缓解突变。一个或多个突变可位于其中生物合成酶受到调节控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因可编码选自3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶和分支酸变位酶的一种或多种酶。在一些实施方案中,一个或多个生物合成酶基因编码3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶。在一些情况下,一个或多个生物合成酶基因可编码分支酸变位酶。在某些情况下,一个或多个反馈抑制缓解突变可存在于选自aro4和aro7的生物合成酶基因中。在某些情况下,一个或多个反馈抑制缓解突变可存在于生物合成酶基因aro4中。在某些情况下,一个或多个反馈抑制缓解突变存在于生物合成酶基因aro7中。在一些实施方案中,工程化宿主细胞可在一个或多个生物合成酶基因(如表3中所述的那些基因之一)中包含一个或多个反馈抑制缓解突变。
可利用任何适宜数目和类型的突变来缓解反馈抑制控制机制。如本文所用的,术语“突变”是指相对于参考序列或基序,氨基酸残基或核苷酸残基的缺失、插入或置换。突变可作为原始基因座处的天然基因的定向突变而并入。在一些情况下,突变可作为在单独基因座处作为遗传整合引入的基因的另外拷贝或作为附加型载体如2μ或着丝粒质粒上的另外拷贝而并入。在某些情况下,酶的反馈抑制性拷贝处于天然细胞转录调节下。在一些情况下,通过将酶的反馈抑制性拷贝置于合成启动子的控制下,从而在工程化的蛋白质表达的组成型或动态调节的情况下引入所述拷贝。
在某些实施方案中,一个或多个反馈抑制缓解突变可存在于aro4基因中。感兴趣的aro4突变可包括但不限于在229位上用亮氨酸置换赖氨酸残基、在166位上用赖氨酸残基置换谷氨酰胺残基,或者如hartmannm等人((2003)procnatlacadsciusa100(3):862-867)或fukuda等人((1992)jfermentbioeng74(2):117-119)所述的突变。在一些情况下,赋予反馈抑制的突变可选自酶突变体的诱变文库。此类选择的实例可包括用过量的酪氨酸拯救培养基中的o-氟-d,l-苯丙氨酸突变酵母菌株的生长或aro3突变酵母菌株的生长,如fukuda等人((1990)breedingofbrewingyeastproducingalargeamountofbeta-phenylethylalcoholandbeta-phenylethylacetate.agrbiolchemtokyo54(1):269-271)所述。
在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个乃至15个或更多个反馈抑制缓解突变,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个反馈抑制缓解突变。
转录调节修饰
宿主细胞可包含所述细胞的一个或多个生物合成酶基因的一个或多个转录调节修饰(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个修饰)。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。细胞的任何适宜的生物合成酶基因可被靶向以供转录调节。转录调节意指相对于对照细胞(例如,未修饰的细胞)调节修饰的细胞中的感兴趣的基因的表达,例如,增加或减少、增强或阻遏。在一些情况下,感兴趣的基因的转录调节包括增加或增强表达。增加或增强表达意指相比于对照,即未修饰的相同细胞中的表达,感兴趣的基因的表达水平增加2倍或更多,诸如5倍或更多,且有时25、50或100倍或更多,并且在某些实施方案中300倍或更多或者更高(例如,通过使用任何适宜的基因表达测定)。或者,在细胞中的感兴趣的基因的表达低至不可检测的情况下,如果表达被增加至可易于检测的水平,则感兴趣的基因的表达水平被认为增加。在某些情况下,感兴趣的基因的转录调节包括减少或阻遏表达。减少或阻遏表达意指相比于对照,感兴趣的基因的表达水平减少2倍或更多,诸如5倍或更多,且有时25、50或100倍或更多,并且在某些实施方案中300倍或更多或者更高。在一些情况下,表达被减少至不可检测的水平。可适于在主题宿主细胞中使用的感兴趣的宿主细胞过程的修饰描述于smolke等人的美国公开号20140273109(14/211,611)中,其公开内容通过引用以其全文并入本文。
任何适宜的生物合成酶基因可被转录调节,并且包括但不限于,图2中所述的那些生物合成酶。具体而言,图2示出了根据本发明的实施方案,用于将葡萄糖转化为4-hpa、多巴胺和3,4-dhpa的生物合成方案。图2中所述的酶的实例包括aro3、aro4、aro1、aro7、tyr1、tyr、tyrh、dodc、mao、aro10、aro9、aro8和tkl。在一些情况下,一个或多个生物合成酶基因可选自aro10、aro9、aro8和tkl。在一些情况下,一个或多个生物合成酶基因可以是aro10。在某些情况下,一个或多个生物合成酶基因可以是aro9。在一些实施方案中,一个或多个生物合成酶基因可以是tkl。在一些实施方案中,宿主细胞包含对一个或多个基因(如表3中描述的那些基因之一)的一个或多个转录调节修饰。
在一些实施方案中,转录调节修饰可包括用强启动子置换一个或多个生物合成酶基因的天然启动子,或在强启动子的控制下表达基因的另外的拷贝。驱动感兴趣的基因的表达的启动子可以是组成型启动子或诱导型启动子,条件是所述启动子在宿主细胞中可以是活性的。感兴趣的基因可由其天然启动子表达。另外地或备选地,感兴趣的基因可由非天然启动子表达。虽然不是必要的,但此类启动子在使用它们的宿主中可以是中等至高强度的。启动子可以是受调节的或组成型的。在一些实施方案中,可使用不受葡萄糖阻遏的启动子或者在培养基中存在葡萄糖时仅受轻微阻遏的启动子。存在多种合适的启动子,所述启动子的实例包括糖酵解基因的启动子,如枯草芽孢杆菌tsr基因(编码果糖二磷酸醛缩酶)的启动子或来自酵母酿酒酵母的gapdh(编码甘油醛-磷酸脱氢酶)启动子(bitterg.a.,meth.enzymol.152:673-684(1987))。其他感兴趣的强启动子包括但不限于面包酵母的adhi启动子(ruohonenl.等人,j.biotechnol.39:193-203(1995))、磷酸盐饥饿诱导的启动子如酵母的pho5启动子(hinnen,a.等人,inyeastgeneticengineering,barr,p.j.等人编著,butterworths(1989))、来自地衣芽孢杆菌(b.licheniformis)的碱性磷酸酶启动子(lee.j.w.k.等人,j.gen.microbiol.137:1127-1133(1991))、gpd1和tef1。感兴趣的酵母启动子包括但不限于诱导型启动子如gal1-10、gal1、gall、gals,阻遏型启动子met25、teto,以及组成型启动子如甘油醛3-磷酸脱氢酶启动子(gpd)、醇脱氢酶启动子(adh)、翻译延长因子-1-α启动子(tef)、细胞色素c-氧化酶启动子(cyc1)、mrp7启动子等。在一些情况下,强启动子为gpd1。在某些情况下,强启动子为tef1。含有可被激素如糖皮质激素、类固醇和甲状腺激素诱导的启动子的自主复制型酵母表达载体也是已知的,并且包括但不限于糖皮质激素反应性元件(gre)和甲状腺激素反应性元件(tre),参见例如,美国专利号7,045,290中描述的那些启动子。可使用含有组成型或诱导型启动子如α因子、醇氧化酶和pgh的载体。另外,任何启动子/增强子组合(根据真核启动子数据库epdb)也可用于驱动感兴趣的基因的表达。应当理解,可选择对宿主细胞具有特异性的任何适宜的启动子,例如大肠杆菌。在一些情况下,可使用启动子选择来优化转录,并因此优化酶水平以使产生最大化,同时使能源最小化。
失活突变
工程化宿主细胞可包含所述细胞的酶的一个或多个失活突变(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个)。包含一个或多个失活突变可修饰工程化宿主细胞的合成途径的通量以增加感兴趣的bia或者产生所述bia的期望的酶或前体的水平。在一些实例中,一个或多个失活突变针对对于细胞天然的酶。另外地或备选地,一个或多个失活突变针对对于细胞非天然的酶。如本文所用的,“失活突变”意指细胞的基因或调节性dna序列的一个或多个突变,其中所述突变使由所述感兴趣的基因表达的蛋白质的生物活性失活。在一些情况下,基因对于细胞是天然的。在一些情况下,所述基因编码失活的酶,并且该酶是由宿主细胞产生的感兴趣的bia的合成途径的一部分或与所述合成途径连接。在一些情况下,失活突变位于控制感兴趣的基因的调节性dna序列中。在某些情况下,失活突变针对基因的启动子。任何适宜的突变(例如,如本文所述)可用于使感兴趣的基因或调节性dna序列失活。“失活的”或“失活”意指相对于由未突变的对照基因表达的对照蛋白质,由突变基因表达的蛋白质的生物活性被降低10%或更多,诸如20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多、97%或更多或者99%或更多。在一些情况下,蛋白质是酶,并且失活突变降低酶的活性。
在一些实例中,工程化宿主细胞在对于细胞天然的酶中包含失活突变。任何适宜的酶可被靶向以供失活。感兴趣的酶可包括但不限于在表3中所述的那些酶,所述酶在工程化宿主细胞的合成途径中的作用倾向于降低感兴趣的bia的水平。在一些情况下,所述酶具有葡萄糖-6-磷酸脱氢酶活性。在某些实施方案中,包含失活突变的酶是zwf1。在一些情况下,所述酶具有醇脱氢酶活性。在一些实施方案中,包含失活突变的酶选自选自adh2、adh3、adh4、adh5、adh6、adh7和sfa1。在某些实施方案中,包含失活突变的酶是adh2。在某些实施方案中,包含失活突变的酶是adh3。在某些实施方案中,包含失活突变的酶是adh4。在某些实施方案中,包含失活突变的酶是adh5。在某些实施方案中,包含失活突变的酶是adh6。在某些实施方案中,包含失活突变的酶是adh7。在一些情况下,所述酶具有醛氧化还原酶活性。在某些实施方案中,包含失活突变的酶选自ald2、ald3、ald4、ald5和ald6。在某些实施方案中,包含失活突变的酶是ald2。在某些实施方案中,包含失活突变的酶是ald3。在某些实施方案中,包含失活突变的酶是ald4。在某些实施方案中,包含失活突变的酶是ald5。在某些实施方案中,包含失活突变的酶是ald6。在一些实施方案中,宿主细胞包含表3中描述的一个或多个基因的一个或多个失活突变。
差向异构化修饰
本文提供的一些方法、过程和系统描述了(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化是底物向多种范围的生物碱的转化的关键步骤。在一些实例中,(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化包括差向异构化反应。在一些实例中,(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化包括经由工程化差向异构酶的差向异构化反应。在一些情况下,底物生物碱的差向异构化可通过以下方式进行:将(s)-底物氧化成对应的席夫碱(schiffbase)或亚胺中间体,然后将该中间体立体定向地还原为(r)-产物(如图3中所提供和方案1中大致表示的)。如方案1中所提供的,r1、r2、r3和r4可以是h或ch3。r5可以是h、oh或och3。
方案1
在一些实例中,(s)-底物向(r)-产物的转化可涉及至少一个氧化反应和至少一个还原反应。在一些情况下,任选地在氧化反应之后进行还原反应。在一些情况下,氧化反应和还原反应中的至少一个在酶的存在下进行。在一些情况下,氧化反应和还原反应中的至少一个通过酶催化。在一些情况下,氧化反应和还原反应两者均在至少一种酶的存在下进行。在一些情况下,至少一种酶可用于催化氧化反应和还原反应。氧化反应和还原反应可由相同的酶催化。在一些情况下,氧化和还原反应中的至少一种由工程化差向异构酶催化。在一些情况下,氧化和还原反应均在工程化的融合差向异构酶的存在下进行。在一些情况下,氧化和还原反应分别均在具有分别表达的氧化酶组分和还原酶组分的工程化拆分差向异构酶的存在下进行。在一些情况下,工程化差向异构酶可用于催化氧化和还原反应。氧化和还原反应可由相同的工程化差向异构酶催化。
在本文所述的一些方法、过程和系统中,氧化反应可在酶的存在下进行。在一些实例中,该酶可以是氧化酶。在一些实例中,该酶可以是工程化差向异构酶的一部分。在一些实例中,该工程化差向异构酶可具有氧化酶组分。在一些情况下,该氧化酶组分可以是工程化的融合差向异构酶的组分。在一些情况下,该氧化酶组分可以独立地表达为工程化拆分差向异构酶的一部分。氧化酶可使用(s)-1-苄基异喹啉作为底物。氧化酶可将(s)-底物转化为对应的亚胺或席夫碱衍生物。氧化酶可被称为1,2-脱氢牛心果碱合酶(drs)。适用于本公开的(s)-1-苄基异喹啉生物碱的氧化的酶的非限制性实例包括细胞色素p450氧化酶、2-氧戊二酸依赖性氧化酶和黄素蛋白氧化酶。例如,(s)-四氢原小檗碱氧化酶(stox,e.c1.3.3.8)可将(s)-去甲牛心果碱和其他(s)-1-苄基异喹啉生物碱氧化为1,2-脱氢去甲牛心果碱和其它对应的1,2-脱氢产物。在一些实例中,包含前述实例中的任一个的氧化酶结构域的蛋白质可进行氧化。在一些实例中,氧化酶可催化宿主细胞(诸如如本文所述的工程化宿主细胞)内的氧化反应。
在一些实例中,还原反应可在氧化反应之后进行。在一些实例中,还原反应可通过酶进行。在一些实例中,还原反应可以通过作为工程化差向异构酶的一部分的酶来进行。在一些实例中,还原酶可使用衍生自1-苄基异喹啉的亚胺或席夫碱作为底物。还原酶可将亚胺或席夫碱衍生物转化为(r)-1-苄基异喹啉。还原酶可被称为1,2-脱氢牛心果碱还原酶(drr)。适用于衍生自(s)-1-苄基异喹啉生物碱的亚胺或席夫碱的还原的酶的非限制性实例包括醛酮还原酶(例如,可待因酮还原酶样酶(ec1.1.1.247))和短链脱氢酶(例如,沙罗泰里啶还原酶样酶(ec1.1.1.248))。在一些实例中,包含前述实例中的任一个的还原酶结构域的蛋白质可进行还原。在进一步的实施方案中,还原是立体定向的。在一些实例中,还原酶可催化宿主细胞(诸如如本文所述的工程化宿主细胞)内的还原反应。
可进行将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构化反应的酶的实例包括具有氧化酶结构域和还原酶结构域的差向异构酶。具体而言,差向异构酶可具有细胞色素p450氧化酶82y2样结构域。另外,差向异构酶可具有可待因酮还原酶样结构域。此外,具有细胞色素p450氧化酶82y2样结构域并且还具有可待因酮还原酶样结构域的差向异构酶可被称为drs-drr酶。特别是,drs-drr酶可以是作为融合差向异构酶的融合酶。此外,当通过至少一个增加活性的修饰来修饰drs-drr酶时,该融合酶可以是工程化的融合差向异构酶。
可用于进行(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化的drs-drr酶的氨基酸序列的实例提供于图4中。具体而言,图4示出了根据本发明实施方案的drs-drr酶的氨基酸序列。如图4所示,下划线的文本表示细胞色素p450cyp82y2样结构域(与afb74617.1具有59%同一性)。点状下划线的文本表示醛酮还原酶nadph依赖性可待因酮还原酶样结构域(与acm44066.1具有75%同一性)。drs-drr酶的另外的氨基酸序列在表1中阐述。用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构酶的氨基酸序列可以与表1中列出的给定氨基酸序列75%或以上相同。例如,这样的差向异构酶的氨基酸序列可包含与本文提供的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
可以提供工程化宿主细胞,其产生将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构酶,其中该差向异构酶包含选自下组的氨基酸序列:seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14和15。可以回收并纯化在工程化宿主细胞内产生的差向异构酶,以便形成生物催化剂。在一些情况下,差向异构酶可以拆分成一种或多种酶。另外,可从工程化宿主细胞中回收通过拆分差向异构酶产生的一种或多种酶。由拆分差向异构酶产生的这一种或多种酶也可以用来催化(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化。具体而言,从产生差向异构酶的工程化宿主细胞中回收的一种或多种酶可以在将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的过程中使用。该过程可以包括使(s)-1-苄基异喹啉生物碱与足以将所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的量的差向异构酶接触。在实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,使得至少5%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。在进一步的实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。
在图4中提供了可用来执行将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的drs-drr酶的氨基酸序列的实例。特别是,图4示出了根据本发明的实施方案,已经被密码子优化的drs-drr酶的氨基酸序列。此外,图5示出了氧化酶部分和还原酶部分的拆分,各自属于图4的drs-drr酶。表1中列出了drs-drr酶的其他氨基酸序列。在将(s)-1-苄基异喹啉碱生物碱转化为(r)-1-苄基异喹啉碱生物碱中使用的差向异构酶的氨基酸序列与表1所列的给定氨基酸序列可以75%或以上相同。例如,这样的差向异构酶的氨基酸序列可以包含与本文提供的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
同源差向异构酶的氨基酸残基可以根据seqidno.16的编号方案来引用,该编号系统在整个公开中用来指代与seqidno.16同源的差向异构酶的特定氨基酸残基。与seqidno.16同源的差向异构酶可以与seqidno.16具有至少约70%、75%、80%、85%、90%、95%、97%、98%或99%的序列同一性。在一些情况下,在同源差向异构酶中被称为位置50的氨基酸可能不是同源差向异构酶中的第50个氨基酸,而是在同源差向异构酶与seqidno.16的蛋白质比对中对应于seqidno.16中第50位氨基酸的氨基酸。在一些情况下,同源酶可以根据一级序列、二级结构或三级结构与seqidno.16进行比对。
可以提供工程化宿主细胞,其产生将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的工程化差向异构酶,其中该差向异构酶包含选自下组的氨基酸序列:seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17和18,并且具有一个或多个增强活动的修饰。可以回收并纯化在工程化宿主细胞内产生的差向异构酶,以便形成生物催化剂。在一些情况下,差向异构酶可以拆分成一种或多种酶。另外,可从工程化宿主细胞中回收通过拆分差向异构酶产生的一种或多种酶。由拆分差向异构酶产生的这一种或多种酶也可以用来催化(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的转化。另外,与利用融合的差向异构酶在细胞内产生苄基异喹啉生物碱产物相比,工程化的拆分差向异构酶的使用可以用来增加细胞内苄基异喹啉生物碱产物的产生。
在另外的情况下,从产生差向异构酶的工程化宿主细胞中回收的一种或多种酶可以在将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的过程中使用。该过程可以包括使(s)-1-苄基异喹啉生物碱与足以将所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的量的差向异构酶接触。在实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,以使至少5%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。在进一步的实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。
可用来将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可在体外接触(s)-1-苄基异喹啉生物碱。另外地或备选地,可用来将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可在体内接触(s)-1-苄基异喹啉生物碱。另外,可用来将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可提供给在其中具有(s)-1-苄基异喹啉生物碱的细胞,或者可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中(s)-底物到(r)-产物的差向异构化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为(r)-1-苄基异喹啉生物碱。在其他实施方案中,所产生的生物碱衍生自(r)-1-苄基异喹啉生物碱,包括例如,4环原吗啡喃和5环吗啡喃生物碱。在另一个实施方案中,(s)-1-苄基异喹啉生物碱是去往工程化宿主细胞的产物的中间体。在另外其他的实施方案中,该生物碱产物选自1-苄基异喹啉、吗啡喃、原吗啡喃、去甲阿片样或nal-阿片样生物碱。
在一些实例中,(s)-底物为选自下组的(s)-1-苄基异喹啉生物碱:(s)-去甲牛心果碱、(s)-牛心果碱、(s)-四氢罂粟碱、(s)-去甲乌药碱、(s)-乌药碱、(s)-n-甲基乌药碱、(s)-3’-羟基-n-甲基乌药碱、(s)-去甲异东罂粟灵、(s)-东罂粟灵、(s)-异东罂粟灵、(s)-去甲原青藤碱((s)-norprotosinomenine)、(s)-原青藤碱、(s)-全去甲劳丹碱、(s)-全劳丹碱、(s)-4’-o-甲基全劳丹碱、(s)-6-o-甲基全去甲劳丹碱、(s)-4’-o-甲基全去甲劳丹碱。
在一些实例中,(s)-底物为式i的化合物:
或其盐,其中:
r1、r2、r3和r4独立地选自氢和甲基;且
r5选自氢、羟基和甲氧基。
在一些其他实例中,r1、r2、r3、r4和r5中的至少一个为氢。
在其他实例中,(s)-底物为式ii的化合物:
或其盐,其中:
r3选自氢和c1-c4烷基;
r6和r7在每次出现时独立地选自羟基、氟、氯、溴、甲醛、c1-c4酰基、c1-c4烷基和c1-c4烷氧基;
n为0、1、2、3或4;且
n’为0、1、2、3、4或5。
当键画在整个环上时,意指取代可发生在非特异性环原子或位置处。例如,在以上所示的式ii中,6元环中的任何-ch-的氢可用r7取代,形成-cr7-。
在一些实例中,r6和r7独立地为甲基或甲氧基。在一些其他实例中,n和n’独立地为1或2。在其他实施方案中,r3为氢或甲基。
在一些实例中,所述方法提供了由(s)-牛心果碱产生生物碱产物的工程化宿主细胞。(s)-牛心果碱向(r)-牛心果碱的差向异构化可构成由前体产生各种生物碱产物的关键步骤。在一些实例中,前体为l-酪氨酸或糖(例如,葡萄糖)。各种生物碱产物可包括但不限于1-苄基异喹啉、吗啡喃、原吗啡喃、去甲阿片样或nal-阿片样生物碱。
可使用任何合适的碳源作为去往差向异构化的1-苄基异喹啉生物碱的前体。合适的前体可包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些实例中,可使用来自可再生原料的未纯化的混合物(例如,玉米浆液、甜菜糖蜜、大麦麦芽、生物质水解产物)。在其他实施方案中,碳前体可以是一碳化合物(例如,甲醇、二氧化碳)或二碳化合物(例如,乙醇)。在其他实施方案中,可利用其他含碳化合物,例如,甲胺、葡糖胺和氨基酸(例如,l-酪氨酸)。在一些实例中,可将1-苄基异喹啉生物碱直接添加到本发明的工程化宿主细胞,该1-苄基异喹啉生物碱包括例如全去甲劳丹碱、全劳丹碱、去甲牛心果碱和牛心果碱。在进一步的实施方案中,1-苄基异喹啉生物碱可作为单一对映体(例如,(s)-1-苄基异喹啉生物碱)或对映体的混合物(包括例如外消旋混合物)添加到工程化宿主细胞。
在一些实例中,所述方法提供1-苄基异喹啉生物碱或其衍生物的立构中心的差向异构化。在进一步的实施方案中,该方法包括使1-苄基异喹啉生物碱与至少一种酶接触。所述至少一种酶可将1-苄基异喹啉生物碱或其衍生物的立构中心的立体化学反转为相反的立体化学。在一些实例中,所述至少一种酶将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。在利用至少一种酶的(s)-1-苄基异喹啉生物碱向(r)-1-苄基异喹啉生物碱的这种转化的一些实例中,(s)-1-苄基异喹啉生物碱选自(s)-去甲牛心果碱、(s)-牛心果碱、(s)-四氢罂粟碱、(s)-去甲乌药碱、(s)-乌药碱、(s)-n-甲基乌药碱、(s)-3’-羟基-n-甲基乌药碱、(s)-去甲异东罂粟灵、(s)-东罂粟灵、(s)-异东罂粟灵、(s)-去甲原青藤碱、(s)-原青藤碱、(s)-全去甲劳丹碱、(s)-全劳丹碱、(s)-4’-o-甲基全劳丹碱、(s)-6-o-甲基全去甲劳丹碱和(s)-4’-o-甲基全去甲劳丹碱。
在其他实施方案中,差向异构化的1-苄基异喹啉生物碱可包含两个或更多个立构中心,其中两个或更多个立构中心中的仅一个被反转以产生底物的非对映体(例如,(s,r)-1-苄基异喹啉生物碱转化为(r,r)-1-苄基异喹啉生物碱)。在其中当与至少一种酶接触时1-苄基异喹啉生物碱的仅一个立构中心反转的实例中,产物被称为1-苄基异喹啉生物碱的差向异构体。
在一些实例中,1-苄基异喹啉生物碱作为单一立体异构体呈现给酶。在一些其他实例中,1-苄基异喹啉生物碱作为立体异构体的混合物呈现给酶。在进一步的实施方案中,立体异构体的混合物可以是外消旋混合物。在一些其他实例中,立体异构体的混合物可以与另一立体异构体相比富集一种立体异构体。
在一些实例中,回收1-苄基异喹啉生物碱或其衍生物。在一些实例中,从细胞培养物中回收1-苄基异喹啉生物碱。在进一步的实施方案中,相较于呈现给酶的1-苄基异喹啉生物碱的原始混合物,回收的1-苄基异喹啉生物碱在对映体方面富集一种立体异构体。在进一步的实施方案中,回收的1-苄基异喹啉生物碱具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的对映体过量。
在一些实例中,回收原吗啡喃或其衍生物。在一些实例中,从细胞培养物中回收原吗啡喃。
在一些实例中,回收吗啡喃或其衍生物。在一些实例中,从细胞培养物中回收吗啡喃。
在一些实例中,回收nal-阿片样物质或其衍生物。在一些实例中,从细胞培养物中回收nal-阿片样物质。
在一些实例中,回收去甲阿片样物质或其衍生物。在一些实例中,从细胞培养物中回收去甲阿片样物质。
“异构体”是具有相同分子式的不同化合物。“立体异构体”是仅在原子的空间布置方式上不同的异构体。“对映体”是一对彼此为不可重叠的镜像的立体异构体。一对对映体的1:1混合物为“外消旋”混合物。“非对映异构体”或“非对映体”是具有至少两个不对称原子但是彼此不互为镜像的立体异构体。如本文所用的术语“差向异构体”是指具有相同的化学式,但是在特定位置处具有不同的光学构型的化合物。例如,化合物的(r,s)和(s,s)立体异构体为彼此的差向异构体。在一些实例中,1-苄基异喹啉生物碱被转化为其差向异构体(例如,差向异构-1-苄基异喹啉生物碱)。绝对立体化学根据cahn-ingold-prelogr-s系统规定。当化合物为纯对映体时,每个手性碳处的立体化学可被规定为r或s。其绝对构型未知的拆分化合物可根据它们在钠d线波长处旋转平面偏振光的方向(右旋或左旋)而指定为(+)或(-)。本文所述的某些化合物包含一个或多个非对称中心,因此可产生对映体、非对映体,以及就绝对立体化学而言可被定义为(r)-或(s)-的其他立体异构形式。
表1.drs-drr酶、拆分的drs和drr酶的示例性氨基酸序列以及其他核苷酸序列。
吗啡喃生物碱生成修饰
本文提供的一些方法、过程和系统描述了原吗啡喃生物碱向吗啡喃生物碱的转化。这些方法、过程和系统中的一些描述了四环支架向五环支架的转化(图20)。一些方法、过程和系统可以包括工程化的宿主细胞。在一些实例中,描述了由四环前体或原吗啡喃生物碱产生五环蒂巴因或吗啡喃生物碱。在一些实例中,原吗啡喃生物碱向蒂巴因的转化是底物向多种范围的苄基异喹啉生物碱的转化的关键步骤。
在一些实例中,四环前体可以是沙罗泰里啶、沙罗泰里啶醇或沙罗泰里啶醇-7-o-乙酸。通过关闭c-4与c-5之间的氧化物桥,可以将四环前体转化为五环蒂巴因。在一些实例中,可以通过在c-7处的逐步羟基化和o-乙酰化来制备用于闭环的四环前体沙罗泰里啶。可以通过消除乙酸酯离去基团来激活闭环。在一些实例中,自发地发生生成蒂巴因的烯丙基消除和氧化物环闭合。在其他实例中,诸如ph或溶剂等因素促进生成五环蒂巴因的闭环反应。在其他实例中,通过与蛋白质或酶接触促进生成蒂巴因的闭环反应。这些转化步骤在图14中提供,并在方案2中大致表示。r1、r2和r3可以是h或ch3。r4可以是ch3、ch3ch2、ch3ch2ch2或其他合适的烷基。在一些情况下,r1、r2、r3和r4可以是如图14中提供的ch3。
方案2
在一些实例中,制备四环前体的第一种酶是沙罗泰里啶还原酶(salr)。在一些情况下,salr在c-7位处羟基化底物沙罗泰里啶(参见式iii)。该反应的产物可以是一种或多种沙罗泰里啶醇差向异构体。在一些实例中,产物是(7s)-沙罗泰里啶醇。在一些实例中,如本文所述,沙罗泰里啶还原酶可催化宿主细胞如工程化宿主内的还原反应。
在一些实例中,制备四环前体的第二种酶是沙罗泰里啶醇7-o-乙酰基转移酶(salat)。在一些情况下,salat将乙酰基从乙酰辅酶a转移至沙罗泰里啶醇的7-oh(参见式iv)。在其他情况下,salat可以利用新型辅因子如正丙酰基辅酶a,并将丙酰基转移至沙罗泰里啶醇的7-oh。在一些实例中,salat的产物是(7s)-沙罗泰里啶醇-7-o-乙酸。在一些实例中,如本文所述,沙罗泰里啶醇7-o-乙酰基转移酶可催化宿主细胞如工程化宿主内的乙酰基转移反应。
在一些实例中,蒂巴因的四环前体是(7s)-沙罗泰里啶醇-7-o-乙酸。在一些实施例中,(7s)-沙罗泰里啶醇-7-o-乙酸不稳定并且自发地消除c-7处的乙酸酯并关闭c-4与c-5之间的氧化物桥以形成蒂巴因(参见式v)。在一些实例中,通过ph促进乙酸酯离去基团的消除速率。在一些实例中,用具有蒂巴因合酶活性的酶或蒂巴因合酶催化烯丙基消除和氧化物桥关闭。在一些实例中,该酶是betv1折叠蛋白。在一些实例中,该酶是工程化的蒂巴因合酶、工程化的salat、指挥(dirigent,dir)蛋白或查耳酮异构酶(chi)。在一些实例中,如本文所述,编码蒂巴因合酶活性的酶可以催化宿主细胞如工程化宿主内的闭环反应。
在一些实例中,沙罗泰里啶还原酶可以是生物合成蒂巴因的毛茛目(ranunculales)植物如罂粟中的salr或salr样酶,例如罂粟。在其他实例中,具有沙罗泰里啶还原酶活性的酶可以来自生物合成内源性吗啡的哺乳动物或其他任何脊椎动物或无脊椎动物。
在一些实例中,沙罗泰里啶醇7-o-乙酰基转移酶可以是生物合成蒂巴因的毛茛目植物如罂粟中的salat或salat样酶。在其他实例中,具有沙罗泰里啶醇7-o-乙酰基转移酶活性的酶可以来自生物合成内源性吗啡的哺乳动物或其他任何脊椎动物或无脊椎动物。
在一些实例中,蒂巴因合酶可以是来自生物合成蒂巴因的毛茛目植物如罂粟的betv1折叠蛋白。在一些实例中,betv1蛋白以从n端到c端的顺序包括以下结构域:β-链、一个或两个α-螺旋、六个β-链和一个或两个α-螺旋。蛋白质的组织方式使其具有betv1折叠和活性位点,该活性位点接纳大的、大体积的疏水分子,如吗啡喃生物碱。该蛋白质可以是任何植物betv1蛋白,与发病机理有关的10蛋白(pr-10),主要胶乳蛋白(mlp),水果或花粉变应原,植物激素结合蛋白(例如与细胞分裂素或油菜素类固醇结合),植物聚酮化合物环化酶样蛋白,或具有betv1折叠的去甲乌药碱合酶(ncs)相关蛋白。betv1折叠蛋白的其他非植物实例是聚酮化合物环化酶、hsp90atp酶激活物同源物1(aha1)蛋白、smu440样蛋白(例如,来自变异链球菌(streptococcusmutans))、pa1206相关蛋白(例如,来自铜绿假单胞菌(pseudomonasaeruginosa))、calc加利车霉素抗性蛋白(例如,来自棘孢小单孢菌(micromonosporaechinospora))以及来自代谢一氧化碳的食羧假单胞菌(oligotrophacarboxidovorans)的coxg蛋白。来自betv1相关家族的其他实例包括start脂质转移蛋白、磷脂酰肌醇转移蛋白和环羟化酶。
在一些实例中,蒂巴因合酶可以是来自生物合成蒂巴因的毛茛目植物如罂粟的指挥蛋白。在其他实例中,该酶可以是来自植物的任何指挥蛋白。
在一些实例中,蒂巴因合酶可以是来自生物合成蒂巴因的毛茛目植物如罂粟的查耳酮异构酶蛋白。在其他实例中,该酶可以是来自植物的任何查耳酮异构酶蛋白。
在一些实例中,蒂巴因合酶可以是来自生物合成蒂巴因的毛茛目植物如罂粟的salat样酶。在其他实例中,该酶可以是来自植物的任何salat样蛋白。
在一些实例中,具有蒂巴因合酶活性的酶可以来自生物合成内源性吗啡的哺乳动物或其他任何脊椎动物或无脊椎动物。
在一些实例中,以上酶与另外的辅助蛋白质的任何组合可以起到将任何四环前体转化成蒂巴因的作用。在一些实例中,如本文所述,这些酶催化宿主细胞如工程化宿主内的反应。
表2列出了蒂巴因合酶活性的氨基酸序列的实例。在蒂巴因的四环前体中使用的蒂巴因合酶的氨基酸序列可以与表2中列出的给定氨基酸序列45%或以上相同。例如,这样的蒂巴因合酶的氨基酸序列可包含与本文提供的氨基酸序列至少45%或以上、46%或以上、47%或以上、48%或以上、49%或以上、50%或以上、51%或以上、52%或以上、53%或以上、54%或以上、55%或以上、56%或以上、57%或以上、58%或以上、59%或以上、60%或以上、61%或以上、62%或以上、63%或以上、64%或以上、65%或以上、66%或以上、67%或以上、68%或以上、69%或以上、70%或以上、71%或以上、72%或以上、73%或以上、74%或以上、75%或以上、76%或以上、77%或以上、78%或以上、79%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
可以提供工程化宿主细胞,其产生沙罗泰里啶还原酶、沙罗泰里啶醇7-o-乙酰基转移酶和将四环前体转化为蒂巴因的蒂巴因合酶,其中该蒂巴因合酶包含选自seqidno:30、31、32、33、34、35、36和37的氨基酸序列。在一些情况下,蒂巴因合酶可与其他酶形成融合蛋白。可以回收并纯化在工程化宿主细胞内产生的酶,以形成生物催化剂。这一种或多种酶还可用来催化四环原吗啡喃前体向蒂巴因的转化。
在其他实例中,蒂巴因合酶包含选自seqidno:38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60和61的氨基酸序列。
在另外的情况下,从工程化宿主细胞中回收的所述一种或多种酶可以在将四环原吗啡喃前体转化为蒂巴因的过程中使用。该过程可以包括使四环原吗啡喃前体与足以将所述四环原吗啡喃前体转化为蒂巴因的量的回收的酶接触。在实例中,四环原吗啡喃前体可与足量的所述一种或多种酶接触,使得至少5%的所述四环原吗啡喃前体转化为蒂巴因。在进一步的实例中,四环原吗啡喃前体可与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述四环原吗啡喃前体转化为蒂巴因。
在一些实例中,实施工艺条件以支持工程化宿主细胞中蒂巴因的形成。在一些情况下,工程化宿主细胞在ph3.3下生长,一旦达到高细胞密度,就将ph调节至ph8.0,以支持在较高ph下继续生产蒂巴因。在一些情况下,工程化宿主细胞会产生其他酶,以将糖和其他简单的前体(例如酪氨酸)转化为蒂巴因。在一些情况下,已对salat酶进行了改造,使其在ph8.0时具有较高的活性,并从晚期启动子表达。
在一些实例中,将四环原吗啡喃前体转化为蒂巴因的一种或多种酶位于细胞区室中。在一些实例中,可以修饰salr、salat和betv1,使得它们编码靶向序列,所述靶向序列将它们定位于工程化宿主细胞的内质网膜上(参见例如wo2014143744)。在其他实例中,salat和betv1可以共定位到单个蛋白质融合物中。在一些实例中,通过几种方法之一在salat与betv1之间创建融合,包括直接融合,共定位到酵母细胞器,或通过酶共定位工具如亮氨酸拉链,利用衔接子结构域的蛋白质支架,或利用适体的rna支架。蒂巴因合成酶的共定位可促进酶活性位点之间的底物通道化,并限制不稳定的中间体如沙罗泰里啶醇-7-o-乙酸的扩散。
在一些实例中,工程化的沙罗泰里啶醇7-o-乙酰基转移酶(salat)在将四环原吗啡喃前体转化为蒂巴因中使用。在一些实例中,salat酶被工程化为组合两种功能:(1)酰基从乙酰辅酶a转移至沙罗泰里啶醇的7-oh,和(2)随后消除乙酰基并关闭碳c4与c5之间的氧化物桥,以形成蒂巴因。
在一些实例中,具有沙罗泰里啶醇7-o-乙酰基转移酶活性的酶与betv1折叠的肽融合。在一些实例中,沙罗泰里啶醇7-o-乙酰基转移酶和betv1折叠蛋白可以以从n端至c端、c端至n端、n端至n端或c端至c端的顺序融合。在一些实例中,两个蛋白质序列可以直接融合或通过肽接头区融合。
在一些实例中,通过环状排列将具有沙罗泰里啶醇7-o-乙酰基转移酶活性的酶与具有betv1折叠的肽融合。在一些情况下,salat的n端和c端融合在一起,然后将betv1序列随机插入该序列内。在一些情况下,针对蒂巴因的产生筛查所得的融合蛋白文库。在其他情况下,首先在不存在betv1的情况下针对活性筛查循环排列salat文库。在其他情况下,salat的n端和c端融合在一起,然后对酶进行消化和平端克隆。在其他情况下,针对沙罗泰里啶醇7-o-乙酰基转移酶活性筛查该环状排列的salat文库。在其他情况下,来自环状排列的salat文库的活性变体然后用来设计与具有betv1折叠的肽的蛋白质融合物。
可用来将四环原吗啡喃前体转化为蒂巴因的一种或多种酶可以在体外与四环原吗啡喃前体接触。另外地或备选地,可用来将四环原吗啡喃前体转化为蒂巴因的一种或多种酶可以在体内与四环原吗啡喃前体接触。另外,可用来将四环原吗啡喃前体转化为蒂巴因的一种或多种酶可以提供给在其内具有四环原吗啡喃前体的细胞,或者可以在工程化宿主细胞内产生。
在一些实例中,所述方法提供了产生生物碱产物的工程化宿主细胞,其中四环原吗啡喃前体向蒂巴因的转化可以包括产生生物碱产物中的关键步骤。在一些实例中,该生物碱产物是蒂巴因。在另外其他的实施方案中,该生物碱产物衍生自蒂巴因,包括例如下游吗啡喃生物碱。在另一个实施方案中,四环原吗啡喃前体是朝向工程化宿主细胞的产物的中间体。在另外其他的实施方案中,该生物碱产物选自吗啡喃、去甲阿片样或nal-阿片样生物碱。
在一些实例中,还原反应的底物是式iii化合物:
或其盐,其中:
r1、r2和r3独立地选自氢和甲基。
在一些其他实例中,r1、r2和r3为甲基,并且所述还原反应由沙罗泰里啶还原酶催化。
在一些实例中,碳链转移反应的底物是下式的化合物
或其盐,其中:
r1、r2和r3独立地选自氢和甲基。
在另一些实例中,r1、r2和r3为甲基,并且所述碳链转移反应由沙罗泰里啶醇7-o-乙酰基转移酶催化。
在一些实例中,蒂巴因合酶的底物是式v化合物:
或其盐,其中:
r1、r2和r3独立地选自氢和甲基;且
r4选自甲基、乙基、丙基和其他合适的烷基。
在另一些实例中,r1、r2和r3和r4为甲基,并且该闭环反应由蒂巴因合酶催化。在一些实例中,该蒂巴因合酶是betv1蛋白。
在一些实例中,所述方法提供了由沙罗泰里啶产生生物碱产物的工程化宿主细胞。沙罗泰里啶向蒂巴因的转化可包括从前体产生多种生物碱产物中的关键步骤。在一些实例中,该前体是l-酪氨酸或糖(例如葡萄糖)。所述多种生物碱产物可包括但不限于吗啡喃、去甲阿片样或nal-阿片样生物碱。
任何合适的碳源都可以用作五环吗啡喃生物碱的前体。合适的前体可包括但不限于单糖(例如葡萄糖、果糖、半乳糖、木糖)、寡糖(例如乳糖、蔗糖、棉子糖)、多糖(例如淀粉、纤维素)或其组合。在一些实例中,可使用来自可再生原料的未纯化的混合物(例如,玉米浆、甜菜糖蜜、大麦麦芽、生物质水解产物)。在另外其他的实施方案中,碳前体可以是一碳化合物(例如,甲醇、二氧化碳)或二碳化合物(例如,乙醇)。在另外其他的实施方案中,可以使用其他含碳化合物,例如甲胺、葡糖胺和氨基酸(例如l-酪氨酸)。在一些实例中,可以将1-苄基异喹啉生物碱直接添加到本发明的工程化宿主细胞中,包括例如全去甲劳丹碱、全劳丹碱、去甲牛心果碱和牛心果碱。
在一些实例中,回收苄基异喹啉生物碱产物或其衍生物。在一些实例中,从细胞培养物中回收苄基异喹啉生物碱产物。在一些实例中,苄基异喹啉生物碱产物是吗啡喃、去甲阿片样或nal-阿片样生物碱。
表2.吗啡喃生物碱生成酶的示例氨基酸序列。
bia生成修饰
一旦形成bia,bia可进行进一步衍生化或修饰。可利用由工程化宿主细胞产生的一种或多种酶衍生化或修饰bia。具体而言,可通过使bia与工程化宿主细胞产生的一种或多种酶接触来衍生化或修饰bia。另外地或备选地,可通过使bia与从工程化宿主细胞外部的来源提供给bia的一种或多种酶接触来衍生化或修饰bia。可用于衍生化或修饰bia的一种或多种酶可用于进行裁剪(tailoring)反应。裁剪反应的实例包括氧化、还原、o-甲基化、n-甲基化、o-脱甲基化、乙酰化、亚甲基二氧桥形成以及o,o-脱亚甲基化。可使用一种或多种裁剪反应衍生化或修饰bia。
裁剪反应的实例提供于表9中。在一些实例中,裁剪酶可用于催化在bia或其衍生物上进行的碳-碳偶联反应。可用于催化碳-碳偶联反应的裁剪酶的实例包括来自罂粟(papaversomniferum)、花菱草、日本黄连(coptisjaponica)、匍枝小檗、黄唐松草(thalictrumflavum)或另外物种的小檗碱桥酶(bbe);来自罂粟或另外物种的沙罗泰里啶合酶(salsyn);以及来自日本黄连或另外物种的紫堇块茎碱合酶(corsyn)。可通过裁剪酶催化的反应的非限制性实例在方案2中示出,其中ra、rb、rc和rd独立地选自氢、羟基、氟、氯、溴、甲醛、c1-c4酰基、c1-c4烷基和c1-c4烷氧基。在一些实例中,ra、rb及其所附接的碳原子任选地形成碳环或杂环。在一些实例中,rc、rd及其所附接的碳原子任选地形成碳环或杂环。
方案3
在一些实例中,裁剪酶可用于催化在bia或其衍生物上进行的氧化反应。可用于催化氧化反应的裁剪酶的实例包括来自日本黄连、蓟罂粟(argemonemexicana)、金花小檗(berberiswilsonae)或另外物种的四氢原小檗碱氧化酶(stox);来自罂粟或另外物种的二氢苯并菲啶氧化酶(dbox);来自罂粟或另外物种的甲基刺罂粟碱羟化酶(msh);以及来自罂粟、花菱草或另外物种的原阿片碱6-羟化酶(p6h)。
裁剪酶也可用于催化在bia或其衍生物上进行的亚甲基二氧桥形成反应。可用于催化亚甲基二氧桥形成反应的裁剪酶的实例包括来自罂粟、花菱草、蓟罂粟或另外物种的刺罂粟碱合酶(stysyn);来自罂粟、花菱草、蓟罂粟或另外物种的碎叶紫堇碱合酶(chesyn);以及来自黄唐松草、黄连(coptischinensis)或另外物种的坎那定合酶(cas)。
在其他实例中,裁剪酶可用于催化在bia或其衍生物上进行的o-甲基化反应。可用于催化o-甲基化反应的裁剪酶的实例包括来自罂粟、黄唐松草、日本黄连、大红罂粟或另外物种的去甲乌药碱6-o-甲基转移酶(6omt);来自罂粟、黄唐松草、日本黄连、黄连或另外物种的3’羟基-n-甲基乌药碱4’-o-甲基转移酶(4’omt);来自罂粟、花菱草或另外物种的牛心果碱7-o-甲基转移酶(7omt);以及来自罂粟、黄唐松草、日本黄连、黄连或另外物种的金黄紫堇碱9-o-甲基转移酶(9omt)。
另外,裁剪酶可用于催化在bia或其衍生物上进行的n-甲基化反应。可用于催化n-甲基化反应的裁剪酶的实例包括来自罂粟、黄唐松草、日本黄连或另外物种的乌药碱n-甲基转移酶(cnmt);来自罂粟、花菱草、大红罂粟或另外物种的四氢原小檗碱n-甲基转移酶(tnmt)。
此外,裁剪酶可用于催化在bia或其衍生物上进行的o-脱甲基化反应。可用于催化o-脱甲基化反应的裁剪酶的实例包括来自罂粟或另外物种的蒂巴因脱甲基酶(t6odm);以及来自罂粟或另外物种的可待因脱甲基酶(codm)。
裁剪酶也可用于催化在bia或其衍生物上进行的还原反应。可用于催化还原反应的裁剪酶的实例包括来自罂粟、大红罂粟或另外物种的沙罗泰里啶还原酶(salr);来自罂粟或另外物种的可待因酮还原酶(cor);以及来自花菱草或另外物种的血根碱还原酶(sanr)。在其他实例中,裁剪酶可用于催化在bia或其衍生物上进行的乙酰化反应。可用于催化乙酰化反应的裁剪酶的实例包括来自罂粟或另外物种的沙罗泰里啶乙酰基转移酶(salat)。
o-脱甲基化修饰
本文提供的一些方法、过程和系统描述了通过去除o-连接的甲基基团从第一苄基异喹啉生物碱向第二苄基异喹啉生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一苄基异喹啉生物碱向第二苄基异喹啉生物碱的转化是底物到去甲阿片样物质或nal-阿片样物质的转化的关键步骤。在一些实例中,第一生物碱向第二生物碱的转化包括脱甲基酶反应。
图6示出了根据本发明的实施方案,具有阿片样3-o-脱甲基酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以从与碳3结合的氧去除甲基基团。
odm酶的氨基酸序列的实例在表4中阐述。用于将第一生物碱转化为第二生物碱的odm的氨基酸序列可与表4中列出的给定氨基酸序列75%或以上相同。例如,这样的差向异构酶的氨基酸序列可包含与本文提供的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的odm,其中odm包含表4中列出的给定氨基酸序列。可提供产生一种或多种odm酶的工程化宿主细胞。可以回收并纯化在工程化宿主细胞内产生的odm,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的odm接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的o-脱甲基化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为去甲阿片样物质或nal-阿片样物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片样物质或nal-阿片样物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自吗啡、脱氢吗啡、东罂粟碱、氢吗啡酮、二氢吗啡、14-羟基吗啡、吗啡酮和14-羟基吗啡酮。
在一些实例中,底物生物碱是选自下组的阿片样物质:可待因、羟考酮、蒂巴因、氢可酮、二氢可待因、14-羟基可待因、可待因酮和14-羟基可待因酮。
n-脱甲基化修饰
本文提供的一些方法、过程和系统描述了通过去除n-连接的甲基基团从第一生物碱向第二生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一生物碱向第二生物碱的转化是底物到去甲阿片样物质或nal-阿片样物质的转化的关键步骤。在一些实例中,第一生物碱向第二生物碱的转化包括脱甲基酶反应。
图7示出了根据本发明的实施方案,具有阿片样n-脱甲基酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以从氮去除甲基基团。
表5中提供了可用于进行第一生物碱向第二生物碱的转化的n-脱甲基酶的氨基酸序列的实例。用于将第一生物碱转化为第二生物碱的ndm的氨基酸序列可与表5中列出的给定氨基酸序列75%或以上相同。例如,这样的差向异构酶的氨基酸序列可包含与本文提供的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的ndm,其中ndm包含表5中列出的给定氨基酸序列。可提供产生一种或多种ndm酶的工程化宿主细胞。可以回收并纯化在工程化宿主细胞内产生的ndm,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的ndm接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的n-脱甲基化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为去甲阿片样物质或nal-阿片样物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片样物质或nal-阿片样物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮和去甲-14-羟基-吗啡酮。
在一些实例中,底物生物碱是选自下组的阿片样物质:可待因、羟考酮、蒂巴因、氢可酮、二氢可待因、14-羟基可待因、可待因酮和14-羟基可待因酮、吗啡、羟吗啡酮、东罂粟碱、氢吗啡酮、二氢吗啡、14-羟基-吗啡、吗啡酮或14-羟基-吗啡酮。
n-连接的修饰
本文提供的一些方法、过程和系统描述了通过添加n-连接的侧链基团的第一生物碱向第二生物碱的转化。本文提供的一些方法、过程和系统描述了通过将侧链基团从辅底物转移至第一生物碱的第一生物碱向第二生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一生物碱向第二生物碱的转化是底物到nal-阿片样物质的转化的关键步骤。在一些实例中,第一生物碱向第二生物碱的转化包括甲基转移酶反应。
图8示出了根据本发明的实施方案,具有n-甲基转移酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以将甲基基团或其他碳部分添加到氮。s-腺苷甲硫氨酸(sam)可作为官能团(甲基、烯丙基、环丙基甲基等等)的供体。
nmt酶的氨基酸序列的实例在表6中阐述。用于将第一生物碱转化为第二生物碱的nmt的氨基酸序列可与表6列出的给定氨基酸序列75%或以上相同。例如,这样的差向异构酶的氨基酸序列可包含与本文提供的氨基酸序列至少75%或以上、80%或以上、81%或以上、82%或以上、83%或以上、84%或以上、85%或以上、86%或以上、87%或以上、88%或以上、89%或以上、90%或以上、91%或以上、92%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上或者99%或以上相同氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列具有至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更高,在某些情况下至少95%、96%、97%、98%和99%的同一性。在一些情况下,除了dna序列被改变例如以优化针对宿主生物体的密码子使用以外,氨基酸序列可以是相同的。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的nmt,其中nmt包含表6中提供的氨基酸序列。可提供产生一种或多种nmt酶的工程化宿主细胞。可以回收并纯化在工程化宿主细胞内产生的nmt,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的nmt接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用来将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的n-甲基转移酶可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为nal-阿片样物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片样物质或nal-阿片样物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自纳洛酮、纳曲酮和纳美芬。
在一些实例中,底物生物碱为选自下组的阿片样物质:去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮和去甲-14-羟基-吗啡酮。在一些实例中,辅底物为s-腺苷甲硫氨酸、烯丙基-s-腺苷甲硫氨酸或环丙基甲基-s-腺苷甲硫氨酸。
异源编码序列
在一些情况中,工程化宿主细胞携带一个或多个异源编码序列(如两个或更多个、三个或更多个、四个或更多个、五个或更多个),所述异源编码序列编码使工程化宿主细胞能够产生期望的感兴趣的酶和/或感兴趣的bia(例如,如本文所述)的活性。如本文所用的,术语“异源编码序列”用于指示编码或最终编码通常不存在于宿主生物体中且可在适当条件下在宿主细胞中表达的肽或蛋白质或其等效氨基酸序列(例如,酶)的任何多核苷酸。因而,“异源编码序列”包括通常存在于宿主细胞中的编码序列的多个拷贝,以使得所述细胞表达通常不存在于所述细胞中的编码序列的另外拷贝。异源编码序列可以是rna或其任何类型(例如,mrna)、dna或其任何类型(例如,cdna)或rna/dna的杂合体。感兴趣的编码序列包括但不限于包含诸如编码序列、内含子、启动子区、3'-utr和增强子区等特征的全长转录单位。
在实例中,工程化宿主细胞可包含多个异源编码序列,各自编码酶,如表3中列出的酶。在一些实例中,由多个异源编码序列编码的多种酶可以彼此不同。在一些实例中,由多个异源编码序列编码的多种酶中的一些可以彼此不同,而由多个异源编码序列编码的多种酶中的一些酶可以是重复拷贝。
在一些实例中,异源编码序列可以可操作地连接。可操作地连接的异源编码序列可以在产生特定的苄基异喹啉生物碱产物和/或蒂巴因合酶产物的相同途径内。在一些实例中,可操作地连接的异源编码序列可以是沿着产生特定的苄基异喹啉生物碱产物和/或蒂巴因合酶产物的途径直接连续的。在一些实例中,可操作地连接的异源编码序列可以在由多个异源编码序列编码的一种或多种酶之间具有一种或多种天然酶。在一些实例中,异源编码序列可在由多个异源编码序列编码的一种或多种酶之间具有一种或多种异源酶。在一些实例中,异源编码序列可在由多个异源编码序列编码的一种或多种酶之间具有一种或多种非天然酶。
工程化宿主细胞还可被修饰为具有一个或多个遗传改变以适应异源编码序列。天然宿主基因组的改变包括但不限于修饰基因组以减少或消除可能干扰期望途径的特定蛋白质的表达。此类天然蛋白质的存在可将该途径的中间体或终产物中的一种迅速转化成代谢物或在期望途径中不可用的其他化合物。因此,如果天然酶的活性被降低或完全不存在,所产生的中间体将会更容易地可用于并入期望产物中。
异源编码序列包括但不限于编码通常负责产生植物中感兴趣的bia的酶的序列(野生型序列或等效序列)。在一些情况下,异源序列所编码的酶可以是1-bia途径中的任何酶,并且可来自任何适宜的来源。针对于特定合成途径的由异源编码序列编码的酶的选择和数目可基于期望产物进行选择。在某些实施方案中,本发明的宿主细胞可包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个乃至15个或更多个异源编码序列,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个异源编码序列。
如本文所用的,术语“异源编码序列”还包括肽或酶的编码部分,即肽或酶的cdna或mrna序列,以及全长转录单位的编码部分,即包含内含子和外含子的基因,以及编码酶或编码其等效氨基酸序列的“密码子优化的”序列、截短序列或其他形式的改变序列,条件是该等效氨基酸序列产生功能蛋白质。此类等效氨基酸序列可具有一个或多个氨基酸的缺失,其中缺失是n末端、c末端或内部的。设想到截短形式,只要它们具有本文所指示的催化能力。还设想到两种或更多种酶的融合物以有助于途径中代谢物的转移,条件是催化活性得以维持。
可操作的片段、突变体或截短形式可通过建模和/或筛选进行鉴定。在一些情况下,通过以逐步方式删除例如蛋白质的n末端、c末端或内部的区域,然后相较于原始序列关于所得衍生物针对期望反应的活性对所得衍生物进行分析来实现这一点。如果所讨论的衍生物在这种能力方面起作用,则认为正确构成了酶的等效衍生物。
在实例中,一些异源蛋白当在重组宿主中表达时可显示出它们被不被正确加工的发生。例如,在微生物产生宿主中表达的植物蛋白如细胞色素p450酶,可具有不正确加工的发生。具体而言,沙罗泰里啶合酶当在酵母中异源表达时可经历n-连接的糖基化。这种n-连接的糖基化在植物中可能观察不到,这可指示初生salsyn转录物的不正确的n末端分选,从而降低在异源微生物宿主中的酶活性。在此类实例中,针对校正初生转录物的n末端分选以便去除n-连接的糖基化模式的蛋白质工程化可导致沙罗泰里啶合酶在重组产生宿主中的活性改善,参见,例如,wo2016183023a1。
本发明的一些方面还涉及编码与各种酶的天然氨基酸序列等效的氨基酸序列的异源编码序列。“等效”的氨基酸序列被定义为与特定氨基酸序列不相同而是包含至少一些氨基酸变化(缺失、置换、反转、插入等)的氨基酸序列,当用于期望目的时,与特定氨基酸序列的类似活性相比,所述氨基酸变化不实质影响蛋白质的生物活性。在蒂巴因合酶的实例中,生物活性是指其催化活性。等效序列还意在包括已被工程化和/或进化为具有不同于原始氨基酸序列的特性的那些序列。感兴趣的易突变性质包括催化活性、底物特异性、选择性、稳定性、溶解性、定位等。
在一些情况下,每种类型的酶的表达通过另外的基因拷贝(即,多个拷贝)而增加,其增加中间体积累和/或感兴趣的bia产生。本发明的一些实施方案包括通过同时表达单一或多种酶的多个种类的变体而增加宿主细胞中的感兴趣的bia的产生。在一些情况下,单一或多种酶的另外的基因拷贝包含在宿主细胞中。可利用任何适宜的方法,包括针对宿主细胞中的酶的异源编码序列的多个拷贝。
在一些实例中,工程化宿主细胞包含针对酶的异源编码序列的多个拷贝,如2个或更多个、3个或更多个、4个或更多个、5个或更多个乃至10个或更多个拷贝。在某些实施方案中,工程化宿主细胞包含针对一种或多种酶的异源编码序列的多个拷贝,如两种或更多种、三种或更多种、四种或更多种等酶的多个拷贝。在一些情况下,与宿主细胞相比,针对酶的异源编码序列的多个拷贝来源于两种或更多种不同的来源生物体。例如,工程化宿主细胞可包含一个异源编码序列的多个拷贝,其中每个拷贝来源于不同的来源生物体。因此,基于由异源编码序列编码的感兴趣的酶的种间差异,每个拷贝可包含显式序列中的一些变异。
在某些实施方案中,工程化宿主细胞包含针对一种或多种酶的异源编码序列的多个拷贝,如两个或更多个、三个或更多个、四个或更多个等的多个拷贝。在一些情况下,与宿主细胞相比,针对酶的异源编码序列的多个拷贝来源于两种或更多种不同的来源生物体。例如,工程化宿主细胞可包含一个异源编码序列的多个拷贝,其中每个拷贝来源于不同的来源生物体。因此,基于由异源编码序列编码的感兴趣的酶的种间差异,每个拷贝可包含显式序列中的一些变异。
可对工程化宿主细胞培养基进行取样并且监测感兴趣的bia的产生。可使用任何适宜的方法观察和测量感兴趣的bia。感兴趣的方法包括但不限于lc-ms方法(例如,如本文所述),其中通过与已知量的标准化合物比较来分析感兴趣的样品。另外,存在可观察和/或测量感兴趣的bia的其他方式。观察和/或测量bia的备选方式的实例包括gc-ms、紫外-可见光谱法、nmr、lc-nmr、lc-uv、tlc、毛细管电泳等等。可通过例如m/z和ms/ms片段化模式确认身份,并且可通过已知保留时间的lc迹线峰和/或通过参考已知量的化合物标准品的对应lc-ms分析进行的eicms峰分析来实现化合物的量化或测量。
另外,可对工程化宿主细胞的培养物进行取样并且监测感兴趣的酶如蒂巴因合酶的产生。可使用任何适宜的方法观察和测量感兴趣的酶。感兴趣的方法包括酶活性测定、聚丙烯酰胺凝胶电泳、一氧化碳光谱法以及western印迹分析。
方法
培养用于bia产生的宿主细胞的方法
如上文所总结的,本发明的一些方面包括制备感兴趣的苄基异喹啉生物碱(bia)的方法。另外,本发明的一些方面包括制备感兴趣的酶的方法。因而,本发明的一些方面包括在其中功能性地表达一种或多种宿主细胞修饰(例如,如本文所述)的条件下培养工程化宿主细胞,使得所述细胞将感兴趣的起始化合物转化为感兴趣的产物酶和/或bia。还提供包括在适于蛋白质产生的条件下培养工程化宿主细胞的方法,使得功能性地表达一个或多个异源编码序列并且将感兴趣的起始化合物转化为感兴趣的产物酶或bia。在实例中,所述方法是制备苄基异喹啉生物碱(bia)的方法,其包括培养工程化宿主细胞(例如,如本文所述);将起始化合物添加至细胞培养物;以及从细胞培养物中回收bia。在一些实例中,所述方法是制备酶的方法,其包括培养工程化宿主细胞(例如,如本文所述);将起始化合物添加至细胞培养物;以及从细胞培养物回收酶。
发酵培养基可包含合适的碳底物。适用于进行本公开的方法的碳源可涵盖多种含碳底物。合适的底物可包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些情况下,可使用来自可再生原料的未纯化的混合物(例如,玉米浆液、甜菜糖蜜、大麦麦芽)。在一些情况下,碳底物可以是一碳底物(例如,甲醇、二氧化碳)或二碳底物(例如,乙醇)。在其他情况下,可利用其他含碳化合物,例如,甲胺、葡糖胺和氨基酸。
培养工程化宿主细胞的任何适宜的方法可用于产生感兴趣的酶和/或bia。所采用的具体方案可例如根据工程化宿主细胞、异源编码序列、感兴趣的酶、感兴趣的bia等而变化。细胞可存在于任何适宜的环境中,诸如其中细胞能够表达一种或多种功能性异源酶的环境。在一些实施方案中,细胞在有利于酶表达的条件下培养,并且与可用于允许在体内产生感兴趣的酶和/或bia的适当底物一起培养。在一些实施方案中,从工程化宿主提取功能性酶,以用于在体外条件下产生感兴趣的酶和/或bia。在一些情况下,将工程化宿主细胞放回到多细胞宿主生物体中。工程化宿主细胞处于任何生长期,包括但不限于稳定期和对数生长期等。此外,培养物本身可以是连续培养物,或者它们可以是分批培养物。
细胞可在介于14-40℃之间的温度下在适当的发酵培养基中生长。细胞可在任何适宜速度(例如,200rpm)的振荡下生长。细胞可在合适的ph下生长。适用于发酵的ph范围可介于ph5-9之间。发酵可在有氧、缺氧或微氧条件下进行。可使用任何合适的生长培养基。合适的生长培养基可包括但不限于常见的商业制备的培养基,如合成限定的(sd)基本培养基或酵母提取物蛋白胨右旋糖(yepd)丰富培养基。可使用适合于微生物的其他任何丰富、限定或合成性生长培养基。
可在基本上任何大小和形状的容器中培养细胞。适用于进行本公开的方法的容器的实例可包括但不限于多孔摇板、试管、烧瓶(带挡板和不带挡板的)以及生物反应器。培养物的体积可在10微升至大于10,000升的范围内。
可包括向生长培养基添加已知以产生生物碱所期望的方式调节代谢的试剂。在非限制性实例中,可向生长培养基添加环腺苷2’3’-单磷酸以调节分解代谢物阻遏。
可利用针对特定细胞类型的任何适宜的细胞培养条件。在某些实施方案中,使用标准细胞培养基和补充剂,将在标准或容易优化的条件下培养包含一个或多个修饰的宿主细胞。作为一个实例,当不需要用于质粒维持的选择压力时,标准生长培养基可包含20g/l酵母提取物、10g/l蛋白胨和20g/l右旋糖(ypd)。含有质粒的宿主细胞在含有1.7g/l酵母含氮碱基、5g/l硫酸铵和20g/l右旋糖的合成完全(sc)培养基中生长,该培养基补充有生长和选择所需的适当氨基酸。可用于诱导型酶表达的备选碳源包括但不限于蔗糖、棉子糖和半乳糖。在实验室中,细胞在任何适宜的温度(例如,30℃)下伴有任何适宜速率(例如,200rpm)的振荡在容器中生长,例如在1-1000ml或更大范围的体积的试管或烧瓶中生长。
可按比例放大培养体积以用于在较大发酵容器中生长,例如作为工业过程的一部分。工业发酵过程可在封闭分批、分批补料或连续恒化器条件下或者任何合适的发酵模式下进行。在一些情况下,可将细胞作为全细胞催化剂固定在底物上并使其经受发酵条件以产生生物碱。
分批发酵是封闭系统,其中培养基的组成在发酵开始时设定并且在发酵过程中不改变。在发酵开始时将期望的生物体接种到培养基中。在一些情况下,分批发酵在对系统做出改变以控制诸如ph和氧浓度等因素(但不包括碳)的情况下运行。在这种类型的发酵系统中,系统的生物质和代谢物组成在整个发酵过程中连续变化。细胞通常经历迟滞期,然后到达对数期(高生长速率),然后到达稳定期(生长速率降低或停止),并且最终到达死亡期(如果保持未处理)。
连续发酵是开放式系统,其中将确定的发酵培养基连续添加至生物反应器,并从容器连续移取等量的发酵培养基以供处理。通常对连续发酵系统进行操作以维持稳态生长条件,使得由于移取培养基造成的细胞损失必须通过发酵中的生长速率进行平衡。连续发酵通常在细胞处于恒定的高细胞密度的条件下操作。连续发酵允许调节影响靶标产物浓度和/或细胞生长的一个或多个因素。
液体培养基可包括但不限于具有上述添加剂组分的丰富培养基或合成限定培养基。培养基组分可溶解于水中并且通过加热、压力、过滤、辐射、化学物质或其任何组合进行灭菌。若干培养基组分可单独制备并灭菌,然后在发酵容器中进行组合。培养基可以是缓冲的,以便帮助在整个发酵过程中维持恒定的ph。
可在整个发酵过程中监测或控制过程参数,包括温度、溶解氧、ph、搅拌、通气速率和细胞密度。例如,可通过浸入培养基中的温度探头监测发酵过程的温度。可通过调节夹套温度将培养温度控制在设定点。可将水在外部冷却器中冷却,然后使其流动到生物反应器控制塔中并且以维持容器中的设定点温度所需的温度循环至夹套。
另外,可监测发酵过程中的气体流动参数。例如,气体可通过喷雾器流动到培养基中。适用于本公开的方法的气体可包括压缩空气、氧气和氮气。气体流动可处于固定的速率或被调节以维持溶解氧设定点。
还可监测培养基的ph。在实例中,可通过浸入容器内部的培养基中的ph探头监测ph。如果实行ph控制,可通过酸碱泵调整ph,所述酸碱泵以所需速率向培养基添加每种溶液。用于控制ph的酸溶液可以是硫酸或盐酸。用于控制ph的碱溶液可以是氢氧化钠、氢氧化钾或氢氧化铵。
此外,可通过浸入培养基中的溶解氧探头监测培养基中的溶解氧。如果实行溶解氧调节,可通过增大或减小搅拌速度来调整氧水平。还可通过增大或减小气体流动速率来调整溶解氧水平。气体可以是压缩空气、氧气或氮气。
还可监测发酵过程中的搅拌速度。在实例中,搅拌机马达可驱动搅动器。搅拌机速度可在整个发酵过程中设定为恒定rpm或者可动态调节以维持设定的溶解氧水平。
另外,可监测发酵过程中的浊度。在实例中,可使用浊度探头测量细胞密度。或者,可通过从生物反应器取样并且在分光光度计中对它们进行分析来测量细胞密度。此外,可通过无菌取样装置以一定时间间隔从生物反应器移取样品。可针对宿主细胞产生的生物碱对样品进行分析。还可针对其他代谢物和糖、培养基组分的消耗或细胞的密度对样品进行分析。
在另一个实例中,可监测发酵过程期间的原料参数。具体而言,可使用外部泵向发酵添加原料,所述原料包含糖和其他碳源、营养素和辅因子。还可在发酵过程中添加其他组分,包括但不限于消泡剂、盐、螯合剂、表面活性剂和有机液体。
用于优化宿主细胞中的异源多核苷酸的表达的任何适宜的密码子优化技术可适用于在主题宿主细胞和方法中使用,参见例如,gustafssonc.等人(2004)trendsbiotechnol,22,346-353,其通过引用以其全文并入。
主题方法还可包括将起始化合物添加至细胞培养物。任何适宜的添加方法可适于在主题方法中使用。细胞培养物可补充有足量的感兴趣的起始材料(例如,如本文所述),例如mm至μm的量,如约1-5mm的起始化合物。应当理解,所添加的起始材料的量、添加的时间设置和速率、所添加的材料的形式等可根据多种因素而变化。可添加纯的或预先溶解于合适的溶剂(例如,细胞培养基、水或有机溶剂)中的起始材料。起始材料可以以浓缩形式(例如,超过期望浓度10x)添加以使添加时细胞培养基的稀释最小化。起始材料可以以一个或多个批次添加,或通过在延长的时间段(例如,数小时或数天)内的连续添加而添加。
用于从发酵培养基中分离产物的方法
主题方法还可包括从细胞培养物回收感兴趣的酶和/或bia。任何适宜的分离和隔离方法(例如,色谱方法或沉淀方法)可适于在主题方法中使用以从细胞培养物回收感兴趣的酶和/或bia。过滤方法可用于分离细胞培养物的可溶性部分与不溶性部分。在一些情况下,液相色谱方法(例如,反相hplc、大小排阻、正相色谱法)可用于分离感兴趣的bia与细胞培养物的其他可溶性组分。在一些情况下,萃取方法(例如,液体萃取、基于ph的纯化、固相萃取、亲和色谱法、离子交换等)可用于分离感兴趣的酶和/或bia与细胞培养物的其他组分。
可使用本领域已知的方法分离所产生的生物碱与发酵培养基。可在发酵之后立即(或在一些情况下,在发酵期间)进行多个回收步骤,以初始回收期望产物。通过这些步骤,可将生物碱(例如,bia)与细胞、细胞碎片和废物分离,并且其他营养素、糖和有机分子可保留在废培养基中。可使用该过程产生富含bia的产物。
在一个实例中,通过向间歇式反应器提供工程化酵母细胞以及包含营养素和水的原料来形成具有苄基异喹啉生物碱(bia)产物的产物流。具体而言,可通过将工程化酵母细胞温育至少约5分钟的时间段来使工程化酵母细胞进行发酵,从而产生包含bia产物以及细胞物质的溶液。一旦工程化酵母细胞已经进行发酵,可使用至少一个分离装置将bia产物与细胞物质分离以提供包含bia产物的产物流。具体而言,产物流可包含bia产物,以及另外的组分,如澄清的酵母培养基。另外,bia产物可包含一种或多种感兴趣的bia,如一种或多种bia化合物。
可使用不同的方法从生物反应器培养基移取包含感兴趣的酶和/或bia的细胞。在实例中,通过随时间推移的沉降移取细胞。这种沉降过程可通过冷却或通过添加澄清剂如二氧化硅来加速。然后可从反应器顶部虹吸废培养基或者可从反应器底部滗析细胞。或者,可通过用过滤器、膜或其他多孔材料过滤来移取细胞。还可通过离心,例如通过连续流动离心或通过使用连续萃取器来移取细胞。
如果一些有价值的感兴趣的酶和/或bia存在于细胞内部,可将细胞透化或裂解,并且可通过上述方法中的任一种移除细胞碎片。用于使细胞透化的试剂可包括但不限于有机溶剂(例如,dmso)或盐(例如,乙酸锂)。用来裂解细胞的方法可包括添加表面活性剂如十二烷基硫酸钠,或通过珠磨或超声处理进行机械破坏。
可通过添加与水性培养基不混溶的有机液体,通过液-液萃取从澄清的废培养基萃取感兴趣的酶和/或bia。在实例中,可在其他处理步骤之外使用液-液萃取。合适的有机液体的实例包括但不限于肉豆蔻酸异丙酯、乙酸乙酯、氯仿、乙酸丁酯、甲基异丁基酮、油酸甲酯、甲苯、油醇、丁酸乙酯。可以以水性培养基的体积的至少10%或至多100%添加有机液体。
在一些情况下,可在发酵开始时或在发酵期间的任何时间添加有机液体。该萃取发酵过程可通过将酶和/或bia连续地移取至有机相而提高来自宿主细胞的感兴趣的酶和/或bia的产率。
搅拌可使有机相与水性培养基形成乳液。促进两个相分成不同层的方法可包括但不限于添加破乳剂或成核剂,或者调整ph。还可通过例如连续锥形板离心将乳液离心以分离两个相。
或者,可将有机相与水性培养基隔离开,以使在萃取后可以物理移取所述有机相。例如,可将溶剂包封在膜中。
在实例中,可使用吸附方法从发酵培养基提取感兴趣的酶和/或bia。在实例中,可通过添加树脂如
还可使用过滤从发酵培养基提取感兴趣的bia。在高ph下,感兴趣的bia可在生物反应器中形成晶状沉淀。可通过用过滤器、膜或其他多孔材料过滤直接移取该沉淀。还可通过离心和/或滗析收集沉淀。
上述提取方法可原位(在生物反应器中)或非原位(例如,在外部回路中,培养基通过所述外部回路流出生物反应器并接触提取剂,然后再循环回到容器中)进行。或者,提取方法可在发酵结束之后使用从生物反应器容器移取的澄清培养基进行。
用于从富含生物碱的溶液中纯化产物的方法
后续纯化步骤可涉及使用本领域已知的方法处理富含感兴趣的bia产物的发酵后溶液,从而回收高纯度的单一的感兴趣的产物物质。
在一个实例中,可将在有机相中萃取的感兴趣的bia转移到水溶液中。在一些情况下,可通过加热和/或真空蒸发有机溶剂,并且可将所得粉末溶解于合适ph的水溶液中。在进一步的实例中,可通过添加促进将感兴趣的bia萃取到水相中的合适ph的水溶液来从有机相萃取感兴趣的bia。然后可通过滗析、离心或另外的方法移除水相。
可对含有bia的溶液进行进一步处理以移除金属,例如,通过用合适的螯合剂处理。可通过沉淀进一步处理含有感兴趣的bia的溶液以移除其他杂质,如蛋白质和dna。在一个实例中,用适当的沉淀剂如乙醇、甲醇、丙酮或异丙醇处理含有感兴趣的bia的溶液。在备选的实例中,可通过渗析或通过将较小的生物碱与污染的生物大分子分离的其他大小排阻方法移除dna和蛋白质。
在进一步的实例中,可使用本领域已知的方法通过连续交叉流过滤将包含感兴趣的bia的溶液萃取至高纯度。
如果溶液包含感兴趣的bia的混合物,那么可使用本领域已知的方法使其经受酸-碱处理,以得到单一的感兴趣的bia。在该过程中,调整水溶液的ph以沉淀单一的bia。
对于高纯度的小规模制备,可通过液相色谱法在单个步骤中纯化bia。
液相色谱质谱(lcms)法:
可使用液相色谱法分离感兴趣的bia化合物,包括吗啡喃、nal-阿片样和去甲阿片样物质,并使用质谱法进行检测和定量。化合物的同一性可通过特征洗脱时间、质荷比(m/z)和碎裂模式(ms/ms)来确认。可通过将化合物峰面积与已知的参考标准化合物的标准曲线进行比较来进行定量。另外,感兴趣的bia可通过备选方法如gc-ms、紫外-可见光谱法、nmr、lc-nmr、lc-uv、tlc和毛细管电泳进行检测。
purpald测定方法
对于脱甲基化反应的高通量筛选,可使用purpald测定。例如,由2-氧戊二酸依赖性双加氧酶催化的脱甲基化产生甲醛作为产物,如通用化学方程式所示:
澄清的酵母培养基(cycm)可包含多种杂质。澄清的酵母培养基可通过真空和/或加热脱水,以得到富含生物碱的粉末。该产物类似于由罂粟种植国出口且由api制造商购买的罂粟杆浓缩物(cps)或阿片。对于本发明而言,cps是任何类型的纯化的植物提取物的代表性实例,可由其最终进一步纯化期望的生物碱产物。表10和表11突出显示了这两种产物中的杂质,它们对于cycm或cps可能是特定的,或者可以存在于两者中。某些bia可含有色素作为杂质,而其他bia可被归类为色素本身。因此,可基于非色素杂质,针对杂质评估这些bia。通过针对这些杂质的子集对未知来源的产物进行分析,本领域技术人员可确定产物源自酵母还是植物的产生宿主。
api级药物成分是高度纯化的分子。因而,可指示api的植物或酵母来源的杂质(如表10和表11中列出的那些)可能不存在于api级的产物中。实际上,源自本发明的酵母菌株的许多api产物可能非常难以与传统的植物来源的api区分开。然而,在一些情况下,可使用化学合成方法使常规的生物碱化合物经受化学修饰,其可在需要此类化学修饰的基于植物的产物中表现为化学杂质。例如,化学衍生化通常可导致与化学合成过程相关的一组杂质。在某些情况下,这些修饰可在酵母产生平台中以生物学方式进行,从而避免与化学衍生相关联的一些杂质存在于酵母来源的产物中。具体而言,来自化学衍生产物的这些杂质可存在于使用化学合成过程产生的api产物中,但可不存在于使用酵母来源的产物产生的api产物中。或者,如果将酵母来源的产物与化学衍生的产物混合,所得杂质可能存在,但是其量少于在仅含或主要包含化学衍生产物的api中将预期的量。在该实例中,通过针对这些杂质的子集对api产物进行分析,本领域技术人员可确定产物源自酵母产生宿主还是传统的化学衍生化路线。
可存在于化学衍生化吗啡喃api中但不存在于生物合成的api中的杂质的非限制性实例包括api可待因中的可待因-o(6)-甲基醚杂质;api羟考酮中的8,14-二羟基-7,8-二氢可待因酮;以及api氢可酮中的四氢蒂巴因。可待因-o(6)-甲基醚可通过吗啡的化学过度甲基化形成。api羟考酮中的8,14-二羟基-7,8-二氢可待因酮可通过蒂巴因的化学过度氧化形成。另外,api氢可酮中的四氢蒂巴因可通过蒂巴因的化学过度还原形成。
然而,在其中酵母来源的化合物和植物来源的化合物均通过化学合成方式受到化学修饰的情况下,可预期产物中与化学合成过程相关联的相同杂质。在这样的情况下,可如上所述对起始材料(例如,cycm或cps)进行分析。
宿主细胞来源的nal-阿片样物质与化学衍生的nal-阿片样物质
通过化学合成产生的nal-阿片样物质可含有多种杂质。这些杂质可由许多不同的原因引起,例如,未反应的起始材料、不完全的反应、副产物的形成、中间体的持久性、二聚化或降解。未反应的起始材料的实例可以是在纳曲酮制剂中剩余的羟吗啡酮。由不完全反应引起的杂质的实例可以是由蒂巴因的不完全3-o-脱甲基化产生的3-o-甲基丁丙诺啡。化学修饰可导致在脱靶位点处添加或去除官能团。例如,在纳曲酮合成期间氧化c10以产生10-羟基纳曲酮和10-酮基纳曲酮,或在丁丙诺啡合成期间去除6-o-甲基基团以得到6-o-脱甲基丁丙诺啡。杂质可由反应中间体的持久性引起,例如在n-脱甲基化过程期间形成的n-氧化物如羟吗啡酮n-氧化物的持久性。杂质的另一个来源是二聚化,即两个阿片样分子的共轭,例如两个丁丙诺啡分子(2,2’-双丁丙诺啡)、两个纳曲酮分子(2,2’-双纳曲酮)或两个纳洛酮分子(2,2’-双纳洛酮)。杂质可由起始材料、反应中间体或反应产物的降解引起。化学合成中使用的极端物理条件可使得更可能存在降解。可由降解引起的杂质的实例是在丁丙诺啡合成期间通过氧化条件产生的脱氢丁丙诺啡。
宿主细胞中通过酶催化产生的nal-阿片样物质可含有与通过化学合成产生的nal-阿片样物质不同的杂质。宿主细胞中通过酶催化产生的nal-阿片样物质可含有比通过化学合成产生的nal-阿片样物质更少的杂质。宿主细胞中通过酶催化产生的nal-阿片样物质可缺乏在通过化学合成产生的nal-阿片样物质中发现的某些杂质。在实例中,酶合成的关键特征可包括,(1)酶以高保真度靶向特定底物和残基;(2)酶在不损害分子的稳定性的细胞内的温和生理条件下进行反应;以及(3)酶被工程化成为驱动反应完成的有效催化剂。
表12突出显示了对于化学产生的nal-阿片样物质可以是特异性的一些杂质。因此,可针对杂质对nal-阿片样物质进行评估以确定存在或不存在来自表12的任何杂质。通过针对这些杂质的子集对未知来源的产物进行分析,本领域技术人员可确定产物源自化学合成还是酶合成。
工程改造宿主细胞的方法
还包括出于产生感兴趣的酶和/或bia的目的工程改造宿主细胞的方法。将dna插入宿主细胞中可使用任何适宜的方法来实现。所述方法用来将异源编码序列插入工程化宿主细胞中,使得宿主细胞功能性地表达酶,并且将感兴趣的起始化合物转化成感兴趣的产物酶和/或bia。
任何适宜的启动子可用于主题工程化宿主细胞和方法中。驱动异源编码序列的表达的启动子可以是组成型启动子或诱导型启动子,条件是所述启动子在工程化宿主细胞中是活性的。异源编码序列可由其天然启动子表达,或者可使用非天然启动子。此类启动子在使用它们的宿主中可以是低至高强度。启动子可以是调节型或组成型的。在某些实施方案中,使用不受葡萄糖阻遏的启动子或者在培养基中存在葡萄糖时仅受轻微阻遏的启动子。感兴趣的启动子包括但不限于糖酵解基因的启动子如枯草芽孢杆菌tsr基因的启动子(编码果糖二磷酸醛缩酶基因的启动子区)或来自酵母酿酒酵母基因的编码甘油醛3-磷酸脱氢酶(gpd、gapdh或tdh3)的启动子,面包酵母的adh1启动子,磷酸盐饥饿诱导的启动子如酵母的pho5启动子,来自地衣芽孢杆菌的碱性磷酸酶启动子,酵母诱导型启动子如gal1-10、gal1、gall、gals,阻遏型启动子met25、teto,以及组成型启动子如甘油醛3-磷酸脱氢酶启动子(gpd)、醇脱氢酶启动子(adh)、翻译延长因子-1-α启动子(tef)、细胞色素c-氧化酶启动子(cyc1)、mrp7启动子等。还可使用含有可受激素(如糖皮质激素、类固醇和甲状腺激素)诱导的启动子的自主复制酵母表达载体,并且包括但不限于糖皮质激素反应性元件(gre)和甲状腺激素反应性元件(tre)。这些和其他实例描述于美国专利号7,045,290中,其通过引用并入,包括其中引用的参考文献。可使用包含组成型或诱导型启动子如α因子、醇氧化酶和pgh的另外的载体。另外,任何启动子/增强子组合(根据真核启动子数据库epdb)也可用于驱动基因的表达。可针对宿主细胞例如大肠杆菌选择任何适宜的适当启动子。还可使用启动子选择以优化转录,并因此优化酶水平以使产生最大化,同时使能源最小化。
任何适宜的载体可用于主题工程化宿主细胞和方法中。感兴趣的载体包括用于在酵母和其他细胞中使用的载体。酵母载体的类型可分成4种一般类别:整合载体(yip)、自主复制高拷贝数载体(yep或2μ质粒)、自主复制低拷贝数载体(ycp或着丝粒质粒)以及用于克隆大片段的载体(yac)。经由任何适宜的转化或转染技术将载体dna引入原核或真核细胞中。另外来源的dna(例如,pcr生成的双链dna产物或者合成的双链或单链寡核苷酸)可通过整合到基因组中来用于使酵母工程化。任何单个转化事件可包括一种或若干核酸(载体、双链或单链dna片段)以对宿主细胞进行遗传修饰。图11示出了适宜的载体的示例。
应用
本发明的工程化宿主细胞和方法(例如,如上文所述)适用于多种应用。感兴趣的应用包括但不限于:研究应用和治疗应用。本发明的方法适用于多种不同的应用,包括其中产生感兴趣的酶和/或bia的任何适宜的应用。
主题工程化宿主细胞和方法适用于多种治疗应用。感兴趣的治疗应用包括其中对于制备包含bia的药物产品感兴趣的那些应用。本文所述的工程化宿主细胞产生感兴趣的bia以及感兴趣的酶。牛心果碱是包括工程化行为以产生终产物如阿片样产物的bia合成中感兴趣的主要分支点中间体。主题宿主细胞可用于由简单且廉价的起始材料产生感兴趣的bia,所述材料可适用于产生包括牛心果碱在内的感兴趣的bia和bia终产物。因此,主题宿主细胞适用于供应治疗活性的感兴趣的bia。
在一些情况下,工程化宿主细胞和方法适用于产生商业规模量的其bia,其中这些化合物的化学合成是低产率的并且不是大规模生产的可行手段。在某些情况下,宿主细胞和方法用于发酵设施中,所述发酵设施将包括例如5,000-200,000升容量的生物反应器(发酵罐),从而允许快速产生用于治疗性产物的其感兴趣的bia。此类应用可包括由可发酵的碳源如纤维素、淀粉和游离糖以工业规模产生感兴趣的bia。
主题工程化宿主细胞和方法适用于多种研究应用。主题宿主细胞和方法可用于分析多种酶对多种感兴趣的酶和/或bia的生物合成途径的作用。此外,工程化宿主细胞可被工程化以产生感兴趣的去甲阿片样和/或nal-阿片样bia,所述感兴趣的酶和/或bia适用于测试在尚未证实的治疗功能方面的感兴趣的生物活性。在一些情况下,对宿主细胞进行工程化以包含编码多种酶的多种异源编码序列阐明了针对感兴趣的酶和/或bia的高产率生物合成途径。在某些情况下,研究应用包括产生用于感兴趣的治疗分子的感兴趣的酶和/或bia,所述治疗分子随后可进行进一步化学修饰或衍生化为期望产物或针对增加的感兴趣的治疗活性进行筛选。在一些情况下,宿主细胞菌株用于筛选在此类途径中感兴趣的酶活性,其可导致经由在这些菌株中产生的bia代谢物的转化而发现酶。
主题工程化宿主细胞和方法可用作植物特化代谢物的产生平台。主题宿主细胞和方法可用作药物文库开发以及植物酶发现的平台。例如,主题工程化宿主细胞和方法可适用于通过采用酵母菌株产生感兴趣的支架分子如原阿片碱,并且通过组合的生物合成或通过化学手段使化合物结构进一步功能化,从而开发基于天然产物的药物文库。通过以这种方式产生药物文库,任何潜在药物命中已经与易于大规模培养和产生的产生宿主相关联。作为另一个实例,这些主题工程化宿主细胞和方法可适用于植物酶发现。主题宿主细胞提供限定的代谢物的干净背景以表达植物est文库,从而鉴定新的酶活性。主题宿主细胞和方法提供用于酵母中的植物酶的功能性表达和活性增加的表达方法和培养条件。
试剂盒和系统
本发明的方面进一步包括试剂盒和系统,其中所述试剂盒和系统可包含本发明的方法中采用的一种或多种组分,例如,工程化宿主细胞、起始化合物、异源编码序列、载体、培养基等,如本文所述。在一些实施方案中,主题试剂盒包含工程化宿主细胞(例如,如本文所述),以及选自下组的一种或多种组分:起始化合物、异源编码序列和/或包含所述异源编码序列的载体、载体、生长原料、适合在表达系统中使用的组分(例如,细胞、克隆载体、多克隆位点(mcs)、双向启动子、内部核糖体进入位点(ires)等)以及培养基。
本文所述的任何组分可提供于试剂盒中,例如,包含一个或多个修饰的宿主细胞、起始化合物、培养基等。适合在制备和使用异源编码序列、克隆载体和表达系统中使用的多种组分可适用于主题试剂盒。试剂盒还可包含管、缓冲液等,以及使用说明。根据需要,试剂盒的各种试剂组分可存在于单独的容器中,或所述组分中的一些或全部可在单个容器中预先组合成试剂混合物。
还提供了用于产生感兴趣的酶和/或bia的系统,其中所述系统可包含含有一个或多个修饰(例如,如本文所述)的工程化宿主细胞、起始化合物、培养基、发酵罐和发酵设备,例如,适于维持宿主细胞的生长条件的装置、取样和监测设备以及组分等。适合在酵母细胞的大规模发酵中使用的多种组分可适用于主题系统。
在一些情况下,所述系统包含用于工程化宿主细胞的大规模发酵以及监测和纯化由发酵的宿主细胞产生的酶和/或bia的组分。在某些实施方案中,在发酵罐中的工程化宿主细胞产生一种或多种期望的感兴趣的bia的条件下将一种或多种起始化合物(例如,如本文所述)添加至所述系统。在一些情况下,宿主细胞产生感兴趣的bia(例如,如本文所述)。在某些情况下,感兴趣的bia产物是阿片样产物,如蒂巴因、可待因、尼奥品、吗啡、尼奥吗啡、氢可酮、羟考酮、氢吗啡酮、二氢可待因、14-羟基可待因、二氢吗啡或羟吗啡酮。
在一些情况下,所述系统包含用于监测和/或分析通过主题宿主细胞产生的一种或多种感兴趣的酶和/或bia化合物的过程。例如,如本文所述的lc-ms分析系统、色谱法系统或任何适宜的系统,其中可对样品进行分析并且与标准品比较,例如,如本文所述。可通过取样和分析在发酵之前和期间的任何适宜的时间监测发酵培养基。当起始化合物到感兴趣的酶和/或bia产物的转化完成时,发酵可停止并且可进行bia产物的纯化。因此,在一些情况下,主题系统包含适用于从感兴趣的酶和/或bia产物在其中产生的宿主细胞培养基纯化感兴趣的酶和/或bia产物的纯化部件。纯化部件可包括可用于纯化发酵产生的感兴趣的酶和/或bia产物的任何适宜的手段,包括但不限于,二氧化硅色谱法、反相色谱法、离子交换色谱法、hic色谱法、大小排阻色谱法、液体萃取和ph萃取方法。在一些情况下,在将一种或多种起始化合物输入系统之后,主题系统提供感兴趣的酶和/或bia发酵产物的产生和分离。
给出以下实施例以便为本领域的普通技术人员提供如何制备和使用本发明的完整公开内容和描述,并且既不旨在限制发明人所认为的他们的发明的范围,也不旨在表示以下实验是所进行的全部或仅有的实验。尽管已经力图确保关于所用数字(例如,量、温度等)的精确性,但应考虑到一些实验误差和偏差。除非另有说明,否则份为重量份,分子量为重均分子量,温度为摄氏度,并且压力为大气压或接近大气压。
酶列表的讨论
宿主细胞可被工程化以变化提供感兴趣的bia和/或感兴趣的酶的产生的一个或多个修饰(如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个修饰)。表3提供了可受到一个或多个修饰的作用以便提供工程化宿主细胞中感兴趣的bia和/或感兴趣的酶的产生的示例性基因的列表。
如表3中提供的基因的修饰可用于由工程化宿主细胞产生感兴趣的bia,所述工程化宿主细胞配有包含生长所需的基本营养素的培养基。该基本培养基可包含碳源、氮源、氨基酸、维生素和盐。例如,如表3中提供的基因的修饰可用于由供给供应有糖的工程化宿主细胞产生感兴趣的bia。另外,如表3中提供的一个或多个基因的修饰可用于加强可被工程化用于药物产生的宿主细胞的生物合成过程。
另外,使用这些修饰以提供工程化宿主细胞中感兴趣的bia以及/或者感兴趣的酶的产生仅由可由所述基因产生的酶的鉴定并不显而易见。具体而言,在宿主细胞(诸如如本文所述的酵母细胞)中已经重构的合成途径包括在天然不在单个生物体内一起作用的多种酶。另外,本文讨论的一些酶在它们的天然背景下不用于bia生物合成。此外,本文所述的一些酶在特定的宿主细胞如酵母细胞中未进化成行使功能,并且未进化成一起行使功能。在这些情况下,将不太清楚酶是否将会在宿主细胞如酵母中的合成bia途径的背景下表现出足够的活性,以具有通过所述途径的足够通量从而产生下游bia终产物。
例如,植物酶通常难以在异源微生物宿主如酵母中功能性地表达。在许多情况下,酶可能错误折叠、不正确地定位在宿主细胞内和/或不正确地加工。酵母与植物之间的蛋白质翻译和加工的差异可导致这些酶在酵母宿主中表现出大大降低直至不可检测的活性。这些挑战通常针对于内膜定位的酶如细胞色素p450(其在bia途径中强烈表示)而产生。即使降低的酶活性也可对酵母工程化以产生复杂的bia提出巨大挑战,因为该过程的每个步骤均需要足够的活性以确保期望的bia产物的高水平积累。
另外,在一些宿主细胞如酵母中存在内源酶/途径,它们可作用于bia途径中的许多早期前体(即,从酪氨酸到去甲乌药碱的中间体),因此鉴于这些竞争性内源途径,是否将存在通过异源途径以实现大量bia产生的足够通量可能并不显而易见。例如,酵母中的erlich途径(hazelwood等人2008.appl.environ.microbiol.74:2259-66;larroy等人2003.chem.biol.interact.143-144:229-38;larroy等人2002.eur.j.biochem.269:5738-45)是将会用作将早期bia途径中的许多中间体转化为非期望产物并且使来自合成途径的通量转向的主要内源途径。
此外,如本文所讨论和如表3中所提供的许多酶可在天然植物宿主中在非常特定的调节策略(包括部分调节)下行使功能,其可能在转移至异源酵母宿主时丢失。此外,植物呈现出与酵母细胞极为不同的生化环境,酶在所述生化环境下进化以行使功能,所述生化环境包括ph、氧化还原态,以及底物、辅底物、辅酶和辅因子可利用性。鉴于天然宿主与异源酵母宿主之间的生化环境和调节策略的差异,酶在处于酵母环境的背景下时是否将表现出显著活性并不清楚,并且它们是否将会一起作用以引导简单的前体如糖成为复杂的bia化合物也并不清楚。在酵母宿主中维持酶的活性是尤其重要的,因为许多途径具有许多反应步骤(>10),使得如果这些步骤无效,那么期望的下游产物的积累将不可预期。
此外,在天然植物宿主中,这些途径中的相关代谢物可遍布不同的细胞和组织类型进行定位。在若干实例中,存在可被特化用于生物合成的细胞类型和可被合成用于代谢物积累的细胞类型。当在异源酵母宿主内表达所述途径时,这种类型的细胞特化可能会丢失,并且可能在控制这些代谢物对细胞的毒性方面起到重要作用。因此,酵母是否可被成功工程化用于生物合成和积累这些代谢物而不受到这些化合物的毒性的伤害并不清楚。
作为一个实例,在天然植物宿主中,酶bbe被报道为具有动态的亚细胞定位。具体而言,酶bbe最初起始于er中,然后被分选至液泡(bird和facchini.2001.planta.213:888-97)。已经表明,植物中bbe与er的关联(alcantara等人2005.plantphysiol.138:173-83)提供对于bbe活性最佳的碱性ph(ph~8.8)(ziegler和facchini.2008.annu.rev.plantbiol.59:735-69)。作为另一个实例,有证据表明血根碱生物合成发生在植物细胞内的特化囊泡中(amann等人1986.planta.167:310-20),但是仅一些中间体在囊泡中积累。这可能发生以使得它们与其他酶活性和/或毒性作用相隔绝。
作为另一个实例,吗啡喃途径分支中的生物合成酶全部定位在韧皮部,韧皮部是植物中的维管组织的一部分。在韧皮部中,途径酶可在以下两种细胞类型之间进一步划分:所有植物共有的筛管成分;以及乳汁器,其为仅存在于制备特化的次生代谢物的某些植物中的特化细胞类型。上游酶(即,从ncs到salat)主要处于筛管成分中,并且下游酶(即,t6odm、cor、codm)大部分处于乳汁器中(onoyovwe等人2013.plantcell.25:4110-22)。另外,据发现,那可丁生物合成途径中的最终步骤发生在乳汁器中(chen和facchini.2014.plantj.77:173-84)。这种区室化被认为对于通过分离或运输中间体、提供最佳ph、增强辅因子供应来调节生物合成是高度重要的,但是罂粟乳汁器微环境的性质尚在研究中(ziegler和facchini.2008.annu.rev.plantbiol.59:735-69)。此外,据推测,几种酶可充当多酶复合物或植物次生代谢常见的代谢通道(kempe等人2009.phytochemistry.70:579-89;allen等人2004.nat.biotechnol.22:1559-66)。当来自不同宿主的生物合成酶进行组合和/或所述生物合成酶在异源酵母细胞中重组表达时,这些复合物或通道是否将会像它们在天然宿主中那样形成尚不清楚。在另一个实例中,在日本黄连中,小檗碱在根组织中进行生物合成,然后通过特化的atp结合盒转运蛋白的作用积累在根茎内(shitan等人2013.phytochemistry.91:109-16)。在鸦片罂粟中,吗啡喃生物碱积累在乳汁(乳汁器细胞的细胞质)内(martin等人1967.biochemistry.6:2355-63)。
此外,即使不考虑这些,也存在用于本文所述途径中的若干步骤的植物酶尚未得到表征的情况。例如,酪氨酸到早期苄基异喹啉生物碱支架去甲乌药碱的转化尚未得到表征。另外,如本文所述,最近才表征了(s)-牛心果碱向(r)-牛心果碱的转化。因此,对于本文所述途径中的若干步骤,通过使天然通常不一起存在的酶活性一起用于bia的生物合成,或由基因组序列信息鉴定新的酶活性以用于重构的途径中,从而产生备选的生物合成方案。
例如,可通过组合至少5种哺乳动物酶和1种细菌酶来实现酪氨酸到多巴胺的两步转化,所述至少5种哺乳动物酶和1种细菌酶天然不一起存在并且未进化成在该途径的背景下行使功能或与植物酶一起行使功能。在这些情况下,可能不太清楚是否可利用这些酶进行它们天然并未进化出的化合物的生物合成,以及它们在异源微生物宿主和该途径的背景下是否会有效发挥作用。在这些情况下,可能不太清楚是否可利用这些酶进行它们天然并未进化出的化合物的生物合成,以及它们在异源微生物宿主和该途径的背景下是否会有效地行使功能。
作为另一个实例,直到近几年才知道负责将(s)-牛心果碱转化为(r)-牛心果碱的酶。即使发现了融合的差向异构酶,进化分析也提示,产生吗啡的罂粟花会在氧化酶与还原酶之间进化出融合酶以进行差向异构酶反应,这与差向异构酶未融合的不产生吗啡的罂粟花形成对比。基于该分析,一些学者认为,氧化酶与还原酶部分的融合对于有效催化(s)-牛心果碱向(r)-牛心果碱的转化是必需的。使用本文讨论的工程化的拆分差向异构酶的新方法可以在酵母中和在合成bia途径的情况下进行该差向异构反应,并且与用野生型差向异构酶进行差向异构化相比,可以以更高的效率进行这种差向异构化。
下文讨论了作为修饰对象以便产生感兴趣的bia以及/或者感兴趣的酶的基因的实例。另外,在示出用于生成感兴趣的bia和/或感兴趣的酶的途径的一系列附图的背景下对所述基因进行讨论。
[tlk1]在一些实例中,工程化宿主细胞可改变转酮醇酶的表达。转酮醇酶由tkl1基因编码。在实例中,
[zwf1]在一些实例中,工程化宿主细胞可改变葡萄糖-6-磷酸脱氢酶的表达。葡萄糖-6-磷酸脱氢酶由zwf1基因编码。在实例中,葡萄糖-6-磷酸脱氢酶催化葡萄糖-6-磷酸→6-磷酸葡糖酸内酯的反应,参见图2。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失zwf1基因的编码区。或者,工程化宿主细胞可被修饰以使zwf1基因的功能性失效,如通过引入失活突变。
[aro4]在一些实例中,工程化宿主细胞可改变3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶的表达。dahp合酶由aro4基因编码。在实例中,dahp合酶催化赤藓糖-4-磷酸+磷酸烯醇式丙酮酸→dahp的反应,参见图2。工程化宿主细胞可修饰aro4基因以并入一个或多个反馈抑制缓解突变。具体而言,反馈抑制缓解突变(例如,aro4fbr)可如下并入:作为原始基因座处的天然aro4基因的定向突变;作为在单独基因座处作为遗传整合引入的另外的拷贝;或作为附加型载体如2-μm或着丝粒质粒上的另外的拷贝。突变aro4fbr中的标识符“fbr”称为反馈抗性突变体和突变。dahp合酶的反馈抑制拷贝可在天然酵母转录调节下,诸如当工程化宿主细胞为酵母细胞时。或者,可通过将dahp合酶的反馈抑制拷贝置于合成启动子的控制下,在蛋白质表达的工程化组成型或动态调节的情况下将所述dahp合酶的反馈抑制拷贝引入工程化宿主细胞中。在一些情况下,aro4基因可来源于酿酒酵母。在一些情况下,aro4基因可与天然存在的基因100%相似。aro4基因的修饰的实例包括反馈抑制抗性突变、k229l或q166k。
[aro7]在一些实例中,工程化宿主细胞可改变分支酸变位酶的表达。分支酸变位酶由aro7基因编码。在实例中,分支酸变位酶催化分支酸→预苯酸的反应,参见图2。工程化宿主细胞可修饰aro7基因以并入一个或多个反馈抑制缓解突变。具体而言,反馈抑制缓解突变(例如,aro7fbr)可如下并入:作为原始基因座处的天然aro7基因的定向突变;作为在单独基因座处作为遗传整合引入的另外的拷贝;或作为附加型载体如2-μm或着丝粒质粒上的另外的拷贝。突变aro7fbr中的标识符“fbr”称为反馈抗性突变体和突变。分支酸变位酶的反馈抑制拷贝可在天然酵母转录调节下,诸如当工程化宿主细胞为酵母细胞时。或者,可通过将分支酸变位酶的反馈抑制拷贝置于合成启动子的控制下,在蛋白质表达的工程化组成型或动态调节的情况下将所述分支酸变位酶的反馈抑制拷贝引入工程化宿主细胞中。在一些情况下,aro7基因可来源于酿酒酵母。在一些情况下,aro7基因可与天然存在的基因100%相似。aro7基因的修饰的实例包括反馈抑制抗性突变或t226i。
[aro10]在一些实例中,工程化宿主细胞可改变苯丙酮酸脱羧酶的表达。苯丙酮酸脱羧酶由aro10基因编码。在实例中,苯丙酮酸脱羧酶催化羟基苯丙酮酸→4-羟基苯乙酸(4hpa)的反应,参见图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括aro10基因的组成型过表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节aro10基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入aro10基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达aro10基因的强启动子元件的引入。aro10基因可来源于酿酒酵母或另外的物种。在一些实例中,aro10基因可与天然存在的基因100%相似。
[adh2-7、sfa1]在一些实例中,工程化宿主细胞可改变醇脱氢酶的表达。醇脱氢酶可由adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个编码。在实例中,醇脱氢酶催化4hpa→酪醇的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个的编码区。或者,工程化宿主细胞可被修饰以使adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个的功能性失效,如通过引入失活突变。
[ald2-6]在一些实例中,工程化宿主细胞可改变醛氧化酶的表达。醛氧化酶可由ald2、ald3、ald4、ald5和ald6基因中的一个或多个编码。在实例中,醛氧化酶催化4hpa→羟基苯乙酸的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失ald2、ald3、ald4、ald5和ald6基因中的一个或多个的编码区。或者,工程化宿主细胞可被修饰以使ald2、ald3、ald4、ald5和ald6基因中的一个或多个的功能性失效,如通过引入失活突变。
[aro9]在一些实例中,工程化宿主细胞可改变芳香族氨基转移酶的表达。芳香族氨基转移酶由aro9基因编码。在实例中,芳香族氨基转移酶催化羟基苯丙酮酸+l-丙氨酸→酪氨酸+丙酮酸的反应,参见图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括aro9基因的组成型过表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节aro9基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入aro9基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达aro9基因的强启动子元件的引入。aro9基因可来源于酿酒酵母或另外的物种。在一些实例中,aro9基因可与天然存在的基因100%相似。
[aro8]在一些实例中,工程化宿主细胞可改变芳香族氨基转移酶的表达。芳香氨基转移酶由aro8基因编码。在实例中,
[tyr1]在一些实例中,工程化宿主细胞可改变预苯酸脱氢酶的表达。预苯酸脱氢酶由tyr1基因编码。在实例中,预苯酸脱氢酶催化预苯酸+nadp+→4-羟基苯丙酮酸+co2+nadph的反应,参见图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tyr1基因的组成型过表达。另外或备选地,工程化宿主细胞可被修饰以合成性地调节tyr1基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入tyr1基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达tyr1基因的强启动子元件的引入。tyr1基因可来源于酿酒酵母或另外的物种。在一些实例中,tyr1基因可与天然存在的基因100%相似。
[tyr]在一些实例中,工程化宿主细胞可改变酪氨酸酶的表达。酪氨酸酶由tyr基因编码。在实例中,酪氨酸酶催化酪氨酸→l-dopa的反应,参见图2、12和13。在其他实例中,酪氨酸酶催化l-dopa→多巴醌的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tyr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节tyr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入tyr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达tyr基因的强启动子元件的引入。tyr基因可来源于青枯雷尔氏菌(ralstoniasolanacearum)、双孢蘑菇(agaricusbisporus)或另外的物种。在一些实例中,tyr基因可与天然存在的基因100%相似。
[tyrh]在一些实例中,工程化宿主细胞可改变酪氨酸羟化酶的表达。酪氨酸羟化酶由tyrh基因编码。在实例中,酪氨酸羟化酶催化酪氨酸→l-dopa的反应,参见图2、12和13。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tyrh基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节tyrh基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入tyrh基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达tyrh基因的强启动子元件的引入。tyrh基因可来源于智人、褐家鼠、小家鼠或另外的物种。在一些实例中,tyrh基因可与天然存在的基因100%相似。
[dodc]在一些实例中,工程化宿主细胞可改变l-dopa脱羧酶的表达。l-dopa脱羧酶由dodc基因编码。在实例中,l-dopa脱羧酶催化l-dopa→多巴胺的反应,参见图2、12和13。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dodc基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节dodc基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入dodc基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达dodc基因的强启动子元件的引入。dodc基因可来源于恶臭假单胞菌、褐家鼠或另外的物种。在一些实例中,dodc基因可与天然存在的基因100%相似。
[tydc]在一些实例中,工程化宿主细胞可改变酪氨酸/dopa脱羧酶的表达。酪氨酸/dopa脱羧酶由tydc基因编码。在实例中,酪氨酸/dopa脱羧酶催化l-dopa→多巴胺的反应,参见2、12和13。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tydc基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节tydc基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入tydc基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达tydc基因的强启动子元件的引入。tydc基因可来源于罂粟或另外的物种。在一些实例中,tydc基因可与天然存在的基因100%相似。
[mao]在一些实例中,工程化宿主细胞可改变单胺氧化酶的表达。单胺氧化酶由mao基因编码。在实例中,单胺氧化酶催化多巴胺→3,4-dhpa的反应,参见图2和13。工程化宿主细胞可被修饰以在工程化宿主细胞中包括mao基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节mao基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入mao基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达mao基因的强启动子元件的引入。在一些情况下,mao基因可针对在酿酒酵母中的表达进行密码子优化。mao基因可来源于大肠杆菌、智人、藤黄微球菌(micrococcusluteus)或另外的物种。在一些实例中,mao基因可与天然存在的基因77%相似。
[ncs]在一些实例中,工程化宿主细胞可改变去甲乌药碱合酶的表达。去甲乌药碱合酶由ncs基因编码。在实例中,去甲乌药碱合酶催化4hpa+多巴胺→(s)-去甲乌药碱的反应,参见图12和13。具体而言,图12示出了根据本发明的实施方案,用于通过去甲乌药碱将l-酪氨酸转化为牛心果碱的生物合成方案。图12提供了酶tyrh,酪氨酸羟化酶;dodc,dopa脱羧酶;ncs,去甲乌药碱合酶,如本文所讨论的;6omt,6-o-甲基转移酶;cnmt,乌药碱n-甲基转移酶;cyp80b1,细胞色素p45080b1;cpr,细胞色素p450nadph还原酶;4’omt,3’羟基-n-甲基乌药碱4’-o-甲基转移酶;l-dopa,l-3,4-二羟基苯丙氨酸;以及4-hpa,4-羟基苯基乙基醛的使用。在图12所示的酶中,4-hpa和l-酪氨酸在酵母中天然合成。所示出的所有其他代谢物不在酵母中天然产生。另外,尽管tyrh被描绘为催化l-酪氨酸到l-dopa的转化,还可使用其他酶进行这一步骤,如说明书中所描述。例如,还可使用酪氨酸酶进行l-酪氨酸到l-dopa的转化。此外,还可使用其他酶如细胞色素p450氧化酶进行l-酪氨酸到l-dopa的转化。此类酶可对包括l-dopa和l-酪氨酸在内的相关bia前体化合物表现出氧化酶活性。
另外,去甲乌药碱合酶催化3,4-dhpa+多巴胺→(s)-全去甲劳丹碱的反应,参见图13。具体而言,图13示出了根据本发明的实施方案,用于通过全去甲劳丹碱将l-酪氨酸转化为牛心果碱的生物合成方案。图13提供了酶tyrh,酪氨酸羟化酶;dodc,dopa脱羧酶;maoa,单胺氧化酶;ncs,去甲乌药碱合酶;6omt,6-o-甲基转移酶;cnmt,乌药碱n-甲基转移酶;4’omt,3’羟基-n-甲基乌药碱4’-o-甲基转移酶;l-dopa,l-3,4-二羟基苯丙氨酸;以及3,4-dhpa,3,4-二羟基苯乙醛的使用。在图13所示的酶中,l-酪氨酸在酵母中天然合成。图13所示的其他代谢物不在酵母中天然产生。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括ncs基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节ncs基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入ncs基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达ncs基因的强启动子元件的引入。另外,去甲乌药碱合酶可具有n末端截短。在一些情况下,ncs基因可针对在酿酒酵母中的表达进行密码子优化。ncs基因可来源于日本黄连、罂粟、大红罂粟、黄唐松草、岩黄连(corydalissaxicola)或另外的物种。在一些实例中,ncs基因可与天然存在的基因80%相似。
[6omt]在一些实例中,工程化宿主细胞可改变去甲乌药碱6-o-甲基转移酶的表达。去甲乌药碱6-o-甲基转移酶由6omt基因编码。在一些实例中,去甲乌药碱6-o-甲基转移酶催化去甲乌药碱→乌药碱的反应,参见图12。在其他实例中,去甲乌药碱6-o-甲基转移酶催化全去甲劳丹碱→3’羟基乌药碱的反应,以及本文详细描述的其他反应,如图13中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括6omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节6omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入6omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达6omt基因的强启动子元件的引入。6omt基因可来源于罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,6omt基因可与天然存在的基因100%相似。
[cnmt]在一些实例中,工程化宿主细胞可改变乌药碱-n-甲基转移酶的表达。乌药碱-n-甲基转移酶由cnmt基因编码。在一些实例中,乌药碱-n-甲基转移酶催化乌药碱→n-甲基乌药碱的反应,参见图12。在其他实例中,乌药碱-n-甲基转移酶可催化3’羟基乌药碱→3’羟基-n-甲基乌药碱的反应。在其他实例中,乌药碱-n-甲基转移酶可催化本文详细描述的其他反应,如图13中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括cnmt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cnmt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cnmt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cnmt基因的强启动子元件的引入。cnmt基因可来源于罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,cnmt基因可与天然存在的基因100%相似。
[4’omt]在一些实例中,工程化宿主细胞可改变4’-o-甲基转移酶的表达。4’-o-甲基转移酶由4’omt基因编码。在一些实例中,4’-o-甲基转移酶催化3’-羟基-n-甲基乌药碱→牛心果碱的反应,参见图12。在其他实例中,4’-o-甲基转移酶催化本文详细描述的其他反应,如图13中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括4’omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节4’omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入4’omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达4’omt基因的强启动子元件的引入。4’omt基因可来源于罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,4’omt基因可与天然存在的基因100%相似。
[cyp80b1]在一些实例中,工程化宿主细胞可改变酶细胞色素p45080b1的表达。细胞色素p45080b1由cyp80b1基因编码。在实例中,细胞色素p45080b1催化n-甲基乌药碱→3’-羟基-n-甲基乌药碱的反应,参见图12。工程化宿主细胞可被修饰以在工程化宿主细胞中包括细胞色素p45080b1基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节细胞色素p45080b1基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入细胞色素p45080b1基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达细胞色素p45080b1基因的强启动子元件的引入。在一些情况下,cyp80b1基因可针对在酿酒酵母中的表达进行密码子优化。细胞色素p45080b1基因可来源于罂粟、花菱草、黄唐松草或另外的物种。在一些实例中,p45080b1基因可与天然存在的基因77%相似。
[fol2]在一些实例中,工程化宿主细胞可改变gtp环化水解酶的表达。gtp环化水解酶由fol2基因编码。在一些实例中,gtp环化水解酶催化gtp→二氢新蝶呤三磷酸的反应,参见图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括fol2基因的组成型过表达。工程化宿主细胞也还被修饰以包含天然调节。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节fol2基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入fol2基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达fol2基因的强启动子元件的引入。fol2基因可来源于酿酒酵母、智人、小家鼠或另外的物种。在一些实例中,fol2基因可与天然存在的基因100%相似。
[ptps]在一些实例中,工程化宿主细胞可改变6-丙酮酰四氢生物蝶呤(ptp)合酶的表达。丙酮酰四氢生物蝶呤合酶由ptps基因编码。在一些实例中,6-丙酮酰四氢生物蝶呤合酶催化二氢新蝶呤三磷酸→ptp的反应,参见图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括ptps基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节ptps基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入ptps基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达ptps基因的强启动子元件的引入。在一些情况下,ptps基因可针对在酿酒酵母中的表达进行密码子优化。ptps基因可来源于褐家鼠、智人、小家鼠或另外的物种。在一些实例中,ptps基因可与天然存在的基因80%相似。
[sepr]在一些实例中,工程化宿主细胞可改变墨蝶呤还原酶的表达。墨蝶呤还原酶由sepr基因编码。在一些实例中,墨蝶呤还原酶催化ptp→bh4的反应,参见图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括sepr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节sepr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入sepr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达sepr基因的强启动子元件的引入。在一些情况下,sepr基因可针对在酿酒酵母中的表达进行密码子优化。sepr基因可来源于褐家鼠、智人、小家鼠或另外的物种。在一些实例中,sepr基因可与天然存在的基因72%相似。
[pcd]在一些实例中,工程化宿主细胞可改变4a-羟基四氢生物蝶呤(蝶呤-4α-甲醇胺)脱水酶的表达。4a-羟基四氢生物蝶呤脱水酶由pcd基因编码。在一些实例中,4a-羟基四氢生物蝶呤脱水酶催化4a-羟基四氢生物蝶呤→h2o+醌型二氢蝶啶的反应,参见图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括pcd基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节pcd基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入pcd基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达pcd基因的强启动子元件的引入。在一些情况下,pcd基因可针对在酿酒酵母中的表达进行密码子优化。pcd基因可来源于褐家鼠、智人、小家鼠或另外的物种。在一些实例中,pcd基因可与天然存在的基因79%相似。
[qdhpr]在一些实例中,工程化宿主细胞可改变醌型二氢蝶啶还原酶的表达。醌型二氢蝶啶还原酶由qdhpr基因编码。在一些实例中,醌型二氢蝶啶还原酶催化醌型二氢蝶啶→bh4的反应,参见图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括qdhpr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节qdhpr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入qdhpr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达qdhpr基因的强启动子元件的引入。在一些情况下,qdhpr基因可针对在酿酒酵母中的表达进行密码子优化。qdhpr基因可来源于褐家鼠、智人、小家鼠或另外的物种。在一些实例中,qdhpr基因可与天然存在的基因75%相似。
[dhfr]在一些实例中,工程化宿主细胞可改变二氢叶酸还原酶的表达。二氢叶酸还原酶由dhfr基因编码。在一些实例中,二氢叶酸还原酶催化7,8-二氢生物蝶呤(bh2)→5,6,7,8-四氢生物蝶呤(bh4)的反应,参见图1。该反应可用于回收bh4作为用于将酪氨酸转化为l-dopa的辅底物,如图12中所示。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dhfr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节dhfr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入dhfr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达dhfr基因的强启动子元件的引入。在一些情况下,dhfr基因可针对在酿酒酵母中的表达进行密码子优化。dhfr基因可来源于褐家鼠、智人或另外的物种。在一些实例中,dhfr基因可与天然存在的基因77%相似。
[drs-drr]如上文关于1-bia的差向异构化所论述的,工程化宿主细胞可改变bia差向异构酶的表达。bia差向异构酶由drs-drr基因编码。在一些实例中,drs-drr也可称为cyp-cor。在一些实例中,bia差向异构酶或bia差向异构酶的工程化拆分形式或工程融合形式催化(s)-1-bia→(r)-1-bia的转化,参见图14。具体而言,图14示出了根据本发明的实施方案,用于将l-酪氨酸转化为吗啡喃生物碱的生物合成方案。图14提供了酶cpr,细胞色素p450还原酶;drs-drr,脱氢牛心果碱合酶和脱氢牛心果碱还原酶;salsyn,沙罗泰里啶合酶;salr,沙罗泰里啶还原酶;salat,沙罗泰里啶醇7-o-乙酰基转移酶;ts,蒂巴因合酶;t6odm,蒂巴因6-o-脱甲基酶;cor,可待因酮还原酶;以及codm,可待因-o-脱甲基酶的使用。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括drs-drr基因或工程化drs-drr基因的组成型表达。在一些情况下,工程化drs-drr基因可以编码工程化的融合差向异构酶。在一些情况下,工程化drs-drr基因可以编码工程化的拆分差向异构酶。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节drs-drr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入drs-drr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达drs-drr基因的强启动子元件的引入。drs-drr基因可来源于大红罂粟、罂粟、渥美罂粟、白屈菜或另外的物种。在一些实例中,drs-drr基因可与天然存在的基因77%相似。
[cpr]在一些实例中,工程化宿主细胞可改变细胞色素p450还原酶的表达。细胞色素p450还原酶由cpr基因编码。在一些实例中,细胞色素p450还原酶催化(r)-牛心果碱→沙罗泰里啶的反应,参见图14。备选地,细胞色素p450还原酶催化其他反应,如整个申请的附图中所述的那些反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cpr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cpr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cpr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cpr基因的强启动子元件的引入。cpr基因可来源于花菱草、罂粟、智人、酿酒酵母、拟南芥或另外的物种。在一些实例中,cpr基因可与天然存在的基因100%相似。
[salsyn]在一些实例中,工程化宿主细胞可改变沙罗泰里啶合酶的表达。沙罗泰里啶合酶由salsyn基因编码。在一些实例中,沙罗泰里啶合酶催化(r)-牛心果碱→沙罗泰里啶的反应,参见图14。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salsyn基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节salsyn基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入salsyn基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达salsyn基因的强启动子元件的引入。在一些情况下,salsyn基因可针对在酿酒酵母中的表达进行密码子优化。在一些实例中,salsyn可以在n末端处进行修饰。salsyn基因可来源于罂粟、罂粟属的种、白屈菜或另外的物种。在一些实例中,salsyn基因可与天然存在的基因78%相似。
[salr]在一些实例中,工程化宿主细胞可改变沙罗泰里啶还原酶的表达。沙罗泰里啶还原酶由salr基因编码。在一些实例中,沙罗泰里啶还原酶可逆地催化沙罗泰里啶醇→沙罗泰里啶的反应,参见图14。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节salr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入salr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达salr基因的强启动子元件的引入。在一些情况下,salr基因可针对在酿酒酵母中的表达进行密码子优化。salr基因可来源于罂粟、大红罂粟、罂粟属的种、白屈菜或另外的物种。在一些实例中,salr基因可与天然存在的基因80-100%相似。
[salat]在一些实例中,工程化宿主细胞可改变乙酰-coa:沙罗泰里啶醇7-o-乙酰基转移酶的表达。乙酰-coa:沙罗泰里啶醇7-o-乙酰基转移酶由salat基因编码。在一些实例中,乙酰-coa:沙罗泰里啶醇7-o-乙酰基转移酶催化乙酰-coa+沙罗泰里啶醇→coa+7-o-乙酰基沙罗泰里啶醇的反应,参见图14。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salat基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节salat基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入salat基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达salat基因的强启动子元件的引入。在一些情况下,salat基因可针对在酿酒酵母中的表达进行密码子优化。salat基因可来源于罂粟、大红罂粟、东方罂粟(papaverorientale)、罂粟属的种或另外的物种。在一些实例中,salat基因可与天然存在的基因77-80%相似。
[ts]在一些实例中,工程化宿主细胞可改变蒂巴因合酶的表达。蒂巴因合酶由ts基因编码。在一些实施例中,蒂巴因合酶或工程化的蒂巴因合酶催化7-o-乙酰基沙罗泰里啶醇→蒂巴因+乙酸的反应,参见图14。在一些实例中,7-o-乙酰基沙罗泰里啶醇→蒂巴因+乙酸的反应自发发生,但是蒂巴因合酶催化该反应的一部分。特别地,图14示出了根据本发明的实施方案,用于将l-酪氨酸转化为吗啡喃生物碱的生物合成方案。图14提供了酶cpr,细胞色素p450还原酶;drs-drr,脱氢牛心果碱合酶和脱氢牛心果碱还原酶;salsyn,沙罗泰里啶合酶;salr,沙罗泰里啶还原酶;salat,沙罗泰里啶醇7-o-乙酰基转移酶;ts,蒂巴因合酶;t6odm,蒂巴因6-o-脱甲基酶;cor,可待因酮还原酶;以及codm,可待因-o-脱甲基酶的使用。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括ts基因或工程化ts基因的组成型表达。在一些情况下,工程化ts基因可以编码工程化的融合酶。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节ts基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入ts基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达ts基因的强启动子元件的引入。在一些情况下,ts基因可针对在酿酒酵母中的表达进行密码子优化。ts基因可来源于罂粟、大红罂粟、东方罂粟(papaverorientale)、罂粟属的种或另外的物种。来源于罂粟、大红罂粟、东方罂粟、罂粟属的种或其他物种。在一些实例中,ts基因可以与天然存在的基因75-80%相似。
[t6odm]在一些实例中,工程化宿主细胞可改变蒂巴因6-o-脱甲基酶的表达。蒂巴因6-o-脱甲基酶由t6odm基因编码。在一些实例中,蒂巴因6-o-脱甲基酶催化蒂巴因→尼奥品酮的反应,参见图14、15和16。一旦已经产生尼奥品酮,尼奥品酮可转化为可待因酮。尼奥品酮→可待因酮的转化可自发发生。或者,尼奥品酮→可待因酮的转化可由于催化反应而发生。在其他实例中,t6odm酶可催化除蒂巴因之外的底物的o-脱甲基化。例如,t6odm可使东罂粟碱o-脱甲基化,产生吗啡酮。或者,t6odm可催化1-苄基异喹啉、原小檗碱或原阿片碱种类之内的bia(如分别为罂粟碱、坎那定和别隐品碱(allocryptopine))的o-脱甲基化。工程化宿主细胞可被修饰以在工程化宿主细胞中包括t6odm基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节t6odm基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入t6odm基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达t6odm基因的强启动子元件的引入。在一些情况下,t6odm基因可针对在酿酒酵母中的表达进行密码子优化。t6odm基因可来源于罂粟或另外的物种。在一些实例中,t6odm基因可与天然存在的基因76.2%相似。
[cor]在一些实例中,工程化宿主细胞可改变可待因酮还原酶的表达。可待因酮还原酶由cor基因编码。在一些实例中,可待因酮还原酶催化可待因酮到可待因的反应,参见图14、15和16。在一些情况下,可待因酮还原酶可催化尼奥品酮到尼奥品的反应。在其他实例中,cor可催化其他吗啡喃的还原,包括氢可酮→二氢可待因、14-羟基可待因酮→14-羟基可待因,以及氢吗啡酮→二氢吗啡。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cor基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cor基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cor基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cor基因的强启动子元件的引入。在一些情况下,cor基因可针对在酿酒酵母中的表达进行密码子优化。另外地或备选地,cor基因可通过添加针对线粒体、液泡、内质网或其组合的靶向序列进行修饰。cor基因可来源于罂粟或另外的物种。在一些实例中,cor基因可与天然存在的基因76-78%相似。在实例中,cor基因可与天然存在的基因76.8%、77.0%、77.3%或77.7%相似。
[codm]在一些实例中,工程化宿主细胞可改变可待因o-脱甲基酶的表达。可待因o-脱甲基酶由codm基因编码。在一些实例中,可待因o-脱甲基酶催化可待因到吗啡的反应,参见图14、15和16。可待因o-脱甲基酶还可催化尼奥品到尼奥吗啡的反应。可待因o-脱甲基酶还可催化蒂巴因到东罂粟碱的反应。在其他实例中,codm可催化1-苄基异喹啉、阿朴啡和原小檗碱种类之内的bia(如分别为牛心果碱、异紫堇定和金黄紫堇碱)的o-脱甲基化。在其他实例中,codm酶可催化o,o-脱亚甲基化反应,以切割原阿片碱中的亚甲基二氧桥结构。工程化宿主细胞可被修饰以在工程化宿主细胞中包括codm基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节codm基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入codm基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达codm基因的强启动子元件的引入。在一些情况下,codm基因可针对在酿酒酵母中的表达进行密码子优化。另外地或备选地,codm基因可通过添加针对线粒体的靶向序列进行修饰。codm基因可来源于罂粟、罂粟属的种或另外的物种。在一些实例中,codm基因可与天然存在的基因75%相似。在实例中,codm基因可与天然存在的基因75.2%相似。
[bbe]在一些实例中,工程化宿主细胞可改变小檗碱桥酶的表达。小檗碱桥酶由bbe基因编码。在一些实例中,小檗碱桥酶催化(s)-牛心果碱→(s)-金黄紫堇碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括bbe基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节bbe基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入bbe基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达bbe基因的强启动子元件的引入。bbe基因可来源于罂粟、蓟罂粟、花菱草、匍枝小檗、黄唐松草粉绿亚种(thalictrumflavumsubsp.glaucum)、日本黄连、罂粟属的种或另外的物种。在一些实例中,bbe基因可与天然存在的基因99%相似。
[s9omt]在一些实例中,工程化宿主细胞可改变s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶的表达。s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶由s9omt基因编码。在一些实例中,s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶催化s-腺苷-l-甲硫氨酸+(s)-金黄紫堇碱→s-腺苷-l-高半胱氨酸+(s)-四氢非洲防己碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括s9omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节s9omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入s9omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达s9omt基因的强启动子元件的引入。在一些情况下,s9omt基因可针对在酿酒酵母中的表达进行密码子优化。s9omt基因可来源于黄唐松草粉绿亚种、日本黄连、黄连、罂粟、唐松草属的种、黄连属的种、罂粟属的种或另外的物种。在一些实例中,s9omt基因可与天然存在的基因100%相似。在一些实例中,s9omt基因可与天然存在的基因80%相似。
[cas]在一些实例中,工程化宿主细胞可改变(s)-坎那定合酶的表达。(s)-坎那定合酶由cas基因编码。在一些实例中,(s)-坎那定合酶催化(s)-四氢非洲防己碱→(s)-坎那定的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中表达cas基因。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cas基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cas基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cas基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cas基因的强启动子元件的引入。cas基因可来源于黄唐松草粉绿亚种、日本黄连、唐松草属的种、黄连属的种或另外的物种。在一些实例中,cas基因可与天然存在的基因100%相似。
[stox]在一些实例中,工程化宿主细胞可改变(s)-四氢原小檗碱氧化酶的表达。(s)-四氢原小檗碱氧化酶由stox基因编码。在一些实例中,(s)-四氢原小檗碱氧化酶催化(s)-四氢小檗碱+2o2→小檗碱+2h2o2的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括stox基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节stox基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入stox基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达stox基因的强启动子元件的引入。在一些实例中,stox可在n末端处进行修饰。在一些情况下,stox基因可针对在酿酒酵母中的表达进行密码子优化。stox基因可来源于金花小檗、日本黄连、小檗属的种、黄连属的种或另外的物种。在一些实例中,stox基因可与天然存在的基因78%相似。
[tnmt]在一些实例中,工程化宿主细胞可改变四氢原小檗碱-n-甲基转移酶的表达。四氢原小檗碱-n-甲基转移酶由tnmt基因编码。在一些实例中,四氢原小檗碱-n-甲基转移酶催化坎那定→n-甲基坎那定的反应,在一些实例中,四氢小檗碱-n-甲基转移酶催化去甲羟吗啡酮→纳洛酮的反应。
在其他实例中,四氢小檗碱-n-甲基转移酶催化刺罂粟碱→顺式-n-甲基刺罂粟碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tnmt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节tnmt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入tnmt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达tnmt基因的强启动子元件的引入。在一些情况下,tnmt基因可针对在酿酒酵母中的表达进行密码子优化。tnmt基因可来源于罂粟、花菱草、大红罂粟、蓟罂粟或另外的物种。在一些实例中,tnmt基因可与天然存在的基因100%相似。在实例中,tnmt基因可与天然存在的基因81%相似。
[cfs]在一些实例中,工程化宿主细胞可改变碎叶紫堇碱合酶的表达。碎叶紫堇碱合酶由cfs基因编码。在实例中,碎叶紫堇碱合酶催化金黄紫堇碱→碎叶紫堇碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cfs基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cfs基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cfs基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cfs基因的强启动子元件的引入。cfs基因可来源于罂粟、花菱草、蓟罂粟或另外的物种。在一些实例中,cfs基因可与天然存在的基因77%、78%或79%相似。另外,cfs基因可针对在酿酒酵母中的表达进行密码子优化。
在一些实例中,工程化宿主细胞可改变刺罂粟碱合酶的表达。刺罂粟碱合酶由sts基因编码。在实例中,刺罂粟碱合酶催化碎叶紫堇碱→刺罂粟碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括sts基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节sts基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入sts基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达sts基因的强启动子元件的引入。sts基因可来源于罂粟、花菱草、蓟罂粟或另外的物种。在一些实例中,sts基因可与天然存在的基因76%、78%或79%相似。另外,sts基因可针对在酿酒酵母中的表达进行密码子优化。
[msh]在一些实例中,工程化宿主细胞可改变顺式-n-甲基刺罂粟碱14-羟化酶的表达。顺式-n-甲基刺罂粟碱14-羟化酶由msh基因编码。在实例中,顺式-n-甲基刺罂粟碱14-羟化酶催化顺式-n-甲基刺罂粟碱→原阿片碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括msh基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节msh基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入msh基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达msh基因的强启动子元件的引入。msh基因可来源于罂粟或另外的物种。在一些实例中,msh基因可与天然存在的基因79%相似。另外,msh基因可针对在酿酒酵母中的表达进行密码子优化。
[p6h]在一些实例中,工程化宿主细胞可改变原阿片碱-6-羟化酶的表达。原阿片碱-6-羟化酶由p6h基因编码。在实例中,原阿片碱-6-羟化酶催化原阿片碱→6-羟基原阿片碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括p6h基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节p6h基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入p6h基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cfs基因的强启动子元件的引入。p6h基因可来源于罂粟、花菱草或另外的物种。在一些实例中,p6h基因可与天然存在的基因79%相似。另外,p6h基因可针对在酿酒酵母中的表达进行密码子优化。
[dbox]在一些实例中,工程化宿主细胞可改变二氢苯并菲啶氧化酶的表达。二氢苯并菲啶氧化酶由dbox基因编码。在实例中,二氢苯并菲啶氧化酶催化二氢血根碱→血根碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dbox基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节dbox基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入dbox基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达dbox基因的强启动子元件的引入。dbox基因可来源于罂粟或另外的物种。在一些实例中,dbox基因可与天然存在的基因100%相似。另外,dbox基因可针对在酿酒酵母中的表达进行密码子优化。
[mora]在一些实例中,工程化宿主细胞可改变吗啡脱氢酶的表达。吗啡脱氢酶由mora基因编码。在一些实例中,吗啡脱氢酶催化吗啡→吗啡酮的反应,参见图15。在其他实例中,吗啡脱氢酶催化可待因酮→可待因的反应,同样参见图15。图15示出了根据本发明的实施方案,用于产生半合成的阿片样物质的生物合成方案。具体而言,图15示出了通过并入mora(吗啡脱氢酶)和morb(吗啡还原酶),蒂巴因在酵母中延伸的转化。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括mora基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节mora基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入mora基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达mora基因的强启动子元件的引入。在一些情况下,mora基因可针对在酿酒酵母中的表达进行密码子优化。mora基因可来源于恶臭假单胞菌或另外的物种。在一些实例中,mora基因可与天然存在的基因73.7%相似。
[morb]在一些实例中,工程化宿主细胞可改变吗啡酮还原酶的表达。吗啡酮还原酶由morb基因编码。在一些实例中,吗啡酮还原酶催化可待因酮→氢可酮的反应,参见图15。在其他实例中,吗啡酮还原酶催化吗啡酮→氢吗啡酮的反应,同样参见图15。在其他实例中,吗啡酮还原酶催化14-羟基可待因酮→羟考酮的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括morb基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节morb基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入morb基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达morb基因的强启动子元件的引入。在一些情况下,morb基因可针对在酿酒酵母中的表达进行密码子优化。morb基因可来源于恶臭假单胞菌或另外的物种。在一些实例中,morb基因可与天然存在的基因67.2%相似。
[cyp80a1]在一些实例中,工程化宿主细胞可表达酶小檗宁合酶。小檗宁合酶由针对细胞色素p450酶80a1(cyp80a1)的基因编码。在一些实例中,cyp80a1催化(s)-n-甲基乌药碱+(r)-n-甲基乌药碱→小檗宁的反应。在其他实例中,cyp80a1催化(r)-n-甲基乌药碱+(r)-n-甲基乌药碱→guattegaumerine的反应。在其他实例中,cyp80a1催化(r)-n-甲基乌药碱+(s)-乌药碱→2’去甲小檗宁的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cyp80a1基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节cyp80a1基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入cyp80a1基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达cyp80a1基因的强启动子元件的引入。在一些情况下,cyp80a1基因可针对在酿酒酵母中的表达进行密码子优化。cyp80a1基因可来源于匍枝小檗或另外的物种。在一些实例中,cyp80a1基因可与天然存在的基因76%相似。
[poda]在一些实例中,工程化宿主细胞可表达酶原阿片碱o-脱烷基酶。原阿片碱o-脱烷基酶由基因poda编码。在一些实例中,poda催化原小檗碱类和原阿片碱类如坎那定、刺罂粟碱、小檗碱、隐品碱、别隐品碱和原阿片碱的o,o-脱亚甲基化。在一些实例中,poda催化包括四氢罂粟碱、四氢巴马亭和隐品碱在内的bia的o-脱甲基化。工程化宿主细胞可被修饰以在工程化宿主细胞中包括poda基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节poda基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入poda基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过表达poda基因的强启动子元件的引入。在一些情况下,poda基因可针对在酿酒酵母中的表达进行密码子优化。poda基因可来源于罂粟或其他物种。在一些实例中,poda基因可与天然存在的基因70-100%相似。
[bm3]在一些实例中,工程化宿主细胞可表达酶bm3。bm3是在其天然宿主中与脂肪酸单加氧化有关的巨大芽孢杆菌(bacillusmegaterium)细胞色素p450。在一些情况下,bm3使阿片样物质发生n-脱甲基化以产生去甲阿片样物质,参见图9。在一些情况下,宿主细胞被修饰为除了其他异源酶之外还表达bm3,以产生nal-阿片样物质或去甲阿片样物质,参见图10。工程化宿主细胞可被修饰以包括bm3基因在工程化宿主细胞中的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调节bm3基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以并入bm3基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以并入用于在工程化宿主细胞内过度表达bm3基因的强启动子元件的引入。bm3作为生物合成酶具有若干优点,包括其是可溶的、带有融合的还原酶伙伴蛋白以及可容易地被工程化以接受新的底物。另外,表8示出了bm3n-脱甲基酶的变体。
前述基因的实例可由宿主细胞中多种不同的平台表达,包括质粒(2μ,ars/cen)、yac或基因组。另外,前述基因序列的实例可以是天然的,或针对在所需异源宿主(例如,酿酒酵母)中的表达而密码子优化的。
实施例
以下实施例为了说明本发明的各个实施方案的目的而给出,并非意味着以任何方式限制本发明。在注明的情况下,表达构建体应被理解为并入了合适的启动子、基因和终止子,即使未指定所用的确切终止子序列。本发明实施例以及目前代表优选实施方案的本文所述的方法是示例性的,并非旨在限制本发明的范围。本领域技术人员将会想到包含在由权利要求范围限定的本发明精神内的其变化以及其他用途。
实施例1:用于吗啡喃生物碱生产的酶的生物信息学鉴定
用来自每种假定的酶类别的代表性变体的氨基酸序列查询onekp(matascin等人.2014.dataaccessforthe1,000plants(1kp)project.gigascience3:17)和phytometasyn(xiaom等人.2013.transcriptomeanalysisbasedonnext-generationsequencingofnon-modelplantsproducingspecializedmetabolitesofbiotechnologicalinterest.jbiotechnol166:122–34)植物转录组数据库。具体而言,搜索包括许多产生感兴趣的苄基异喹啉生物碱的植物物种的基础真双子叶植物进化枝。从这些搜索中鉴定出大量序列,并且通过构建系统树来缩小候选序列的列表。在构建系统树时,包括来自产生吗啡喃生物碱的植物物种的类似已知和表征的酶的序列。这些参考序列有助于发展对序列之间的关系的理解,并进一步限制序列空间,以鉴定最有可能表现出所需活性的候选物。使用该方法为betv1/pr10/主要胶乳蛋白类别的酶生成的系统树的实例在图21中示出。
实施例2:drs-drr可被截短以形成单独的drs和drr酶的氨基酸位置。
使用clustalomega(http://www.ebi.ac.uk/tools/msa/clustalo/)生成pbdrs-drr相对于来自虞美人的脱氢牛心果碱合酶(drs)和脱氢牛心果碱还原酶(drr)的一级氨基酸序列的比对。基于与来自虞美人的drr的比对,我们鉴定出将pbdrs-drr分离成drs和drr酶的截短点,其中在位置m569处发现了保守的甲硫氨酸残基(seqidno.16)。该残基对应于seqidno.18的位置1。在图17中,残基d568与m569之间的黑色箭头表示pbdrs-drr被截短的位点。将基于pbdrs-drr的单独drs酶设计为在位置d568处终止。虚线箭头指向pbdrs-drr中与来自虞美人的drs或drr不保守或同源的区域。生成在这些非保守残基中的每一个之后的截短,即在黑盒内开始于k557并结束于d568的序列,并且在与pdw21相同的载体骨架中测定drs的每个连续截短的活性(drr在tef1启动子的控制下)。将这些质粒分别转化到在单独的质粒(dw24)上携带pbsalsyn的报道酵母菌株ya106中。
为了增殖携带工程化drs-drr(或单独的drs和drr)酶的酵母菌株,使用标准分子生物学技术用表达质粒转化报道菌株,并在选择性条件下(如合成的完全2%右旋糖,不含色氨酸)从固体琼脂培养基板中分离单个酵母菌落。将菌落接种到液体培养基中,并在30℃下生长2天。然后将培养物传代培养到相同组成的新鲜培养基中,或者在一些情况下,传代培养到含有8%麦芽糖糊精的合成完全液体培养基中。为了从麦芽糖糊精聚合物中释放单糖,以约3u/l的浓度添加来自黑曲霉的淀粉葡糖苷酶(sigma)。酵母菌株在30℃下再生长3天或4天,通过离心分离培养物,并通过lc-ms直接测定上清液中的沙罗泰里啶浓度。
质粒和菌株
实施例3:被工程化为由葡萄糖和简单氮源产生(s)-牛心果碱的平台酵母菌株
构建由l-酪氨酸产生关键分支点bia中间体(s)-牛心果碱的平台酵母菌株(图12)。具体而言,将四种多基因表达构建体整合到酵母菌株的基因组中。四种构建体的组成在图18中指出。每种构建体由酵母启动子表达的4或5种基因组成。将基因定位在每个基因座处作为包含启动子、基因开放阅读框和终止子的完整表达盒,如示意图上方的注释中所指明的。示意图通过代表给定基因的箭头的方向示出每个表达盒的取向。选择性标记在注释中是斜体的并且在示意图中通过灰色箭头表示。每个选择标记侧翼为loxp位点,以允许从基因座移除标记。另外,每个构建体具有侧翼为loxp位点的选择性标记,以便其可通过cre重组酶移除。
在第一整合构建体中,将来自褐家鼠的四种异源基因与g418选择标记(kanmx)一起整合到ybr197c基因座中。需要rnptps、rnsepr、rnpcd和rnqdhpr由酵母内源叶酸合成途径来合成和再生四氢生物蝶呤(bh4),如图1所示。每个基因针对在酵母中的表达进行密码子优化。
在第二整合构建体中,将四种异源基因与his5选择标记一起整合到his3基因座中。褐家鼠酪氨酸羟化酶(rntyrh)使用由先前的整合构建体生成的辅底物bh4将酪氨酸转化为l-dopa。rntyrh基因可以是野生型的,或是赋予增强活性的改善的突变体(例如,w166y、r37e和r38e)中的任一种。第二褐家鼠基因rndhfr编码将二氢生物蝶呤(bh4的氧化产物)还原为bh4的酶,以这种方式增加该辅底物的可用性。第三构建体中还包含来自恶臭假单胞菌的ppdodc(一种将l-dopa转化为多巴胺的酶)。第四种酶为来自日本黄连的cjncs,其缩合4-hpa与多巴胺以制备去甲乌药碱。每个基因均针对在酵母中的表达进行密码子优化。
在第三整合构建体中,将来自植物的五种异源基因和leu2选择标记整合到基因座ydr514c中。ps6omt、ps4’omt和pscnmt为来自罂粟的甲基转移酶并且以天然植物核苷酸序列表达。第四罂粟基因ypscprv2针对酵母进行密码子优化并且编码支持来自花菱草的细胞色素p450的活性的还原酶eccyp80a1。在该构建体中编码的酶进行两次o-甲基化、一次n-甲基化和一次羟基化,以由先前的整合构建体产生的去甲乌药碱产生牛心果碱。每个基因都针对在酵母中的表达进行密码子优化。
在最后的整合构建体中,将酿酒酵母内源基因aro4q166k、aro7t226i、tyr1和aro10的另外拷贝与潮霉素抗性选择标记一起整合到aro4基因座中。aro4q166k和aro7t226i为aro4和aro10的反馈抗性突变体,其各自编码相对于野生型序列的单个碱基对置换。tyr1和aro10与天然酵母基因相同,但是在强启动子后方表达。aro4p和aro7p是包括酪氨酸在内的芳香族氨基酸的生物合成中的酶。去除这些酶的反馈抑制导致内源酪氨酸生物合成的上调。tyr1p的过表达上调酪氨酸生物合成,从而上调酪氨酸的产生。aro10p的过表达增加4-hpa的产生。
可利用任何数目的所述四种表达盒构建平台酵母菌株。具体而言,利用整合构建体1-4和整合构建体1-3构建平台酵母菌株。在其中不包括酪氨酸过量产生构建体(构建体4)的后一种菌株中,可在培养基中供应额外的酪氨酸以支持牛心果碱的生物合成。可将另外的遗传修饰并入平台菌株中,以支持下游bia的产生和通往bia生物合成的通量增加。
使酵母菌株在具有适当的氨基酸撤除成分溶液的合成完全培养基中在30℃下生长。在生长48和96小时之后通过lc-ms/ms分析对培养基上清液中的bia代谢物进行分析。
实施例4a:被工程化为由葡萄糖和简单氮源产生蒂巴因的平台酵母菌株
酵母菌株可被工程化为由早期前体如酪氨酸产生吗啡喃生物碱蒂巴因。作为实例,实施例3中所述的平台酵母菌株可被进一步工程化以由l-酪氨酸产生吗啡喃生物碱产物(图14)。
由l-酪氨酸产生(s)-牛心果碱的平台酵母菌株(参见实施例3中的描述)被进一步工程化,以并入工程化的拆分差向异构酶drs-drr、工程化的沙罗泰里啶合酶、沙罗泰里啶还原酶、沙罗泰里啶醇乙酰基转移酶和蒂巴因合酶,以将生物合成的(s)-牛心果碱转化为第一吗啡喃生物碱蒂巴因(图14)。将三个表达盒(ptdh3-yeccfs1-26-ypbss33-504、ptpi1-ypbsalr、ptef1-ypssalat)组装到具有bler选择性标记的整合构建体中,并整合到平台酵母菌株中的基因座trp1内。将另外三个表达盒(ptdh3-ypbdrs、ptef1-ypbdrr、ppgk1-ypsts)组装到具有ura3选择性标记的整合构建体中,并整合到平台酵母菌株中的基因座ypl250cδ内。这两种构建体的组成在图19中示出。
使携带整合盒的酵母菌株在具有适当的撤除成分溶液的合成完全培养基中在30℃下生长。生长96小时后,针对bia代谢物通过lc-ms/ms分析对培养基进行分析。
实施例4b:经由工程化酵母菌株由葡萄糖和简单氮源产生蒂巴因
如实施例3和4所述对酵母菌株进行工程化,以直接由标准生长培养基中存在的单糖(例如葡萄糖)和氮源产生五环吗啡喃生物碱蒂巴因。具体而言,将酿酒酵母的cen.pk菌株工程化为通过整合到酵母染色体中来表达以下异源酶:tyrh、dodc、ptps、sepr、pcd、qdhpr、ncs、6omt、cnmt、cyp80b1、cpr、4omt、drs、drr、salsyn、salr、salat和ts。在该实施例中,对salsyn酶进行工程化,以使其前导序列被来自花菱草(eschscholziacalifornica)chelanthifoline合酶(eccfs)的n端的83个氨基酸替代。对该菌株进行了另外的修饰,以增加bia前体积累,包括:aro10的过表达、tyr1的过表达、反馈抗性aro4(aro4q166k)的表达和反馈抗性aro7(aro7t226i)的表示。如所述制备单独的工程化酵母菌株,其携带编码蒂巴因合酶活性(ts)的酶的不同变体,包括seqidno.35(即ts1)、37(即ts2)和35的变体,其具有前22个氨基酸的n端截短(即tts1),并且没有蒂巴因合酶(ya397)。这些酶变体的序列在表2中提供。
将描述的酵母菌株接种到2ml含2%葡萄糖的合成完全培养基(酵母含氮碱基和氨基酸)中,并在30℃下生长约4小时。然后,将10ul的每种培养物转移到96孔板中的400ul新鲜培养基中,一式四份,并在30℃下再生长48小时。生产培养基含有1x酵母氮肉汤和氨基酸、20mm抗坏血酸、300mg/l酪氨酸、40g/l麦芽糖糊精和2单位/l的淀粉酶。使用淀粉酶模拟补料分批过程,并逐渐从麦芽糖糊精聚合物中释放葡萄糖,以便酵母可以用其作为碳源。通过离心从培养基中分离细胞,并通过lc-ms/ms分析直接测定上清液中的蒂巴因浓度。所有工程化酵母菌株均由生长培养基中存在的葡萄糖和简单氮源产生蒂巴因(图22和23)。在所述发酵条件下,具有蒂巴因合酶活性的菌株相对于不具有该活性的菌株产生更高水平的蒂巴因。
实施例5:被工程化为由葡萄糖和简单氮源产生下游吗啡喃生物碱的酵母菌株
可以对酵母菌株进行工程化,以由诸如酪氨酸的早期前体产生下游吗啡喃生物碱。例如,可对实施例4中所述的平台酵母菌株进行进一步工程化,以由l-酪氨酸产生下游吗啡喃生物碱产物(图14)。
由l-酪氨酸产生蒂巴因的平台酵母菌株(参见实施例5中的描述)被进一步工程化,以并入蒂巴因6-o-脱甲基酶、可待因酮还原酶和可待因酮-o-去甲基酶,以将生物合成的蒂巴因转化为下游吗啡喃生物碱,包括吗啡(图14)。三个表达盒(padh1-t6odm-tadh1、phxt7-cor-tpgk1、ptef1-codm-tcyc1)直接与trp1选择性标记组装在一起,并整合到蒂巴因平台酵母菌株中的trp1基因座中(thodey等人,2014)。
携带整合盒的酵母菌株在具有适当滴落溶液的合成完全培养基中30℃生长。生长96小时后,通过lc-ms/ms分析来分析培养基中的bia代谢物。
实施例6:被工程化为由葡萄糖和简单氮源产生半合成阿片样物质的酵母菌株
可以对酵母菌株进行工程化,以由诸如酪氨酸的早期前体产生下游吗啡喃生物碱。例如,可对实施例4和5中所述的酵母菌株进行进一步工程化,以由l-酪氨酸产生半合成的阿片样产物(图15)。
由l-酪氨酸产生下游吗啡喃生物碱的酵母菌株(参见实施例4中的描述)被进一步工程化,以并入吗啡脱氢酶和吗啡酮还原酶,以将生物合成的蒂巴因转化为下游吗啡喃生物碱,包括吗啡(图15)。两个表达盒(pgpd-mora-tcyc1、ppgk1-morb-tpho5)直接与kanmx选择性标记组装在一起,并整合到下游产生吗啡喃生物碱的酵母菌株的ho基因座内(thodey等人,2014)。
携带整合盒的酵母菌株在具有适当滴落溶液的合成完全培养基中30℃生长。生长96小时后,通过lc-ms/ms分析来分析培养基中的bia代谢物。
实施例7:被工程化为由葡萄糖和简单氮源产生o-去甲基化阿片样化合物的微生物菌株
将表4中列出的对吗啡喃生物碱表现出o-脱甲基酶活性的酶并入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中(如实施例5所述)。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并进行进一步修饰然后经历由蒂巴因合酶催化的氧-碳偶联反应以得到第一吗啡喃生物碱结构蒂巴因(参见图14)。表3列出了完整途径中的酶和活性。
图10示出了根据本发明的实施方案,微生物细胞中的生物合成方案。将由所述细胞内源产生的和/或在培养基中提供的酪氨酸转化为羟考酮(虚线箭头代表多个酶促步骤)。然后使羟考酮进行3-o-脱甲基化为羟吗啡酮,并进行n-脱甲基化为去甲羟吗啡酮。最后,n-甲基转移酶接受来自sam类似物的烯丙基和环丙基甲基碳部分,以分别产生纳洛酮和纳曲酮。
为了检测产生吗啡喃生物碱分子的菌株中的o-脱甲基酶活性,通过发酵繁殖表达来自质粒载体或染色体整合盒的候选酶的细胞,并收集细胞上清液以分析总阿片样物质曲线(如上所述)。通过lc-ms检测携带完整bia途径的菌株中阿片样分子的o-脱甲基化(如上所述)。具体而言,检测羟考酮到羟吗啡酮的转化。为了检测通过生物催化的o-脱甲基化活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供阿片样底物(参见图6)和酶功能所必需的其他辅因子。通过lc-ms检测阿片样分子的o-脱甲基化。
实施例8:被工程化为由葡萄糖和简单氮源产生n-去甲基化阿片样化合物的微生物菌株
将表5中列出的对吗啡喃生物碱表现出n-脱甲基酶活性的酶并入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中(如实施例6所述)。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并进一步修饰,之后经历由蒂巴因合酶催化的氧-碳偶联反应,以得到第一吗啡喃生物碱结构蒂巴因(参见图14)。表3列出了完整途径中的酶和活性。
为了检测产生吗啡喃生物碱分子的菌株中的n-脱甲基酶活性,通过发酵繁殖表达来自质粒载体或染色体整合盒的候选酶的细胞,并收集细胞上清液以分析总阿片样物质曲线(如上所述)。通过lc-ms检测携带完整bia途径的菌株中阿片样分子的n-脱甲基化(如上所述)。具体而言,检测羟吗啡酮到去甲羟吗啡酮的转化。为了检测通过生物催化的n-脱甲基化活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供阿片样底物(参见图7)和酶功能所必需的其他辅因子。通过lc-ms检测阿片样分子的n-脱甲基化。
实施例9:被工程化为由葡萄糖和简单氮源产生nal-阿片样化合物的微生物菌株
将表6中列出的对吗啡喃生物碱表现出n-甲基化酶活性的酶并入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中(如实施例6所述)。图10显示了从前体分子蒂巴因到最终nal-阿片样化合物纳洛酮和纳曲酮的完整反应方案的实例。这些菌株还表达来自实施例8和9以及表3的酶,其负责由完整bia途径产生去甲阿片样化合物。n-甲基化酶还在缺乏生物合成途径的微生物菌株(例如,针对于酿酒酵母的cen.pk2或针对于大肠杆菌的bl21)中表达,以产生能够对几种不同的外源供应的底物分子进行生物催化的菌株。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并对其进行进一步修饰然后经历由蒂巴因合酶催化的氧-碳偶联反应以得到第一吗啡喃生物碱结构蒂巴因(参见图14)。表3列出了完整途径中的酶和活性。
为了检测具有针对去甲阿片样物质的完整bia途径的菌株中的n-修饰活性(参见图10),通过发酵繁殖表达候选酶的细胞(如上所述),并与图8中列出的那些sam或sam类似物一起温育。通过lc-ms在上清液中检测携带完整bia途径的菌株中的去甲阿片样物质或其他bia分子的酶促修饰(如上所述)。为了检测通过生物催化的n-修饰活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供sam或sam类似物,以及酶功能所必需的其他辅因子。具体而言,检测去甲羟吗啡酮到纳洛酮和纳曲酮的转化(使用sam类似物烯丙基-sam或环丙烷-sam,如图8所示)。通过lc-ms检测去甲阿片样或其他bia分子的修饰。为了检测在不具有完整bia途径的菌株中通过生物催化的n-修饰活性,使表达所述异源酶的cen.pk2菌株在选择培养基中培养,并通过玻璃珠破坏来裂解。向细胞裂解物外源地提供sam或sam类似物、酶功能所必需的辅因子以及去甲阿片样分子,如图8和表3中列出的那些。通过lc-ms检测这些化合物的修饰。
表3:酶列表
表4:o-脱甲基酶候选酶
表5:n-脱甲基酶候选酶
表6:n-甲基转移酶和n-修饰的候选酶
表7.bm3n-脱甲基酶的变体
表8:pa24、pa25和pa26序列
表9.裁剪酶
表10.罂粟杆浓缩物和澄清的酵母培养基中可能存在的杂质的比较。
表11:澄清的酵母培养基(cycm)中存在的不同组的分子。与罂粟杆浓缩物(cps)不同,酵母宿主菌株可被工程化以产生预定类别的生物碱分子(即,每种菌株仅有一个生物合成途径),使得不存在其他类别的生物碱。因此,cycm可包含单个生物合成途径内的分子,包括跨越一列或两列的分子的子集,而cps可包含跨越许多列的分子的子集。
表12:化合物的化学合成制剂中可能存在的杂质
尽管本文已经示出并描述了本发明的优选实施方案,但对于本领域技术人员将会显而易见的是,这些实施方案仅以示例的方式提供。本领域技术人员在不脱离本发明的情况下现将想到多种变化、改变和替代。应当理解,本文描述的本发明实施方案的各种替代方案可用于实施本发明。旨在以下述权利要求限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!