基质金属蛋白酶-1反义寡核苷酸的制作方法
本发明涉及互补地靶向人基质金属蛋白酶-1前体mrna(pre-mrna)以改善由基质金属蛋白酶-1介导的皮肤衰老的肽核酸衍生物。
背景技术:
由于衰老的迹象在皮肤中最明显,因此皮肤衰老受到了相当的关注。由于皮肤衰老的预防和治疗对生活质量非常重要,因此已经衰老的人以及年轻人对相关的保健食品、化妆品、药品、医疗用品等都非常感兴趣。有两个主要的皮肤衰老过程。一种是伴随年龄增长的内在或自然衰老,另一种是外在衰老,这是由外源性因素例如阳光暴晒、吸烟和营养不良引起的。
紫外线照射暴露在皮肤上会加速基质金属蛋白酶1(mmp-1)的表达,从而促进胶原蛋白的降解,胶原蛋白是真皮的主要结构成分。此外,吸烟诱导皮肤中基质金属蛋白酶-1mrna,导致与紫外线照射暴露在皮肤上的结果相同[j.cosmeticdermatologyvol6,40-50(2007)]。
胶原蛋白是皮肤、血管、骨骼、牙齿和肌肉等各种结缔组织中细胞外间隙的主要结构蛋白。由于胶原蛋白负责支持大多数组织和细胞结构,因此其降解和变形可能会严重影响皮肤衰老[j.pathol.vol211,241-251(2007)]。
基质金属蛋白酶是由成纤维细胞、角质细胞等分泌的酶,其能降解各种细胞外基质(ecm)和基底膜(bm)。已鉴定出26种以上的基质金属蛋白酶,例如mmp-1(间质胶原酶)、mmp-2(明胶酶)、mmp-3(溶基质素)、mmp-7(基质溶素)、mmp-8(嗜中性粒细胞胶原酶)和mmp-12(金属弹性蛋白酶)[j.biol.chem.vol277,451-454(2002);j.matrix.biol.vol15,519-526(1997)]。
已知由紫外线照射暴露和吸烟引起的活性氧是基质金属蛋白酶-1过表达的原因。从这个意义上说,已开发出抗氧化剂和具有抗氧化作用的功能性食品,例如维生素a(视黄醇)、维生素c(抗坏血酸)、维生素e(生育酚)、类胡萝卜素、类黄酮、绿茶和硒,用于治疗皮肤衰老,关于其作用机制的研究目前正在进行中[int.j.foodsci.technol.vol73,989-996(2005);kor.j.aesthet.cosmetol.vol11,649-654(2013);int.j.mol.med.vol38,357-363(2016)]。
考虑到金属蛋白酶-1在皮肤衰老中的重要性,基于金属蛋白酶-1表达的机制开发可改善和预防皮肤衰老状况的药物或化妆品是非常感兴趣和必要的。
前体-mrna:遗传信息携带在dna(2-脱氧核糖核酸)上。dna在细胞核中被转录以产生前体mrna(前体信使核糖核酸)。哺乳动物前体mrna通常由外显子和内含子组成,外显子和内含子以下图所示方式相互连接。外显子和内含子的编号如下图所示。
前体mrna的剪接:通过统称作“剪接”的一系列复杂反应,在内含子缺失后,前体mrna被加工成mrna,如下图所示[ann.rev.biochem.72(1),291-336(2003);naturerev.mol.cellbiol.6(5),386-398(2005);naturerev.mol.cellbiol.15(2),108-121(2014)]。
剪接是通过在前体mrna和剪接适体因子之间形成“剪接体e复合体”(即早期剪接体复合体)而启始。在“剪接体e复合体”中,u1结合在外显子n和内含子n的连接处,u2af35结合在内含子n和外显子(n+1)的连接处。因此,外显子/内含子或者内含子/外显子的连接对于早期剪接体复合体的形成至关重要。在与u2进一步复合后,“剪接体e复合体”演变为“剪接体a复合体”。“剪接体a复合体”经历一系列复杂反应,缺失或剪接去除内含子以邻接相邻的外显子。
核糖体蛋白质合成:蛋白质由dna(2-脱氧核糖核酸)编码。响应于细胞刺激或自发地,dna在细胞核中被转录以产生前体mrna(前体信使核糖核酸)。前体mrna的内含子被酶解剪接除去以产生mrna(信使核糖核酸),然后将其易位至细胞质中。在细胞质中,称作核糖体的翻译机制复合物与mrna结合,并随着其沿着mrna扫描编码的遗传信息进行蛋白质合成[biochemistryvol41,4503-4510(2002);cancerres.vol48,2659-2668(1988)]。
反义寡核苷酸(aso):序列特异性方式(即互补地)与核酸包括dna、mrna和前体mrna结合的寡核苷酸称为反义寡核苷酸(aso)。
例如,如果aso与细胞质中的mrna紧密结合,则aso可抑制沿着mrna的核糖体蛋白质合成。aso需要存在于细胞质中,以抑制其靶蛋白的核糖体蛋白质合成。
剪接的反义抑制:如果aso与细胞核中的前体mrna紧密结合,则aso可抑制或调节前体mrna变为mrna的剪接。aso需要存在于细胞核内,以抑制或调节前体mrna变为mrna的剪接。这种对剪接的反义抑制产生了一或多种缺少被aso靶向的外显子的mrna。这种mrna被称为“剪接变体”,编码的蛋白质小于由全长mrna编码的蛋白质。
原则上,剪接可以通过抑制“剪接体e复合体”的形成而中断。如果aso与(5’→3’)外显子-内含子的连接处即“5’剪接位点”紧密结合,则aso阻断前体mrna与因子u1之间的复合体形成,及因此阻断“剪接体e复合体”的形成。同样,如果aso紧密结合(5’→3’)内含子-外显子的连接处,即“3’剪接位点”,则不能形成“剪接体e复合体”。
在下图中示意性地说明了3’剪接位点和5’剪接位点。
非天然寡核苷酸:dna或rna寡核苷酸易被内源核酸酶降解,从而限制了其治疗用途。迄今为止,已经开发并深入研究了许多类型的非天然(天然不存在的)寡核苷酸[clin.exp.pharmacol.physiol.vol33,533-540(2006)]。与dna和rna相比,其中一些显示出扩展的代谢稳定性。以下提供了一些代表性的非天然寡核苷酸的化学结构。预测这种寡核苷酸可与dna或rna一样结合互补核酸。
b:核碱基
硫代磷酸酯寡核苷酸:硫代磷酸酯寡核苷酸(pto)是一种dna类似物,每个单体中的一个主链磷酸酯氧原子被硫原子取代。这种小的结构变化使pto对核酸酶降解具有相对抗性[ann.rev.biochem.vol54,367-402(1985)]。
反映了pto和dna主链的结构相似性,其在大多数哺乳动物细胞类型中均难以渗透过细胞膜。但是,对于某些类型的大量表达dna转运蛋白的细胞,dna和pto表现出良好的细胞通透性。已知全身施用的pto易于分布到肝和肾[nucleicacidsres.vol25,3290-3296(1997)]。
为了促进pto在体外的细胞渗透,脂质转染已被普遍实践。但是,脂质转染会物理性地改变细胞膜,引起细胞毒性,因此对于长期体内治疗应用而言不是理想的。
在过去的30年中,已经对反义pto和pto变体进行了临床评估,以治疗癌症、免疫系统疾病、代谢性疾病等[biochemistryvol41,4503-4510(2002);clin.exp.pharmacol.physiol.vol33,533-540(2006)]。部分由于pto的不良细胞通透性,许多这种反义候选药物尚未成功开发。为了克服不良的细胞通透性,为了治疗活性需要以高剂量施用pto。然而,已知pto与剂量限制性毒性有关,包括增加的凝血时间、补体激活、肾小管肾病、kupffer细胞激活以及免疫刺激,包括脾肿大、淋巴样增生、单个核细胞浸润[clin.exp.pharmacol.physiol.vol33,533-540(2006)]。
已发现许多反义pto对于肝或肾主要所致疾病示出预期的临床活性。mipomersen是一种pto类似物,其抑制apob-100(参与ldl胆固醇转运的蛋白质)的合成。mipomersen在动脉粥样硬化患者中表现出预期的临床活性,这很可能是由于其优先分布在肝脏中所致[circulationvol118(7),743-753(2008)]。isis-113715是一种pto反义类似物,其抑制蛋白质酪氨酸磷酸1b(ptp1b)的合成,且发现在ii型糖尿病患者中示出治疗活性[curr.opin.mol.ther.vol6,331-336(2004)]。
锁核酸:在锁核酸(lna)中,rna的主链核糖环在结构上受限以增加对rna或dna的结合亲和力。因此,lna可以被认为是高亲和力dna或rna类似物[biochemistryvol45,7347-7355(2006)]。
磷酸二酰胺吗啉代寡核苷酸:在磷酸二酰胺吗啉代寡核苷酸(pmo)中,dna的主链磷酸酯和2-脱氧核糖分别被氨基磷酸酯和吗啉置换[appl.microbiol.biotechnol.vol71,575-586(2006)]。dna主链是负电荷的,而pmo主链无电荷。因此,pmo和mrna之间的结合在主链之间没有静电排斥,且倾向于比dna和mrna之间的结合更强。由于pmo与dna在结构上非常不同,因此pmo不被识别dna或rna的肝转运蛋白识别。但是,pmo不能轻易穿透细胞膜。
肽核酸:肽核酸(pna)是一种以n-(2-氨基乙基)甘氨酸为单位主链的多肽,由nielsen博士及其同事发现[sciencevol254,1497-1500(1991)]。下图提供了pna的化学结构和简称。与dna和rna一样,pna也选择性地结合互补核酸[nature(london)vol365,566-568(1992)]。与互补核酸结合时,pna的n末端被认为等价于dna或rna的“5’末端”,pna的c末端等价于dna或rna的“3’末端”。
与pmo一样,pna主链无电荷。因此,pna和rna之间的结合倾向于比dna和rna之间的结合更强。由于pna在化学结构上与dna明显不同,因此pna不会被识别dna的肝转运蛋白识别,且示出与dna或pto不同的组织分布特征。然而,pna也很难穿透哺乳动物细胞膜[adv.drugdeliveryrev.vol55,267-280(2003)]。
改善pna的膜通透性的修饰的核碱基:通过导入具有阳离子脂质或与其共价附着的等价物的修饰的核碱基,使pna对哺乳动物细胞膜具有高通透性。这种修饰的核碱基的化学结构在下文提供。发现胞嘧啶、腺嘌呤和鸟嘌呤的这种修饰的核碱基可预测地和互补地分别与鸟嘌呤、胸腺嘧啶和胞嘧啶杂交[pct申请号pct/kr2009/001256;ep2268607;us8680253]。
将这种修饰的核碱基掺入pna类似于脂质转染的情况。通过脂质转染,具有磷酸酯主链的寡核苷酸分子被阳离子脂质分子如lipofectamine包裹,这种lipofectamine/寡核苷酸复合物与裸露的寡核苷酸分子相比倾向于容易透过细胞膜。
除了良好的膜通透性外,还发现这些pna衍生物对互补核酸具有超强的亲和性。例如,在11-13碱基(13-mer)pna衍生物上导入4-5个修饰的核碱基,在与互补dna形成双链体时容易获得20℃或更高的tm增益。这种pna衍生物对单个碱基错配高度敏感。取决于修饰碱基的类型以及pna序列,单个碱基错配导致tm损失11-22℃。
小干扰rna(sirna):小干扰rna(sirna)是指20-25个碱基对的双链rna[microbiol.mol.biol.rev.vol67(4),657-685(2003)]。sirna的反义链以某种方式与蛋白质相互作用形成“rna诱导的沉默复合物”(risc)。然后,risc结合与sirna反义链互补的mrna的特定部分。与risc复合的mrna经历裂解。因此,sirna催化性诱导其靶mrna裂解,及因此抑制mrna的蛋白质表达。risc不总是结合其靶mrna内的完全互补序列,这引起了与sirna治疗的脱靶作用相关的担忧。与其他具有dna或rna主链的寡核苷酸类别一样,sirna的细胞通透性差,因此除非通过适当配制或化学修饰以具有良好的膜通透性,否则倾向表现出不良的体外或体内治疗活性。
基质金属蛋白酶-1sirna:据报道,靶向人mmp-1mrna内19-碱基rna序列的mmp-1sirna在100nm脂质转染后抑制人软骨肉瘤mmp-1mrna和蛋白质的表达[j.orthop.res.vol23,1467-1474(2005)]。这个结果可用于研究mmp-1相关的癌症转移和癌症治疗方法的开发。
技术实现要素:
要解决的问题
已经开发出用于治疗皮肤衰老的抗氧化剂和具有抗氧化作用的功能性食品,但是其功效有限,目前正在进行作用机理的研究。尽管据报道mmp-1相关sirna在体外可抑制mmp-1mrna和蛋白质的表达,但sirna的生产成本过高,为了实现良好的用户顺应性,需要通过经皮施用将其递送至皮肤。因此,考虑到金属蛋白酶-1在皮肤衰老中的重要性,基于金属蛋白酶-1表达的机理来开发可改善和预防皮肤衰老状况的药物和化妆品是非常感兴趣和必要的。
问题的解决方案
本发明提供了式i所示肽核酸衍生物或其药学上可接受的盐:
[式i]
其中,
n是10-21之间的整数;
式i所示化合物与人mmp-1前体mrna中[(5’→3’)cauauauggugaguau]所示16碱基前体mrna序列具有至少10碱基互补重叠;
式i所示化合物与人mmp-1前体mrna完全互补,或者与人mmp-1前体mrna部分互补,具有一或两个错配;
s1,s2,…,sn-1,sn,t1,t2,…,tn-1,和tn独立地表示氢基、氘基、取代或未取代的烷基,或者取代或未取代的芳基;
x和y独立地表示氢基,氘基,甲酰基[hc(=o)-],氨基羰基[nh2-c(=o)-],氨基硫羰基[nh2-c(=s)-],取代或未取代的烷基,取代或未取代的芳基,取代或未取代的烷氧基,取代或未取代的芳氧基,取代或未取代的烷酰基,取代或未取代的芳基酰基,取代或未取代的烷氧基羰基,取代或未取代的芳氧基羰基,取代或未取代的烷基氨基羰基,取代或未取代的芳基氨基羰基,取代或未取代的烷基氨基硫代羰基,取代或未取代的芳基氨基硫代羰基,取代或未取代的烷氧基硫代羰基,取代或未取代的芳氧基硫代羰基,取代或未取代的烷基磺酰基,取代或未取代的芳基磺酰基,取代或未取代的烷基膦酰基,或者取代或未取代的芳基膦酰基;
z代表氢基,氘基,羟基,取代或未取代的烷氧基,取代或未取代的芳氧基,取代或未取代的氨基,取代或未取代的烷基,或者取代或未取代的芳基;
b1,b2,…,bn-1和bn独立地选自包括腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶和尿嘧啶的天然核碱基,以及非天然核碱基;及
b1,b2,…,bn-1和bn中的至少四个独立地选自非天然核碱基,具有与核碱基部分共价连接的取代或未取代的氨基。
式i所示化合物诱导人mmp-1前体mrna中“外显子5”跳过(skipping),产生缺少“外显子5”的人mmp-1mrna剪接变体,因此可用于抑制转录人mmp-1前体mrna的基因的功能活性。
“n是10-21之间的整数”的条件从字面上意味着n是可选自11、12、13、14、15、16、17、18、19和20一组整数的整数。
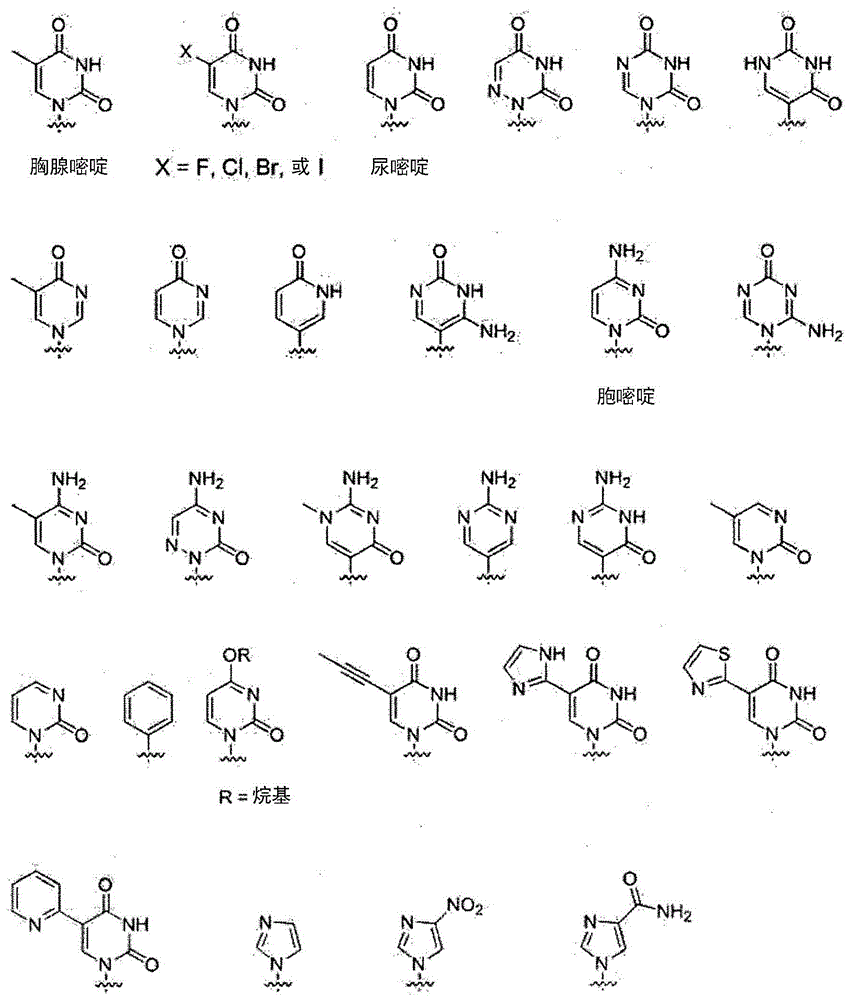
式i所示pna衍生物中天然或非天然核碱基的化学结构在图1a-1c中举例说明。本发明的天然(即天然存在的)或非天然的(天然不存在的)核碱基包括但不限于图1a-1c中提供的核碱基。提供这种非天然核碱基是示例容许的核碱基的多样性,因此不应解释为限制本发明的范围。
用于描述式i所示pna衍生物的取代基在图2a-2e中举例说明。图2a提供了取代或未取代烷基的实例。取代或未取代的烷基酰基和取代或未取代的芳基酰基在图2b中举例说明。图2c示例了取代或未取代的烷基氨基、取代或未取代的芳基氨基、取代或未取代的芳基、取代或未取代的烷基磺酰基或芳基磺酰基以及取代或未取代的烷基膦酰基或芳基膦酰基的实例。图2d提供了取代或未取代的烷氧基羰基或芳氧基羰基、取代或未取代的烷基氨基羰基或芳基氨基羰基的实例。在图2e中提供了取代或未取代的烷基氨基硫代羰基、取代或未取代的芳基氨基硫代羰基、取代或未取代的烷氧基硫代羰基以及取代或未取代的芳氧基硫代羰基的实例。提供这样的示例取代基是为了说明允许的取代基的多样性,因此不应解释为限制本发明的范围。本领域技术人员可以易于理解寡核苷酸序列是寡核苷酸与靶前体mrna序列在n末端或c末端的取代基之上序列特异性结合的主要因素。
如现有技术[pct/kr2009/001256]中所示,式i所示化合物与互补dna紧密结合。式i所示pna衍生物与其全长互补dna或rna之间的双链体具有太高的tm值,以致于不能在水性缓冲液中可靠地确定。式i所示pna化合物与更短长度的互补dna具有高tm值。
式i所示化合物与人mmp-1前体mrna的“外显子5”的5’剪接位点互补结合。[ncbi参考序列:ng_011740]。16-碱基序列[(5’→3’)cauauauggugaguau]跨越人mmp-1前体mrna中“外显子5”和“内含子5”的连接处,由来自“外显子5”的8个碱基和来自“内含子5”的8个碱基组成。因此,该16-碱基前体mrna序列通常可以表示为[(5’→3’)cauauaug┃gugaguau],其中外显子和内含子序列分别以“大写”和“小写”字母表示,外显子-内含子连接处用“┃”表示。前体mrna的常规表示形式由30-碱基序列[(5’→3’)uccaagccauauaug┃gugaguauggggaaa]表示,该序列跨越人mmp-1前体mrna中“外显子5”和“内含子5”的连接处。。
式i所示化合物紧密结合从人mmp-1基因转录的人mmp-1前体mrna的靶5’剪接位点,及干扰“剪接体早期复合物”的形成以产生缺少“外显子5”(外显子5跳过)的mmp-1mrna剪接变体。
即使当pna衍生物与mmp-1前体mrna中靶5’剪接位点具有一或两个错配时,强大的rna亲和性也可以使式i所示化合物诱导mmp-1“外显子5”跳过。类似地,式i所示pna衍生物仍可在在靶剪接位点具有一或两个snp(单核苷酸多态性)的mmp-1突变体前体mrna中诱导mmp-1“外显子5”跳过。
式i所示化合物具有良好的细胞通透性,及可以作为“裸”寡核苷酸容易地递送到细胞中,如现有技术[pct/kr2009/001256]所示。因此,本发明的化合物在mmp-1前体mrna中诱导“外显子5”跳过,及在用式(i)所示化合物作为“裸”寡核苷酸处理的细胞中产生缺少mmp-1“外显子5”的mmp-1mrna剪接变体。式i所示化合物不需要任何手段或配制即可递送到细胞中以在细胞中有效诱导靶外显子跳过。在用本发明化合物作为“裸”寡核苷酸以亚飞摩尔浓度处理的细胞中,式i所示化合物容易诱导mmp-1“外显子5”跳过。
由于良好的细胞或膜通透性,式i所示pna衍生物可以作为“裸”寡核苷酸表面施用,以诱导皮肤中mmp-1“外显子5”的跳过。式i所示化合物不需要为指定的治疗或生物学活性而配制以增加透皮输送至靶组织中。通常,将式i所示化合物溶于水和共溶剂中,以亚皮摩尔浓度表面或透皮施用,以在靶皮肤中引起所需的治疗或生物学活性。本发明的化合物不需要重度或侵入性配制以引起表面治疗活性。然而,式i所示pna衍生物可以与化妆品成分或佐剂一起配制成表面用乳膏或洗剂。这种表面用化妆乳膏或洗剂可用于处理皮肤衰老。
本发明的化合物可以以1am至高于1nm的治疗或生物学有效浓度表面施用给对象,所述浓度可根据给药方案、对象的状况或状态等而变化。
式i所示pna衍生物可以被不同地配制,包括但不限于注射剂、鼻喷雾剂、透皮贴剂等。另外,式i所示pna衍生物可以以治疗有效剂量施用给对象,所述施用剂量可以根据适应症、施用途径、给药方案、对象的状况或状态等而变化。
式i所示化合物可以与药学上可接受的酸或碱组合使用,所述酸或碱包括但不限于氢氧化钠、氢氧化钾、盐酸、甲磺酸、柠檬酸、三氟乙酸等。
式i所示pna衍生物或其药学上可接受的盐可以与药学上可接受的佐剂组合施用给对象,所述佐剂包括但不限于柠檬酸、盐酸、酒石酸、硬脂酸、聚乙二醇、聚丙二醇、乙醇、异丙醇、碳酸氢钠、蒸馏水、防腐剂等。
感兴趣的是式i所示pna衍生物或其药学上可接受的盐:
其中,
n是10-21之间的整数;
式i所示化合物与人mmp-1前体mrna中16-碱基前体mrna序列[(5’→3’)cauauauggugaguau]具有至少10-碱基互补重叠;
式i所示化合物与人mmp-1前体mrna完全互补,或与人mmp-1前体mrna具有一或两个错配而部分互补;
s1,s2,…,sn-1,sn,t1,t2,…,tn-1和tn独立地表示氢基、氘基;
x和y独立地表示氢基,氘基,甲酰基[hc(=o)-],氨基羰基[nh2-c(=o)-],氨基硫代羰基[nh2-c(=s)-],取代或未取代的烷基,取代或未取代的芳基,取代或未取代的烷氧基,取代或未取代的芳氧基,取代或未取代的烷基酰基,取代或未取代的芳基酰基,取代或未取代的烷氧基羰基,取代或未取代的芳氧基羰基,取代或未取代的烷基氨基羰基,取代或未取代的芳基氨基羰基,取代或未取代的烷基氨基硫代羰基,取代或未取代的芳基氨基硫代羰基,取代或未取代的烷氧基硫代羰基,取代或未取代的芳氧基硫代羰基,取代或未取代的烷基磺酰基,取代或未取代的芳基磺酰基,取代或未取代的烷基膦酰基,或者取代或未取代的芳基膦酰基;
z代表氢基,羟基,取代或未取代的烷氧基,取代或未取代的芳氧基,或者取代或未取代的氨基;
b1,b2,…,bn-1和bn独立地选自包括腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶和尿嘧啶的天然核碱基,以及非天然核碱基;
b1,b2,…,bn-1和bn中的至少四个独立地选自式ii、式iii或式iv表示的非天然核碱基;
其中,
r1,r2,r3,r4,r5和r6独立地选自氢基和取代或未取代的烷基;
l1,l2和l3是由式v表示的共价接头,其将碱性氨基基团与核碱基部分共价连接:
[式v]
其中,
q1和qm是取代或未取代的亚甲基(-ch2-),及qm直接连接于碱性氨基基团;
q2,q3,…和qm-1独立地选自取代或未取代的亚甲基,氧(-o-),硫(-s-)以及取代或未取代的氨基[-n(h)-,或-n(取代基)-];及,
m是1-15之间的整数。
特别感兴趣的是式i所示pna寡聚物或其药学上可接受的盐:
其中,
n是11-16之间的整数;
式i所示化合物与人mmp-1前体mrna中16-碱基前体mrna序列[(5’→3’)cauauauggugaguau]具有至少10-碱基互补重叠;
式i所示化合物与人mmp-1前体mrna完全互补;
s1,s2,…,sn-1,sn,t1,t2,…,tn-1和tn是氢基;
x和y独立地代表氢基,取代或未取代的烷基酰基,或取代或未取代的烷氧基羰基;
z代表取代或未取代的氨基;
b1,b2,…,bn-1和bn独立地选自包括腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶和尿嘧啶的天然核碱基,以及非天然核碱基;
b1,b2,…,bn-1和bn中的至少五个独立地选自式ii、式iii或式iv表示的非天然核碱基;
r1,r2,r3,r4,r5和r6是氢基;
q1和qm是亚甲基,及qm直接连接于碱性氨基基团;
q2,q3,…,和qm-1独立地选自亚甲基和氧基;及
m是1-9之间的整数。
更感兴趣的是式i所示pna衍生物或其药学上可接受的盐:
其中,
n是11-16之间的整数;
式i所示化合物与人mmp-1前体mrna中的16-碱基前体mrna序列[(5’→3’)cauauauggugaguau]具有至少10-碱基互补重叠;
式i所示化合物与人mmp-1前体mrna完全互补;
s1,s2,…,sn-1,sn,t1,t2,…,tn-1和tn是氢基;
x是氢基;
y代表取代或未取代的烷氧基羰基;
z代表取代或未取代的氨基;
b1,b2,…,bn-1和bn独立地选自包括腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶和尿嘧啶的天然核碱基,以及非天然核碱基;
b1,b2,…,bn-1和bn中的至少五个独立地选自式ii、式iii或式iv表示的非天然核碱基;
r1,r2,r3,r4,r5和r6是氢基;
l1表示-(ch2)2-o-(ch2)2-,-ch2-o-(ch2)2-,-ch2-o-(ch2)3-,-ch2-o-(ch2)4-或-ch2-o-(ch2)5-,右侧末端与碱性氨基基团直接连接;及
l2和l3独立地选自-(ch2)2-o-(ch2)2-,-(ch2)3-o-(ch2)2-,-(ch2)2-o-(ch2)3-,-(ch2)2-,-(ch2)3-,-(ch2)4-,-(ch2)5-,-(ch2)6-,-(ch2)7-,和-(ch2)8-,右侧末端与碱性氨基基团直接连接。
特别感兴趣的是式i所示pna衍生物,其是下文提供的化合物(aso1,反义寡核苷酸1)或其药学上可接受的盐:
(n→c)fethoc-ta(6)c-tca(6)-cc(1o2)a(6)-ta(6)t-a(6)t-nh2
其中,
a、t和c分别是具有腺嘌呤、胸腺嘧啶和胞嘧啶的天然核碱基的pna单体;
c(poq)和a(p)是分别具有由式vi和式vii表示的非天然核碱基的pna单体;
其中,
在aso1中,p和q是整数,且p是1或6以及q是2;及
“fethoc-”是“[[2-(9-芴基)乙基-1-氧基]羰基”的缩写,且“-nh2”是未取代的“-氨基”基团。
图3总体明确地提供了缩写为a、g、t、c、c(poq)、a(p)、a(poq)、g(p)和g(poq)的pna单体的化学结构。如现有技术[pct/kr2009/001256]中所讨论的,由于c(poq)与“鸟嘌呤”杂交而被认为是“修饰的胞嘧啶”pna单体。由于a(p)和a(poq)与“胸腺嘧啶”杂交而被视为“修饰的腺嘌呤”pna单体。
为了说明这种pna衍生物的缩写,图4中提供了aso1的化学结构。
aso1等价于“(5’→3’)tac-tca-cca-tat-at”的dna序列,与前体mrna互补结合。14-碱基pna与跨越人mmp-1前体mrna中“外显子5”和“内含子5”连接处的30-碱基rna序列[(5’→3’)
在一些实施方案中,本发明提供了在对象中治疗与人mmp-1基因转录相关的疾病或状况的方法,包括给对象施用本发明的肽核酸衍生物或其药学上可接受的盐。
在一些实施方案中,本发明提供了一种治疗对象皮肤衰老的方法,包括给对象施用本发明的肽核酸衍生物或其药学上可接受的盐。
在一些实施方案中,本发明提供了用于治疗与人mmp-1基因转录有关的疾病或状况的药物组合物,其包含本发明的肽核酸衍生物或其药学上可接受的盐。
在一些实施方案中,本发明提供了用于治疗与人mmp-1基因转录相关的疾病或状况的化妆品组合物,其包含本发明的肽核酸衍生物或其药学上可接受的盐。
在一些实施方案中,本发明提供了用于治疗皮肤衰老的药物组合物,其包含本发明的肽核酸衍生物或其药学上可接受的盐。
在一些实施方案中,本发明提供了用于治疗皮肤衰老的化妆品组合物,其包含本发明的肽核酸衍生物或其药学上可接受的盐。
与人mmp-1基因转录有关的疾病或状况可以通过施用式i所示pna衍生物或其药学上可接受的盐治疗。
与皮肤衰老有关的疾病或状况可以通过施用式i所示pna衍生物或其药学上可接受的盐治疗。
附图简述
图1a-1c:式i所示肽核酸衍生物可选择的天然或非天然(修饰的)核碱基实例。
图2a-2e:式i所示肽核酸衍生物可选择的取代基实例。
图3:具有天然或修饰的核碱基的pna单体的化学结构。
图4:“aso1”的化学结构。
图5:用于合成本发明的pna衍生物的fmoc-pna单体的化学结构。
图6a-6b:分别在hplc纯化之前和之后的“aso1”的c18反相hplc色谱图。
图7:通过c18-rp制备型hplc纯化的“aso1”的esi-tof质谱图。
图8:hdf中“aso1”抑制mmp-1mrna形成(实时qpcr)。
图9a-9b:hdf中“aso1”抑制mmp-1蛋白表达(蛋白质表达水平变化的western印迹和图)。
图10a-10b:hdf中“aso1”增强胶原蛋白表达(蛋白质表达水平变化的western印迹和图)。
图11a-11b:细胞外液中“aso1”抑制mmp-1蛋白表达(蛋白质表达水平变化的western印迹和图)。
图12a-12b:细胞外液中“aso1”增强胶原蛋白表达(蛋白质表达水平变化的western印迹和图)。
图13:细胞外液中“aso1”抑制mmp-1蛋白表达(elisa)。
实施本发明的最佳模式
制备pna寡聚物的一般程序
根据现有技术[us6,133,444;wo96/40685]公开的方法略加修改,基于fmoc-化学通过固相肽合成(spps)合成pna寡聚物。本研究中使用的固体支持物是购自pcasbiomatrixinc.(quebec,canada)的h-rinkamide-chemmatrix。如现有技术[pct/kr2009/001256]中所述或稍作修改,合成具有修饰的核碱基的fmoc-pna单体。具有修饰的核碱基的这种fmoc-pna单体和具有天然存在的核碱基的fmoc-pna单体被用于合成本发明的pna衍生物。通过c18反相hplc(水/乙腈或水/甲醇,含0.1%tfa)纯化pna寡聚物并通过质谱分析包括esi/tof/ms进行鉴定。
方案1示例了这项研究的spps中采用的典型单体延伸循环,其合成细节如下提供。然而,对于本领域技术人员而言,在自动肽合成仪或手动肽合成仪上有效地进行这种spps反应显然有许多小变化。方案1中的每个反应步骤简述如下。
[方案1]
[defmoc]将树脂在1.5ml的20%哌啶/dmf中涡旋7分钟,然后滤去defmoc溶液。将树脂相继用1.5mlmc、1.5mldmf、1.5mlmc、1.5mldmf和1.5mlmc依次各洗涤30秒。将固体支持物上所得游离胺立即与fmoc-pna单体偶联。
[与fmoc-pna单体偶联]如下所述将固体支持物上的游离胺与fmoc-pna单体偶联。将0.04mmol的pna单体、0.05mmol的hbtu和10mmol的diea在1ml无水dmf中温育2分钟,与游离胺一起加入树脂中。将该树脂溶液涡旋1小时,并滤去反应介质。然后将树脂相继用1.5mlmc、1.5mldmf和1.5mlmc各洗涤30秒钟。图6提供了本发明中使用的具有修饰的核碱基的fmoc-pna单体的化学结构。图6提供了具有修饰的核碱基的fmoc-pna单体作为例子,因此不应视为限制本发明的范围。本领域技术人员可容易地理解fmoc-pna单体的多种变化形式以合成式i所示pna衍生物。
[加帽]在偶联反应后,通过在1.5ml加帽溶液(在dmf中5%乙酸酐和6%的2,6-leutidine)中振摇5分钟将未反应的游离胺加帽。然后滤去加帽溶液,相继用1.5mlmc、1.5mldmf和1.5mlmc各洗涤30秒。
[在n末端导入“fethoc-”基]通过在碱性偶联条件下使树脂上的游离胺与“fethoc-osu”反应,将“fethoc-”基导入n末端。如下提供了“fethoc-osu”的化学结构[cas号179337-69-0,c20h17no5,mw351.36]。
[从树脂上裂解]通过在1.5ml裂解溶液(在三氟乙酸中2.5%三异丙基硅烷和2.5%水)中摇动3小时,将与树脂结合的pna寡聚物从树脂上裂解。滤去树脂,并将滤液减压浓缩。将所得残余物用乙醚研磨,通过过滤收集所得沉淀物,以通过反相hplc纯化。
[hplc分析和纯化]从树脂上裂解后,通过c18反相hplc纯化pna衍生物的粗产物,用含有0.1%tfa的水/乙腈或水/甲醇洗脱(梯度法)。图6a和6b分别是hplc纯化之前和之后“aso1”的示例hplc色谱图。
式i所示pna衍生物的合成实例
为了互补靶向人mmp-1前体mrna中“外显子5”的5’剪接位点,根据以上提供的合成方法或稍加修改制备本发明的pna衍生物。提供靶向人mmp-1前体mrna的这种pna衍生物是为了例证式i所示pna衍生物,不应解释为限制本发明的范围。
表1:pna衍生物互补靶向人mmp-1前体mrna中“外显子5”的5’剪接位点,以及通过质谱法的结构鉴定数据。
a)理论精确质量,b)观测的精确质量
表1提供了互补靶向从人mmp-1基因[ncbi参考序列:ng_011740]读取的人mmp-1前体mrna中“外显子5”的5’剪接位点的pna衍生物,以及通过质谱分析术的结构鉴定数据。在表1中提供本发明的肽核酸衍生物是为了示例式i所示pna衍生物,不应解释为限制本发明的范围。
“aso1”与跨越人mmp-1前体mrna中“外显子5”和“内含子5”连接处的30-碱基rna序列
“aso1”对互补dna的结合亲和性
如下所述在uv/vis光谱仪上测定tm值。将在15ml聚丙烯falcon离心管中的4μmpna寡聚物和4μm互补14-碱基dna在4ml水相缓冲液(ph7.16,10mm磷酸钠,100mmnacl)中的混合溶液在90℃温育1分钟并缓慢冷却至环境温度。然后将溶液移至配有气密封帽的3ml石英uv比色皿中,在uv/可见光分光光度计(agilent8453)上进行在260nm的tm测量。随着比色皿温度每分钟升高0.5或1.0℃,记录在260nm的吸光度变化。根据吸光度对温度曲线,读取显示吸光度最大增加速度的温度作为pna和dna之间的解链温度tm。用于tm测定的14-碱基互补dna购自bioneer(www.bioneer.com,dajeon,republicofkorea),无需进一步纯化即可使用。
“aso1”对于具有14-碱基互补dna的双链体示出tm值为72.67℃。
式i所示pna衍生物的生物学活性实例
通过使用实时定量聚合酶链反应(rtqpcr)在人皮肤成纤维细胞(hdf)等中评估本发明pna衍生物的体外mmp-1反义活性。提供了生物学实例作为实例以说明式i所示pna衍生物的生物学概况,因此不应解释为限制本发明的范围。
实施例1:在hdf中“aso1”抑制mmp-1mrna形成
如下所述,通过western印迹评估“aso1”下调hdf中mmp-1mrna形成的能力。
[细胞培养和aso处理]将hdf细胞保持在成纤维细胞基础培养基(atccpcs-201-030)中,该培养基中补加了成纤维细胞生长试剂盒低血清(atccpcs-201-041)和1%链霉素/青霉素,将其在37℃和5%co2条件下生长。将在60mm培养皿中稳定化24小时的hdf细胞(3×105)与0(阴性对照)和100am至1m的“aso1”温育24小时。
[rna提取和cdna合成]使用rneasymini试剂盒(qiagen,cat.no.714106)根据厂商指导,从aso1处理的细胞中提取总rna,及使用primescripttm第一链cdna合成试剂盒(takara,cat.no.6110a)从400ngrna制备cdna。向pcr管中的400ngrna、1l随机六聚体和1l的dntp(10mm)的混合物中加入经depc处理的水至总体积为10l,在65℃反应5分钟。通过向反应混合物中加入10l的primescriptrtase及相继在30℃反应10分钟和在42℃反应60分钟以合成cdna。
[定量实时pcr]为了评估人mmp-1mrna的表达水平,使用taqman探针对合成的cdna进行实时qpcr。根据如下所述指定的循环条件,使用cfx96touch实时系统(biorad)使cdna、taqman探针、iqsupermix(biorad,cat.no.170-8862)和无核酸酶的水在pcr管中的混合物反应:95℃3分钟(初次变性),然后进行50个如下循环:95℃10秒(变性),60℃30秒(退火)和72℃30秒(聚合)。在每个循环结束时测量荧光强度,通过解链曲线评估pcr的结果。在用gapdh将每个基因的阈值循环(ct)标准化后,对比并分析ct的变化。
[aso降低mmp-1mrna]从图8可以看出,与对照实验相比,用1μm的“aso1”处理,mmp-1mrna降低的量为65%,在用100am至10nmμm的“aso1”处理时分别为10%-15%。
实施例2:在hdf中“aso1”抑制mmp-1蛋白表达
如下所述,通过western印迹评估“aso1”下调hdf中mmp-1蛋白表达的能力。
[western印迹]将hdf细胞如实施例1所述生长,48小时后,将细胞用冷pbs(磷酸盐缓冲液)洗涤2次并溶于50mmtris-cl(ph7.5)、150mmnacl、1%np-40、0.5%脱氧胆酸钠和0.1%sds蛋白酶抑制剂中。用bca溶液(thermo,cat.no.23225)定量蛋白质并通过8%sds-page凝胶纯化。将蛋白移至pvdf膜(聚偏二氟乙烯膜)(millipore,cat.no.ipvh00010)上,将其在脱脂乳缓冲液中封闭1小时。将该膜用抗mmp-1(santacruz,cat.no.58377)和抗β-肌动蛋白(sigma,cat.no.a3854)作为一抗探查,并用山羊抗小鼠抗体(cst,cat.no.7076v)作为二抗。利用supersignaltmwestpico(pierace,usa)检测化学发光信号并使用geldoc系统(atto)测量信号强度。基于每个条带的western印迹结果,用image-j程序定量mmp-1的相对表达水平。
[aso抑制mmp-1蛋白表达]如图9a和9b所示,与对照实验相比,用100am至1μm的“aso1”处理,mmp-1蛋白表达水平降低的量为20%-50%。因此,“aso1”被证明具有下调hdf中mmp-1蛋白表达的能力。
实施例3:在hdf中“aso1”增强胶原蛋白表达
如下所述,通过western印迹评估“aso1”上调hdf中与mmp-1蛋白表达降低相关的i型胶原蛋白表达的能力。
[western印迹]将hdf细胞如实施例1所述生长,48小时后,将细胞用冷pbs(磷酸盐缓冲液)洗涤2次并溶于50mmtris-cl(ph7.5)、150mmnacl、1%np-40、0.5%脱氧胆酸钠和0.1%sds蛋白酶抑制剂中。用bca溶液(thermo,cat.no.23225)定量蛋白质并通过8%sds-page凝胶纯化。将蛋白移至pvdf膜(聚偏二氟乙烯膜)(millipore,cat.no.ipvh00010)上,将其在脱脂乳缓冲液中封闭1小时。将膜用抗mmp-1(santacruz,cat.no.58377)和抗β-肌动蛋白(sigma,cat.no.a3854)作为一抗探查,且用兔抗山羊抗体(santacruz,cat.no.2768)作为二抗。利用supersignaltmwestpico(pierace,usa)检测化学发光信号并使用geldoc系统(atto)测量信号强度。基于每个条带的western印迹结果,用image-j程序定量mmp-1的相对表达水平。
[aso增强i型胶原蛋白表达]如图10a和10b所示,与对照实验相比,用100am至1μm的“aso1”处理,i型胶原蛋白表达水平提高的量超过30%。因此,证明了由“aso1”诱导的mmp-1蛋白表达降低示出其上调hdf中i型胶原蛋白表达的能力。
实施例4:在细胞外液中“aso1”抑制mmp-1蛋白表达
细胞中“aso1”诱导的mmp-1蛋白表达降低结果可能会影响细胞外分泌的mmp-1蛋白表达水平。从这个意义上说,如下所述在“aso1”处理后48小时,通过western印迹评估“aso1”下调细胞培养液中mmp-1蛋白表达的能力。
[western印迹]将hdf细胞如实施例1所述生长,48小时后,通过8%sds-page凝胶纯化收集的细胞培养液。将分离的蛋白移至pvdf膜(聚偏二氟乙烯膜)(millipore,cat.no.ipvh00010)上,将其在脱脂乳缓冲液中封闭1小时。将膜用抗mmp-1(santacruz,cat.no.58377)作为一抗探查,且用山羊抗小鼠抗体(cst,cat.no.7076v)作为二抗。利用supersignaltmwestpico(pierace,usa)检测化学发光信号并使用geldoc系统(atto)测量信号强度。基于每个条带的western印迹结果,用image-j程序定量mmp-1的相对表达水平。
[aso抑制mmp-1蛋白表达]如图11a和11b所示,与对照实验相比,用100pm至1μm的“aso1”处理,细胞外液中mmp-1蛋白表达水平降低的量为10%-60%。因此,“aso1”被证明具有下调细胞外液中mmp-1蛋白表达的能力。
实施例5:在细胞外液中“aso1”增强胶原蛋白表达
如下所述通过western印迹评估“aso1”在细胞外液中上调i型胶原蛋白表达的能力。
[western印迹]将hdf细胞如实施例1所述生长,48小时后,通过8%sds-page凝胶纯化收集的细胞培养液。将分离的蛋白质移至pvdf膜(聚偏二氟乙烯膜)(millipore,cat.no.ipvh00010)上,将其在脱脂乳缓冲液中封闭1小时。将膜用抗mmp-1(santacruz,cat.no.58377)作为一抗探查,且用兔抗山羊抗体(santacruz,cat.no.2768)作为二抗。利用supersignaltmwestpico(pierace,usa)检测化学发光信号并使用geldoc系统(atto)测量信号强度。基于每个条带的western印迹结果,用image-j程序定量mmp-1的相对表达水平。
[aso增强i型胶原蛋白表达]如图12a和12b所示,与对照实验相比,用1pm和1m的“aso1”处理,i型胶原蛋白表达水平的提高量分别为20%和80%。因此,证明在hdf中“aso1”诱导的mmp-1蛋白表达降低示出其上调细胞外液中i型胶原蛋白表达的能力。
实施例6:在细胞外液中“aso1”抑制mmp-1蛋白表达(elisa)
在细胞中由“aso1”诱导的mmp-1蛋白表达降低结果可能影响细胞外分泌的mmp-1蛋白表达水平。在这种意义上,如下所述在“aso1”处理后48小时,通过酶联免疫吸附测定(elisa)评价“aso1”下调细胞培养液中mmp-1蛋白表达的能力。
[elisa]将hdf细胞如实施例1所述生长,48小时后,用人mmp-1elisa试剂盒(abcam,cat.no.ab100603)根据厂商指导通过吸光度(sunrise,tecan)评估收集的细胞培养液中mmp-1表达水平。
[aso抑制mmp-1蛋白表达]如图13所示,与对照实验相比,用100pm至10nm的“aso1”处理,mmp-1蛋白表达水平降低的量分别为15%-30%,用1m的“aso1”处理,降低的量为50%。因此,“aso1”被证明具有下调细胞外液中mmp-1蛋白表达的能力。
实施例7:含有式i所示化合物(w/w%)的表面用精华液的制备
将式i所示化合物例如“aso1”配制成精华液以用于给对象表面施用。如下所述制备表面用精华液。鉴于表面用精华液可能有许多变化,这种制备应作为实例,而不应解释为限制本发明的范围。
在一个单独的烧杯中,在25℃分别溶解部分a和部分b的混合物质。将部分a和部分b通过使用3,600rpm均化器在25℃混合并乳化5分钟。将乳化的部分c通过50目滤网过滤并将滤物加入部分a和部分b的混合物中。所得混合物通过使用3,600rpm均化器在80℃乳化5分钟。将部分d加入部分a、b和c的混合物中之后,将所得混合物通过使用2,500rpm均化器在25℃乳化3分钟。最后确保均匀分散及完全消泡。
实施例8:含有式i所示化合物(w/w%)的表面用乳膏的制备
将式i所示化合物例如“aso1”配制成乳膏以用于给对象表面施用。如下所述制备表面用乳膏。鉴于表面用乳膏可能有许多变化,这种制备应作为实例,而不应解释为限制本发明的范围。
在一个单独的烧杯中,分别在80℃溶解部分a的物质和在85℃溶解部分b的物质。将部分a和部分b通过混合并使用3,600rpm均化器在80℃乳化5分钟。在将部分c和d加入部分a和b的混合物中之后,通过使用3,600rpm均化器在80℃将所得混合物乳化5分钟。将部分e在35℃加入部分a、b、c和d的混合物中后,将所得混合物在35℃用3,600rpm均化器乳化3分钟。最后确保在25℃均匀分散及完全消泡。
序列表
<110>奥利通公司
韩璿瑛
成基浩
洪铭涍
吴有利
许情奭
张降愿
<120>基质金属蛋白酶-1反义寡核苷酸
<130>2018dp101
<150>kr10-2018-0057352
<151>2018-05-18
<160>1
<170>patentinversion3.2
<210>1
<211>14
<212>dna
<213>artificial
<220>
<223>人基质金属蛋白酶-1靶向人工序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>carbamatedn-terminal
<220>
<221>misc_feature
<222>(1)..(14)
<223>pnamodifiedolegonucleotide
<220>
<221>modified_base
<222>(2)..(2)
<223>nisa,g,c,ort
<220>
<221>modified_base
<222>(6)..(6)
<223>nisa,g,c,ort
<220>
<221>modified_base
<222>(8)..(8)
<223>nisa,g,c,ort
<220>
<221>modified_base
<222>(9)..(9)
<223>nisa,g,c,ort
<220>
<221>modified_base
<222>(11)..(11)
<223>nisa,g,c,ort
<220>
<221>modified_base
<222>(13)..(13)
<223>nisa,g,c,ort
<400>1
tnctcncnntntnt14
- 还没有人留言评论。精彩留言会获得点赞!