通过磁珠附着至细胞进行的基于磁性的生物淘选方法与流程
通过磁珠附着至细胞进行的基于磁性的生物淘选方法
【技术领域】
1.本发明涉及使用附着有磁珠的细胞筛选抗体或其抗原结合片段的方法,并且更具体地涉及使用在其表面上含有磷脂/生物素/链霉亲和素/磁珠复合物并且过表达抗原蛋白的细胞用基于磁性的系统筛选与抗原蛋白特异性结合的抗体或其抗原结合片段的方法。
背景技术:
2.在1975年,用于开发单克隆抗体的技术以杂交瘤技术开始。杂交瘤技术是通过以下方式选择单克隆抗体的技术:在小鼠中诱导免疫应答,然后将b细胞与骨髓瘤细胞融合,并维持永生状态。这项技术涉及获得小鼠抗体,因此由于小鼠抗体在施加至人体时被识别为抗原从而引起免疫应答而具有副作用。这被称为“hama”(人抗小鼠抗体反应)(tiandra j.j.等人,immunol.cell biol.,第66卷,第367-76页,1990)。
3.为了克服副作用,通过应用将小鼠抗体转化为与人抗体相似的技术来开发嵌合抗体和人源化抗体。然而,仍然存在发生免疫应答和开发时间很长的问题。
4.在1985年开发了用于在噬菌体表面上表达蛋白质或肽的噬菌体展示技术。噬菌体展示是产生具有多种抗体片段的噬菌体文库并使用噬菌体文库进行抗体选择的方法,并且由于其选择速度快且应用相对简单而被开发者持续使用。
5.通过使用噬菌体文库选择、回收和扩增对所需抗原具有特异性的抗体片段的方法来选择抗体,这种方法被称为“生物淘选”。存在多种典型的淘选方法,包括使用重组蛋白淘选、细胞淘选、基于磁珠的淘选、体内淘选、和使用组织的淘选(mcguire m.j.等人,method mol.biol.,第504卷,第291-321页,2009)。
6.使用重组蛋白淘选被普遍使用,但是不利地针对特定抗原具有抗体文库的限制,并且需要具有高纯度的纯化的抗原。使用纯化的蛋白质,难以实现蛋白质的翻译后修饰(ptm),因此即使发现了抗体,所述抗体也可能实际上无法在体内作用。
7.为了克服这个问题,开发了细胞淘选,并且开发与特定膜蛋白(g蛋白偶联受体、配体门控的离子通道、受体酪氨酸激酶、和免疫球蛋白样受体)结合的抗体已经变得更容易。这种方法使用自然形式的细胞作为抗原,并且因此能够选择呈实现蛋白质的三维结构和ptm的形式的抗体。
8.然而,细胞淘选是劳动密集型的并且可能在实验中在使用者之间展现巨大差异。因此,存在对能够解决和克服这些问题的下一代细胞淘选的需要。
9.迄今为止已经通过噬菌体展示开发出多种诊断性和治疗性抗体,并且与自动化系统联合的高速大规模筛选系统方法也正在开发中,以建立快速准确的淘选方法。
10.因此,作为开发以高速度和高容积筛选抗体的方法的大量努力的结果,本发明人发现,可以通过使用基于磁性的系统以及含有磁珠和抗原蛋白的细胞筛选抗体文库,在降低副作用的同时以高速度、灵敏度和准确度选择抗体,从而完成本发明。
11.此背景技术章节中公开的信息仅为加强对本发明背景的理解而提供,并且因此所述信息可能不包括形成对本领域技术人员而言已经清楚的现有技术的信息。
技术实现要素:
12.本发明的一个目标是提供使用基于磁性的系统和在其表面上包含磁珠并且过表达抗原蛋白的细胞筛选抗体的方法。
13.根据本发明的方面,上述和其他目标可以通过提供筛选与抗原蛋白结合的抗体或其抗原结合片段的方法来实现,所述方法包括:(i)制备过表达抗原蛋白的细胞,其中将生物素化的磷脂插入所述细胞的膜中并且使所述生物素化的磷脂与链霉亲和素/磁珠复合物结合;(ii)用包括抗体或其抗原结合片段的文库处理所述细胞并使用基于磁性的系统筛选与所述抗原蛋白结合的抗体或其抗原结合片段;(iii)使筛选的抗体或其抗原结合片段文库与不表达所述抗原蛋白的细胞反应,以仅选择与所述抗原蛋白特异性结合的抗体或其抗原结合片段;以及(iv)从所选择的抗体或其抗原结合片段分离和/或去除与除了所述抗原蛋白以外的抗原结合的抗体或其抗原结合片段。
【附图说明】
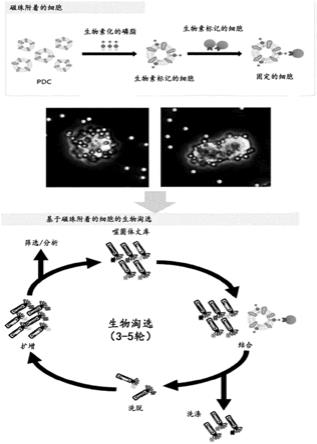
14.图1是显示根据本发明的方法的原理的示意图。
15.图2a显示在本发明的实施方案中使用的dhpe-fitc的化学式,图2b是所述材料的示意图,并且图2c是说明通过facs分析根据本发明的实施方案分离细胞的过程的示意图。
16.图3a显示根据本发明的实施方案在含有细胞膜样材料的细胞中取决于反应时间(30min、60min)的荧光强度,并且图3b显示即使在6小时后,图3a的细胞仍含有所述细胞膜样材料。
17.图4a显示本发明的实施方案中使用的b-x-dhpe的化学式,图4b是所述材料的示意图,并且图4c是通过facs分析说明根据本发明的实施方案分离细胞的过程的示意图。
18.图5a显示根据本发明的实施方案在包含细胞膜样材料的细胞中取决于细胞膜样材料的浓度的结合效率,并且图5b显示取决于浓度和反应温度的结合效率。
19.图6a显示取决于是否融合细胞膜样材料的在细胞膜表面上的蛋白质表达水平,并且图6b是显示细胞膜样材料与细胞膜结合的情况的示意图。
20.图7a是显示根据本发明的实施方案将细胞与磷脂/生物素/链霉亲和素/磁珠复合物融合的方法的示意图,并且图7b显示观察两种方法的融合效率的结果。
21.图8显示根据本发明的实施方案取决于培养基条件的磁珠粘附率的测量结果。
22.图9显示根据本发明的实施方案形成细胞的磷脂/生物素/链霉亲和素/磁珠复合物的效率的测量结果。
23.图10显示说明基于磁性的自动化细胞淘选装置和操作所述装置的步骤的示意图。
24.图11显示根据本发明的实施方案在自动化系统中使用磁珠进行细胞淘选的步骤。
25.图12显示当根据本发明的实施方案通过在形成细胞的磷脂/生物素/链霉亲和素/磁珠复合物后应用于基于磁性的装置自动进行淘选时在最终步骤之后剩余的细胞数量与手动淘选方法的细胞数量的比较结果。
26.图13a显示使用基于磁性的装置淘选磁珠附着的细胞所需试剂的总结,并且图13b显示用于使用基于磁性的装置淘选磁珠附着的细胞的方案的总结(bindit软件3.3.1,用于kingfisher仪器)。
27.图14a显示使用基于磁性的装置自动淘选过表达特定抗原的源自患者的细胞的结
果,其中使用通过抗原固定方法进行的生物淘选的输出,并且在强和弱洗涤条件下获得结果,并且图14b显示使用基于磁性的装置自动淘选过表达特定抗原的源自患者的细胞的结果,其中使用通过磁珠附着的抗原进行的生物淘选的输出,并且在弱洗涤条件下获得结果。
28.图15a显示使用自动淘选的输出的对具有与特定抗原的特异性结合能力的抗体的基于elisa的筛选结果,其中使用通过抗原固定方法进行的生物淘选的输出,并且在强和弱洗涤条件下获得结果,并且图15b显示使用自动淘选的输出的具有与特定抗原的特异性结合能力的抗体的基于elisa的筛选结果,其中使用通过磁珠附着的抗原进行的生物淘选的输出,并且在弱洗涤条件下获得结果。
29.图16是显示作为比较所选择的抗体的elisa值的结果的阳性/阴性重组蛋白的相对值的图。
【具体实施方式】
30.除非另外定义,否则本文所用的所有技术和科学术语的含义与由本发明所属领域中的技术人员所理解的含义相同。通常,本文所用的命名法是本领域中熟知的,并且是通常使用的。
31.本发明人已经尽力克服细胞淘选结果在使用者之间差异很大的缺点。因此,本发明人设法证实,当在基于磁性的系统中使用含有磁珠的细胞进行细胞淘选时,细胞淘选的效率有所增加并且高速大规模筛选是可能的。
32.另外,本发明人使用具有抗原蛋白的源自患者的细胞努力开发用于抗癌治疗的抗体,以选择如下抗体,所述抗体具有成功用于未来临床试验中的高度可能性,并且被内化且可以在细胞内有效作用。因此,本发明人已经使用噬菌体展示技术选择了以高亲和力与抗原蛋白结合并且被内化至细胞中的抗体,并且证实这些抗体被内化至细胞中。
33.因此,在本发明的实施方案中,使用在细胞膜上含有结合生物素的磷脂并且在其表面上含有链霉亲和素/磁珠复合物的细胞进行细胞淘选。因此,可以以高速度筛选抗体(图12)。
34.因此,在一方面,本发明提供筛选与抗原蛋白结合的抗体或其抗原结合片段的方法,所述方法包括:(i)制备过表达抗原蛋白的细胞,其中将生物素化的磷脂插入所述细胞的膜中并且使所述生物素化的磷脂与链霉亲和素/磁珠复合物结合;(ii)用包括抗体或其抗原结合片段的文库处理所述细胞,并使用基于磁体的系统筛选与所述抗原蛋白结合的抗体或其抗原结合片段;(iii)使筛选的抗体或其抗原结合片段文库与不表达所述抗原蛋白的细胞反应,从而仅选择与所述抗原蛋白特异性结合的抗体或其抗原结合片段;以及(iv)从所选择的抗体或其抗原结合片段分离并去除与除了所述抗原蛋白以外的抗原结合的抗体或其抗原结合片段。
35.如本文所用术语“抗体”意指选自iga、ige、igm、igd、igy和igg的免疫球蛋白,并且可以与靶抗原特异性地结合。抗体由两条轻链和两条重链组成,并且每条链包括具有可变氨基酸序列的可变结构域和具有恒定氨基酸序列的恒定结构域。抗原结合位点位于可变结构域的三维结构的末端,并且该位点是通过组合每条轻链和重链中存在的三个互补决定区来形成。互补决定区是可变结构域中具有极高氨基酸序列可变性的部分,并且由于这种高可变性,可以发现对多种抗原具有特异性的抗体。本发明的范围不仅包括完整抗体形式,还
包括抗体分子的抗原结合片段。
36.如本文所用,术语“scfv”(单链fv,单链片段抗体或抗体片段)是指这样的抗体,其中轻链和重链的可变结构域是连接的。在一些情况下,scfv可以包括由具有约15个连接的氨基酸的肽链组成的接头(连接位点),并且在这种情况下,scfv可以具有包括轻链可变结构域、连接位点和重链可变结构域或者包括重链可变结构域、连接位点和轻链可变结构域的结构,并且具有与初始抗体的抗原特异性相同或相似的抗原特异性。
37.术语“完整抗体”是指具有两条全长轻链和两条全长重链的结构,其中每条轻链通过二硫键与相应重链连接。重链恒定结构域具有伽马(γ)、缪(μ)、阿尔法(α)、德耳塔(δ)和伊普西隆(ε)型,并且分为以下亚类:伽马1(γ1)、伽马2(γ2)、伽马3(γ3)、伽马4(γ4)、阿尔法1(α1)和阿尔法2(α2)。轻链的恒定结构域具有卡帕(κ)和兰布达(λ)型。
38.抗体或抗体片段的抗原结合片段是指具有抗原结合能力的片段,并且包括fab、f(ab')、f(ab')2、fv等。在抗体片段中,fab是指包括重链和轻链各自的可变结构域、轻链的恒定结构域和重链的第一恒定结构域(ch1)的结构,每个fab具有一个抗原结合位点。fab'与fab的不同之处在于,它还包括铰链区,所述铰链区在重链ch1结构域的c末端包括至少一个半胱氨酸残基。f(ab')2是通过fab'的铰链区中的半胱氨酸残基之间的二硫键产生的。fv是仅具有重链可变结构域和轻链可变结构域的最小抗体片段,并且用于产生fv的重组技术披露于pct国际公开案中,如wo 88/10649、wo 88/106630、wo88/07085、wo 88/07086和wo 88/09344。双链fv是如下片段:其中重链的可变结构域与轻链的可变结构域通过非共价键连接;并且单链fv(scfv)是如下片段:其中重链的可变结构域与轻链的可变结构域通常经由它们之间的肽接头通过共价键连接,或者在c末端直接连接,从而形成像双链fv一样的二聚体状结构。此类抗体片段可以使用蛋白酶获得(例如,fab可以通过用木瓜蛋白酶限制性切割完整抗体来获得,并且f(ab')2片段可以通过用胃蛋白酶限制性切割完整抗体来获得),并且可以使用遗传重组技术来制备。
39.如本文所用,术语“抗体(或scfv)文库”是指具有不同序列的多种抗体基因的集合。为了从抗体文库分离对任何抗原具有特异性的抗体,需要极高的多样性,并且构建和使用由多种抗体克隆组成的文库。可以将构成这种抗体文库的抗体基因克隆至例如噬菌粒载体中并转化至转化体(大肠杆菌(e.coli))中。
40.如本文所用,术语“核酸”可以与“基因”或“核苷酸”互换使用,并且可以例如选自天然/合成dna、基因组dna、天然/合成rna、cdna和crna,但是不限于此。
41.如本文所用,术语“噬菌粒”载体是指用于噬菌体展示并且具有噬菌体复制起点的质粒dna,并且通常具有抗生素抗性基因作为选择标记。用于噬菌体展示的噬菌粒载体包括m13噬菌体的giii基因或其部分,并且scfv基因与giii基因的5'端连接,并且通过转化体来表达。
42.如本文所用,术语“辅助噬菌体”是指提供所需遗传信息以使得将噬菌粒包装至噬菌体颗粒中的噬菌体。由于只有噬菌体基因的giii或其部分存在于噬菌粒中,因此用辅助噬菌体感染用所述噬菌粒转化的宿主细胞(转化体),从而供应其余的噬菌体基因。存在如m13k07或vcsm13的类型,并且它们大多数包括抗生素抗性基因(如卡那霉素),使得可以选择被辅助噬菌体感染的转化体。另外,因为包装信号有缺陷,所以将噬菌粒基因而不是辅助噬菌体基因选择性地包装至噬菌体颗粒中。
43.如本文所用,术语“信号序列”是指碱基序列或与其对应的氨基酸序列,其位于基因的5'端,并且在所述基因编码的蛋白质被分泌到外部时起所需信号的作用。
44.如本文所用,术语“噬菌体展示”是用于展示突变体多肽的技术,所述突变体多肽作为与例如噬菌体(例如纤维状噬菌体)颗粒表面上的外壳蛋白的至少一部分的融合蛋白。噬菌体展示的有用性在于快速且有效地对大型随机化蛋白质突变体文库中以高亲和力与靶抗原结合的序列进行分类。在噬菌体上展示肽和蛋白质文库已经用于筛选数百万种多肽,以鉴定具有特异性结合特性的多肽。
45.噬菌体展示技术已提供用于产生和筛选与特定配体(例如,抗原)结合的新型蛋白质的有效工具。使用噬菌体展示技术,可以产生大型蛋白质突变体文库,并且可以将以高亲和力与靶抗原结合的序列快速分类。将编码突变体多肽的核酸与编码病毒外壳蛋白(例如,基因iii或基因viii蛋白)的核酸序列融合。已经开发出单相噬菌体展示系统,其中将编码蛋白质或多肽的核酸序列与编码基因iii蛋白的一部分的核酸序列融合。在单相展示系统中,融合基因以低水平表达,并且还表达野生型基因iii蛋白,由此维持颗粒感染性。
46.对于抗体噬菌体展示文库的开发,重要的是证明肽在纤维状噬菌体表面上的表达以及功能性抗体片段在大肠杆菌的外周细胞质中的表达。通过多种方法(例如通过插入随机dna序列来修饰单一基因或克隆相关基因序列的方法)制备抗体结合多肽或抗原结合多肽的文库。可针对具有所需特征的抗体结合蛋白或抗原结合蛋白的表达来筛选文库。
47.对于产生具有所需特征的抗体,噬菌体展示技术相对于常规杂交瘤和重组方法具有若干优点。这种技术可在不使用动物的情况下,在短时间内产生具有多个序列的大型抗体文库。杂交瘤的产生和人源化抗体的产生可能需要数月的产生时间。另外,由于不需要免疫力,噬菌体抗体文库可以产生针对具有毒性或具有低抗原性的抗原的抗体。所述噬菌体抗体文库还可以用于产生和鉴定新型治疗性抗体。
48.可以使用利用噬菌体展示文库从被免疫的人、未被免疫的人、种系序列或未致敏的b细胞ig库产生人抗体的技术。可以使用多种淋巴组织来制备未致敏或非免疫原性抗原结合文库。
49.用于从噬菌体展示文库鉴定和分离高亲和力抗体的技术对于分离新型治疗性抗体是重要的。从文库分离高亲和力抗体取决于文库的大小、细菌细胞中的产生效率和文库的多样性。文库的大小会因抗体结合蛋白或抗原结合蛋白的无效折叠以及由于存在终止密码子所致的无效产生而降低。在抗体结合结构域或抗原结合结构域没有正确折叠时,在细菌细胞中的表达可能被抑制。可以通过使可变/恒定界面的表面上的残基或所选cdr残基交替突变来改进表达。当在细菌细胞中产生抗体噬菌体文库时,框架区的序列是提供适当折叠的元件。
50.在高亲和力抗体的分离中,重要的是产生抗体结合蛋白或抗原结合蛋白的多个文库。经常发现cdr3区域参与抗原结合。由于重链上的cdr3区域在大小、序列和结构维度形态方面显著变化,可使用所述cdr3区域来制备多个文库。
51.还可通过在每个位置使用所有20种氨基酸使可变重链和轻链的cdr区域随机化,来产生多样性。使用所有20种氨基酸得到具有高多样性的抗体序列,以及增加的鉴定出新抗体的机会。
52.本发明的抗体包括但不限于单克隆抗体、多特异性抗体、人抗体、人源化抗体、嵌
合抗体、单链fv(scfv)、单链抗体、fab片段、f(ab')片段、二硫键连接的fv(sdfv)、抗个体基因型(抗id)抗体、抗体的表位结合片段等。
53.术语“单克隆抗体”是指从基本上同质的抗体的群体获得的相同抗体,即构成所述群体的每个抗体,但不包括可能以少量存在的可能的天然存在的突变。单克隆抗体具有高度特异性并且是针对单一抗原位点诱导的。
[0054]“人源化”型非人(例如,鼠)抗体是指嵌合抗体,其含有源自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体高变区的残基被来自具有所需特异性、亲和力和能力的非人物种(如小鼠、大鼠、兔子或非人灵长类动物)(供体抗体)的高变区的残基替代。
[0055]
术语“人抗体”意指源自人免疫球蛋白的分子,其中构成包括互补决定区和结构区的所述抗体的所有氨基酸序列均由人免疫球蛋白构成。
[0056]
重链和/或轻链的一部分与源自特定物种或属于特定抗体种类或亚类的抗体中的相应序列相同或同源,同时其他一条或多条链包括“嵌合”抗体(免疫球蛋白),所述“嵌合”抗体与源自另一物种或属于另一抗体种类或亚类的抗体以及这种抗体中展现所需生物活性的片段中的相应序列相同或同源。
[0057]
如本文所用,术语“抗体可变结构域”是指抗体分子的轻链和重链区域,包括互补决定区(cdr;即,cdr1、cdr2和cdr3)和框架区(fr)的氨基酸序列。vh是指重链的可变结构域。vl是指轻链的可变结构域。
[0058]
术语“互补决定区”(cdr;即,cdr1、cdr2和cdr3)是指抗体可变结构域中对于抗原结合所需的氨基酸残基。每个可变结构域通常具有三个cdr区域,被鉴定为cdr1、cdr2和cdr3。
[0059]
术语“框架区”(fr)是指除了cdr残基以外的可变结构域残基。每个可变结构域通常具有四个fr,被鉴定为fr1、fr2、fr3和fr4。
[0060]
如本文所用,术语“生物素”是指水溶性b维生素(维生素b7),也称为维生素h或辅酶r。生物素包括与四氢噻吩环融合的脲基(四氢咪唑酮(tetrahydroimidizalone))环。
[0061]
生物素包括与四氢噻吩环的一个碳原子结合的缬草酸。生物素是羧化酶的辅酶,并且参与脂肪酸、异亮氨酸和缬氨酸的合成,以及参与糖原异生。除了作为辅酶的上述特征以外,生物素具有10-14
至10-15
m的解离常数kd,并且具有与蛋白质(如亲和素、链霉亲和素和中性亲和素(或脱糖基化亲和素;中性亲和素或脱糖基化亲和素))的强结合能力。特别地,由于即使在极为苛刻的条件下也可以维持与链霉亲和素的特异性结合,链霉亲和素-生物素结合已经以多种方式应用于生物技术领域。由于生物素尺寸较小,并且不影响包含生物素的生理活性物质(如蛋白质)的活性,生物素可以与多种生理活性物质结合并因此用于生物化学测定。该过程(即将生物素与生理活性物质结合的过程)被称为“生物素化”。
[0062]
在本发明中,磷脂包括选自以下的任一种:基于pe(磷酸乙醇胺)的磷脂、基于pa(磷脂酸)的磷脂、基于pg(磷脂酰甘油)的磷脂、基于ps(磷脂酰丝氨酸)的磷脂、基于pi(磷脂酰肌醇)的磷脂、基于鞘酯的磷脂和基于甾醇的磷脂,但不限于此。
[0063]
在本发明中,磷脂包括选自以下的任一种:dhpe(1,2-双十六酰基-sn-甘油-3-磷酸乙醇胺)、荧光素dhpe(n-(荧光素-5-氨基硫羰基)-1-2-双十六酰基-sn-甘油-3-磷酸乙醇胺)、b-x dhpe(n-((6-(生物素酰基)氨基)己酰基)-1-2-双十六酰基-sn-甘油-3-磷酸乙
醇胺)、生物素ps(1-油酰基-2-(12-生物素基(氨基十二酰基))-sn-甘油-3-磷酸-l-丝氨酸(铵盐))、和生物素pc(1-油酰基-2-[12-生物素基(氨基十二酰基)]-sn-甘油-3-磷酸胆碱),但不限于此。
[0064]
在本发明中,其中生物素化的磷脂被插入所述细胞膜中并且所述生物素化的磷脂与所述链霉亲和素/磁珠复合物结合的过表达抗原蛋白的所述细胞可以通过包括以下的过程来制备:(a)在生物素化的磷脂的存在下培养过表达抗原蛋白的细胞,以获得其中所述生物素化的磷脂被插入所述细胞膜中的细胞;以及(b)用链霉亲和素/磁珠复合物处理所获得细胞的所述生物素化的磷脂,以获得其中所述生物素化的磷脂被插入所述细胞膜中并且其中所述生物素化的磷脂与所述链霉亲和素/磁珠复合物结合的细胞。
[0065]
在本发明中,其中生物素化的磷脂被插入所述细胞膜中并且所述生物素化的磷脂与所述链霉亲和素/磁珠复合物结合的过表达抗原蛋白的所述细胞可以通过包括以下的过程来制备:(a)使生物素化的磷脂与链霉亲和素和磁珠反应,以制备磷脂/生物素/链霉亲和素/磁珠复合物;以及(b)将所述磷脂/生物素/链霉亲和素/磁珠复合物与过表达抗原蛋白的细胞融合,以获得其中所述生物素化的磷脂被插入所述细胞膜中并且其中所述生物素化的磷脂与所述链霉亲和素/磁珠复合物结合的过表达抗原蛋白的细胞。
[0066]
在本发明中,可以在含有表面活性剂的培养基中将所述细胞与链霉亲和素/磁珠复合物融合。
[0067]
在本发明中,表面活性剂包括选自以下的任一种:烷基多糖苷、鲸蜡醇、癸基葡糖苷、癸基聚葡糖苷、麦芽糖苷、np-40、油醇、泊洛沙姆、聚山梨醇酯、山梨聚糖、triton x-100和吐温80,但不限于此。
[0068]
在本发明中,基于磁性的系统是使用磁性分离细胞的装置,并且优选地是kingfisher flex
tm
,但不限于此。
[0069]
在本发明中,抗体或其抗原结合片段可以是内化至细胞中的抗体或其抗原结合片段。
[0070]
本发明还包括(ii)用包括抗体或其抗原结合片段的文库处理包含磁珠并且过表达抗原蛋白的细胞,以筛选与抗原蛋白结合的抗体或其抗原结合片段。
[0071]
测量过表达细胞和正常细胞的抗原蛋白含量的方法可以通过测量并比较编码抗原蛋白的基因或蛋白质的表达水平来进行,并且优选地通过选自以下的一种或多种方法来进行:facs、elisa、全外显子组测序和rna测序,但不限于此。
[0072]
根据本发明的方法还包括(iii)用所筛选的抗体或其抗原结合片段文库处理不表达抗原蛋白的细胞,从而仅选择与所述抗原蛋白特异性结合的抗体或其抗原结合片段。
[0073]
步骤(iii)是对步骤(ii)中选择的抗体或其抗原结合片段进行阴性选择的步骤,并且使得能够筛选对抗原具有高选择性的抗体。
[0074]
在本发明中,被去除而使得不表达步骤(iii)的抗原蛋白的细胞可以是并非天然表达抗原蛋白的细胞,或者可以是被人工操纵而使得不表达抗原蛋白的源自患者的细胞。人工操纵方法可以是能够防止表达抗原蛋白的任何方法,但是优选地通过用选自以下的至少一种的处理来进行:与抗原蛋白结合的适体、sirna、单链sirna、微小rna和shrna。
[0075]
在本发明中,使用不表达抗原蛋白的源自患者的细胞仅选择与抗原蛋白结合的抗体的步骤是阴性筛选,它是在阳性筛选后立即进行的,并且具有改进对于抗原蛋白的所选
择抗体的准确度的作用。
[0076]
本发明还包括从所选择的抗体或其抗原结合片段分离和/或去除与除了抗原蛋白以外的抗原结合的抗体或其抗原结合片段。
[0077]
所述分离和/或去除可以使用以下方法来进行:电泳、离心、凝胶过滤、沉淀、透析、色谱法(如离子交换色谱法、亲和色谱法、免疫吸附色谱法、尺寸排阻色谱法)、等电聚焦、其各种修改形式和组合等,但不限于此。
[0078]
所述分离和/或去除可以通过以下方式来进行:通过例如离心或超滤来去除杂质,并且使用例如亲和色谱法来纯化所得物。可以使用另外的纯化技术,如阴离子或阳离子交换色谱法、疏水相互作用色谱法、羟基磷灰石色谱法等。
[0079]
通过本发明选择的抗体或其结合片段可以是例如igg形式、fab'片段、f(ab')2片段、fab片段、fv片段、或单链fv片段(scfv),但是优选地以igg形式来产生。
[0080]
在另一方面,本发明涉及通过上文方法筛选的抗体或其抗原结合片段。
[0081]
本发明的抗体或抗体片段可以不仅包括抗体,还包括其生物等同物,只要它可以特异性地识别抗原蛋白即可。例如,可以对抗体的氨基酸序列进行另外的变异,以进一步改进抗体的结合亲和力和/或其他生物特性。此类变异包括例如抗体的氨基酸序列残基的缺失、插入和/或取代。此类氨基酸突变是基于氨基酸侧链取代基的相对相似性,如所述侧链取代基的疏水性、亲水性、电荷和大小。通过对氨基酸侧链取代基的大小、形状和类型的分析可见,精氨酸、赖氨酸和组氨酸全部都是带正电荷的残基;丙氨酸、甘氨酸和丝氨酸具有相似的大小;并且苯丙氨酸、色氨酸和酪氨酸具有相似的形状。因此,基于这些考虑,将精氨酸、赖氨酸和组氨酸;丙氨酸、甘氨酸和丝氨酸;以及苯丙氨酸、色氨酸和酪氨酸视为生物学功能等同物。
[0082]
在引入突变时可以考虑氨基酸的亲水指数。每种氨基酸具有根据其疏水性和电荷分配的疏水性指数,如下:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。
[0083]
疏水氨基酸指数在引发蛋白质的相互作用生物功能方面极为重要。众所周知,需要用具有相似疏水性指数的氨基酸进行取代以保持相似的生物活性。在引入关于疏水性指数的突变时,在显示疏水性指数差异的氨基酸之间进行取代,所述疏水性指数差异优选地在
±
2内、更优选地在
±
1内、以及甚至更优选地在
±
0.5内。
[0084]
同时,还众所周知,具有相似亲水性值的氨基酸之间的取代产生具有一致的生物活性的蛋白质。如美国专利号4,554,101中所披露,以下亲水性值被分配给相应氨基酸残基:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0
±
1);谷氨酸(+3.0
±
1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5
±
1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);以及色氨酸(-3.4)。
[0085]
蛋白质中不完全改变分子活性的氨基酸交换是本领域中已知的。最常出现的交换是以下氨基酸残基之间的交换:ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、thr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/
glu和asp/gly。
[0086]
在考虑到具有生物学等同活性的突变时,根据本发明的抗体或编码所述抗体的核苷酸分子被解释为包括与所述序列号中所示的序列具有基本同一性的序列。术语“基本同一性”意味着,在比对本发明序列与任何其他序列以尽可能多地相互对应并使用本领域中常用的算法分析所比对序列时,序列具有至少61%的同源性、优选地至少70%、更优选地至少80%、以及最优选地至少90%的同源性。用于序列对比的比对方法是本领域所熟知的。ncbi基础局部比对搜索工具(blast)可以通过ncbi等获得,并且可以与互联网上的序列分析程序如blastp、blastm、blastx、tblastn和tblastx联合使用。blast可以在www.ncbi.nlm.nih.gov/blast/获得。使用该程序比较序列同源性的方法可以在www.ncbi.nlm.nih.gov/blast/blast_help.html找到。
[0087]
实施例
[0088]
在下文中,将参考以下实施例更详细地描述本发明。然而,对于本领域技术人员清楚的是,以下实施例仅用于说明本发明来提供,并且不应被视为基于本发明的主题限制本发明的范围。
[0089]
实施例1:细胞膜样物质与细胞膜的融合的证实
[0090]
为了将磁珠附着至细胞表面,使用流式细胞仪作为预处理过程来证实与生物素结合的细胞膜样材料是否与细胞表面融合。使用dhpe(1,2-双十六酰基-sn-甘油-3-磷酸乙醇胺)作为细胞膜样材料(图2)。使用附着至dhpe的荧光物质,即荧光素dhpe(n-(荧光素-5-氨基硫羰基)-1,2-双十六酰基-sn-甘油-3-磷酸乙醇胺,三乙铵盐,由invitrogen corporation生产),在不同的浓度条件(1:250、1:500、1:1000、1:2000)、温度条件(室温、4℃)、和反应时间条件(30分钟、60分钟)下进行测试。
[0091]
首先,将癌细胞系hcc.95在每种条件下分配为500,000个细胞,并且反应体积为300μl。将所培养的样品与1%fbs溶液一起以1,500rpm离心3分钟,然后进行洗涤以去除上清液。将该过程重复两次。然后,通过流式细胞仪(facs aria iii)进行分析。
[0092]
作为结果,在所有条件下观察到荧光强度与浓度成比例(图3a)。基于上述结果,证实细胞膜样材料与活细胞的表面融合,并且通过以下方式获得的结果也显示相同的模式:将相同样品在4℃下孵育6小时,然后使用流式细胞仪测量荧光强度(图3b)。这意味着,即使细胞膜样物质与细胞膜融合,细胞也是稳定的。
[0093]
实施例2:结合生物素的细胞膜样物质与细胞的融合的证实和优化
[0094]
使用实际上附着至磁珠的物质,即bx dhpe(n-((6-(生物素酰基)氨基)己酰基)-1,2-双十六酰基-sn-甘油-3-磷酸乙醇胺,三乙铵盐,由invitrogen corporation生产),在不同的浓度条件(0.5mg/ml、0.25mg/ml、0.125mg/ml和0.0625mg/ml)下进行测试(图4)。
[0095]
首先,将癌细胞系hcc.95在每种条件下分配为500,000个细胞,并且反应体积为300μl。将所培养的样品与1%fbs溶液一起以1,500rpm离心3分钟,然后进行洗涤以去除上清液。将该过程重复两次。然后,使对生物素具有特异性结合能力的链霉亲和素-fitc(荧光材料)在4℃下反应1小时。将所培养的样品与1%fbs溶液一起以1,500rpm离心3分钟,然后进行洗涤以去除上清液。将该过程重复两次。然后,使用流式细胞仪(facs aria iii)进行分析。
[0096]
作为结果,证实荧光强度具有与实施例1中相同的性能(图5a)。
[0097]
为了优化所述物质与细胞膜融合的条件,在不同的b-x dhpe浓度条件(0.5mg/ml、0.25mg/ml、0.125mg/ml和0.0625mg/ml)、温度条件(4℃、室温)、和反应时间条件(30分钟、60分钟)下进行测试,并且以与上文相同的方式进行样品制备。
[0098]
作为结果,证实所述材料与细胞膜的融合在b-x dhpe浓度(0.5mg/ml)、室温和30分钟的反应时间下是最佳的(图5b)。
[0099]
实施例3:与细胞膜样物质融合的细胞中的表面蛋白表达的证实
[0100]
尽管细胞膜样物质与细胞融合,但是它在表面蛋白表达出现变化时并不适合用于基于噬菌体展示的细胞淘选。因此,证实b-x dhpe的优化条件不影响细胞表面蛋白,并且还确定了与细胞表面融合的b-x dhpe的量。
[0101]
使用源自患者的细胞gbm15-682t。该细胞过表达fgfr3细胞表面蛋白,因此适合于比较表达水平。在细胞膜样物质(b-x dhpe)融合的条件下以及在细胞膜样物质不融合的条件下通过流式细胞仪测量fgfr3细胞表面蛋白的表达水平。在每种条件下将gbm15-682t分配为500,000个细胞,将其以300μl的反应体积使用,并且与b-x dhpe(0.5mg/ml)在室温下反应30分钟。将所培养的样品与1%fbs溶液一起以1,500rpm离心3分钟,然后进行洗涤以去除上清液。将该过程重复两次。
[0102]
然后,将细胞分别用链霉亲和素-fitc(荧光材料)和fgfr3-pe(荧光材料)抗体处理,并且在4℃下反应1小时。在如上所述进行洗涤两次后,通过fitc荧光分析b-x dhpe,并且通过pe荧光分析fgfr3。
[0103]
作为结果,证实与细胞表面融合的b-x dhpe的水平以及所表达的fgfr3细胞表面蛋白的水平无变化(图6)。也就是说,所述结果意味着,尽管细胞膜样物质(b-x dhpe)与细胞膜融合,但是它不引起细胞表面上的任何改变。
[0104]
实施例4:通过将磁珠附着至与细胞膜样物质融合的细胞来诱导磁化以及条件的优化
[0105]
4-1:复合物结合方法的作用的证实
[0106]
与细胞融合的b-x dhpe含有生物素组分并且因此具有与链霉亲和素的特异性结合能力。因此,可以使用链霉亲和素附着的磁珠(链霉亲和素dynabead:dynabead m-280链霉亲和素;invitrogen corporation)在细胞中诱导磁性。作为通过将磁珠附着至细胞来诱导磁化的方法,比较直接方法与间接方法。直接方法是指首先使b-x dhpe与链霉亲和素dynabead反应然后使所得物与细胞融合的方法,并且间接方法是指使b-x dhpe与细胞融合然后使所得物与链霉亲和素dynabead反应的方法。
[0107]
如下进行直接方法。在室温下使3.0μg的b-x dhpe与500μg的先前使用磁力分离器用pbs(ph 7.4)缓冲溶液洗涤的链霉亲和素dynabead反应30分钟。然后,将所得物使用磁力分离器用相同的缓冲溶液洗涤两次。将先前用pbs(ph 7.4)缓冲溶液洗涤的1.0-5.0e+6个细胞与先前反应的b-x dhpe和链霉亲和素dynabead缀合物在室温下一起培养1小时。此时,将反应体积设为1ml。
[0108]
如下进行间接方法。将用pbs(ph 7.4)缓冲溶液洗涤的1.0-5.0e+6个细胞与3μg的b-x dhpe在室温下一起培养30分钟。然后,将细胞使用磁力分离器用pbs(ph 7.4)缓冲溶液洗涤两次。将500μg的先前使用磁力分离器用pbs(ph 7.4)缓冲溶液洗涤的链霉亲和素dynabead与b-x dhpe融合的细胞在室温下一起培养1小时。反应体积与直接方法中的相同。
[0109]
通过本发明证实,在两种方法中,直接方法能够更容易地将磁珠附着至细胞(图7)。也就是说,直接方法在通过磁珠诱导细胞磁性中有效。
[0110]
4-2:磁珠粘附率的优化
[0111]
为了增加磁珠与细胞的粘附率,优化反应缓冲溶液。将
①
培养基,
②
pbs(ph 7.4),
③
2mm edta/0.1%bsa,和
④
0.1%pluronic f-68(gibco)应用于上文进行的直接方法。将b-x dhpe与链霉亲和素dynabead的缀合物与预先制备的细胞一起分别在上文四种缓冲溶液条件下培养。在培养完成后,将每个样品转移至6孔板并在显微镜(20x、40x)下分析。
[0112]
因此,证实0.1%pluronic f-68的培养条件展现更高的磁珠与细胞的粘附率(图8)。
[0113]
使用用于实际细胞淘选的细胞数量来测量通过磁珠的附着所诱导的磁化的细胞数量。使用6μg的b-x dhpe和2mg的链霉亲和素dynabead将2e+6个通常用于细胞淘选的细胞磁化。在通过使用基于磁性的装置(kingfisher flex,thermo scientific)或磁力分离器向细胞施加磁性而将细胞附着至磁体后,去除上清液,将细胞再次悬浮于1m的pbs(ph 7.4)缓冲溶液中,并用c-芯片计算细胞数量。重复实验显示,约90%或更多的细胞被磁化并且与磁体相互作用(图9)。
[0114]
实施例5:将磁珠附着的细胞应用于基于磁性的装置和自动细胞淘选
[0115]
在本发明中,通过联合噬菌体展示技术,使用磁珠附着的细胞通过基于磁性的装置(kingfisher flex,thermo scientific)开发了自动细胞淘选。因此,证实了磁珠所附着的细胞是否通过基于磁性的装置或磁力分离器来引导以及是否通过磁性来移动或固定。
[0116]
基于磁性的装置可以指定八个板位置。在将具有24个深孔的板置于八个板位置后,在每个位置分配1ml pbs。然后,指定磁珠所附着的细胞并将其接种于第一板上,然后通过软件(bindit 3.3,用于kingfisher)用装置的磁棒将所述细胞从第一板转移至第二板,以供基于磁性的装置的操作。此时,证实磁珠所附着的细胞从第一板移动到了第二板。将该过程重复进行直到第八板(图10和图11)。
[0117]
完成后,通过c-芯片测量保留在每个板的pbs(ph 7.4)缓冲溶液中的细胞数量。另外,将最终移动到第八板的细胞数量与在通用细胞淘选方法后保留的细胞数量进行比较。
[0118]
结果显示,在通过基于磁性的装置进行的细胞淘选方法后保留的细胞数量与在由实验者直接进行的细胞淘选方法后保留的细胞数量是相似的(图12)。
[0119]
自动细胞淘选使得能同时淘选24至96个细胞并且实现高速大规模筛选系统。另外,在每个淘选步骤中可以灵活地控制结合、洗涤、洗脱和裂解条件,并且可以缩短其所耗费的时间。
[0120]
实施例6:使磁珠附着至过表达抗原的源自患者的细胞并且通过基于磁性的装置使用所述细胞应用自动细胞淘选
[0121]
通过本发明中开发的实验方法将磁珠附着至活细胞,并且使用基于磁性的装置对所述细胞进行自动细胞淘选。此实施例中使用的抗原是成纤维细胞生长因子受体3(fgf3),并且此实施例中使用的重组抗原是重组人fgf r3(iiic),即由r&d systems生产的fc嵌合体蛋白。
[0122]
首先,通过将抗原固定在免疫管上的通常且一般已知的方法进行四次(轮)生物淘选以获得噬菌体池,其中通过生物淘选的第四次重复来扩增抗原特异性噬菌体,使用所述
噬菌体池和基于磁性的装置在强洗涤条件(在kingfisher flex设备软件bindit software 3.3.1中的洗涤(wash)步骤中将洗涤强度设置为快速(fast))和弱洗涤条件(在洗涤步骤中将洗涤强度设置为中等(medium)或慢速(slow))下进行一次(一轮)自动细胞淘选,然后对细胞淘选的所得物进行计数和回收。
[0123]
接下来,使用kingfisher flex基于磁性的装置(thermofisher scientific,美国)通过基于重组蛋白的磁珠淘选进行四次自动淘选以获得噬菌体池,其中通过生物淘选的第四次重复扩增抗原特异性噬菌体,使用所述噬菌体池在弱洗涤条件(在洗涤步骤中将洗涤强度设置为中等或慢速)下通过基于磁性的装置进行一次自动细胞淘选,然后对细胞淘选的所得物进行计数和回收。
[0124]
为了从在正常条件下回收的池和通过自动化淘选回收的池回收和计数对在实际细胞表面上表达的特定抗原结构具有更强特异性结合能力的噬菌体,使用基于磁性的装置通过本发明中开发的淘选方法自动地进行磁珠附着的细胞淘选。
[0125]
使用过表达抗原的源自患者的细胞pdc#1和低表达抗原的源自患者的细胞pdc#2进行自动细胞淘选。首先,使先前用pbs洗涤的低表达抗原的pdc#2(2x10e+6个细胞/文库)和先前洗涤的磁珠(dynabead)与在抗原中扩增四次的噬菌体池在室温下反应1小时,然后将样品离心以仅回收上清液并去除对抗原无特异性的噬菌体和对磁珠无特异性的噬菌体。
[0126]
通过本发明中开发的方法将回收的上清液与磁珠附着的源自患者的细胞一起引入自动化装置(kingfisher flex,thermo scientific,美国)中,并且相应的操作软件方案显示于图13中。
[0127]
将通过自动细胞淘选回收的噬菌体感染至tg1宿主细胞中并在lb/氨苄西林培养基中计数。为了确定回收的噬菌体的量,将回收的溶液稀释并感染至宿主细胞中,然后在lb/氨苄西林琼脂培养基中涂抹并通过第二天的菌落数定量(图14)。将剩余回收溶液涂抹在15cm培养基上并进行培养,然后向其添加5ml的sb培养基(50%甘油)以回收并储存菌落(-80℃)。
[0128]
实施例7:使用自动淘选所得物对与特定抗原具有特异性结合能力的所得物进行基于elisa的抗体筛选
[0129]
通过常规和通用scfv elisa筛选来选择fgfr3特异性抗体。用通过自动细胞淘选在每种条件下回收的噬菌体池感染宿主细胞(tg1),并从其获得单一菌落,然后将其用于elisa验证。将每个单一菌落接种于96孔板上的填充有200μl的sb/氨苄西林的孔中(37℃,3小时),并且将培养基用终浓度1mm的iptg处理以诱导蛋白质表达,然后将其在28℃下培养16小时或更长时间。
[0130]
第二天,在离心并去除上清液后,将培养板用tes溶液(20%w/v蔗糖,50mm tris,1mm edta,ph 8.0)处理,以收集存在于留在每个孔中的大肠杆菌宿主细胞的周围细胞质区域附近的scfv并使其在4℃下静置,然后将上清液通过离心机回收,在提前用特定抗原包被的96孔板上处理,并在室温下反应1小时。在反应后,进行洗涤过程并用抗ha hrp以及封闭缓冲液一起进行处理1小时,进行相同的洗涤过程,然后用tmb底物进行处理,并且用450nm的o.d.进行分析。
[0131]
因此,如从图16可见,可以从通过使用重组蛋白的生物淘选获得的与fgfr3具有特异性结合能力的scfv池自动地选择对实际细胞表面上表达的fgfr3更具特异性并且结构更
稳定的scfv,并且可以通过基于磁性的装置自动地选择对各种文库和各种抗原或细胞具有特异性的抗体。
[0132]
尽管已经详细描述了本发明的具体配置,但本领域技术人员应理解,本说明书是出于说明性目的为了阐述优选实施方案而提供,并且不应理解为限制本发明的范围。因此,本发明的实质范围由随附权利要求及其等同物限定。
[0133]
【工业实用性】
[0134]
根据本发明将磁珠附着至活细胞的方法是可以应用于使用磁性诱导的细胞的基于噬菌体展示的生物淘选的方法。所述方法能够在维持细胞表面蛋白的结构的同时选择抗体,并且与使用重组蛋白的淘选方法相比,具有选择抗原特异性抗体的更高可能性。另外,所述方法能够通过应用于基于磁性的高速大规模筛选装置和系统以极少劳动选择针对大量不同抗原的抗体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1