二取代的5(3)-吡唑羧酸酯及由烯醇酯和氟烷基氨基(FAR)试剂制备其的方法与流程
二取代的5(3)-吡唑羧酸酯及由烯醇酯和氟烷基氨基(far)试剂制备其的方法
[0001]
本发明涉及二取代的5(3)-吡唑羧酸酯及其新的制备方法。由wo 2012/126766已知,n-烷基-3-卤代烷基-4-(甲基亚磺酰基)-5-吡唑羧酸酯是用于合成具有强的杀虫活性的吡唑甲酰胺的重要前体。wo 2012/126766中记载了在3位具有c2f
5-基团且在4位具有sme-基团的吡唑的化学合成。然而,该合成需要具有中等产率的多步转化和繁琐的分离和纯化。
[0002]
利用氟烷基氨基试剂(far)来合成各种取代的吡唑已被公开,例如pazenok等人,european journal of organic chemistry 2015(27),6052-6060;pazenok等人,european journal of organic chemistry 2013(20),4249-4253;wo 2014/033164和wo 2008/022777。
[0003]
鉴于上述现有技术,本发明的目的是提供一种不具有上述缺点的方法,并因此提供了一种以高产率得到二取代的5(3)-吡唑羧酸酯衍生物的路线。
[0004]
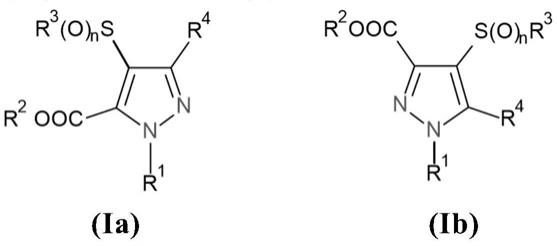
上述目的通过一种制备式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯的方法来实现,
[0005][0006]
其中
[0007]
r1选自h、(c
1-c6)烷基、苯基或2-吡啶基,
[0008]
r2选自h、(c
1-c
12
)烷基或(c
3-c8)环烷基,
[0009]
r3选自(c
1-c
12
)烷基、(c
1-c3)卤代烷基、(c
3-c8)环烷基、(c
6-c
12
)芳基、(c
1-c3)烷基(c
6-c
12
)芳基和(c
6-c
12
)芳基(c
1-c6)烷基,
[0010]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,以及
[0011]
n为0、1或2,
[0012]
其包括步骤(a),其中
[0013]
式(iii)的α,α-二氟烷基氨基试剂(far),
[0014][0015]
其中
[0016]
r4如上所定义,以及
[0017]
r6和r7各自独立地选自(c
1-c6)烷基、(c
3-c8)环烷基、(c
6-c
12
)芳基或与它们所连接的氮原子一起可以形成五元环或六元环,
[0018]
首先在路易斯酸[l]的存在下转化为式(vi)的化合物,
[0019][0020]
其中r4、r6和r7如式(iii)所定义,且[lf]-为由路易斯酸[l]和来自化合物(iii)的一个氟原子形成的阴离子,
[0021]
然后,使式(vi)的化合物与式(ii)的烯醇酯反应
[0022][0023]
其中
[0024]
r5选自(c
1-c
12
)烷基或(c
3-c8)环烷基,
[0025]
r3和n如上所定义,
[0026]
m为1或2,以及
[0027]
cat
m+
选自碱金属阳离子(其中m=1)、碱土金属阳离子(其中m=2)、有机铵阳离子(其中m=1)或有机膦阳离子(其中m=1),
[0028]
形成式(iv)的化合物
[0029][0030]
其中
[0031]
n、[lf]-、r3、r4、r5、r6和r7如上所定义,
[0032]
以及还包括步骤(b),其中与式(v)的肼
[0033]
nh
2-nh-r1ꢀꢀꢀ
(v),
[0034]
其中r1如上所定义,
[0035]
进行环化以形成式(ia)或(ib)的化合物。
[0036]
优选本发明的方法,其中式(ia)、(ib)、(ii)、(iii)、(iv)、(v)和(vi)中的基团定义如下:
[0037]
r1选自h、(c
1-c6)烷基、苯基或2-吡啶基,
[0038]
r2选自h、(c
1-c6)烷基或(c
3-c6)环烷基,
[0039]
r3选自(c
1-c6)烷基、(c
1-c3)卤代烷基、(c
3-c6)环烷基、(c
6-c9)芳基、(c
1-c3)烷基(c
6-c9)芳基和(c
6-c9)芳基(c
1-c3)烷基,
[0040]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,
[0041]
r5选自(c
1-c6)烷基或(c
3-c6)环烷基,
[0042]
n为0、1或2,
[0043]
r6和r7各自独立地选自(c
1-c6)烷基、(c
3-c6)环烷基、(c
6-c
12
)芳基,或者
[0044]
r6和r7与它们所连接的氮原子一起可以形成五元环或六元环,m为1,以及
[0045]
cat
m+
选自碱金属阳离子,优选li
+
、na
+
、k
+
和cs
+
;有机铵阳离子,优选(r8)4n
+
;或有机膦阳离子,优选(苯基)4p
+
,其中
[0046]
r8各自独立地选自(c
1-c6)烷基。
[0047]
更优选本发明的方法,其中式(ia)、(ib)、(ii)、(iii)、(iv)、(v)和(vi)中的基团定义如下:
[0048]
r1选自h、(c
1-c6)烷基或苯基,
[0049]
r2选自h、(c
1-c6)烷基,
[0050]
r3选自(c
1-c6)烷基,
[0051]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,其中卤素选自氟和/或氯,
[0052]
r5选自(c
1-c6)烷基,
[0053]
n为0、1或2,
[0054]
r6和r7各自独立地选自(c
1-c6)烷基,
[0055]
m为1,以及
[0056]
cat
m+
选自li
+
、na
+
、k
+
、cs
+
或me4n
+
。
[0057]
甚至更优选本发明的方法,其中式(ia)、(ib)、(ii)、(iii)、(iv)、(v)和(vi)中的基团定义如下:
[0058]
r1选自h、甲基、乙基或苯基,
[0059]
r2选自h、甲基或乙基,
[0060]
r3选自甲基或乙基,
[0061]
r4选自二氟甲基(cf2h)、氯氟甲基(chfcl)、1,2,2,2-四氟乙基(cf3cfh)、五氟乙基(c2f5)和三氟甲氧基氟甲基(cf3ocfh),
[0062]
r5选自(c
1-c3)烷基,
[0063]
n为2,
[0064]
r6和r7为甲基,
[0065]
m为1,以及
[0066]
cat
+
选自li
+
、na
+
或k
+
。
[0067]
最优选本发明的方法,其中式(ia)、(ib)、(ii)、(iii)、(iv)、(v)和(vi)中的基团定义如下:
[0068]
r1选自h、甲基或苯基,
[0069]
r2选自h、甲基或乙基,
[0070]
r3为甲基,
[0071]
r4选自二氟甲基(cf2h)、氯氟甲基(chfcl)、1,2,2,2-四氟乙基(cf3cfh)、五氟乙基(c2f5)和三氟甲氧基氟甲基(cf3ocfh),
[0072]
r5选自甲基或乙基,
[0073]
n为2,
[0074]
r6和r7为甲基,
[0075]
m为1,以及
[0076]
cat
m+
为na
+
或k
+
。
[0077]
在本发明特别优选的实施方案中,通式(ia)、(ib)、(ii)和(iv)的化合物的n为2。
[0078]
在本发明优选的实施方案中,所述方法在一种或多种合适溶剂的存在下进行。下文将为各个方法步骤详述合适的溶剂。
[0079]
出人意料地,式(ia)或(ib)的吡唑可以在本发明的条件下仅在几个步骤中以高产率和高纯度制备,这意指本发明的方法克服了现有技术中先前记载的制备方法的上述缺点。
[0080]
本发明的另一个目的是通式(iv)的中间体
[0081][0082]
其中
[0083]
n、r3、r4、r5、r6和r7如上所定义,且[lf]-为由路易斯酸[l]和一个氟原子形成的阴离子。
[0084]
[lf]-优选代表bf
4-、alcl3f-、sbcl5f-、sbf
6-、pf
6-或zncl2f-,更优选bf
4-、alcl3f-或sbf
6-,甚至更优选bf
4-或alcl3f-,最优选[lf]-为bf
4-。
[0085]
分别形成[lf]-的路易斯酸[l]优选选自bf3、alcl3、sbcl5、sbf5、pf5或zncl2或它们的任何混合物,更优选bf3、alcl3或sbf5,甚至更优选bf3或alcl3,最优选路易斯酸为bf3。
[0086]
本发明的目的还在于式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯,
[0087][0088]
其中
[0089]
r1选自h、(c
1-c6)烷基、苯基或2-吡啶基,
[0090]
r2选自(c
1-c
12
)烷基或(c
3-c8)环烷基,
[0091]
r3选自(c
1-c
12
)烷基、(c
1-c3)卤代烷基、(c
3-c8)环烷基、(c
6-c
12
)芳基、(c
1-c3)烷基(c
6-c
12
)芳基和(c
6-c
12
)芳基(c
1-c6)烷基,
[0092]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,以及
[0093]
n为0、1或2,
[0094]
优选式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯,其中
[0095]
r1选自h、(c
1-c6)烷基、苯基或2-吡啶基,
[0096]
r2选自(c
1-c6)烷基或(c
3-c6)环烷基,
[0097]
r3选自(c
1-c6)烷基、(c
1-c3)卤代烷基、(c
3-c6)环烷基、(c
6-c9)芳基、(c
1-c3)烷基(c
6-c9)芳基和(c
6-c9)芳基(c
1-c3)烷基,
[0098]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,以及
[0099]
n为0、1或2。
[0100]
更优选式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯,其中
[0101]
r1选自h、(c
1-c6)烷基或苯基,
[0102]
r2选自(c
1-c6)烷基,
[0103]
r3选自(c
1-c6)烷基,
[0104]
r4选自(c
1-c6)卤代烷基和(c
1-c3)卤代烷氧基(c
1-c6)卤代烷基,其中卤素选自氟和/或氯,以及
[0105]
n为0、1或2。
[0106]
甚至更优选式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯,其中
[0107]
r1选自h、甲基、乙基或苯基,
[0108]
r2选自甲基或乙基,
[0109]
r3选自甲基或乙基,
[0110]
r4选自二氟甲基(cf2h)、氯氟甲基(chfcl)、1,2,2,2-四氟乙基(cf3cfh)、五氟乙基(c2f5)和三氟甲氧基氟甲基(cf3ocfh),以及
[0111]
n为2。
[0112]
最优选式(ia)或(ib)的二取代的5(3)-吡唑羧酸酯,其中
[0113]
r1选自h、甲基或苯基,
[0114]
r2选自甲基或乙基,
[0115]
r3为甲基,
[0116]
r4选自二氟甲基(cf2h)、氯氟甲基(chfcl)、1,2,2,2-四氟乙基(cf3cfh)、五氟乙基(c2f5)和三氟甲氧基氟甲基(cf3ocfh),以及
[0117]
n为2。
[0118]
在本发明特别优选的实施方案中,通式(ia)、(ib)和(iv)的化合物的n为2。
[0119]
一般定义
[0120]
在本发明的上下文中,除非另有定义,术语“卤素”(hal)包括选自氟、氯、溴和碘,优选氟、氯和溴,更优选氟和氟的那些元素。
[0121]
在本发明的上下文中,除非另有定义,烷基基团为直链或支链的饱和烃基基团。定义c
1-c
12-烷基包括本文中对烷基基团所定义的最宽的范围。具体而言,该定义包括下列含义:例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基、正戊基、正己基,1,3-二甲基丁基、3,3-二甲基丁基、正庚基、正壬基、正癸基、正十一烷基或正十二烷基。
[0122]
在本发明的情况下,术语烷氧基——以其本身或与其他术语结合(例如卤代烷氧基)——应理解为意指o-烷基基团,其中术语“烷基”如上所定义。
[0123]
在本发明的上下文中,环烷基基团为具有3至8个碳环成员且优选3至6个碳环成员的单环饱和烃基基团,例如(但不限于)环丙基、环戊基和环己基。除非另有定义,该定义还适用于作为复合取代基(例如环烷基烷基等)的一部分的环烷基。
[0124]
在本发明的上下文中,除非另有定义,芳基基团为芳族烃基基团。定义c
6-c
12-芳基包括本文中对具有6至12个骨架原子的芳基所定义的最宽的范围。芳基可为单环或双环的。具体而言,该定义包括下列含义:例如,苯基、环庚三烯基、环辛四烯基、萘基和蒽基。
[0125]
在本发明的上下文中,除非另有定义,芳基烷基基团(芳烷基基团)为被芳基基团取代的烷基。具体而言,该定义包括下列含义:例如,苄基和苯乙基。
[0126]
在本发明的上下文中,除非另有定义,烷基芳基基团(烷芳基基团)为被一个或多个烷基基团取代的芳基基团,其在烷基链中可具有1至6个碳原子。具体而言,该定义包括下列含义:例如,甲苯基或2,3-二甲基苯基、2,4-二甲基苯基、2,5-二甲基苯基、2,6-二甲基苯基、3,4-二甲基苯基或3,5-二甲基苯基。
[0127]
卤素取代的基团,例如卤代烷基,为单卤代或多卤代的,最高达可能取代基的最大数目。在多卤代的情况下,卤素原子可以相同或不同。除非另有说明,任选地取代的基团可为单取代或多取代的,其中在多取代的情况下,取代基可以相同或不同。
[0128]
在本发明的上下文中,卤代烷基基团为具有1至6个且优选1至3个碳原子的直链或支链烷基基团(如上所述),其中这些基团中的一些或全部氢原子可以被如上所述的卤素原子替代,例如(但不限于)c
1-c3卤代烷基,例如氯甲基、溴甲基、二氯甲基、三氯甲基、氟甲基、二氟甲基、三氟甲基、氯氟甲基、二氯氟甲基、氯二氟甲基、1-氯乙基、1-溴乙基、1-氟乙基、2-氟乙基、2,2-二氟乙基、2,2,2-三氟乙基、2-氯-2-氟乙基、2-氯-2-二氟乙基、2,2-二氯-2-氟乙基、2,2,2-三氯乙基、五氟乙基和1,1,1-三氟丙-2-基。除非另有定义,该定义还适用于作为复合取代基的一部分的卤代烷基,例如卤代烷基烷氧基、卤代烷氧基卤代烷基、卤代烷基氨基烷基等。优选被一个或多个卤素原子取代的烷基基团,例如三氟甲基(cf3)、二氟甲基(chf2)、cf3cfh、cf3ch2、cf2cl、cf3cf2、cf3ccl2。
[0129]
在本发明的上下文中,所用的术语中间体描述了这样的物质:其在本发明的方法中出现,并被制备以用于进一步的化学处理,并且在所述化学处理中被消耗或使用以转化
为另一种物质。中间体通常可以被分离并立即储存,或无需预先分离即用于后续的反应步骤。术语“中间体”还包括通常不稳定的和短寿命的中间体,其在多阶段反应(分级反应)中短暂地出现,并且可被赋予反应能量曲线中的局部最小值。
[0130]
本发明的化合物可作为任何不同的可能的异构体形式的混合物存在,特别是立体异构体,例如e型和z型异构体、苏型和赤型异构体以及光学异构体,但是如果合适,还为互变异构体。公开和要求保护的是e型和z型异构体两者,同样公开和要求保护的是苏型和赤型异构体,以及光学异构体,这些异构体的任意混合物,以及可能的互变异构体形式。
[0131]
方法说明
[0132]
本发明的方法示于方案1中:
[0133]
方案1:
[0134][0135]
步骤(a)
[0136]
在步骤(a)中,首先在路易斯酸[l]的存在下,将式(iii)的far转化为式(vi)的化合物,然后与式(ii)的化合物反应。
[0137]
优选的通式(iii)的化合物为1,1,2,2-四氟乙基-n,n-二甲胺(tfedma)、1,1,2,2-四氟乙基-n,n-二乙胺、1,1,2-三氟-2-(三氟甲基)乙基-n,n-二甲胺、1,1,2-三氟-2-(三氟甲基)乙基-n,n-二乙胺(ishikawa试剂)、1,1,2-三氟-2-氯乙基-n,n-二甲胺和1,1,2-三氟-2-氯乙基-n,n-二乙胺(yarovenko试剂)、1,1,2-三氟-n,n-二甲基-2-(三氟甲氧基)乙胺。通式(iii)的化合物用作亚氨基酰化试剂。优选1,1,2,2-四氟乙基-n,n-二甲胺(tfedma)、1,1,2-三氟-2-氯乙基-n,n-二甲胺和1,1,2-三氟-n,n-二甲基-2-(三氟甲氧基)乙胺。
[0138]
α,α-二卤代胺如tfedma、ishikawa试剂或yarovenko试剂可商购或可以根据以下方法(yarovenko等人,zh.obshch.khim.1959,29,2159,chem.abstr.1960,54,9724h或petrov等人,j.fluor.chem.109(2011)25-31)制备。1,1,2-三氟-n,n-二甲基-2-(三氟甲氧基)乙胺可根据s.pazenok等人organic letters(2017),19(18),4960-4963获得。
[0139]
在本发明的方法中,首先将α,α-二氟烷基胺(iii)与路易斯酸[l]反应以形成式(vi)的化合物。用路易斯酸活化α,α-二氟烷基胺通常记载于wo 2008/022777中。
[0140]
本发明合适的路易斯酸[l]包括本领域技术人员已知的所有有机和无机电子对受体,优选无机电子对受体。优选路易斯酸选自bf3、alcl3、sbcl5、sbf5、pf5或zncl2或它们的任何混合物,更优选bf3、alcl3或sbf5,甚至更优选bf3或alcl3且最优选路易斯酸为bf3。
[0141]
路易斯酸可以物质本身使用或以合适的溶剂中的稳定溶液使用,所述溶剂优选为通常用于步骤(a)的溶剂。
[0142]
在式(iii)的化合物与路易斯酸反应以形成式(vi)的化合物中,由路易斯酸[l]和化合物(iii)的一个氟原子形成阴离子[lf]-。优选[lf]-代表bf
4-、alcl3f-、sbcl5f-、sbf
6-、pf
6-或zncl2f-,更优选bf
4-、alcl3f-或sbf
6-,甚至更优选bf
4-或alcl3f-,最优选[lf]-为bf
4-。
[0143]
根据本发明,1摩尔的路易斯酸[l]与等摩尔量的式(iii)的α,α-二氟烷基胺反应。
[0144]
然后使活化的far(vi)与式(ii)的化合物反应以获得式(iv)的化合物。
[0145]
在该步骤中,优选将式(ii)的化合物加入溶解在合适的溶剂中的化合物(vi)中。
[0146]
式(ii)的化合物可以根据sokolov,m.p.等人;journal of organic chemistry ussr(英文翻译);第22卷;(1986);第644-647页由廉价且可得的化学品(如甲基烷基砜和草酸酯)来制备。优选的式(ii)的化合物为3-甲氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠、3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠、3-乙氧基-1-(苯基磺酰基)-3-氧代丙-1-烯-2-醇钠、3-甲氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钾、3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钾。
[0147]
对于本发明的方法,将1至2摩尔,优选1至1.5摩尔,最优选1至1.2摩尔的式(vi)的活化的far与1摩尔的式(ii)的化合物反应。
[0148]
根据本发明,步骤(a)优选在-20℃至+60℃的温度下,更优选在-20℃至+40℃,甚至更优选在-10至+20℃的温度下和在标准压力下进行。由于α,α-二氟烷基胺的水解敏感性,该反应优选在无水条件下在惰性气体气氛下进行。反应时间不是至关重要的,并且可以根据批量大小和温度在几分钟到几小时之间的范围内进行选择。
[0149]
化合物(ii)与活化的far(vi)的反应优选在碱的存在下进行。优选有机碱,例如三(c
1-c4)烷基胺、吡啶、(c
1-c4)烷基吡啶(例如甲基吡啶)和1,8-二氮杂二环[5.4.0]十一碳烯(dbu)或碱金属氢氧化物(例如氢氧化锂、氢氧化钠或氢氧化钾)、碱金属碳酸盐(例如na2co3或k2co3)和碱金属(c
1-c4)醇盐(例如naome、naoet、naot-but或kot-but)或碱金属氟化物(例如kf)。还可以使用这些碱的混合物。最优选的是有机碱,如吡啶和(c
1-c4)烷基吡啶或kf。
[0150]
步骤(a)优选在一种或多种溶剂的存在下进行。用于步骤(a)的合适的溶剂为例如脂族烃、脂环族烃或芳族烃,例如石油醚、正己烷、正庚烷、环己烷、甲基环己烷、苯、甲苯、二甲苯或十氢化萘;以及卤代烃,例如氯苯、二氯苯、二氯甲烷、三氯甲烷、四氯甲烷、二氯乙烷或三氯乙烷;醚,例如乙醚、二异丙醚、甲基叔丁基醚、甲基叔戊基醚、二氧六环、四氢呋喃、1,2-二甲氧基乙烷、1,2-二乙氧基乙烷或苯甲醚;酯,例如乙酸乙酯或乙酸异丙酯;腈,例如乙腈、丙腈、正丁腈或异丁腈或苄腈;酰胺,例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基甲酰苯胺、n-甲基吡咯烷酮或六甲基磷酰三胺;亚砜,例如二甲基亚砜;或砜,例如环丁砜。特别优选thf、乙腈、甲基叔丁基醚、二氯甲烷、甲苯、二甲苯、氯苯、正己烷、环己烷或甲基环己烷,并且非常特别优选乙腈、thf、甲基叔丁基醚或二氯甲烷。
[0151]
所形成的式(iv)的中间体可无需预先后处理即用于环化步骤(b)。或者,可以通过
合适的后处理分离中间体,对其进行表征和任选地进一步纯化。
[0152]
步骤(b):
[0153]
在环化步骤(b)中,使式(iv)的化合物与式(v)的肼反应。
[0154]
该反应优选在-20℃至+80℃的温度下,更优选在+0℃至+70℃,甚至更优选在+20至+50℃的温度下和在标准压力下进行。反应时间不是至关重要的,并且可以根据批量大小在相对宽的范围内进行选择。
[0155]
根据本发明,优选将1摩尔至2摩尔,更优选1至1.5摩尔的肼用于转化1摩尔的式(iv)的化合物。
[0156]
步骤(b)优选在一种或多种溶剂的存在下进行。更优选环化步骤(b)在步骤(a)后在不改变溶剂的情况下进行。
[0157]
合适的溶剂为例如脂族烃、脂环族烃或芳族烃,例如石油醚、正己烷、正庚烷、环己烷、甲基环己烷、苯、甲苯、二甲苯或十氢化萘;以及卤代烃,例如氯苯、二氯苯、二氯甲烷、三氯甲烷、四氯甲烷、二氯乙烷或三氯乙烷;醚,例如乙醚、二异丙醚、甲基叔丁基醚、甲基叔戊基醚、二氧六环、四氢呋喃、1,2-二甲氧基乙烷、1,2-二乙氧基乙烷或苯甲醚;醇,例如甲醇、乙醇、异丙醇或丁醇;酯,例如乙酸乙酯或乙酸异丙酯;腈,例如乙腈、丙腈、正丁腈或异丁腈或苄腈;酰胺,例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基甲酰苯胺、n-甲基吡咯烷酮或六甲基磷酰三胺;亚砜,例如二甲基亚砜;或砜,例如环丁砜。特别优选乙腈、thf、甲基叔丁基醚、乙醇、乙酸异丙酯、二氯甲烷、甲苯、二甲苯、氯苯、正己烷、环己烷或甲基环己烷,并且非常特别优选乙腈、thf、乙醇、乙酸异丙酯、甲苯或二甲苯。
[0158]
反应结束后,可以通过本领域技术人员已知的合适方法分离和纯化通式(i)的化合物。例如,可以除去溶剂,并且可以通过过滤分离产物。或者,首先可以将产物用有机溶剂进行萃取,并用水进行洗涤,所述水优选用酸(优选hcl或h2so4)进行酸化,然后可以在减压下除去溶剂,并通过结晶纯化产物。
[0159]
从通式(iv)的化合物开始,可以在步骤(b)期间形成通式(ia)或(ib)的两种不同的异构体。环化步骤(b)的区域选择性可受所选择的溶剂和底物、特别是通式(v)的肼的影响。
[0160]
根据现有技术方法(例如在wo 2013/113829中记载),可以在另一步骤(c)中,将其中r2=(c
1-c
12
)烷基或(c
3-c8)环烷基的式(i)的化合物转化为其中r2=h的式(i)的吡唑酸。
[0161]
方案2,步骤(c):
[0162][0163]
本发明的方法优选由步骤a和b组成,或由步骤a和b和c组成。
实施例:
[0164]
本发明通过但不限于以下实施例来说明:
[0165]
实施例1
[0166]
[(z/e)-1-(二氟甲基)-4-乙氧基-3-羟基-2-甲基-4-氧代-丁-2-烯亚基]-二甲基-四氟硼酸铵
[0167][0168]
在特氟龙(teflon)烧瓶中,在氩气下,将bf3.oet2(0.12ml,1.0mmol)加入1,1,2,2-四氟乙基-n,n-二甲胺(tfedma)(0.12ml,1.0mmol)于干燥二氯甲烷(1ml)的溶液中。将溶液在室温下搅拌15分钟,然后在减压下除去二氯甲烷。然后将固体残余物溶于乙腈(1ml)中,并将3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠(0.216g,1.0mmol)和吡啶(0.316g,4mmol)加入cd3cn(2ml)中,并将混合物在室温下搅拌10小时。真空蒸发溶剂,然后通过1h、
13
c和
19
f nmr分析残余物。
[0169]1h nmr(600mhz,cd3cn-d3)δppm 1.29(br t,j=7.13hz,4h)3.22(s,3h)3.44(br s,6h)4.24(q,j=7.23hz,3h)6.90-7.09(m,1h)8.99-9.34(m,1h)。
[0170]
13
c nmr(151mhz,cd3cn-d3)δppm 14.20(s,1c)46.42(s,1c)46.65-47.52(m,1c)62.96(s,1c)104.90-105.03(m,1c)111.25(t,j=248.91hz,1c)165.03-165.52(m,1c)166.44(s,1c)177.33(s,1c)。
[0171]
19
f nmr(cdcl3,282mhz):δppm-117.3(chf2,j
f-h
=53.6hz),-150(bf4)。
[0172]
实施例2
[0173]
5-(二氟甲基)-2-甲基-4-甲基磺酰基-吡唑-3-甲酸乙酯
[0174][0175]
在特氟龙烧瓶中,在氩气下,将bf3·
ch3cn络合物(17重量%溶液)(2.17g,20mmol)加入tfedma(2.86g,20mmol)于25ml ch3cn的溶液中。将溶液在室温下搅拌15分钟,然后在10℃下加入3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠(3.2g,15mmol)和吡啶(4.7g,60mmol),并将混合物在室温下搅拌10小时。将混合物冷却至-10℃,并将甲基肼(1.38g,30mmol)加入反应混合物中。将形成的悬浮液在室温(rt)下搅拌4小时,并加入100ml水。用乙酸乙酯萃取产物,将有机溶液用10ml(10重量%)hcl和水洗涤,并蒸发有机溶剂,得到浅黄色固体,将其从甲基环己烷中重结晶。
[0176]
产量3.18g,理论值的75%。
[0177]1h nmr(dmso-d6,600mhz):δppm 7.25(t,j=53.3hz,1h)4.43(q,j=7.2hz,2h)4.09(s,3h)1.36(t,j=7.1hz,3h)。
[0178]
13
c nmr(151mhz,dmso-d6)δppm 13.63(s,1c)40.46(s,1c)44.92(s,1c)63.25(s,1c)108.90(t,j=236.56hz,1c)122.47(s,1c)135.77(s,1c)143.14(t,j=24.85hz,1c)157.63(s,1c)。
[0179]
19
f nmr(cfcl3,282mhz):δppm-115.06,(d)。
[0180]
实施例3
[0181]
5-(二氟甲基)-2-甲基-4-甲基磺酰基-吡唑-3-甲酸
[0182][0183]
将甲苯(15ml)中的5-(二氟甲基)-2-甲基-4-甲基磺酰基-吡唑-3-甲酸乙酯(2.83g,10mmol)与8n氢氧化钠水溶液(100ml)混合,并在50℃下搅拌3小时。分离各相,并将水相用6n hcl酸化至ph 1。滤出形成的沉淀物并干燥。
[0184]
产量2.3g,90%,无色固体,熔点(m.p.)168℃。
[0185]1h nmr(dmso-d6,600mhz):δppm 7.24(t,j=53.3hz,1h)4.08(s,3h)3,39(s,3h)。
[0186]
13
c nmr(151mhz,dmso-d6):δppm:40.4(s,1c)44.92(s,1c)109.0(t,j=236.56hz,1c)121.9(s,1c)137.5(s,1c)143.0(t,j=24.85hz,1c)159.3(s,1c)。
[0187]
19
f nmr(cfcl3,282mhz):δppm-114.61,(d)。
[0188]
实施例4
[0189]
5-(二氟甲基)-1-甲基-4-甲基磺酰基-吡唑-3-甲酸乙酯
[0190][0191]
在特氟龙烧瓶中,在氩气下,将bf3·
ch3cn络合物(17重量%溶液)(2.17g,20mmol)加入tfedma(2.86g,20mmol)于25ml ch3cn的溶液中。将溶液在室温下搅拌15分钟,然后在10℃下加入3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠(3.2g,15mmol)和吡啶(4.70g,60mmol),并将混合物在室温下搅拌10小时。在真空(20mbar)中除去溶剂和挥发性产物,并将残余物溶于30ml乙醇中。将溶液冷却至10℃,并在30分钟内将甲基肼(1.38g,30mmol)加入反应混合物中。将形成的悬浮液在室温(rt)下搅拌4小时,并加入100ml水。将产物用乙酸乙酯萃取,将有机溶液用10ml(10重量%)hcl和水洗涤,并蒸发有机溶剂,得到浅黄色固体,将其从甲基环己烷中重结晶。
[0192]
产量3.3g,理论值的78%。
[0193]1h nmr(600mhz,dmso-d6)δppm 1.32(s,3h)3.50(s,3h)4.11(s,3h)4.34-4.38(m,2h)7.42-7.61(m,1h)。
[0194]
13
c nmr(151mhz,dmso-d6)δppm 13.99(s,1c)40.49(s,1c)44.60(s,1c)62.12(s,1c)123.87(s,1c)136.88(s,1c)140.54-141.18(m,1c)159.97(s,1c)。
[0195]
实施例5
[0196]
5-(二氟甲基)-1-甲基-4-甲基磺酰基-吡唑-3-甲酸乙酯
[0197][0198]
将甲苯(15ml)中的5-(二氟甲基)-1-甲基-4-甲基磺酰基-吡唑-3-甲酸乙酯(2.83g,10mmol)与8n氢氧化钠水溶液(30ml)混合,并在50℃下搅拌3小时。分离各相,并将水相用6n hcl酸化至ph1。滤出形成的沉淀物并干燥。
[0199]
产量2.4g,95%,无色固体,熔点(m.p.)186℃。
[0200]1h nmr(600mhz,dmso-d6)δppm 3.50(s,3h)4.09(s,3h)7.40-7.66(m,1h)13.17-14.78(m,1h)。
[0201]
13
c nmr(151mhz,dmso-d6)δppm 40.46(t,j=3.46hz,1c)44.50(s,1c)107.21(t,j=236.26hz,1c)123.66(s,1c)136.68(t,j=25.15hz,1c)142.02(s,1c)161.55(s,1c)。
[0202]
19
f nmr(cfcl3,282mhz)δppm-115,44,(d)。
[0203]
实施例6
[0204]
5-(二氟甲基)-4-甲基磺酰基-2-苯基-吡唑-3-甲酸乙酯
[0205][0206]
在特氟龙烧瓶中,在氩气下,将bf3·
ch3cn络合物(17重量%溶液)(3.26g,30mmol)加入tfedma(4.3g,30mmol)于25ml ch3cn的溶液中。将溶液在室温下搅拌15分钟,然后在10℃下加入3-乙氧基-1-(甲基磺酰基)-3-氧代丙-1-烯-2-醇钠(3.2g,15mmol)和吡啶(4.7g,60mmol),并将混合物在室温下搅拌10小时。将混合物冷却至-10℃,并将苯肼(3.2g,30mmol)加入反应混合物中。将形成的悬浮液在室温下搅拌4小时,并加入100ml水。用乙酸乙酯萃取产物,将有机溶液用10ml(10重量%)hcl和水洗涤,并蒸发有机溶剂,得到浅黄色固体,将其从乙醇/水中重结晶。
[0207]
产量4.17g,理论值的81%。
[0208]1h nmr(600mhz,dmso-d6)δppm 1.11(t,j=7.13hz,3h)3.45(s,3h)4.28(q,j=7.16hz,2h)7.33-7.35(m,1h)7.55-7.58(m,2h)7.59-7.62(m,2h)7.60-7.63(m,1h)。
[0209]
13
c nmr(151mhz,dmso-d6)δppm 13.66(s,1c)40.49(s,1c)44.95(s,1c)63.28(s,
1c)108.92(s,1c)122.48(t,j=3.61hz,1c)135.79(s,1c)142.97-143.38(m,1c)157.65(s,1c)。
[0210]
实施例7
[0211]
5-(二氟甲基)-4-甲基磺酰基-2-苯基-吡唑-3-甲酸
[0212][0213]
将甲苯(15ml)中的5-(二氟甲基)-4-甲基磺酰基-2-苯基-吡唑-3-甲酸乙酯(3.44g,10mmol)与8n氢氧化钠水溶液(142ml)混合,并在40℃下搅拌3小时。分离各相,并将水相用6n hcl酸化至ph 1。滤出沉淀物并干燥。
[0214]
产量3g,95%的无色固体,熔点(m.p.)187℃。
[0215]1h nmr(600mhz,dmso-d6)δppm 3.50(s,3h)4.09(s,3h)7.40-7.66(m,1h)13.17-14.78(m,1h)。
[0216]
13
c nmr(151mhz,dmso-d6)δppm 40.46(t,j=3.46hz,1c)44.50(s,1c)107.21(t,j=236.26hz,1c)123.66(s,1c)136.68(t,j=25.15hz,1c)142.02(s,1c)161.55(s,1c)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 取代的(r)-3-(4-甲基氨基甲酰基-3-氟苯基氨基)四氢呋喃-3-甲酸(变体)和其酯,其制 ...的制作方法
- 一种3-[1-(二甲基氨基)乙基]苯酚的制备方法
- 一种二甲基苯甲醛精馏装置的制造方法
- 一种二甲基苯甲醛精馏系统的制作方法
- 由3,7-二甲基辛-2-烯醛或3,7-二甲基辛-2,6-二烯醛制备的(6r,10r)-6,10,14-三甲基 ...的制作方法
- 一种(2s)-2-氨基-4-甲基-1-[(2r)-2-甲基环氧乙烷基]-1-戊酮三氟乙酸盐的新晶型及 ...的制作方法
- 键合3,5-二甲基苯氨基甲酰化β-环糊精手性固定相在手性分析和/或分离盐酸舍曲林中 ...的制作方法
- 一种罗丹明-(4-二甲基氨乙基氨基-1,8-萘二甲酰亚胺)荧光分子及其制备方法和应用
- 异戊二烯和丙烯醛制备对甲基苯甲醛的方法
- 1,3-二氨基-5,7-二甲基金刚烷的一种合成方法