含氟化合物的制造方法与流程
[0001]
本发明涉及含氟化合物的制造方法。
背景技术:
[0002]
生物体内的生理活性物质中存在作为含有含氟亚甲基的化合物的物质,因此积极研究着具有氟代亚甲基的化合物在医药品等中的应用。
[0003]
例如,作为在α位具有选自氟原子和全氟有机基团中的1个以上的取代基的羰基化合物的、α-氟代亚甲基化合物和α-二氟羟醛化合物等含氟亚甲基化合物的制造方法的有用性高(非专利文献1和2)。
[0004]
作为含有含氟亚甲基的化合物的制造方法的例子,专利文献1中提出了通式(1)所示的化合物、或者其闭环衍生物或开环衍生物的制造方法,该制造方法包括:使如下的通式(2)所示的化合物在还原剂的存在下且在光照射下与如下的通式(3)所示的化合物反应的工序a。
[0005]
式(1):
[0006][0007]
[式中,
[0008]
r1表示有机基团,
[0009]
r
x
表示氢原子或氟原子,且
[0010]
r
2a
、r
2b
、r
2c
和r
2d
相同或不同,表示-y-r
21
或-n(-r
22
)2,或者r
2b
和r
2c
可以连结而形成键,
[0011]
y表示价键、氧原子或硫原子,
[0012]
r
21
表示氢原子或有机基团,
[0013]
r
22
在每次出现时相同或不同,表示氢原子或有机基团。]
[0014]
式(2):
[0015][0016]
[式(2)中,x表示消去基团,且其它符号与上述意义相同。]
[0017]
式(3):
[0018][0019]
[式中的符号与上述意义相同。]
[0020]
现有技术文献
[0021]
专利文献
[0022]
专利文献1:国际公开2017/154948号小册子
[0023]
非专利文献
[0024]
非专利文献1:john t.welch等,tetrahedron,1987年,43,14,3123页
[0025]
非专利文献2:svante等,j.am.chem.soc.,1981年,103,4452页
技术实现要素:
[0026]
发明所要解决的课题
[0027]
但是,进一步要求提供新的含有含氟亚甲基的化合物的制造方法。
[0028]
本发明的目的在于提供新的含有含氟亚甲基的化合物的制造方法等。
[0029]
用于解决课题的技术方案
[0030]
本发明包括如下方案。
[0031]
项1.
[0032]
一种式(1)所示的化合物的制造方法,其包括:
[0033]
使式(2)所示的化合物在根据需要的还原剂的存在下且在光照射下与式(3)所示的化合物反应的工序a,
[0034]
式(1):
[0035][0036]
[式中,
[0037]
r1为有机基团,
[0038]
r
a
为氢原子或氟原子,
[0039]
r
4a
为氢原子或有机基团,
[0040]
r
4b
为氢原子或有机基团,
[0041]
r2为氢原子或有机基团,且
[0042]
r
5a
为氢原子或有机基团,
[0043]
r
5b
为氢原子或有机基团。
[0044]
或者,r2可以与r
4a
连结而形成环。]
[0045]
式(2):
[0046][0047]
[式中,x1为消去基团,且其它符号与上述意义相同。]
[0048]
式(3):
[0049][0050]
[式中,x2为消去基团,且其它符号与上述意义相同。]
[0051]
项2.
[0052]
如项1所述的制造方法,其中,
[0053]
r1为r
11
-y-或(r
11
-)2n-,
[0054]
y为价键、氧原子或硫原子,且
[0055]
r
11
在每次出现时独立地为可以具有1个以上的取代基的烃基。
[0056]
项3.
[0057]
如项2所述的制造方法,其中,
[0058]
r1为r
11
-y-,
[0059]
y为价键,且
[0060]
r
11
为可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基。
[0061]
项4.
[0062]
如项2所述的制造方法,其中,
[0063]
r1为r
11
-y-,
[0064]
y为-o-c(=o)-或-o-c(=s)-,且
[0065]
r
11
为可以具有1个以上的取代基的脂肪族烃基。
[0066]
项5.
[0067]
如项2所述的制造方法,其中,
[0068]
r1为(r
11
-)2n-c(=o)-,
[0069]
r
11
在每次出现时独立地为可以具有1个以上的取代基的脂肪族烃基。
[0070]
项6.
[0071]
如项1~5所述的制造方法,其中,
[0072]
r
a
为氟原子。
[0073]
项7.
[0074]
如项1~6所述的制造方法,其中,
[0075]
r
4a
为氢原子,
[0076]
r
4b
为氢原子,
[0077]
r2为氢原子、可以具有1个以上的取代基的烃基或可以具有1个以上的取代基的烷氧羰基,
[0078]
r
5a
为氢原子,且
[0079]
r
5b
为氢原子。
[0080]
项8.
[0081]
如项1~7所述的制造方法,其中,
[0082]
x1为卤原子、烷基磺酰氧基、或芳基磺酰氧基。
[0083]
项9.
[0084]
如项1~8所述的制造方法,其中,
[0085]
x2为-so2r、-sr、-s(=o)r、-ser、-ter、-cl、-br、-i、-pr2或-p(=o)r2。
[0086]
[这些式中,r在每次出现时独立地为有机基团。]
[0087]
项10.
[0088]
如项9所述的制造方法,其中,
[0089]
x2为-so2r(该式中,r为有机基团)。
[0090]
项11.
[0091]
如项1~10中任一项所述的制造方法,其中,
[0092]
上述还原剂为具有n-h部的含氮不饱和杂环化合物。
[0093]
项12.
[0094]
如项1~11中任一项所述的制造方法,其中,
[0095]
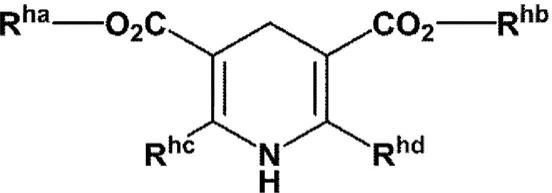
上述还原剂为式(4)所示的化合物:
[0096][0097]
[式中,
[0098]
r
ha
、r
hb
、r
hc
和r
hd
相同或不同,为烷基。]
[0099]
项13.
[0100]
如项1~12中任一项所述的制造方法,其中,
[0101]
工序a的反应在催化剂的存在下实施。
[0102]
项14.
[0103]
如项13所述的制造方法,其中,
[0104]
上述催化剂为选自过渡金属配位化合物和有机色素化合物中的1种以上。
[0105]
项15.
[0106]
一种式(1a)所示的化合物的制造方法,其包括:
[0107]
使式(2)所示的化合物在根据需要的还原剂的存在下且在光照射下与式(3)所示
的化合物反应的工序aa,
[0108]
式(1a):
[0109][0110]
[式中,
[0111]
r1在每次出现时独立地为有机基团,
[0112]
r
a
在每次出现时独立地为氢原子或氟原子,
[0113]
r
4a
在每次出现时独立地为氢原子或有机基团,
[0114]
r
4b
在每次出现时独立地为氢原子或有机基团,且
[0115]
r2为氢原子或有机基团。]
[0116]
式(2):
[0117][0118]
[式中,x1为消去基团,且其它符号与上述意义相同。]
[0119]
式(3):
[0120][0121]
[式中,x2为消去基团,且其它符号与上述意义相同。]
[0122]
项16.一种式(1)所示的化合物,
[0123]
式(1):
[0124][0125]
[式中,
[0126]
r1为有机基团,
[0127]
r
a
为氢原子或氟原子,
[0128]
r
4a
为氢原子或有机基团,
[0129]
r
4b
为氢原子或有机基团,
[0130]
r2为有机基团,
[0131]
r
5a
为氢原子或有机基团,且
[0132]
r
5b
为氢原子或有机基团
[0133]
(其中,在r1为全氟烷基的情况下,r2为碳原子数2以上的烷基或碳原子数3以上的酯基。)。]
[0134]
项17.
[0135]
如项16所述的化合物,其中,
[0136]
r1为r
11
-y-,
[0137]
y为价键,且
[0138]
r
11
为可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0139]
r
a
为氢原子或氟原子,且
[0140]
r2为氢原子或有机基团。
[0141]
项18.
[0142]
如项17所述的化合物,其中,
[0143]
r
a
为氟原子。
[0144]
项19.
[0145]
如项17或18所述的化合物,其中,
[0146]
r
4a
为氢原子,
[0147]
r
4b
为氢原子,
[0148]
r2为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0149]
r
5a
为氢原子,且
[0150]
r
5b
为氢原子。
[0151]
项20.
[0152]
如项16所述的化合物,其中,
[0153]
r1为r
11
-y-,
[0154]
y为-o-c(=o)-或-o-c(=s)-,
[0155]
r
11
为可以具有1个以上的取代基的脂肪族烃基,
[0156]
r
a
为氢原子或氟原子,且
[0157]
r2为氢原子或有机基团。
[0158]
项21.
[0159]
如项20所述的化合物,其中,
[0160]
r
a
为氟原子。
[0161]
项22.
[0162]
如项20或21所述的化合物,其中,
[0163]
r
4a
为氢原子,
[0164]
r
4b
为氢原子,
[0165]
r2为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0166]
r
5a
为氢原子,且
[0167]
r
5b
为氢原子。
[0168]
项23.
[0169]
如项16所述的化合物,其中,
[0170]
r1为r
11
-y-,
[0171]
y为-o-c(=o)-或-o-c(=s)-,
[0172]
r
11
为可以具有1个以上的取代基的脂肪族烃基,
[0173]
r
a
为氢原子或氟原子,且
[0174]
r2为氢原子或有机基团。
[0175]
项24.
[0176]
如项16所述的化合物,其中,
[0177]
r1为(r
11
-)2n-c(=o)-,
[0178]
r
11
在每次出现时独立地为可以具有1个以上的取代基的脂肪族烃基,
[0179]
r
a
为氢原子或氟原子,
[0180]
r
4a
为氢原子,
[0181]
r
4b
为氢原子,
[0182]
r2为氢原子或有机基团,
[0183]
r
5a
为氢原子,且
[0184]
r
5b
为氢原子或有机基团。
[0185]
项25.
[0186]
如项24所述的化合物,其中,
[0187]
r
a
为氟原子。
[0188]
发明的效果
[0189]
根据本发明,提供具有氟代亚甲基的化合物的高效的新的制造方法。
具体实施方式
[0190]
术语
[0191]
本说明书中的符号和缩写只要没有特别限定,就能够根据本说明书的上下文,以本发明所属的技术领域中通常使用的意思来理解。
[0192]
本说明书中,语句“含有”是以包括语句“本质上由
……
构成”和语句“由
……
构成”的意思来使用。
[0193]
只要没有特别限定,本说明书中记载的工序、处理或操作能够在室温实施。
[0194]
本说明书中,室温是指10~40℃的范围内的温度。
[0195]
本说明书中,“c
n-m”(其中,n和m分别为自然数。)如有机化学领域所惯用的那样,表示碳原子数为n以上且m以下。
[0196]
本说明书中,“氟代亚甲基”只要没有特别限定,包括单氟亚甲基和二氟亚甲基。
[0197]
本说明书中,只要没有特别限定,作为“卤原子”,例如可以例示氟原子、氯原子、溴
原子和碘原子。
[0198]
本说明书中,只要没有特别限定,“有机基团”是指含有1个以上的碳原子作为其构成原子的基团。
[0199]
本说明书中,只要没有特别限定,作为“有机基团”,可以例示烃基、氰基、羧基、烷氧基、酯基、醚基和酰基。
[0200]
本说明书中,只要没有特别限定,“烃基”是指含有1个以上的碳原子和1个以上的氢原子作为其构成原子的基团。
[0201]
本说明书中,只要没有特别限定,作为“烃基”,可以例示脂肪族烃基、芳香族烃基(芳基)以及它们的组合等。
[0202]
本说明书中,只要没有特别限定,“脂肪族烃基”能够为直链状、支链状、环状、或它们的组合。
[0203]
本说明书中,只要没有特别限定,“脂肪族烃基”能够为饱和或不饱和。
[0204]
本说明书中,只要没有特别限定,作为“脂肪族烃基”,例如可以例示烷基、烯基、炔基和环烷基。
[0205]
本说明书中,只要没有特别限定,作为“烷基”,例如可以例示甲基、乙基、丙基(例:正丙基、异丙基)、丁基(例:正丁基、异丁基、仲丁基、叔丁基)、戊基(例:正戊基、叔戊基、新戊基、异戊基、仲戊基、3-戊基)、己基、庚基、辛基、壬基和癸基等直链状或支链状且为伯、仲或叔的c
1-15
烷基(例:c
1-12
烷基、c
1-10
烷基)。
[0206]
本说明书中,“氟烷基”是至少1个氢原子被氟原子取代的烷基。
[0207]
本说明书中,“氟烷基”所具有的氟原子的数量可以为1个以上(例如1~3个、1~6个、1~12个、1个至能够取代的最大数)。
[0208]“氟烷基”包括全氟烷基。“全氟烷基”是全部氢原子都被氟原子取代的烷基。
[0209]
本说明书中,只要没有特别限定,作为“烯基”,例如可以例示乙烯基、1-丙烯基、异丙烯基、2-甲基-1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-乙基-1-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、4-甲基-3-戊烯基、1-己烯基、2-己烯基、3-己烯基、4-己烯基和5-己烯基等直链状或支链状的碳原子数1~10的烯基。
[0210]
本说明书中,只要没有特别限定,作为“炔基”,例如可以例示乙炔基、1-丙炔基、2-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、4-戊炔基、1-己炔基、2-己炔基、3-己炔基、4-己炔基和5-己炔基等直链状或支链状的碳原子数2~6的炔基。
[0211]
本说明书中,只要没有特别限定,作为“环烷基”,例如可以例示环戊基、环己基和环庚基等碳原子数3~10(优选碳原子数4~10)的环烷基。
[0212]
本说明书中,只要没有特别限定,“烷氧基”例如为ro-(该式中,r为烷基。)所示的基团。
[0213]
本说明书中,只要没有特别限定,“酯基”例如为rco2-(该式中,r为烷基。)所示的基团。
[0214]
本说明书中,只要没有特别限定,“醚基”是指具有醚键(-o-)的基团,包括聚醚基。聚醚基包括式:r
a
-(o-r
b
)n-(该式中,r
a
为烷基,r
b
在每次出现时相同或不同,为亚烷基,且n为1以上的整数。)所示的基团。亚烷基为从上述烷基去除1个氢原子所形成的2价基
团。
[0215]
本说明书中,只要没有特别限定,“酰基”包括烷酰基。本说明书中,只要没有特别限定,“烷酰基”例如为rco-(该式中,r为烷基。)所示的基团。
[0216]
本说明书中,只要没有特别限定,“芳香族基”包括芳基和杂芳基。
[0217]
本说明书中,“芳基”的例子包括苯基和萘基等c
6-14
芳基(例:c
6-10
芳基)。
[0218]
本说明书中,“杂芳基”的例子包括除了碳原子以外还包含选自氮原子、硫原子和氧原子中的1~4个杂原子作为环构成原子的5~14元(单环、2环或3环式)杂环基。
[0219]
本说明书中,“杂芳基”的具体例包括:
[0220]
(1)呋喃基、噻吩基、吡啶基、嘧啶基、哒嗪基、吡嗪基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、噁二唑基、噻二唑基、三唑基、四唑基、三嗪基等单环式芳香族杂环基;以及
[0221]
(2)喹啉基、异喹啉基、喹唑啉基、喹喔啉基、苯并呋喃基、苯并噻吩基、苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并咪唑基、苯并三唑基、吲哚基、吲唑基、吡咯并吡嗪基、咪唑并吡啶基、咪唑并吡嗪基、咪唑并噻唑基吡唑并吡啶基、吡唑并噻吩基、吡唑并三嗪基等多环式(例如二环式)芳香族杂环基。
[0222]
本说明书中,“芳香环”的例子包括:
[0223]
(1)苯环和萘环等的芳香族碳环;以及
[0224]
(2)呋喃环、噻吩环、吡咯环、噁唑环、异噁唑环、噻唑环、异噻唑环、咪唑环、吡唑环、1,2,3-噁二唑环、1,2,4-噁二唑环、1,3,4-噁二唑环、呋咱环、1,2,3-噻二唑环、1,2,4-噻二唑环、1,3,4-噻二唑环、1,2,3-三唑环、1,2,4-三唑环、四唑环、吡啶环、哒嗪环、嘧啶环、吡嗪环、三嗪环等除了碳原子以外还含有1~3个选自氧原子、硫原子和氮原子中的杂原子作为环构成原子的5或6元的单环式芳香族杂环。
[0225]
本说明书中,“非芳香族烃环”的例子包括碳原子数3~8的非芳香族烃环,其具体例能够包括:
[0226]
(1)环丙烷、环丁烷、环戊烷、环己烷、环庚烷和环辛烷的c
3-8
环烷烃;
[0227]
(2)环戊烯、环己烯、环庚烯和环辛烯的c
5-8
环烯烃;
[0228]
(3)环戊二烯、环己二烯、环庚二烯、环辛二烯等c
5-8
环二烯烃;以及
[0229]
(4)双环[2.1.0]戊烷、双环[2.2.1]庚烷、双环[3.2.1]辛烷、双环[2.2.1]庚-2-烯以及三环[2.2.1.0]庚烷等碳原子数5~8的桥环烃。
[0230]
本说明书中,“非芳香族杂环”的例子包括3~8元的非芳香族杂环等,其具体例包括:环氧乙烷、氮杂环丁烷、氧杂环丁烷、硫杂环丁烷、吡咯烷、二氢呋喃、四氢呋喃、四氢噻吩、咪唑啉、噁唑啉、异噁唑啉、哌啶、二氢吡喃、四氢吡喃、四氢噻喃、吗啉、硫代吗啉、哌嗪、二氢噁嗪、四氢噁嗪、二氢嘧啶、四氢嘧啶、氮杂环庚烷、氧杂环庚烷、硫杂环庚烷、氧氮杂环庚烷、硫氮杂环庚烷、氮杂环辛烷、氧杂环辛烷、硫杂环辛烷、氧氮杂环辛烷和硫氮杂环辛烷。
[0231]
制造方法[化合物(1)]
[0232]
本发明的式(1)所示的化合物[本说明书中,有时称为化合物(1)。]的制造方法包括使式(2)所示的化合物在根据需要的还原剂的存在下且在光照射下与式(3)所示的化合物反应的工序a。
[0233]
式(1):
[0234][0235]
[式中,
[0236]
r1为有机基团,
[0237]
r
a
为氢原子或氟原子,
[0238]
r
4a
为氢原子或有机基团,
[0239]
r
4b
为氢原子或有机基团,
[0240]
r
5a
为氢原子或有机基团,
[0241]
r
5b
为氢原子或有机基团,且
[0242]
r2为氢原子或有机基团。
[0243]
或者,r2可以与r
4a
连结而形成环。]
[0244]
式(2):
[0245][0246]
[式中,x1为消去基团,且其它符号与上述意义相同。]
[0247]
式(3):
[0248][0249]
[式中,x2为消去基团,且其它符号与上述意义相同。]
[0250]
在本发明的优选的一个方式中,
[0251]
r1为r
11
-y-或(r
11
-)2n-,
[0252]
y为价键、氧原子或硫原子,且
[0253]
r
11
在每次出现时独立地为可以具有1个以上的取代基的烃基。
[0254]
在本发明的更优选的一个方式中,
[0255]
r1为r
11
-y-,
[0256]
y为价键,且
[0257]
r
11
为可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基。
[0258]
r
11
优选为芳基或全氟烷基。
[0259]
在本发明的更优选的另一个方式中,
[0260]
r1为r
11
-y-,
[0261]
y为-o-c(=o)-或-o-c(=s)-,且
[0262]
r
11
为可以具有1个以上的取代基的脂肪族烃基。
[0263]
r
11
优选为c
1-6
烷基或c
7-11
芳烷基(例:苄基)。
[0264]
在本发明的更优选的又一个方式中,
[0265]
r1为(r
11
-)2n-c(=o)-,
[0266]
r
11
在每次出现时独立地为可以具有1个以上的取代基的脂肪族烃基。
[0267]
r
11
优选在每次出现时独立地为c
1-6
烷基。
[0268]
r
a
优选为氟原子。
[0269]
r2与r
4a
连结而形成的“环”的例子包含芳香环、非芳香族烃环和非芳香族杂环。
[0270]
该环的取代基的例子包含卤原子、硝基、氰基、氨基、羟基、羧基、烷基、烯基和炔基。
[0271]
r2优选为氢原子、可以具有1个以上的取代基的烃基或可以具有1个以上的取代基的烷氧羰基。
[0272]
r2更优选为氢原子、可以具有1个以上的取代基的c
1-6
烷基、可以具有1个以上的取代基的c
6-14
芳基或可以具有1个以上的取代基的c
1-6
烷氧基-羰基。
[0273]
r
4a
优选为氢原子。
[0274]
r
4b
优选为氢原子。
[0275]
r
5a
优选为氢原子。
[0276]
r
5b
优选为氢原子。
[0277]
优选r2为氢原子、可以具有1个以上的取代基的烃基或可以具有1个以上的取代基的烷氧羰基,
[0278]
r
4a
为氢原子,
[0279]
r
4b
为氢原子,
[0280]
r
5a
为氢原子,且
[0281]
r
5b
为氢原子。
[0282]
x1所示的消去基团的例子包含:
[0283]
卤原子(例:氟原子、氯原子、溴原子和碘原子)、烷基磺酰氧基(例:甲磺酰氧基、三氟甲磺酰氧基等c
1-6
烷基磺酰氧基)、以及
[0284]
芳基磺酰氧基(例:苯磺酰氧基、对甲苯磺酰氧基等c
6-10
芳基磺酰氧基)。
[0285]
x1优选为卤原子、烷基磺酰氧基或芳基磺酰氧基。
[0286]
x2优选为-so2r、-sr、-s(=o)r、-ser、-ter、-cl、-br、-i、-pr2或-p(=o)r2[0287]
[这些式子中,r在每次出现时独立地为有机基团。]。
[0288]
x2更优选为-so2r(该式中,r为有机基团。)。
[0289]
工序a中的化合物(3)的使用量相对于化合物(2)的1摩尔优选在1.0~20.0摩尔的范围内,更优选在1.3~10摩尔的范围内,并且更加优选在1.5~5摩尔的范围内。
[0290]
工序a的反应根据需要优选在还原剂的存在下实施。
[0291]
上述还原剂能够为无机或有机的还原剂,其例子包含氢、甲酸、甲酸铵、甲酸钠、甲
酸三乙胺、三乙基硅烷、四甲基二硅氧烷、聚甲基氢硅氧烷、nabh3cn、nhcbh3(n-杂环卡宾硼烷,n-heterocyclic carbene boranes)以及具有n-h部(亚氨基)的含氮不饱和杂环化合物。
[0292]
上述还原剂的优选例包含具有n-h部的含氮不饱和杂环化合物。
[0293]
作为上述还原剂的上述“具有n-h部的含氮不饱和杂环化合物”的优选例包含式(4)所示的化合物[本说明书中,有时称为化合物(4)。]:
[0294][0295]
[式中,
[0296]
r
3a
、r
3b
、r
3c
和r
3d
相同或不同,表示烷基。]。
[0297]
r
3a
优选为c
1-6
烷基,更优选为甲基或乙基。
[0298]
r
3b
优选为c
1-6
烷基,更优选为甲基或乙基。
[0299]
r
3c
优选为c
1-6
烷基,更优选为甲基或乙基。
[0300]
r
3d
优选为c
1-6
烷基,更优选为甲基或乙基。
[0301]
本发明中能够使用的上述还原剂的更优选的例子包含如下的化学式的化合物。这些化合物为所谓的汉奇酯(hantzsch酯)(本说明书中,有时简记为heh。)。
[0302][0303]
这些还原剂可以单独使用1种,也可以组合使用2种以上。
[0304]
在工序a的反应中,能够根据需要使用胺等除酸剂。
[0305]
其中,在使用化合物(4)的情况,能够优选不使用其它的胺。
[0306]
在工序a中使用还原剂的情况下,其量相对于作为底物的上述式(2)所示的化合物的1摩尔,优选在0.5~10摩尔的范围内,更优选在1.0~5.0摩尔的范围内,且更加优选在1.2~3.0摩尔的范围内。
[0307]
工序a的反应能够在催化剂的存在下、或者实质上或完全不存在下实施。
[0308]
工序a的反应优选为在催化剂的存在下实施。
[0309]
本发明中能够使用的上述催化剂的例子包含过渡金属配位化合物和有机色素化合物。
[0310]
本发明中能够使用的上述过渡金属配位化合物所具有的中心金属种的例子包含钴、钌、铑、铼、铱、镍、钯、锇和铂。
[0311]
该中心金属种的优选例包含钌、铱和钯。
[0312]
本发明中能够使用的上述过渡金属配位化合物所具有的配位体的例子包含含氮化合物、含氧化合物和含硫化合物。
[0313]
作为配位体的该“含氮化合物”的例子包含二胺化合物(例:乙二胺)、和含氮杂环
化合物(例:吡啶、联吡啶、邻二氮菲、吡咯、吲哚、咔唑、咪唑、吡唑、喹啉、异喹啉、吖啶、哒嗪、嘧啶、吡嗪、酞嗪、喹唑啉和喹喔啉)。
[0314]
作为配位体的该“含氧化合物”的例子包含二酮(例:二新戊酰基甲烷)和含氧杂环化合物(例:呋喃、苯并呋喃、噁唑、吡喃、吡喃酮、香豆酮以及苯并吡喃酮)。
[0315]
作为配位体的该“含硫化合物”的例子包含含硫杂环化合物(例如:噻吩、硫茚和噻唑)。
[0316]
在上述过渡金属配位化合物中,这些配位体的数量可以为1个以上。但当然其数量并不一定要清楚。
[0317]
在工序a的反应中使用催化剂的情况下,工序a中的催化剂的使用量相对于化合物(2)的1摩尔优选在0.0001~0.1摩尔的范围内,更优选在0.001~0.05摩尔的范围内,且更加优选在0.005~0.02摩尔的范围内。
[0318]
本发明中能够使用的上述有机色素化合物能够为在分子内不含金属原子的化合物。
[0319]
该有机色素化合物的例子包含孟加拉玫瑰红、赤藓红、伊红(例:伊红b、伊红y)、吖啶黄、核黄素和硫堇。
[0320]
该催化剂的优选例包含[ir{df(cf3)ppy}2(dtbpy)]pf6、[ir(dtbbpy)(ppy)2][pf6]、ir(ppy)3、ru(bpy)3cl2·
6h2o、[ru(bpz)3][pf6]2、[ru(bpm)3][cl]2、[ru(bpy)2(phen-5-nh2)][pf6]2、[ru(bpy)3][pf6]2、ru(phen)3cl2、cu(dap)2氯化物、9-均三甲苯基-10-甲基吖啶高氯酸盐、ir(ppy)3和pd(pph 3
)4。
[0321]
这些催化剂可以单独使用1种,也可以组合使用2种以上。
[0322]
工序a中使用的催化剂优选能够为光氧化还原(photoredox)催化剂。
[0323]
工序a中使用的催化剂可以被载持于载体(例:沸石)。
[0324]
工序a的反应能够在溶剂的存在下或者实质上或完全不存在下实施。
[0325]
工序a的反应优选在溶剂的存在下实施。
[0326]
本发明中能够使用的上述溶剂的例子包含二甲基甲酰胺(dmf)、甲苯、ch3cn、醚、四氢呋喃(thf)、苯、二甲基亚砜(dmso)、己烷和三氟甲苯(btf)。
[0327]
这些溶剂可以单独使用1种,也可以组合使用2种以上。
[0328]
在工序a的反应的开始时,其反应体系的混合物中的化合物(2)的浓度优选在1~10000mm的范围内,更优选在10~1000mm的范围内,且更加优选在50~200mm的范围内。
[0329]
在工序a的反应的开始时,其反应体系的混合物中的化合物(3)的浓度优选在50~50000mm的范围内,更优选在100~5000mm的范围内,且更加优选在300~1000mm的范围内。
[0330]
在工序a的反应中使用催化剂的情况下,其反应体系的混合物中的催化剂的浓度优选在0.01~100mm的范围内,更优选在0.1~50mm的范围内,且更加优选在0.5~20mm的范围内。
[0331]
工序a例如能够通过将化合物(2)、化合物(3)、根据要求的还原剂、根据要求的催化剂和根据要求的溶剂混合来实施。
[0332]
作为该混合的方法,能够采用惯用的方法。
[0333]
该混合可以将全部物质同时混合,或者可以逐次或阶段性地混合。
[0334]
工序a的反应在光照射下实施。
[0335]
作为该光照射中使用的照射光,例如只要是能够引发和/或促进工序a的反应的光就能够没有特别限定使用。其光源的例子可以列举低压、中压或高压的水银灯、钨灯和发光二极管(led)。
[0336]
照射光能够优选为可见光。
[0337]
照射光能够优选为包含300~600nm的波长的光的光,更优选包含400~500nm的光的光。
[0338]
照射时间能够优选在1~24小时的范围内,更优选在10~18小时。
[0339]
光照射的开始能够在上述混合之前、途中、同时或之后。
[0340]
光照射的强度只要为供给能够引发和/或促进工序a的反应的能量的程度即可,这例如能够根据技术常识,通过调整光源的输出和光源与工序a的反应体系的距离等来适当调整,以使工序a的反应适当进行。
[0341]
工序a的反应可以在不活泼气体的存在下实施。这样的不活泼气体的例子包含氮和氩。
[0342]
工序a的反应温度优选在0~120℃的范围内,更优选在10~80℃的范围内,更加优选在20~60℃的范围内。
[0343]
通过设为该范围内的条件,工序a的反应充分进行。
[0344]
通过设为该范围内的条件,在成本上有利,且可以抑制不希望的副反应。
[0345]
工序a的反应时间优选在1~24小时的范围内,更优选在5~18小时的范围内,更加优选在10~15小时的范围内。
[0346]
通过设为该范围内的条件,工序a的反应充分进行。
[0347]
通过设为该范围内的条件,在成本上有利,且可以抑制不希望的副反应。
[0348]
工序a的反应优选能够通过批式或流动体系实施。
[0349]
根据需要,通过本发明的制造方法得到的化合物(1)能够通过溶剂提取、干燥、过滤、蒸馏、浓缩以及它们的组合等的公知的纯化方法来纯化。
[0350]
根据本发明的制造方法,作为原料的化合物(2)的转化率能够优选为40%以上,更优选为60%以上,更加优选为80%以上。
[0351]
根据本发明的制造方法,化合物(1)的选择率能够优选为70%以上,更优选为80%以上。
[0352]
根据本发明的制造方法,化合物(1)的收率能够优选为40%以上,更优选为60%以上。
[0353]
由本发明的制造方法得到的化合物(1)例如能够用于医药品中间体等的用途。
[0354]
制造方法[化合物(1a)]
[0355]
本说明书还公开了式(1a)所示的化合物的制造方法,包括:
[0356]
使式(2)所示的化合物在根据需要的还原剂的存在下且在光照射下与式(3)所示的化合物反应的工序aa,
[0357]
式(1a):
[0358][0359]
[式中,
[0360]
r1在每次出现时独立地为有机基团,
[0361]
r
a
在每次出现时独立地为氢原子或氟原子,
[0362]
r
4a
在每次出现时独立地为氢原子或有机基团,
[0363]
r
4b
在每次出现时独立地为氢原子或有机基团,且
[0364]
r2为氢原子或有机基团。]
[0365]
式(2):
[0366][0367]
[式中,x1为消去基团,且其它符号与上述意义相同。]
[0368]
式(3):
[0369][0370]
[式中,x2为消去基团,且其它符号与上述意义相同。]。
[0371]
该工序aa除了产物不同以外,能够与上述工序a相同。
[0372]
换言之,在工序a(或工序aa)的反应的底物和条件下,能够生成化合物(1)和/或化合物(1a)。
[0373]
因此,该工序aa可以根据上述工序a的说明来理解。
[0374]
其中,为了使化合物(aa)更优先地生成,优选使化合物(3)的量相对于化合物(2)的量较小。
[0375]
该情况下,具体而言,化合物(3)/化合物(2)的摩尔比能够优选在0.9~0.1的范围内,且更优选在0.5~0.2的范围内。
[0376]
另一方面,为了使化合物(a)更加优先地生成,优选使化合物(3)的量相对于化合物(2)的量较大。
[0377]
该情况下,具体而言,化合物(3)/化合物(2)的摩尔比能够优选在1.1~10的范围内,且更优选在2~5的范围内。
[0378]
化合物(1)
[0379]
本说明书还公开以下的化合物[有时将该化合物称为化合物(1)。]。
[0380]
式(1)所示的化合物:
[0381][0382]
[式中,
[0383]
r1为有机基团,
[0384]
r
a
为氢原子或氟原子,
[0385]
r
4a
为氢原子或有机基团,
[0386]
r
4b
为氢原子或有机基团,
[0387]
r2为有机基团,
[0388]
r
5a
为氢原子或有机基团,且
[0389]
r
5b
为氢原子或有机基团,
[0390]
(其中,
[0391]
在r1为全氟烷基的情况下,r2为碳原子数2以上的烷基或碳原子数3以上的酯基。)。]
[0392]
方式1a1
[0393]
在该化合物(1)中,优选
[0394]
r1为r
11
-y-,
[0395]
y为价键,且
[0396]
r
11
为可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0397]
r
a
为氢原子或氟原子,且
[0398]
r2为氢原子或有机基团。
[0399]
r
11
优选为芳基或全氟烷基。
[0400]
r
11
更优选为c
6-10
芳基或c
1-10
全氟烷基。
[0401]
r
a
优选为氟原子。
[0402]
r2优选为氢原子、可以具有1个以上的取代基的烃基或可以具有1个以上的取代基的烷氧羰基。
[0403]
r2更加优选为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基。
[0404]
r2更加优选为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基。
[0405]
r2更加优选为氢原子、可以具有1个以上的取代基的c
1-6
烷基、可以具有1个以上的取代基的c
6-14
芳基或可以具有1个以上的取代基的c
1-6
烷氧基-羰基。
[0406]
r2更进一步优选为氢原子、c
1-6
烷基、c
6-14
芳基或c
1-6
烷氧基-羰基。
[0407]
r
4a
优选为氢原子。
[0408]
r
4b
优选为氢原子。
[0409]
r
5a
优选为氢原子。
[0410]
r
5b
优选为氢原子。
[0411]
优选:
[0412]
r
4a
为氢原子或有机基团,
[0413]
r
4b
为氢原子或有机基团,
[0414]
r2为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0415]
r
5a
为氢原子,且
[0416]
r
5b
为氢原子。
[0417]
方式1a2
[0418]
在该化合物(1)中,还优选:
[0419]
r1为r
11
-y-,
[0420]
y为-o-c(=o)-或-o-c(=s)-,
[0421]
r
11
为可以具有1个以上的取代基的脂肪族烃基,
[0422]
r
a
为氢原子或氟原子,且
[0423]
r2为氢原子或有机基团。
[0424]
优选r
a
为氟原子。
[0425]
优选r2为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基。
[0426]
优选r2为氢原子、可以具有1个以上的取代基的c
1-6
烷氧羰基、可以具有1个以上的取代基的c
6-14
芳基或可以具有1个以上的取代基的c
1-6
烷基。
[0427]
r
4a
优选为氢原子。
[0428]
r
4b
优选为氢原子。
[0429]
r
5a
优选为氢原子。
[0430]
r
5b
优选为氢原子。
[0431]
优选:
[0432]
r
4a
为氢原子,
[0433]
r
4b
为氢原子,
[0434]
r2为氢原子、可以具有1个以上的取代基的烷氧羰基、可以具有1个以上的取代基的芳基或可以具有1个以上的取代基的烷基,
[0435]
r
5a
为氢原子,且
[0436]
r
5b
为氢原子。
[0437]
方式1a3
[0438]
在该化合物(1)中,还优选:
[0439]
r1为r
11
-y-,
[0440]
y为-o-c(=o)-或-o-c(=s)-,
[0441]
r
11
为可以具有1个以上的取代基的脂肪族烃基,
[0442]
r
a
为氢原子或氟原子,且
[0443]
r2为氢原子或有机基团。
[0444]
方式1a4
[0445]
在该化合物(1)中,还优选:
[0446]
r1为(r
11
-)2n-c(=o)-,
[0447]
r
11
在每次出现时独立地为可以具有1个以上的取代基的脂肪族烃基,
[0448]
r
a
为氢原子或氟原子,且
[0449]
r2为氢原子或有机基团。
[0450]
r
11
优选为在每次出现时独立地为c
1-6
烷基。
[0451]
r
a
优选为氟原子。
[0452]
制造方法[化合物(1b)的制造方法]
[0453]
本说明书还公开式(1b)所示的化合物(本说明书中,有时将该化合物称为化合物(1b)。)的制造方法,包括:使式(2)所示的化合物在还原剂的存在下且在光照射下与式(3)所示的化合物和式(4)所示的化合物反应的工序a
b
,
[0454][0455]
[式中,
[0456]
r1为有机基团,
[0457]
r
a
为氢原子或氟原子,
[0458]
r
b1
为氢原子或有机基团,
[0459]
r
b2
为氢原子或有机基团,且
[0460]
r2为氢原子或有机基团。]
[0461]
式(2):
[0462][0463]
[式中,x1为消去基团,且其它符号与上述意义相同。]
[0464]
式(3):
[0465][0466]
[式中,x2为消去基团,且其它符号与上述意义相同。]
[0467]
式(4):
[0468][0469]
[式中的符号与上述意义相同。]。
[0470]
工序a
b
中的化合物(4)的使用量相对于化合物(2)的1摩尔优选在3~20摩尔的范围内,更优选在4~15摩尔的范围内,且更加优选在5~12摩尔的范围内。
[0471]
工序a
b
的其它条件和方法可以与上述工序a的条件和方法相同。具体而言,如下所述。
[0472]
工序a
b
的反应可以在光照射下实施。
[0473]
作为该光照射所使用的照射光,例如只要是能够引发和/或促进工序a的反应的光就能够没有特别限定使用。其光源的例子可以列举低压、中压或高压的水银灯、钨灯和发光二极管(led)。
[0474]
照射光能够优选为可见光。
[0475]
照射光能够优选为包含300~600nm的波长的光的光,更优选为包含400~500nm的光的光。
[0476]
照射时间能够优选在1~24小时的范围内,更优选在10~18小时。
[0477]
光照射的开始能够在上述混合之前、途中、同时或之后。
[0478]
光照射的强度只要是供给能够引发和/或促进工序a
b
的反应的能量的程度即可,这例如能够根据技术常识,通过调整光源的输出和光源与工序a
b
的反应体系的距离等来适当调整,以使工序a
b
的反应适当进行。
[0479]
工序a
b
的反应可以在不活泼气体的存在下实施。这样的不活泼气体的例子包含氮和氩。
[0480]
工序a
b
的反应温度能够优选在0~120℃的范围内,更优选在10~80℃的范围内,更加优选在20~60℃的范围内。
[0481]
通过设为该范围内的条件,工序a
b
的反应充分进行。
[0482]
通过设为该范围内的条件,在成本上有利,且可以抑制不希望的副反应。
[0483]
工序a
b
的反应时间能够优选在1~24小时的范围内,更优选在5~18小时的范围内,更加优选在10~15小时的范围内。
[0484]
通过设为该范围内的条件,工序a
b
的反应充分进行。
[0485]
通过设为该范围内的条件,在成本上有利,且可以抑制不希望的副反应。
[0486]
工序a
b
的反应优选能够通过批式或流动体系来实施。
[0487]
根据需要,通过本发明的制造方法得到的化合物(1b)能够通过溶剂提取、干燥、过滤、蒸馏、浓缩以及它们的组合等的公知的纯化方法来纯化。
[0488]
根据本发明的制造方法,作为原料的化合物(2)的转化率能够优选为40%以上,更优选为60%以上,更加优选为80%以上。
[0489]
根据本发明的制造方法,化合物(1b)的选择率能够优选为70%以上,更优选为80%以上。
[0490]
根据本发明的制造方法,化合物(1b)的收率能够优选为40%以上,更优选为60%
以上。
[0491]
由本发明的制造方法得到的化合物(1b)例如能够用于医药品中间体等的用途。
[0492]
实施例
[0493]
以下,通过实施例对本发明进行更详细的说明,但本发明不限定于这些实施例。
[0494]
本说明书中,有时使用以下的缩写。
[0495]
heh:汉奇酯(hantzsch酯)
[0496]
ttmss:三(三甲基甲硅烷基)硅烷
[0497]
diea:n,n-二异丙基乙基胺
[0498]
bpy:2,2
′
-联吡啶
[0499]
在以下的实施例中,没有特别说明的情况下,收率为分离收率。
[0500]
实施例1(在各种条件下的化合物3a和化合物4a的制造)
[0501]
在表1所记载的材料和条件下,在玻璃管中,在催化剂(1mol%)的存在下,对于化合物1a(0.5mmol)、化合物2a(1.5当量、或3.0当量)、汉奇酯a(heh)和胺(2当量)的溶液(溶剂3ml),使用白色led灯(5w),进行12小时光照射。
[0502]
其结果,化合物3a和/或化合物4a可以以表1所记载的nmr收率获得。
[0503][0504]
[表1]
[0505][0506]
实施例2(利用ru-光还原催化剂的二氟卤代烷基化合物和烯丙基砜化合物的烯丙基化合物的制造)
[0507]
在表2所记载的材料和条件下,在玻璃管中,对各化合物1以及各化合物2、ru(bpy)3cl2·
6h2o(1mol%)、汉奇酯a(heh)和et3n的dmf溶液,使用白色led灯(5w),进行2小时光照射。
[0508]
其结果,各化合物3以表2所记载的收率(表中,符号c表示nmr收率。)得到。
[0509]
[表2]
[0510]
[0511]
实施例3(光照射的效果的验证)
[0512][0513]
上述方案的条件的反应中,为了验证光照射的效果,实施了本方案的光照射的开关。
[0514]
通过10分钟光照射,以收率49%形成产物3a。
[0515]
如果关闭光源停止光照射,则反应迅速停止。
[0516]
其26小时后,打开光源再次开始光照射,则反应迅速再次开始。
[0517]
实施例4
[0518]
方案t
[0519][0520]
除了上述的实施例的化合物1和2以外,在本实施例中,进一步添加烯烃(1-辛烯5a),由此以上述方案t的条件对3成分自由基反应进行了试验。
[0521]
通过2-溴-2,2-二氟乙酸乙酯1b、1-辛烯5a和2-甲氧基羰基取代烯丙基砜2a的反应,以收率50%得到来自3成分的产物6a。
[0522]
通过全氟溴癸烷1e、1-辛烯5a和2-苯基烯丙基砜2a的3成分的反应,以收率56%得到化合物6b。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1