改进多核苷酸簇克隆性优先性的方法与流程
改进多核苷酸簇克隆性优先性的方法
1.优先权
2.本申请要求于2018年12月19日提交的美国临时申请第62/782,279号的优先权,其内容通过引用整体并入本文。
技术领域
3.本公开特别涉及利用靶核酸的排除扩增来产生扩增子测序簇;更具体涉及增加单克隆簇的数目。
背景技术:
4.下一代测序(ngs)技术的改进极大地提高了测序速度和数据输出,导致当前测序平台的样品通量巨大。大约10年前,illumina基因组分析仪每次运行能够生成多达1千兆字节的序列数据。如今,illumina novaseq
tm
系列系统能够在两天内生成多达2兆兆字节的数据,这代表容量(capacity)增加了2000倍以上。
5.实现这种增加容量的一方面是簇生成。簇生成可包括文库的产生,其中文库的成员包括在每个末端存在的通用序列。将文库加载到流动池中,并在与通用序列互补的表面结合寡聚物丛上捕获文库的个别成员。然后,通过桥式扩增将各个成员扩增成不同的克隆簇。簇生成完成后,个别簇可包含大约1000个拷贝的文库单一成员,并且该文库已准备好进行测序。
6.桥式扩增的一种方法是排除扩增(exclusion amplification,examp),又被称为动力学排除扩增。该方法是重组酶促进的扩增反应,其利用图案化阵列和等温条件来扩增文库,从而更快地扩增,并且使用较少的试剂在阵列的孔中生成克隆簇。已证明examp方法对于克隆簇生成是非常有用的;然而,导致更多的占用孔的条件也引起产生更多的多克隆孔。
技术实现要素:
7.下一代测序(ngs)技术依赖于从单一靶核酸产生的扩增子的单克隆群体的高度平行测序。测序扩增子的单克隆群体产生高得多的信噪比,增加的强度以及增加的通过过滤器的簇的百分比,所有这些都有助于提高数据输出和数据质量。
8.排除扩增方法允许在图案化流动池上的每个孔扩增单一靶核酸,并在孔中产生扩增子的单克隆群体。通常,相对于孔中慢得多的靶核酸转运和捕获速率,孔中第一捕获靶核酸的扩增速率更快。捕获在孔中的第一靶核酸可被快速扩增并填满整个孔,从而防止在同一孔中捕获其他靶核酸。或者,如果第二靶核酸在第一靶核酸之后附着于同一孔,则第一靶核酸的快速扩增通常填充足够的孔以产生通过过滤器的信号。排除扩增的使用还可以导致单克隆孔的超泊松(super
‑
poisson)分布,即阵列中单克隆孔的分数超过泊松分布预测的分数。
9.高度期望增加有用簇的超泊松分布,因为更多的单克隆孔导致更多的数据输出;
然而,靶核酸接种到孔中通常遵循空间泊松分布,其中较多占用孔的权衡是较多的多克隆孔。获得较高超泊松分布的一种方法是使接种迅速发生,然后是接种的靶核酸间的延迟。延迟(称为“动力学延迟”,因为它被认为是通过生化反应动力学产生的)使一种接种的靶核酸比其他接种的靶物更早地启动。
10.排除扩增如下起作用,即利用重组酶以当它发现序列匹配时促进引物(如附着于孔的引物)侵入双链dna(如靶核酸)中。为了最大化扩增效率,排除扩增的标准做法是利用侵入引物和衔接子序列之间的完全同一性。发明人已经确定了通过调节(tune)靶核酸衔接子与附着于孔的引物之间的同源性程度来将动力学延迟编码到接种的靶核酸的方式。通过降低侵入引物与衔接子序列之间的平均同源性,即使扩增的平均速率是降低的,孔的所谓单克隆性的速率有令人惊讶的改善。通常,随着引入更多的错配,扩增效率降低。出乎意料的是,当使用具有较高和较低扩增效率两者的衔接子序列的混合物时,混合物未与个别组分的性能平均值——介于高效率和低效率之间的中间——一样表现,而是在强度和通过过滤器的簇两者中均优于所有单一类型的衔接子序列。
11.定义
12.除非另有规定,否则本文中使用的术语应理解为具有相关领域中的普通含义。下面列出本文中使用的几个术语及其含义。
13.如本文所用,术语“扩增子”在用于指核酸时指对核酸复制的产物,其中产物具有与核酸的核苷酸序列的至少一部分相同或互补的核苷酸序列。扩增子可以通过使用核酸,例如靶核酸或其扩增子作为模板的多种扩增方法中的任一种来产生,所述方法包括例如聚合酶延伸、聚合酶链式反应(pcr)、滚环扩增(rca)、连接延伸或连接链式反应。扩增子可以是具有特定核苷酸序列的单拷贝(例如聚合酶延伸产物)或核苷酸序列的多个拷贝(例如rca的多联体(concatemeric)产物)的核酸分子。靶核酸的第一扩增子通常是互补拷贝。后续的扩增子是在产生第一扩增子后从靶核酸或从第一扩增子创建的拷贝。后续的扩增子可具有与靶核酸基本上互补或与靶核酸基本上相同的序列。
14.如本文所用,术语“扩增位点”是指阵列中或阵列上可产生一个或多个扩增子的位点。扩增位点可以进一步配置为含有、保持或附着在该位点处产生的至少一个扩增子。
15.如本文所用,术语“阵列”是指可以根据相对位置彼此区分的位点群体。可以根据阵列中位点的位置将位于阵列的不同位点处的不同分子彼此区分。阵列的单独位点可包括一个或多个特定类型的分子。例如,位点可以包括具有特定序列的单一靶核酸分子,或者位点可以包含具有相同序列(和/或其互补序列)的几个核酸分子。阵列的位点可以是位于同一基底上的不同特征。示例性特征包括但不限于,基底中的孔、基底中或基底上的珠(或其他颗粒)、从基底的突起、基底上的脊或基底中的通道。阵列的位点可以是各自带有不同分子的分开的底物。可以根据在与基底缔合的表面上基底位置或者根据液体或凝胶中基底的位置鉴定附着于分开的基底的不同分子。分开的基底位于表面上的示例性阵列包括但不限于在孔中具有珠的那些阵列。
16.如本文所用,术语“容量”当用于提及位点和核酸材料时指可以占据位点的最大量的核酸材料,例如源自靶核酸的扩增子。例如,该术语可以指在特定条件下可以占据该位点的核酸分子的总数。也可以使用其他测量,包括例如核酸材料的总质量或在特定条件下可占据该位点的特定核苷酸序列的拷贝总数。通常,靶核酸的位点的容量将基本上等同于靶
核酸的扩增子的位点的容量。
17.如本文所用,术语“捕获剂”是指能够附着、保留或结合靶分子(例如靶核酸)的材料、化学物质、分子或其部分。示例性捕获剂包括但不限于与经修饰的靶核酸的至少一部分互补的捕获核酸(例如通用捕获结合序列)、能够结合经修饰的靶核酸(或附着于它的连接部分)的受体
‑
配体结合对的成员(例如抗生物素蛋白、链霉抗生物素蛋白、生物素、凝集素、碳水化合物、核酸结合蛋白、表位、抗体等),或能够与经修饰的靶核酸(或附着于它的连接部分)形成共价键的化学试剂。在一个实施方案中,捕获剂是核酸。核酸捕获剂也可以用作扩增引物。
18.当提及核酸捕获剂时,可以使用术语“p5”和“p7”。术语“p5
’”
(p5 prime)和“p7
’”
(p7 prime)分别是指p5和p7的互补物。应当理解的是,任何合适的核酸捕获剂可用于本文提出的方法中,并且p5和p7的使用仅是示例性的实施方案。如wo 2007/010251、wo 2006/064199、wo 2005/065814、wo 2015/106941、wo 1998/044151和wo 2000/018957的公开示例,流动池上核酸捕获剂诸如p5和p7的使用是本领域中已知的。本领域技术人员将认识到,核酸捕获剂也可以发挥扩增引物的功能。例如,任何合适的核酸捕获剂都可以起正向扩增引物的作用,无论是固定化的还是在溶液中,并且可以用于本文提出的方法以与序列(例如,通用捕获结合序列)杂交和序列扩增。类似地,任何合适的核酸捕获剂都可以起反向扩增引物的作用,无论是固定化的还是溶液中,并且可以用于本文提出的方法以与序列杂交(例如,通用捕获结合序列)和扩增序列。鉴于可获得的常识和本公开的教导,本领域技术人员将理解如何设计和使用适合于捕获和扩增如本文所提出的靶核酸的序列。
19.如本文所用,术语“通用序列”是指两个或更多个靶核酸共有的序列区域,其中分子还具有彼此不同的序列区域。存在于分子集合的不同成员中的通用序列可以允许使用与通用序列(例如通用捕获结合序列)的一部分互补的捕获核酸群体来捕获多个不同的核酸。通用捕获结合序列的非限制性实例包括与p5和p7引物相同或互补的序列。本文详细描述的通用捕获结合序列的其他非限制性实例包括与p5和p7引物的同一性降低(例如,一个或多个错配)或互补性降低的序列,和/或具有小于p5和p7引物的长度的序列。类似地,存在于分子集合的不同成员中的通用序列可以允许使用与通用序列,例如通用引物结合位点的一部分互补的通用引物群体来复制或扩增多个不同的核酸。如本文所述,可以修饰靶核酸分子以在例如不同靶序列的一个或两个末端附着通用衔接子(在本文中也称为衔接子)。
20.如本文所用,术语“衔接子”及其衍生物,例如通用衔接子,通常是指可以与靶核酸连接的任何线性寡核苷酸。在一些实施方案中,衔接子基本上与样品中存在的任何靶序列的3’端或5’端非互补。在一些实施方案中,合适的衔接子长度在约10
‑
100个核苷酸、约12
‑
60个核苷酸和约15
‑
50个核苷酸的范围内。通常,衔接子可以包括核苷酸和/或核酸的任何组合。在一些方面,衔接子可在一个或多个位置处包含一个或多个可切割基团。在另一方面,衔接子可以包含与引物,例如捕获核酸的至少一部分基本上相同或基本上互补的序列。在一些实施方案中,衔接子可以包括条形码,也称为索引或标签,以辅助下游校正、鉴定或测序。术语“衔接头”和“衔接子”可互换使用。
21.如本文所定义,“样品”及其衍生物以其最广泛的含义使用,并且包括怀疑包括靶核酸的任何样品、培养物等。在一些实施方案中,样品包含dna、rna、pna、lna、核酸的嵌合或杂合形式。样品可以包括任何含有一种或多种核酸的基于生物、临床、外科、农业、大气或水
生的样品。该术语还包括任何分离的核酸样品,例如基因组dna、新鲜冷冻的或福尔马林固定的石蜡包埋的核酸样本。还涵盖的是样品可以来自单一个体、来自遗传相关成员的核酸样品的集合、来自遗传无关成员的核酸样品、来自单一个体的核酸样品(匹配),例如肿瘤样品和正常组织样品,或来自含有遗传材料的两种独特形式,诸如从母体受试者获得的母体和胎儿dna的单一来源的样品,或者在含有植物或动物dna的样品中污染性细菌dna的存在。在一些实施方案中,核酸材料的来源可以包括获自新生儿的核酸,例如通常用于新生儿筛查的核酸。
22.如本文所用,术语“克隆群体”指就特定核苷酸序列而言同质的核酸群体。同源序列通常长至少10个核苷酸,但是甚至可以更长,包括例如至少50、至少100、至少250、至少500或至少1000个核苷酸长。克隆群体可以源自单一靶核酸。通常,克隆群体中的所有核酸将具有相同的核苷酸序列。应当理解,在不脱离克隆性的情况下,少数突变(例如由于扩增伪像(artifacts))可以在克隆群体中发生。还应理解,在不脱离克隆性的情况下,少数不同的靶核酸(例如由于未扩增或以有限程度扩增的靶核酸)可以在克隆群体中发生。
23.如本文所用,术语“不同”在用于提及核酸时指核酸具有彼此不同的核苷酸序列。两个或更多个核酸可以具有沿其整个长度不同的核苷酸序列。或者,两个或更多个核酸可以具有沿着其长度的实质性部分不同的核苷酸序列。例如,两个或更多个核酸可以具有彼此不同的靶核苷酸序列部分,同时还具有彼此相同的通用序列区域。
24.如本文所用,术语“流体通路(fluidic access)”在用于指流体中的分子和与流体接触的位点时指分子在流体中或通过流体移动以接触或进入该位点的能力。该术语还可以指分子与位点分离或离开位点以进入溶液的能力。当没有障碍物时可以发生流体通路,所述障碍物阻止分子进入位点,接触位点,与位点分离和/或离开位点。然而,只要不绝对防止进入,即使扩散被延迟,减少或改变,也理解存在流体通路。
25.如本文所用,术语“双链”在用于指核酸分子时是指核酸分子中基本上所有的核苷酸都与互补核苷酸氢键键合。部分双链核酸可以具有其与互补核苷酸氢键键合的核苷酸的至少10%、至少25%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%。
26.如本文所用,术语“各(each)”当用于指项集合时意图鉴定该集合中的个别项,但是不一定指该集合中的每个项,除非上下文清楚地指示其他事项。
27.如本文所用,术语“排除体积”是指由特定分子占据而排除其他此类分子的空间的体积。
28.如本文所用,术语“间隙区域”是指基底中或表面上的与基底或表面的其他区域分开的区域。例如,间隙区域可以将阵列的一个特征与阵列的另一特征分开。彼此分开的两个区域可以是离散的,缺乏彼此接触。在另一个示例中,间隙区域可以将特征的第一部分与特征的第二部分分开。由间隙区域提供的分开可以是部分分开或完全分开。间隙区域通常将具有与表面上的特征的表面材料不同的表面材料。例如,阵列的特征可具有的捕获剂的量或浓度超过间隙区域中存在的量或浓度。在一些实施方案中,捕获剂可以不存在于间隙区域处。
29.如本文所用,术语“聚合酶”意图与其在本领域中的用途一致,并且包括例如使用核酸作为模板链产生核酸分子的互补重复的酶。通常,dna聚合酶结合模板链,然后沿着模板链向下移动,从而在核酸的生长链的3'端顺序向游离羟基添加核苷酸。dna聚合酶通常从
dna模板合成互补dna分子,而rna聚合酶通常从dna模板合成rna分子(转录)。聚合酶可以使用称为引物的短rna或dna链来开始链生长。一些聚合酶可以置换位点上游的链,在该位点处它们正在将碱基添加到链。认为此类聚合酶是链置换的,意味着它们具有从聚合酶读取的模板链中除去互补链的活性。具有链置换活性的示例性聚合酶包括但不限于bsu(枯草芽孢杆菌(bacillus subtilis))、bst(嗜热脂肪芽孢杆菌(bacillus stearothermophilus))聚合酶、exo
‑
klenow聚合酶或测序级t7exo
‑
聚合酶的大片段。一些聚合酶降解它们前面的链,从而有效地将其替换为后面的增长链(5’外切核酸酶活性)。一些聚合酶具有降解其后面的链的活性(3’外切核酸酶活性)。一些有用的聚合酶已经通过突变或其他方式进行了修饰,以减少或消除3’和/或5’外切核酸酶活性。
30.如本文所用,术语“核酸”意图与其在本领域中的使用一致,并且包括天然存在的核酸及其功能类似物。特别有用的功能类似物能够以序列特异性的方式与核酸杂交或者能够用作复制特定核苷酸序列的模板。天然存在的核酸通常具有包含磷酸二酯键的主链。类似物结构可具有交替的主链连接,包括本领域已知的多种主链连接之任一种。天然存在的核酸通常具有脱氧核糖(例如在脱氧核糖核酸(dna)中发现)或核糖(例如在核糖核酸(rna)中发现)。核酸可含有本领域已知的这些糖部分的多种类似物中的任一种。核酸可包括天然或非天然碱基。在这方面,天然脱氧核糖核酸可以具有选自腺嘌呤、胸腺嘧啶、胞嘧啶或鸟嘌呤的一种或多种碱基,并且核糖核酸可以具有选自尿嘧啶、腺嘌呤、胞嘧啶或鸟嘌呤的一种或多种碱基。可以包含在核酸中的有用的非天然碱基是本领域已知的。当用于指核酸时,术语“靶物”在本文所述方法或组合物的上下文中意图作为核酸的语义标识符,并不一定限制超出其他情况下明确指示的情况的核酸结构或功能。具有每个末端的通用序列,例如在每个末端的通用衔接子的靶核酸可以称为经修饰的靶核酸。
31.如本文所用,术语“重组酶负载蛋白”和“重组酶”可互换使用,并且旨在与其在本领域中的应用一致,包括例如reca蛋白、t4uvsx蛋白、rb69噬菌体uvsx蛋白、来自任何门的任何同源蛋白或蛋白复合物、或它们的功能变体。真核reca同源物在该组的第一个成员被鉴定之后通常被命名为rad51。可使用其他非同源重组酶代替reca,例如rect或reco。
32.如本文所用,术语“单链结合蛋白”,又被称为“ssb蛋白”或“ssb”,旨在指具有结合单链核酸的功能,例如以防止过早退火,保护单链核酸免于核酸酶消化,从核酸去除二级结构,或促进核酸的复制的任何蛋白。该术语旨在包括但不限于被国际生物化学与分子生物学联合会命名委员会(nc
‑
iubmb)正式认定为单链结合蛋白的蛋白质。示例性单链结合蛋白包括但不限于大肠杆菌ssb、t4 gp32、t7基因2.5ssb、噬菌体phi 29ssb、rb69噬菌体gp32蛋白、来自任何门的任何同源蛋白或蛋白复合物、以及它们的功能变体。
33.如本文所用,术语“辅助蛋白”旨在指具有与重组酶和单链结合蛋白相互作用以帮助在ssdna上产生uvsx细丝的成核作用的功能的任何蛋白。术语“辅助蛋白”,“重组酶辅助蛋白”和“重组酶辅助蛋白质”可互换使用。示例性的辅助蛋白包括但不限于t4 uvsy、rb69噬菌体uvsy蛋白、大肠杆菌reco、大肠杆菌recr、来自任何门的任何同源蛋白或蛋白复合物、以及它们的功能变体。
34.如本文所用,术语“转运”是指分子通过流体的移动。该术语可包括被动转运,例如分子沿其浓度梯度的移动(例如被动扩散)。该术语还可以包括主动转运,由此分子可以沿着分子的浓度梯度或逆着其浓度梯度移动。因此,转运可包括施加能量以使一个或多个分
子沿期望的方向移动或移动至期望的位置,例如扩增位点。
35.如本文所用,术语“速率”当用于指转运、扩增、捕获或其他化学过程时,意图与其在化学动力学和生化动力学中的含义一致。可以就最大速率(例如,在饱和时)、稳态前速率(例如,在平衡之前)、动力学速率常数或本领域已知的其他度量而言比较两个过程的速率。在具体的实施方案中,可以就完成过程的总时间而言确定特定过程的速率。例如,可以就完成扩增所花费的时间而言确定扩增速率。但是,不需要就完成过程的总时间而言确定特定过程的速率。
36.术语“和/或”是指所列元件中的一个或全部或所列元件中任何两个或更多个的组合。
37.词语“优选的”和“优选地”是指在某些情况下可以提供某些益处的本发明的实施方案。然而,在相同或其他情况下,其他实施方案也可以是优选的。此外,对一个或多个优选实施方案的叙述并不意味着其他实施方案不可用,并且不意图从本发明的范围排除其他实施方案。
38.术语“包括”及其变型在说明书和权利要求书中出现这些术语时不具有限制意义。
39.应当理解的是,无论何处用语言“包括”等描述实施方案,也提供了以术语“由
……
组成”和/或“基本上由
……
组成”描述的其他方面类似的实施方案。
40.除非另有规定,否则“一个”、“一种”,“所述/该”和“至少一个”可互换使用并且表示一个/种或超过一个/种。
[0041]“适合”于事件发生的条件,例如两个核酸序列的杂交,或“适合”条件是不阻止此类事件发生的条件。因此,这些条件允许、增强、促进和/或有利于该事件。
[0042]
如本文所用,在组合物、制品或核酸的上下文中“提供”指制备组合物、制品或核酸,购买组合物、制品或核酸,或以其他方式获得化合物、组合物、制品、核酸。
[0043]
还有,在本文中,通过端点叙述数值范围包括该范围内所包含的所有数字(例如1至5包括1、1.5、2、2.75、3、3.80、4、5等)。
[0044]
在整个说明书中提及“一个实施方案”、“实施方案”、“某些实施方案”或“一些实施方案”等意味着本公开的至少一个实施方案中包括结合该实施方案描述的特定特征、配置、组成或特性。因此,在整个说明书中这些短语在各个地方的出现不一定是指本公开的相同实施方案。此外,在一个或多个实施方案中,可以以任何合适的方式组合特定的特征、配置、组成或特性。
[0045]
对于本文公开的包括离散步骤的任何方法,步骤可以以任何可行的顺序进行。并且,适当时,可以同时进行两个或更多个步骤的任何组合。
[0046]
本发明的以上概述并非意图描述本发明的各个公开的实施方案或每个实施方式。下面的描述更具体地举例说明了示例性实施方案。在整个申请中的多个地方,通过示例列表提供了指导,这些示例可以以各种组合使用。在各种情况下,所列举的列表仅充当代表组,而不应解释为排他性列表。
附图说明
[0047]
当结合以下附图阅读时,可以最好地理解本公开的示例性实施方案的以下详细描述。
[0048]
图1a和图1b是附着于阵列的孔的第一和第二捕获序列的示例性实例的示意图(图1a),以及具有附着于各末端的通用衔接子的靶核酸的示例性实例的示意图(图1b)。
[0049]
图2是附着于阵列的孔的第一捕获核酸和靶核酸的杂交单链的示例性实例的示意图。
[0050]
图3a显示个别和成组的衔接子的通过过滤器的密度。k/mm2,千/平方毫米。泳道是指实施例的表2中所示的流动池的泳道。图3b显示与个别突变体衔接子相关的最终读段的比率。
[0051]
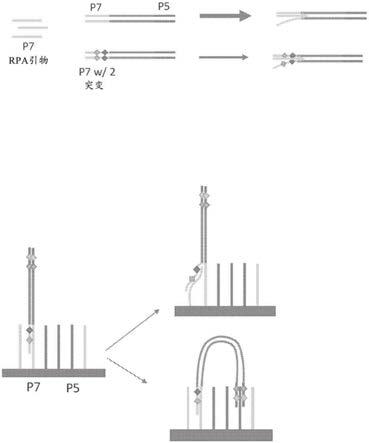
图4a和图4b显示链侵入和复制的示例性实例的示意图(“rpa”指重组酶聚合酶扩增)。图4a中,重组酶促进游离的p7引物侵入含有同源序列(即匹配p7末端)的双链模板中。不需要完美的同源性(此处通过引入p7的两个故意错配来显示),但是通过减少的同源性的衔接子(此处由突变体链的较小箭头表示),可以降低侵入和扩增的速率。图4b中,重组酶介导的从任一末端的侵入均在未突变的引物丛(lawn
‑
primer)的情况下发生,并有效地纠正来自子链的突变,从而将它们转化回到完美的衔接子。然而,由于减少了原始链与丛链(lawn strand)之间的同源性,因此直到出现第一拷贝的时间延迟与突变的数量和程度成正比。
[0052]
图5a和图5b显示短和突变体衔接子文库对扩增速率的影响。图5a中,一个成功的拷贝将各个模板转化成完美的模板。然而,该转变的时间常数取决于要克服的非同源性程度(较大的速率由较粗的箭头指示)。图5b中,短和突变体衔接子文库中的扩增速率减慢由实时扩增曲线向右迁移指示。
[0053]
图6显示个别垫层上不同模板间克隆优势的竞争。示出具有扩增偏爱(即动力学延迟)的接种模板;1=最快,6=最慢。模板的等摩尔比不是必需的或者甚至是不希望的。优选较高数目的较快模板。然而,甚至最慢的模板(6)可以在它在垫层上没有竞争时用单克隆簇填充垫层。
[0054]
示意图不一定按比例绘制。附图中使用的相同数字指代相同的组件、步骤等。然而,应当理解,在给定附图中使用数字来指代组件并非意图限制另一附图中用相同数字标记的组件。另外,使用不同的数字来指代组件并非意图指示不同编号的组件不能与其他编号的组件相同或相似。
具体实施方式
[0055]
本文提供了与增加产生可用于测序的单克隆簇有关的组合物和方法。
[0056]
本公开提供了用于扩增核酸的方法和用于确定核酸序列的方法。在一个实施方案中,该方法包括提供扩增试剂,所述扩增试剂包含(i)扩增位点的阵列,和(ii)具有多个不同靶核酸的溶液。扩增位点包括至少两个捕获核酸群体。一个群体,第一群体,包括第一捕获序列,而第二群体包括第二捕获序列。不同的靶核酸在3’端包含第一通用捕获结合序列。在一个实施方案中,靶核酸是双链的。所述第一通用捕获结合序列比与所述第一捕获序列具有100%互补性的第一通用捕获结合序列具有更小的对所述第一捕获序列的亲和力。例如,如图1a所示,第一捕获核酸群体的核酸100包含第一捕获序列110,其中核酸100附着于扩增位点120的表面。图1b中示出的是双链靶核酸130,其包含在各端的通用衔接子140,和在各个通用衔接子140的3’端的第一通用捕获结合序列150。
[0057]
可选地,不同的靶核酸还在5’端包含第二通用捕获结合序列。第二通用捕获结合序列的互补物比与所述第二捕获序列具有100%互补性的互补物的第二通用捕获结合序列具有更小的对所述第二捕获序列的亲和力。例如,如图1a所示,第二捕获核酸群体的核酸160包含第一捕获序列170,其中核酸160附着于扩增位点120的表面。图1b中示出的是双链靶核酸130,其包含各端的通用衔接子140,和各个通用衔接子140的5’端的第二通用捕获结合序列180。
[0058]
该方法进一步包括使扩增试剂反应以产生多个扩增位点,所述扩增位点各自具有来自溶液的个别靶核酸的扩增子的克隆群体。反应包括将不同靶核酸转运至扩增位点并在扩增位点处扩增靶核酸。例如,如图2所示,第一捕获核酸群体的核酸200包含第一捕获序列210,其中核酸200附着于扩增位点220的表面。包含在单链3’端的第一通用捕获结合序列250的靶核酸230的一条链与核酸200的第一捕获序列210杂交。第一通用捕获结合序列250包含“x”来表示第一通用捕获结合序列250与第一捕获序列210之间的错配的存在。这然后可以进行簇扩增,如通过桥式扩增,以导致簇产生。
[0059]
本文还提供了用于产生核酸文库的方法。该文库可用于本文所述的扩增方法。该方法包括提供多个不同靶核酸的溶液。在一个实施方案中,靶核酸是双链的。将通用衔接子连接至双链靶核酸的两端,以形成第一多个经修饰的靶核酸,其中各个经修饰的靶核酸均包含侧翼有通用衔接子的靶核酸。通用衔接子包含双链核酸区和单链非互补核酸链区。单链非互补核酸链区在3’端包含第一通用捕获结合序列。第一通用捕获结合序列比具有与第一捕获序列的100%互补性的第一通用捕获结合序列具有更小的对第一捕获序列的亲和力。任选地,单链非互补核酸链区在5’端包含第二通用捕获结合序列。第二通用捕获结合序列的互补物比具有与第二捕获序列的100%互补性的互补物的第二通用捕获结合序列具有更小的对第二捕获序列的亲和力。
[0060]
阵列
[0061]
在本文所述方法中使用的扩增位点的阵列可以作为一种或多种基底存在。可以用于阵列的基底材料的示例类型包括玻璃、改性玻璃、功能化玻璃、无机玻璃、微球(例如惰性和/或磁性颗粒)、塑料、多糖、尼龙、硝化纤维素、陶瓷、树脂、二氧化硅、基于二氧化硅的材料、碳、金属、光纤或光纤束、聚合物和多孔(例如微量滴定)板。示例性塑料包括丙烯酸、聚苯乙烯、苯乙烯与其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯和teflon
tm
。示例性的基于二氧化硅的材料包括硅和各种形式的改性硅。
[0062]
在具体的实施方案中,基底可以在诸如孔、管、通道、皿、培养皿、瓶等的容器之内或是该容器的部分。特别有用的容器是流动池,例如,如美国专利no.8,241,573或bentley等人,nature 456:53
‑
59(2008)中所述。示例性的流动池是可购自illumina,inc.(san diego,calif.)的流动池。另一个特别有用的容器是多孔板或微量滴定板中的孔。
[0063]
在一些实施方案中,阵列的位点可以被配置为表面上的特征。这些特征可以以多种期望形式中的任一种存在。例如,位点可以是孔、坑、通道、脊、凸起区域、钉、柱等。如上文所述,位点可以含有珠。但是,在具体的实施方案中,位点不需要含有珠或颗粒。示例性位点包括存在于用于由454lifesciences(roche,basel switzerland的子公司)或ion torrent(life technologies,carlsbad,calif.的子公司)出售的商业测序平台的基底的孔。具有孔的其他基底包括例如蚀刻的光纤和其它基底,记载于美国专利no.6,266,459;美国专利
no.6,355,431;美国专利no.6,770,441;美国专利no.6,859,570;美国专利no.6,210,891;美国专利no.6,258,568;美国专利no.6,274,320;美国专利no.8,262,900;美国专利no.7,948,015;美国专利公开文本no.2010/0137143;美国专利no.8,349,167,或pct公开文本no.wo 00/63437。在几种情况下,在这些参考文献中举例说明在孔中应用珠的基底。在本公开的方法或组合物中,含孔的基底可以与或不与珠一起使用。在一些实施方案中,基底的孔可以包含凝胶材料(具有或不具有珠),如美国专利no.9,512,422中所述。
[0064]
阵列的位点可以是非金属表面上的金属特征,例如玻璃、塑料或上文示例的其他材料。可以使用本领域已知的方法将金属层沉积在表面上,例如湿法等离子体蚀刻、干法等离子体蚀刻、原子层沉积、离子束蚀刻、化学气相沉积、真空溅射等。可以适当地使用多种商业仪器中的任一种,包括例如、ionfab或optofab系统(oxford instruments,uk)。金属层也可以通过电子束蒸发或溅射来沉积,如thornton,ann.rev.mater.sci.7:239
‑
60(1977)中所述。金属层沉积技术,例如上文示例的那些,可以与光刻技术结合以在表面上创建金属区域或斑块。在美国专利no.8,778,848和美国专利no.8,895,249中提供了用于组合金属层沉积技术和光刻技术的示例性方法。
[0065]
特征阵列可以以斑点或斑块的网格出现。特征可以以重复图案或不规则的非重复图案定位。特别有用的图案是六边形图案、直线图案、网格图案、具有反射对称性的图案、具有旋转对称性的图案等。不对称图案也可以是有用的。在不同对的最近邻特征之间的间距可以是相同的,或者在不同对的最近邻特征之间的间距可以存在变化。在具体的实施方案中,阵列的特征可各自具有大于约100nm2、250nm2、500nm2、1μm2、2.5μm2、5μm2、10μm2、100μm2或500μm2的面积。或者/另外,阵列的特征可以各自具有小于约1mm2、500μm2、100μm2、25μm2、10μm2、5μm2、1μm2、500nm2、或100nm2的面积。实际上,区域可以具有在选自上文示例者的上限和下限之间的范围内的大小。
[0066]
对于在表面上包括特征阵列的实施方案,特征可以是离散的,被间隙区域隔开。特征的大小和/或区域之间的间隔可以存在变化,使得阵列可以是高密度、中密度或较低密度的。高密度阵列的特征为具有间隔小于约15μm的区域。中密度阵列具有间隔约15至30μm的区域,而低密度阵列具有间隔大于30μm的区域。在本公开中有用的阵列可以具有间隔小于100μm、50μm、10μm、5μm、1μm或0.5μm的区域。
[0067]
在具体的实施方案中,阵列可以包括珠或其他颗粒的集合。可以将颗粒悬浮于溶液中或者可以将它们定位于基底的表面上。溶液中的珠阵列的例子是那些由luminex(austin,tex.)商业化的。具有位于表面上的珠的阵列的例子包括其中珠位于孔中的阵列,例如beadchip阵列(illumina inc.,san diego,calif.)或用于来自454lifesciences(roche,basel,switzerland的子公司)或iontorrent(life technologies,carlsbad,calif.的子公司)的测序平台中的基底。具有位于表面上的珠的其他阵列记载于美国专利no.6,266,459;美国专利no.6,355,431;美国专利no.6,770,441;美国专利no.6,859,570;美国专利no.6,210,891;美国专利no.6,258,568;美国专利no.6,274,320;us 2009/0026082a1;us 2009/0127589 a1;us 2010/0137143 a1;us 2010/0282617 a1;或pct公开文本no.wo 00/63437。上面的几个参考文献描述了在阵列基底中或阵列基底上加载珠之前将靶核酸附着于珠的方法。然而,应当理解,可将珠制成包含扩增引物,然后可将珠用于加载阵列,从而形成用于本文所述方法的扩增位点。如本文先前所述,可以在没有珠的情况下
使用基底。例如,可以直接将扩增引物附着于孔或孔中的凝胶材料。因此,参考文献例示了可以被修改以用于本文所述的方法和组合物中的材料、组合物或装置。
[0068]
阵列的扩增位点可包含多个能够结合靶核酸的捕获剂。在一个实施方案中,捕获剂包含捕获核酸。在制备用于测序的阵列的典型条件下,本公开的捕获核酸的核苷酸序列与一个或多个靶核酸的序列互补。相反地,本公开的捕获核酸的核苷酸序列与一个或多个靶核酸的序列不完全互补。在本文中详细描述了可用于本公开提供的方法中的捕获核酸的核苷酸序列。在一些实施方案中,捕获核酸还可充当用于扩增靶核酸的引物(无论它是否还包含通用序列)。在一些实施方案中,一个捕获核酸群体包含p5引物或其互补物,而第二捕获核酸群体包含p7引物或其互补物。
[0069]
在具体的实施方案中,可以将捕获剂如捕获核酸附着于扩增位点。例如,可以见捕获剂附着于阵列特征的表面。附着可以通过中间结构,例如珠、颗粒或凝胶。通过凝胶将捕获核酸附着于阵列的例子描述于美国专利no.8,895,249,并进一步以可购自illumina inc.(san diego,calif.)或在wo 2008/093098中描述的流动池举例说明。可以在本文所述的方法和装置中使用的示例性凝胶包括但不限于具有胶体结构的那些,例如琼脂糖;聚合物网状结构,例如明胶;或交联的聚合物结构,例如聚丙烯酰胺,sfa(例如,参见美国专利公开文本no.2011/0059865a1)或pazam(例如,参见美国临时专利申请序列流水no.61/753,833和美国专利no.9,012,022)。经由珠的附着可如在本文先前所述的描述和引用的参考文献中举例说明的那样实现。
[0070]
在一些实施方案中,阵列基底的表面上的特征是不连续的,被表面的间隙区域隔开。与阵列的特征相比,具有基本上较低数量或浓度的捕获剂的间隙区域是有利的。缺少捕获剂的间隙区域是特别有利的。例如,在间隙区域处相对少量或不存在捕获部分有利于将靶核酸以及随后产生的簇定位于期望的特征。在具体的实施方案中,特征可以是表面(例如孔)中的凹形特征,并且特征可以含有凝胶材料。含有凝胶的特征可以由表面上的间隙区域彼此分开,在所述间隙区域中基本上不存在凝胶,或者若存在的话,凝胶基本上不能支持核酸的定位。在美国专利no.9,512,422中阐述了制备和使用具有含凝胶的特征如孔的基底的方法和组合物。
[0071]
靶核酸
[0072]
本文所述方法中使用的扩增试剂的溶液包括靶核酸。术语“靶核酸”、“靶片段”、“靶核酸片段”、“靶分子”和“靶核酸分子”可互换使用,指期望测序,诸如在阵列上测序的核酸分子。靶核酸基本上可以是已知或未知序列的任何核酸。例如,它可以是基因组dna或cdna的片段。测序可导致测定全部或部分靶分子的序列。靶物可以源自已经随机片段化的初级核酸样品。在一个实施方案中,可以通过在各个靶标片段的末端放置通用扩增序列,例如通用衔接头中存在的序列,将靶标加工成适合于扩增的模板。
[0073]
初级核酸样品可以源自来自样品的双链dna(dsdna)形式(例如基因组dna片段、pcr和扩增产物等)或者可以以单链形式源自样品(如dna或rna)并转换为dsdna形式。举例来说,可以使用本领域公知的标准技术将mrna分子复制成适用于本文所述方法的双链cdna。来自初级核酸样品的多核苷酸分子的精确序列通常对本公开内容并不重要,并且可以是已知的或未知的。
[0074]
在一个实施方案中,来自初级核酸样品的初级多核苷酸分子是dna分子。更特别
地,初级多核苷酸分子代表生物体的整个遗传互补物,并且是基因组dna分子,其既包括内含子和外显子序列,又包括非编码调控序列,例如启动子和增强子序列。在一个实施方案中,可以使用多核苷酸序列或基因组dna的特定子集,诸如例如特定的染色体。更特别地,初级多核苷酸分子的序列是未知的。仍然更特别地,初级多核苷酸分子是人基因组dna分子。可以在任何随机片段化过程之前或之后,以及在通用衔接头序列连接之前或之后,化学或酶处理dna靶片段。
[0075]
核酸样品可以包括高分子量材料,例如基因组dna(gdna)。样品可以包括低分子量材料,例如从ffpe或存档的dna样品中获得的核酸分子。在另一个实施方案中,低分子量材料包括酶或机械片段化的dna。样品可以包含无细胞的循环dna。在一些实施方案中,样品可包括获自活组织检查、肿瘤、刮擦物、拭、血液、粘液、尿液、血浆、精液、毛发、激光捕获显微切割、手术切除以及其他临床或实验室获得的样品的核酸分子。在一些实施方案中,样品可以是流行病学、农业、法医或病原学样品。在一些实施方案中,样品可以包括获自诸如人类或哺乳动物来源的动物的核酸分子。在另一个实施方案中,样品可以包括获自非哺乳动物来源如植物、细菌、病毒或真菌的核酸分子。在一些实施方案中,核酸分子的来源可以是已存档或耗尽的样品或种类。
[0076]
此外,本文公开的方法和组合物可用于扩增具有低质量核酸分子的核酸样品,例如来自法医样品的降解和/或片段化的基因组dna。在一个实施方案中,法医样品可以包括从犯罪现场获得的核酸、从失踪人员dna数据库获得的核酸、从与法医调查相关的实验室获得的核酸、或包括从执法机构、一个或多个军事部门或任何此类人员获得的法医样品。核酸样品可以是纯化的样品或含有粗dna的裂解物,例如源自口腔拭子、纸、织物或其他可以用唾液、血液或其他体液浸渍的基底。因此,在一些实施方案中,核酸样品可以包括少量的dna(例如基因组dna)或该dna的片段化部分。在一些实施方案中,靶序列可以存在于一种或多种体液中,包括但不限于血液、痰液、血浆、精液、尿液和血清。在一些实施方案中,靶序列可获自受害者的毛发、皮肤、组织样品、尸检或遗骸。在一些实施方案中,可以从已故的动物或人获得包括一个或多个靶序列的核酸。在一些实施方案中,靶序列可包括获自非人dna的核酸,例如微生物、植物或昆虫学dna。在一些实施方案中,靶序列或扩增的靶序列针对人类鉴定的目的。在一些实施方案中,本公开涉及用于鉴定法医样品的特征的方法。在一些实施方案中,本公开一般涉及使用本文公开的一种或多种靶物特异性引物或使用本文概述的引物设计标准设计的一种或多种靶物特异性引物的人鉴定方法。在一个实施方案中,可以使用任何一种或多种本文公开或使用本文概述的引物标准得到的靶物特异性引物扩增包含至少一个靶序列的法医或人鉴定样品。
[0077]
生物样品来源的其他非限制性实例可包括完整的生物体以及从患者获得的样品。生物样品可以从任何生物流体或组织获得,并且可以为多种形式,包括液体流体和组织、实体组织和保存形式,例如干燥、冷冻和固定形式。样品可以是任何生物组织、细胞或体液的。此类样品包括但不限于痰液、血液、血清、血浆、血细胞(例如白细胞)、腹水、尿液、唾液、泪液、痰液、阴道液(排出)、在医疗程序期间获得的清洗液(例如,在活组织检查、内窥镜检查或手术期间获得的骨盆或其他清洗物)、组织、乳头抽吸物、核心或细针活组织检查样品、含细胞的体液、游离的浮动核酸、腹膜液和胸膜液,或来自它们的细胞。生物样品还可以包括组织切片,例如出于组织学目的而采取的冷冻切片或固定切片,或者显微切割的细胞或其
细胞外部分。在一些实施方案中,样品可以是血液样品,诸如例如全血样品。在另一个实例中,样品是未处理的干燥血斑(dss)样品。在另一个实例中,样品是福尔马林固定的石蜡包埋的(ffpe)样品。在又一个实例中,样品是唾液样品。在又一个实例中,样品是干燥唾液斑(dss)样品。
[0078]
可以衍生靶核酸的示例性生物学样品包括,例如,来自真核生物的样品,例如哺乳动物,例如啮齿动物、小鼠、大鼠、兔、豚鼠、有蹄动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物、人或非人灵长类;植物,如拟南芥(arabidopsis thaliana)、玉米、高粱、燕麦、小麦、稻、芥花或大豆;藻,例如莱茵衣藻(chlamydomonas reinhardtii);线虫,如秀丽隐杆线虫(caenorhabditis elegans);昆虫,如黑腹果蝇(drosophila melanogaster)、蚊、果蝇、蜜蜂或蜘蛛;鱼,例如斑马鱼;爬行动物;两栖动物,例如青蛙或非洲爪蟾(xenopus laevis);盘基网柄菌(dictyostelium discoideum);真菌,如卡氏肺囊虫(pneumocystis carinii)、红鳍东方鲀(takifugu rubripes)、酵母、酿酒酵母(saccharamoyces cerevisiae)或粟酒裂殖酵母(schizosaccharomyces pombe);或恶性疟原虫(plasmodium falciparum)。靶核酸还可以源自原核生物,例如细菌、大肠杆菌、葡萄球菌或肺炎支原体(mycoplasma pneumoniae);古细菌(archaea);病毒,如人丙型肝炎病毒或人类免疫缺陷病毒;或类病毒。靶核酸可以源自上述生物体的均质培养物或群体,或者可替代地源自例如社区或生态系统中的几种不同生物体的集合。
[0079]
随机片段化指通过酶促、化学或机械手段以无序方式片段化来自初级核酸样品的多核苷酸分子。磁力片段化方法是本领域已知的,并使用标准方法(sambrook and russell,molecular cloning,a laboratory manual,第三版)。在一个实施方案中,可以使用通常被称为标签片段化(tagmentation)的过程来实现片段化。标签片段化使用转座体复合物,并组合成一步片段化和连接以添加通用衔接子(gunderson等,wo 2016/130704)。为了清楚起见,通过较大片段的核酸序列保持完整(即,保留完整的核酸序列),通过特异性pcr扩增较小片段产生较大段核酸的此类较小片段并不等同于将较大段核酸进行片段化,因为较大段核酸序列保持完整(即不被pcr扩增片段化)。此外,设计随机片段化以产生片段,而与包含和/或围绕断裂的核苷酸的序列同一性或位置无关。更特别地,随机片段化是通过机械手段,例如雾化或超声处理,以产生长度为约50个碱基对至长度为约1500个碱基对的片段,还更特别地长度为50
‑
700个碱基对,更特别地长度为50
‑
400个碱基对。最特别地,该方法用于产生长度为50
‑
150个碱基对的较小片段。
[0080]
通过机械手段(例如雾化,超声处理和hydroshear)将多核苷酸分子片段化产生具有平端和3
’‑
和5
’‑
突出端的异质混合的片段。因此,期望使用本领域已知的方法或试剂盒(例如lucigen dna终止剂末端修复试剂盒)来修复片段末端,以产生对于插入例如克隆载体的平位点中而言最佳的末端。在一个具体的实施方案中,核酸群体的片段末端是平末端的。更特别地,片段末端是平末端并磷酸化的。可以通过酶处理来引入磷酸部分,所述酶处理例如使用多核苷酸激酶。
[0081]
靶核酸群体或其扩增可以具有对于本文所述方法或组合物的特定应用而言期望或合适的平均链长度。例如,平均链长度可以小于约100,000个核苷酸、50,000个核苷酸、10,000个核苷酸、5,000个核苷酸、1,000个核苷酸、500个核苷酸、100个核苷酸或50个核苷酸。或者/另外,平均链长度可以大于约10个核苷酸、50个核苷酸、100个核苷酸、500个核苷
酸、1,000个核苷酸、5,000个核苷酸、10,000个核苷酸、50,000个核苷酸或100,000个核苷酸。靶核酸群体或其扩增子的平均链长可以在上文所述的最大值和最小值之间的范围内。应当理解,在扩增位点处产生(或在本文中以其它方式制备或使用)的扩增子可以具有在选自上文示例者的上限和下限之间的范围内的平均链长度。
[0082]
在某些情况下,靶核酸群体可以在一定条件下产生或以其他方式配置为具有其成员的最大长度。例如,用于本文所述方法的一个或多个步骤中或存在于特定组合物中的成员的最大长度可以小于100,000个核苷酸、小于50,000个核苷酸、小于10,000个核苷酸、小于5,000个核苷酸、小于1,000个核苷酸、小于500个核苷酸、小于100个核苷酸或小于50个核苷酸。或者/另外,靶核酸群体或其扩增子可以在一定条件下产生或以其他方式配置为具有其靶成员的最小长度。例如,用于本文所述方法的一个或多个步骤中或存在于特定组合物中的成员的最小长度可以是大于10个核苷酸、大于50个核苷酸、大于100个核苷酸、大于100个核苷酸、大于500个核苷酸、大于1000个核苷酸、大于5,000个核苷酸、大于10,000个核苷酸、大于50,000个核苷酸或大于100,000个核苷酸。群体中靶核酸的最大和最小链长度可以在上文阐述的最大和最小值之间的范围内。应当理解,在扩增位点处产生(或在本文中以其它方式制备或使用)的扩增子可以具有在以上示例者的上限和下限之间的范围内的最大和/或最小链长度。
[0083]
在一个具体的实施方案中,相对于扩增位点的面积确定靶核酸的大小,例如,以促进排除扩增。例如,阵列的各个位点的面积可大于靶核酸的排除体积的直径,以实现排除扩增。以例如使用表面上的特征阵列的实施方案为例,各个特征的面积可大于转运至扩增位点的靶核酸的排除体积的直径。靶核酸的排除体积及其直径可以例如由靶核酸的长度来确定。确定核酸的排除体积和排除体积的直径的方法描述于例如美国专利号7,785,790;rybenkov etal.,proc.natl.acad.sci.u.s.a.90:5307
‑
5311(1993);zimmerman et al.,j.mol.biol.222:599
‑
620(1991);或sobel et al.,biopolymers 31:1559
‑
1564(1991)。
[0084]
在一个具体的实施方案中,通过例如某些类型的dna聚合酶如taq聚合酶或klenow exo minus聚合酶的活性制备具有单一突出的核苷酸的靶片段序列,所述聚合酶具有非模板依赖性的末端转移酶活性,该活性将单一脱氧核苷酸,例如脱氧腺苷(a)添加到dna分子(例如pcr产物)的3’端。此类酶可用于在双链靶片段的各条链的平末端3’端添加单核苷酸“a”。因此,可以通过与taq或klenow exo minus聚合酶反应在双链靶片段的每个末端修复链的3’端添加“a”,而通用衔接子多核苷酸构建体可以是t构建体,其具有通用衔接子的双链核酸的各个区域的3’端存在的相容性“t”突出端。此末端修饰还防止载体和靶标两者的自身连接,使得存在对组合的连接的衔接头
‑
靶物
‑
衔接头分子形成的偏爱。
[0085]
在一些情况下,在用于本文的方法或组合物之前,可以扩增源自此类来源的靶核酸。可以使用多种已知扩增技术中的任一种,包括但不限于聚合酶链式反应(pcr)、滚环扩增(rca)、多置换扩增(mda)或随机引发扩增(random prime amplification,rpa)。应当理解,在用于本文所述方法或组合物之前,靶核酸的扩增是任选的。因此,在用于本文所述的方法和组合物的一些实施方案之前,可不扩增靶核酸。靶核酸可以任选地源自合成文库。合成的核酸可以具有天然的dna或rna组成或者可以是其类似物。
[0086]
通用衔接子
[0087]
本文所述的方法或组合物中使用的靶核酸包括附着于各个末端的通用衔接子。在
本文描述的方法中使用的将通用衔接子附着于靶核酸的各个末端的方法是本领域技术人员已知的。可以通过使用连接的标准文库制备技术(chesney et al.美国专利公开文本no.2018/0305753a1),或通过使用转座酶复合物的标签片段化(gunderson等人,wo 2016/130704)进行连接。
[0088]
在一个实施方案中,通过首先将相同的通用衔接子分子(“错配的衔接子”,其一般特征在下面定义,并且在gormley等人,us 7,741,463和bignell等人,us 8,053,192中进一步描述)连接至双链靶核酸(其可以是已知的,部分已知的或未知的样品)的5’和3’端来处理来自样品,例如片段化的样品的双链靶核酸。在一个实施方案中,通用衔接子包括将靶核酸固定化在阵列上以进行后续测序所必需的通用捕获结合序列。在另一个实施方案中,在固定化和测序之前,使用pcr步骤进一步修饰存在于靶核酸的各个末端的通用衔接子。例如,使用通用引物结合位点进行初始引物延伸反应,其中形成与各个单独靶核酸的两条链互补的延伸产物并添加通用捕获结合序列。所得的引物延伸产物和任选的其扩增的拷贝共同提供了可被固定化,然后测序的经修饰的靶核酸的文库。术语“文库”是指在其3’和5’端含有已知的共同序列的靶核酸的集合,并且也可以称为3’和5’修饰的文库。附着于靶核酸的通用衔接子的3’端和任选地5’端可包含本文所述的通用捕获结合序列的同质群体或异质群体。
[0089]
在本公开的方法中使用的通用衔接子称为“错配”衔接头,因为如本文中详细解释的,衔接头包含序列错配的区域,即,它们不通过退火完全互补的多核苷酸链形成。
[0090]
如下形成用于本文的错配衔接头,即退火两条部分互补的多核苷酸链,以在两条链退火时提供至少一个双链区(也称为双链核酸区域)和至少一个不匹配的单链区,也称为单链非互补核酸链的区域。
[0091]
通用衔接子的“双链区”是短的双链区,通常包含5个或更多个连续碱基对,其通过退火两个部分互补的多核苷酸链形成。该术语指两条链退火的核酸双链区,并不意味着任何特定的结构构象。如本文所用,术语“双链”在用于提及核酸分子时,意指该核酸分子中基本上所有的核苷酸都与互补核苷酸氢键键合。部分双链核酸可具有其与互补核苷酸氢键键合的核苷酸的至少10%、25%、50%、60%、70%、80%、90%或95%。
[0092]
通常有利的是,双链区在不损失功能的情况下尽可能短。在本文中,“功能”指双链区在酶催化的核酸连接反应的标准反应条件下形成稳定双链体的能力,所述条件对于熟练的读者是公知的(例如,在适合于酶的连接缓冲液中在4℃至25℃的范围内的温度温育),从而形成通用衔接子的两条链在通用衔接子与靶分子的连接期间保持部分退火。双链区在引物延伸或pcr反应的退火步骤中通常使用的条件下稳定不是绝对必要的。
[0093]
通用衔接子的双链区通常在连接中使用的所有通用衔接子中是相同的。因为通用衔接子与各个靶分子的两个末端连接,所以经修饰的靶核酸侧翼可以有源自通用衔接子的双链区的互补序列。在经修饰的靶核酸构建体中双链区以及由其衍生的互补序列越长,经修饰的靶核酸构建体能够在引物延伸和/或pcr中使用的退火条件下在内部自身互补性的这些区域内向后折叠并且与其自身进行碱基配对的可能性越大。因此,通常优选的是双链区的长度为20或更小、15或更小或10或更小的碱基对,以降低此效应。可以通过包含比标准watson
‑
crick碱基对表现出更强的碱基配对的非天然核苷酸增加双链区的稳定性,并因此潜在缩短其长度。
[0094]
在一个实施方案中,通用衔接子的两条链在双链区中100%互补。应当理解的是,可以在双链区内容许一个或多个核苷酸错配,条件是两条链能够在标准连接条件下形成稳定的双链体。
[0095]
用于本文的通用衔接子通常可包括形成衔接头的“可连接”末端的双链区,例如在连接反应中与双链靶核酸连接的末端。通用衔接头的可连接末端可以是平端,或者在其他实施方案中,可以存在一个或多个核苷酸的短5’或3’突出端,以便于/促进连接。通用衔接子的可连接末端的5’端核苷酸通常被磷酸化以实现与靶多核苷酸上的3’羟基的磷酸二酯连接。
[0096]
术语“不匹配区”是指通用衔接头的区域,单链非互补核酸链的区域,其中形成通用衔接头的两条多核苷酸链的序列表现出一定程度的非互补性,使得在引物延伸或pcr反应的标准退火条件下,两条链不能完全彼此退火。在酶催化的连接反应的标准反应条件下,不匹配区可以表现出一定程度的退火,只要两条链在扩增反应中的退火条件下转化为单链形式。
[0097]
应当理解,“不匹配区”由形成双链区的相同两条多核苷酸链的不同部分提供。衔接头构建体中的错配可以采取一条链长于另一条链的形式,使得其中一条链上存在单链区,或者采用如下的序列,该序列选择为使得两条链不杂交,从而在两条链上形成单链区。错配也可以采取“气泡”的形式,其中通用衔接子构建体的两个末端能够彼此杂交并形成双链体,而中心区域则不能。在将相同两条链的其他部分退火以形成一个或多个双链区的条件下,形成不匹配区的链部分不退火。为了避免疑问,应当理解,在本公开的上下文中,随后经历与靶序列的连接的多核苷酸双链体的3’末端的单链或单碱基突出端不构成“不匹配区”。
[0098]
不匹配区长度的下限通常由功能决定,例如提供适合于以下项的序列的需要:i)引物结合以进行引物延伸、pcr和/或测序(例如,引物与通用引物结合位点的结合),或者ii)通用捕获结合序列与捕获序列的结合,以将经修饰的靶核酸固定化于表面。理论上,不匹配区的长度没有上限,只是通常有利的是使通用衔接子的总长度最小化,例如,以便于在连接步骤后将未结合的通用衔接子与经修饰的靶核酸构建体分开。因此,通常优选的是,不匹配区的长度应小于50、或小于40、或小于30、或小于25个连续核苷酸。
[0099]
单链非互补核酸链区在3’端包含至少一个通用捕获结合序列(参见图1b,通用捕获结合序列150)。通用衔接子的3’端包含第一通用捕获结合序列,该序列将与捕获核酸上存在的第一捕获序列杂交。例如,如图2所示,第一捕获核酸群体的核酸200包含第一捕获序列210。显示在单链的3’端包含第一通用捕获结合序列250的经修饰的靶核酸230的一条链与第一捕获序列210杂交。为了降低亲和力并且将动力学延迟编码到孔中接种的靶核酸而改变的正是第一通用捕获结合序列250与第一捕获序列210之间的相互作用。标准examp方法使用通用捕获结合序列和在捕获序列的整个长度上完全互补的捕获序列。本文所述的examp方法使用通用捕获结合序列,其包含一个或多个错配,具有减小的长度,或它们的组合。与两个完全互补的全长序列的亲和力相比,错配和/或长度减少的结果是两个序列之间的亲和力降低。降低的亲和力导致扩增效率的降低,其中所产生的扩增效率通常是通用捕获结合序列与捕获序列之间差异数目的函数。
[0100]
任选地,通用衔接子的5’端包含附着于靶核酸各端的第二通用捕获结合序列,其
中第二通用捕获结合序列将与捕获核酸上存在的第二捕获序列杂交。例如,如图1b所示,通用捕获结合序列180。因此,除非另有说明,以下关于如何调节通用捕获结合序列以降低亲和力的讨论适用于3’和5’通用捕获结合序列两者。
[0101]
捕获序列的3’端充当本文所述方法中dna聚合酶进行dna合成的起始点。本领域技术人员将认识到,在捕获序列3’端的核苷酸和通用捕获结合序列中的相应核苷酸应当互补,以保持dna聚合酶启动dna合成的能力。
[0102]
通用捕获结合序列可包括一个或多个与捕获序列不互补的核苷酸。在一个实施方案中,与本文所述的扩增反应中使用的捕获序列相比,通用捕获结合序列可包含1至5个错配的核苷酸(又被称为非互补核苷酸),例如至少1个、至少2个、至少3个、至少4个或5个错配的核苷酸。错配的核苷酸可以是摆动(wobble)错配或真实(true)错配。
[0103]
摆动错配是指在通用捕获结合序列的群体中表示所有四个核苷酸的位置。例如,如果n是actngc中的摆动核苷酸,那么通用捕获结合序列的群体将包括acttgc、actagc、actcgc和actggc,并且群体中25%的通用捕获结合序列将与相应的捕获序列核苷酸互补。在一个实施方案中,与本文所述扩增反应中使用的捕获序列相比,通用捕获结合序列可包含1至5个摆动核苷酸,例如至少1个、至少2个、至少3个、至少4个或5个摆动核苷酸。在一个实施方案中,摆动核苷酸可位于整个通用捕获结合序列的任何位置
[0104]
真实错配是指在通用捕获结合序列的群体中的特定位置处代表四个核苷酸中仅三个的位置。例如,如果g是acttgc中真实错配核苷酸的位置,则通用捕获结合序列的群体将包括acttcc、actttc和acttac,并且群体中的通用捕获结合序列中的无一与相应核苷酸互补,在此示例中为捕获序列的c。在一个实施方案中,与本文所述扩增反应中使用的捕获序列相比,通用捕获结合序列可包含1至5个错配核苷酸,例如至少1个、至少2个、至少3个、至少4个或5个摆动核苷酸。在一个实施方案中,摆动核苷酸可位于整个通用捕获结合序列的任何位置。
[0105]
技术人员将认识到,摆动错配或真实错配的使用提供了对改变通用捕获结合序列的亲和力的更大控制。使用仅具有单个摆动核苷酸的通用捕获结合序列导致25%的通用捕获结合序列在该位置处具有互补性,比其他75%具有更大的亲和力,和预期比其他75%更高的扩增效率。使用仅具有单个真实错配核苷酸的通用捕获结合序列,导致所有通用捕获结合序列在该位置处均没有互补性,亲和力降低,并且预期的扩增效率降低。
[0106]
在另一个实施方案中,通用捕获结合序列具有缩短的长度,其导致亲和力小于全长通用捕获结合序列与捕获序列之间的亲和力。在本文所述的标准扩增方法中有用的捕获序列通常具有约20个至约30个核苷酸的长度,尽管如果需要的话,它们可以更长或更短。在本文所述方法中有用的通用捕获结合序列具有比在本文所述的扩增反应中使用的捕获序列短1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个或12个核苷酸的长度。在一个实施方案中,通过从第一通用捕获结合序列的3’端和/或从第二通用捕获结合序列的5’端去除核苷酸来减少通用捕获结合序列的长度。
[0107]
本文所述的扩增反应可使用通用捕获结合序列的异质群体(例如,多个不同的靶核酸可包含存在于3’端并且任选地存在于5’端的通用捕获结合序列的异质群体)。在一个实施方案中,异质群体包含具有错配核苷酸的个别通用捕获结合序列。在一个实施方案中,通用捕获结合序列具有1个、2个、3个、4个或5个错配核苷酸。错配核苷酸可以是摆动错配,
真实错配,或它们的组合。
[0108]
在一个实施方案中,异质群体包含具有缩短长度的个别通用捕获结合序列。在一个实施方案中,异质群体包含个别通用捕获结合序列,其长度比本文所述的扩增反应中使用的捕获序列短1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个或12个核苷酸。
[0109]
在一个实施方案中,异质群体包含具有一个或多个错配核苷酸和缩短长度的组合的个别通用捕获结合序列。错配核苷酸的数目和从通用捕获结合序列缺少的核苷酸的数目可以任何组合存在,例如,错配核苷酸的数目和缺少核苷酸的数目是独立的。
[0110]
异质群体还可包含个别的靶核酸,其3’端和任选地5’端具有与捕获序列具有100%互补性的通用捕获结合序列。异质群体中不同的通用捕获结合序列的摩尔比可以相等或改变。在摩尔比不相等的那些实施方案中,具有更高扩增效率的那些通用捕获结合序列的更高摩尔比是优选的。因此,在异质群体包含与捕获序列具有100%互补性的通用捕获结合序列的那些实施方案中,具有100%互补性的通用捕获结合序列可以以比异质群体的任何其他成员更大的比例存在。
[0111]
单链非互补核酸链区通常还包含至少一个通用引物结合位点。通用引物结合位点是可用于扩增和/或测序连接至通用衔接子的靶核酸的通用序列。
[0112]
单链非互补核酸链区还可包含至少一个索引。索引可用作阵列上特定靶核酸来源的特征性标志物。通常,索引是合成的核苷酸序列,该序列为通用衔接子的一部分,其作为文库制备步骤的一部分添加至靶核酸。因此,索引是附着于特定样品的各个靶分子的核酸序列,其存在指示或用于识别分离出靶分子的样品或来源。
[0113]
优选地,该索引长度可多至20个核苷酸,更优选地为1
‑
10个核苷酸,最优选地长度为4
‑
8个核苷酸。例如,四核苷酸索引提供了在同一阵列上多路复用256(44)个样品的可能性,而六碱基索引在同一阵列上能够处理4,096(46)个样品。
[0114]
在一个实施方案中,当通用捕获结合序列与双链靶片段连接时,它是通用衔接子的一部分,并且在另一个实施方案中,在通用衔接子与双链靶片段连接后,将通用引物延伸结合位点添加到通用衔接子。可以使用常规方法来完成添加,包括基于pcr的方法。
[0115]
通用衔接子的精确核苷酸序列通常对本发明不重要,并且可以由用户选择,使得期望的序列元件最终包括在多个不同的经修饰的靶核酸的共同序列中,例如,以提供通用捕获结合序列和用于特定组的通用扩增引物和/或测序引物的结合位点。可以包括其他序列元件,例如,以提供用于测序引物的结合位点,例如在固体支持物上,所述测序引物最终会用于文库中靶核酸的测序或源自文库中靶核酸扩增的产物。
[0116]
尽管通用衔接子的精确核苷酸序列通常不限于本公开,但是在不匹配区中的单独链的序列应使得任何单独链均不表现出任何内部自互补性,其在标准退火条件下可以导致自退火、形成发夹结构等。应当避免在不匹配区中链的自退火,因为它可以阻止或减少扩增引物与此链的特异性结合。
[0117]
错配的衔接子优选自两条dna链形成,但可以包括通过磷酸二酯和非磷酸二酯主链连接的混合物连接的天然和非天然核苷酸(例如一个或多个核糖核苷酸)的混合物。
[0118]
连接和扩增
[0119]
连接方法是本领域已知的并且使用标准方法。此类方法使用连接酶,例如dna连接酶来实现或催化在此种情况下通用衔接子和双链靶核酸的两条多核苷酸链的末端的连接,
从而形成共价连接。通用接头可含有5
’‑
磷酸部分,以促进与靶片段上存在的3
’‑
oh的连接。双链靶核酸含有5
’‑
磷酸部分,自剪切过程残留或者使用酶处理步骤添加,并已进行末端修复,并任选地通过一个或多个突出碱基进行延伸,从而给出适合于连接的3
’‑
oh。在本上下文中,连接指先前未共价连接的多核苷酸链的共价连接。在本公开的特定方面,此类连接通过在两条多核苷酸链之间形成磷酸二酯连接而发生,但是可以使用其他共价连接的方式(例如非磷酸二酯主链连接)。
[0120]
如本文所讨论,在一个实施方案中,用于连接的通用衔接子是完整的,并且包括通用捕获结合序列和其他通用序列,例如通用引物结合位点和索引序列。所得的多个靶核酸可用于制备固定化的样品用于测序。
[0121]
同样如本文所讨论,在一个实施方案中,用于连接的通用衔接头包含通用引物结合位点和索引序列,并且不包含通用捕获结合序列。所得的多个经修饰的靶核酸可以进一步修饰以包括特定序列,例如通用捕获结合序列。用于向与双链靶片段连接的通用引物添加特定序列,如通用捕获结合序列的方法包括基于pcr的方法,并且在本领域中是已知的,并且例如描述于:bignell等人(us 8,053,192)和gunderson等人(wo2016/130704)。
[0122]
在通用接头被修饰的那些实施方案中,制备扩增反应。扩增反应的内容物是本领域技术人员已知的,并且包括扩增反应所需要的合适的底物(例如dntp)、酶(例如dna聚合酶)和缓冲液组分。通常,扩增反应需要至少两个扩增引物,通常表示为“正向”和“反向”引物(引物寡核苷酸),它们能够在扩增反应的各个循环的引物退火步骤中遇到的条件下与待扩增的多核苷酸序列(例如靶核酸)的一部分特异性退火。应当理解,如果引物含有在第一扩增循环中不与经修饰的靶核酸退火的任何核苷酸序列,则可以将此序列复制到扩增产物中。例如,使用具有通用捕获结合序列,例如不与经修饰的靶核酸退火的序列的引物,通用捕获结合序列将被掺入所得的扩增子中。
[0123]
扩增引物通常是单链多核苷酸结构。它们也可以含有天然和非天然碱基以及天然和非天然主链连接的混合物,条件是任何非天然修饰均不排除作为引物的功能——定义为在扩增反应的条件期间与模板多核苷酸链退火的能力并且作用为合成与模板链互补的新多核苷酸链的起始点。另外,引物可以包含非核苷酸化学修饰,例如硫代磷酸酯以增加外切核酸酶抗性,再次条件是使得修饰不阻止引物功能。
[0124]
用于测序的固定化样品的制备
[0125]
本公开的方法可包括使扩增试剂(扩增位点的阵列和多个不同的经修饰的靶核酸)反应以产生多个扩增位点,所述扩增位点各自包括来自已经接种位点的个别靶核酸的扩增子的克隆群体。在标准反应中,由于靶核酸接种的相对较慢速率(例如,相对较慢扩散或转运)相对于发生扩增以给位点填充核酸种子拷贝的相对较快速率而发生排除扩增。在本文描述的方法中,排除扩增由于在已接种位点的靶核酸的第一拷贝形成中的动力学延迟相对于产生后续拷贝以填充位点的相对较快速率而发生。例如,个别位点可以已经接种了几种不同的靶核酸,各个靶核酸具有不同的通用捕获结合序列(如多个不同的经修饰的靶核酸包含通用捕获结合序列的异质群体)。然而,预期任何给定靶核酸的第一拷贝形成取决于其通用捕获结合序列的扩增效率,使得与产生后续拷贝的速率相比,第一拷贝形成的平均速率相对较慢。在这种情况下,尽管个别位点可以已经接种了几种不同的靶核酸,但只有一种会先开始扩增,并且排除扩增通常只允许该靶核酸填充扩增位点。更具体地,一旦第一
靶核酸开始扩增,该位点将迅速用它的拷贝填充至容量,从而防止在该位点形成第二靶核酸的拷贝。
[0126]
在一些实施方案中,即使在第二靶核酸在该位点处开始扩增之前未将扩增位点填充至容量,也可以实现明显的克隆性。在某些条件下,第一靶核酸的扩增可以进行到如下的点,即产生足够数量的拷贝以有效胜过或压倒自转运至该位点的第二靶核酸的拷贝产生。例如,在对直径小于500nm的圆形特征上使用桥式扩增过程的实施方案中,已经确定在对第一靶核酸进行14轮指数扩增的循环之后,来自相同位点处的第二靶核酸的污染将产生数量不足的污染性扩增子以对illumina测序平台上的合成测序分析产生不利影响。
[0127]
在所有实施方案中,阵列中的扩增位点不需要是完全克隆的。相反,对于某些应用,单独的扩增位点可以主要填充有来自第一靶核酸的扩增子,并且还可以具有低水平的来自第二靶核酸的污染性扩增子。阵列可以具有一个或多个具有低水平污染扩增子的扩增位点,只要污染水平不对阵列的后续使用产生不可接受的影响。例如,当阵列要用于检测应用时,可接受的污染水平是不以不可接受的方式影响信噪比或检测技术的分辨率的水平。因此,表观克隆性通常与通过本文所述方法制成的阵列的特定用途或应用有关。对于特定应用在单独的扩增位点处可接受的污染的示例性水平包括但不限于最多0.1%、0.5%、1%、5%、10%或25%的污染扩增子。阵列可以包括一个或多个具有这些示例性水平的污染扩增子的扩增位点。例如,阵列中多达5%、10%、25%、50%、75%或甚至100%的扩增位点可以具有一些污染性扩增子。
[0128]
尽管以上对于靶核酸在扩增前存在于扩增位点处的实施方案举例说明了利用差异活性引物来引起不同速率的第一扩增子和后续扩增子形成,但是该方法也可在扩增发生时靶核酸被转运(例如通过扩散)至扩增位点的条件下进行。因此,排除扩增方法可以利用相对于随后的扩增子形成的相对较慢的转运速率和相对较慢的第一扩增子的产生两者。因此,可以进行本文所述的扩增反应,使得与以下项同时将靶核酸从溶液中转移到扩增位点:(i)产生第一扩增子,和(ii)在阵列的其他位点处产生随后的扩增子。在具体的实施方案中,在扩增位点处产生随后扩增子的平均速率可以超过将靶核酸从溶液转运至扩增位点的平均速率。在某些情况下,可以从单独的扩增位点处的单一靶核酸产生足够数量的扩增子,以填充相应扩增位点的容量。产生扩增子以填充相应扩增位点的容量的速率可以例如超过将单独的靶核酸从溶液转运至扩增位点的速率。
[0129]
在本文阐述的方法中使用的扩增试剂优选地能够在扩增位点处快速产生靶核酸的拷贝。通常,在本公开方法中使用的扩增试剂将包含聚合酶和核苷三磷酸(ntp)。可使用本领域已知的多种聚合酶中的任何一种,但是在一些实施方案中,可以优选使用核酸外切酶阴性的聚合酶。对于产生dna拷贝的实施方案,ntp可以是脱氧核糖核苷酸三磷酸(dntp)。通常,四种天然种类datp、dttp、dgtp和dctp将存在于dna扩增试剂中;然而,如果需要的话,可使用类似物。对于产生rna拷贝的实施方案,ntp可以是核糖核苷酸三磷酸(rntp)。通常,四种天然种类ratp、rutp、rgtp和rctp将存在于rna扩增试剂中;然而,如果需要的话,可使用类似物。
[0130]
扩增试剂可包含有助于扩增子形成并且在某些情况下提高扩增子形成速率的其他组分。示例是重组酶负载蛋白。重组酶可通过允许反复侵入/延伸来促进扩增子形成。更具体地,重组酶可使用靶核酸作为扩增子形成的模板来促进聚合酶对靶核酸的侵入和聚合
酶对引物的延伸。该过程可作为链式反应重复进行,其中每轮侵入/延伸产生的扩增子在后续轮次中用作模板。由于不需要变性循环(如通过加热或化学变性),因此该过程会比标准pcr更快地发生。因此,重组酶促进的扩增可以等温地进行。通常期望在重组酶促进的扩增试剂中包含atp或其他核苷酸(或在某些情况下其不可水解的类似物)以促进扩增。重组酶、单链结合(ssb)蛋白和辅助蛋白的混合物特别有用。用于重组酶促进的扩增的示例性配制剂包括由twistdx(cambridge,uk)以twistamp试剂盒商业出售的那些。重组酶促进的扩增试剂的有用成分和反应条件阐述于美国专利号5,223,414和美国专利号7,399,590,其各自通过引用并入本文。
[0131]
可包含在扩增试剂中以促进扩增子形成并且在某些情况下提高扩增子形成速率的组分的另一个实例是解旋酶。解旋酶可通过允许扩增子形成的链式反应来促进扩增子形成。由于不需要变性循环(如通过加热或化学变性),因此该过程会比标准pcr更快地发生。因此,解旋酶促进的扩增可以等温地进行。解旋酶和单链结合(ssb)蛋白的混合物特别有用,因为ssb可进一步促进扩增。用于解旋酶促进扩增的示例性配制剂包括由biohelix(beverly,ma)以isoamp试剂盒商业出售的那些。此外,包括解旋酶蛋白的有用配制剂的实例描述于美国专利号7,399,590和美国专利号7,829,284,其各自通过引用并入本文。
[0132]
可包含在扩增试剂中以促进扩增子形成并且在某些情况下提高扩增子形成速率的组分的另一个实例是起始结合蛋白。
[0133]
溶液中分子拥挤试剂的存在可用于辅助排除扩增。有用的分子拥挤试剂的实例包括但不限于聚乙二醇(peg)、葡聚糖或聚乙烯醇。示例性的分子拥挤试剂和配制剂阐述于美国专利号7,399,590。
[0134]
可以通过增加扩增反应的一种或多种活性成分的浓度或量来增加扩增反应发生的速率。例如,可以增加聚合酶、核苷酸三磷酸、引物、重组酶、解旋酶或ssb的量或浓度以增加扩增速率。在一些情况下,量或浓度增加(或在本文所述的方法中以其他方式操作)的扩增反应的一种或多种活性成分是扩增反应的非核酸成分。
[0135]
还可以通过调节温度在本文所述的方法中提高扩增速率。例如,可通过将一个或多个位点处的温度升高至由于变性或其他不良事件导致反应速率降低的最大温度来提高一个或多个扩增位点处的扩增速率。最佳温度或期望温度可以从使用的扩增组分的已知特性或者对于给定扩增反应混合物凭经验确定。可以基于引物解链温度(tm)的先验预测或凭经验进行此类调整。
[0136]
可以通过增加一种或多种扩增试剂的活性来增加发生扩增反应的速率。例如,可以将增加聚合酶的延伸速率的辅因子添加到使用该聚合酶的反应中。在一些实施方案中,可以将金属辅助因子例如镁、锌或锰添加至聚合酶反应或可以添加甜菜碱。
[0137]
在本文阐述的方法的一些实施方案中,期望使用双链的靶核酸群体。已经观察到,在排除扩增条件下,在位点阵列形成扩增子对于双链靶核酸是有效的。例如,在重组酶和单链结合蛋白的存在下,可由双链靶核酸更有效地产生具有扩增子的克隆群体的多个扩增位点(相比相同浓度的单链靶核酸)。然而,将理解的是,单链靶核酸可用于本文阐述的方法的一些实施方案中。
[0138]
本文阐述的方法可使用多种扩增技术中的任何一种。可使用的示例性技术包括但不限于聚合酶链反应(pcr)、滚环扩增(rca)、多重置换扩增(mda)或随机引发扩增(rpa)。在
一些实施方案中,例如,当扩增位点能够包含具有所期望容量的体积的扩增子时,可以在溶液中进行扩增。优选地,本公开方法中在排除扩增条件下使用的扩增技术将在固相上进行。例如,用于扩增的一种或多种引物可在扩增位点附着于固相。在pcr实施方案中,用于扩增的引物之一或两者可附着于固相。利用附着在表面上的两种引物的形式通常被称为桥式扩增,因为双链扩增子在两个表面附着的引物之间形成桥状结构,该引物于已被复制的模板序列侧翼。可用于桥式扩增的示例性试剂和条件描述于,例如美国专利号5,641,658;美国专利公开号2002/0055100;美国专利号7,115,400;美国专利公开号2004/0096853;美国专利号2004/0002090;美国专利公开号2007/0128624号;以及美国专利公开号2008/0009420。固相pcr扩增也可利用附着到固相支持物的扩增引物之一和溶液中的第二引物进行。使用表面附着的引物和可溶性引物的组合的示例性形式是乳液pcr,描述于例如dressman et al.,proc.natl.acad.sci.usa 100:8817
‑
8822(2003),wo 05/010145,或美国专利公开号2005/0130173或2005/0064460。乳液pcr是该形式的示例,应当理解,出于本文所述方法的目的,乳液的使用是任选的,并且实际上对于一些实施方案,不使用乳液。所描述的pcr技术可被修改用于非循环扩增(如等温扩增),其使用本文其他地方所示例的组分来促进或提高扩增速率。因此,所描述的pcr技术可以在排除扩增条件下使用。
[0139]
可以改进rca技术以用于本公开的方法。可在rca反应中使用的示例性组分和rca产生扩增子的原理描述于,例如lizardi et al.,nat.genet.19:225
‑
232(1998)和us 2007/0099208 a1。用于rca的引物可在溶液中或在扩增位点附着于固体支持物表面。在以上参考文献中示例的rca技术可根据本文的教导进行改进,例如以提高扩增速率来适合特定应用。因此,可以在排除扩增条件下使用rca技术。
[0140]
可以改进mda技术以用于本公开的方法中。mda的一些基本原理和有用条件已描述于,例如dean et al.,proc natl.acad.sci.usa 99:5261
‑
66(2002);lage et al.,genome research 13:294
‑
307(2003);walker et al.,molecular methods for virus detection,academic press,inc.,1995;walker et al.,nucl.acids res.20:1691
‑
96(1992);美国专利号5,455,166;美国专利号5,130,238;以及美国专利号6,214,587。用于mda的引物可在溶液中或在扩增位点附着于固体支持物表面。在以上参考文献中示例的mda技术可根据本文的教导改进,例如以提高扩增速率来适合特定应用。因此,可以在排除扩增条件下使用mda技术。
[0141]
在具体实施方案中,可将所描述的扩增技术的组合用于在排除扩增条件下制备阵列。例如,rca和mda可以组合使用,其中rca用于在溶液中产生连环扩增子(例如,使用溶液相引物)。然后可将其用作模板使用引物进行mda,该引物在扩增位点附着于固体支持物表面。在该实例中,在组合rca和mda步骤之后产生的扩增子将附着于扩增位点的表面。
[0142]
如关于以上几个实施方案所示例,本公开的方法不需要使用循环扩增技术。例如,可在没有变性循环的扩增位点进行靶核酸的扩增。示例性的变性循环包括将化学变性剂引入扩增反应和/或提高扩增反应的温度。因此,靶核酸的扩增无需包括利用使靶核酸和扩增子变性的化学试剂更换扩增溶液的步骤。类似地,靶核酸的扩增无需包括将溶液加热至使靶核酸和扩增子变性的温度。因此,在扩增位点处扩增靶核酸可在本文所述方法的持续时间内等温地进行。实际上,本文所述的扩增方法可以发生,而无需在标准条件下对某些扩增技术进行一个或多个循环操作。此外,在一些标准的固相扩增技术中,在将靶核酸装载到基
底之后且在扩增开始之前进行洗涤。然而,在本方法的实施方案中,在将靶核酸转运至反应位点与在扩增位点扩增靶核酸之间无需进行洗涤步骤。相反,允许转运(如通过扩散)和扩增同时发生,以提供排除扩增。
[0143]
在一些实施方案中,可能期望重复在排除扩增条件下发生的扩增循环。因此,尽管靶核酸的拷贝可在单个扩增位点制备而无需循环操作,但是可循环处理扩增位点的阵列,以增加每个循环后含有扩增子的位点的数目。在具体实施方案中,可由一个循环到下一个循环改变扩增条件。例如,可在循环之间调节上述一个或多个改变转运速率或改变扩增速率的条件。这样,可由一个循环到另一个循环提高转运速率,可由一个循环到另一个循环降低转运速率,可由一个循环到另一个循环提高扩增速率,或者可由一个循环到另一个循环降低扩增速率。
[0144]
组合物
[0145]
在本文所述的扩增聚簇方法期间或之后,可产生不同的组合物。在一个实施方案中,组合物包括扩增位点阵列。各个位点包含第一和第二捕获核酸,其分别包含第一和第二捕获序列,其中第一和第二捕获核酸结合到位点的表面。阵列的不同位点包含与第一捕获核酸的第一捕获序列杂交的靶核酸。在不同位点的靶核酸各自在3’端包含与捕获序列杂交的通用捕获结合序列。存在的通用捕获结合序列比与第一捕获序列具有100%互补性的通用捕获结合序列对捕获序列具有更低的亲和力。在一个实施方案中,在每个位点存在不同的通用捕获结合序列,例如,存在通用捕获结合序列的第一异质群体。第一异质群体可包括至少2个、至少3个、至少4个、至少5个、至少6个、至少7个或至少8个不同的通用捕获结合序列。
[0146]
在一个实施方案中,第一通用捕获结合序列包含与第一捕获序列不互补的1至5个核苷酸。组合物可包含一些靶核酸,其具有与第一捕获序列具有100%互补性的通用捕获结合序列。在一个实施方案中,与第一捕获序列具有100%互补性的第一异质群体的成员以比第一异质群体的其他成员更多的数目存在。第一异质群体还可包括个别的第一通用捕获结合序列,其长度比第一捕获序列的长度更小,例如长度比第一捕获序列的长度小1至12个核苷酸。第一异质群体的个别成员的长度可以具有比第一捕获序列的长度更小的长度,并且包含与第一捕获序列的序列不互补的1至5个核苷酸,或者与第一捕获序列的序列100%的互补性。
[0147]
任选地,5’端可包含第二通用捕获结合序列,其具有比具有与第二捕获序列100%互补性的互补物的第二通用捕获结合序列具有更低的对第二捕获序列的亲和力的互补物。在一个实施方案中,第二通用捕获结合序列的互补物包含与第二捕获序列不互补的1至5个核苷酸。组合物可包含一些具有第二通用捕获结合序列的靶核酸,所述第二通用捕获结合序列具有互补物,所述互补物与第二捕获序列具有100%互补性。在一个实施方案中,在各个位点存在不同的第二通用捕获结合序列,例如,存在第二通用捕获结合序列的第二异质群体。第二异质群体可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个或至少8个不同的第二通用捕获结合序列。在一个实施方案中,具有与第二捕获序列具有100%互补性的互补物的第二异质群体的成员以比第二异质群体的其他成员更多的数目存在。5’端的通用捕获结合序列的第二异质群体还可包含个别第二通用捕获结合序列,其具有比第二捕获序列的长度更小的长度,例如长度比第二捕获序列的长度小1至12个核苷酸。第二异质群
体的个别成员可具有比第二捕获序列的长度更小的长度,并且包含互补物,其具有与第二捕获序列的序列不互补的1至5个核苷酸,或与第二捕获序列的序列100%互补性。
[0148]
可产生的另一组合物包括溶液,该溶液包含来自单个样品或来源(例如文库)的不同双链靶核酸,其中各个靶核酸包含在各末端附着的通用衔接子。通用衔接子包含通用捕获结合序列,并且通用捕获结合序列是异质群体。异质群体可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个或至少8个不同的通用捕获结合序列。
[0149]
在测序/测序方法中应用
[0150]
例如,已经通过本文所述方法产生并且在扩增位点处包括扩增的靶核酸的本公开的阵列可以用于多种应用中的任一种。特别有用的应用是核酸测序。一个例子是合成测序(sbs)。在sbs中,监测核酸引物沿核酸模板(例如靶核酸或其扩增子)的延伸,以确定模板中核苷酸的序列。潜在的化学过程可以是聚合反应(例如,如通过聚合酶催化)。在特定的基于聚合酶的sbs实施方案中,将荧光标记的核苷酸以模板依赖的方式添加到引物(从而延伸引物),以便可以使用添加到引物的核苷酸的顺序和类型的检测来确定模板的序列。在本文所述的阵列的不同位点处的多个不同模板可以在由于其在阵列中的位置而可以区分针对不同模板发生的事件的条件下经受sbs技术。
[0151]
流动池提供了容纳阵列的便利形式,该阵列通过本公开的方法生产,并经过sbs或其他检测技术,其涉及循环中试剂的重复递送。例如,为了启动第一个sbs循环,可以将一个或多个标记的核苷酸,dna聚合酶等流入/流到容纳核酸模板阵列的流动池。可以检测引物延伸导致掺入标记核苷酸的阵列的那些位点。任选地,标记的核苷酸可以进一步包括可逆的终止性质,一旦已经将核苷酸添加到引物,该可逆的终止性质终止进一步的引物延伸。例如,可以将具有可逆终止剂部分的核苷酸类似物添加至引物,使得随后的延伸直到递送解封闭剂来除去该部分时才发生。因此,对于使用可逆终止的实施方案,可以(在发生检测之前或之后)将解封闭剂递送至流动池。可以在各个递送步骤之间进行洗涤。然后可以将循环重复n次以将引物延伸n个核苷酸,从而检测长度n的序列。可以容易地适合于与通过本公开的方法生产的阵列一起使用的示例性sbs程序、流体系统和检测平台描述于例如bentley等人,nature 456:53
‑
59(2008),wo 04/018497;美国专利no.7,057,026;wo 91/06678;wo 07/123,744;美国专利no.7,329,492;美国专利no.7,211,414;美国专利no.7,315,019;美国专利no.7,405,281,和美国专利no.8,343,746。
[0152]
可以使用其他使用循环反应的测序程序,例如焦磷酸测序。焦磷酸测序检测在特定的核苷酸被掺入新生核酸链中时无机焦磷酸盐(ppi)的释放(ronaghi,等人,analytical biochemistry 242(1),84
‑
9(1996);ronaghi,genome res.11(1),3
‑
11(2001);ronaghi等人science 281(5375),363(1998);美国专利号6,210,891;6,258,568和6,274,320)。在焦磷酸测序中,释放的ppi可以通过被atp硫化酶立即转化为三磷酸腺苷(atp)来检测,并且产生的atp的水平可以通过萤光素酶产生的光子进行检测。因此,可以通过发光检测系统监测测序反应。焦磷酸测序程序不必需用于基于荧光的检测系统的激发辐射源。可用于将焦磷酸测序应用于本公开的阵列的有用的流体系统、检测器和程序描述于例如wipo公开的专利申请2012/058096、us 2005/0191698 a1、美国专利no.7,595,883和美国专利no.7,244,559。
[0153]
连接测序反应也是有用的,包括例如shendure等人science 309:1728
‑
1732
(2005);美国专利no.5,599,675;和美国专利no.5,750,341中描述的。一些实施方案可以包括杂交测序程序,如记载于bains等人,journal of theoretical biology 135(3),303
‑
7(1988);drmanac等人,nature biotechnology 16,54
‑
58(1998);fodor等人,science 251(4995),767
‑
773(1995);和wo 1989/10977。在连接测序和杂交测序程序两者中,对存在于阵列位点处的模板核酸(例如,靶核酸或其扩增子)进行寡核苷酸递送和检测的重复循环。如本文所述或本文引用的参考文献中所述的用于sbs方法的流体系统可以容易地适于递送试剂以用于连接测序或杂交测序程序。通常,寡核苷酸被荧光标记并且可以使用荧光检测器检测,所述荧光检测器类似于就本文或本文引用的参考文献中的sbs程序而言描述的荧光检测器。
[0154]
一些实施方案可以使用涉及实时监测dna聚合酶活性的方法。例如,可以通过携带荧光团的聚合酶和γ
‑
磷酸标记的核苷酸之间的荧光共振能量转移(fret)相互作用或使用零模波导来检测核苷酸掺入。用于基于fret的测序的技术和试剂描述于例如levene等人science 299,682
‑
686(2003);lundquist等人opt.lett.33,1026
‑
1028(2008);korlach等人proc.natl.acad.sci.usa105,1176
‑
1181(2008)。
[0155]
一些sbs实施方案包括检测将核苷酸掺入延伸产物后释放的质子。例如,基于释放的质子的检测的测序可以使用电检测器和可购自ion torrent(guilford,conn.,a life technologies子公司)的相关技术或us 2009/0026082 a1;us 2009/0127589 a1;us 2010/0137143 a1;或us 2010/0282617 a1中描述的测序方法和系统。使用排除扩增来扩增靶核酸的本文所述的方法可以容易地应用于用于检测光子的基底。更具体地,本文所述的方法可以用于在用于检测光子的阵列的位点处的扩增子的克隆群体。
[0156]
例如已经通过本文所述方法产生的本公开的阵列的有用应用是基因表达分析。可以使用rna测序技术,如那些称为数字rna测序的技术检测或定量基因表达。rna测序技术可以使用本领域已知的测序方法进行,例如上述方法。还可以使用通过与阵列直接杂交进行的杂交技术或使用在阵列上检测其产物的多重测定法来检测或定量基因表达。例如,已经通过本文所述方法产生的本公开的阵列还可用于确定来自一个或多个个体的基因组dna样品的基因型。可在本公开的阵列上进行的用于基于阵列的表达和基因型分型分析的示例性方法记载于美国专利no.7,582,420;6,890,741;6,913,884或6,355,431或美国专利公开文本no.2005/0053980 a1;2009/0186349 a1或us 2005/0181440 a1。
[0157]
已经通过本文所述方法产生的阵列的另一个有用应用是单细胞测序。当与索引化方法组合时,可以在染色质可及性测定法中使用单细胞测序,以在数千个单细胞中产生活性调控元件的概况,并且可以产生单细胞全基因组文库。可以在本公开的阵列上进行的单细胞测序的实例记载于美国公布的专利申请2018/0023119 a1,美国临时申请流水号62/673,023和62/680,259。
[0158]
本文所述方法的优点在于它们提供了从多种核酸文库中的任一种快速且有效创建阵列。因此,本公开提供了集成系统,其能够使用本文中阐述的一种或多种方法来制备阵列并且还能够使用本领域中已知的技术(例如上文举例说明的那些)来检测阵列上的核酸。因此,本公开的集成系统可以包括能够将扩增试剂递送到扩增位点阵列的流体组件,例如泵、阀、储器、流体线等。特别有用的流体成分是流动池。流动池可以在集成系统中配置和/或使用以创建本公开的阵列并检测该阵列。示例性流动池描述于例如us2010/0111768a1和
美国专利no.8,951,781。如流动池例示,集成系统的一个或多个流体组件可用于扩增方法和检测方法。以核酸测序实施方案为例,集成系统的一种或多种流体组件可用于本文所述的扩增方法和用于测序方法诸如上文例示的测序方法中的测序试剂的递送。或者,集成系统可以包括分开的流体系统以进行扩增方法和进行检测方法。能够创建核酸阵列并确定核酸序列的集成测序系统的例子包括但不限于miseq
tm
、hiseq
tm
、nextseq
tm
、miniseq
tm
、novaseq
tm
和iseq
tm
平台(illumina,inc.,san diego,calif.)和美国专利no.8,951,781中描述的装置。可以根据本文阐述的指导修改此类装置以制备使用排除扩增的阵列。
[0159]
能够进行本文所述方法的系统不需要与检测装置集成在一起。相反,也可以是独立系统或与其他装置集成的系统。在此类实施方案中可以使用与以上在集成系统的上下文中例示的那些类似的流体组件。
[0160]
无论与检测能力集成与否,能够进行本文提出的方法的系统可以包括系统控制器,该系统控制器能够执行一组指令以进行本文所述的方法、技术或过程的一个或多个步骤。例如,指令可以指导在桥式扩增条件下创建阵列的步骤的进行。任选地,指令可以进一步指导使用本文先前所述的方法检测核酸的步骤的进行。有用的系统控制器可以包括任何基于处理器或基于微处理器的系统,包括使用微控制器、精简指令集计算机(risc)、专用集成电路(asic)、现场可编程门阵列(fpga)、逻辑电路、和任何其他能够执行本文所述功能的电路或处理器的系统。用于系统控制器的一组指令可以是软件程序的形式。如本文所使用,术语“软件”和“固件”是可互换的,并且包括存储在存储器中以供计算机执行的任何计算机程序,包括ram存储器、rom存储器、eprom存储器、eeprom存储器和非易失性ram(nvram)存储器。软件可以采用各种形式,例如系统软件或应用软件。此外,软件可以采取单独程序的集合,或较大程序内的程序模块或程序模块的一部分的形式。软件还可以包括面向对象编程形式的模块化编程。
[0161]
上文在整体检测的背景下示例了本公开阵列的几种应用,其中一起检测了在各个扩增位点处存在的多个扩增子。在可选择的实施方案中,可以在各个扩增位点检测单核酸,无论是靶核酸还是其扩增子。例如,扩增位点可被配置为包含具有待检测的靶核苷酸序列的单核酸分子和多个填充核酸。在该实例中,填充核酸的功能是填充扩增位点的容量,而它们不一定意图被检测。待检测的单分子可通过能够在填充核酸的背景中区分单分子的方法来检测。可使用各种单分子检测技术中的任何一种,包括例如对上述集合检测技术的改进,以检测增量的位点,或使用更敏感的标记物来检测位点。可以使用的单分子检测方法的其他实例示于us 2011/0312529a1;美国专利号9,279,154;以及us 2013/0085073 a1。
[0162]
可以在具有以下修改的情况下使用本文所述的一种或多种方法创建可用于单分子核酸检测的阵列。可将多个不同的靶核酸配置成既包括待检测的靶核苷酸序列,又包括待扩增以产生填充扩增子的一个或多个填充核苷酸序列。多个不同的靶核酸可以被包括在诸如本文其他地方所述的那些扩增试剂中,并在排除扩增条件下与扩增位点阵列反应,使得填充核苷酸序列填充扩增位点。可用于允许填充序列扩增,而禁止靶序列扩增的示例性配置包括例如具有第一区域和第二区域的单一靶分子,所述第一区域具有侧翼有存在于扩增位点的扩增引物的结合位点的填充序列,所述第二区域具有侧翼区域之外的靶序列。在另一种配置中,靶核酸可包括分别带有靶序列和填充序列的单独的分子或链。分开的分子或链可附着于颗粒或以核酸树状聚合物或其他分支结构的臂形成。
[0163]
在具体实施方案中,使用引物延伸测定法或合成测序技术可检测具有各自包含填充序列和靶序列的扩增位点的阵列。在这种情况下,可以通过使用适当放置的引物结合位点,在靶核苷酸序列而不是大量填充序列上实现特异性延伸。例如,用于测序引物的结合位点可置于靶序列的上游,并且可能不在任何填充序列中。或者或另外,靶序列可包括一种或多种不能与标准核苷酸氢键键合的非天然核苷酸类似物。可将非天然核苷酸置于引物结合位点的下游(例如,在靶序列中或介于靶序列和引物结合位点的区域中),因此在加入适当的核苷酸伴侣(即能够与靶序列中的非天然类似物氢键键合的核苷酸伴侣)之前将防止延伸或合成测序。核苷酸类似物异胞嘧啶(isoc)和异鸟嘌呤(isog)特别有用,因为它们彼此特异性配对,但不与大多数延伸和合成测序技术中使用的其他标准核苷酸配对。在靶序列或靶序列上游使用isoc和/或isog的另一个好处是,通过从用于扩增的核苷酸混合物中省略了相应的伴侣防止扩增步骤期间不希望的靶序列扩增。
[0164]
应当理解,例如已经通过本文所述方法生产的本公开的阵列不需要用于检测方法。相反,该阵列可用于储存核酸文库。因此,可以以在其中保存核酸的状态储存阵列。例如,阵列可以以干燥状态、冷冻状态(例如在液氮中)或在保护核酸的溶液中储存。或者/另外,阵列可用于复制核酸文库。例如,阵列可以用于从阵列上一个或多个位点创建重复扩增子。
[0165]
在本文中已经就将靶核酸转运至阵列的扩增位点并在扩增位点处产生捕获的靶核酸的拷贝而言示例了本公开的几个实施方案。相似的方法可用于非核酸靶分子。因此,本文阐述的方法可与代替示例性靶核酸的其他靶分子一起使用。例如,可以实施本公开的方法来转运来自不同靶分子群体的个别靶分子。可将各个靶分子转运至(在某些情况下捕获于)阵列的个别位点,以在捕获位点处引发反应。各个位点处的反应可以例如产生捕获分子的拷贝,或者反应可改变位点以分离或隔离捕获的分子。在任一情况下,最终结果可以是阵列的位点,其各自就自包含不同类型靶分子的群体存在的靶分子类型而言是纯的。
[0166]
在使用除核酸之外的靶分子的具体实施方案中,可以使用利用排除扩增的方法来制备不同靶分子的文库。例如,在用溶液中的靶分子随机接种阵列的位点并生成靶分子的拷贝来填充各个接种位点至容量的条件下,可制备靶分子阵列。根据本公开的排除扩增方法,在产生拷贝的速率超过接种速率的条件下,接种和复制过程可以同时进行。因此,在已被第一靶分子接种的位点处产生拷贝的相对快的速率将有效地排除第二靶分子接种该位点。在某些情况下,靶分子的接种将引发通过除复制靶分子以外的过程将位点填充至容量的反应。例如,靶分子在位点处的捕获可引发链式反应,该反应最终使位点不能捕获第二靶分子。可以以如下的速率发生链式反应,所述速率可超过将靶分子捕获的速率,从而在排除扩增条件下发生。
[0167]
如靶核酸所示例,当应用于其他靶分子时排除扩增可利用阵列位点处启动重复反应(如链式反应)的相对较慢的速率相对于一旦启动便继续重组反应的相对较快的速率。在前段的示例中,由于相对较慢的靶分子接种速率(例如,相对较慢的扩散)相对于发生反应例如以用靶分子种子的拷贝填充位点的相对较快速率而发生排除扩增。在另一个示例性实施方案中,可以由于已接种位点的靶分子的第一拷贝的形成延迟(例如,延迟或缓慢激活)相对于产生后续拷贝以填充位点的相对较快速率而发生排除扩增。在该实例中,个别位点可以已接种了几种不同的靶分子。然而,任何给定靶分子的第一拷贝形成可被随机激活,使
得相比产生后续拷贝的速率,第一拷贝形成的平均速率相对较慢。在此种情况下,尽管个别位点可以已接种了几种不同的靶分子,但排除扩增将仅允许复制那些靶分子之一。
[0168]
因此,本公开内容提供了用于制备分子阵列的方法,该方法可包括以下步骤:(a)提供试剂,该试剂包括(i)位点阵列,和(ii)具有多个不同靶分子的溶液,其中溶液中靶分子的数目超过阵列中位点的数目,其中不同的靶分子具有向多个位点的流体通路,并且其中各个位点包括多个不同的靶分子中的几种靶分子的容量;和(b)使试剂反应以产生多个位点,所述位点各自具有来自所述多个的单一靶分子,或者以产生多个位点,所述位点各自具有来自溶液的个别靶分子的纯拷贝群体,其中反应包括同时(i)以平均转运速率将不同分子转运至位点,和(ii)以平均反应速率启动将位点填充至容量的反应,其中平均反应速率超过平均转运速率。在一些实施方案中,步骤(b)可替代地如下进行:使试剂反应以产生各自具有来自所述多个的单一靶分子的多个位点,或者以产生各自具有来自溶液的个别靶分子的纯拷贝群体的多个位点,其中反应包括(i)在各个位点启动重复反应(如链式反应)以由靶分子形成产物,以及(ii)在各个位点处继续反应以形成后续产物,其中在该位点发生反应的平均速率超过在该位点启动反应的平均速率。
[0169]
在上述非核酸的实施方案中,靶分子可以是在阵列的各个位点发生重复反应的起始子。例如,重复反应可形成排除其他靶分子占据该位点的聚合物。或者,重复反应可形成一种或多种聚合物,其构成被转运至该位点的靶分子的分子拷贝。
[0170]
示例性实施方案
[0171]
实施方案1.用于扩增核酸的方法,其包括:
[0172]
(a)提供扩增试剂,其包含:
[0173]
(i)扩增位点的阵列,
[0174]
其中所述扩增位点包含两个捕获核酸群体,各个群体包含捕获序列,
[0175]
其中第一群体包含第一捕获序列,并且第二群体包含第二捕获序列,和
[0176]
(ii)溶液,其包含多个不同的经修饰的双链靶核酸,
[0177]
其中所述不同的经修饰的靶核酸在3’端包含第一通用捕获结合序列,其比与所述第一捕获序列具有100%互补性的第一通用捕获结合序列具有更小的对所述第一捕获序列的亲和力;和
[0178]
(b)使所述扩增试剂反应以产生多个扩增位点,所述扩增位点各自包含来自所述溶液的个别靶核酸的扩增子的克隆群体。
[0179]
实施方案2.用于扩增核酸的方法,其包括:
[0180]
(a)提供扩增试剂,其包含:
[0181]
(i)扩增位点的阵列,
[0182]
其中所述扩增位点包含两个捕获核酸群体,各个群体包含捕获序列,
[0183]
其中第一群体包含第一捕获序列,并且第二群体包含第二捕获序列,和
[0184]
(ii)溶液,其包含多个不同的经修饰的靶核酸,
[0185]
其中所述不同的经修饰的靶核酸在3’端包含第一通用捕获结合序列,其比与所述第一捕获序列具有100%互补性的第一通用捕获结合序列具有更小的对所述第一捕获序列的亲和力;和
[0186]
(b)使所述扩增试剂反应以产生多个扩增位点,所述扩增位点各自包含来自所述
溶液的个别靶核酸的扩增子的克隆群体,其中所述反应包括:
[0187]
(i)从转运至各个所述扩增位点的个别靶核酸产生第一扩增子,和
[0188]
(ii)从转运至各个所述扩增位点的所述个别靶核酸或从所述第一扩增子产生后续扩增子,
[0189]
其中在所述扩增位点处产生所述后续扩增子的平均速率小于在所述扩增位点处产生所述第一扩增子的平均速率。
[0190]
实施方案3.用于测定核酸序列的方法,其包括进行测序程序,该测序程序检测在阵列上多个扩增子位点的各处的扩增子的表观克隆群体,其中所述阵列通过包括以下的方法制备:
[0191]
(a)提供扩增试剂,其包含:
[0192]
(i)多个扩增位点,
[0193]
其中所述扩增位点包含两个捕获核酸群体,各个群体包含捕获序列,
[0194]
其中第一群体包含第一捕获序列,并且第二群体包含第二捕获序列,和
[0195]
(ii)溶液,其包含多个不同的经修饰的靶核酸,
[0196]
其中所述不同的经修饰的靶核酸在3’端包含第一通用捕获结合序列,其比与所述第一捕获序列具有100%互补性的第一通用捕获结合序列具有更小的对所述第一捕获序列的亲和力;
[0197]
(b)使所述扩增试剂反应。
[0198]
实施方案4.实施方案1至3中任一个的方法,其中所述溶液中所述不同的经修饰的靶核酸的数目超过所述阵列中扩增位点的数目,
[0199]
其中所述不同的经修饰的靶核酸具有对所述多个扩增位点的流体通路,和
[0200]
其中各个所述扩增位点包含所述多个不同核酸中几个核酸的容量。
[0201]
实施方案5.实施方案1至4中任一个的方法,其中所述反应包括同时:
[0202]
(i)以平均转运速率将所述不同的经修饰的靶核酸转运至所述扩增位点,和
[0203]
(ii)以平均扩增速率扩增位于所述扩增位点处的所述靶核酸,其中所述平均扩增速率小于所述平均转运速率。
[0204]
实施方案6.实施方案1至5中任一个的方法,其中所述溶液中多个不同的经修饰的靶核酸为如下的浓度,所述浓度同时导致:
[0205]
(i)将所述不同的经修饰的靶核酸从所述溶液转运至所述扩增位点,和
[0206]
(ii)以扩增速率扩增位于所述扩增位点处的所述靶核酸,以产生扩增子位点的阵列,所述扩增子位点各自包含所述扩增子的表观克隆群体。
[0207]
实施方案7.实施方案1至6中任一个的方法,其中所述第一通用捕获结合序列与所述第一捕获序列具有小于100%的互补性。
[0208]
实施方案8.实施方案1至7中任一个的方法,其中所述第一通用捕获结合序列包含与所述第一捕获序列不互补的1个、2个或3个核苷酸。
[0209]
实施方案9.实施方案1至8中任一个的方法,其中所述不同的经修饰的靶核酸包含第一通用捕获结合序列的异质群体,其中所述异质群体包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有(i)与所述第一捕获序列不互补的1个、2个或3个核苷酸,或(ii)与所述第一捕获序列的100%互补性。
[0210]
实施方案10.实施方案1至9中任一个的方法,其中与所述第一捕获序列具有100%互补性的所述异质群体的成员以比所述异质群体的其他成员更多的数目存在。
[0211]
实施方案11.实施方案1至10中任一个的方法,其中所述第一通用捕获结合序列具有比所述第一捕获序列的长度更小的长度。
[0212]
实施方案12.实施方案1至11中任一个的方法,其中所述第一通用捕获结合序列具有比所述第一捕获序列的长度小1至12个核苷酸的长度。
[0213]
实施方案13.实施方案1至12中任一个的方法,其中所述不同的经修饰的靶核酸包含第一通用捕获结合序列的异质群体,其中所述异质群体包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有比所述第一捕获序列的长度小1至12个核苷酸。
[0214]
实施方案14.实施方案1至13中任一个的方法,其中所述异质群体还包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有(iii)比所述第一捕获序列的长度更小的长度。
[0215]
实施方案15.实施方案1至14中任一个的方法,其中所述个别的第一通用捕获结合序列具有比所述第一捕获序列的长度小1至12个核苷酸的长度。
[0216]
实施方案16.实施方案1至15中任一个的方法,其中具有比所述第一捕获序列的长度更小的长度的所述异质群体的个别成员包含与所述第一捕获序列的序列不互补的1个、2个或3个核苷酸,或与所述第一捕获序列的序列的100%互补性。
[0217]
实施方案17.实施方案1至16中任一个的方法,其中所述不同的经修饰的靶核酸在5’端包含具有互补物的第二通用捕获结合序列,其比具有与所述第二捕获序列具有100%互补性的互补物的第二通用捕获结合序列具有更小的对所述第二捕获序列的亲和力。
[0218]
实施方案18.实施方案1至17中任一个的方法,其中所述第二通用捕获结合序列的互补物与所述第二捕获序列具有小于100%的互补性。
[0219]
实施方案19.实施方案1至18中任一个的方法,其中所述第二通用捕获结合序列的互补物包含与所述第二捕获序列不互补的1个、2个或3个核苷酸。
[0220]
实施方案20.实施方案1至19中任一个的方法,其中所述不同的经修饰的靶核酸包含第二通用捕获结合序列的异质群体,其中所述异质群体包含个别的第二通用捕获结合序列,所述第二通用捕获序列包含互补物,所述互补物具有(i)与所述第二捕获序列不互补的1个、2个或3个核苷酸,或(ii)与所述第二捕获序列的100%互补性。
[0221]
实施方案21.实施方案1至20中任一个的方法,其中包含与所述第二捕获序列具有100%互补性的互补物的所述异质群体的成员以比所述异质群体的其他成员更多的数目存在。
[0222]
实施方案22.实施方案1至21中任一个的方法,其中所述第二通用捕获结合序列具有比所述第二捕获序列的长度更小的长度。
[0223]
实施方案23.实施方案1至22中任一个的方法,其中所述第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸的长度。
[0224]
实施方案24.实施方案1至23中任一个的方法,其中所述不同的经修饰的靶核酸包含第二通用捕获结合序列的异质群体,其中所述异质群体包含个别的第二通用捕获结合序列,所述第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸。
[0225]
实施方案25.实施方案1至24中任一个的方法,其中所述异质群体还包含个别的第
二通用捕获结合序列,所述第二通用捕获结合序列具有(iii)比所述第二捕获序列的长度更小的长度。
[0226]
实施方案26.实施方案1至25中任一个的方法,其中所述个别的第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸的长度。
[0227]
实施方案27.实施方案1至26中任一个的方法,其中具有比所述第二捕获序列的长度更小的长度的所述异质群体的个别成员包含互补物,所述互补物包含与所述第二捕获序列的序列不互补的1个、2个或3个核苷酸,或与所述第二捕获序列的序列的100%互补性。
[0228]
实施方案28.实施方案1至27中任一个的方法,其中所述靶核酸是dna。
[0229]
实施方案29.实施方案1至28中任一个的方法,其中所述扩增位点的阵列包括表面上特征的阵列。
[0230]
实施方案30.实施方案1至29中任一个的方法,其中各个所述特征的面积比被转运至所述扩增位点的所述靶核酸的排除体积的直径更大。
[0231]
实施方案31.实施方案1至30中任一个的方法,其中所述特征是不连续的,并且被缺乏捕获剂的所述表面的间隙区域分开。
[0232]
实施方案32.实施方案1至31中任一个的方法,其中各个所述特征包括珠、孔、通道、脊、突起或它们的组合。
[0233]
实施方案33.实施方案1至2中任一个的方法,其中所述扩增位点的阵列包括溶液中的珠或表面上的珠。
[0234]
实施方案34.实施方案1至3中任一个的方法,其中等温发生被转运至所述扩增位点的所述靶核酸的扩增。
[0235]
实施方案35.实施方案1至34中任一个的方法,其中被转运至所述扩增位点的所述不同的经修饰的靶核酸的扩增不包括变性循环。
[0236]
实施方案36.实施方案1至35中任一个的方法,其中包含扩增子的克隆群体的所述多个扩增位点超过在(b)期间所述不同的经修饰的靶核酸具有流体通路的所述扩增位点的40%。
[0237]
实施方案37.实施方案1至36中任一个的方法,其中在(b)期间分别从所述个别扩增位点处的所述个别靶核酸产生足够数目的扩增子,以填充相应扩增位点的容量。
[0238]
实施方案38.实施方案1至37中任一个的方法,其中产生所述扩增子以填充相应扩增位点的容量的速率小于分别将所述个别靶核酸转运至所述个别扩增位点的速率。
[0239]
实施方案39.实施方案1至38中任一个的方法,其中所述转运包括被动扩散。
[0240]
实施方案40.实施方案1至39中任一个的方法,其中所述扩增试剂还包含聚合酶和重组酶。
[0241]
实施方案41.用于产生文库的方法,其包括:
[0242]
提供多个双链靶核酸的溶液;
[0243]
将通用衔接子连接至所述双链靶核酸的两端,以形成第一多个经修饰的靶核酸,
[0244]
其中各个所述经修饰的靶核酸包含侧翼有所述通用衔接子的靶核酸,
[0245]
其中所述通用衔接子包含(i)双链核酸区,和(ii)包含3’端的通用捕获结合序列的单链非互补核酸链区,
[0246]
其中所述通用捕获结合序列包含异质群体,并且
[0247]
其中所述连接将所述通用衔接子的所述双链核酸区共价附着于所述双链靶片段的各端。
[0248]
实施方案42.实施方案41的方法,其中3’端的所述通用捕获结合序列的异质群体的成员彼此相差1个、2个或3个核苷酸。
[0249]
实施方案43.实施方案41或42的方法,其中3’端的所述通用捕获结合序列的异质群体的成员具有彼此相差1至12个核苷酸的长度。
[0250]
实施方案44.实施方案41至43中任一个的方法,其中3’端的所述通用捕获结合序列的异质群体的成员彼此相差1个、2个或3个核苷酸,彼此相差1至12个核苷酸,或它们的组合。
[0251]
实施方案45.实施方案41至44中任一个的方法,其中所述单链非互补核酸链区包含5’端的第二通用捕获结合序列。
[0252]
实施方案46.实施方案41至45中任一个的方法,其中5’端的所述第二通用捕获结合序列的异质群体的成员彼此相差1个、2个或3个核苷酸。
[0253]
实施方案47.实施方案41至46中任一个的方法,其中5’端的所述第二通用捕获结合序列的异质群体的成员具有彼此相差1至12个核苷酸的长度。
[0254]
实施方案48.实施方案41至47中任一个的方法,其中5’端的所述第二通用捕获结合序列的异质群体的成员彼此相差1个、2个或3个核苷酸,彼此相差1至12个核苷酸,或它们的组合。
[0255]
实施方案49.组合物,其包含扩增位点的阵列和结合至扩增位点的至少一种靶核酸,
[0256]
其中所述扩增位点包含两个捕获核酸群体,各个群体包含捕获序列,
[0257]
其中第一群体包含第一捕获序列,并且第二群体包含第二捕获序列,
[0258]
其中所述靶核酸在3’端包含第一通用捕获结合序列,其比与所述第一捕获序列具有100%互补性的第一通用捕获结合序列具有更小的对所述第一捕获序列的亲和力,
[0259]
其中所述靶核酸通用捕获结合序列与所述第一捕获序列杂交。
[0260]
实施方案50.实施方案49的组合物,其中所述第一通用捕获结合序列与所述第一捕获序列具有小于100%的互补性。
[0261]
实施方案51.实施方案49或50的组合物,其中所述第一通用捕获结合序列包含与所述第一捕获序列不互补的1个、2个或3个核苷酸。
[0262]
实施方案52.实施方案49至51中任一个的组合物,其中所述阵列的所述扩增位点的至少30%被至少一种靶核酸占据。
[0263]
实施方案53.实施方案49至52中任一个的组合物,其中所述第一通用捕获结合序列包含异质群体,其中所述异质群体包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有(i)与所述第一捕获序列不互补的1个、2个或3个核苷酸,或(ii)与所述第一捕获序列的100%互补性,并且其中所述异质群体的成员与不同的扩增位点结合。
[0264]
实施方案54.实施方案49至53中任一个的组合物,其中与所述第一捕获序列具有100%互补性的所述异质群体的成员以比所述异质群体的其他成员更多的数目存在。
[0265]
实施方案55.实施方案49至54中任一个的方法,其中所述第二通用捕获结合序列具有比所述第二捕获序列的长度更小的长度。
[0266]
实施方案56.实施方案49至55中任一个的组合物,其中所述第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸的长度。
[0267]
实施方案57.实施方案49至56中任一个的组合物,其中所述组合物包含多个不同的靶核酸,所述不同的靶核酸包含第一通用捕获结合序列的异质群体,其中所述异质群体包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有比所述第一捕获序列的长度小1至12个核苷酸。
[0268]
实施方案58.实施方案49至57中任一个的组合物,其中所述异质群体还包含个别的第一通用捕获结合序列,所述第一通用捕获结合序列具有(iii)比所述第一捕获序列的长度更小的长度。
[0269]
实施方案59.实施方案49至58中任一个的组合物,其中包含缩短长度的个别的第一通用捕获结合序列具有比所述第一捕获序列的长度小1至12个核苷酸的长度。
[0270]
实施方案60.实施方案49至59中任一个的组合物,其中具有缩短长度的所述异质群体的个别成员包含与所述第一捕获序列的序列不互补的1个、2个或3个核苷酸,或与所述第一捕获序列的序列的100%互补性。
[0271]
实施方案61.实施方案49至60中任一个的组合物,其中所述组合物包含多个不同的靶核酸,所述不同的靶核酸在5’端包含具有互补物的第二通用捕获结合序列,其比具有与所述第二捕获序列具有100%互补性的互补物的第二通用捕获结合序列具有更小的对所述第二捕获序列的亲和力。
[0272]
实施方案62.实施方案49至61中任一个的组合物,其中所述第二通用捕获结合序列的互补物与所述第二捕获序列具有小于100%的互补性。
[0273]
实施方案63.实施方案49至62中任一个的组合物,其中所述第二通用捕获结合序列的互补物包含与所述第二捕获序列不互补的1个、2个或3个核苷酸。
[0274]
实施方案64.实施方案49至63中任一个的组合物,其中所述组合物包含多个不同的靶核酸,所述不同的靶核酸包含第二通用捕获结合序列的异质群体,其中所述异质群体包含个别的第二通用捕获结合序列,所述第二通用捕获结合序列包含互补物,所述互补物具有(i)与所述第二捕获序列不互补的1个、2个或3个核苷酸,或(ii)与所述第二捕获序列的100%互补性。
[0275]
实施方案65.实施方案49至64中任一个的组合物,其中包含与所述第二捕获序列具有100%互补性的互补物的所述异质群体的成员以比所述异质群体的其他成员更多的数目存在。
[0276]
实施方案66.实施方案49至65中任一个的组合物,其中所述靶核酸在5’端包含第二通用捕获结合序列,所述第二通用捕获结合序列具有比所述第二捕获序列的长度更小的长度。
[0277]
实施方案67.实施方案49至66中任一个的组合物,其中所述第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸的长度。
[0278]
实施方案68.实施方案49至67中任一个的组合物,其中所述组合物包含多个不同的靶核酸,所述不同的靶核酸包含第二通用捕获结合序列的异质群体,其中所述异质群体包含个别的第二通用捕获结合序列,所述第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸。
[0279]
实施方案69.实施方案49至68中任一个的组合物,其中所述异质群体还包含个别的第二通用捕获结合序列,所述第二通用捕获结合序列具有(iii)比所述第二捕获序列的长度更小的长度。
[0280]
实施方案70.实施方案49至69中任一个的组合物,其中个别的第二通用捕获结合序列具有比所述第二捕获序列的长度小1至12个核苷酸的长度。
[0281]
实施方案71.实施方案49至70中任一个的组合物,其中具有比所述第二捕获序列的长度小的长度的所述异质群体的个别成员包含互补物,所述互补物包含与所述第二捕获序列的序列不互补的1个、2个或3个核苷酸,或与所述第二捕获序列的序列的100%互补性。
[0282]
实施方案72.实施方案49至71中任一个的组合物,其中所述靶核酸是dna。
[0283]
实施例
[0284]
通过以下实施例阐述本发明。应当理解的是,具体的实例、材料、数量和程序将根据本文所述的本发明的范围和精神来广义地解释。
[0285]
实施例1
[0286]
一般测定方法和条件
[0287]
除非另有说明,这描述了本文所述实施例中使用的一般测定条件。
[0288]
以标准nextera
tm
文库制备开始以通过人gdna的标签片段化(tagmentation)引入衔接子的通用部分来生成核酸文库。然后,将此种通用标签片段化分到个别反应中,各个不同的衔接子对(pcr1
‑
pcr21)有1个。在这些中的各个反应中,使用nextera
tm
xt文库制备试剂(illumina公司,sandiego,california)通过12个pcr循环引入经修饰的衔接子,通过用经修饰的衔接子替换标准p5/p7衔接子进行。设计与标准p5/p7序列(如下概述)具有变化的经修饰的衔接子,并由integrated dna technologies(idt公司,skokie,illinois)合成。
[0289]
实施例2
[0290]
对衔接子突变体评估动力学延迟
[0291]
将一系列经修饰的衔接子用于生成与标准nextera
tm
文库(表1)不同的文库。这些衔接子比标准物略短(
‑
4bp或
‑
9bp),或者具有沿p5/p7区的长度引入的1个、2个或3个错配(“摆动”碱基:分别为1w,2w或3w)。突变的范围是从完美的p5&p7序列(pcr1)到两端的3个错配(pcr 21)。
[0292]
然后量化每个文库的浓度,并将文库相对于相同浓度标准化。然后,使用用于illumina平台的kapa文库定量试剂盒(kapa biosystems)与定制引物在qpcr仪(biorad cfx384实时系统)上分别扩增具有不同的经修饰的衔接子的文库,以模拟流动池的条件来生成表1中的结果。根据达到qpcr标准定义的ct(阈值循环)所需的循环数目计算效率。
[0293]
表1.
[0294]
[0295][0296]
αβ
‑
4是指从衔接子上去除的四个碱基对;αβ
‑
9是指从衔接子上去除的九个碱基对;1w,2w,3w分别指1个、2个或3个摆动错配,沿着与阵列表面上存在的捕获核酸结合的区域的长度存在;1mm,真实错配;fcp5,fcp7,分别指全长p5和p7引物。
[0297]
实施例3
[0298]
使用测序评估衔接子突变体的动力学延迟
[0299]
选择了不同的突变体衔接子,并且单独或成组地在hiseq
tm
x流动池上运行(表2)。使用标准试剂盒在illumina hiseq
tm
x仪上进行所有测序。
[0300]
表2
[0301][0302][0303]
结果
[0304]
如图3a所示,泳道1、2和4是使用具有较少错配和较高效率的衔接子进行的反应,并且如预期导致高强度和通过过滤器的簇的高百分比。泳道3和5是使用具有更多错配和较低效率的衔接子进行的反应,如预期导致低强度和通过过滤器的簇百分比低。泳道6、7和8是具有高效率和低效率的衔接子的混合。违反直觉地,混合物不与个别组分的表现的平均值(例如,在高效率和低效率之间的中间)一样表现,而是在强度和通过过滤器的簇两者上优于所有单一类型的文库。因此,令人惊讶的结果是通过降低平均同源性,即使扩增的平均速率降低,纳米孔的所谓单克隆性的速率得到改善。新颖之处在于将一定程度的可变性引入衔接子序列中,从而模板群体中现在存在一定效率范围。以此方式,当将多个模板接种到垫层时,通常有一种模板比所有其他模板有优势,使得它明显在垫层上占优势。此外,降低的同源性在子代拷贝中得以校正,使得延迟仅引入至第一拷贝,而不影响随后扩增的效率。
[0305]
选择不同的突变体衔接子,并且单独或成组地在hiseq
tm
x流动池上运行(表3)。如上所述,使用标准试剂盒在illumina hiseq
t
mx仪器上进行所有测序。
[0306]
表3
[0307]
流动池的泳道在泳道中使用的衔接子泳道1pcr 1泳道2pcr 3泳道3pcr 10泳道4pcr 16泳道5pcr 1,3,6,8,9,10,16
‑
18泳道6pcr 21泳道7pcr 1,3,6,8,9,10,16
‑
18泳道8pcr 1,3,10
[0308]
当一组突变体衔接子在混合物(如泳道7)中运行时,它们以相等的浓度组合。在常规测序运行中,即不使用所提出的方法,相同浓度的相同衔接子的混合文库将导致流动池上的读段比率相等。如图3b所示,不同突变体衔接子的混合物得到最终读段计数的表示,其与它们的效率而非它们的接种浓度成正比,因此证明所提出方法的功效,即具有较低亲和力的衔接子具有更长的动力学延迟,这导致最终读段的较低比例。
[0309]
本文中引用的所有专利、专利申请和出版物以及电子可获得的材料(包括例如在例如genbank和refseq中的核苷酸序列提交以及在例如swissprot,pir,prf,pdb中的氨基酸序列提交,以及来自genbank和refseq中带注释的编码区的翻译)的完整公开通过引用整体并入。出版物中引用的补充材料(例如补充表,补充图,补充材料和方法和/或补充实验数据)同样通过引用完整并入。在本申请的公开与通过引用并入本文的任何文件的公开之间存在任何不一致的情况下,以本申请的公开为准。仅出于清楚理解的目的给出了前面的详细描述和示例。不应从它们理解不必要的限制。本公开不限于所示出和描述的确切细节,对于本领域技术人员显而易见的变化将包括在由权利要求书限定的本公开之内。
[0310]
除非另有说明,否则在说明书和权利要求书中使用的所有表示组分数量,分子量等的数字在所有情况下均应理解为由术语“约”修饰。因此,除非另有相反指示,否则说明书和权利要求书中列出的数字参数是近似值,其可以根据本公开试图获得的期望性质而变化。无论如何,不作为将等同原则限于权利要求范围的尝试,每个数字参数应至少根据所报
告的有效数字的数目并通过应用普通的舍入技术来解释。
[0311]
尽管阐述本公开的广泛范围的数值范围和参数是近似值,然而在具体实施例中阐述的数值尽可能精确报告。然而,所有数值固有含有一定范围,该范围必然是由存在于它们各自的测试测量中的标准偏差得出的。
[0312]
除非另有说明,否则所有标题都是为了方便读者阅读,并且不应用于限制标题后面的文本的含义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1