用于核酸治疗的可控偶联多肽纳米颗粒导入系统的组合物及方法与流程
用于核酸治疗的可控偶联多肽纳米颗粒导入系统的组合物及方法
1.相关专利申请的交叉引用
2.本申请旨在获得美国专利申请号为62/676,218的权益和优先权,该专利申请日期为2018年5月24日,其全文以引用方式并入本文中。
发明领域
3.本发明涉及特定的肽和多肽,这些肽和多肽用于制备将核酸和治疗药物输送到哺乳动物细胞、人体内、及其他哺乳动物的纳米颗粒。
4.发明背景
5.自从在哺乳动物中发现功能性rnai途径以来,作为鉴定基因功能的一种方法,rnai已经为反向遗传学提供了强大的工具,此外包括核苷酸类药物在内的潜在新型生物药物,如microrna(mirna)、小干扰rna(sirna)和dna疫苗等药物所具备的rnai潜力使其能够沉默任何基因,并使rnai成为一种极具吸引力的治疗方式。近年来,sirna药物因其特异性的序列转录体内后的基因沉默能力,已成为极具前景的新型治疗候选药物,可用于治疗诸如癌症、传染病、黄斑衰退症、心血管疾病、神经系统疾病和其它基因相关疾病。因其能够降低任何基因的表达,sirna药物被誉为可治疗包括"不可成药"靶标在内的多种疾病的理想候选药物。
6.然而,限制rnai药物进入临床应用的主要挑战是需要一个有效的转运载体(导入/递送系统),这一转运载体必须能够有效保护和转运其所载物,并且到达靶标细胞外后,必须能够穿过细胞质膜,并且进入rnai发挥作用的场所——细胞质。将sirna递送到细胞质中的主要障碍包括:(a)活细胞对蛋白质和寡核苷酸等大分子的渗透性性很低;(b)细胞膜通常具有整体带负电荷的双层结构,因此带负电荷的sirna很难渗透并跨过细胞膜进入胞内;(c)sirna药物的稳定性较低,因此在很短的时间内会被体内高浓度血浆中存在的各种酶降解;(d)另一个重要的方面是,sirna转运复合物在细胞内的内涵体逃逸,使sirna药物从内涵体转移到细胞质,实现与其靶基因相应的mrna结合;(e)sirna可能被机体识别为异物,并诱发不良的免疫效应。理想的递送系统应能解决这些技术挑战中的大部分,以达到预期的治疗效果。
7.近年来,含有可电解的阳离子脂质的脂质纳米颗粒(lnp),如1,2
‑
二林酰氧基
‑3‑
二甲基氨基丙烷(dlindma)已被用于将sirna递送到肝脏。这类导入载体相关药物目前有20多项临床研究正在进行,以评估sirna的临床应用。sirna局部导入的例子包括:通过眼部途径治疗老年性黄斑衰退症[amd](quark制药,促血管新生因子,2期);通过表皮给药治疗先天性骨质增生症[pc](transderm;角蛋白6a基因,1b期);通过肺部途径治疗哮喘(zabecor制药;酪氨酸蛋白激酶,2期);通过鼻腔途径治疗呼吸道合胞病毒[rsv](alnylam制药;rsv核衣壳蛋白,2期);以及通过口服途径治疗家族性腺瘤性息肉病(marina biotech,β
‑
连环蛋白,i/2期)。sirna的系统导入的例子包括:使用阳离子脂质纳米颗粒稳定核酸脂质颗粒(snalp)
[1,2]
治疗实体瘤(tekmira制药;马球样激酶1[plk1],1期)和肝细胞癌(alnylam制
药;血管内皮生长因子[vegf]和激肽纺锤蛋白[ksp],1期)
[3]
。此外,arrowhead research(calando制药)公司利用胆固醇结合的sirna开发了一种用于乙肝病毒(hbv)感染的动态多聚缀合物递送系统(dpc)(i期临床试验)
[4]
。在该递送系统中,sirna与聚乙二醇(peg)和n
‑
乙酰半乳糖胺的肝细胞靶向配体一起,通过可逆的二硫键联结到两性聚乙醚(pbave)上。与其他方法相比,纳米颗粒递送系统具有明显的优势。
[5]
总体而言,在各种新兴的递送平台中,脂质纳米颗粒(lnp)已经成为系统性递送sirna的最先进的递送平台之一。
[6]
[0008]
最近,圣诺制药(盖瑟斯堡,马里兰州)开发了一种富含组氨酸
‑
赖氨酸的多肽导入系统,用于系统性递送双sirna(转化生长因子
‑
β,tgf
‑
β1,和环氧酶
‑
2,cox
‑
2),以达到协同作用,用于减少和预防增生性瘢痕(2期,临床试验)以及肝纤维化疾病或其他纤维化疾病的治疗
[7,8]
。在该导入系统中,主要通过静电相互作用和氢键,使带正电荷的多肽和带负电荷的sirna之间形成稳定的纳米颗粒。在目前的临床试验中表现出了良好的安全性和有效性,它是一类新型的导入系统,用于递送多序列特异性靶向sirna,以达到双重治疗目的,用于治疗各种疾病。
[9]
[0009]
本发明包括一种生物可降解多肽(称为“hkc2
‑
核酸递送系统”),其中生物相容性多肽通过特定的非共价相互作用与核酸络合形成纳米颗粒。该多肽在生物相容的条件下,通过富含组氨酸
‑
赖氨酸多肽中的可生物解离的共价键自交联。这种整体设计和导入系统提高了核酸的体内稳定性和递送效率,可以作为在特定组织中获得沉默的有效手段。hkc2
‑
核酸递送系统是一种适用于各种疾病治疗的新型纳米颗粒转运载体,其机制是通过使核酸与单独的hkc2肽复合,或由多分支肽(hkp)组成的共递送制剂存在下发挥功能。这种多肽具有适当的正电荷,并具有可进一步修饰的官能团,以实现靶向特异性和降低毒性。
[0010]
图示简介
[0011]
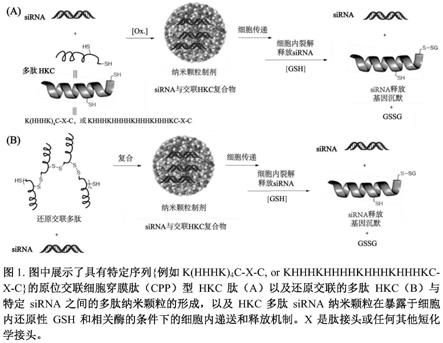
图1.多肽纳米颗粒形成。(a)为具有特定肽序列的原位交联细胞穿膜肽(cpp)hkc肽,如k(hhhk)4c
‑
x
‑
c,或khhhkhhkhhkhhkc
‑
x
‑
c;(b)为已经交联的多肽和选定的sirna,及其在细胞内的递送,以及hkc多肽
‑
sirna纳米颗粒暴露于细胞内的还原性gsh及其酶促产物作用下的细胞内释放机制。x是肽序列内的连接体,也可以是短的化学连接体。
[0012]
图2a.a)hkp(h3k4b)和hkp(+h)支链肽的结构,b)h3k4c2(缩写为hkc2)末端伴有两个半胱氨酸位点的结构,c)hkc的一般结构。
[0013]
图2b.hkc2的hplc色谱图和积分表,该洗脱方法在c18反相柱上运行,峰保留时间为8.053,或在水(0.065%tfa)和乙腈(0.05%tfa)之间产生的梯度>91%。
[0014]
图2c.hkc2的质谱(esi
‑
ms,正),展示了在1343[m]
2+
处观察到的双电荷分子离子峰。
[0015]
图3.图中显示了hkc多肽交联形成和降解的机制,主要通过使用氧气或dmso氧化性成交联,在谷胱甘肽还原条件下发生降解。
[0016]
图4.图中显示,通过暴露于多肽纳米颗粒pnp表面的游离硫醇的硫醇
‑
马来酰亚胺反应进行hkc2、以及hkc2连接功能化靶向配体后的设计,该多肽可以与sirna形成复合物,促使药物有针对性地递送到有特定受体的细胞内。进入细胞后,细胞内gsh(谷胱甘肽)对s
‑
s键的裂解释放出sirna,使sirna的目标基因表达得以沉默。
[0017]
图5.使用动态光散射(dls)仪测量hkc2和tgf
‑
β1之间形成的多纳米颗粒的尺寸分布。使用90plus纳米粒度分布分析仪(布鲁克海文仪器有限公司,纽约)测量hkc
‑
sirna颗粒
的大小。将tgf
‑
β1(25ng/μl,溶于水)的溶液加入hkc2(300ng/μl,溶于水),并在室温下混合,剧烈搅拌,并在测量前放置30分钟。通过将混合物稀释到比色皿的2.0ml体积来测量dls。结果表明,随着hkc2和sirna比例的增加,hkc
‑
sirna纳米颗粒的平均尺寸在64nm至206nm之间,zeta电位值为+10。
[0018]
图6.使用dls测量hkc2和tgf
‑
β1sirna之间的多聚体颗粒的大小分布。将tgf
‑
β1sirna(25ng/μl,溶于水)加入hkc2(25ng/μl,溶于水)中,并在室温下混合,剧烈搅拌,放置30分钟后,在2.0ml体积比色皿中稀释所得混合物后测量dls。
[0019]
图7.评估hkc2作为sirna载体。hek293细胞以每孔3
×
104个细胞的速度接种在48孔板中,孵育过夜。af488标记的sirna/hkc2复合物的制备方法如下:将sirna(0.025μg/μl,21个核苷酸长度)和hkc2(0.05μg/μl)的水溶液按以下hkc2:sirna的质量比进行组合,分别为1:1、1.7:1、2:1、4:1、8:1和1:2。30分钟后,将sirna/hkc2复合物加入到前一天孵育的细胞中,转染后24h拍摄荧光图像。
[0020]
图8.hkc2介导的荧光标记的sirna(alexa fluor 488)输送到a549细胞中。在转染前一天将a549细胞以3
×
104个细胞/孔的密度接种在48孔板的孔中,孵育过夜。af488标记的sirna/hkc2复合物的制备方法如下:将sirna(25ng/μl,21个核苷酸长度)和hkc2(50ng/μl)的水溶液按以下hkc2:sirna的比例混合,分别为1:1、1.7:1、2:1、4:1、8:1和1:2。在30分钟内,将sirna/转染试剂复合物加入到前一天孵育的细胞中,转染后24h拍摄荧光图像。
[0021]
图9.使用凝胶阻滞分析测定法确定可抑制sirna迁移的hkc2量。制备不同比例的hkc2与sirna(tgf
‑
β1,500ng)的复合物,并进行了30分钟的凝胶电泳(3%凝胶)。凝胶上方表示hkc与sirna的不同比例。在实际操作中,将25ng/μl的sirna与不同量的hkc2以1:2、1:1、1.5:1、2:1、3:1、4:1的比例和参考hkp(4:1)进行孵育。孵育20分钟后,在孔中装载20μl sirna/肽(每个含500ng sirna)复合物,用溴化乙锭rna染料对凝胶进行预染,然后在100v下,3.0%的非变性琼脂糖凝胶上分离游离和结合的sirna 30分钟,用富士las4000成像仪观察uv=290nm处所产生的荧光带,呈现的结果代表了观察到的图像。
[0022]
图10.使用凝胶阻滞分析测定法验证可降解的hkc在存在谷胱甘肽(gsh)的情况下可释放sirna。制备不同比例的hkc2或hkp与sirna(tgf
‑
β1,500ng)的复合物,并进行凝胶电泳30分钟(3%凝胶)。凝胶上方表示hkc2与sirna的不同比例。在实际操作中,将25ng/μl的sirna与不同量的交联hkc2多肽以4:1和8:1的比例和参考hkp(4:1)或产物在20mm谷胱甘肽(gsh)存在或不存在的情况下进行孵育。孵育40分钟后,将20μl的sirna/肽(每种sirna各500ng)复合物装入凝胶孔中,用溴化乙锭rna染料对凝胶进行预染,然后在100v电压下,3.0%的琼脂糖凝胶上分离游离和结合的sirna 30分钟,用富士las4000成像仪观察uv=290nm处所产生的荧光带,呈现的结果代表了观察到的图像。
[0023]
图11.hkc2:hkp:tgf
‑
β1形成纳米颗粒制剂的尺寸分布。其中hkc2=k(hhhk)4cssc,hkp=h3k4b。tgf
‑
β1用水稀释成80ng/μl,并与等体积的hkc和hkp在水中混合。分析hkc2、hkp和sirna(tgf
‑
β1)在各自不同比例下形成的纳米颗粒。在hkp/sirna配方中加入hkc2后,保持了相似的纳米颗粒大小,但与对照组hkp/sirna相比,多分散性指数(pdi)降低(n:p质量比=4:1),尺寸范围也显著缩小了。hkc2/hkp/sirna按质量比0:4:1、1:4:1、1:3:1、2:3:1、2:2:1、3:1:1配制,然后将hkc2(160ng/μl)、hkp(320ng/μl)和sirna(80ng/μl)的水溶液按规定比例混合,并在室温下孵育30分钟,随后使用nanoplus 90通过动态光散射测
量所得样品,记录的动态半径如图11显示。
[0024]
图12.hkc2:hkp:tgf
‑
β1形成纳米颗粒制剂的多分散性。其中hkc2=k(hhhk)4cssc,hkp=h3k4b。tgf
‑
β1用水稀释成80ng/μl,并与等体积的hkc和hkp在水中混合。分析hkc2、hkp和sirna(tgf
‑
β1)在各自不同比例下形成的纳米颗粒。与对照组hkp/sirna相比,在hkp/sirna配方中加入hkc2可保持相似的纳米颗粒大小,但多分散度指数(pdi)(n:质量比=4:1)显著变小。hkc2/hkp/sirna按质量比0:4:1、1:4:1、1:3:1、2:3:1、2:2:1、3:1:1配制,然后将hkc2(160ng/μl)、hkp(320ng/μl)和sirna(80ng/μl)的水溶液按规定比例混合,并在室温下孵育30分钟,随后使用nanoplus 90通过动态光散射测量所得样品,记录的动态半径如图12显示。
[0025]
图13.单独使用celldeath sirna配制的hkp,或与不同量的hkp和hkc组合处理,对人胶质母细胞瘤t98g细胞系的治疗效果。采用不同质量比的hkp/hkc2/sirna的同时也用脂质体转染作对照。首先将hkc(160ng/μl)的水溶液加入sirna(80ng/μl)的水溶液中,混合,短暂漩涡振荡,然后以同样的方式加入hkp(320ng/μl),混合物在室温下孵育30min。将转染复合物用opti
‑
mem稀释后,加入到100μl培养基中的细胞中,提供新鲜培养基,孵育6小时后,用10%fbs/dmem或emem替换转染培养基,转染后72h,用celltiter
‑
glo发光细胞活力测定法(promega)评估有活力细胞的数量。未经处理的细胞(空白)的值设置为100%,所有数值均代表四个重复的平均值
±
s.d.。ns=non
‑
silencing sirna,即非沉默型sirna。cd=celldeath sirna,即细胞凋亡型sirna。
[0026]
图14.单独使用celldeath sirna配制的hkp,或与不同量的hkp和hkc组合处理,对人肝癌hepg2细胞系的治疗效果。采用不同质量比的hkp/hkc2/sirna的同时也用脂质体转染作对照。首先将hkc(160ng/μl)的水溶液加入sirna(80ng/μl)的水溶液中,混合,短暂漩涡振荡,然后以同样的方式加入hkp(320ng/μl),混合物在室温下孵育30min。将转染复合物用opti
‑
mem稀释后,加入到100μl培养基中的细胞中,提供新鲜培养基,孵育6小时后,用10%的fbs/dmem或emem替换转染培养基,转染后72h,用celltiter
‑
glo发光细胞活力测定法(promega)评估有活力细胞的数量。未经处理的细胞(空白)的值设置为100%,所有数值均代表四个重复的平均值
±
s.d.。ns=non
‑
silencing sirna,即非沉默型sirna。cd=celldeath sirna,即细胞凋亡型sirna。
[0027]
发明部分的描述
[0028]
本发明提供了特定的肽和多肽以用于制备纳米颗粒,此纳米颗粒可以用于将核酸和药物递送到哺乳动物的细胞、以及人类和其他哺乳动物的体内。
[0029]
肽
[0030]
本发明包含一种结构式为:kp{[(h)n(k)m]}y
‑
c
‑
x
‑
z或为:kp{[(h)a(k)m(h)b(k)m(h)c(k)m(h)d(k)m]}y
‑
c
‑
x
‑
z的肽。其中k表示是赖氨酸,h是组氨酸,c是半胱氨酸,x是连接子(连接器),z是哺乳动物细胞靶向配体,p为0或1,n是范围为1
‑
5的整数(优先为3),m是范围为0
‑
3的整数(优先为0或1),a、b、c和d为3或4,y是从3
‑
10的整数(优先为4或8)。在一种实施的方案中,肽的结构式为k[(h)n(k)m]y
‑
c
‑
x
‑
c,其中k是赖氨酸,h是组氨酸,c是半胱氨酸,n表示为1至5的整数(优先为3),m表示为0至3的整数(优先为0或1),y是3至7的整数(优先为4),x表示是连接子。发明中的肽可以是直链,也可以是支链的。它们能够被导入进哺乳动物细胞,优先可导入的是人类细胞,例如人类的肿瘤细胞。
[0031]
哺乳动物细胞靶向配体(z)为肽、蛋白、抗体、小分子、碳水化合物部分或寡核苷酸等。靶向配体是一种能够与特定细胞表面上的特异性受体相结合的分子,并且可以使其所载的物体进入细胞内部。
[0032]
在一种实施例中,z表示为长度为1至60个氨基酸的肽。在这个方案的一种情况下,z表示一个氨基酸,优先为半胱氨酸(c)。在其它情况,如果z为超过几个氨基酸的肽,它可能包含几个惰性氨基酸(例如丝氨酸)的“间隔区”。z还可包括靶向哺乳动物细胞表面上受体的肽配体(例如转铁蛋白受体、egfr或glp1r)。有许多受体仅在特定的细胞类型上表达,并且任何能够结合这些受体的配体都可以帮助sirna特异性地向表达该受体的细胞导入。
[0033]
在一种实施例中,x是单个氨基酸残基,或具有2至15个氨基酸的肽序列。在该实施例的一方面,该肽序列具有3至8个氨基酸。
[0034]
此发明也包括一种结构为k[(h)n(k)m]y
‑
c的肽,其中k表示是赖氨酸,h表示是组氨酸,c表示是半胱氨酸,n表示为1至5的整数(优先为3),m表示为0至3的整数(优先为0或1),y是3至7的整数(优先为4)。
[0035]
多肽
[0036]
本发明包括一种多肽,该多肽包含通过二硫键交联的上述至少两个肽。此多肽可以是直链也可以是支链的。所述键是可被生物降解的半胱氨酸二硫键。另外,可生物降解的半胱氨酸二硫键能够被任何可裂解的键代替,可裂解的键包括但不限于酸酐键、肼键、酶特异性肽键或其组合。
[0037]
纳米颗粒
[0038]
本发明包含一种或多种包含上述多肽和核酸的纳米颗粒。纳米颗粒可包括组氨酸
‑
赖氨酸共聚物,双链核酸和/或药物。纳米颗粒能够被导入到哺乳动物细胞内。在一种实施例中,多肽和纳米颗粒在哺乳动物细胞中是可被生物降解的,例如通过细胞内的谷胱甘肽还原、酶或ph改变来实现。方案包含两个方面:其一,纳米颗粒尺寸为50至300nm;其二,纳米粒度为80至130nm,它的多分散指数为0.2或更低。
[0039]
核酸包含sirna、mirna、反义寡核苷酸、质粒、mrna、rna酶、dna酶、或者适配体序列。
[0040]
在一种实施例中,核酸包含一种sirna。如本发明中,“sirna”或“sirna分子”是双链体寡核苷酸,是一种短的双链多核苷酸,在将分子引入细胞后,sirna分子会干扰细胞中产生信使rna的所对应基因的表达。例如,sirna分子靶向结合单链目标rna分子中的互补核苷酸序列,例如mrna或微小rna(mirna),然后目标rna被降解。这些分子由本领域的专业技术人员所设计。这些技术方法分别在美国和欧洲的专利中进行了描述,专利号为分别为:(美国专利号)no.5898031、6107094、6506559、7056704、re46873e和9642873b2;(欧洲专利号):no.1214945和1230375。所有的这些技术都通过引用整合并入本发明中。按照本领域的惯例,当sirna分子识别特定核苷酸序列时,该序列是指双链体分子的有义链。
[0041]
sirna分子可以从天然存在的核糖核苷酸中获得,即在活细胞中发现的核糖核苷酸,或一个或多个单核苷酸可以通过本领域已知的技术方法进行化学修饰获得。除了在一个或多个核苷酸的水平上被修饰之外,寡核苷酸的主链也可以被修饰。其他的修饰还包括使用小分子(例如糖分子)、氨基酸分子、肽、胆固醇以及其他大分子缀合到sirna分子上。
[0042]
在一种实施例中,sirna分子是具有16至27个碱基对长度的双链寡核苷酸。此方案
的一种情况,sirna分子是长度为约19至约27个碱基对的寡核苷酸。另一种情况,sirna子是长度为约21至约25个碱基对的寡核苷酸。在所有这些方面中,分子可以在两端具有平末端,或在两端具有粘性末端,或在一端具有平末端而在另一端具有粘性末端。在该实施例的一方面,粘性末端具有1至3个核苷酸的突出。另一方面,核酸包含在本文表1至3中所确定的sirna分子。
[0043]
本发明中的sirna分子包括衍生自表1
‑
3中所确定的那些分子。这些sirna分子包括:a)由表1
‑
3中任一双链体的24个连续碱基对组成的衍生双链体;b)由表1
‑
3中任一双链体的23个连续碱基对组成的衍生双链体;c)由表1
‑
3中任一双链体的22个连续碱基对组成的衍生双链体;d)由表1
‑
3中任一双链体的21个连续碱基对组成的衍生双链体;e)由表1
‑
3中任一双链体的20个连续碱基对组成的衍生双链体;f)由表1
‑
3中任一双链体的19个连续碱基对组成的衍生双链体;g)由表1
‑
3中任一双链体的18个连续碱基对组成的衍生双链体;h)由表1
‑
3中任何一双链体的17个连续碱基对组成的衍生双链体;i)由表1
‑
3中任一双链体的16个连续碱基对组成的衍生双链体。
[0044]
本发明的组氨酸
‑
赖氨酸共聚物(hkp)公开于2006年7月4日授权的美国专利7070807b2,公开于2007年1月16日授权的美国专利7163695b2、公开于2010年8月10日授权的美国专利7772201b2,公开于2018年5月29日授权的美国专利re46873e和公开于2017年5月9日授权的美国专利9642873b2。所有这些专利都通过引用整合并入本发明中。在一个实施例中,该共聚物包含h3k4b。在另一个实施例中,还包括hkp(+h),见图2a。
[0045]
在一种实施例中,纳米颗粒还包括通过部分游离的硫醇基残基连接的官能团。在该实施例的一种情况,巯基残基位于纳米颗粒的表面上,这是在纳米粒子形成后添加的。在此实施例另一种情况,巯基残基位于肽序列内的胞嘧啶侧链上,这是在纳米粒子形成之前添加的。
[0046]
本发明的官能团选自小分子(例如阿霉素或吉西他滨等,可以与细胞表面受体结合的分子或内化时可以诱导细胞杀伤的分子),或一种保护性聚乙二醇(peg)分子,脂质,肽或蛋白质(例如抗体),或寡核苷酸(例如sirna分子的适配体或它的一条链),以及具有识别去唾液酸糖蛋白受体(asgpr)的碳水化合物结合位点的有机分子(例如,galnac,甘露糖6p,无唾液酸铁蛋白等)。肽/蛋白质/碳水化合物糖基团以及其他实体对离散细胞上存在的受体具有亲和力,并允许纳米颗粒与这些细胞结合,同时纳米颗粒被吸收到这些细胞内。例如,galnac与肝细胞上的asgpr结合,并且其已显示出对肝脏内肝细胞的特异性。在一个特定方面,该官能团是一种保护性聚乙二醇分子,以帮助改善生物分布或最小化与细胞的非特异性结合。
[0047]
在另一种实施例中,纳米颗粒中包含一种药物。在此实施例的一方面,包含的药物选自小分子药物、肽药物以及蛋白药物。
[0048]
制作方法
[0049]
本发明中公开的方法,由本领域技术人员通过已知的技术制备本发明的肽和多肽。在一种实施例中,通过以下步骤的方法制备肽:a)将初始赖氨酸连接至固体支持物;b)将另外的氨基酸一个接一个地连接到初始赖氨酸上;c)回收合成的肽。在一种实施例中,通过以下步骤的方法制备多肽:a)通过化学氧化使本发明的肽交联,以形成具有可裂解键的多肽,b)回收所制备的多肽。在该实施例的一方面,可裂解键是二硫键。
[0050]
鉴于本文公开的方法,由本领域技术人员通过已知的技术制备本发明的纳米颗粒。在一中实施例中,纳米颗粒通过以下步骤的方法制备:a)通过化学氧化使本发明的肽交联,以形成具有可裂解键的多肽,b)将所述多肽与核酸混合,c)回收纳米颗粒。该实施例的一方面,可裂解的键是二硫键。在另一种实施例中,通过以下步骤的方法制备纳米颗粒:a)将本发明的多肽与核酸混合以形成纳米颗粒,b)回收纳米颗粒。在另一个实施例中,通过以下步骤的方法制备纳米颗粒:a)将本发明的肽与核酸混合,b)通过化学氧化使肽交联以形成具有可裂解键的多肽,从而产生纳米粒子,c)回收纳米颗粒。在此实施例的一方面,可裂解键是二硫键。在这些实施例的一方面,将多肽和核酸在水溶液中混合,例如ph范围为6.0
‑
8.0的水性缓冲液。这些实施例的另一方面,在可控制的混合条件范围内,以铵盐与磷酸盐配比介于(w:w=2:1至8:1)来配制纳米颗粒。在这些实施例的另一方面,核酸可以是sirna、mirna、反义寡核苷酸、质粒、mrna、rna酶、dna酶、或适配体序列。
[0051]
在一种实施例中,制备本发明的纳米颗粒的方法包括添加组氨酸
‑
赖氨酸共聚物的附加步骤。组氨酸
‑
赖氨酸共聚物的百分比为20%至97%。
[0052]
在另一种实施例中,制备本发明的纳米颗粒的方法包括将药物与多肽和核酸混合的额外步骤。该药物可包括小分子药物、肽药物或蛋白质药物。
[0053]
使用方法
[0054]
本发明所述的纳米颗粒可用于将核酸及药物递送至人、其他哺乳动物以及哺乳动物的细胞。
[0055]
本发明包括将核酸递送至哺乳动物细胞的方法,该方法包括在将纳米颗粒进入细胞并释放核酸的条件下,将足够量的本发明所述的纳米颗粒递送至细胞内。如前面所述,核酸包含sirna、mirna、反义寡核苷酸、质粒、mrna、rna酶、dna酶或适配体序列。一方面,核酸在体外被递送至细胞。另一方面,核酸也在体内被递送至细胞。一方面,哺乳动物细胞是实验动物的细胞。这类实验动物包括啮齿动物、狗、猫和非人灵长类动物等。另一方面,哺乳动物细胞是人的细胞。在特定的一方面,该核酸是sirna,如文中实施例所述。
[0056]
本发明还包括一种在哺乳动物中进行基因治疗的方法,该方法包括对哺乳动物施用治疗有效量的本发明所述的纳米颗粒。在纳米颗粒被靶细胞吸收并且将核酸释放到细中,足够量的纳米颗粒就被递送到了哺乳动物体内。在一种实施例中,哺乳动物是人。在另一个实施例中,哺乳动物是实验动物,例如前面段落中所述的动物。在这些实施例的一方面,核酸是sirna,如具体实施例所述。
[0057]
本发明还包括将治疗性化合物递送至哺乳动物的方法,其包括将有效剂量的具有治疗效果的本发明所述纳米颗粒递送至哺乳动物体内。纳米颗粒被靶细胞吸收并且将治疗性化合物释放到细胞内,此时足够量的纳米颗粒就被递送至哺乳动物体内。在一方面,哺乳动物是人。在另一方面,哺乳动物是实验动物,例如本发明前述提到的动物。
[0058]
鉴于本文所给定的方法,本领域技术人员可以容易地确定给药剂量、给药方法和给药时间。在一种实施例中,通过注射入哺乳动物的组织中来施用组合物。在另一种实施例中,通过皮下注射向哺乳动物施用组合物。还有一种方案,将组合物静脉注射到哺乳动物体内。在一种优选的实施例中,哺乳动物是人。
[0059]
实验设计和技术
[0060]
背景
[0061]
本发明提供一种核酸药物递送系统。该系统包含具有还原敏感性的二硫键屏蔽系统。其中,该系统包含靶向功能、一种带正电荷的多肽材料和核酸。带正电荷的多肽和带负电荷的sirna通过非共价作用形成纳米颗粒,其表面被多肽屏蔽以减少了毒性。稳定的复合物把负载的遗传物质运输到细胞中。然后,在强还原性的细胞内环境中(相对于细胞外环境),纳米颗粒中的多肽被谷胱甘肽(gsh)降解并释放其有效负载的核酸序列,完成转染过程。此外,本发明所述递送系统的优点在于其简单性和有效性。在纳米颗粒表面部分游离的半胱氨酸可进一步耦合靶向配体。这种靶向功能可利用所连接的配体,提高核酸转染进特异性靶向细胞的效率。
[0062]
本发明提供了一种多肽纳米颗粒,所述多肽纳米颗粒包含通过二硫键交联的含半胱氨酸的富含组氨酸
‑
赖氨酸的多肽,以及多肽与sirna通过静电和氢键作用形成的复合物。
[0063]
本发明还提供至少一种核酸(以及两种不同的核酸)和药学上可接受的载体。以sirna为例,双链结构中一条链与一个含编码vegf的mrna分子结合,另一条链与一个含编码vegfr2的mrna分子结合。在一个实施例中,该双链体进一步包括sirna双链结构中一条链与一个含编码tgfβ1的mrna分子结合。在这些实施例中,双链既可以针对人的mrna,也针对同源的小鼠的mrna。
[0064]
本发明涉及一种氧化还原活性组分,它可以是肽或线性分子,可以在氧化条件下交联形成多肽。多肽与核酸通过络合形成纳米颗粒,此粒径取决于两组分之间的相对比例,其粒径范围为50
‑
300nm。优选地,粒径范围在80
‑
130nm之间,且多分散度系数(pdi)值较窄。
[0065]
本发明进一步涉及一种复合物,其包括可生物降解的多肽组分和sirna、mrna或dna。两者通过复合形成纳米颗粒或者纳米聚集体。复合物的形成有效地保护并递送sirna、mrna或dna到细胞中。sirna或其他物质可以在细胞内的还原环境中(gsh浓度,细胞质液内0.5
‑
10mm,细胞核内20mm)释放。其中,细胞内环境中能导致二硫键的断裂,目标细胞通过重复的组氨酸
‑
赖氨酸单元引发的内吞作用,提高细胞的摄取。
[0066]
新型h3k4c2系统的设计
[0067]
本系统的设计是基于之前成功建立的h3k4b[kkk(khhhkhhh
n
khhhkhhhk)4]、hkp(n=1)、hkp(+h)(n=2),参考图2a的sirna递送系统的体外和体内实验。将两个sirna(分别针对同一个基因或不同的基因)与h3k4b有效地复合形成稳定的纳米颗粒(约150nm)。纳米颗粒在与细胞结合时被胞吞递送至细胞内,从内涵体逃逸到细胞质中并释放sirna,此时的sirna起到基因沉默的作用。被包裹的sirna从胞内体中释放,可诱导癌细胞的基因沉默。尽管h3k4b已经被证明是双靶向sirna的有效载体,但仍有改进的空间,其中包括从紧密结合的带正电荷的h3k4b纳米颗粒中释放带负电荷的sirna。紧密结合的程度可能会降低sirna在转染过程中的效率。换句话说,可能需要配制更高剂量的sirna才能引起治疗效果。
[0068]
多肽中的可生物解离键可以是二硫键、酸酐键、联氨键、酶特异性裂解肽键,以及其它化学键。类似的,也可以是多种键类型的组合。这种可生物解离键可以在特定的生物环境下被降解。在本发明中,多肽中的单肽与其它成分通过可生物解离键(如还原敏感的s
‑
s键、低ph值可断裂的亚胺等)连接,可生物解离键可以通过选择性生物刺激,如酶暴露、ph酸度的增加(ph的控制)、特定的生物环境(如在肿瘤细胞中存在着高浓度的gsh)或其它化学刺激实现生物降解。因此,hkc2多肽在特定的生物条件下被降解,被包裹的sirna可从多肽
纳米颗粒中释放出。
[0069]
随后,被释放的sirna一旦到达目的基因mrna所在位置,将实现对目的基因表达的抑制。例如,为了通过增强sirna的释放效率以提高sirna递送到细胞的效率,我们设计了一种化学可生物降解的组氨酸
‑
赖氨酸
‑
半胱氨酸的hkc2聚合物,该聚合物基于分支状hk中的半胱氨酸与主链中的半胱氨酸之间的二硫键结合,形成一个重复单位为单支化hk的多肽hkc2,其结构与h3k4b相似。它能有效地保护核酸免受核酸酶的分解,并处于非还原性环境时保持稳定,如细胞外液和血液(谷胱甘肽(gsh)浓度,0.5
‑
10μm)。但该hkc2聚合物暴露在细胞内较高浓度的谷胱甘肽(0.5~10mm)时,就会断开。特别是在以往研究中,考虑到肿瘤细胞中谷胱甘肽(gsh)浓度的增加,可生物解离键,如多肽
‑
sirna纳米颗粒载体中的二硫键,可以有效地解离,释放sirna并递送至靶细胞中
[10,11]
。支化hk和主链相连接的s
‑
s键断裂,将把支化hk切成单独的片段,预期这些片段不再与sirna形成稳定的复合物。因此,gsh可以通过在细胞内降解hkc2聚合物/sirna复合物,从而触发sirna的释放(图1)。
[0070]
设计一种具有氧化还原活性的hkc2多肽以提高sirna的释放和转染效率
[0071]
1.组氨酸
‑
赖氨酸(hk)分支状聚合物的结构
[0072]
在所有已研究的组氨酸
‑
赖氨酸(hk)聚合物中,包括h2k、h3k、h3k4b(图2a),之前的报道
[12,13]
和我们的配方及功效研究表明,h3k4b与sirna复合后可形成有效的纳米颗粒。基于已报道的实验阐明,线性结构的hk不能有效地与sirna形成复合物
[12,13]
。然而,我们也观察到在转染过程中sirna的缓慢释放的现象,这是基于在完整的聚合物h3k4b中带正电荷的赖氨酸和负电荷sirna的磷酸骨架之间存在强的非共价相互作用。
[0073]
因此,有必要设计和开发一种更有效的hkp聚合物,这种聚合物能够在氧化条件下与sirna形成聚合物,当聚合物暴露于还原条件(如肿瘤细胞内高浓度的gsh)时,聚合物分解并释放sirna
[14,15]
。理想的情况下,这种可生物降解的hkp聚合物可以有效地与sirna复合,以防止sirna在递送过程中降解,最终将包裹的sirna在细胞质中高效地释放,进入sirna通路机制以实现治疗靶标mrna的基因沉默(图1)。
[0074]
2.可生物降解的组氨酸
‑
赖氨酸
‑
半胱氨酸hkc2聚合物的设计与制备
[0075]
h3k4b聚合物可以分解成四个相同的线性肽结构单元,结构如下图所示。这种分支状聚合物可以由两个基本单元组成:一个含有多肽rsh的线性半胱氨酸,一个含有多个游离巯基的主链,通过氧化还原反应形成二硫键把两者连接起来。例如,在sirna制剂中,sh被氧化成s
‑
s键形成h3k4b聚合物,并诱捕sirna形成复合物。但当复合物暴露在高浓度的细胞内gsh中时,s
‑
s键就会被破坏从而释放出sirna。这种多肽可通过连续固相合成法制备。我们将这两种化学成分简化为一种多肽h3k42c,其末端含有两个半胱氨酸序列,并带有两个氨基酸间隔基团(
‑
cssc,或任意的c
‑
连接子
‑
c型序列,组氨酸
‑
赖氨酸
‑
半胱氨酸,简称hkc2),以减少二硫键在分子内而不是在分子间交联的可能性。在这结构中,多肽含有一个赖氨酸和三个重复的组氨酸序列(k(hhhk)4cssc)。这个序列的结构和多肽h3k4b的一个支链相似。然而,与分支状多肽相比,制备该序列可以显著降低合成成本(图2a)。
[0076][0077]
在本发明中,可生物降解的多肽
‑
核酸递送系统与其他系统相比具有几个优点:(1)类似的多肽h3k4b的相对安全性和有效性已在各种动物模型,甚至临床试验中进行了研究。这种可生物降解的系统比合成的聚合物或由混合脂质组成的亲脂性系统更具生物相容性;(2)生产过程的成本相对较低且易于制备;(3)复合物在生理条件下是可生物降解的;(4)可以同时负载多个核酸以达到协同治疗效果(以多个协同或独立的途径靶向基因);(5)多肽(阳离子型)和核酸(阴离子型)通过静电作用和氢键作用复合在一起;(6)该系统的简单性是实践中的另一个优点,自交联原理如图3和图1所示。
[0078]
本发明所述的多肽/核酸载体是通过将多肽与单个或多个核酸结合制备而成的,步骤如下:(a)将所述的可生物降解功能基团,如两个游离硫醇基,引入到富含组氨酸
‑
赖氨酸的线性多肽中;(b)通过空气氧化或在水介质中使用低百分比的二甲基亚砜,将生物共价连接肽结合成多肽;(c)将步骤(b)制备的多肽与一个或多个sirna分子结合,通过电荷相互作用以制备稳定的纳米颗粒。
[0079]
或者,也可以通过将线性肽和核酸混合在一起制备多肽/核酸,多肽可原位交联形成纳米颗粒。
[0080]
根据sirna结合和纳米颗粒形成的机理,上述方法可以同时增加其他额外的步骤。
[0081]
由上述方法制备的多肽纳米颗粒,是通过多肽复合物和各种类型的核酸在水溶液中自组装而成。化疗药物也可以被引入到复合物中以制备纳米颗粒,用于治疗特定疾病,例如癌症、疤痕和炎症。例如,吉西他滨、5
‑
fu或顺铂联合治疗癌症。
[0082]
根据所述的生产方法,本发明制备的多肽纳米颗粒的粒径范围为10nm到3000nm。根据临床前的研究,首选粒径为80~130nm(通过动态光散射仪测量其粒径和分布)。
[0083]
此外,根据本发明的hkc2多肽
‑
核酸递送系统可用作有效的药物组合物。因此,本
发明提供一种药物组合物,其包含有效剂量的hkc2多肽和核酸。除了用于给药的hkc2多肽
‑
核酸递送系统外,还可包括一种或多种与药物相容的聚合物或载体。
[0084]
由此得到的产品可以通过各种方式配制,如以液体、固体形态、胶囊、注射剂等,或混合一种或多种有效成分,如盐溶液、缓冲溶液或其他相容成分,以维持核酸
‑
肽/多肽纳米颗粒的稳定性和有效性。
[0085]
hkc2的结构通过高效液相色谱和质谱表征,在rp
‑
hplc观察到保留时间在8.053min处有一个主峰,纯度≥90.0%。在esi
‑
ms光谱中(图2b),观察到一个分子离子峰为双电荷离子[m+2h]
2+
。同样地,也观察到4+和5+种类的三重电荷。谱图结果中可得出实际的分子量为2683da,与理论值非常吻合。在ph值为7.0时,多肽的净电荷为6+,所以它很容易溶于水(图2a)。这有利于在水溶液中与sirna形成复合物制剂。
[0086]
rnai治疗方法
[0087]
我们已开发一种组氨酸
‑
赖氨酸聚合物(hkp)的多肽载体用于在体外内递送sirna。这项技术(见2014年5月27日发布的美国专利no.8,735,567b2,以及2017年5月9日发布的美国专利no.9,642,873b2)能够大幅提高sirna向病变组织中特定细胞的递送效率,并在这些细胞中沉默靶标mrna,阻止蛋白质的生成,从而治疗如疤痕愈合、肝纤维化、癌症等疾病。
[0088]
rnai和治疗药剂
[0089]
rnai是通过特定序列来破坏mrna的方式抑制基因的表达,是一种有效的疾病治疗方法。rnai可以快速而持续地发挥生物功能。本发明提供了一种rnai递送方法,用于潜在的疾病治疗。本发明提供了多种形式的sirna分子作为治疗药剂,包括双链rna(dsrna)寡核苷酸(有/无突起、粘末端或平末端)、短发夹rna(shrna)和dna衍生rna(ddrna)。
[0090]
sirna序列的设计
[0091]
rnai分子被设计成具有与目标基因的部分序列相匹配的核苷酸序列。靶基因的sirna序列可能位于基因表达产生的mrna的任何部位。rnai分子中包含的一条序列,即sirna序列的“反义链”,将与目标基因的mrna杂交。sirna序列包含一条与反义链杂交的序列,即sirna序列的一条“正义链”。针对目标基因选择的sirna序列不应与细胞产生任何的其他mrna同源,也不应与未转录为mrna的目标基因序列同源。选择目标mrna序列的20到27个碱基序列的诸多规则是已知的,也包括商业上可用的方法。设计可从至少三种方法中获得,并从这些方法中构建和组装一个最优级别的一致性清单。我们发现,制备至少6条最优先级别的候选序列,然后进行基因抑制的细胞培养测试,结果中几乎总显示至少两个具有活性的sirna序列。如果没有,可进行第二轮筛选(获得六个最优先级别的候选序列和测试)。
[0092]
除了鉴定具有活性的sirna序列,设计还必须确保只与目标mrna序列同源。sirna序列与目标基因以外的基因组序列的同源性差,会降低在mrna水平或基因水平上的脱靶效应。同时,sirna序列的“正义链”的同源性较差,可降低脱靶效应。通过使用clone manager suite和在线blast搜索进行dna比对,可以确定所选基因的目标序列是唯一的,并且与其他基因(包括人类基因)缺乏序列同源性。例如,与mvegf
‑
a的mrna相匹配的序列被证实为mvegf
‑
a的独特序列,而与mvegf
‑
b mrna、mvegf
‑
c mrna、mvegf
‑
d mrna或人类对应的hvegf165
‑
a(af486837)没有同源性。然而,匹配序列将靶向mvegf
‑
a的多种亚型,例如mvegf
(m95200)、mvegf115(u502791)、mvegf
‑
2(s38100)、mvegf
‑
a(nm.sub.—192823),它们分别编码190个氨基酸(aa)、141个氨基酸(aa)、146个氨基酸(aa)和148个氨基酸(aa)的mvegf
‑
a蛋白质。所有已发表的mvegf
‑
a亚型的cdna序列,除了mvegf
‑
a(nm.sub.—192823,蛋白质的成熟形态),在n端包含一条26个氨基酸信号肽。mvegf的靶向序列不是在信号肽部分,而是在所有这些mvegf
‑
a亚型共有的成熟蛋白部分。
[0093]
mvegf
‑
r2的靶向序列也被证实了分别对这两个基因是唯一的。本发明包括不同形式的干扰rna。例如,根据上述目标序列,利用已知的准则设计sirna序列。这些sirna是25个平末端的rna寡核苷酸(表1
‑
3)。
[0094]
rnai分子对于目标基因序列的特异性,取决于我们试图靶向的生物体(动物)的种类。大多数哺乳动物的基因具有相当大的同源性,可以通过选择多个物种的相关基因的mrna的同源片段,筛选对多个物种基因都有活性的rnai分子。首选的sirna抑制剂设计应该与人类基因和实验动物基因的mrna有完全的同源性。实验动物应是常用于药效及毒性研究的动物,例如老鼠、兔子或猴子。
[0095]
由于已知至少需要与其它基因序列同源的17个核苷酸,才能使sirna产生依赖于序列的脱靶效应。因此需要blast工具,从一个25个碱基对长度的sirna中选择8个可能的17个核苷酸序列,以研究依赖于序列的非靶向效应的可能性,并利用这些信息作为一个重要参数,以最终确定几个sirna治疗程序中的api(药物活性成分)的sirna的选择。
[0096]
尽管我们的rpp递送系统极不可能诱导toll样受体介导的干扰素途径激活,但我们依然检查了sirna候选基因,排除了那些可能通过tlr(toll样受体)途径在体内和体外诱导ifn途径激活的已知免疫刺激基序(富含gu的区域,5'
‑
ugugu
‑
3'或5'
‑
guccuucaa
‑
3')。最后,我们还将每个测试的sirna序列的靶向区域映射到它们的目标mrna序列上。这种映射特别有助于理解sirna候选序列对靶基因mrna及其可变转录体的靶向能力。
[0097]
有效sirna靶向序列的筛选如下表所示。筛选的sirna序列首先在体外细胞系中进行检测,然后在给药前通过与选定的转染载体复合,进行体内效力和有效性测试。
[0098]
表1.有效vegf靶向sirna的筛选
[0099]
[0100][0101]
表2.有效vegf2靶向sirna的筛选
[0102]
[0103][0104]
表3.有效tgf
‑
beta1靶向sirna的筛选
[0105][0106]
除非有特殊说明,否则,此处所述单数形式“a”、“an”和“the”,是指一个或多个。
[0107]
以下示例说明了本发明的部分方面,不应理解为本发明的只限于这些方面。
[0108]
实例说明
[0109]
具体实施例1:肽在气体环境下通过二硫键交联
[0110]
最开始的工作是通过肽的二硫键交联来检测多肽的形成。将多肽hkc2(3.0mg)在室温下用去离子水(0.5ml)溶解,溶液于4℃下保存10小时。通过反相c
‑
8高效液相色谱分析所得混合物,用水(0.1%tfa)和乙腈(0.1%tfa)洗脱,在色谱图上显示有一个峰,保留时间为3.3分钟。在保留时间为8.053分钟时洗脱峰消失,代表原始材料hkc2的洗脱。图3证实了
该肽可以在气体中氧化和交联。
[0111]
具体实施例2:在dmso作用下,通过二硫键交联多肽
[0112]
类似地,用5%的dmso水溶液将多肽hkc2氧化。将多肽hkc2(3.0mg)在室温下用去离子水溶解,溶液于4℃下保存10小时。通过反相c
‑
8高效液相色谱分析所得混合物,用水(0.1%tfa)和乙腈(0.1%tfa)洗脱。它在色谱图中显示了一个峰,保留时间为3.3分钟。起始原料hkc2在8.053分钟的保留时间没有洗脱出峰。图3证实了该肽可以被dmso氧化。
[0113]
具体实施例3:交联的hkc2肽和sirna自组装形成纳米颗粒
[0114]
确认了hkc2在水中交联后,我们研究了hkc2和sirna(tgfβ1)的自组装。首先,用含有5%dmso的水溶液制备交联hkc2肽浓缩原液。将hkc2与sirna按不同比例(质量比)混合(1:1,2:1,4:1等),涡旋快速搅拌。30分钟后,hkc2和tgfβ1形成的多肽纳米颗粒的大小分布通过动态光散射仪测量。从大小分布来看,tgfβ1(2.5μg/μl)和hkc2(30μg/μl)的高浓度下,按比例1:1至1:6混合,纳米颗粒大小较大(2000~3000nm),且在某些情况下可以观察到沉淀。图1表明,无论sirna和hkc2如何添加序列,其大小均保持不变(图1)。
[0115]
具体实施例4:hkc2
‑
sirna多肽纳米颗粒(pnp)胞内递送到hek293细胞内
[0116]
hek293细胞以每孔3
×
104个细胞接种到48孔板中,孵育过夜。第二天,af488标记的sirna/hkc2复合物的制备如下:sirna(0.025μg/μl,21个碱基对长度)水溶液和hkc2(0.05μg/μl)水溶液按hkc2与sirna质量比为1:1,1.7:1,2:1,4:1,8:1和1:2混合。30分钟后,将sirna/hkc2复合物添加到细胞中。转染24小时后荧光成像。从图7中,我们观察到sirna被递送到细胞内(图7)。
[0117]
具体实施例5:hkc2
‑
sirna多肽纳米颗粒(pnp)递送到a549细胞内
[0118]
使用荧光标记的sirna(alexa fluor 488)与hkc2多肽复合物来验证sirna的递送。转染前一天,a549细胞以每孔3
×
104个细胞的密度接种到48孔板中。第二天,制备af488标记的sirna/hkc2复合物:sirna(0.025μg/μl,21个碱基对长度)水溶液和hkc2(0.05μg/μl)水溶液按hkc2与sirna质量比为1:1,1.7:1,2:1,4:1,8:1和1:2混合。30分钟后,将sirna/hkc2复合物添加到细胞中。转染24小时后荧光成像。从图8中,我们观察到sirna被递送到a549细胞内(图8)。
[0119]
具体实施例6:通过凝胶阻滞法测定可以抑制sirna迁移的hkc2含量
[0120]
制备不同比例的hkc2与sirna(tgfβ1,500ng)的复合物,然后凝胶电泳30min(3%的凝胶)。凝胶上显示了hkc2多肽比sirna的不同比例(图9)。实际上,25ng/μl的sirna与不同数量的hkc2肽按1:2、1:1、1.5:1、2:1、3:1、4:1的比例孵育,并且参考hkp(4:1)作比较。孵育20分钟后,在凝胶的每个孔中加入20μl的sirna/肽复合物(每孔500ng sirna)。将游离和结合的sirna用3.0%的非变性琼脂糖凝胶分离,在100v电压下运行30分钟。用溴化乙锭进行染色,荧光条带在紫外(290nm)下由富士las40000成像仪显示(图9)。
[0121]
具体实施例7:凝胶阻滞试验验证了在谷胱甘肽(gsh)存在的情况下,hkc2的降解和sirna的释放
[0122]
制备不同比例的hkc2或hkp与sirna(tgf
‑
β1,500ng)的复合物,凝胶(3%)电泳30分钟。hkc2与sirna的不同比例在以上凝胶孔中展示(图10)。实际上,25ng/μl的sirna与hkc2按4:1和8:1的比例孵育交联,且在有无20nm谷胱甘肽(gsh)下参考hkp(4:1)。孵育40分钟后,每个孔加入20μl的sirna/肽(每孔500ng sirna)复合物。将游离和结合的sirna用
3.0%的非变性琼脂糖凝胶分离,在100v电压下运行30min。凝胶用溴化乙锭rna染料进行染色,荧光条带在紫外(290nm)下由富士las40000成像仪显示。所给出的结果代表了从多次测试中获得的图像。
[0123]
具体实施例8:hkc2:hkp:tgfβ1在纳米颗粒形成中的粒径分布及多分散性
[0124]
hkc2=k(hhhk)4cssc.hkp=h3k4b。tgfβ1sirna在水中浓度为80ng/μl。将sirna与等体积的hkc和hkp在水中混合。评估不同混合比例的hkc2,hkp和sirna的纳米颗粒。将hkc2加入到hkp/sirna制剂中,保持了相似的纳米颗粒大小,但是与对照组hkp/sirna(n:p质量比=4:1)相比,其多分散性指数(pdi)显著缩小了。hkc2/hkp/sirna的质量比为0:4:1,1:4:1,1:3:1,2:3:1,2:2:1,3:1:1。将hkc2(160ng/μl),hkp(320ng/μl),sirna(80ng/μl)水溶液按规定比例混合,室温孵育30分钟。所得样品随后用nanoplus 90仪器(brookhaven)通过动态光散射进行测量。记录动态半径和多分散性,如图11和12所示。
[0125]
具体实施例9:hkp单独或不同剂量hkp和hkc联合细胞死亡sirna(qiagen)对人胶质母细胞瘤t98g细胞系的影响
[0126]
使用不同质量比的hkp/hkc2/sirna,脂质体作为对照。首先将hkc(160ng/ul)水溶液加入到80ng/ul的sirna水溶液中,混合并短暂涡流,然后以同样方式加入hkp(320ng/ul)。混合物在室温下孵育30min。转染复合物用opti
‑
mem稀释,加入100μl到细胞中。转染6h后,用含10%胎牛血清的dmem或emem新鲜培养替代前面的培养基。转染后72h,使用celltiter
‑
glo发光细胞活力测定(promega)评估活细胞数。未处理细胞(空白)的值设置为100%。所有的值代表四次重复的平均
±
s.d.。非沉默sirna(qiagen,germantown,md),细胞死亡sirna(qiagen,germantown,md)(见图13)。
[0127]
具体实施例10:hkp单独或与不同剂量hkp和hkc联合细胞死亡sirna(qiagen)对人肝癌hepg2细胞的影响
[0128]
使用不同质量比的hkp/hkc2/sirna,脂质体作为对照。首先将hkc(160ng/ul)水溶液加入到80ng/ul的sirna水溶液中,混合并短暂涡流,然后以同样方式加入hkp(320ng/ul)。混合物在室温下孵育30min。转染复合物用opti
‑
mem稀释,加入100μl到细胞中。转染6h后,用含10%胎牛血清的dmem或emem新鲜培养替代前面的培养基。转染后72h,使用celltiter
‑
glo发光细胞活力测定(promega)评估活细胞数。未处理细胞(空白)的值设置为100%。所有的值代表四次重复的平均
±
s.d.。非沉默sirna(qiagen,germantown,md),细胞死亡sirna(qiagen,germantown,md)。
[0129]
参考文献
[0130]
1.ts齐默尔曼,ac李,a阿金,b布拉姆拉奇,d布姆罗特,mn费多鲁克,i麦克拉克伦。非人类灵长类动物中rnai介导的基因沉默。自然杂志。
[0131]
2006,441:111
–
114。
[0132]
2.ad贾奇,m罗宾斯,i塔瓦科利,j列维,l胡,a弗朗达,i麦克拉克伦。证实rnai介导的基于sirna的癌症治疗剂在小鼠中的作用机制。临床研究杂志。2009,119:661
‑
673。
[0133]
3.sc辛普尔,a阿金,j陈,ap桑德,bl梅,ck康妮,mj霍普。用于sirna输送的阳离子脂质的合理设计。自然生物技术。2010,28:172
‑
176。
[0134]
4.db罗兹玛,dl刘易斯,dh韦克菲尔德,sc黄,jj克莱因,pl罗什,sl贝尔汀,tw雷彭,q楚,av布洛金,je哈格斯特罗姆,ja沃尔夫。动态多聚缀合物递送系统(dpc)可将sirna
靶向体内递送至肝细胞。美国国家科学院院刊。2007,104:12982
‑
12987。
[0135]
5.ci伍德德尔,db罗兹玛,m霍斯巴赫,m约翰,hl汉密尔顿,q楚,jo奥格,jj克莱因,dh韦克菲尔德,ce奥罗佩萨,j德克特,i罗尔,k雅恩
·
霍夫曼,p哈德维格,hp冯洛赫,a麦克拉克伦,dl刘易斯。肝细胞靶向rnai治疗慢性乙型肝炎病毒感染。分子疗法。2013,21:973
‑
985。
[0136]
6.k塔蒂帕蒂,s索,sk喀什,ak基耶。sirna递送策略:最新进展的全面综述。纳米材料(巴塞尔)。2017,7(4):e77。
[0137]
7.陆等人的2014年5月27日授权的美国专利号8,735,567b2,涉及多目标rnai治疗技术,可实现皮肤无痛伤口愈合。
[0138]
8.陆等人的美国专利9,642,873b2,于2017年5月9日发布,涉及tgf
‑
β和cox
‑
2抑制剂的组合及其治疗方法。
[0139]
9.j周,y赵,v西蒙南科,jj徐,k刘,d王,j石,t钟,l张,l曾,b黄,s唐,ay路,aj米森,y孙,py陆和q李。同时沉默tgf
‑
β1和cox
‑
2通过激活成纤维细胞凋亡减少人皮肤增生性疤痕。肿瘤靶向。2017,8:80651
‑
80665。
[0140]
10.r程,f冯,f孟,c邓,j费仁,z钟。谷胱甘肽响应型纳米载体是一种很有前途的细胞内靶向药物和基因递送平台。控制释放杂志。2011,152:2
‑
12。
[0141]
11.l朱,pt弗拉基米尔。刺激反应的纳米制剂用于肿瘤靶向。整合生物学。2013,5:96
‑
107。
[0142]
12.q冷,aj米森。具有富含组氨酸尾巴的修饰分支肽可增强体外基因转染。核酸研究。2005,33:e40。
[0143]
13.st周,k霍姆,d张,q冷,lj特里科利,jm胡斯泰特,a李,mj夏皮罗,j西格,jd卡恩,aj米森。通过组氨酸介导的氢键增强sirna多聚体的沉默和稳定。生物材料。2014,35:846
‑
855。
[0144]
14.t阿纳加菲,j于,a塞迪,mk哈达尔,ww穆霍宁,s奥伯兰德,h瓦斯尼斯,j弗罗伯格,ms莫拉,ks卡蒂,y崔,jb沙布,dk斯里瓦斯塔瓦,s马利克。核定位肽共轭,氧化还原敏感的聚合物递送姜黄素和阿霉素到胰腺癌的微肿瘤。分子药学。2017,14:1916
‑
1928。
[0145]
15.pf戴维,da艾琳。使用半胱氨酸交联审查钉合肽。肽科学。2016,106:843
‑
852。
[0146]
此处列出的所有出版物,包括已授权或已申请的专利,和所有可以通过链接地址,编码或者其他方式访问的数据库条目,都通过参考文献的形式在此处全部披露。
[0147]
尽管本发明描述了特定的具体实施例,并且为了阐述清楚而列举了许多细节,显而易见的是对熟悉这一领域的技术人员来说,此发明容易受到额外实施例的影响,并且在不违背本发明的基本原理下,本文中某些特定的细节可以有各种不同的描述形式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1