制备N-羧基内酸酐的方法与流程
制备n
‑
羧基内酸酐的方法
技术领域
1.本发明公开了一种通过氨基酸与光气反应制备n
‑
羧基内酸酐(nca)的方法。
背景技术:
2.nca在工业上用于制备肽。
3.wo 2006/047703 a2公开了一种制备n
‑
羧基内酸酐的方法,其中氨基酸在溶剂中与光气反应,通过在反应过程中使吹扫气体通过反应混合物,从反应混合物中清除hcl形式的副产物。wo 2006/047703 a2公开了总共三个实施例,在所有三个实施例中,反应混合物在反应后被浓缩,通过该浓缩去除任何溶剂和过量的光气;在实施例1的情况下,获得油状残余物,在说明了l
‑
glu
‑
(obzl)
‑
oh的制备的实施例2和实施例3的情况下,残余物结晶。将残余物溶于乙酸乙酯,通过过滤去除不溶的固体。然后通过加入己烷使产物结晶并通过过滤分离,然后将其洗涤并干燥。
4.us 2002/0082431 a1公开了一种通过使相应的氨基酸与光气、双光气和/或三光气在溶剂介质中反应来制备nca的方法,其特征在于该反应至少部分地在不饱和有机化合物存在的情况下进行,该不饱和有机化合物具有一个或多个烯键式双键,其中至少一个烯键式双键中的碳之一完全被卤素原子以外的取代基取代。
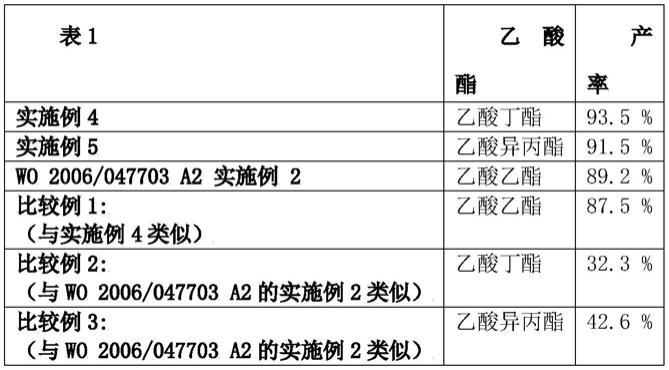
5.实施例2公开了α氨基酸为ala的情况下产率为68.8%,而本发明实施例3为79.0%。
6.实施例4公开了91.3%的产率,并且实施例5公开了在α氨基酸为glu的情况下92.6%的产率,而在本发明的实施例3中为93.5%。
7.实施例3公开了将lys转化为相应的nca,使用2当量的α
‑
蒎烯。
8.需要一种制备nca的方法,其不需要如us 2002/0082431 a1中所要求的具有一个或多个烯键式双键的不饱和有机化合物的存在。该方法应以高产率提供高纯度、低氯化物含量的nca。
9.发现了一种制备nca的方法,该方法不需要如us 2002/0082431 a1中所要求的具有一个或多个烯键式双键的不饱和有机化合物的存在,并且能够以高产率提供高纯度、低氯化物含量的nca。
10.如表1所示,与wo 2006/047703 a2相比,本发明显示出更好的产率:
[0011][0012]
缩略语:
[0013]
%
ꢀꢀ
除非另有说明,否则百分比为重量百分比(wt%,w/w)
[0014]
bzl
ꢀꢀ
苄基,保护基
[0015]
乙二醇二甲醚
ꢀꢀ
1,2
‑
二甲氧基乙烷
[0016]
二乙二醇二甲醚
ꢀꢀ1‑
甲氧基
‑2‑
(2
‑
甲氧基乙氧基)乙烷
[0017]
三乙二醇二甲醚
ꢀꢀ
1,2
‑
二(2
‑
甲氧基乙氧基)乙烷
[0018]
eq
ꢀꢀ
当量
[0019]
mtbe
ꢀꢀ
甲基叔丁基醚
[0020]
nca
ꢀꢀ
n
‑
羧基内酸酐
[0021]
tfa、tfa
ꢀꢀ
三氟乙酰基,保护基
[0022]
thf
ꢀꢀ
四氢呋喃
技术实现要素:
[0023]
本发明的主题是制备式(ii)化合物的方法,
[0024][0025]
所述方法包含步骤step1,
[0026]
step1包含反应reac1,其中式(i)的化合物与phos在溶剂solv1中反应;
[0027][0028]
r选自由以下组成的群组:
‑
h、
‑
ch3、
‑
ch2‑
sh、
‑
ch2
‑
cooh、
‑
(ch2)2‑
cooh、苄基、h、ch(ch3)
‑
ch2ch3、
‑
(ch2)4‑
nh2、
‑
ch2‑
ch2‑
(ch3)2、
‑
(ch2)2‑
s
‑
ch3、
‑
ch2‑
c(o)
‑
nh2、
‑
(ch2)2‑
c(o)
‑
nh2、
‑
(ch2)3‑
nh
‑
c(nh)
‑
nh2、
‑
ch2‑
oh、
‑
ch(oh)
‑
ch3、
‑
ch(ch3)2、
‑
(ch2)3‑
nh
‑
c(o)
‑
nh2和
‑
(ch2)3‑
nh2;
[0029]
能够与光气反应的r的任何官能残基均被合适的保护基pg保护;
[0030]
r1选自由以下组成的群组:h、c1‑4烷基和苄基;
[0031]
n为0或1;
[0032]
phos选自由以下组成的群组:光气、双光气、三光气及其混合物;
[0033]
solv1选自由以下组成的群组:thf、2
‑
甲基
‑
thf、二恶烷、乙酸乙酯、二氯甲烷、乙二醇二甲醚、二乙二醇二甲醚、三乙二醇二甲醚、环戊基甲醚、乙腈及其混合物;
[0034]
在step2中,将solv1的一部分交换为溶剂solv2;
[0035]
solv2选自由以下组成的群组:
[0036]
甲酸己酯、乙酸戊酯、丙酸丁酯、丁酸丙酯、戊酸乙酯、己酸甲酯、
[0037]
甲酸戊酯、乙酸丁酯、丙酸丙酯、丁酸乙酯、戊酸甲酯、
[0038]
甲酸丁酯、乙酸丙酯、丙酸乙酯、丁酸甲酯及其混合物。
具体实施方式
[0039]
在一个实施方案中,在不存在具有一个或多个烯键式双键的不饱和有机化合物的情况下进行reac1,该不饱和有机化合物的分子的其余部分对存在于介质中的化合物是惰性的并且至少一个烯键式双键的碳之一完全被卤素原子以外的取代基取代。
[0040]
在另一个实施方案中,在不存在具有一个或多个烯键式双键的不饱和有机化合物的情况下进行reac1,该不饱和有机化合物的至少一个烯键式双键的碳之一完全被卤素原子以外的取代基取代。
[0041]
在另一个实施方案中,在不存在具有一个或多个烯键式双键的不饱和有机化合物的情况下进行reac1,该不饱和有机化合物的分子的其余部分对存在于介质中的化合物是惰性的。
[0042]
在另一个实施方案中,在不存在具有一个或多个烯键式双键的不饱和有机化合物的情况下进行reac1。
[0043]
优选地,式(ii)的化合物是式(ii
‑
l)的化合物;
[0044][0045]
其中r、r1和n如本文定义,其所有实施方案也是如此。
[0046]
优选地,式(i)的化合物是式(i
‑
l)的化合物;
[0047][0048]
其中r、r1和n如本文定义,其所有实施方案也是如此。
[0049]
优选地,式(i)的化合物是天然存在的氨基酸,更优选地,式(i)的化合物选自由以下组成的群组:αala、βala、cys、asp、glu、phe、gly、his、ile、lys、leu、met、asn、pro、gln、arg、ser、thr、val、trp、tyr、瓜氨酸和鸟氨酸。
[0050]
优选地,r选自由以下组成的群组:h、
‑
(ch2)4‑
nh2、
‑
ch3和
‑
(ch2)2‑
cooh;
[0051]
更优选地,r选自由以下组成的组:
‑
(ch2)4‑
nh2、
‑
ch3和
‑
(ch2)2‑
cooh。
[0052]
优选地,r1选自由h、甲基、乙基和苄基组成的群组;
[0053]
更优选地,r1为h或甲基;
[0054]
进一步更优选r1为h。
[0055]
优选地,当n为1时,则r1为h或甲基;
[0056]
更优选地,当n为1时,则r1为h。
[0057]
优选地,n为0。
[0058]
适于保护r的任何官能残基不与光气反应的pg是技术人员已知的,例如,从peter g.m.wuts和theodora w.greene的“greene's protective groups in organic synthesis”,第四版,wiley
‑
interscience,a.john wiley&sons,inc.,2007年,isbn 978
‑0‑
471
‑
69754
‑
1,或从norbert sewald和hans
‑
dieter jakubke的“peptides:chemistry and biology”,第二版,修订和更新版,wiley
‑
vch verlag gmbh,2009年,isbn 978
‑3‑
527
‑
31867
‑
4。
[0059]
对于r的每个不同的官能残基,优选的pg取决于在reac之后从r的任何官能团裂解pg的期望机理,这也是技术人员已知的。
[0060]
pg优选是通常用于保护天然存在的α氨基酸的侧链中的任何官能残基的保护基。
[0061]
arg的胍基可以用诸如硝基、氨基甲酸酯(酰基)、芳烃磺酰基和三苯甲基类型的pg保护。
[0062]
其他合适的pg例如选自由以下组成的群组:z、z(ome)、z(2
‑
no2)、z(no2)、z(cl)、z(3,5
‑
ome)、z(2
‑
br)、ddz、nvoc、pz、tmz、bic、bpoc、azoc、inoc、boc、cyoc、tcboc、adoc、adpoc、iboc、fmoc、mio
‑
fmoc、dio
‑
fmoc、tsoc、msc、nsc、bspoc、bsmoc、mspoc、alloc、teoc、tipseoc、pipoc、poc、ptnm、epoc、dts、tsc、for、tfa、tos、onbs、pnbs、dnbs、bts、nps、dde、ivdde、nde、trt、trt(2
‑
cl)、bzl、(bzl)2、bzl(4
‑
me)、me、et、nbz、mob、2,4
‑
dmb、pic、tse、pac、pac(ome)、tbu、cy、1
‑
ada、2
‑
ada.pf、fm、tmse、ptmse、dcpm、all、dmba、bcmacm、hmb、hnb、simb、硝基、mbs、mts、mtr、pmc、pbf、ans、btb、npys、ptnm、acm、tmb、dpm、tacm、stbu、
smpys、allocam、xan、dnp、bom、pdpm、bum、allom、bzl、dcb、zte、mtm、pen、hoc、mbh、4,4'
‑
二甲基二苯甲基、4,4'
‑
二甲氧基二苯甲基、4
‑
甲氧基苄基、2,4
‑
二甲氧基苄基、2,4,6
‑
三甲氧基苄基和二苯甲基;
[0063]
这些pg缩略语的含义可以在norbert sewald和hans
‑
dieter jakubke的“peptides:chemistry and biology”,第二版,修订和更新版,wiley
‑
vch verlag gmbh,2009年,isbn 978
‑3‑
527
‑
31867
‑
4中找到,这些pg中的哪个适合于保护r的哪个官能残基也可在其中找到。
[0064]
优选地,式(i)化合物选自由tyr、lys、αala、βala、n
‑
甲基丙氨酸和glu组成的群组;
[0065]
更优选地,式(i)化合物选自由tyr、lys、αala、n
‑
甲基丙氨酸和glu组成的群组;
[0066]
优选地,r的官能残基被选自由tfa或bzl组成的群组的pg保护;
[0067]
因此,式(i)化合物在其各自的保护形式中优选选自以下组成的群组:tyr、lys(tfa)、αala、βala、n
‑
甲基丙氨酸和glu(bzl);
[0068]
更优选选自由以下组成的群组:try、lys(tfa)、αala、n
‑
甲基丙氨酸和glu(bzl);
[0069]
优选地,phos是光气。
[0070]
优选地,reac中phos的摩尔量为式(i)化合物的摩尔量的1
‑
5eq、更优选1.1
‑
4eq、甚至更优选1.2
‑
3.5eq、尤其是1.3
‑
3eq。
[0071]
优选地,solv1是thf、2
‑
甲基
‑
thf、乙腈或其混合物;
[0072]
更优选地,solv1是thf或2
‑
甲基
‑
thf;
[0073]
进一步更优选地,solv1是thf。
[0074]
优选地,solv1的重量是式(i)化合物的重量的2至40倍,更优选地3至30倍,进一步更优选地4至25倍。
[0075]
优选地,reac1在温度tempreac1下进行,tempreac1为0至70℃,更优选为10至60℃,进一步更优选为15至55℃。
[0076]
优选地,reac1的反应时间timereac1为10分钟至9小时,更优选为20分钟至7小时,进一步更优选为20分钟至6小时。
[0077]
timereac1可包含将phos和式(i)的化合物混合的时间timemix1和将phos和式(i)的化合物搅拌的时间timestirr1;
[0078]
timemix1优选为10分钟至4小时,更优选为30分钟至3小时,进一步更优选为1
‑
3小时;
[0079]
timestirr1优选为10分钟至5小时,更优选为20分钟至4小时,进一步更优选为20分钟至3小时。
[0080]
solv2中的己基、戊基、丁基和丙基残基可以是任何可能的异构体,诸如正、异、仲和叔异构体。
[0081]
优选地,solv2是乙酸丁酯、乙酸异丙酯或乙酸戊酯;
[0082]
更优选地,solv2是乙酸丁酯;
[0083]
进一步更优选地,solv2是乙酸正丁酯。
[0084]
可以在去除一部分solv1之前、期间或之后添加solv2,优选在去除一部分solv1期间或之后添加solv2。
[0085]
进一步更优选地,在去除这部分solv1之后加入solv2。
[0086]
当去除部分solv1时,则优选去除35至87.5wt%,更优选40至85wt%,进一步更优选45至85wt%,该wt%基于solv1的重量。
[0087]
当仅在如上所述去除部分solv1之后才添加solv2时,则在如上所述去除部分solv1之后和添加solv2之前,反应混合物的体积优选为1至10ml每g式(i)化合物,更优选为2至6ml每g式(i)化合物。
[0088]
优选地,solv2的重量为式(i)化合物的量的2至15倍,更优选为2至13倍,进一步更优选为2至12倍,特别是3至11倍。
[0089]
优选地,在用solv2替换solv1期间的温度temp2为10至100℃,更优选为20至75℃,进一步更优选为30至60℃。
[0090]
step2可以包含反应混合物的过滤filt2,该过滤可以在用solv2替换solv1之前或之后进行,优选在用solv2交换solv1之后进行。
[0091]
优选地,用孔径为0.1至10微米,更优选为0.2至5微米,进一步更优选为0.3至2微米的过滤器进行filt2。
[0092]
在filt2之后,可以用solv2清洗过滤器。
[0093]
优选地,在filt2之后用于洗涤过滤器的solv2的重量为式(i)化合物的重量的0.5至7.5倍,更优选为0.75至5倍,进一步更优选为1至3倍。
[0094]
优选地,该方法还包含步骤step3,
[0095]
step3在step2之后完成;
[0096]
在step3中,去除部分solv2。
[0097]
优选地,去除部分solv2后,反应混合物的体积为1.5至15ml每g式(i)化合物,更优选为1.5至10ml每g式(i)化合物,进一步更优选2至8ml每g式(i)化合物。
[0098]
优选地,该方法进一步包含步骤step4,
[0099]
step4在step2之后或step3之后完成;
[0100]
在step4中,分别将来自step2或step3的混合物与溶剂solv4混合;
[0101]
solv4选自戊烷、己烷、环己烷、甲基环己烷、庚烷、辛烷、甲苯、二甲苯、二乙醚、mtbe、其任何异构体及其混合物;
[0102]
优选地,solv4是庚烷、其任何异构体、甲苯或它们的混合物;
[0103]
更优选地,solv4是庚烷或甲苯的异构体混合物。
[0104]
优选地,将solv4分别添加来自step2或step3的混合物中。
[0105]
优选地,solv4的重量为式(i)化合物的重量的0.1至15倍,更优选为0.2至10倍,进一步更优选为0.2至5倍,特别是0.3至4倍。
[0106]
优选地,在分别将来自step2或来自step3的混合物与solv4混合期间的温度temp4为0至95℃,更优选为20至75℃,进一步更优选为30至60℃,特别是35至55℃。
[0107]
优选地,该方法包含step3,并且在step3之后完成step4。
[0108]
优选地,该方法进一步包含步骤step5,
[0109]
step5在step4之后完成;
[0110]
在step5中,将来自step4的混合物冷却到温度temp5;
[0111]
temp5为
‑
20至20℃,优选为
‑
15至15℃,更优选为
‑
10至10℃,进一步更优选为
‑
5至
5℃,特别是
‑
2.5至2.5℃,尤其为
‑
1至1℃。
[0112]
优选地,step5中的冷却时间time5为0.5至10小时,更优选为1至5小时,进一步更优选为2至4小时。
[0113]
优选地,step5在冷却之后包含搅拌stirr5。
[0114]
优选地,stirr5在temp5下完成。
[0115]
优选地,stirr5的时间为0.1至48小时,更优选为0.25至48小时,进一步优选为0.5至24小时,特别是0.5至20小时,尤其是0.5至18小时。
[0116]
在一个实施例中,该方法包含步骤step1和step2;
[0117]
在另一个实施例中,该方法包含步骤step1、step2和step3;
[0118]
在另一个实施例中,该方法包含步骤step1、step2和step4;
[0119]
在另一个实施例中,该方法包含步骤step1、step2、step3和step4;
[0120]
在另一个实施例中,该方法包含步骤step1、step2、step4和step5
[0121]
在另一个实施例中,该方法包含步骤step1、step2、step3、step4和step5。
[0122]
在步骤step1、step2、step3、step4或step5中的任何一个之后,可以通过技术人员已知的标准方法来分离式(ii)的化合物,诸如蒸馏、离心、过滤、洗涤和干燥,优选过滤、洗涤和干燥。可以使用solv4进行清洗,优选在过滤后进行。
[0123]
实施例
[0124]
材料
[0125][0126]
实施例1
[0127]
在n2气氛下,将20.0g(0.110mol,1.00eq)l
‑
酪氨酸和400g thf装入配备有回流冷凝器的500ml反应器中,该回流冷凝器的冷却器温度为
‑
15℃,并将混合物加热至45℃。在45℃下,在120分钟的时间内加入15.3g(0.155mol,1.41eq)光气。将悬浮液在45℃下搅拌直至所有固体溶解,大约30分钟后就是这种情况。通过蒸馏将体积减少至100ml。在40至50℃下添加200g乙酸丁酯。通过蒸馏将反应体积减少至150ml。将形成的悬浮液在3小时内冷却至0℃,并在0℃搅拌17小时。将悬浮液在真空下过滤并将滤饼用25ml庚烷洗涤。将固体在50℃下真空干燥,得到21.8g(95.9%)白色产物。
[0128]
co2滴定法测定
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
98.0%w/w
[0129]
滴定法测定的氯化物含量
ꢀꢀ
426mg/kg
[0130]
实施例2
[0131]
在n2气氛下,将45.0g(0.186mol,1.00eq)l
‑
lys(tfa)
‑
oh和391g thf装入配备有回流冷凝器的500ml反应器中,该回流冷凝器的冷却器温度为
‑
15℃,并将混合物加热至20℃。在20℃下,在120分钟的时间内加入46.0g(0.465mol,2.50eq)光气。在30分钟内将悬浮液加热至30℃并搅拌直至所有固体溶解,大约2小时20分钟后就是这种情况。通过蒸馏将体积减少至100ml。在35至40℃下添加150g乙酸丁酯。将溶液通过0.5微米的过滤器过滤。用50g乙酸丁酯洗涤反应器和过滤器。通过蒸馏将合并的产物溶液减少至100ml,并在40至50℃下添加17g庚烷。将形成的悬浮液在3小时内冷却至0℃,并在0℃下搅拌1小时。将悬浮液在真空下过滤并将滤饼用50ml庚烷洗涤。将该固体在50℃下真空干燥,得到43.1g(86.5%)白色产物。
[0132]
co2滴定法测定
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
98.6%w/w
[0133]
滴定法测定的氯化物含量
ꢀꢀ
389mg/kg
[0134]
实施例3
[0135]
在n2气氛下,将20.0g(0.224mol,1.00eq)l
‑
丙氨酸和445g thf装入配备有回流冷凝器的500ml反应器中,该回流冷凝器的冷却器温度为
‑
15℃,并将混合物加热至50℃。在50℃下,在120分钟的时间内添加55.0g(0.561mol,2.50eq)光气。搅拌该悬浮液直至所有固体溶解,大约2小时后就是这种情况。通过蒸馏将体积减少至100ml。在35至40℃下添加214g乙酸丁酯。将溶液通过1微米的过滤器过滤。用50g乙酸丁酯洗涤反应器和过滤器。通过蒸馏将合并的产物溶液减少至100ml,并在40至50℃下添加75g庚烷。将形成的悬浮液在3小时内冷却至0℃,并在0℃下搅拌1小时。将悬浮液在真空下过滤并将滤饼用25ml庚烷洗涤。将该固体在50℃下真空干燥,得到20.4g(79.0%)白色产物。
[0136]
co2滴定法测定
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
97.7%w/w
[0137]
滴定法测定的氯化物含量
ꢀꢀ
620mg/kg
[0138]
实施例4
[0139]
在n2气氛下,将45.0g(0.189mol,1.00eq)l
‑
glu
‑
(obzl)
‑
oh和258g thf装入配备有回流冷凝器的500ml反应器中,该回流冷凝器的冷却器温度为
‑
15℃,并将混合物加热至50℃。在50℃下,在120分钟的时间内加入28.0g(0.283mol,1.50eq)光气。搅拌该悬浮液直至所有固体溶解,大约1小时后就是这种情况。通过蒸馏将体积减少至150ml。在35至40℃下添加175g乙酸丁酯。将溶液通过1微米的过滤器过滤。用50g乙酸丁酯洗涤反应器和过滤器。通过蒸馏将合并的产物溶液减少至200ml,并在40至50℃下添加150g庚烷。将形成的悬浮液在3小时内冷却至0℃,并在0℃下搅拌1小时。将悬浮液在真空下过滤并将滤饼用50ml庚烷洗涤。将该固体在50℃下真空干燥,得到46.5g(93.5%)白色产物。
[0140]
co2滴定法测定
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
98.9%w/w
[0141]
滴定法测定的氯化物含量
ꢀꢀ
262mg/kg
[0142]
实施例5
[0143]
重复实施例4,不同之处在于加入乙酸异丙酯代替乙酸丁酯。
[0144]
产率:91.5%。
[0145]
比较例1
[0146]
重复实施例4,不同之处在于加入乙酸乙酯代替乙酸丁酯。
[0147]
产率:87.5%,低于实施例4(乙酸丁酯)和实施例5(乙酸异丙酯)的90%以上的产率,并且也低于wo 2006/047703 a2的实施例2的89.2%的产率。
[0148]
比较例2
[0149]
重复wo 2006/047703 a2的实施例2,不同之处在于使用乙酸丁酯代替乙酸乙酯。
[0150]
产率:32.3%,大大低于实施例4(乙酸丁酯)和实施例5(乙酸异丙酯)的90%以上的产率。
[0151]
比较例3
[0152]
重复wo 2006/047703 a2的实施例2,不同之处在于使用乙酸异丙酯代替乙酸乙酯。
[0153]
产率:42.6%,大大低于实施例4(乙酸丁酯)和实施例5(乙酸异丙酯)的90%以上的产率。
[0154]
实施例6和7
[0155]
重复实施例3,不同之处在表2中给出:
[0156]
实施例与实施例3的不同之处产率评测氯化物
ꢀꢀ
[%][wt%][mg/kg]6n
‑
甲基丙氨酸替代l
‑
丙氨酸77.698.75057甲苯替代庚烷70.198.5179
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1