具有核酸酶活性的多肽的制作方法
具有核酸酶活性的多肽
1.序列表的引用
2.本申请含有处于计算机可读形式的序列表,将其通过引用并入本文。
技术领域
3.本发明涉及具有核酸酶活性的多肽和编码这些多肽的多核苷酸。本发明还涉及包含这些多核苷酸的核酸构建体、载体和重组宿主细胞,以及产生、回收和使用这些多肽的方法。本发明进一步涉及洗涤剂组合物,其包含具有核酸酶活性的一种或多种多肽。本发明进一步涉及洗涤方法和具有核酸酶活性的多肽的用途。
背景技术:
4.当使用衣物洗涤物品(像t恤或运动衣)时,它们暴露于来自使用者的身体和来自它们所处的使用环境中其余部分的细菌,体垢例如汗液、死细胞、皮肤碎片,污染物等。这些体垢和污染物中的一些能够粘附于衣物洗涤物品并且在该物品上形成生物膜。体垢的存在意味着,衣物洗涤物品变得粘稠并且因此污垢粘附到粘稠区域。使用可商购的洗涤剂组合物难以去除这种污垢。此外,当非常脏的衣物洗涤物品与不太脏的衣物洗涤物品一起洗涤时,洗涤液中存在的污物倾向于粘附到体垢,使得衣物洗涤物品在洗涤后可能比洗涤前更“脏”。此外,这些体垢可以是难闻的气味的来源,该难闻的气味在使用衣物洗涤物品后产生。难闻的气味难以去除,并且即使在洗涤后仍可存在。
5.国际专利申请wo 2011/098579涉及细菌脱氧核糖核酸酶化合物以及用于破坏和防止生物膜的方法。
技术实现要素:
6.本发明提供具有核酸酶活性的多肽;编码这些多肽的多核苷酸;包含所述多肽的组合物;方法以及所述具有核酸酶活性的多肽的用途。
7.本发明的一个方面涉及清洁组合物,其包含:
8.(a)至少0.001ppm的具有核酸酶活性的多肽,其中该多肽包含基序[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h(seq id no:102)、g[ga]nx[vilfy]x[vlm](seq id no:103)和/或[sadn]r[gs]h(seq id no:104)中的一个或多个;其中该多肽属于pfam家族pf02265(s1
‑
p1_核酸酶)、pf01223(核酸内切酶_ns)或pf13930(核酸内切酶_ns_2);和
[0009]
(b)一种或多种表面活性剂。
[0010]
本发明的另一方面涉及具有核酸酶活性的多肽,以及包含如多肽的清洁组合物,其中该多肽选自由以下组成的第一组:
[0011]
(a)与seq id no:3的多肽具有至少99%序列同一性的多肽;
[0012]
(b)与seq id no:6的多肽具有至少62%序列同一性的多肽;
[0013]
(c)与seq id no:12的多肽具有至少97%序列同一性的多肽;以及
[0014]
(d)与seq id no:21或27的多肽具有至少86%序列同一性的多肽;
[0015]
(e)与seq id no:30的多肽具有至少98%序列同一性的多肽;
[0016]
(f)与seq id no:33或48的多肽具有100%序列同一性的多肽;
[0017]
(g)与seq id no:39或51的多肽具有至少76%序列同一性的多肽;
[0018]
(h)与seq id no:42的多肽具有至少95%序列同一性的多肽;
[0019]
(i)与seq id no:45或24的多肽具有至少79%序列同一性的多肽;
[0020]
(j)与seq id no:54的多肽具有至少94%序列同一性的多肽;
[0021]
(k)与seq id no:57的多肽具有至少72%序列同一性的多肽;
[0022]
(l)与seq id no:60的多肽具有至少82%序列同一性的多肽;
[0023]
(m)与seq id no:63的多肽具有至少75%序列同一性的多肽;
[0024]
(n)与seq id no:69或75的多肽具有至少80%序列同一性的多肽;
[0025]
或该多肽选自由以下组成的第二组:
[0026]
(o)与seq id no:78的多肽具有至少77%序列同一性的多肽;
[0027]
(p)与seq id no:84的多肽具有至少94%序列同一性的多肽;
[0028]
(q)与seq id no:87的多肽具有至少99%序列同一性的多肽;
[0029]
(r)与seq id no:90的多肽具有至少80%序列同一性的多肽;以及
[0030]
(s)与seq id no:93的多肽具有至少90%序列同一性的多肽;
[0031]
或该多肽是选自以下的变体或片段:
[0032]
(t)选自所述第一组或所述第二组的多肽的变体,其中该变体具有核酸酶活性并包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20位置中的一个或多个氨基酸取代、和/或一个或多个氨基酸缺失、和/或一个或多个氨基酸插入或其任何组合;以及
[0033]
(u)(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)、(j)、(k)、(l)、(m)、(n)、(o)、(p)、(q)、(r)和(s)的多肽的片段,其中所述片段具有核酸酶活性。
[0034]
本发明的一个方面涉及编码本发明的多肽的多核苷酸。
[0035]
本发明的一个方面涉及核酸构建体或表达载体,该核酸构建体或表达载体包含编码本发明的多肽的多核苷酸,其中该多核苷酸可操作地连接至指导该多肽在表达宿主中的产生的一个或多个控制序列。
[0036]
本发明的一个方面涉及重组宿主细胞,该重组宿主细胞包含编码本发明的多肽的多核苷酸,该多核苷酸可操作地连接至指导该多肽的产生的一个或多个控制序列。
[0037]
本发明的一个方面涉及产生本发明的多肽的方法,该方法包括在有益于产生该多肽的条件下培养细胞,该细胞以其野生型形式产生该多肽;以及任选地回收该多肽。
[0038]
本发明的一个方面涉及包含本发明的多肽的全培养液配制品或细胞培养组合物。
[0039]
本发明的一个方面涉及清洁组合物,其包含:
[0040]
(a)至少0.001ppm的具有核酸酶活性的多肽;和
[0041]
(b)一种或多种表面活性剂;
[0042]
其中该多肽选自由以下组成的组:
[0043]
(i)与seq id no:9的多肽具有至少80%序列同一性的多肽;
[0044]
(ii)与seq id no:15的多肽具有至少80%序列同一性的多肽;
[0045]
(iii)与seq id no:18的多肽具有至少80%序列同一性的多肽;
[0046]
(iv)与seq id no:36的多肽具有至少80%序列同一性的多肽;
[0047]
(v)与seq id no:66的多肽具有至少80%序列同一性的多肽;
[0048]
(vi)与seq id no:72的多肽具有至少80%序列同一性的多肽;
[0049]
(vii)与seq id no:81的多肽具有至少80%序列同一性的多肽;
[0050]
(viii)与seq id no:96的多肽具有至少80%序列同一性的多肽;
[0051]
(ix)与seq id no:99的多肽具有至少80%序列同一性的多肽。
[0052]
除至少一种表面活性剂之外,本文的清洁组合物优选地还包含一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶。
[0053]
一个方面涉及用于洗涤物品的洗涤方法,该洗涤方法包括以下步骤:
[0054]
a)将物品暴露于包含本发明的多肽的洗涤液或包含本发明的多肽的清洁组合物;
[0055]
b)完成至少一个洗涤周期;以及
[0056]
c)任选地冲洗该物品,
[0057]
其中该物品是纺织品。
[0058]
本发明的一个方面涉及根据本发明的多肽或根据本发明的清洁组合物用于清洁物品的用途,该清洁通过如下项进行:
[0059]
(a)防止、减少或去除该物品的粘性;
[0060]
(b)防止、减少或去除来自该物品的生物膜或生物膜组分;
[0061]
(c)在该物品的清洁期间防止、减少或去除污垢的再沉积;
[0062]
(d)防止、减少或去除污垢在该物品上的附着;
[0063]
(e)维持或改进该物品的白度;或
[0064]
(f)防止、减少或去除来自该物品的恶臭,
[0065]
其中该物品是纺织品。
[0066]
序列综述
[0067]
s1
‑
p1核酸酶基因及其编码的多肽:
[0068]
seq id no:1:编码来自钩状木霉(trichoderma hamatum)的全长多肽的dna
[0069]
seq id no:2:衍生自seq id no:1的多肽
[0070]
seq id no:3:获得自钩状木霉的成熟多肽
[0071]
seq id no:4:编码来自宽肋羊肚菌(morchella costata)的全长多肽的dna
[0072]
seq id no:5:衍生自seq id no:4的多肽
[0073]
seq id no:6:获得自宽肋羊肚菌的成熟多肽
[0074]
seq id no:7:编码来自里氏木霉(trichoderma reesei)的全长多肽的dna
[0075]
seq id no:8:衍生自seq id no:7的多肽
[0076]
seq id no:9:获得自里氏木霉的成熟多肽
[0077]
seq id no:10:编码来自奶灰青霉(penicillium cremeogriseum)的全长多肽的dna
[0078]
seq id no:11:衍生自seq id no:10的多肽
[0079]
seq id no:12:获得自奶灰青霉的成熟多肽
[0080]
seq id no:13:编码来自玉蜀黍狭壳柱孢(stenocarpella maydis)的全长多肽的dna
[0081]
seq id no:14:衍生自seq id no:13的多肽
[0082]
seq id no:15:获得自玉蜀黍狭壳柱孢的成熟多肽
[0083]
seq id no:16:编码来自玉蜀黍狭壳柱孢的全长多肽的dna
[0084]
seq id no:17:衍生自seq id no:16的多肽
[0085]
seq id no:18:获得自玉蜀黍狭壳柱孢的成熟多肽
[0086]
seq id no:19:编码来自深红虫草(cordyceps cardinalis)的全长多肽的dna
[0087]
seq id no:20:衍生自seq id no:19的多肽
[0088]
seq id no:21:获得自深红虫草的成熟多肽
[0089]
seq id no:22:编码来自膝曲瓶霉(phialophora geniculata)的全长多肽的dna
[0090]
seq id no:23:衍生自seq id no:22的多肽
[0091]
seq id no:24:获得自膝曲瓶霉的成熟多肽
[0092]
seq id no:25:编码来自塔形栾背芽突霉(cadophora fastigiata)的全长多肽的dna
[0093]
seq id no:26:衍生自seq id no:25的多肽
[0094]
seq id no:27:获得自塔形栾背芽突霉的成熟多肽
[0095]
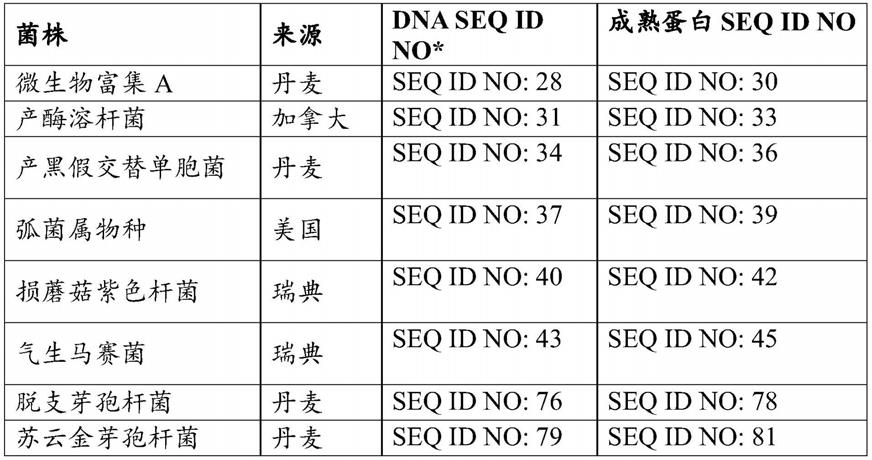
seq id no:28:编码来自微生物富集a(microbial enrichment a)的全长多肽的dna
[0096]
seq id no:29:衍生自seq id no:28的多肽
[0097]
seq id no:30:获得自微生物富集a的成熟多肽
[0098]
seq id no:31:编码来自产酶溶杆菌(lysobacter enzymogenes)的全长多肽的dna
[0099]
seq id no:32:衍生自seq id no:31的多肽
[0100]
seq id no:33:获得自产酶溶杆菌的成熟多肽
[0101]
seq id no:34:编码来自产黑假交替单胞菌(pseudoalteromonas nigrifaciens)的全长多肽的dna
[0102]
seq id no:35:衍生自seq id no:34的多肽
[0103]
seq id no:36:获得自产黑假交替单胞菌的成熟多肽
[0104]
seq id no:37:编码来自弧菌属物种(vibrio sp.)的全长多肽的dnaseq id no:38:衍生自seq id no:37的多肽
[0105]
seq id no:39:获得自弧菌属物种的成熟多肽
[0106]
seq id no:40:编码来自损蘑菇紫色杆菌(janthinobacterium agaricidamnosum)的全长多肽的dna
[0107]
seq id no:41:衍生自seq id no:40的多肽
[0108]
seq id no:42:获得自损蘑菇紫色杆菌的成熟多肽
[0109]
seq id no:43:编码来自气生马赛菌(massilia aerilata)的全长多肽的dna
[0110]
seq id no:44:衍生自seq id no:43的多肽
[0111]
seq id no:45:获得自气生马赛菌的成熟多肽
[0112]
seq id no:46:编码来自米曲霉(aspergillus oryzae)的全长多肽的dna
[0113]
seq id no:47:衍生自seq id no:46的多肽
[0114]
seq id no:48:获得自米曲霉的成熟多肽
[0115]
seq id no:49:编码来自黑绿青霉(penicillium atramentosum)的全长多肽的dna
[0116]
seq id no:50:衍生自seq id no:49的多肽
[0117]
seq id no:51:获得自黑绿青霉的成熟多肽
[0118]
seq id no:52:编码来自埃默森青霉(penicillium emersonii)的全长多肽的dna
[0119]
seq id no:53:衍生自seq id no:52的多肽
[0120]
seq id no:54:获得自埃默森青霉的成熟多肽
[0121]
seq id no:55:编码来自奥斯特罗帕芭芭拉(ostropa barbara)的全长多肽的dna
[0122]
seq id no:56:衍生自seq id no:55的多肽
[0123]
seq id no:57:获得自奥斯特罗帕芭芭拉的成熟多肽
[0124]
seq id no:58:编码来自拟棘壳孢菌属物种(pyrenochaetopsis sp.)的全长多肽的dna
[0125]
seq id no:59:衍生自seq id no:58的多肽
[0126]
seq id no:60:获得自拟棘壳孢菌属物种的成熟多肽
[0127]
seq id no:61:编码来自小毛盘菌属物种(lachnellula sp.)的全长多肽的dna
[0128]
seq id no:62:衍生自seq id no:61的多肽
[0129]
seq id no:63:获得自小毛盘菌属物种的成熟多肽
[0130]
seq id no:64:编码来自里氏木霉的全长多肽的dna
[0131]
seq id no:65:衍生自seq id no:64的多肽
[0132]
seq id no:66:获得自里氏木霉的成熟多肽
[0133]
seq id no:67:编码来自深红虫草的全长多肽的dna
[0134]
seq id no:68:衍生自seq id no:67的多肽
[0135]
seq id no:69:获得自深红虫草的成熟多肽
[0136]
seq id no:70:编码来自嗜碱枝顶孢(acremonium alcalophilum)的全长多肽的dna
[0137]
seq id no:71:衍生自seq id no:70的多肽
[0138]
seq id no:72:获得自嗜碱枝顶孢的成熟多肽
[0139]
seq id no:73:编码来自芦苇微座孢(microdochium phragmitis)的全长多肽的dna
[0140]
seq id no:74:衍生自seq id no:73的多肽
[0141]
seq id no:75:获得自芦苇微座孢的成熟多肽
[0142]
en_ns核酸酶基因及其编码的多肽:
[0143]
seq id no:76:编码来自脱支芽孢杆菌(bacillus deramificans)的全长多肽的dna
[0144]
seq id no:77:衍生自seq id no:76的多肽
[0145]
seq id no:78:获得自脱支芽孢杆菌的成熟多肽
[0146]
seq id no:79:编码来自苏云金芽孢杆菌(bacillus thuringiensis)的全长多肽的dna
[0147]
seq id no:80:衍生自seq id no:79的多肽
[0148]
seq id no:81:获得自苏云金芽孢杆菌的成熟多肽
[0149]
seq id no:82:编码来自帚青霉(penicillium virgatum)的全长多肽的dna
[0150]
seq id no:83:衍生自seq id no:82的多肽
[0151]
seq id no:84:获得自帚青霉的成熟多肽
[0152]
seq id no:85:编码来自卷须链霉菌(streptomyces cirratus)的全长多肽的dna
[0153]
seq id no:86:衍生自seq id no:85的多肽
[0154]
seq id no:87:获得自卷须链霉菌的成熟多肽
[0155]
seq id no:88:编码来自枝顶孢霉属物种(acremonium sp.)xz1968的全长多肽的dna
[0156]
seq id no:89:衍生自seq id no:88的多肽
[0157]
seq id no:90:获得自枝顶孢霉属物种xz1968的成熟多肽
[0158]
seq id no:91:编码来自开裂轮层炭壳菌(daldinia fissa)的全长多肽的dna
[0159]
seq id no:92:衍生自seq id no:91的多肽
[0160]
seq id no:93:获得自开裂轮层炭壳菌的成熟多肽
[0161]
seq id no:94:编码来自雅致放射毛霉(actinomucor elegans)的全长多肽的dna
[0162]
seq id no:95:衍生自seq id no:94的多肽
[0163]
seq id no:96:获得自雅致放射毛霉的成熟多肽
[0164]
seq id no:97:编码来自雷塞氏篮状菌(talaromyces leycettanus)的全长多肽的dna
[0165]
seq id no:98:衍生自seq id no:97的多肽
[0166]
seq id no:99:获得自雷塞氏篮状菌的成熟多肽
[0167]
克隆引物:
[0168]
seq id no:100:5
’‑
gacgcggccgcaccatgccgcgcttactccc
[0169]
seq id no:101:5
’‑
gacgcgatcgctcaagagggctgactcg基序:
[0170]
seq id no:102:[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h
[0171]
seq id no:103:g[ga]nx[vilfy]x[vlm]
[0172]
seq id no:104:[sadn]r[gs]h
[0173]
信号肽:
[0174]
seq id no:105:mkkplgkivastallisvafsssiasa
[0175]
另外的en_ns核酸酶基因及其编码的多肽:
[0176]
seq id no:106:编码来自芽孢杆菌属物种(bacillus sp.)的全长多肽的dna
[0177]
seq id no:107:衍生自seq id no:106的多肽
[0178]
seq id no:108:获得自芽孢杆菌属物种的成熟多肽
[0179]
seq id no:109:编码来自婴儿链球菌(streptococcus infantis)的全长多肽的dna
[0180]
seq id no:110:衍生自seq id no:109的多肽
[0181]
seq id no:111:获得自婴儿链球菌的成熟多肽
[0182]
另外的基序:
[0183]
seq id no:112:p[lm]h[va][ga]
[0184]
seq id no:113:plh[dn]e
[0185]
seq id no:114:[yv][dn]rgh
[0186]
seq id no:115:ydrghq[av]
[0187]
seq id no:116:[dna]r[gsc]h[li]
[0188]
seq id no:117:[rienlg][yf][rhn]v
[0189]
定义
[0190]
术语“核酸酶”意指具有核酸酶活性的多肽,并且在本发明的上下文中关于两组多肽使用。第一组多肽是s1
‑
p1核酸酶,这些s1
‑
p1核酸酶切割无序列特异性的单链dna和rna(ec:3.1.30.1),并且也可在双链dna或rna或dna
‑
rna杂合体中引入单链断裂。该第一组的多肽包含s1
‑
p1_核酸酶结构域(pfam结构域id pf02265,pfam版本31.0finn(2016)nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285)。
[0191]
第二组多肽被分类为核酸外切酶或核酸内切酶(en_ns核酸酶),因为它们的特征在于具有功能性核酸内切酶_ns或核酸内切酶_ns_2结构域(鉴定为pfam结构域id pf01223或pf13930)(finn等人,(2016)nucleic acids research[核酸研究],44:d279
‑
d285,以及pfam版本31.0)。核酸内切酶_ns和核酸内切酶_ns_2是为多肽提供催化活性的功能性结构域。
[0192]
s1_p1
‑
核酸酶是切割单链或双链核酸中的dna或rna的非特异性核酸酶。
[0193]
核酸内切酶_ns核酸酶是切割dna和rna的非特异性核酸内切酶,其切割双链或单链核酸。
[0194]
出于本发明的目的,根据实例中所描述的程序确定核酸酶活性。本发明的第一组多肽具有seq id no:3、6、9、12、15、18、21、24、27、30、33、36、39、42、45、48、51、54、57、60、63、66、69、72或75的成熟多肽的至少20%,例如,至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、或至少100%的核酸酶活性。
[0195]
本发明的第二组多肽具有seq id no:78、81、84、87、90、93、96、99、108或111的成熟多肽的至少20%,例如,至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、或至少100%的核酸酶活性。
[0196]
术语“等位基因变体”意指占据同一染色体基因座的基因的两种或更多种替代形式中的任一种。等位基因变异通过突变而自然产生,并且可以导致群体内部的多态性。基因突变可以是沉默的(所编码的多肽无变化)或可以编码具有改变的氨基酸序列的多肽。多肽的等位基因变体是由基因的等位基因变体编码的多肽。
[0197]
术语“生物膜”意指由其中细胞彼此粘附在一起或粘附至表面(如纺织品、餐具或硬表面)或另一种表面的任何群组的微生物产生的膜。这些粘附细胞通常嵌入细胞外聚合物(eps)的自生基质中。生物膜eps是一般由细胞外dna、蛋白质和多糖组成的聚合物团块。生物膜可以形成在活的或非活的表面上。在生物膜中生长的微生物细胞与同一生物的浮游细胞(相比之下,浮游细胞是可以在液体介质中漂浮或浮游的单个细胞)在生理上是不同的。生活在生物膜中的细菌通常与同一物种的浮游细菌具有显著不同的特性,因为膜的密集并且受保护的环境允许它们以不同方式协作和相互作用。微生物的这一环境的一个益处是增加对洗涤剂和抗生素的抗性,因为,密集的细胞外基质和细胞的外层保护群落的内部。关于产生衣物洗涤生物膜的细菌可以在以下物种中找到,这些物种包括:不动杆菌属物种
(acinetobacter sp.)、气微菌属物种(aeromicrobium sp.)、短波单胞菌属物种(brevundimonas sp.)、微杆菌属物种(microbacterium sp.)、滕黄微球菌(micrococcus luteus)、假单胞菌属物种(pseudomonas sp.)、表皮葡萄球菌(staphylococcus epidermidis)以及寡养单胞菌属物种(stenotrophomonas sp.)。关于产生硬表面生物膜的细菌可以在以下物种中找到:不动杆菌属物种、气微菌属物种、短波单胞菌属物种、微杆菌属物种、滕黄微球菌、假单胞菌属物种、表皮葡萄球菌、金黄色葡萄球菌(staphylococcus aureus)以及寡养单胞菌属物种。
[0198]
术语“催化结构域”意指含有该酶的催化机构的酶的区域。
[0199]
术语“cdna”意指可以通过从获得自真核或原核细胞的成熟的、剪接的mrna分子进行反转录而制备的dna分子。cdna缺乏可以存在于对应基因组dna中的内含子序列。初始的初级rna转录物是mrna的前体,其要通过一系列的步骤(包括剪接)进行加工,然后呈现为成熟的剪接的mrna。
[0200]
术语“编码序列”意指直接指定多肽的氨基酸序列的多核苷酸。编码序列的边界通常由可读框确定,该可读框以起始密码子(例如atg、gtg或ttg)开始并且以终止密码子(例如taa、tag或tga)结束。编码序列可为基因组dna、cdna、合成dna或其组合。
[0201]
术语“控制序列”意指表达编码本发明的成熟多肽的多核苷酸所必需的核酸序列。每个控制序列对于编码该多肽的多核苷酸来说可以是天然的(即,来自相同基因)或外源的(即,来自不同基因),或相对于彼此是天然的或外源的。此类控制序列包括但不限于前导序列、多腺苷酸化序列、前肽序列、启动子、信号肽序列、以及转录终止子。最少,控制序列包括启动子、以及转录和翻译终止信号。出于引入有利于将控制序列与编码多肽的多核苷酸的编码区连接的特异性限制位点的目的,这些控制序列可以提供有多个接头。
[0202]
在本上下文中,术语“深度清洁”意指破坏、减少或去除有机组分,如多糖、蛋白质、rna、dna、污垢或存在于有机物质(如生物膜)中的其他组分。
[0203]
术语“清洁组合物”包括“洗涤剂组合物”并且是指用于从有待清洁的物品(如纺织品、餐具和硬表面)除去不希望的化合物的组合物。该洗涤剂组合物可以用于例如清洁纺织品,用于家用清洁和工业清洁二者。这些术语涵盖选择用于希望的特定类型的清洁组合物和产品的形式(例如,液体、凝胶、粉末、颗粒、膏、或喷雾组合物)的任何材料/化合物,并且包括但不限于洗涤剂组合物(例如,液体和/或固体衣物洗涤剂和精细织物洗涤剂;织物清新剂;织物软化剂;以及纺织品和衣物预去污剂/预处理)。
[0204]
除了含有本发明的酶之外,该清洁组合物还可以含有一种或多种另外的酶(如dna酶、蛋白酶、淀粉酶、脂肪酶、角质酶、纤维素酶、内切葡聚糖酶、木葡聚糖酶、果胶酶、果胶裂解酶、黄原胶酶、过氧化物酶、卤代过氧合酶、过氧化氢酶、半乳聚糖酶、甘露聚糖酶、或其任何混合物),和/或清洁组分,如表面活性剂、助洗剂、螯合剂或螯合试剂、漂白系统或漂白组分、聚合物、增泡剂、抑泡剂、染料、香料、晦暗抑制剂、光学增亮剂、杀细菌剂、杀真菌剂、污垢悬浮剂、防腐剂、酶抑制剂或稳定剂、酶活化剂、一种或多种转移酶、水解酶、氧化还原酶、上蓝剂和荧光染料、抗氧化剂以及增溶剂。
[0205]
术语“表达”包括涉及多肽产生的任何步骤,包括但不限于:转录、转录后修饰、翻译、翻译后修饰、以及分泌。
[0206]
术语“表达载体”意指直链或环状dna分子,其包含编码多肽的多核苷酸并且可操
作地连接至提供用于其表达的控制序列。
[0207]
术语“片段”意指具有从成熟多肽或结构域的氨基和/或羧基末端缺失的一个或多个氨基酸的多肽或催化结构域;其中该片段具有核酸酶活性。
[0208]
术语“his
‑
标签”是指典型地包含至少6个组氨酸残基的多组氨酸标签,该多组氨酸标签可以添加到n
‑
或c
‑
末端上。his标签在本领域已知用于例如蛋白质纯化,但也可以用于改进低ph值下的溶解度。类似地,如本领域已知的,“hq
‑
标签”(即组氨酸
‑
谷氨酰胺标签)也可以用于纯化目的。
[0209]
术语“宿主细胞”意指易于用包含本发明的多核苷酸的核酸构建体或表达载体进行转化、转染、转导等的任何细胞类型。术语“宿主细胞”涵盖由于复制期间出现的突变而与亲本细胞不完全相同的任何亲本细胞子代。
[0210]
本文将术语“改进的洗涤性能”定义为相对于没有酶的相同洗涤剂组合物的洗涤性能,展示出洗涤剂组合物中增加的洗涤性能的酶,例如,通过增加污渍去除或较少的再沉积。术语“改进的洗涤性能”包括在衣物洗涤、硬表面和餐具洗涤中的洗涤性能。
[0211]
术语“分离的”意指处于自然界中不存在的形式或环境中的物质。分离的物质的非限制性实例包括(1)任何非天然存在的物质,(2)包括但不限于任何酶、变体、核酸、蛋白质、肽或辅因子的任何物质,该物质至少部分地从与其性质相关的一种或多种或所有天然存在的成分中去除;(3)相对于自然界中发现的物质通过人工修饰的任何物质;或(4)通过相对于与其天然相关的其他组分,增加物质的量而修饰的任何物质(例如,宿主细胞中的重组产生;编码该物质的基因的多个拷贝;以及使用比与编码该物质的基因天然相关的启动子更强的启动子)。分离的物质可以存在于发酵液样品中;例如宿主细胞可以经遗传修饰以表达本发明的多肽。来自该宿主细胞的发酵液将包含分离的多肽。
[0212]
术语“衣物洗涤”涉及家用衣物洗涤和工业衣物洗涤两者并且意指用含有本发明的清洁或洗涤剂组合物的溶液处理纺织品的过程。衣物洗涤过程可以例如使用例如家用或工业洗衣机进行或可以手动进行。
[0213]
关于术语“恶臭”意指在清洁物品上不希望的气味。清洁的物品应气味清新并且干净,而没有粘附在该物品上的恶臭。恶臭的一个实例是具有令人不快的气味的化合物,其可以由微生物产生并且被在生物膜内捕获或粘附到生物膜的“胶”上。令人不快的气味的其他实例是附着于已经与人或动物接触的物品的汗味或体味。恶臭的其他实例是来自香味料的气味,其粘附于物品,例如气味强烈的咖喱或其他异国香味料。
[0214]
术语“成熟多肽”意指在n
‑
末端加工(例如,信号肽的去除)后处于其成熟形式的多肽。
[0215]
在一方面,该成熟多肽是seq id no:2的氨基酸1至302。seq id no:2的氨基酸
‑
19至
‑
1是信号肽。
[0216]
在一方面,该成熟多肽是seq id no:5的氨基酸1至336。seq id no:5的氨基酸
‑
21至
‑
1是信号肽。
[0217]
在一方面,该成熟多肽是seq id no:8的氨基酸1至324。seq id no:8的氨基酸
‑
20至
‑
1是信号肽。
[0218]
在一方面,该成熟多肽是seq id no:11的氨基酸1至322。seq id no:11的氨基酸
‑
20至
‑
1是信号肽。
[0219]
在一方面,该成熟多肽是seq id no:14的氨基酸1至276。seq id no:14的氨基酸
‑
19至
‑
1是信号肽。
[0220]
在一方面,该成熟多肽是seq id no:17的氨基酸1至321。seq id no:17的氨基酸
‑
17至
‑
1是信号肽。
[0221]
在一方面,该成熟多肽是seq id no:20的氨基酸1至314。seq id no:20的氨基酸
‑
20至
‑
1是信号肽。
[0222]
在一方面,该成熟多肽是seq id no:23的氨基酸1至302。seq id no:23的氨基酸
‑
19至
‑
1是信号肽。
[0223]
在一方面,该成熟多肽是seq id no:26的氨基酸1至273。seq id no:26的氨基酸
‑
20至
‑
1是信号肽。
[0224]
在一方面,该成熟多肽是seq id no:29的氨基酸1至240。seq id no:29的氨基酸
‑
30至
‑
1是信号肽。
[0225]
在一方面,该成熟多肽是seq id no:32的氨基酸1至252。seq id no:32的氨基酸
‑
34至
‑
1是信号肽。
[0226]
在一方面,该成熟多肽是seq id no:35的氨基酸1至258。seq id no:35的氨基酸
‑
26至
‑
1是信号肽。
[0227]
在一方面,该成熟多肽是seq id no:38的氨基酸1至251。seq id no:38的氨基酸
‑
24至
‑
1是信号肽。
[0228]
在一方面,该成熟多肽是seq id no:41的氨基酸1至324。seq id no:41的氨基酸
‑
21至
‑
1是信号肽。
[0229]
在一方面,该成熟多肽是seq id no:44的氨基酸1至332。seq id no:44的氨基酸
‑
2至
‑
1是信号肽。
[0230]
在一方面,该成熟多肽是seq id no:47的氨基酸1至322。seq id no:47的氨基酸
‑
20至
‑
1是信号肽。
[0231]
在一方面,该成熟多肽是seq id no:50的氨基酸1至324。seq id no:50的氨基酸
‑
19至
‑
1是信号肽。
[0232]
在一方面,该成熟多肽是seq id no:53的氨基酸1至267。seq id no:53的氨基酸
‑
19至
‑
1是信号肽。
[0233]
在一方面,该成熟多肽是seq id no:56的氨基酸1至271。seq id no:56的氨基酸
‑
19至
‑
1是信号肽。
[0234]
在一方面,该成熟多肽是seq id no:59的氨基酸1至292。seq id no:59的氨基酸
‑
18至
‑
1是信号肽。
[0235]
在一方面,该成熟多肽是seq id no:62的氨基酸1至270。seq id no:62的氨基酸
‑
21至
‑
1是信号肽。
[0236]
在一方面,该成熟多肽是seq id no:65的氨基酸1至308。seq id no:65的氨基酸
‑
19至
‑
1是信号肽。
[0237]
在一方面,该成熟多肽是seq id no:68的氨基酸1至288。seq id no:68的氨基酸
‑
19至
‑
1是信号肽。
[0238]
在一方面,该成熟多肽是seq id no:71的氨基酸1至285。seq id no:71的氨基酸
‑
19至
‑
1是信号肽。
[0239]
在一方面,该成熟多肽是seq id no:74的氨基酸1至308。seq id no:74的氨基酸
‑
20至
‑
1是信号肽。
[0240]
在一方面,该成熟多肽是seq id no:77的氨基酸1至371。seq id no:77的氨基酸
‑
28至
‑
1是信号肽。
[0241]
在一方面,该成熟多肽是seq id no:80的氨基酸1至235。seq id no:80的氨基酸
‑
25至
‑
1是信号肽。
[0242]
在一方面,该成熟多肽是seq id no:83的氨基酸1至302。seq id no:83的氨基酸
‑
22至
‑
1是信号肽。
[0243]
在一方面,该成熟多肽是seq id no:86的氨基酸1至246。seq id no:86的氨基酸
‑
28至
‑
1是信号肽。
[0244]
在一方面,该成熟多肽是seq id no:89的氨基酸1至322。seq id no:89的氨基酸
‑
21至
‑
1是信号肽。
[0245]
在一方面,该成熟多肽是seq id no:92的氨基酸1至345。seq id no:92的氨基酸
‑
18至
‑
1是信号肽。
[0246]
在一方面,该成熟多肽是seq id no:95的氨基酸1至279。seq id no:95的氨基酸
‑
25至
‑
1是信号肽。
[0247]
在一方面,该成熟多肽是seq id no:98的氨基酸1至319。seq id no:98的氨基酸
‑
17至
‑
1是信号肽。
[0248]
在本领域中已知的是,宿主细胞可以产生由相同多核苷酸表达的两种或更多种不同的成熟多肽(即,具有不同的c
‑
末端和/或n
‑
末端氨基酸)的混合物。在本领域中还已知的是,不同的宿主细胞不同地加工多肽,并且因此一个表达多核苷酸的宿主细胞当与另一个表达相同多核苷酸的宿主细胞相比时可以产生不同的成熟多肽(例如,具有不同的c
‑
末端和/或n
‑
末端氨基酸)。
[0249]
术语“成熟多肽编码序列”意指编码具有核酸酶活性的成熟多肽的多核苷酸。在一方面,该成熟多肽编码序列是seq id no:1的核苷酸58至1095;并且seq id no:1的核苷酸1至57编码信号肽。
[0250]
在另一方面,该成熟多肽编码序列是seq id no:4的核苷酸64至1135;并且seq id no:4的核苷酸1至63编码信号肽。
[0251]
在另一方面,该成熟多肽编码序列是seq id no:7的核苷酸61至1113;并且seq id no:7的核苷酸1至60编码信号肽。
[0252]
在另一方面,该成熟多肽编码序列是seq id no:10的核苷酸61至1078;并且seq id no:10的核苷酸1至60编码信号肽。
[0253]
在另一方面,该成熟多肽编码序列是seq id no:13的核苷酸58至1124;并且seq id no:13的核苷酸1至57编码信号肽。
[0254]
在另一方面,该成熟多肽编码序列是seq id no:16的核苷酸52至1083;并且seq id no:16的核苷酸1至51编码信号肽。
[0255]
在另一方面,该成熟多肽编码序列是seq id no:19的核苷酸61至1119;并且seq id no:19的核苷酸1至60编码信号肽。
no:79的核苷酸1至75编码信号肽。
[0276]
在另一方面,该成熟多肽编码序列是seq id no:82的核苷酸67至972;并且seq id no:82的核苷酸1至66编码信号肽。
[0277]
在另一方面,该成熟多肽编码序列是seq id no:85的核苷酸85至822;并且seq id no:85的核苷酸1至84编码信号肽。
[0278]
在另一方面,该成熟多肽编码序列是seq id no:88的核苷酸64至1029;并且seq id no:88的核苷酸1至63编码信号肽。
[0279]
在另一方面,该成熟多肽编码序列是seq id no:91的核苷酸55至1089;并且seq id no:91的核苷酸1至75编码信号肽。
[0280]
在另一方面,该成熟多肽编码序列是seq id no:94的核苷酸76至973;并且seq id no:94的核苷酸1至75编码信号肽。
[0281]
在另一方面,该成熟多肽编码序列是seq id no:97的核苷酸52至1008;并且seq id no:97的核苷酸1至51编码信号肽。
[0282]
术语“核酸构建体”意指单链或双链的核酸分子,该核酸分子是从天然存在的基因中分离的,或以原本不存在于自然界中的方式被修饰成包含核酸的区段,或者是合成的,该核酸分子包含一个或多个控制序列。
[0283]
术语“可操作地连接”意指如下构型,在该构型中,控制序列被放置在相对于多核苷酸的编码序列适当的位置处,使得该控制序列指导该编码序列的表达。
[0284]
两个氨基酸序列之间或两个核苷酸序列之间的关联度通过参数“序列同一性”来描述。
[0285]
出于本发明的目的,使用如在emboss软件包(emboss:欧洲分子生物学开放软件包(emboss:the european molecular biology open software suite),rice等人,2000,trends genet.[遗传学趋势]16:276
‑
277)(优选5.0.0版本或更新版本)的尼德尔程序中所实施的尼德曼
‑
翁施算法(needleman
‑
wunsch algorithm)(needleman和wunsch,1970,j.mol.biol.[分子生物学杂志]48:443
‑
453)来确定两个氨基酸序列之间的序列同一性。所使用的参数是空位开放罚分10、空位延伸罚分0.5和eblosum62(emboss的blosum62版)取代矩阵。将标记为“最长同一性”的needle的输出(使用非简化选项(nobrief option)获得)用作同一性百分比并且计算如下:
[0286]
(相同的残基x 100)/(比对长度
‑
比对中的空位总数)
[0287]
出于本发明的目的,使用如在emboss软件包(emboss:欧洲分子生物学开放软件包(emboss:the european molecular biology open software suite),rice等人,2000,同上)(优选5.0.0版本或更新版本)的尼德尔程序中所实施的尼德曼
‑
翁施算法(needleman和wunsch,1970,同上)来确定两个脱氧核糖核苷酸序列之间的序列同一性。所使用的参数是空位开放罚分10、空位延伸罚分0.5和ednafull(ncbi nuc4.4的emboss版)取代矩阵。将标记为“最长同一性”的needle的输出(使用非简化选项(nobrief option)获得)用作同一性百分比并且计算如下:
[0288]
(相同的脱氧核糖核苷酸x 100)/(比对长度
‑
比对中的空位总数)
[0289]
术语“子序列”意指使一个或多个核苷酸从成熟多肽编码序列的5'端和/或3'端缺失的多核苷酸;其中该子序列编码具有核酸酶活性的片段。
[0290]
术语“变体”意指具有核酸酶活性的、在一个或多个位置处包含改变(即取代、插入和/或缺失)的多肽。取代意指用不同的氨基酸替代占据某一位置的氨基酸;缺失意指去除占据某一位置的氨基酸;而插入意指在邻接并且紧随占据某一位置的氨基酸之后添加氨基酸。术语“纺织品”意指包括纱线、纱线中间体、纤维、非机织物材料、天然材料、合成材料、以及任何其他纺织品材料的任何纺织品材料,这些材料制造的织物和由这些织物制成的产品(例如服装和其他物品)。该纺织品或织物可以处于针织品、机织物(woven)、牛仔布(denim)、非机织物、毡、纱线、以及毛巾布的形式。该纺织品可以是基于纤维素的,如天然纤维素制品,包括棉、亚麻/亚麻布、黄麻、苎麻、剑麻或椰壳纤维,或者人造纤维素(例如,来源于木浆),包括粘胶纤维/人造丝、乙酸纤维素纤维(三胞)、莱赛尔纤维(lyocell)或其共混物。该纺织品或织物也可以不基于纤维素,如天然聚酰胺,包括羊毛、驼毛、羊绒、马海毛、兔毛和蚕丝,或合成聚合物如尼龙、芳族聚酰胺、聚酯、丙烯酸、聚丙烯和氨纶/弹性纤维(spandex/elastane)、或其共混物以及基于纤维素和不基于纤维素的纤维的共混物。共混物的实例是棉和/或人造丝/粘胶纤维与一种或多种伴随材料的共混物,该伴随材料如羊毛、合成纤维(例如聚酰胺纤维、丙烯酸纤维、聚酯纤维、聚氯乙烯纤维、聚氨酯纤维、聚脲纤维、芳族聚酰胺纤维)和/或含纤维素的纤维(例如人造丝/粘胶纤维、苎麻、亚麻/亚麻布、黄麻、乙酸纤维素纤维、莱赛尔纤维)。织物可以是常规的可洗涤衣物,例如有污渍的家用衣物。当使用术语织物或服装时,旨在也包括广义术语纺织品。
[0291]
本文将术语“洗涤周期”定义为如下洗涤操作,其中将一种或多种物品暴露于洗涤液,并且使这些物品和洗涤液经受相互作用,例如通过将某种机械作用施加至该洗涤液和/或该物品,或通过将该洗涤液喷洒到这些物品上,以释放污渍,并且协助洗涤液流进和流出这些物品,并且最终去除多余的洗涤液。在一个或多个洗涤周期后,总体上对这些物品进行冲洗和干燥。本文将术语“洗涤液”定义为水和清洁组合物的溶液或混合物。
[0292]
命名法:出于本发明的目的,命名法[e/q]或简单的[eq]意指在该位置的氨基酸可以是谷氨酸(glu,e)或谷氨酰胺(gln,q)。同样,命名法[v/g/a/i]或[vgai]意指在此位置的氨基酸可以是缬氨酸(val,v)、甘氨酸(gly,g)、丙氨酸(ala,a)或异亮氨酸(ile,i),对于如本文所描述的其他组合,依次类推。除非进一步另有限制,否则氨基酸x被这样定义,使得它可以是20种天然氨基酸中的任一种。
具体实施方式
[0293]
清洁组合物和具有核酸酶活性的多肽
[0294]
本发明提供具有核酸酶活性的多肽,其成员的特征在于具有赋予该多肽催化活性的功能性核酸酶结构域,以及包含这些多肽的清洁组合物。
[0295]
根据第一实施例,具有核酸酶活性的多肽是s1
‑
p1核酸酶。s1
‑
p1核酸酶切割无序列特异性的单链dna和rna,并且也可在双链dna或rna或dna
‑
rna杂合体中引入单链断裂。该s1
‑
p1包含s1
‑
p1_核酸酶结构域(pfam结构域id pf02265,pfam版本31.0finn(2016)nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285),该核酸酶结构域是赋予多肽水解活性的功能性结构域(分类为ec:3.1.30.1)。在自然界中,s1
‑
p1核酸酶是分泌的蛋白质。
[0296]
根据第二实施例,将具有核酸酶活性的多肽分类为核酸外切酶或核酸内切酶,因
为它们的特征在于具有功能性核酸内切酶_ns或核酸内切酶_ns_2结构域(鉴定为pfam结构域id pf01223和pf13930)(finn等人,(2016)nucleic acids research[核酸研究],44:d279
‑
d285,以及pfam版本31.0)。核酸内切酶_ns和核酸内切酶_ns_2是为多肽提供催化活性的功能性结构域。
[0297]
在一个实施例中,该多肽是属于pfam家族pf02265(s1
‑
p1_核酸酶)的s1
‑
p1核酸酶,并且该多肽包含基序[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h(seq id no:102)和/或g[ga]nx[vilfy]x[vlm](seq id no:103)。
[0298]
在特定的实施例中,该多肽是细菌来源的s1
‑
p1核酸酶并且包含基序p[lm]h[va][ga](seq id no:112)。
[0299]
在另一个特定的实施例中,该多肽是真菌来源的s1
‑
p1核酸酶并且包含基序plh[dn]e(seq id no:113)。
[0300]
在另一个实施例中,该多肽是属于pfam家族pf01223(核酸内切酶_ns)或pf13930(核酸内切酶_ns_2)的en_ns核酸酶,并且该多肽包含基序[sadn]r[gs]h(seq id no:104)和/或[yv][dn]rgh(seq id no:114),优选地[yv][dn]rgh(seq id no:114)。
[0301]
在一个特定的实施例中,该多肽是真菌来源的en_ns核酸酶,特别是属于pfam家族pf01223(核酸内切酶_ns)的en_ns核酸酶,并且该多肽包含基序ydrghq[av](seq id no:115)。
[0302]
在另一个特定的实施例中,该多肽是真菌来源的en_ns核酸酶,特别是属于pfam家族pf01223(核酸内切酶_ns)的en_ns核酸酶,并且该多肽包含基序[dna]r[gsc]h[li](seq id no:116)和/或[rienlg][yf][rhn]v(seq id no:117)。
[0303]
在第一方面,本发明涉及具有核酸酶活性的多肽,该多肽选自由以下组成的第一组:
[0304]
(a)与seq id no:3的多肽具有至少99%序列同一性的多肽;
[0305]
(b)与seq id no:6的多肽具有至少62%序列同一性的多肽;
[0306]
(c)与seq id no:12的多肽具有至少97%序列同一性的多肽;以及
[0307]
(d)与seq id no:21或27的多肽具有至少86%序列同一性的多肽;
[0308]
(e)与seq id no:30的多肽具有至少98%序列同一性的多肽;
[0309]
(f)与seq id no:33或48的多肽具有100%序列同一性的多肽;
[0310]
(g)与seq id no:39或51的多肽具有至少76%序列同一性的多肽;
[0311]
(h)与seq id no:42的多肽具有至少95%序列同一性的多肽;
[0312]
(i)与seq id no:45或24的多肽具有至少79%序列同一性的多肽;
[0313]
(j)与seq id no:54的多肽具有至少94%序列同一性的多肽;
[0314]
(k)与seq id no:57的多肽具有至少72%序列同一性的多肽;
[0315]
(l)与seq id no:60的多肽具有至少82%序列同一性的多肽;
[0316]
(m)与seq id no:63的多肽具有至少75%序列同一性的多肽;
[0317]
(n)与seq id no:69或75的多肽具有至少80%序列同一性的多肽;
[0318]
或该多肽选自由以下组成的第二组:
[0319]
(o)与seq id no:78的多肽具有至少77%序列同一性的多肽;
[0320]
(p)与seq id no:84的多肽具有至少94%序列同一性的多肽;
[0321]
(q)与seq id no:87的多肽具有至少99%序列同一性的多肽;
[0322]
(r)与seq id no:90的多肽具有至少80%序列同一性的多肽;
[0323]
(s)与seq id no:93的多肽具有至少90%序列同一性的多肽;
[0324]
或该多肽是选自以下的变体或片段:
[0325]
(t)选自所述第一组或所述第二组的多肽的变体,其中该变体具有核酸酶活性并包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20位置中的一个或多个氨基酸取代、和/或一个或多个氨基酸缺失、和/或一个或多个氨基酸插入或其任何组合;以及
[0326]
(u)(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)、(j)、(k)、(l)、(m)、(n)、(o)、(p)、(q)、(r)和(s)的多肽的片段,其中所述片段具有核酸酶活性。
[0327]
该具有核酸酶活性的多肽可以选自由以下组成的所述第一组:
[0328]
i.与seq id no:6、24、39、45、51、57、63、69和75中任一个的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[0329]
ii.与seq id no:21、27、42、54和60中任一个的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[0330]
在本发明的另一个实施例中,该具有核酸酶活性的多肽选自由以下组成的所述第二组:
[0331]
iii.与seq id no:78或90的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[0332]
iv.与seq id no:84或93的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[0333]
在本发明的一个实施例中,该具有核酸酶活性的多肽可以由多核苷酸编码,该多核苷酸与以下序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性:
[0334]
v.seq id no:28、31、37、40、76、82、85、88和91中任一个的成熟多肽编码序列;或
[0335]
vi.seq id no:1、4、10、19、22、25、43、46、49、52、55、58、61、67和73中任一个的成熟多肽cdna编码序列。
[0336]
在本发明的实施例中,该具有核酸酶活性的多肽可选自由以下多肽组成的组:
[0337]
(a)包含seq id no:3或seq id no:2的成熟多肽,或由其组成;
[0338]
(b)包含seq id no:6或seq id no:5的成熟多肽,或由其组成;
[0339]
(c)包含seq id no:12或seq id no:11的成熟多肽,或由其组成;
[0340]
(d)包含seq id no:21或seq id no:20的成熟多肽,或由其组成;
[0341]
(e)包含seq id no:24或seq id no:23的成熟多肽,或由其组成;
[0342]
(f)包含seq id no:27或seq id no:26的成熟多肽,或由其组成;
[0343]
(g)包含seq id no:30或seq id no:29的成熟多肽,或由其组成;
[0344]
(h)包含seq id no:33或seq id no:32的成熟多肽,或由其组成;
[0345]
(i)包含seq id no:39或seq id no:38的成熟多肽,或由其组成;
[0346]
(j)包含seq id no:42或seq id no:41的成熟多肽,或由其组成;
[0347]
(k)包含seq id no:45或seq id no:44的成熟多肽,或由其组成;
[0348]
(l)包含seq id no:48或seq id no:47的成熟多肽,或由其组成;
[0349]
(m)包含seq id no:51或seq id no:50的成熟多肽,或由其组成;
[0350]
(n)包含seq id no:54或seq id no:53的成熟多肽,或由其组成;
[0351]
(o)包含seq id no:57或seq id no:56的成熟多肽,或由其组成;
[0352]
(p)包含seq id no:60或seq id no:59的成熟多肽,或由其组成;
[0353]
(q)包含seq id no:63或seq id no:62的成熟多肽,或由其组成;
[0354]
(r)包含seq id no:69或seq id no:68的成熟多肽,或由其组成;
[0355]
(s)包含seq id no:75或seq id no:74的成熟多肽,或由其组成;
[0356]
(t)包含seq id no:78或seq id no:77的成熟多肽,或由其组成;
[0357]
(u)包含seq id no:84或seq id no:83的成熟多肽,或由其组成;
[0358]
(v)包含seq id no:87或seq id no:86的成熟多肽,或由其组成;
[0359]
(w)包含seq id no:90或seq id no:89的成熟多肽,或由其组成;
[0360]
(x)包含seq id no:93或seq id no:92的成熟多肽,或由其组成;
[0361]
(y)包含seq id no:96或seq id no:95的成熟多肽,或由其组成;
[0362]
(z)包含seq id no:99或seq id no:98的成熟多肽,或由其组成;
[0363]
包含seq id no:108或seq id no:107的成熟多肽,或由其组成;以及
[0364]
包含seq id no:111或seq id no:110的成熟多肽,或由其组成。
[0365]
在实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:3的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0366]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少70%的核酸酶活性。
[0367]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少75%的核酸酶活性。
[0368]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少80%的核酸酶活性。
[0369]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少85%的核酸酶活性。
[0370]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少90%的核酸酶活性。
[0371]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少95%的核
酸酶活性。
[0372]
在特定的实施例中,本发明涉及与seq id no:3的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:3的成熟多肽的至少至少100%的核酸酶活性。
[0373]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:3的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:3的成熟多肽或由其组成。
[0374]
在实施例中,本发明涉及与seq id no:6的成熟多肽具有至少62%,例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:6的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0375]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少70%的核酸酶活性。
[0376]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少75%的核酸酶活性。
[0377]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少80%的核酸酶活性。
[0378]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少85%的核酸酶活性。
[0379]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少90%的核酸酶活性。
[0380]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成熟多肽的至少至少95%的核酸酶活性。
[0381]
在特定的实施例中,本发明涉及与seq id no:6的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:6的成
熟多肽的至少至少100%的核酸酶活性。
[0382]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:6的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:6的成熟多肽或由其组成。
[0383]
在实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:12的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0384]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少70%的核酸酶活性。
[0385]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少75%的核酸酶活性。
[0386]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少80%的核酸酶活性。
[0387]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少85%的核酸酶活性。
[0388]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少90%的核酸酶活性。
[0389]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少95%的核酸酶活性。
[0390]
在特定的实施例中,本发明涉及与seq id no:12的成熟多肽具有至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:12的成熟多肽的至少至少100%的核酸酶活性。
[0391]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:12的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:12的成熟多肽或由其组成。
[0392]
在实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:21或seq id no:27的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0393]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少
97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少70%的核酸酶活性。
[0394]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少75%的核酸酶活性。
[0395]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少80%的核酸酶活性。
[0396]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少85%的核酸酶活性。
[0397]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少90%的核酸酶活性。
[0398]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少86%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少95%的核酸酶活性。
[0399]
在特定的实施例中,本发明涉及与seq id no:21或seq id no:27的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:21或seq id no:27的成熟多肽的至少至少100%的核酸酶活性。
[0400]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:21或seq id no:27的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:21或seq id no:27的成熟多肽或由其组成。
[0401]
在实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:30的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0402]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少70%的核酸酶活性。
[0403]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少75%的核酸酶活性。
[0404]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少80%的核酸酶活性。
[0405]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少85%的核酸酶活性。
[0406]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少90%的核酸酶活性。
[0407]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少95%的核酸酶活性。
[0408]
在特定的实施例中,本发明涉及与seq id no:30的成熟多肽具有至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:30的成熟多肽的至少至少100%的核酸酶活性。
[0409]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:30的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:30的成熟多肽或由其组成。
[0410]
在实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:33或seq id no:48的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0411]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少70%的核酸酶活性。
[0412]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少75%的核酸酶活性。
[0413]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少80%的核酸酶活性。
[0414]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少85%的核酸酶活性。
[0415]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少90%的核酸酶活性。
[0416]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多
肽的至少至少95%的核酸酶活性。
[0417]
在特定的实施例中,本发明涉及与seq id no:33或seq id no:48的成熟多肽具有100%的序列同一性的多肽,并且其中该多肽具有seq id no:33或seq id no:48的成熟多肽的至少至少100%的核酸酶活性。
[0418]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:33或seq id no:48的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:33或seq id no:48的成熟多肽或由其组成。
[0419]
在实施例中,本发明涉及与seq id no:39的成熟多肽具有至少76%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:39的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0420]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少70%的核酸酶活性。
[0421]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少75%的核酸酶活性。
[0422]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少80%的核酸酶活性。
[0423]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少85%的核酸酶活性。
[0424]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少90%的核酸酶活性。
[0425]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的成熟多肽的至少至少95%的核酸酶活性。
[0426]
在特定的实施例中,本发明涉及与seq id no:39的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:39的
成熟多肽的至少至少100%的核酸酶活性。
[0427]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:39的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:39的成熟多肽或由其组成。
[0428]
在实施例中,本发明涉及与seq id no:42的成熟多肽具有至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:42的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0429]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少70%的核酸酶活性。
[0430]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少75%的核酸酶活性。
[0431]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少80%的核酸酶活性。
[0432]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少85%的核酸酶活性。
[0433]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少90%的核酸酶活性。
[0434]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少95%的核酸酶活性。
[0435]
在特定的实施例中,本发明涉及与seq id no:42的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:42的成熟多肽的至少至少100%的核酸酶活性。
[0436]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:42的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:42的成熟多肽或由其组成。
[0437]
在实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少69%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:45或seq id no:24的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0438]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少70%的核酸酶活性。
[0439]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少75%的核酸酶活性。
[0440]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少80%的核酸酶活性。
[0441]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少85%的核酸酶活性。
[0442]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少90%的核酸酶活性。
[0443]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少95%的核酸酶活性。
[0444]
在特定的实施例中,本发明涉及与seq id no:45或seq id no:24的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:45或seq id no:24的成熟多肽的至少至少100%的核酸酶活性。
[0445]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:45或seq id no:24的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:45或seq id no:24的成熟多肽或由其组成。
[0446]
在实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:54的成熟多肽相差多达10个(例如1个、2个、3个、
4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0447]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少70%的核酸酶活性。
[0448]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少75%的核酸酶活性。
[0449]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少80%的核酸酶活性。
[0450]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少85%的核酸酶活性。
[0451]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少90%的核酸酶活性。
[0452]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少95%的核酸酶活性。
[0453]
在特定的实施例中,本发明涉及与seq id no:54的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:54的成熟多肽的至少至少100%的核酸酶活性。
[0454]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:54的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:54的成熟多肽或由其组成。
[0455]
在实施例中,本发明涉及与seq id no:57的成熟多肽具有至少72%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:57的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0456]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少70%的核酸酶活性。
[0457]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少75%的核酸酶活性。
[0458]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少
85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少80%的核酸酶活性。
[0459]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少85%的核酸酶活性。
[0460]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少90%的核酸酶活性。
[0461]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少95%的核酸酶活性。
[0462]
在特定的实施例中,本发明涉及与seq id no:57的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:57的成熟多肽的至少至少100%的核酸酶活性。
[0463]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:57的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:57的成熟多肽或由其组成。
[0464]
在实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:60的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0465]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少70%的核酸酶活性。
[0466]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少75%的核酸酶活性。
[0467]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少80%的核酸酶活性。
[0468]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少85%的核酸酶活性。
[0469]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少90%的核酸酶活性。
[0470]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少95%的核酸酶活性。
[0471]
在特定的实施例中,本发明涉及与seq id no:60的成熟多肽具有至少82%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:60的成熟多肽的至少至少100%的核酸酶活性。
[0472]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:60的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:60的成熟多肽或由其组成。
[0473]
在实施例中,本发明涉及与seq id no:63的成熟多肽具有至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:63的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0474]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少70%的核酸酶活性。
[0475]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少75%的核酸酶活性。
[0476]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少80%的核酸酶活性。
[0477]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的
成熟多肽的至少至少85%的核酸酶活性。
[0478]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少90%的核酸酶活性。
[0479]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少95%的核酸酶活性。
[0480]
在特定的实施例中,本发明涉及与seq id no:63的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:63的成熟多肽的至少至少100%的核酸酶活性。
[0481]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:63的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:63的成熟多肽或由其组成。
[0482]
在实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:69或seq id no:75的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0483]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少70%的核酸酶活性。
[0484]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少75%的核酸酶活性。
[0485]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少80%的核酸酶活性。
[0486]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少85%的核酸酶活性。
[0487]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少
96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少90%的核酸酶活性。
[0488]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少95%的核酸酶活性。
[0489]
在特定的实施例中,本发明涉及与seq id no:69或seq id no:75的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:69或seq id no:75的成熟多肽的至少至少100%的核酸酶活性。
[0490]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:69或seq id no:75的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:69或seq id no:75的成熟多肽或由其组成。
[0491]
在实施例中,本发明涉及与seq id no:78的成熟多肽具有至少77%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:78的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0492]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少70%的核酸酶活性。
[0493]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少75%的核酸酶活性。
[0494]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少80%的核酸酶活性。
[0495]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少85%的核酸酶活性。
[0496]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少90%的核酸酶活性。
[0497]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少
85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少95%的核酸酶活性。
[0498]
在特定的实施例中,本发明涉及与seq id no:78的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:78的成熟多肽的至少至少100%的核酸酶活性。
[0499]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:78的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:78的成熟多肽或由其组成。
[0500]
在实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:84的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0501]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少70%的核酸酶活性。
[0502]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少75%的核酸酶活性。
[0503]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少80%的核酸酶活性。
[0504]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少85%的核酸酶活性。
[0505]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少90%的核酸酶活性。
[0506]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少95%的核酸酶活性。
[0507]
在特定的实施例中,本发明涉及与seq id no:84的成熟多肽具有至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:84的成熟多肽的至少至少100%的核酸酶活性。
[0508]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:84的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:84的成熟多肽或由其组成。
[0509]
在实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序
列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:87的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0510]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少70%的核酸酶活性。
[0511]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少75%的核酸酶活性。
[0512]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少80%的核酸酶活性。
[0513]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少85%的核酸酶活性。
[0514]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少90%的核酸酶活性。
[0515]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少95%的核酸酶活性。
[0516]
在特定的实施例中,本发明涉及与seq id no:87的成熟多肽具有至少99%或100%的序列同一性的多肽,并且其中该多肽具有seq id no:87的成熟多肽的至少至少100%的核酸酶活性。
[0517]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:87的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:87的成熟多肽或由其组成。
[0518]
在实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:90的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0519]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少70%的核酸酶活性。
[0520]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少75%的核酸酶活性。
[0521]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少80%的核酸酶活性。
[0522]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少85%的核酸酶活性。
[0523]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少90%的核酸酶活性。
[0524]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少95%的核酸酶活性。
[0525]
在特定的实施例中,本发明涉及与seq id no:90的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:90的成熟多肽的至少至少100%的核酸酶活性。
[0526]
在实施例中,该多肽已经被分离。本发明的多肽优选地包含seq id no:90的氨基酸序列或其等位基因变体,或由其组成;或是其具有核酸酶活性的片段。在另一方面,该多肽包含seq id no:90的成熟多肽或由其组成。
[0527]
在实施例中,本发明涉及与seq id no:93的成熟多肽具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,这些多肽具有核酸酶活性。在一方面,这些多肽与seq id no:93的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0528]
在特定的实施例中,本发明涉及与seq id no:93的成熟多肽具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:93的成熟多肽的至少至少70%的核酸酶活性。
[0529]
在特定的实施例中,本发明涉及与seq id no:93的成熟多肽具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:93的成熟多肽的至少至少75%的核酸酶活性。
[0530]
在特定的实施例中,本发明涉及与seq id no:93的成熟多肽具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:93的成熟多肽的至少至少80%的核酸酶活性。
id no:70、seq id no:73的成熟多肽编码序列或其cdna序列具有至少60%,例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性。在另外的实施例中,该多肽已经被分离。
[0539]
在另一个实施例中,本发明涉及由多核苷酸编码的具有核酸酶活性的多肽,该多核苷酸与seq id no:28、seq id no:31、seq id no:34、seq id no:37、seq id no:40、seq id no:43、seq id no:76、seq id no:79、seq id no:82、seq id no:85、seq id no:88、seq id no:91、seq id no:94、或seq id no:97的成熟多肽编码序列具有至少60%,例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性。在另外的实施例中,该多肽已经被分离。
[0540]
在另一个实施例中,本发明涉及seq id no:1、seq id no:4、seq id no:7、seq id no:10、seq id no:13、seq id no:16、seq id no:19、seq id no:22、seq id no:25、seq id no:28、seq id no:31、seq id no:34、seq id no:37、seq id no:40、seq id no:43、seq id no:46、seq id no:49、seq id no:52、seq id no:55、seq id no:58、seq id no:61、seq id no:64、seq id no:67、seq id no:70、seq id no:73、seq id no:76、seq id no:79、seq id no:82、seq id no:85、seq id no:88、seq id no:91、seq id no:94、或seq id no:97的成熟多肽的变体,这些变体在一个或多个位置处包含取代、缺失、和/或插入。在实施例中,引入seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:21、seq id no:24、seq id no:27、seq id no:30、seq id no:33、seq id no:36、seq id no:39、seq id no:42、seq id no:45、seq id no:48、seq id no:51、seq id no:54、seq id no:57、seq id no:60、seq id no:63、seq id no:66、seq id no:69、seq id no:72、seq id no:75、seq id no:78、seq id no:81、seq id no:84、seq id no:87、seq id no:90、seq id no:93、seq id no:96、seq id no:99、seq id no:108、或seq id no:111的成熟多肽中的氨基酸取代、缺失和/或插入的数目多达10个,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个。氨基酸改变可以具有微小性质,即,不会显著地影响蛋白质的折叠和/或活性的保守氨基酸取代或插入;典型地为1
‑
30个氨基酸的小缺失;小的氨基末端或羧基末端延伸,如氨基末端的甲硫氨酸残基;多达20
‑
25个残基的小接头肽;或小的延伸,其通过改变净电荷或另一功能(例如聚组氨酸段、抗原表位或结合结构域)来促进纯化。
[0541]
保守取代的实例是在下组之内:碱性氨基酸(精氨酸、赖氨酸及组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺和天冬酰胺)、疏水性氨基酸(亮氨酸、异亮氨酸及缬氨酸)、芳族氨基酸(苯丙氨酸、色氨酸及酪氨酸)及小氨基酸(甘氨酸、丙氨酸、丝氨酸、苏氨酸及甲硫氨酸)。通常不会改变比活性的氨基酸取代是本领域已知的并且例如由h.neurath和r.l.hill,1979,于the proteins[蛋白质],academic press[学术出版社],纽约中描述。常见取代为ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、tyr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu和asp/gly。
[0542]
可以根据本领域中已知的程序,如定点诱变或丙氨酸扫描诱变(cunningham和wells,1989,science[科学]244:1081
‑
1085)来鉴定多肽中的必需氨基酸。在后一项技术
中,在该分子中的每个残基处引入单个丙氨酸突变,并且测试所得分子的核酸酶活性以鉴定对于该分子的活性关键的氨基酸残基。还参见,hilton等人,1996,j.biol.chem.[生物化学杂志]271:4699
‑
4708。酶或其他生物学相互作用的活性部位还可通过对结构的物理分析来确定,如由下述技术确定:核磁共振、晶体学(crystallography)、电子衍射、或光亲和标记,连同对推定的接触位点(contact site)氨基酸进行突变。参见例如,de vos等人,1992,science[科学]255:306
‑
312;smith等人,1992,j.mol.biol.[分子生物学杂志]224:899
‑
904;wlodaver等人,1992,febs lett.[欧洲生化学会联合会快报]309:59
‑
64。还可以从与相关多肽的比对来推断必需氨基酸的身份。
[0543]
使用已知的诱变、重组和/或改组方法,随后进行相关的筛选程序可以做出单或多氨基酸取代、缺失和/或插入并对其进行测试,这些相关的筛选程序例如由reidhaar
‑
olson和sauer,1988,science[科学]241:53
‑
57;bowie和sauer,1989,proc.natl.acad.sci.usa[美国国家科学院院刊]86:2152
‑
2156;wo 95/17413;或wo 95/22625披露的那些。其他可以使用的方法包括易错pcr、噬菌体展示(例如lowman等人,1991,biochemistry[生物化学]30:10832
‑
10837;美国专利号5,223,409;wo 92/06204)以及区域定向诱变(derbyshire等人,1986,gene[基因]46:145;ner等人,1988,dna 7:127)。
[0544]
诱变/改组方法可以与高通量、自动化的筛选方法组合以检测由宿主细胞表达的克隆的、诱变的多肽的活性(ness等人,1999,nature biotechnology[自然生物技术]17:893
‑
896)。可从宿主细胞回收编码活性多肽的诱变的dna分子,并使用本领域的标准方法快速测序。这些方法允许快速确定多肽中各个氨基酸残基的重要性。
[0545]
多肽可以是杂合多肽,其中一种多肽的一个区域在另一种多肽的一个区域的n
‑
末端或c
‑
末端处融合。
[0546]
该多肽可以是融合多肽或可切割的融合多肽,其中另一种多肽在本发明多肽的n
‑
末端或c
‑
末端处融合。通过将编码另一种多肽的多核苷酸融合于本发明的多核苷酸来产生融合多肽。用于产生融合多肽的技术是本领域已知的,且包括连接编码多肽的编码序列使得它们符合读框,而且融合多肽的表达处于一个或多个相同的启动子和终止子的控制之下。还可以使用内含肽技术构建融合多肽,其中在翻译后产生融合多肽(cooper等人,1993,embo j.[欧洲分子生物学学会杂志]12:2575
‑
2583;dawson等人,1994,science[科学]266:776
‑
779)。
[0547]
融合多肽可进一步包含两个多肽之间的切割位点。在融合蛋白分泌之时,位点被切割,从而释放出这两种多肽。切割位点的实例包括但不限于在以下文献中披露的位点:martin等人,2003,j.ind.microbiol.biotechnol.[工业微生物生物技术杂志]3:568
‑
576;svetina等人,2000,j.biotechnol.[生物技术杂志]76:245
‑
251;rasmussen
‑
wilson等人,1997,appl.environ.microbiol.[应用与环境微生物学]63:3488
‑
3493;ward等人,1995,biotechnology[生物技术]13:498
‑
503;和contreras等人,1991,biotechnology[生物技术]9:378
‑
381;eaton等人,1986,biochemistry[生物化学]25:505
‑
512;collins
‑
racie等人,1995,biotechnology[生物技术]13:982
‑
987;carter等人,1989,proteins:structure,function,and genetics[蛋白质:结构、功能以及遗传学]6:240
‑
248;以及stevens,2003,drug discovery world[药物发现世界]4:35
‑
48。
[0548]
具有核酸酶活性的多肽的来源
[0549]
本发明的具有核酸酶活性的多肽可获得自任何属的微生物。出于本发明的目的,如本文结合给定来源使用的术语“获得自”应当意指由多核苷酸编码的多肽是由该来源或由已经插入了来自该来源的多核苷酸的菌株产生的。在一方面,获得自给定来源的多肽被分泌到细胞外。
[0550]
在一方面,具有核酸酶活性的多肽可获得自芽孢杆菌属(bacillus)、青霉属(penicillium)、链霉菌属(streptomyces)、枝顶孢霉属(acremonium)、轮层炭壳菌属(daldinia)、放射毛霉属(actinomucor)、篮状菌属(talaromyces)、溶杆菌属(lysobacter)、假交替单胞菌属(pseudoalteromonas)、弧菌属(vibrio)、紫色杆菌属(janthinobacterium)、马赛菌属(massilia)、曲霉属(aspergillus)、拟棘壳孢菌属(pyrenochaetopsis)、小毛盘菌属(lachnellula)、木霉属(trichoderma)、虫草属(cordyceps)、枝顶孢霉属、微座孢属(microdochium)、羊肚菌属(morchella)、狭壳柱孢属(stenocarpella)、虫草属、瓶霉属(phialophora)、或背芽突霉属(adophora)细胞。
[0551]
在一方面,具有核酸酶活性的多肽可获得自芽孢杆菌属,例如获得自芽孢杆菌属物种
‑
62738、脱支芽孢杆菌、或苏云金芽孢杆菌。
[0552]
在一方面,具有核酸酶活性的多肽可获得自青霉属,例如获得自帚青霉、黑绿青霉、埃默森青霉或奶灰青霉。
[0553]
在一方面,具有核酸酶活性的多肽可获得自链霉菌属,例如卷须链霉菌。
[0554]
在一方面,具有核酸酶活性的多肽可获得自枝顶孢霉属,例如枝顶孢霉属物种xz1968或嗜碱枝顶孢。
[0555]
在一方面,具有核酸酶活性的多肽可获得自轮层炭壳菌属,例如开裂轮层炭壳菌。
[0556]
在一方面,具有核酸酶活性的多肽可获得自放射毛霉属,例如雅致放射毛霉。
[0557]
在一方面,具有核酸酶活性的多肽可获得自篮状菌属,例如雷塞氏篮状菌。
[0558]
在一方面,具有核酸酶活性的多肽可获得自溶杆菌属,例如产酶溶杆菌。
[0559]
在一方面,具有核酸酶活性的多肽可获得自假交替单胞菌属,例如产黑假交替单胞菌。
[0560]
在一方面,具有核酸酶活性的多肽可获得自弧菌属,例如弧菌属物种
‑
63684。
[0561]
在一方面,具有核酸酶活性的多肽可获得自紫色杆菌属,例如损蘑菇紫色杆菌。
[0562]
在一方面,具有核酸酶活性的多肽可获得自马赛菌属,例如气生马赛菌。
[0563]
在一方面,具有核酸酶活性的多肽可获得自曲霉属,例如米曲霉。
[0564]
在一方面,具有核酸酶活性的多肽可获得自奥斯特罗帕(ostropa),例如奥斯特罗帕芭芭拉。
[0565]
在一方面,具有核酸酶活性的多肽可获得自小毛盘菌属,例如拟棘壳孢菌属物种。
[0566]
在一方面,具有核酸酶活性的多肽可获得自拟棘壳孢菌属,例如小毛盘菌属物种。
[0567]
在一方面,具有核酸酶活性的多肽可获得自木霉属,例如里氏木霉或钩状木霉。
[0568]
在一方面,具有核酸酶活性的多肽可获得自虫草属,例如深红虫草。
[0569]
在一方面,具有核酸酶活性的多肽可获得自微座孢属,例如芦苇微座孢。
[0570]
在一方面,具有核酸酶活性的多肽可获得自羊肚菌属,例如宽肋羊肚菌。
[0571]
在一方面,具有核酸酶活性的多肽可获得自狭壳柱孢属,例如玉蜀黍狭壳柱孢。
[0572]
在一方面,具有核酸酶活性的多肽可获得自瓶霉属,例如膝曲瓶霉。
[0573]
在一方面,具有核酸酶活性的多肽可获得自背芽突霉属(cadophora),例如塔形栾背芽突霉。
[0574]
应理解的是,对于前述物种,本发明涵盖完全和不完全阶段(perfect and imperfect states),和其他分类学等同物(equivalent),例如无性型,而与它们已知的种名无关。本领域的技术人员会容易地识别适当等同物的身份。
[0575]
这些物种的菌株可容易地在许多培养物保藏中心为公众所获得,如美国典型培养物保藏中心(american type culture collection,atcc)、德国微生物和细胞培养物保藏中心(deutsche sammlung von mikroorganismen und zellkulturen gmbh,dsmz)、荷兰菌种保藏中心(centraalbureau voor schimmelcultures,cbs)以及美国农业研究服务专利培养物保藏中心北方地区研究中心(agricultural research service patent culture collection,northern regional research center,nrrl)。
[0576]
可以使用以上提到的探针从其他来源,包括从自然界(例如,土壤、堆肥、水等)分离的微生物或直接从天然材料(例如,土壤、堆肥、水等)获得的dna样品鉴定和获得该多肽。用于从天然生境中直接分离微生物和dna的技术是本领域熟知的。然后可以通过类似地筛选另一微生物的基因组dna或cdna文库或混合的dna样品来获得编码该多肽的多核苷酸。一旦已经用一种或多种探针检测到编码多肽的多核苷酸,则可以通过利用本领域普通技术人员已知的技术(参见例如,sambrook等人,1989,同上)分离或克隆多核苷酸。
[0577]
多核苷酸
[0578]
本发明还涉及编码本发明的多肽的多核苷酸,如本文中所述。在实施例中,编码本发明的多肽的多核苷酸已经被分离。
[0579]
用于分离或克隆多核苷酸的技术是本领域已知的且包括从基因组dna或cdna或其组合进行分离。来自基因组dna的多核苷酸的克隆可以例如通过使用众所周知的聚合酶链式反应(pcr)或用以对具有共有的结构特征的克隆的dna片段进行检测的表达库抗体筛选来实现。参见例如,innis等人,1990,pcr:a guide to methods and application[pcr:方法和应用指南],academic press[学术出版社],纽约。可以使用其他核酸扩增程序例如连接酶链式反应(lcr)、连接激活转录(lat)和基于多核苷酸的扩增(nasba)。这些多核苷酸可以克隆自芽孢杆菌属、青霉属、链霉菌属、枝顶孢霉属、轮层炭壳菌属、放射毛霉属、篮状菌属、溶杆菌属、假交替单胞菌属、弧菌属、紫色杆菌属、马赛菌属、曲霉属、拟棘壳孢菌属、小毛盘菌属、木霉属、虫草属、枝顶孢霉属、微座孢属、羊肚菌属、狭壳柱孢属、虫草属、瓶霉属、背芽突霉属的菌株或相关生物,并且因此,例如可以是该多核苷酸的多肽编码区的等位基因变体或物种变体。
[0580]
编码本发明的多肽的多核苷酸的修饰对于合成基本上类似于该多肽的多肽可以是必需的。术语“基本上类似”于该多肽是指多肽的非天然存在的形式。
[0581]
核酸构建体
[0582]
本发明还涉及核酸构建体,这些核酸构建体包含可操作地连接至一个或多个控制序列的本发明的多核苷酸,在与控制序列相容的条件下,该一个或多个控制序列指导该编码序列在合适的宿主细胞中的表达。
[0583]
可用许多方式操作该多核苷酸以提供多肽的表达。取决于表达载体,在多核苷酸插入载体之前对其进行操作可以是理想的或必需的。用于利用重组dna方法修饰多核苷酸
的技术是本领域熟知的。
[0584]
控制序列可为启动子,即,被宿主细胞识别用于表达编码本发明的多肽的多核苷酸的多核苷酸。该启动子包含介导多肽的表达的转录控制序列。该启动子可以是在宿主细胞中显示出转录活性的任何多核苷酸,包括变体、截短型及杂合型启动子,并且可以从编码与该宿主细胞同源或异源的细胞外或细胞内多肽的基因获得。
[0585]
用于在细菌宿主细胞中指导本发明核酸构建体的转录的适合启动子的实例是从以下基因中获得的启动子:解淀粉芽孢杆菌(bacillus amyloliquefaciens)α
‑
淀粉酶基因(amyq)、地衣芽孢杆菌(bacillus licheniformis)α
‑
淀粉酶基因(amyl)、地衣芽孢杆菌青霉素酶基因(penp)、嗜热脂肪芽孢杆菌(bacillus stearothermophilus)产麦芽糖淀粉酶基因(amym)、枯草芽孢杆菌(bacillus subtilis)果聚糖蔗糖酶基因(sacb)、枯草芽孢杆菌xyla和xylb基因、苏云金芽孢杆菌cryiiia基因(agaisse和lereclus,1994,molecular microbiology[分子微生物学]13:97
‑
107)、大肠杆菌(e.coli)lac操纵子、大肠杆菌trc启动子(egon等人,1988,gene[基因]69:301
‑
315)、天蓝链霉菌(streptomyces coelicolor)琼脂水解酶基因(daga)和原核β
‑
内酰胺酶基因(villa
‑
kamaroff等人,1978,proc.natl.acad.sci.usa[美国国家科学院院刊]75:3727
‑
3731)以及tac启动子(deboer等人,1983,proc.natl.acad.sci.usa[美国国家科学院院刊]80:21
‑
25)。其他启动子描述于gilbert等人,1980,scientific american[科学美国人]242:74
‑
94的“useful proteins from recombinant bacteria[来自重组细菌的有用蛋白质]”;和在sambrook等人,1989,同上。串联启动子的实例披露于wo 99/43835中。
[0586]
用于在丝状真菌宿主细胞中指导本发明核酸构建体的转录的适合启动子的实例是从以下基因中获得的启动子:构巢曲霉(aspergillus nidulans)乙酰胺酶、黑曲霉(aspergillus niger)中性α
‑
淀粉酶、黑曲霉酸稳定性α
‑
淀粉酶、黑曲霉或泡盛曲霉(aspergillus awamori)葡糖淀粉酶(glaa)、米曲霉taka淀粉酶、米曲霉碱性蛋白酶、米曲霉丙糖磷酸异构酶、尖孢镰孢(fusarium oxysporum)胰蛋白酶样蛋白酶(wo 96/00787)、镶片镰孢(fusarium venenatum)淀粉葡糖苷酶(wo 00/56900)、镶片镰孢daria(wo00/56900)、镶片镰孢quinn(wo 00/56900)、米黑根毛霉(rhizomucor miehei)脂肪酶、米黑根毛霉天冬氨酸蛋白酶、里氏木霉β
‑
葡糖苷酶、里氏木霉纤维二糖水解酶i、里氏木霉纤维二糖水解酶ii、里氏木霉内切葡聚糖酶i、里氏木霉内切葡聚糖酶ii、里氏木霉内切葡聚糖酶iii、里氏木霉内切葡聚糖酶v、里氏木霉木聚糖酶i、里氏木霉木聚糖酶ii、里氏木霉木聚糖酶iii、里氏木霉β
‑
木糖苷酶,和里氏木霉翻译延伸因子,以及na2
‑
tpi启动子(来自曲霉属中性α
‑
淀粉酶基因的经修饰的启动子,其中已经用来自曲霉属丙糖磷酸异构酶基因的未翻译的前导序列替代未翻译的前导序列;非限制性实例包括来自黑曲霉中性α
‑
淀粉酶基因的经修饰的启动子,其中已经用来自构巢曲霉或米曲霉丙糖磷酸异构酶基因的未翻译的前导序列替代未翻译的前导序列);及其变体、截短型、以及杂合型启动子。其他启动子在美国专利号6,011,147中描述。
[0587]
在酵母宿主中,有用的启动子从以下的基因获得:酿酒酵母(saccharomyces cerevisiae)烯醇酶(eno
‑
1)、酿酒酵母半乳糖激酶(gal1)、酿酒酵母醇脱氢酶/甘油醛
‑3‑
磷酸脱氢酶(adh1、adh2/gap)、酿酒酵母丙糖磷酸异构酶(tpi)、酿酒酵母金属硫蛋白(cup1)、以及酿酒酵母3
‑
磷酸甘油酸激酶。酵母宿主细胞的其他有用的启动子由romanos等
人,1992,yeast[酵母]8:423
‑
488描述。
[0588]
控制序列也可为由宿主细胞识别以终止转录的转录终止子。该终止子可操作地连接至编码该多肽的多核苷酸的3'
‑
末端。在宿主细胞中有功能的任何终止子可用于本发明中。
[0589]
细菌宿主细胞的优选终止子从以下的基因获得:克劳氏芽孢杆菌(bacillus clausii)碱性蛋白酶(aprh)、地衣芽孢杆菌α
‑
淀粉酶(amyl)、和大肠杆菌(escherichia coli)核糖体rna(rrnb)。
[0590]
用于丝状真菌宿主细胞的优选终止子从以下的基因获得:构巢曲霉乙酰胺酶、构巢曲霉邻氨基苯甲酸合酶、黑曲霉葡糖淀粉酶、黑曲霉α
‑
葡糖苷酶、米曲霉taka淀粉酶、尖孢镰孢胰蛋白酶样蛋白酶、里氏木霉β
‑
葡糖苷酶、里氏木霉纤维二糖水解酶i、里氏木霉纤维二糖水解酶ii、里氏木霉内切葡聚糖酶i、里氏木霉内切葡聚糖酶ii、里氏木霉内切葡聚糖酶iii、里氏木霉内切葡聚糖酶v、里氏木霉木聚糖酶i、里氏木霉木聚糖酶ii、里氏木霉木聚糖酶iii、里氏木霉β
‑
木糖苷酶以及里氏木霉翻译延伸因子。
[0591]
酵母宿主细胞的优选终止子从以下的基因获得:酿酒酵母烯醇酶、酿酒酵母细胞色素c(cyc1)以及酿酒酵母甘油醛
‑3‑
磷酸脱氢酶。酵母宿主细胞的其他有用的终止子由romanos等人(1992,同上)描述。
[0592]
控制序列还可以是启动子下游和基因的编码序列上游的mrna稳定子区域,其增加该基因的表达。
[0593]
适合的mrna稳定子区域的实例从以下获得:苏云金芽孢杆菌cryiiia基因(wo 94/25612)和枯草芽孢杆菌sp82基因(hue等人,1995,journal of bacteriology[细菌学杂志]177:3465
‑
3471)。
[0594]
控制序列也可以是前导序列,即对宿主细胞翻译很重要的mrna的非翻译区域。该前导序列可操作地连接至编码该多肽的多核苷酸的5'
‑
末端。可以使用在宿主细胞中有功能的任何前导序列。
[0595]
用于丝状真菌宿主细胞的优选前导序列从米曲霉taka淀粉酶和构巢曲霉丙糖磷酸异构酶的基因获得。
[0596]
酵母宿主细胞的适合的前导序列从以下的基因获得:酿酒酵母烯醇酶(eno
‑
1)、酿酒酵母3
‑
磷酸甘油酸激酶、酿酒酵母α
‑
因子和酿酒酵母醇脱氢酶/甘油醛
‑3‑
磷酸脱氢酶(adh2/gap)。
[0597]
控制序列还可以是多腺苷酸化序列,一种可操作地连接至该多核苷酸的3
’‑
末端并且当转录时由宿主细胞识别为将多腺苷酸残基添加至所转录的mrna的信号的序列。可以使用在宿主细胞中有功能的任何多腺苷酸化序列。
[0598]
用于丝状真菌宿主细胞的优选多腺苷酸化序列从以下的基因获得:构巢曲霉邻氨基苯甲酸合酶、黑曲霉葡糖淀粉酶、黑曲霉α
‑
葡糖苷酶、米曲霉taka淀粉酶以及尖孢镰孢胰蛋白酶样蛋白酶。
[0599]
酵母宿主细胞的有用的多腺苷酸化序列由guo和sherman,1995,mol.cellular biol.[分子细胞生物学]15:5983
‑
5990描述。
[0600]
控制序列还可以是编码与多肽的n
‑
末端连接的信号肽并指导多肽进入细胞的分泌途径的信号肽编码区。多核苷酸的编码序列的5’端本身可以含有在翻译阅读框中天然与
编码多肽的编码序列区段相连接的信号肽编码序列。可替代地,编码序列的5’端可以含有对于该编码序列是外源的信号肽编码序列。在编码序列天然地不含有信号肽编码序列的情况下,可能需要外源信号肽编码序列。可替代地,外源信号肽编码序列可以单纯地替代天然信号肽编码序列以便增强多肽的分泌。然而,可以使用指导已表达多肽进入宿主细胞的分泌途径的任何信号肽编码序列。
[0601]
用于细菌宿主细胞的有效信号肽编码序列是从芽孢杆菌ncib 11837产麦芽糖淀粉酶、地衣芽孢杆菌枯草杆菌蛋白酶、地衣芽孢杆菌β
‑
内酰胺酶、嗜热脂肪芽孢杆菌α
‑
淀粉酶、嗜热脂肪芽孢杆菌中性蛋白酶(nprt、nprs、nprm)和枯草芽孢杆菌prsa的基因获得的信号肽编码序列。另外的信号肽由simonen和palva,1993,microbiological reviews[微生物评论]57:109
‑
137描述。
[0602]
用于丝状真菌宿主细胞的有效的信号肽编码序列是从以下的基因获得的信号肽编码序列:黑曲霉中性淀粉酶、黑曲霉葡糖淀粉酶、米曲霉taka淀粉酶、特异腐质霉(humicola insolens)纤维素酶、特异腐质霉内切葡聚糖酶v、柔毛腐质霉(humicola lanuginosa)脂肪酶、以及米黑根毛霉天冬氨酸蛋白酶。
[0603]
用于酵母宿主细胞的有用的信号肽从酿酒酵母α
‑
因子和酿酒酵母转化酶的基因获得。其他的有用的信号肽编码序列由romanos等人(1992,同上)描述。
[0604]
控制序列还可以是编码位于多肽的n
‑
末端的前肽的前肽编码序列。所得的多肽被称为前体酶(proenzyme)或多肽原(或在一些情况下被称为酶原(zymogen))。多肽原通常是无活性的并且可通过催化切割或自身催化切割来自多肽原的前肽而转化为活性多肽。前肽编码序列可以从以下的基因获得:枯草芽孢杆菌碱性蛋白酶(apre)、枯草芽孢杆菌中性蛋白酶(nprt)、嗜热毁丝霉(myceliophthora thermophila)漆酶(wo 95/33836)、米黑根毛霉天冬氨酸蛋白酶和酿酒酵母α
‑
因子。
[0605]
在信号肽序列和前肽序列二者都存在的情况下,该前肽序列位于紧邻多肽的n
‑
末端且该信号肽序列位于紧邻前肽序列的n
‑
末端。
[0606]
还可希望的是添加调节序列,这些调节序列调节宿主细胞生长相关的多肽的表达。调节序列的实例是引起基因表达以响应于化学或物理刺激(包括调节化合物的存在)而开启或关闭的那些。原核系统中的调节序列包括lac、tac、和trp操纵子系统。在酵母中,可以使用adh2系统或gal1系统。在丝状真菌中,可以使用黑曲霉葡糖淀粉酶启动子、米曲霉takaα
‑
淀粉酶启动子和米曲霉葡糖淀粉酶启动子、里氏木霉纤维二糖水解酶i启动子以及里氏木霉纤维二糖水解酶ii启动子。调节序列的其他实例是允许基因扩增的那些序列。在真核系统中,这些调节序列包括在甲氨蝶呤存在下扩增的二氢叶酸还原酶基因以及用重金属扩增的金属硫蛋白基因。在这些情况中,编码多肽的多核苷酸会与调节序列可操作地连接。
[0607]
表达载体
[0608]
本发明还涉及包含本发明的多核苷酸、启动子、以及转录和翻译终止信号的重组表达载体。多个核苷酸和控制序列可连接在一起以产生重组表达载体,该重组表达载体可包括一个或多个便利的限制位点以允许编码该多肽的多核苷酸在此类位点处的插入或取代。可替代地,可以通过将多核苷酸或包含该多核苷酸的核酸构建体插入用于表达的适当载体中而表达该多核苷酸。在产生表达载体时,编码序列如此位于载体中,使得编码序列与
用于表达的适当控制序列可操作地连接。
[0609]
重组表达载体可以是可以方便地经受重组dna程序并且可以引起多核苷酸表达的任何载体(例如,质粒或病毒)。载体的选择将典型地取决于载体与待引入载体的宿主细胞的相容性。载体可以是直链或闭合环状质粒。
[0610]
载体可以是自主复制载体,即作为染色体外实体存在的载体,其复制独立于染色体复制,例如质粒、染色体外元件、微染色体或人工染色体。载体可以含有用于确保自我复制的任何手段。可替代地,载体可以是这样的载体,当它引入宿主细胞中时整合入基因组中并与其中已整合了它的一个或多个染色体一起复制。此外,可以使用单独的载体或质粒或两个或更多个载体或质粒,其共同含有待引入宿主细胞基因组的总dna,或可以使用转座子。
[0611]
载体优选地含有允许方便地选择转化细胞、转染细胞、转导细胞等细胞的一个或多个选择性标记。选择性标记是一种基因,其产物提供了杀生物剂抗性或病毒抗性、对重金属抗性、对营养缺陷型的原养型等。
[0612]
细菌选择性标记的实例是地衣芽孢杆菌或枯草芽孢杆菌dal基因、或赋予抗生素抗性(如氨苄青霉素、氯霉素、卡那霉素、新霉素、大观霉素、或四环素抗性)的标记。酵母宿主细胞的适合的标记包括但不限于:ade2、his3、leu2、lys2、met3、trp1和ura3。用于在丝状真菌宿主细胞中使用的选择性标记包括但不限于adea(磷酸核糖酰氨基咪唑
‑
琥珀羧胺合酶)、adeb(磷酸核糖酰
‑
氨基咪唑合酶)、amds(乙酰胺酶)、argb(鸟氨酸氨甲酰基转移酶)、bar(草丁膦乙酰转移酶)、hph(潮霉素磷酸转移酶)、niad(硝酸还原酶)、pyrg(乳清酸核苷
‑
5'
‑
磷酸脱羧酶)、sc(硫酸腺苷基转移酶)以及trpc(邻氨基苯甲酸合酶)连同其等同物。优选的用于曲霉细胞中的是构巢曲霉或米曲霉amds和pyrg基因以及吸水链霉菌(streptomyces hygroscopicus)bar基因。优选的用于木霉属细胞的是adea、adeb、amds、hph以及pyrg基因。
[0613]
选择性标记可以是如wo 2010/039889中所述的双选择性标记系统。在一方面,双选择性标记是hph
‑
tk双选择性标记系统。
[0614]
载体优选地含有允许载体整合到宿主细胞的基因组中或载体在细胞中独立于基因组自主复制的一个或多个元件。
[0615]
对于整合到宿主细胞基因组中,载体可以依靠编码该多肽的多核苷酸序列或用于通过同源或非同源重组整合到该基因组中的该载体的任何其他元件。可替代地,载体可以含有用于指导通过同源重组而整合入宿主细胞基因组中的染色体中的精确位置处的另外的多核苷酸。为了增加在精确位置处整合的可能性,整合元件应当含有足够数目的核酸,例如100至10,000个碱基对、400至10,000个碱基对和800至10,000个碱基对,这些核酸与相应的靶序列具有高度序列同一性以增强同源重组的概率。整合元件可以是与宿主细胞基因组内的靶序列同源的任何序列。此外,整合元件可以是非编码或编码的多核苷酸。另一方面,载体可以通过非同源重组整合入宿主细胞的基因组中。
[0616]
为了自主复制,载体可以进一步包含复制起点,该复制起点使得载体在讨论中的宿主细胞中自主复制成为可能。复制起点可以是在细胞中发挥作用的介导自主复制的任何质粒复制子。术语“复制起点”或“质粒复制子”意指使质粒或载体能够在体内复制的多核苷酸。
[0617]
细菌复制起点的实例是允许在大肠杆菌中复制的质粒pbr322、puc19、pacyc177、和pacyc184的复制起点,以及允许在芽孢杆菌属中复制的质粒pub110、pe194、pta1060、和pamβ1的复制起点。
[0618]
用于酵母宿主细胞中的复制起点的实例是2微米复制起点、ars1、ars4、ars1与cen3的组合、及ars4与cen6的组合。
[0619]
在丝状真菌细胞中有用的复制起点的实例是ama1和ans1(gems等人,1991,gene[基因]98:61
‑
67;cullen等人,1987,nucleic acids res.[核酸研究]15:9163
‑
9175;wo 00/24883)。可以根据wo 00/24883中披露的方法完成ama1基因的分离和包含该基因的质粒或载体的构建。
[0620]
可将本发明多核苷酸的多于一个拷贝插入宿主细胞以增加多肽的产生。通过将序列的至少一个另外的拷贝整合到宿主细胞基因组中或者通过包括与该多核苷酸一起的可扩增的选择性标记基因可以获得多核苷酸的增加的拷贝数目,其中通过在适当的选择性试剂的存在下培养细胞可以选择包含选择性标记基因的经扩增的拷贝以及由此该多核苷酸的另外的拷贝的细胞。
[0621]
用于连接以上所述的元件以构建本发明的重组表达载体的程序是本领域的普通技术人员熟知的(参见例如,sambrook等人,1989,同上)。
[0622]
宿主细胞
[0623]
本发明还涉及重组宿主细胞,这些宿主细胞包含可操作地连接至一个或多个控制序列的本发明的多核苷酸,该一个或多个控制序列指导本发明的多肽的产生。将包含多核苷酸的构建体或载体引入宿主细胞中,这样使得该构建体或载体作为染色体整合体或作为自主复制的染色体外载体维持,如较早前所述。术语“宿主细胞”涵盖由于复制期间出现的突变而与亲本细胞不完全相同的任何亲本细胞子代。宿主细胞的选择将在很大程度上取决于编码该多肽的基因及其来源。
[0624]
宿主细胞可以是在本发明的多肽的重组产生中有用的任何细胞,例如原核细胞或真核细胞。
[0625]
原核宿主细胞可以是任何革兰氏阳性或革兰氏阴性细菌。革兰氏阳性细菌包括但不限于:芽孢杆菌属、梭菌属(clostridium)、肠球菌属(enterococcus)、土芽孢杆菌属(geobacillus)、乳杆菌属(lactobacillus)、乳球菌属(lactococcus)、大洋芽孢杆菌属(oceanobacillus)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、以及链霉菌属。革兰氏阴性细菌包括但不限于:弯曲杆菌属(campylobacter)、大肠杆菌、黄杆菌属(flavobacterium)、梭杆菌属(fusobacterium)、螺杆菌属(helicobacter)、泥杆菌属(ilyobacter)、奈瑟氏菌属(neisseria)、假单胞菌属(pseudomonas)、沙门氏菌属(salmonella)、以及脲原体属(ureaplasma)。
[0626]
细菌宿主细胞可以是任何芽孢杆菌属细胞,包括但不限于:嗜碱芽孢杆菌(bacillus alkalophilus)、高地芽孢杆菌(bacillus altitudinis)、解淀粉芽孢杆菌、植物解淀粉芽孢杆菌亚种(b.amyloliquefaciens subsp.plantarum)、短芽孢杆菌(bacillus brevis)、环状芽孢杆菌(bacillus circulans)、克劳氏芽孢杆菌、凝结芽孢杆菌(bacillus coagulans)、坚强芽孢杆菌(bacillus firmus)、灿烂芽孢杆菌(bacillus lautus)、迟缓芽孢杆菌(bacillus lentus)、地衣芽孢杆菌、巨大芽孢杆菌(bacillus megaterium)、甲基营
养型芽孢杆菌(bacillus methylotrophicus)、短小芽孢杆菌(bacillus pumilus)、沙福芽孢杆菌(bacillus safensis)、嗜热脂肪芽孢杆菌、枯草芽孢杆菌、以及苏云金芽孢杆菌细胞。
[0627]
细菌宿主细胞还可以是任何链球菌属细胞,包括但不限于:类马链球菌(streptococcus equisimilis)、酿脓链球菌(streptococcus pyogenes)、乳房链球菌(streptococcus uberis)、以及马链球菌兽疫亚种(streptococcus equi subsp.zooepidemicus)细胞。
[0628]
细菌宿主细胞还可以是任何链霉菌属细胞,包括但不限于:不产色链霉菌(streptomyces achromogenes)、除虫链霉菌(streptomyces avermitilis)、天蓝链霉菌、灰色链霉菌(streptomyces griseus)、以及浅青紫链霉菌(streptomyces lividans)细胞。
[0629]
将dna引入芽孢杆菌属细胞中可以通过以下方式来实现:原生质体转化(参见,例如,chang和cohen,1979,mol.gen.genet.[分子与普通遗传学]168:111
‑
115)、感受态细胞转化(参见例如,young和spizizen,1961,j.bacteriol.[细菌学杂志]81:823
‑
829;或dubnau和davidoff
‑
abelson,1971,j.mol.biol.[分子生物学杂志]56:209
‑
221)、电穿孔(参见例如,shigekawa和dower,1988,biotechniques[生物技术]6:742
‑
751)或接合(参见例如,koehler和thorne,1987,j.bacteriol.[细菌学杂志]169:5271
‑
5278)。将dna引入大肠杆菌细胞中可以通过以下方式来实现:原生质体转化(参见例如,hanahan,1983,j.mol.biol.[分子生物学杂志]166:557
‑
580)或电穿孔(参见例如,dower等人,1988,nucleic acids res.[核酸研究]16:6127
‑
6145)。将dna引入链霉菌属细胞中可以通过以下方式来实现:原生质体转化、电穿孔(参见例如,gong等人,2004,folia microbiol.(praha)[叶线形微生物学(布拉格)]49:399
‑
405)、接合(参见例如,mazodier等人,1989,j.bacteriol.[细菌学杂志]171:3583
‑
3585)、或转导(参见例如,burke等人,2001,proc.natl.acad.sci.usa[美国国家科学院院刊]98:6289
‑
6294)。将dna引入假单胞菌属细胞中可以通过以下方式来实现:电穿孔(参见例如,choi等人,2006,j.microbiol.methods[微生物学方法杂志]64:391
‑
397)或接合(参见例如,pinedo和smets,2005,appl.environ.microbiol.[应用与环境微生物学]71:51
‑
57)。将dna引入链球菌属细胞中可以通过以下方式来实现:天然感受态(natural competence)(参见例如,perry和kuramitsu,1981,infect.immun.[感染与免疫]32:1295
‑
1297)、原生质体转化(参见例如,catt和jollick,1991,microbios[微生物学]68:189
‑
207)、电穿孔(参见例如,buckley等人,1999,appl.environ.microbiol.[应用与环境微生物学]65:3800
‑
3804)、或接合(参见例如,clewell,1981,microbiol.rev.[微生物学评论]45:409
‑
436)。然而,可以使用本领域已知的将dna引入宿主细胞中的任何方法。
[0630]
宿主细胞还可以是真核生物,如哺乳动物、昆虫、植物或真菌细胞。
[0631]
宿主细胞可以是真菌细胞。如本文所用的“真菌”包括子囊菌门(ascomycota)、担子菌门(basidiomycota)、壶菌门(chytridiomycota)和接合菌门(zygomycota)以及卵菌门(oomycota)和所有有丝分裂孢子真菌(如由hawksworth等人在以下文献中所定义:ainsworth and bisby’s dictionary of the fungi[安斯沃思和拜斯比真菌字典],第8版,1995,cab international[国际应用生物科学中心],university press[大学出版社],cambridge,uk[英国剑桥])。
[0632]
真菌宿主细胞可以为酵母细胞。如本文使用的“酵母”包括产子囊酵母(ascosporogenous yeast)(内孢霉目(endomycetales))、产担子酵母(basidiosporogenous yeast)和属于半知菌纲(fungi imperfecti)(芽孢纲(blastomycetes))的酵母。由于酵母的分类可在将来变化,出于本发明的目的,酵母应当如biology and activities of yeast[酵母的生物学与活性](skinner,passmore和davenport编辑,soc.app.bacteriol.symposium series no.9[应用细菌学学会专题论文集系列9],1980)中所描述的那样定义。
[0633]
酵母宿主细胞可以是假丝酵母属(candida)、汉逊酵母属(hansenula)、克鲁弗酵母属(kluyveromyces)、毕赤酵母属(pichia)、酵母属(saccharomyces)、裂殖酵母属(schizosaccharomyces)或耶氏酵母属(yarrowia)细胞,如乳酸克鲁弗酵母(kluyveromyces lactis)、卡尔酵母(saccharomyces carlsbergensis)、酿酒酵母、糖化酵母(saccharomyces diastaticus)、道格拉氏酵母(saccharomyces douglasii)、克鲁弗酵母(saccharomyces kluyveri)、诺地酵母(saccharomyces norbensis)、卵形酵母(saccharomyces oviformis)或解脂耶氏酵母(yarrowia lipolytica)细胞。
[0634]
真菌宿主细胞可为丝状真菌细胞。“丝状真菌”包括真菌门(eumycota)和卵菌门(oomycota)的亚门的所有丝状形式(如由hawksworth等人,1995(同上)所定义的)。丝状真菌通常的特征在于由几丁质、纤维素、葡聚糖、壳聚糖、甘露聚糖和其他复杂多糖构成的菌丝体壁。营养生长是通过菌丝延伸来进行的,而碳分解代谢是专性需氧的。相反,酵母(如酿酒酵母)的营养生长是通过单细胞菌体的出芽(budding)来进行的,而碳分解代谢可以是发酵性的。
[0635]
丝状真菌宿主细胞可以是枝顶孢霉属、曲霉属、短梗霉属(aureobasidium)、烟管霉属(bjerkandera)、拟腊菌属(ceriporiopsis)、金孢子菌属(chrysosporium)、鬼伞属(coprinus)、革盖菌属(coriolus)、隐球菌属(cryptococcus)、线黑粉菌科(filibasidium)、镰孢属(fusarium)、腐质霉属(humicola)、梨孢菌属(magnaporthe)、毛霉属(mucor)、毁丝霉属(myceliophthora)、新美鞭菌属(neocallimastix)、链孢菌属(neurospora)、拟青霉属(paecilomyces)、青霉属、平革菌属(phanerochaete)、射脉菌属(phlebia)、瘤胃壶菌属(piromyces)、侧耳属(pleurotus)、裂褶菌属(schizophyllum)、篮状菌属、嗜热子囊菌属(thermoascus)、梭孢壳属(thielavia)、弯颈霉属(tolypocladium)、栓菌属(trametes)或木霉属细胞。
[0636]
例如,丝状真菌宿主细胞可以是泡盛曲霉、臭曲霉(aspergillus foetidus)、烟曲霉(aspergillus fumigatus)、日本曲霉(aspergillus japonicus)、构巢曲霉、黑曲霉、米曲霉、黑刺烟管菌(bjerkandera adusta)、干拟蜡菌(ceriporiopsis aneirina)、卡内基拟蜡菌(ceriporiopsis caregiea)、浅黄拟蜡孔菌(ceriporiopsis gilvescens)、潘诺希塔拟蜡菌(ceriporiopsis pannocinta)、环带拟蜡菌(ceriporiopsis rivulosa)、微红拟蜡菌(ceriporiopsis subrufa)、虫拟蜡菌(ceriporiopsis subvermispora)、狭边金孢子菌(chrysosporium inops)、嗜角质金孢子菌(chrysosporium keratinophilum)、卢克诺文思金孢子菌(chrysosporium lucknowense)、粪状金孢子菌(chrysosporium merdarium)、租金孢子菌(chrysosporium pannicola)、女王杜香金孢子菌(chrysosporium queenslandicum)、热带金孢子菌(chrysosporium tropicum)、褐薄金孢子菌
(chrysosporium zonatum)、灰盖鬼伞(coprinus cinereus)、毛革盖菌(coriolus hirsutus)、杆孢状镰孢(fusarium bactridioides)、谷类镰孢(fusarium cerealis)、库威镰孢(fusariumcrookwellense)、大刀镰孢(fusarium culmorum)、禾谷镰孢(fusarium graminearum)、禾赤镰孢(fusarium graminum)、异孢镰孢(fusarium heterosporum)、合欢木镰孢(fusarium negundi)、尖孢镰孢(fusarium oxysporum)、多枝镰孢(fusarium reticulatum)、粉红镰孢(fusarium roseum)、接骨木镰孢(fusarium sambucinum)、肤色镰孢(fusarium sarcochroum)、拟分枝孢镰孢(fusarium sporotrichioides)、硫色镰孢(fusarium sulphureum)、圆镰孢(fusarium torulosum)、拟丝孢镰孢(fusarium trichothecioides)、镶片镰孢、特异腐质霉、柔毛腐质霉、米黑毛霉、嗜热毁丝霉、粗糙链孢菌(neurospora crassa)、产紫青霉(penicillium purpurogenum)、黄孢平革菌(phanerochaete chrysosporium)、射脉菌(phlebia radiata)、刺芹侧耳(pleurotus eryngii)、土生梭孢壳霉(thielavia terrestris)、长域毛栓菌(trametes villosa)、变色栓菌(trametes versicolor)、哈茨木霉(trichoderma harzianum)、康宁木霉(trichoderma koningii)、长枝木霉(trichoderma longibrachiatum)、里氏木霉、或绿色木霉(trichoderma viride)细胞。
[0637]
可以将真菌细胞通过涉及原生质体形成、原生质体转化、以及细胞壁再生的方法以本身已知的方式转化。用于转化曲霉属和木霉属宿主细胞的适合程序描述于以下文献中:ep 238023,yelton等人,1984,proc.natl.acad.sci.usa[美国国家科学院院刊]81:1470
‑
1474以及christensen等人,1988,bio/technology[生物/技术]6:1419
‑
1422。用于转化镰孢属物种的适合方法由malardier等人,1989,gene[基因]78:147
‑
156和wo 96/00787描述。可以使用由以下文献描述的程序转化酵母:becker和guarente,在abelson,j.n.和simon,m.i.编辑,guide to yeast genetics and molecular biology[酵母遗传学与分子生物学指南],methods in enzymology[酶学方法],第194卷,第182
‑
187页,academic press,inc.[学术出版社有限公司],纽约);ito等人,1983,j.bacteriol.[细菌学杂志]153:163;以及hinnen等人,1978,proc.natl.acad.sci.usa[美国国家科学院院刊]75:1920。
[0638]
产生方法
[0639]
本发明还涉及产生本发明的多肽的方法,这些方法包括(a)在有益于产生该多肽的条件下培养细胞,该细胞以其野生型形式产生该多肽;和任选地(b)回收该多肽。在一方面,该细胞是芽孢杆菌属、青霉属、链霉菌属、枝顶孢霉属、轮层炭壳菌属、放射毛霉属、篮状菌属、溶杆菌属、假交替单胞菌属、弧菌属、紫色杆菌属、马赛菌属、曲霉属、拟棘壳孢菌属、小毛盘菌属、木霉属、虫草属、枝顶孢霉属、微座孢属、羊肚菌属、狭壳柱孢属、虫草属、瓶霉属、或背芽突霉属细胞。
[0640]
在另一方面,该细胞是芽孢杆菌属细胞。在另一方面,该细胞是芽孢杆菌属
[0641]
物种
‑
62738、脱支芽孢杆菌或苏云金芽孢杆菌。
[0642]
在另一方面,该细胞是青霉属细胞。在另一方面,该细胞是帚青霉、黑绿青霉、埃默森青霉或奶灰青霉。
[0643]
在另一方面,该细胞是链霉菌属细胞。在另一方面,该细胞是卷须链霉菌。
[0644]
在另一方面,该细胞是枝顶孢霉属细胞。在另一方面,该细胞是枝顶孢霉属物种
xz1968或嗜碱枝顶孢。
[0645]
在另一方面,该细胞是轮层炭壳菌属细胞。在另一方面,该细胞是开裂轮层炭壳菌。
[0646]
在另一方面,该细胞是放射毛霉属细胞。在另一方面,该细胞是雅致放射毛霉。
[0647]
在另一方面,该细胞是篮状菌属细胞。在另一方面,该细胞是雷塞氏篮状菌。
[0648]
在另一方面,该细胞是溶杆菌属细胞。在另一方面,该细胞是产酶溶杆菌。
[0649]
在另一方面,该细胞是假交替单胞菌属细胞。在另一方面,该细胞是产黑假交替单胞菌。
[0650]
在另一方面,该细胞是弧菌属细胞。在另一方面,该细胞是弧菌属物种
‑
63684。
[0651]
在另一方面,该细胞是紫色杆菌属细胞。在另一方面,该细胞是损蘑菇紫色杆菌。
[0652]
在另一方面,该细胞是马赛菌属细胞。在另一方面,该细胞是气生马赛菌。
[0653]
在另一方面,该细胞是曲霉属细胞。在另一方面,该细胞是米曲霉。
[0654]
在另一方面,该细胞是奥斯特罗帕细胞。在另一方面,该细胞是奥斯特罗帕芭芭拉。
[0655]
在另一方面,该细胞是小毛盘菌属细胞。在另一方面,该细胞是拟棘壳孢菌属物种。
[0656]
在另一方面,该细胞是拟棘壳孢菌属细胞。在另一方面,该细胞是小毛盘菌属物种。
[0657]
在另一方面,该细胞是木霉属细胞。在另一方面,该细胞是里氏木霉或钩状木霉。
[0658]
在另一方面,该细胞是虫草属细胞。在另一方面,该细胞是深红虫草。
[0659]
在另一方面,该细胞是微座孢属细胞。在另一方面,该细胞是芦苇微座孢。
[0660]
在另一方面,该细胞是羊肚菌属细胞。在另一方面,该细胞是宽肋羊肚菌。
[0661]
在另一方面,该细胞是狭壳柱孢属细胞。在另一方面,该细胞是玉蜀黍狭壳柱孢。
[0662]
在另一方面,该细胞是瓶霉属细胞。在另一方面,该细胞是膝曲瓶霉。
[0663]
在另一方面,该细胞是背芽突霉属细胞。在另一方面,该细胞是塔形栾背芽突霉。
[0664]
本发明还涉及产生本发明的多肽的方法,这些方法包括(a)在有益于产生该多肽的条件下培养本发明的重组宿主细胞;和任选地(b)回收该多肽。
[0665]
宿主细胞是在适合使用本领域已知的方法产生多肽的营养培养基中培养的。例如,可以通过摇瓶培养、或在实验室或工业发酵罐中小规模或大规模发酵(包括连续、分批、补料分批或固态发酵)培养细胞,该培养在合适的培养基中并且在允许表达和/或分离多肽的条件下进行。使用本领域中已知的程序,培养发生在包含碳和氮来源及无机盐的适合的营养培养基中。适合的培养基可从商业供应商获得或可以根据公开的组成(例如,在美国典型培养物保藏中心(american type culture collection)的目录中)制备。如果多肽被分泌到该营养培养基中,那么可以直接从该培养基中回收该多肽。如果多肽不进行分泌,那么其可以从细胞裂解液中进行回收。
[0666]
可以使用本领域已知的对于具有核酸酶活性的多肽是特异性的方法来检测该多肽。这些检测方法包括但不限于:特异性抗体的使用、酶产物的形成或酶底物的消失。例如,可以使用酶测定来确定多肽的活性。
[0667]
可以使用本领域已知的方法来回收多肽。例如,可通过常规方法,包括但不限于收
集、离心、过滤、提取、喷雾干燥、蒸发或沉淀,从营养培养基回收多肽。在一方面,回收包含多肽的发酵液。
[0668]
可以通过本领域已知的多种程序纯化该多肽,包括但不限于色谱法(例如,离子交换色谱法、亲和色谱法、疏水色谱法、聚焦色谱法和尺寸排阻色谱法)、电泳程序(例如,制备型等电聚焦电泳)、差异性溶解(例如,硫酸铵沉淀)、sds
‑
page或提取(参见例如,protein purification[蛋白质纯化],janson和ryden编辑,vch publishers[vch出版公司],纽约,1989),以便获得基本上纯的多肽。
[0669]
在替代性方面,不回收多肽,而是将表达该多肽的本发明的宿主细胞用作多肽的来源。
[0670]
发酵液配制品或细胞组合物
[0671]
本发明还涉及包含本发明的多肽的发酵液配制品或细胞组合物。该发酵液产物进一步包含在发酵过程中使用的另外的成分,例如像细胞(包括含有编码本发明的多肽的基因的宿主细胞,这些宿主细胞用于产生目的多肽)、细胞碎片、生物质、发酵培养基和/或发酵产物。在一些实施例中,组合物是含有一种或多种有机酸、杀灭的细胞和/或细胞碎片以及培养基的细胞杀灭的全培养液。
[0672]
如本文使用的术语“发酵液”是指由细胞发酵产生的、不经历或经历最少的回收和/或纯化的制剂。例如,当微生物培养物在允许蛋白质合成(例如,由宿主细胞表达酶)并且将蛋白质分泌到细胞培养基中的碳限制条件下温育生长到饱和时,产生发酵液。该发酵液可以含有在发酵结束时得到的发酵材料的未分级的或分级的内容物。典型地,该发酵液是未分级的并且包含用过的培养基以及例如通过离心去除微生物细胞(例如,丝状真菌细胞)之后存在的细胞碎片。在一些实施例中,发酵液含有用过的细胞培养基、胞外酶以及有活力的和/或无活力的微生物细胞。
[0673]
在实施例中,发酵液配制品和细胞组合物包含第一有机酸组分(包含至少一种1
‑
5个碳的有机酸和/或其盐)和第二有机酸组分(包含至少一种6个或更多个碳的有机酸和/或其盐)。在特定实施例中,第一有机酸组分是乙酸、甲酸、丙酸、其盐或前述两种或更多种的混合物;并且该第二有机酸组分是苯甲酸、环己烷羧酸、4
‑
甲基戊酸、苯乙酸、其盐或前述两种或更多种的混合物。
[0674]
在一方面,组合物含有一种或多种有机酸,并且任选地进一步含有杀灭的细胞和/或细胞碎片。在一个实施例中,从细胞杀灭的全培养液中去除这些杀灭的细胞和/或细胞碎片,以提供不含这些组分的组合物。
[0675]
这些发酵液配制品或细胞组合物可以进一步包含防腐剂和/或抗微生物(例如,抑菌)剂,包括但不限于山梨醇、氯化钠、山梨酸钾、以及本领域已知的其他试剂。
[0676]
该细胞杀灭的全培养液或组合物可以含有在发酵结束时得到的发酵材料的未分级的内容物。典型地,该细胞杀灭的全培养液或组合物包含用过的培养基以及在微生物细胞(例如,丝状真菌细胞)生长至饱和、在碳限制条件下温育以允许蛋白合成之后存在的细胞碎片。在一些实施例中,细胞杀灭的全培养液或组合物含有用过的细胞培养基、胞外酶和杀灭的丝状真菌细胞。在一些实施例中,可以使用本领域已知的方法来使细胞杀灭的全培养液或组合物中存在的微生物细胞透性化和/或裂解。
[0677]
如本文所述的全培养液或细胞组合物典型地是液体,但是可以含有不溶性组分,
例如杀灭的细胞、细胞碎片、培养基组分和/或一种或多种不溶性酶。在一些实施例中,可以去除不溶性组分以提供澄清的液体组合物。
[0678]
本发明的全培养液配制品和细胞组合物可以通过wo 90/15861或wo2010/096673中所述的方法来产生。
[0679]
酶组合物
[0680]
本发明进一步包含含有本发明的多肽的组合物。在一个实施例中,该组合物包含具有核酸酶活性的多肽,该多肽选自由以下组成的第一组:
[0681]
(a)与seq id no:3的多肽具有至少99%序列同一性的多肽;
[0682]
(b)与seq id no:6的多肽具有至少62%序列同一性的多肽;
[0683]
(c)与seq id no:12的多肽具有至少97%序列同一性的多肽;以及
[0684]
(d)与seq id no:21或27的多肽具有至少86%序列同一性的多肽;
[0685]
(e)与seq id no:30的多肽具有至少98%序列同一性的多肽;
[0686]
(f)与seq id no:33或48的多肽具有100%序列同一性的多肽;
[0687]
(g)与seq id no:39或51的多肽具有至少76%序列同一性的多肽;
[0688]
(h)与seq id no:42的多肽具有至少95%序列同一性的多肽;
[0689]
(i)与seq id no:45或24的多肽具有至少79%序列同一性的多肽;
[0690]
(j)与seq id no:54的多肽具有至少94%序列同一性的多肽;
[0691]
(k)与seq id no:57的多肽具有至少72%序列同一性的多肽;
[0692]
(l)与seq id no:60的多肽具有至少82%序列同一性的多肽;
[0693]
(m)与seq id no:63的多肽具有至少75%序列同一性的多肽;
[0694]
(n)与seq id no:69或75的多肽具有至少80%序列同一性的多肽;
[0695]
或该多肽选自由以下组成的第二组:
[0696]
(o)与seq id no:78的多肽具有至少77%序列同一性的多肽;
[0697]
(p)与seq id no:84的多肽具有至少94%序列同一性的多肽;
[0698]
(q)与seq id no:87的多肽具有至少99%序列同一性的多肽;
[0699]
(r)与seq id no:90的多肽具有至少80%序列同一性的多肽;以及
[0700]
(s)与seq id no:93的多肽具有至少90%序列同一性的多肽;
[0701]
或该多肽是选自以下的变体或片段:
[0702]
(t)选自所述第一组或所述第二组的多肽的变体,其中该变体具有核酸酶活性并包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20位置中的一个或多个氨基酸取代、和/或一个或多个氨基酸缺失、和/或一个或多个氨基酸插入或其任何组合;
[0703]
(u)(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)、(j)、(k)、(l)、(m)、(n)、(o)、(p)、(q)、(r)和(s)的多肽的片段,其中所述片段具有核酸酶活性。
[0704]
在本发明的一个实施例中,该组合物包含选自由以下组成的组的多肽:
[0705]
i.与seq id no:6、24、39、45、51、57、63、69和75中任一个的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[0706]
ii.与seq id no:21、27、42、54和60中任一个的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[0707]
在本发明的一个实施例中,该组合物包含选自由以下组成的组的多肽:
[0708]
i.与seq id no:78或90的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[0709]
ii.与seq id no:84或93的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[0710]
在本发明的一个实施例中,该组合物包含由多核苷酸编码的多肽,该多核苷酸与以下序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性:
[0711]
i.seq id no:28、31、37、40、76、82、85、88和91中任一个的成熟多肽编码序列;或
[0712]
ii.seq id no:1、4、10、19、22、25、43、46、49、52、55、58、61、67和73中任一个的成熟多肽cdna编码序列。
[0713]
在本发明的一个实施例中,该组合物包含多肽,该多肽选自由以下多肽组成的组:
[0714]
(a)包含seq id no:3或seq id no:2的成熟多肽,或由其组成;
[0715]
(b)包含seq id no:6或seq id no:5的成熟多肽,或由其组成;
[0716]
(c)包含seq id no:12或seq id no:11的成熟多肽,或由其组成;
[0717]
(d)包含seq id no:21或seq id no:20的成熟多肽,或由其组成;
[0718]
(e)包含seq id no:24或seq id no:23的成熟多肽,或由其组成;
[0719]
(f)包含seq id no:27或seq id no:26的成熟多肽,或由其组成;
[0720]
(g)包含seq id no:30或seq id no:29的成熟多肽,或由其组成;
[0721]
(h)包含seq id no:33或seq id no:32的成熟多肽,或由其组成;
[0722]
(i)包含seq id no:39或seq id no:38的成熟多肽,或由其组成;
[0723]
(j)包含seq id no:42或seq id no:41的成熟多肽,或由其组成;
[0724]
(k)包含seq id no:45或seq id no:44的成熟多肽,或由其组成;
[0725]
(l)包含seq id no:48或seq id no:47的成熟多肽,或由其组成;
[0726]
(m)包含seq id no:51或seq id no:50的成熟多肽,或由其组成;
[0727]
(n)包含seq id no:54或seq id no:53的成熟多肽,或由其组成;
[0728]
(o)包含seq id no:57或seq id no:56的成熟多肽,或由其组成;
[0729]
(p)包含seq id no:60或seq id no:59的成熟多肽,或由其组成;
[0730]
(q)包含seq id no:63或seq id no:62的成熟多肽,或由其组成;
[0731]
(r)包含seq id no:69或seq id no:68的成熟多肽,或由其组成;
[0732]
(s)包含seq id no:75或seq id no:74的成熟多肽,或由其组成;
[0733]
(t)包含seq id no:78或seq id no:77的成熟多肽,或由其组成;
[0734]
(u)包含seq id no:84或seq id no:83的成熟多肽,或由其组成;
[0735]
(v)包含seq id no:87或seq id no:86的成熟多肽,或由其组成;
[0736]
(w)包含seq id no:90或seq id no:89的成熟多肽,或由其组成;
[0737]
(x)包含seq id no:93或seq id no:92的成熟多肽,或由其组成;
[0738]
(y)包含seq id no:96或seq id no:95的成熟多肽,或由其组成;
[0739]
(z)包含seq id no:99或seq id no:98的成熟多肽,或由其组成;
[0740]
包含seq id no:108或seq id no:107的成熟多肽,或由其组成;以及
[0741]
包含seq id no:111或seq id no:110的成熟多肽,或由其组成。
[0742]
在本发明的一个实施例中,该组合物是清洁组合物。
[0743]
在本发明的一个实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0744]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0745]
(b)一种或多种表面活性剂;以及
[0746]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0747]
其中所述多肽选自由以下组成的组:
[0748]
(a)与seq id no:3的多肽具有至少99%序列同一性的多肽;
[0749]
(b)与seq id no:6的多肽具有至少62%序列同一性的多肽;
[0750]
(c)与seq id no:12的多肽具有至少97%序列同一性的多肽;以及
[0751]
(d)与seq id no:21或27的多肽具有至少86%序列同一性的多肽;
[0752]
(e)与seq id no:30的多肽具有至少98%序列同一性的多肽;
[0753]
(f)与seq id no:33或48的多肽具有100%序列同一性的多肽;
[0754]
(g)与seq id no:39或51的多肽具有至少76%序列同一性的多肽;
[0755]
(h)与seq id no:42的多肽具有至少95%序列同一性的多肽;
[0756]
(i)与seq id no:45或24的多肽具有至少79%序列同一性的多肽;
[0757]
(j)与seq id no:54的多肽具有至少94%序列同一性的多肽;
[0758]
(k)与seq id no:57的多肽具有至少72%序列同一性的多肽;
[0759]
(l)与seq id no:60的多肽具有至少82%序列同一性的多肽;
[0760]
(m)与seq id no:63的多肽具有至少75%序列同一性的多肽;
[0761]
(n)与seq id no:69或75的多肽具有至少80%序列同一性的多肽;
[0762]
或该多肽选自由以下组成的第二组:
[0763]
(o)与seq id no:78的多肽具有至少77%序列同一性的多肽;
[0764]
(p)与seq id no:84的多肽具有至少94%序列同一性的多肽;
[0765]
(q)与seq id no:87的多肽具有至少99%序列同一性的多肽;
[0766]
(r)与seq id no:90的多肽具有至少80%序列同一性的多肽;以及
[0767]
(s)与seq id no:93的多肽具有至少90%序列同一性的多肽;
[0768]
或该多肽是选自以下的变体或片段:
[0769]
(t)选自所述第一组或所述第二组的多肽的变体,其中该变体具有核酸酶活性并包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20位置中的一个或多个氨基酸取代、和/或一个或多个氨基酸缺失、和/或一个或多个氨基酸插入或其任何组合;
[0770]
(u)(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)、(j)、(k)、(l)、(m)、(n)、(o)、(p)、(q)、(r)和(s)的多肽的片段,其中所述片段具有核酸酶活性。
[0771]
(i)与seq id no:36的多肽具有至少80%序列同一性的多肽;
[0772]
(ii)与seq id no:66的多肽具有至少80%序列同一性的多肽;
[0773]
(iii)与seq id no:72的多肽具有至少80%序列同一性的多肽;
[0774]
(iv)与seq id no:9的多肽具有至少80%序列同一性的多肽;
[0775]
(v)与seq id no:15的多肽具有至少80%序列同一性的多肽;
[0776]
(vi)与seq id no:18的多肽具有至少80%序列同一性的多肽;
[0777]
(vii)与seq id no:81的多肽具有至少80%序列同一性的多肽;
[0778]
(viii)与seq id no:96的多肽具有至少80%序列同一性的多肽;
[0779]
(ix)与seq id no:99的多肽具有至少80%序列同一性的多肽;以及(x)包含基序[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h(seq id no:102)和/或基序g[ga]nx[vilfy]x[vlm](seq id no:103)的多肽。
[0780]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0781]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0782]
(b)一种或多种表面活性剂;以及
[0783]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0784]
其中该多肽与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:36的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0785]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少70%的核酸酶活性。
[0786]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少75%的核酸酶活性。
[0787]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少80%的核酸酶活性。
[0788]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少85%的核酸酶活性。
[0789]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少90%的核酸酶活性。
[0790]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少
97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少95%的核酸酶活性。
[0791]
在特定的实施例中,该组合物包含与seq id no:36的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:36的成熟多肽的至少至少100%的核酸酶活性。
[0792]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0793]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0794]
(b)一种或多种表面活性剂;以及
[0795]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0796]
其中该多肽与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:66的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0797]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少70%的核酸酶活性。
[0798]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少75%的核酸酶活性。
[0799]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少80%的核酸酶活性。
[0800]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少85%的核酸酶活性。
[0801]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少90%的核酸酶活性。
[0802]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少95%的核酸酶活性。
[0803]
在特定的实施例中,该组合物包含与seq id no:66的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:66的成熟多肽的至少至少100%的核酸酶活性。
[0804]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0805]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0806]
(b)一种或多种表面活性剂;以及
[0807]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0808]
其中该多肽与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:72的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0809]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少70%的核酸酶活性。
[0810]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少75%的核酸酶活性。
[0811]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少80%的核酸酶活性。
[0812]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少85%的核酸酶活性。
[0813]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少90%的核酸酶活性。
[0814]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少95%的核酸酶活性。
[0815]
在特定的实施例中,该组合物包含与seq id no:72的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少
97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:72的成熟多肽的至少至少100%的核酸酶活性。
[0816]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0817]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0818]
(b)一种或多种表面活性剂;以及
[0819]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0820]
其中该多肽与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:9的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0821]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少70%的核酸酶活性。
[0822]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少75%的核酸酶活性。
[0823]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少80%的核酸酶活性。
[0824]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少85%的核酸酶活性。
[0825]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少90%的核酸酶活性。
[0826]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少95%的核酸酶活性。
[0827]
在特定的实施例中,该组合物包含与seq id no:9的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:9的成熟多肽的至少至少100%的核酸酶活性。
[0828]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0829]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0830]
(b)一种或多种表面活性剂;以及
[0831]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0832]
其中该多肽与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:15的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0833]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少70%的核酸酶活性。
[0834]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少75%的核酸酶活性。
[0835]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少80%的核酸酶活性。
[0836]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少85%的核酸酶活性。
[0837]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少90%的核酸酶活性。
[0838]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少95%的核酸酶活性。
[0839]
在特定的实施例中,该组合物包含与seq id no:15的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:15的成熟多肽的至少至少100%的核酸酶活性。
[0840]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0841]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0842]
(b)一种或多种表面活性剂;以及
[0843]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0844]
其中该多肽与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:18的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0845]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少70%的核酸酶活性。
[0846]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少75%的核酸酶活性。
[0847]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少80%的核酸酶活性。
[0848]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少85%的核酸酶活性。
[0849]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少90%的核酸酶活性。
[0850]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少95%的核酸酶活性。
[0851]
在特定的实施例中,该组合物包含与seq id no:18的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:18的成熟多肽的至少至少100%的核酸酶活性。
[0852]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0853]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0854]
(b)一种或多种表面活性剂;以及
[0855]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组
分、聚合物、分散剂和另外的酶,
[0856]
其中该多肽与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:81的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0857]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少70%的核酸酶活性。
[0858]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少75%的核酸酶活性。
[0859]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少80%的核酸酶活性。
[0860]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少85%的核酸酶活性。
[0861]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少90%的核酸酶活性。
[0862]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少95%的核酸酶活性。
[0863]
在特定的实施例中,该组合物包含与seq id no:81的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:81的成熟多肽的至少至少100%的核酸酶活性。
[0864]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0865]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0866]
(b)一种或多种表面活性剂;以及
[0867]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0868]
其中该多肽与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少
91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:96的成熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0869]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少70%的核酸酶活性。
[0870]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少75%的核酸酶活性。
[0871]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少80%的核酸酶活性。
[0872]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少85%的核酸酶活性。
[0873]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少90%的核酸酶活性。
[0874]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少95%的核酸酶活性。
[0875]
在特定的实施例中,该组合物包含与seq id no:96的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:96的成熟多肽的至少至少100%的核酸酶活性。
[0876]
在本发明的实施例中,该组合物是清洁组合物,该清洁组合物包含:
[0877]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[0878]
(b)一种或多种表面活性剂;以及
[0879]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[0880]
其中该多肽与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性,该多肽具有核酸酶活性。在一方面,这些多肽与seq id no:99的成
熟多肽相差多达10个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、或10个)氨基酸。
[0881]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少70%的核酸酶活性。
[0882]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少75%的核酸酶活性。
[0883]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少80%的核酸酶活性。
[0884]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少85%的核酸酶活性。
[0885]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少90%的核酸酶活性。
[0886]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少95%的核酸酶活性。
[0887]
在特定的实施例中,该组合物包含与seq id no:99的成熟多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的多肽,并且其中该多肽具有seq id no:99的成熟多肽的至少至少100%的核酸酶活性。
[0888]
在本发明的优选的实施例中,该清洁组合物包含选自阴离子表面活性剂、非离子表面活性剂、阳离子表面活性剂、兼性离子表面活性剂及其混合物的一种或多种表面活性剂。
[0889]
在一个实施例中,该表面活性剂是阴离子表面活性剂,优选地选自由以下组成的组:直链烷基苯磺酸盐(las)、las的异构体、支链烷基苯磺酸盐(babs)、苯基链烷磺酸盐、α
‑
烯烃磺酸盐(aos)、烯烃磺酸盐、链烯烃磺酸盐、链烷
‑
2,3
‑
二基双(硫酸盐)、羟基链烷磺酸盐以及二磺酸盐、烷基硫酸盐(as)(如十二烷基硫酸钠(sds))、脂肪醇硫酸盐(fas)、伯醇硫酸盐(pas)、醇醚硫酸盐(aes或aeos或fes)、仲链烷磺酸盐(sas)、石蜡磺酸盐(ps)、酯磺酸盐、磺化的脂肪酸甘油酯、α
‑
磺基脂肪酸甲酯(α
‑
sfme或ses)(包括甲酯磺酸盐(mes))、烷基琥珀酸或烯基琥珀酸、十二烯基/十四烯基琥珀酸(dtsa)、氨基酸的脂肪酸衍生物、磺基琥
珀酸的二酯和单酯或脂肪酸盐(皂)、及其组合。
[0890]
在本发明的一个实施例中,该一种或多种表面活性剂是非离子表面活性剂,其选自醇乙氧基化物(ae或aeo)、醇丙氧基化物、丙氧基化的脂肪醇(pfa)、烷氧基化的脂肪酸烷基酯(如乙氧基化的和/或丙氧基化的脂肪酸烷基酯)、烷基酚乙氧基化物(ape)、壬基酚乙氧基化物(npe)、烷基多糖苷(apg)、烷氧基化胺、脂肪酸单乙醇酰胺(fam)、脂肪酸二乙醇酰胺(fada)、乙氧基化的脂肪酸单乙醇酰胺(efam)、丙氧基化的脂肪酸单乙醇酰胺(pfam)、多羟基烷基脂肪酸酰胺、或葡萄糖胺的n
‑
酰基n
‑
烷基衍生物(葡糖酰胺(ga)、或脂肪酸葡糖酰胺(faga))、及其组合。
[0891]
在本发明的一个实施例中,该清洁包含一种或多种阴离子表面活性剂和一种或多种非离子表面活性剂。
[0892]
表面活性剂
[0893]
洗涤剂组合物可以包含一种或多种表面活性剂,它们可以是阴离子型和/或阳离子型和/或非离子型和/或半极性型和/或兼性离子型、或其混合物。在特定的实施例中,洗涤剂组合物包括一种或多种非离子表面活性剂和一种或多种阴离子表面活性剂的混合物。该一种或多种表面活性剂典型地以按重量计从约0.1%至60%(如约1%至约40%、或约3%至约20%、或约3%至约10%)的水平存在。基于所希望的清洁应用来选择该一种或多种表面活性剂,并且该一种或多种表面活性剂可以包括本领域中已知的任何常规表面活性剂。
[0894]
当被包括在其中时,该洗涤剂将通常含有按重量计从约1%至约40%的阴离子表面活性剂,如从约5%至约30%,包括从约5%至约15%,或从约15%至约20%,或从约20%至约25%的阴离子表面活性剂。阴离子表面活性剂的非限制性实例包括硫酸盐和磺酸盐,特别是直链烷基苯磺酸盐(las)、las的异构体、支链烷基苯磺酸盐(babs)、苯基链烷磺酸盐、α
‑
烯烃磺酸盐(aos)、烯烃磺酸盐、链烯烃磺酸盐、链烷
‑
2,3
‑
二基双(硫酸盐)、羟基链烷磺酸盐以及二磺酸盐、烷基硫酸盐(as)(如十二烷基硫酸钠(sds))、脂肪醇硫酸盐(fas)、伯醇硫酸盐(pas)、醇醚硫酸盐(aes或aeos或fes,也被称为醇乙氧基硫酸盐或脂肪醇醚硫酸盐)、仲链烷磺酸盐(sas)、石蜡磺酸盐(ps)、酯磺酸盐、磺化的脂肪酸甘油酯、α
‑
磺基脂肪酸甲酯(α
‑
sfme或ses)(包括甲酯磺酸盐(mes))、烷基琥珀酸或烯基琥珀酸、十二烯基/十四烯基琥珀酸(dtsa)、氨基酸的脂肪酸衍生物、磺基琥珀酸的二酯和单酯或脂肪酸盐(皂)、及其组合。
[0895]
当被包括在其中时,该洗涤剂将通常含有按重量计从约1%至约40%的阳离子表面活性剂,例如从约0.5%至约30%,特别是从约1%至约20%、从约3%至约10%,如从约3%至约5%、从约8%至约12%或从约10%至约12%。阳离子表面活性剂的非限制性实例包括烷基二甲基乙醇季胺(admeaq)、十六烷基三甲基溴化铵(ctab)、二甲基二硬脂酰氯化铵(dsdmac)、以及烷基苄基二甲基铵、烷基季铵化合物、烷氧基化季铵(aqa)化合物、酯季铵及其组合。
[0896]
当被包括在其中时,该洗涤剂将通常含有按重量计从约0.2%至约40%的非离子表面活性剂,例如从约0.5%至约30%,特别是从约1%至约20%、从约3%至约10%,如从约3%至约5%、从约8%至约12%或从约10%至约12%。非离子表面活性剂的非限制性实例包括醇乙氧基化物(ae或aeo)、醇丙氧基化物、丙氧基化的脂肪醇(pfa)、烷氧基化的脂肪酸烷基酯(如乙氧基化的和/或丙氧基化的脂肪酸烷基酯)、烷基酚乙氧基化物(ape)、壬基酚乙
氧基化物(npe)、烷基多糖苷(apg)、烷氧基化胺、脂肪酸单乙醇酰胺(fam)、脂肪酸二乙醇酰胺(fada)、乙氧基化的脂肪酸单乙醇酰胺(efam)、丙氧基化的脂肪酸单乙醇酰胺(pfam)、多羟基烷基脂肪酸酰胺、或葡萄糖胺的n
‑
酰基n
‑
烷基衍生物(葡糖酰胺(ga)、或脂肪酸葡糖酰胺(faga))、以及以和商品名可获得的产品、及其组合。
[0897]
当被包括在其中时,该洗涤剂将通常含有按重量计从约0.1%至约10%的半极性表面活性剂。半极性表面活性剂的非限制性实例包括氧化胺(ao),如烷基二甲胺氧化物、n
‑
(椰油基烷基)
‑
n,n
‑
二甲胺氧化物和n
‑
(牛油
‑
烷基)
‑
n,n
‑
双(2
‑
羟乙基)胺氧化物、及其组合。
[0898]
当被包括在其中时,该洗涤剂将通常含有按重量计从约0.1%至约10%的兼性离子表面活性剂。兼性离子表面活性剂的非限制性实例包括甜菜碱,如烷基二甲基甜菜碱、磺基甜菜碱、及其组合。
[0899]
助洗剂和共助洗剂
[0900]
洗涤剂组合物可以含有按重量计约0
‑
65%(如约5%至约50%)的洗涤剂助洗剂或共助洗剂、或其混合物。在餐具洗涤洗涤剂中,助洗剂的水平典型地是40%
‑
65%,特别是50%
‑
65%。助洗剂和/或共助洗剂可以特别是与ca和mg形成水溶性络合物的螯合试剂。可以利用本领域已知的用于在清洁洗涤剂中使用的任何助洗剂和/或共助洗剂。助洗剂的非限制性实例包括沸石、二磷酸盐(焦磷酸盐)、三磷酸盐如三磷酸钠(stp或stpp)、碳酸盐如碳酸钠、可溶性硅酸盐如偏硅酸钠、层状硅酸盐(例如来自赫斯特公司(hoechst)的sks
‑
6)、乙醇胺如2
‑
氨基乙
‑1‑
醇(mea)、二乙醇胺(dea,也称为2,2
’‑
亚氨基二乙
‑1‑
醇)、三乙醇胺(tea,也称为2,2’,2
”‑
次氮基三乙
‑1‑
醇)以及(羧甲基)菊粉(cmi)、及其组合。
[0901]
洗涤剂组合物还可以含有按重量计0
‑
50%,如约5%至约30%的洗涤剂共助洗剂。洗涤剂组合物可以包括单独的共助洗剂,或与助洗剂(例如沸石助洗剂)组合。共助洗剂的非限制性实例包括聚丙烯酸酯的均聚物或其共聚物,如聚(丙烯酸)(paa)或共聚(丙烯酸/马来酸)(paa/pma)。另外的非限制性实例包括柠檬酸盐、螯合剂(如氨基羧酸盐、氨基多羧酸盐和膦酸盐)、以及烷基琥珀酸或烯基琥珀酸。另外的具体实例包括2,2’,2
”‑
次氨基三乙酸(nta)、乙二胺四乙酸(edta)、二亚乙基三胺五乙酸(dtpa)、亚氨基二琥珀酸(ids)、乙二胺
‑
n,n
’‑
二丁二酸(edds)、甲基甘氨酸二乙酸(mgda)、谷氨酸
‑
n,n
‑
二乙酸(glda)、1
‑
羟基乙烷
‑
1,1
‑
二膦酸(hedp)、乙二胺四(亚甲基膦酸)(edtmpa)、二亚乙基三胺五(亚甲基膦酸)(dtmpa或dtpmpa)、n
‑
(2
‑
羟乙基)亚氨基二乙酸(edg)、天冬氨酸
‑
n
‑
单乙酸(asma)、天冬氨酸
‑
n,n
‑
二乙酸(asda)、天冬氨酸
‑
n
‑
单丙酸(asmp)、亚氨基二琥珀酸(ida)、n
‑
(2
‑
磺甲基)
‑
天冬氨酸(smas)、n
‑
(2
‑
磺乙基)
‑
天冬氨酸(seas)、n
‑
(2
‑
磺甲基)
‑
谷氨酸(smgl)、n
‑
(2
‑
磺乙基)
‑
谷氨酸(segl)、n
‑
甲基亚氨基二乙酸(mida)、α
‑
丙氨酸
‑
n,n
‑
二乙酸(α
‑
alda)、丝氨酸
‑
n,n
‑
二乙酸(seda)、异丝氨酸
‑
n,n
‑
二乙酸(isda)、苯丙氨酸
‑
n,n
‑
二乙酸(phda)、邻氨基苯甲酸
‑
n,n
‑
二乙酸(anda)、磺胺酸
‑
n,n
‑
二乙酸(slda)、牛磺酸
‑
n,n
‑
二乙酸(tuda)以及磺甲基
‑
n,n
‑
二乙酸(smda)、n
‑
(2
‑
羟乙基)
‑
亚乙基二胺
‑
n,n’,n
”‑
三乙酸盐(hedta)、二乙醇甘氨酸(deg)、二亚乙基三胺五(亚甲基膦酸)(dtpmp)、氨基三(亚甲基膦酸)(atmp)、及其组合和盐。另外的示例性助洗剂和/或共助洗剂描述于例如wo 09/102854、us 5977053中。
[0902]
漂白系统
[0903]
洗涤剂可以含有按重量计0
‑
30%,如约1%至约20%的漂白系统。可以利用包含本
领域已知的用于在清洁洗涤剂中使用的组分的任何漂白系统。合适的漂白系统组分包括过氧化氢源;过酸源;和漂白催化剂或增效剂。
[0904]
过氧化氢源:
[0905]
合适的过氧化氢源是无机过酸盐,包括碱金属盐(如过碳酸钠和过硼酸钠(通常是一水合物或四水合物)),以及过氧化氢―尿素(1/1)。
[0906]
过酸源:
[0907]
过酸可以是(a)直接作为预形成过酸掺入,或(b)从过氧化氢和漂白活化剂(过水解)在洗涤液中原位形成,或(c)从过氧化氢和过水解酶和后者合适的底物(例如酯)在洗涤液中原位形成。
[0908]
a)合适的预形成过酸包括但不限于过氧羧酸(如过氧苯甲酸)及其环取代的衍生物、过氧
‑
α
‑
萘甲酸、过氧邻苯二甲酸、过氧月桂酸、过氧硬脂酸、ε
‑
邻苯二甲酰亚氨基过氧己酸[邻苯二甲酰亚氨基过氧己酸(pap)]、和邻
‑
羧基苯甲酰氨基过氧己酸;脂族和芳族二过氧二羧酸,如二过氧十二烷二酸、二过氧壬二酸、二过氧癸二酸、二过氧巴西基酸、2
‑
癸基二过氧丁二酸、以及二过氧邻苯二甲酸、
‑
间苯二甲酸和
‑
对苯二甲酸;过亚氨酸;过氧单硫酸;过氧二硫酸;过氧磷酸;过氧硅酸;以及所述化合物的混合物。应理解的是,在一些情况下,所提到的过酸可能最好是作为合适的盐添加,如碱金属盐(例如)或碱土金属盐。
[0909]
b)合适的漂白活化剂包括属于酯、酰胺、酰亚胺、腈类或酸酐类别的那些,以及适用时,其盐。合适的实例是四乙酰基乙二胺(taed)、4
‑
[(3,5,5
‑
三甲基己酰基)氧基]苯
‑1‑
磺酸钠(isonobs)、4
‑
(十二酰基氧基)苯
‑1‑
磺酸钠(lobs)、4
‑
(癸酰基氧基)苯
‑1‑
磺酸钠、4
‑
(癸酰基氧基)苯甲酸(doba)、4
‑
(壬酰基氧基)苯
‑1‑
磺酸钠(nobs)和/或披露于wo 98/17767中的那些。目的漂白活化剂的特定家族披露于ep 624154中并且在该家族中特别优选的是乙酰柠檬酸三乙酯(atc)。atc或短链甘油三酸酯(像三醋精)具有它们是环境友好的优点。此外,乙酰柠檬酸三乙酯和三醋精在储存时在产品中具有良好的水解稳定性,并且是有效的漂白活化剂。最后,atc是多功能的,因为在过水解反应中释放的柠檬酸盐可以作为助洗剂起作用。
[0910]
漂白催化剂和增效剂
[0911]
该漂白系统还可以包括漂白催化剂或增效剂。
[0912]
可以用于本发明组合物中的漂白催化剂的一些非限制性实例包括草酸锰、乙酸锰、锰胶原、钴
‑
胺催化剂和锰三氮杂环壬烷(mntacn)催化剂;特别优选的是锰与1,4,7
‑
三甲基
‑
1,4,7
‑
三氮杂环壬烷(me3
‑
tacn)或1,2,4,7
‑
四甲基
‑
1,4,7
‑
三氮杂环壬烷(me4
‑
tacn)的络合物,特别是me3
‑
tacn,如双核锰络合物[(me3
‑
tacn)mn(o)3mn(me3
‑
tacn)](pf6)2、和[2,2',2
”‑
次氮基三(乙烷
‑
1,2
‑
二基氮烷基亚基
‑
κn
‑
甲基亚基)三酚并
‑
κ3o]锰(iii)。这些漂白催化剂还可以是其他金属化合物,如铁或钴络合物。
[0913]
在其中过酸源包括在内的一些实施例中,可以使用具有下式之一的有机漂白催化剂或漂白增效剂:
[0914][0915]
(iii)及其混合物;其中每个r1独立地是含有从9至24个碳的支链烷基基团或含有从11至24个碳的直链烷基基团,优选地每个r1独立地是含有从9至18个碳的支链烷基基团或含有从11至18个碳的直链烷基基团,更优选地每个r1独立地选自由以下组成的组:2
‑
丙基庚基、2
‑
丁基辛基、2
‑
戊基壬基、2
‑
己基癸基、十二烷基、十四烷基、十六烷基、十八烷基、异壬基、异癸基、异十三烷基以及异十五烷基。
[0916]
其他示例性漂白系统描述于例如wo 2007/087258、wo 2007/087244、wo 2007/087259、ep 1867708(维生素k)以及wo 2007/087242中。合适的光漂白剂可以例如是磺化的酞菁锌或酞菁铝。
[0917]
金属护理剂
[0918]
金属护理剂可以防止或减少金属的锈蚀、腐蚀或氧化,这些金属包括铝、不锈钢和非铁金属,如银和铜。合适的实例包括以下的一个或多个:
[0919]
(a)苯并三唑类,包括苯并三唑或双
‑
苯并三唑及其取代的衍生物。苯并三唑衍生物是其中芳环上可获得的取代位点被部分或完全取代的那些化合物。合适的取代基包括直链或支链ci
‑
c20
‑
烷基基团(例如c1
‑
c20
‑
烷基基团)和羟基、硫代、苯基或卤素(例如氟、氯、溴和碘)。
[0920]
(b)选自下组的金属盐和络合物,该组由以下组成:锌、锰、钛、锆、铪、钒、钴,镓和铯盐和/或络合物,这些金属处于氧化态ii、iii、iv、v或vi之一。在一方面,合适的金属盐和/或金属络合物可以选自下组,该组由以下组成:mn(ii)硫酸盐、mn(ii)柠檬酸盐、mn(ii)硬脂酸盐、mn(ii)乙酰丙酮酸盐、k^tif6(例如,k2tif6)、k^zrf6(例如,k2zrf6)、coso4、co(nos)2和ce(nos)3、锌盐,例如,硫酸锌、水锌矿、或乙酸锌;
[0921]
(c)硅酸盐,包括硅酸钠或硅酸钾、二硅酸钠、偏硅酸钠、结晶页硅酸盐及其混合物。
[0922]
wo 94/26860和wo 94/26859中披露了用作银/铜腐蚀抑制剂的另外合适的有机和无机氧化还原活性物质。优选地,本发明的组合物包含按重量计从0.1%至5%的金属护理剂的组合物,优选地该金属护理剂是锌盐。
[0923]
水溶助剂
[0924]
洗涤剂可以含有按重量计0
‑
10%,例如按重量计0
‑
5%,例如约0.5%至约5%、或约3%至约5%的水溶助剂。可以利用本领域中已知的用于在洗涤剂中使用的任何水溶助剂。水溶助剂的非限制性实例包括苯磺酸钠、对甲苯磺酸钠(sts)、二甲苯磺酸钠(sxs)、枯烯磺酸钠(scs)、伞花烃磺酸钠、氧化胺、醇和聚乙二醇醚、羟基萘甲酸钠、羟基萘磺酸钠、乙基己基磺酸钠、及其组合。
[0925]
聚合物
[0926]
洗涤剂可以含有按重量计0
‑
10%(如0.5%
‑
5%、2%
‑
5%、0.5%
‑
2%或0.2%
‑
1%)的聚合物。可以利用本领域中已知的用于在洗涤剂中使用的任何聚合物。该聚合物可
以作为如上文提到的共助洗剂起作用,或可以提供抗再沉积、纤维保护、污垢释放、染料转移抑制、油脂清洁和/或消泡特性。一些聚合物可以具有多于一种的上文提到的特性和/或多于一种的下文提到的基序。示例性聚合物包括(羧甲基)纤维素(cmc)、聚(乙烯醇)(pva)、聚(乙烯吡咯烷酮)(pvp)、聚(乙二醇)或聚(环氧乙烷)(peg)、乙氧基化的聚(亚乙基亚胺)、羧甲基菊粉(cmi)、和聚羧化物,如paa、paa/pma、聚
‑
天冬氨酸、和甲基丙烯酸月桂酯/丙烯酸共聚物、疏水修饰的cmc(hm
‑
cmc)和硅酮、对苯二甲酸和低聚乙二醇的共聚物、聚(对苯二甲酸乙二酯)和聚(氧乙烯对苯二甲酸乙二酯)的共聚物(pet
‑
poet)、pvp、聚(乙烯基咪唑)(pvi)、聚(乙烯吡啶
‑
n
‑
氧化物)(pvpo或pvpno)以及聚乙烯吡咯烷酮
‑
乙烯基咪唑(pvpvi)。合适的实例包括pvp
‑
k15、pvp
‑
k30、来自ashl和aqualon的chromabond s
‑
400、chromabond s
‑
403e和chromabond s
‑
100,以及来自basf的hp 165、hp 50(分散剂)、hp 53(分散剂)、hp 59(分散剂)、hp 56(染料转移抑制剂)、hp 66k(染料转移抑制剂)。另外的示例性聚合物包括磺化的聚羧酸酯、聚环氧乙烷和聚环氧丙烷(peo
‑
ppo)以及乙氧基硫酸二季铵盐。其他示例性聚合物披露于例如wo 2006/130575中。还考虑了以上提到的聚合物的盐。特别优选的聚合物是来自basf的乙氧基化的均聚物hp20,其有助于防止洗涤液中的污垢再沉积。
[0927]
织物调色剂
[0928]
本发明的洗涤剂组合物还可以包括织物调色剂,例如染料或颜料,当配制在洗涤剂组合物中时,当所述织物与洗涤液接触时织物调色剂可以沉积在织物上,该洗涤液包含所述洗涤剂组合物,并且因此通过可见光的吸收/反射改变所述织物的色彩。荧光增白剂发射至少一些可见光。相比之下,当织物调色剂吸收至少部分可见光谱时,它们改变表面的色彩。合适的织物调色剂包括染料和染料
‑
粘土轭合物,并且还可以包括颜料。合适的染料包括小分子染料和聚合物染料。合适的小分子染料包括选自下组的小分子染料,该组由落入颜色索引(colour index)(c.i.)分类的以下染料组成:直接蓝、直接红、直接紫、酸性蓝、酸性红、酸性紫、碱性蓝、碱性紫和碱性红、或其混合物,例如描述于wo 2005/03274、wo 2005/03275、wo 2005/03276和ep 1876226中(通过引用并入本文)。洗涤剂组合物优选地包含从约0.00003wt%至约0.2wt%、从约0.00008wt%至约0.05wt%、或甚至从约0.001wt%至约0.04wt%的织物调色剂。该组合物可以包含从0.001wt%至0.2wt%的织物调色剂,当该组合物处于单位剂量袋的形式时,这可以是尤其优选的。合适的调色剂还披露于例如wo 2007/087257和wo 2007/087243中。
[0929]
酶
[0930]
洗涤剂添加剂连同洗涤剂组合物可以包括一种或多种另外的酶,例如至少一种脂肪酶、角质酶、淀粉酶、糖酶、纤维素酶、果胶酶、甘露聚糖酶、阿拉伯糖酶、半乳聚糖酶、木聚糖酶、氧化酶,例如漆酶、和/或过氧化物酶。
[0931]
一般而言,所选的一种或多种酶的特性应与所选的洗涤剂相容(即,最适ph、与其他酶和非酶成分的相容性等),并且该一种或多种酶应以有效量存在。
[0932]
纤维素酶
[0933]
合适的纤维素酶包括细菌或真菌来源的那些。包括化学修饰的突变体或蛋白质工程化的突变体。合适的纤维素酶包括来自芽孢杆菌属、假单胞菌属、腐质霉属、镰孢属、梭孢
壳属、枝顶孢霉属的纤维素酶,例如披露于us 4,435,307、us 5,648,263、us 5,691,178、us 5,776,757以及wo 89/09259中的由特异腐质霉、嗜热毁丝霉和尖孢镰孢产生的真菌纤维素酶。
[0934]
尤其合适的纤维素酶是具有颜色护理益处的碱性或中性纤维素酶。此类纤维素酶的实例是描述于ep 0 495 257、ep 0 531 372、wo 96/11262、wo 96/29397、wo 98/08940中的纤维素酶。其他实例是例如描述于wo 94/07998、ep 0 531 315、us 5,457,046、us 5,686,593、us 5,763,254、wo 95/24471、wo 98/12307以及wo 99/001544中的那些纤维素酶变体。
[0935]
其他纤维素酶是具有以下序列的内切
‑
β
‑
1,4
‑
葡聚糖酶,该序列与wo 2002/099091的seq id no:2的位置1至位置773的氨基酸序列具有至少97%同一性,或具有以下序列的家族44木葡聚糖酶,该序列与wo 2001/062903的seq id no:2的位置40
‑
559具有至少60%同一性。
[0936]
可商购的纤维素酶包括celluzyme
tm
和carezyme
tm
(诺维信公司(novozymes a/s))、carezyme premium
tm
(诺维信公司)、celluclean
tm
(诺维信公司)、celluclean classic
tm
(诺维信公司)、cellusoft
tm
(诺维信公司)、whitezyme
tm
(诺维信公司)、clazinase
tm
和puradax ha
tm
(杰能科国际有限公司(genencor international inc.))以及kac
‑
500(b)
tm
(花王株式会社(kao corporation))。
[0937]
甘露聚糖酶
[0938]
合适的甘露聚糖酶包括细菌或真菌来源的那些。包括化学或遗传修饰的突变体。甘露聚糖酶可以是家族5或26的碱性甘露聚糖酶。它可以是来自芽孢杆菌属或腐质霉属的野生型,特别是粘琼脂芽孢杆菌(b.agaradhaerens)、地衣芽孢杆菌(b.licheniformis)、耐盐芽孢杆菌(b.halodurans)、克劳氏芽孢杆菌(b.clausii)或特异腐质霉(h.insolens)。合适的甘露聚糖酶描述于wo 1999/064619中。可商购的甘露聚糖酶是mannaway(诺维信公司)。
[0939]
过氧化物酶/氧化酶
[0940]
合适的过氧化物酶/氧化酶包括植物、细菌或真菌来源的那些。包括化学修饰的突变体或蛋白质工程化的突变体。有用的过氧化物酶的实例包括来自鬼伞属,例如来自灰盖鬼伞(c.cinereus)的过氧化物酶,及其变体,如在wo 93/24618、wo 95/10602、以及wo 98/15257中描述的那些。可商购的过氧化物酶包括guardzyme
tm
(诺维信公司)。
[0941]
脂肪酶和角质酶
[0942]
合适的脂肪酶和角质酶包括细菌或真菌来源的那些。包括化学修饰的突变体酶或蛋白质工程化的突变体酶。实例包括如在ep 258068和ep 305216中所描述的来自嗜热丝孢菌属(thermomyces)(例如来自疏绵状嗜热丝孢菌(t.lanuginosus)(以前命名为柔毛腐质霉)的脂肪酶、来自腐质霉属(例如特异腐质霉(wo 96/13580))的角质酶、来自假单胞菌属(这些假单胞菌属中的一些现在重命名为伯克霍尔德菌属)的菌株(例如,产碱假单胞菌(p.alcaligenes)或类产碱假单胞菌(p.pseudoalcaligene)(ep 218272))的脂肪酶、洋葱假单胞菌(p.cepacia)(ep 331376)、假单胞菌属物种菌株sd705(wo 95/06720和wo 96/27002)、威斯康星假单胞菌(p.wisconsinensis)(wo 96/12012)、gdsl型链霉菌属脂肪酶(wo 10/065455)、来自稻瘟病菌(magnaporthe grisea)(wo 10/107560)的角质酶、来自门
多萨假多胞菌(pseudomonas mendocina)(us 5,389,536)的角质酶、来自嗜热裂孢菌(thermobifida fusca)(wo 11/084412)的脂肪酶、嗜热脂肪土芽孢杆菌脂肪酶(geobacillus stearothermophilus)(wo 11/084417)、来自枯草芽孢杆菌(wo 11/084599)的脂肪酶、以及来自灰色链霉菌(wo 11/150157)和始旋链霉菌(s.pristinaespiralis)(wo 12/137147)的脂肪酶。
[0943]
其他实例是脂肪酶变体,例如ep 407225、wo 92/05249、wo 94/01541、wo 94/25578、wo 95/14783、wo 95/30744、wo 95/35381、wo 95/22615、wo 96/00292、wo 97/04079、wo 97/07202、wo 00/34450、wo 00/60063、wo 01/92502、wo 07/87508以及wo 09/109500中所述的那些。
[0944]
优选的商业化脂肪酶产品包括lipolase
tm
、lipex
tm
;lipolex
tm
和lipoclean
tm
(诺维信公司),lumafast(来自杰能科公司(genencor))以及lipomax(来自吉斯特布罗卡德斯公司(gist
‑
brocades))。
[0945]
仍其他实例是有时称为酰基转移酶或过水解酶的脂肪酶,例如与南极假丝酵母(candida antarctica)脂肪酶a具有同源性的酰基转移酶(wo 10/111143)、来自耻垢分枝杆菌(mycobacterium smegmatis)的酰基转移酶(wo 05/56782)、来自ce 7家族的过水解酶(wo 09/67279)以及耻垢分枝杆菌过水解酶的变体(特别是来自亨斯迈纺织品染化有限公司(huntsman textile effects pte ltd)的商业产品gentle power bleach中所用的s54v变体)(wo 10/100028)。
[0946]
淀粉酶
[0947]
合适的淀粉酶包括α
‑
淀粉酶和/或葡糖淀粉酶并且可以是细菌或真菌来源的。包括化学修饰的突变体或蛋白质工程化的突变体。淀粉酶包括例如从芽孢杆菌属、例如地衣芽孢杆菌的特定菌株(更详细地描述于gb 1,296,839中)获得的α
‑
淀粉酶。
[0948]
合适的淀粉酶包括具有wo 95/10603中的seq id no:2的淀粉酶或其与seq id no:3具有90%序列同一性的变体。优选的变体描述于wo 94/02597、wo 94/18314、wo 97/43424中以及wo 99/019467的seq id no:4中,例如在以下位置的一个或多个中具有取代的变体:15、23、105、106、124、128、133、154、156、178、179、181、188、190、197、201、202、207、208、209、211、243、264、304、305、391、408和444。
[0949]
不同的合适的淀粉酶包括具有wo 02/010355中的seq id no:6的淀粉酶或其与seq id no:6具有90%序列同一性的变体。seq id no:6的优选的变体是在位置181和182中具有缺失并且在位置193中具有取代的那些。
[0950]
其他合适的淀粉酶是包含示于wo 2006/066594的seq id no:6中的来源于解淀粉芽孢杆菌(b.amyloliquefaciens)的α
‑
淀粉酶的残基1
‑
33和示于wo 2006/066594的seq id no:4中的地衣芽孢杆菌α
‑
淀粉酶的残基36
‑
483的杂合α
‑
淀粉酶或其具有90%序列同一性的变体。此杂合α
‑
淀粉酶的优选的变体是在以下位置的一个或多个中具有取代、缺失或插入的那些:g48、t49、g107、h156、a181、n190、m197、i201、a209和q264。包含示于wo 2006/066594的seq id no:6中的来源于解淀粉芽孢杆菌的α
‑
淀粉酶的残基1
‑
33和seq id no:4的残基36
‑
483的杂合α
‑
淀粉酶的最优选的变体是具有以下取代的那些:
[0951]
m197t;
[0952]
h156y+a181t+n190f+a209v+q264s;或
[0953]
g48a+t49i+g107a+h156y+a181t+n190f+i201f+a209v+q264s。
[0954]
另外的合适的淀粉酶是具有wo 99/019467中的seq id no:6的淀粉酶或其与seq id no:6具有90%序列同一性的变体。seq id no:6的优选的变体是在以下位置中的一个或多个中具有取代、缺失或插入的那些:r181、g182、h183、g184、n195、i206、e212、e216和k269。特别优选的淀粉酶是在位置r181和g182、或位置h183和g184中具有缺失的那些。
[0955]
可以使用的另外的淀粉酶是具有wo 96/023873的seq id no:1、seq id no:3、seq id no:2或seq id no:7的那些或其与seq id no:1、seq id no:2、seq id no:3或seq id no:7具有90%序列同一性的变体。seq id no:1、seq id no:2、seq id no:3或seq id no:7的优选的变体是在以下位置中的一个或多个中具有取代、缺失或插入的那些:140、181、182、183、184、195、206、212、243、260、269、304和476,使用wo 96/023873的seq id 2进行编号。更优选的变体是在选自181、182、183和184的两个位置(例如181和182、182和183、或位置183和184)中具有缺失的那些。seq id no:1、seq id no:2或seq id no:7的最优选的淀粉酶变体是在位置183和184中具有缺失并且在位置140、195、206、243、260、304和476中的一个或多个中具有取代的那些。
[0956]
可以使用的其他淀粉酶是具有wo 08/153815的seq id no:2、wo 01/66712中的seq id no:10的淀粉酶或其与wo 08/153815的seq id no:2具有90%序列同一性或与wo 01/66712中的seq id no:10具有90%序列同一性的变体。wo 01/66712中的seq id no:10的优选的变体是在以下位置的一个或多个中具有取代、缺失或插入的那些:176、177、178、179、190、201、207、211和264。
[0957]
另外的合适的淀粉酶是具有wo 09/061380的seq id no:2的淀粉酶或其与seq id no:2具有90%序列同一性的变体。seq id no:2的优选的变体是在以下位置中的一个或多个中具有c
‑
末端截短和/或取代、缺失或插入的那些:q87、q98、s125、n128、t131、t165、k178、r180、s181、t182、g183、m201、f202、n225、s243、n272、n282、y305、r309、d319、q320、q359、k444和g475。seq id no:2的更优选的变体是在以下位置的一个或多个中具有取代的那些:q87e,r、q98r、s125a、n128c、t131i、t165i、k178l、t182g、m201l、f202y、n225e,r、n272e,r、s243q,a,e,d、y305r、r309a、q320r、q359e、k444e以及g475k,和/或在位置r180和/或s181或t182和/或g183处具有缺失的那些。seq id no:2的最优选的淀粉酶变体是具有以下取代的那些:
[0958]
n128c+k178l+t182g+y305r+g475k;
[0959]
n128c+k178l+t182g+f202y+y305r+d319t+g475k;
[0960]
s125a+n128c+k178l+t182g+y305r+g475k;或
[0961]
s125a+n128c+t131i+t165i+k178l+t182g+y305r+g475k,其中这些变体是c
‑
末端截短的,并且任选地进一步包含在位置243处的取代和/或在位置180和/或位置181处的缺失。
[0962]
另外的合适的淀粉酶是具有wo 13184577的seq id no:1的淀粉酶或其与seq id no:1具有90%序列同一性的变体。seq id no:1的优选的变体是在以下位置的一个或多个中具有取代、缺失或插入的那些:k176、r178、g179、t180、g181、e187、n192、m199、i203、s241、r458、t459、d460、g476和g477。seq id no:1的更优选的变体是在以下位置的一个或多个中具有取代的那些:k176l、e187p、n192fyh、m199l、i203yf、s241qadn、r458n、t459s、
d460t、g476k、以及g477k,和/或在位置r178和/或s179或t180和/或g181中具有缺失的那些。seq id no:1的最优选的淀粉酶变体是具有以下取代的那些:
[0963]
e187p+i203y+g476k
[0964]
e187p+i203y+r458n+t459s+d460t+g476k
[0965]
其中变体任选地进一步包含在位置241处的取代和/或在位置178和/或位置179处的缺失。
[0966]
另外的合适的淀粉酶是具有wo 10104675的seq id no:1的淀粉酶或其与seq id no:1具有90%序列同一性的变体。seq id no:1的优选的变体是在以下位置的一个或多个中具有取代、缺失或插入的那些:n21、d97、v128、k177、r179、s180、i181、g182、m200、l204、e242、g477和g478。seq id no:1的更优选的变体是在以下位置的一个或多个中具有取代的那些:n21d、d97n、v128i、k177l、m200l、l204yf、e242qa、g477k、以及g478k,和/或在位置r179和/或s180或i181和/或g182中具有缺失的那些。seq id no:1的最优选的淀粉酶变体是具有以下取代的那些:
[0967]
n21d+d97n+v128i
[0968]
其中变体任选地进一步包含在位置200处的取代和/或在位置180和/或位置181处的缺失。
[0969]
其他合适的淀粉酶是具有wo 01/66712中的seq id no:12的α
‑
淀粉酶或与seq id no:12具有至少90%序列同一性的变体。优选的淀粉酶变体是在wo 01/66712中的seq id no:12的以下位置的一个或多个中具有取代、缺失或插入的那些:r28、r118、n174;r181、g182、d183、g184、g186、w189、n195、m202、y298、n299、k302、s303、n306、r310、n314;r320、h324、e345、y396、r400、w439、r444、n445、k446、q449、r458、n471、n484。特别优选的淀粉酶包括具有d183和g184的缺失并且具有取代r118k、n195f、r320k和r458k的变体,以及另外在一个或多个选自下组的位置中具有取代的变体:m9、g149、g182、g186、m202、t257、y295、n299、m323、e345和a339,最优选的是另外在所有这些位置中具有取代的变体。
[0970]
其他实例是淀粉酶变体,如在wo 2011/098531、wo 2013/001078和wo 2013/001087中描述的那些。
[0971]
可商购的淀粉酶是duramyl
tm
、termamyl
tm
、fungamyl
tm
、stainzyme
tm
、stainzyme plus
tm
、natalase
tm
、liquozyme x and ban
tm
(来自诺维信公司),和rapidase
tm
、purastar
tm
/effectenz
tm
、powerase、preferenz s1000、preferenz s100和preferenz s110(来自杰能科国际有限公司/杜邦公司(dupont))。
[0972]
蛋白酶
[0973]
合适的蛋白酶包括细菌、真菌、植物、病毒或动物来源的那些,例如植物或微生物来源。优选微生物来源。包括化学修饰的突变体或蛋白质工程化的突变体。它可以是碱性蛋白酶,如丝氨酸蛋白酶或金属蛋白酶。丝氨酸蛋白酶可以例如是s1家族(如胰蛋白酶)或s8家族(如枯草杆菌蛋白酶)。金属蛋白酶可以例如是来自例如m4家族的嗜热菌蛋白酶或其他金属蛋白酶,如来自m5、m7或m8家族的那些。
[0974]
术语“枯草杆菌酶”是指根据siezen等人,protein engng.[蛋白质工程]4(1991)719
‑
737和siezen等人,protein science[蛋白质科学]6(1997)501
‑
523的丝氨酸蛋白酶亚组。丝氨酸蛋白酶是特征为在活性位点具有与底物形成共价加合物的丝氨酸的蛋白酶的亚
组。枯草杆菌酶可以被划分为6个亚类,即,枯草杆菌蛋白酶家族、嗜热蛋白酶家族、蛋白酶k家族、羊毛硫氨酸抗生素肽酶家族、kexin家族和pyrolysin家族。
[0975]
枯草杆菌酶的实例是来源于芽孢杆菌属的那些,例如描述于us 7262042和wo 09/021867中的迟缓芽孢杆菌、嗜碱芽孢杆菌、枯草芽孢杆菌、解淀粉芽孢杆菌、短小芽孢杆菌和吉氏芽孢杆菌(bacillus gibsonii);和迟缓枯草杆菌蛋白酶、枯草杆菌蛋白酶novo、枯草杆菌蛋白酶carlsberg、地衣芽孢杆菌、枯草杆菌蛋白酶bpn’、枯草杆菌蛋白酶309、枯草杆菌蛋白酶147和枯草杆菌蛋白酶168,以及例如描述于(wo 93/18140)中的蛋白酶pd138。其他有用的蛋白酶可以是描述于wo 01/016285和wo 02/016547中的那些。胰蛋白酶样蛋白酶的实例是胰蛋白酶(例如猪或牛来源的)和镰孢属蛋白酶(描述于wo 94/25583和wo 05/040372中),以及来源于纤维单胞菌(cellumonas)的胰凝乳蛋白酶(描述于wo 05/052161和wo 05/052146中)。
[0976]
进一步优选的蛋白酶是来自迟缓芽孢杆菌dsm 5483的碱性蛋白酶(如在例如wo 95/23221中所述)、及其变体(在wo 92/21760、wo 95/23221、ep 1921147以及ep 1921148中描述的)。
[0977]
金属蛋白酶的实例是如描述于wo 07/044993(宝洁公司(procter&gamble)/杰能科国际有限公司(genencor int.))中的中性金属蛋白酶,如来源于解淀粉芽孢杆菌的那些。
[0978]
有用的蛋白酶的实例是描述于以下中的变体:wo 89/06279、wo 92/19729、wo 96/034946、wo 98/20115、wo 98/20116、wo 99/011768、wo 01/44452、wo 03/006602、wo 04/03186、wo 04/041979、wo 07/006305、wo 11/036263、wo 11/036264,尤其是在以下位置中的一个或多个处具有取代的变体:3、4、9、15、24、27、42、55、59、60、66、74、85、96、97、98、99、100、101、102、104、116、118、121、126、127、128、154、156、157、158、161、164、176、179、182、185、188、189、193、198、199、200、203、206、211、212、216、218、226、229、230、239、246、255、256、268和269,其中这些位置对应于wo 2016/001449的seq id no1中示出的迟缓芽孢杆菌蛋白酶的位置。更优选的蛋白酶变体可以包含选自下组的一种或多种突变,该组由以下组成:s3t、v4i、s9r、s9e、a15t、s24g、s24r、k27r、n42r、s55p、g59e、g59d、n60d、n60e、v66a、n74d、s85r、a96s、s97g、s97d、s97a、s97sd、s99e、s99d、s99g、s99m、s99n、s99r、s99h、s101a、v102i、v102y、v102n、s104a、g116v、g116r、h118d、h118n、a120s、s126l、p127q、s128a、s154d、a156e、g157d、g157p、s158e、y161a、r164s、q176e、n179e、s182e、q185n、a188p、g189e、v193m、n198d、v199i、y203w、s206g、l211q、l211d、n212d、n212s、m216s、a226v、k229l、q230h、q239r、n246k、n255w、n255d、n255e、l256e、l256d、t268a以及r269h。这些蛋白酶变体优选地是在wo 2016/001449的seq id no 1中示出的迟缓芽孢杆菌蛋白酶的变体、在wo 2016/001449的seq id no 2中示出的解淀粉芽孢杆菌蛋白酶(bpn’)的变体。这些蛋白酶变体与wo 2016/001449的seq id no1或seq id no 2优选地具有至少80%序列同一性。
[0979]
另一个合适的蛋白酶变体是在对应于wo 2004/067737的seq id no:1的位置171、173、175、179或180的一个或多个位置处包含取代的蛋白酶变体,其中所述蛋白酶变体与wo 2004/067737的seq id no:1具有至少75%但小于100%的序列同一性。
[0980]
合适的可商购的蛋白酶包括以下列商品名出售的那些:duralase
tm
、
durazym
tm
、ultra、ultra、ultra、ultra、blaze100t、blaze125t、blaze150t、uno、in andexcel(诺维信公司),以下列商品名出售的那些:purafectpurafectpurafectexcellenz p1000
tm
、excellenz p1250
tm
、preferenz p100
tm
、p 300、purafectpreferenz p110
tm
、effectenz p1000
tm
、effectenz p1050
tm
、purafecteffectenz p2000
tm
、和(丹斯尼克公司(danisco)/杜邦公司)、axapem
tm
(吉斯特布罗卡德斯公司(gist
‑
brocases n.v.))、blap(在us 5352604的图29中显示的序列)及其变体(汉高公司(henkel ag))、以及来自花王株式会社(kao)的kap(嗜碱芽孢杆菌枯草杆菌蛋白酶)。
[0981]
过氧化物酶/氧化酶
[0982]
根据本发明的过氧化物酶是由酶分类ec 1.11.1.7囊括的由国际生物化学和分子生物学联盟命名委员会(iubmb)规定的酶,或来源于其中的展示出过氧化物酶活性的任何片段。
[0983]
合适的过氧化物酶包括植物、细菌或真菌来源的那些。包括化学修饰的突变体或蛋白质工程化的突变体。有用的过氧化物酶的实例包括来自拟鬼伞属(coprinopsis),例如来自灰盖拟鬼伞(c.cinerea)的过氧化物酶(ep179,486),及其变体,如在wo 93/24618、wo 95/10602以及wo 98/15257中所描述的那些。
[0984]
合适的过氧化物酶包括卤代过氧化物酶,如氯过氧化物酶、溴过氧化物酶以及表现出氯过氧化物酶或溴过氧化物酶活性的化合物。根据其对卤素离子的特异性将卤代过氧化物酶进行分类。氯过氧化物酶(e.c.1.11.1.10)催化从氯离子形成次氯酸盐。优选地,该卤代过氧化物酶是钒卤代过氧化物酶,即含钒酸盐的卤代过氧化物酶。已从许多不同真菌,特别是从暗色丝孢菌(dematiaceous hyphomycete)真菌组中分离出了卤代过氧化物酶,如卡尔黑霉属(caldariomyces)(例如,煤卡尔黑霉(c.fumago))、链格孢属(alternaria)、弯孢属(curvularia)(例如,疣枝弯孢(c.verruculosa)和不等弯孢(c.inaequalis))、内脐蠕孢属(drechslera)、细基格孢属(ulocladium)以及葡萄孢属(botrytis)。
[0985]
还已从细菌,如假单胞菌属(例如吡咯假单胞菌(p.pyrrocinia))和链霉菌属(例如,金色链霉菌(s.aureofaciens))中分离出了卤代过氧化物酶。
[0986]
合适的氧化酶特别地包括由酶分类ec 1.10.3.2所包含的任何漆酶或源自其的展现出漆酶活性的任何片段、或展现出类似活性的化合物,如儿茶酚氧化酶(ec 1.10.3.1)、邻氨基苯酚氧化酶(ec 1.10.3.4)或胆红素氧化酶(ec1.3.3.5)。优选的漆酶是微生物来源的酶。这些酶可以来源于植物、细菌或真菌(包括丝状真菌和酵母)。来自真菌的合适的实例包括可来源于以下的菌株的漆酶:曲霉属、脉孢菌属(例如,粗糙脉孢菌(n.crassa))、柄孢
chemicals)供应。合适用于本发明中使用的其他荧光剂包括1
‑3‑
二芳基吡唑啉和7
‑
氨烷基香豆素。合适的荧光增亮剂水平包括从约0.01wt%、从0.05wt%、从约0.1wt%或甚至从约0.2wt%的较低水平至0.5wt%或甚至0.75wt%的较高水平。
[0993]
污垢释放聚合物
[0994]
本发明的洗涤剂组合物还可以包括一种或多种污垢释放聚合物,这些聚合物帮助从织物(如棉和基于聚酯的织物)去除污垢,特别是从基于聚酯的织物去除疏水性污垢。污垢释放聚合物可以例如是非离子或阴离子对苯二甲酸基的聚合物、聚乙烯基己内酰胺和相关共聚物、乙烯基接枝共聚物、聚酯聚酰胺,参见例如powdered detergents[粉末洗涤剂],surfactant science series[表面活性剂科学系列],第71卷,第7章,马塞尔德克尔公司。另一种类型的污垢释放聚合物是包含核心结构和附接至该核心结构的多个烷氧基化基团的两亲性烷氧基化油脂清洁聚合物。核心结构可以包含聚烷基亚胺结构或聚烷醇胺结构,如在wo 2009/087523中详细描述的(通过引用并入本文)。此外,随机接枝共聚物是合适的污垢释放聚合物。合适的接枝共聚物更详细地描述于wo 2007/138054、wo 2006/108856以及wo 2006/113314中(通过引用并入本文)。合适的聚乙二醇聚合物包括包含以下的随机接枝共聚物:(i)含有聚乙二醇的亲水性主链;以及(ii)选自下组的一条或多条侧链,该组由以下组成:c4
‑
c25烷基基团、聚丙烯、聚丁烯、饱和c1
‑
c6单羧酸的乙烯基酯、丙烯酸或甲基丙烯酸的cl
‑
c6烷基酯及其混合物。合适的聚乙二醇聚合物具有聚乙二醇主链(具有随机接枝的聚乙酸乙烯酯侧链)。聚乙二醇主链的平均分子量范围可以为从2,000da至20,000da、或从4,000da至8,000da。聚乙二醇主链与聚乙酸乙烯酯侧链的分子量比率可以在从1:1至1:5、或从1:1.2至1:2的范围内。每个环氧乙烷单元的接枝位点的平均数量可以小于1、或小于0.8,每个环氧乙烷单元的接枝位点的平均数量可在0.5至0.9的范围内,或每个环氧乙烷单元的接枝位点的平均数量可以在0.1至0.5、或0.2至0.4的范围内。合适的聚乙二醇聚合物是sokalan hp22。其他污垢释放聚合物是取代的多糖结构,尤其是取代的纤维素结构,如修饰的纤维素衍生物,如ep 1867808或wo 2003/040279中所描述的那些(将二者都通过引用并入本文)。合适的纤维素聚合物包括纤维素、纤维素醚、纤维素酯、纤维素酰胺及其混合物。合适的纤维素聚合物包括阴离子修饰的纤维素、非离子修饰的纤维素、阳离子修饰的纤维素、兼性离子修饰的纤维素及其混合物。合适的纤维素聚合物包括甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、酯羧甲基纤维素及其混合物。
[0995]
抗再沉积剂
[0996]
本发明的洗涤剂组合物还可以包括一种或多种抗再沉积剂,如羧甲基纤维素(cmc)、聚乙烯醇(pva)、聚乙烯吡咯烷酮(pvp)、聚氧乙烯和/或聚乙二醇(peg)、丙烯酸的均聚物、丙烯酸和马来酸的共聚物、和乙氧基化的聚乙亚胺。以上在污垢释放聚合物下所描述的基于纤维素的聚合物还可以作为抗再沉积剂起作用。
[0997]
流变改性剂
[0998]
本发明的洗涤剂组合物还可以包括一种或多种流变改性剂、结构剂或增稠剂,不同于降粘剂。流变改性剂选自下组,该组由以下组成:非聚合物结晶、羟基功能材料、聚合物流变改性剂,它们为液体洗涤剂组合物的水性液相基质赋予剪切稀化特征。可以通过本领域已知的方法修饰和调整洗涤剂的流变学和粘度,例如,如在ep 2169040中所示。
[0999]
其他合适的清洁组合物组分包括但不限于防缩剂、抗皱剂、杀细菌剂、粘合剂、运
载体、染料、酶稳定剂、织物软化剂、填充剂、泡沫调节剂、水溶助剂、香料、颜料、抑泡剂、溶剂以及用于液体洗涤剂的结构剂和/或结构弹性剂。
[1000]
洗涤剂产品的配制品
[1001]
本发明的洗涤剂组合物可以处于任何常规形式,例如条,均匀的片剂,具有两层或更多层的片剂,具有一个或多个室的袋,规则的或压缩的粉末,颗粒,膏,凝胶,或规则的、压缩的或浓缩的液体。
[1002]
袋可以被配置为单一室或多室。它可以具有适合用于容持该组合物的任何形式、形状和材料,例如在与水接触之前,不允许该组合物从袋中释放出来。袋由水溶性膜制成,它包含了一个内部体积。可以将所述内部体积分成袋的室。优选的膜是聚合物材料,优选地形成膜或薄片的聚合物。优选的聚合物、共聚物或其衍生物选自聚丙烯酸酯、和水溶性丙烯酸酯共聚物、甲基纤维素、羧甲基纤维素、糊精钠、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、麦芽糊精、聚甲基丙烯酸酯,最优选地是聚乙烯醇共聚物以及羟丙基甲基纤维素(hpmc)。优选地,聚合物在膜例如pva中的水平是至少约60%。优选的平均分子量将典型地是约20,000至约150,000。膜还可以是共混组合物,这些共混组合物包含可水解降解并且可水溶的聚合物共混物,如聚乳酸和聚乙烯醇(已知在贸易参考号m8630下,如由美国印第安纳州的monosol有限责任公司(monosol llc)销售)加增塑剂,像甘油、乙二醇、丙二醇、山梨醇及其混合物。袋可以包含固体衣物洗涤清洁组合物或部分组分和/或液体清洁组合物或由水溶性膜分开的部分组分。可用于液体组分的室在组成上可以与含有固体的室不同:us 2009/0011970a1。
[1003]
可以由水溶性袋中的或片剂的不同层中的室来将洗涤剂成分彼此物理分开。因此,可以避免组分间的不良的储存相互作用。在洗涤溶液中,每个室的不同溶解曲线还可以引起选择的组分的延迟溶解。
[1004]
非单位剂量的液体或凝胶洗涤剂可以是水性的,典型地含有按重量计至少20%并且高达95%的水,例如高达约70%的水、高达约65%的水、高达约55%的水、高达约45%的水、高达约35%的水。包括但不限于链烷醇、胺、二醇、醚以及多元醇的其他类型的液体可以被包括在水性液体或凝胶中。水性液体或凝胶洗涤剂可以含有从0
‑
30%的有机溶剂。液体或凝胶洗涤剂可以是非水性的。
[1005]
颗粒洗涤剂配制品
[1006]
本发明的组合物可以被配制为颗粒,例如,配制为结合一种或多种酶的共颗粒。然后,每种酶将存在于多种颗粒中,这些颗粒确保酶在洗涤剂中的分布更均匀。这还减少了由于不同的粒度,不同酶的物理隔离。用于生产针对洗涤剂工业的多酶共颗粒的方法披露于ip.com披露内容ipcom000200739d中。
[1007]
通过使用共颗粒的酶的配制品的另一个实例披露于wo 2013/188331中,其涉及包含以下的洗涤剂组合物:(a)多酶共颗粒;(b)少于10wt沸石(无水的基础上);和(c)少于10wt磷酸盐(无水的基础上),其中所述酶共颗粒包含从10wt%至98wt%的水分汇组分(sink component),并且该组合物另外还包含从20wt%至80wt%的洗涤剂水分汇组分。
[1008]
多酶共颗粒可以包含本发明的多肽和(a)一种或多种选自以下的酶:脂肪酶、半纤维素酶、蛋白酶、淀粉酶、纤维素酶、纤维二糖脱氢酶、木聚糖酶、磷脂酶、酯酶、角质酶、果胶酶、甘露聚糖酶、果胶裂解酶、角蛋白酶、还原酶、氧化酶、酚氧化酶、木质酶、普鲁兰酶、鞣酸
酶、戊聚糖酶、地衣聚糖酶、葡聚糖酶、阿拉伯糖苷酶、透明质酸酶、软骨素酶、淀粉酶、及其混合物。
[1009]
可以根据本领域中已知的方法来制备组合物,并且组合物可以处于液体或干组合物的形式。可以根据本领域中已知的方法将组合物稳定化。
[1010]
下面给出了本发明的组合物的优选的用途的实例。组合物的剂量以及使用组合物的其他条件可以基于本领域中已知的方法进行确定。
[1011]
用途
[1012]
具有核酸酶活性的多肽可以用于深度清洁物品,如纺织品。在本发明的一个实施例中,涉及具有核酸酶活性的多肽用于防止、减少或去除恶臭的用途。本发明的一个实施例涉及具有核酸酶活性的多肽用于对经受多次洗涤的纺织品进行抗再沉积的防止或减少和/或用于改进白度的用途。当生物膜组分(例如细胞外生物膜基质的rna)被去除或减少时,由生物膜引起的粘性也会降低,由此污垢在物品上的附着被防止、减少或去除。因此,当将本发明的组合物应用于清洁过程如衣物洗涤时,具有核酸酶活性的多肽降低了纺织品的灰度。具有核酸酶活性的多肽可以进一步用于在该物品的清洁期间防止、减少或去除污垢的再沉积。
[1013]
本发明的一个方面涉及具有核酸酶活性的多肽用于清洁物品的用途,该清洁通过如下项进行:
[1014]
(a)防止、减少或去除该物品的粘性;
[1015]
(b)防止、减少或去除来自该物品的生物膜或生物膜组分;
[1016]
(c)在该物品的清洁期间防止、减少或去除污垢的再沉积;
[1017]
(d)防止、减少或去除污垢在该物品上的附着;
[1018]
(e)维持或改进该物品的白度;或
[1019]
(f)防止、减少或去除来自该物品的恶臭,
[1020]
其中该物品是纺织品,并且
[1021]
其中该具有核酸酶活性的多肽选自由以下组成的组:seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:21、seq id no:24、seq id no:27、seq id no:30、seq id no:33、seq id no:36、seq id no:39、seq id no:42、seq id no:45、seq id no:48、seq id no:51、seq id no:54、seq id no:57、seq id no:60、seq id no:63、seq id no:66、seq id no:69、seq id no:72、seq id no:75、seq id no:78、seq id no:81、seq id no:84、seq id no:87、seq id no:90、seq id no:93、seq id no:96、seq id no:99、seq id no:108和seq id no:111,以及与其具有至少80%序列同一性的多肽。
[1022]
以下段落中定义本发明的特定实施例:
[1023]
1.一种具有核酸酶活性的多肽,该多肽选自由以下组成的第一组:
[1024]
(a)与seq id no:3的多肽具有至少99%序列同一性的多肽;
[1025]
(b)与seq id no:6的多肽具有至少62%序列同一性的多肽;
[1026]
(c)与seq id no:12的多肽具有至少97%序列同一性的多肽;以及
[1027]
(d)与seq id no:21或27的多肽具有至少86%序列同一性的多肽;
[1028]
(e)与seq id no:30的多肽具有至少98%序列同一性的多肽;
[1029]
(f)与seq id no:33或48的多肽具有100%序列同一性的多肽;
[1030]
(g)与seq id no:39或51的多肽具有至少76%序列同一性的多肽;
[1031]
(h)与seq id no:42的多肽具有至少95%序列同一性的多肽;
[1032]
(i)与seq id no:45或24的多肽具有至少79%序列同一性的多肽;
[1033]
(j)与seq id no:54的多肽具有至少94%序列同一性的多肽;
[1034]
(k)与seq id no:57的多肽具有至少72%序列同一性的多肽;
[1035]
(l)与seq id no:60的多肽具有至少82%序列同一性的多肽;
[1036]
(m)与seq id no:63的多肽具有至少75%序列同一性的多肽;以及
[1037]
(n)与seq id no:69或75的多肽具有至少80%序列同一性的多肽;
[1038]
或该多肽选自由以下组成的第二组:
[1039]
(o)与seq id no:78的多肽具有至少77%序列同一性的多肽;
[1040]
(p)与seq id no:84的多肽具有至少94%序列同一性的多肽;
[1041]
(q)与seq id no:87的多肽具有至少99%序列同一性的多肽;
[1042]
(r)与seq id no:90的多肽具有至少80%序列同一性的多肽;以及
[1043]
(s)与seq id no:93的多肽具有至少90%序列同一性的多肽;
[1044]
或该多肽是选自以下的变体或片段:
[1045]
(t)选自所述第一组或所述第二组的多肽的变体,其中该变体具有核酸酶活性并包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20位置中的一个或多个氨基酸取代、和/或一个或多个氨基酸缺失、和/或一个或多个氨基酸插入或其任何组合;以及
[1046]
(u)(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)、(j)、(k)、(l)、(m)、(n)、(o)、(p)、(q)、(r)和(s)的多肽的片段,其中所述片段具有核酸酶活性。
[1047]
2.根据段落1所述的多肽,该多肽选自由以下组成的所述第一组:
[1048]
i.与seq id no:6、24、39、45、51、57、63、69和75中任一个的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[1049]
ii.与seq id no:42、54、60、21和27中任一个的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[1050]
3.根据段落1所述的多肽,该多肽选自由以下组成的所述第二组:
[1051]
i.与seq id no:78或90的多肽具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽;以及
[1052]
ii.与seq id no:84或93的多肽具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的多肽。
[1053]
4.根据段落1
‑
3中任一项所述的多肽,该多肽由多核苷酸编码,该多核苷酸与以下序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性:
[1054]
i.seq id no:28、31、37、40、76、82、85、88和91中任一个的成熟多肽编码序列;或
[1055]
ii.seq id no:1、4、10、19、22、25、43、46、49、52、55、58、61、67和73中任一个的成熟多肽cdna编码序列。
[1056]
5.根据段落1
‑
4中任一项所述的多肽,该多肽选自由以下多肽组成的组:
[1057]
(a)包含seq id no:3或seq id no:2的成熟多肽,或由其组成;
[1058]
(b)包含seq id no:6或seq id no:5的成熟多肽,或由其组成;
[1059]
(c)包含seq id no:12或seq id no:11的成熟多肽,或由其组成;
[1060]
(d)包含seq id no:21或seq id no:20的成熟多肽,或由其组成;
[1061]
(e)包含seq id no:24或seq id no:23的成熟多肽,或由其组成;
[1062]
(f)包含seq id no:27或seq id no:26的成熟多肽,或由其组成;
[1063]
(g)包含seq id no:30或seq id no:29的成熟多肽,或由其组成;
[1064]
(h)包含seq id no:33或seq id no:32的成熟多肽,或由其组成;
[1065]
(i)包含seq id no:39或seq id no:38的成熟多肽,或由其组成;
[1066]
(j)包含seq id no:42或seq id no:41的成熟多肽,或由其组成;
[1067]
(k)包含seq id no:45或seq id no:44的成熟多肽,或由其组成;
[1068]
(l)包含seq id no:48或seq id no:47的成熟多肽,或由其组成;
[1069]
(m)包含seq id no:51或seq id no:50的成熟多肽,或由其组成;
[1070]
(n)包含seq id no:54或seq id no:53的成熟多肽,或由其组成;
[1071]
(o)包含seq id no:57或seq id no:56的成熟多肽,或由其组成;
[1072]
(p)包含seq id no:60或seq id no:59的成熟多肽,或由其组成;
[1073]
(q)包含seq id no:63或seq id no:62的成熟多肽,或由其组成;
[1074]
(r)包含seq id no:69或seq id no:68的成熟多肽,或由其组成;
[1075]
(s)包含seq id no:75或seq id no:74的成熟多肽,或由其组成;
[1076]
(t)包含seq id no:78或seq id no:77的成熟多肽,或由其组成;
[1077]
(u)包含seq id no:84或seq id no:83的成熟多肽,或由其组成;
[1078]
(v)包含seq id no:87或seq id no:86的成熟多肽,或由其组成;
[1079]
(w)包含seq id no:90或seq id no:89的成熟多肽,或由其组成;
[1080]
(x)包含seq id no:93或seq id no:92的成熟多肽,或由其组成;
[1081]
(y)包含seq id no:96或seq id no:95的成熟多肽,或由其组成;
[1082]
(z)包含seq id no:99或seq id no:98的成熟多肽,或由其组成;
[1083]
包含seq id no:108或seq id no:107的成熟多肽,或由其组成;以及
[1084]
包含seq id no:111或seq id no:110的成熟多肽,或由其组成。
[1085]
6.一种多核苷酸,其编码根据段落1
‑
5中任一项所述的多肽。
[1086]
7.一种核酸构建体或表达载体,该核酸构建体或表达载体包含根据段落6所述的多核苷酸,该多核苷酸可操作地连接至指导该多肽在表达宿主中的产生的一个或多个控制序列。
[1087]
8.一种重组宿主细胞,该重组宿主细胞包含根据段落6所述的多核苷酸,该多核苷酸可操作地连接至指导该多肽的产生的一个或多个控制序列。
[1088]
9.一种全培养液配制品或细胞培养组合物,该全培养液配制品或细胞培养组合物包含根据段落1
‑
5中任一项所述的多肽。
[1089]
10.一种产生根据段落1
‑
5中任一项所述的多肽的方法,该方法包括在有益于产生该多肽的条件下培养细胞,该细胞以其野生型形式产生该多肽;以及任选地回收该多肽。
[1090]
11.一种组合物,其包含根据段落1
‑
5中任一项所述的多肽。
[1091]
12.根据段落11所述的组合物,其中该组合物是清洁组合物。
[1092]
13.根据段落12所述的清洁组合物,其包含:
[1093]
(a)至少0.001ppm的具有核酸酶活性的多肽;
[1094]
(b)一种或多种表面活性剂;以及
[1095]
(c)任选地一种或多种清洁组合物组分,优选地选自表面活性剂、助洗剂、漂白组分、聚合物、分散剂和另外的酶,
[1096]
其中所述多肽是根据段落1
‑
5中任一项所述的多肽,
[1097]
或所述多肽选自由以下组成的组:
[1098]
(i)与seq id no:9的多肽具有至少80%序列同一性的多肽;
[1099]
(ii)与seq id no:15的多肽具有至少80%序列同一性的多肽;
[1100]
(iii)与seq id no:18的多肽具有至少80%序列同一性的多肽;
[1101]
(iv)与seq id no:36的多肽具有至少80%序列同一性的多肽;
[1102]
(v)与seq id no:66的多肽具有至少80%序列同一性的多肽;
[1103]
(vi)与seq id no:72的多肽具有至少80%序列同一性的多肽;
[1104]
(vii)与seq id no:81的多肽具有至少80%序列同一性的多肽;
[1105]
(viii)与seq id no:96的多肽具有至少80%序列同一性的多肽;以及(ix)与seq id no:99的多肽具有至少80%序列同一性的多肽;
[1106]
(x)包含基序[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h(seq id no:102)、g[ga]nx[vilfy]x[vlm](seq id no:103)、和/或[sadn]r[gs]h(seq id no:104)中的一个或多个的多肽,其中该多肽属于pfam家族pf02265(s1
‑
p1_核酸酶)、pf01223(核酸内切酶_ns)或pf13930(核酸内切酶_ns_2)。
[1107]
14.根据段落13所述的清洁组合物,其中该一种或多种表面活性剂选自阴离子表面活性剂、非离子表面活性剂、阳离子表面活性剂、兼性离子表面活性剂及其混合物。
[1108]
15.根据段落13
‑
14中任一项所述的清洁组合物,其中该一种或多种表面活性剂是阴离子表面活性剂,优选地选自由以下组成的组:直链烷基苯磺酸盐(las)、las的异构体、支链烷基苯磺酸盐(babs)、苯基链烷磺酸盐、α
‑
烯烃磺酸盐(aos)、烯烃磺酸盐、链烯烃磺酸盐、链烷
‑
2,3
‑
二基双(硫酸盐)、羟基链烷磺酸盐以及二磺酸盐、烷基硫酸盐(as)(如十二烷基硫酸钠(sds))、脂肪醇硫酸盐(fas)、伯醇硫酸盐(pas)、醇醚硫酸盐(aes或aeos或fes)、仲链烷磺酸盐(sas)、石蜡磺酸盐(ps)、酯磺酸盐、磺化的脂肪酸甘油酯、α
‑
磺基脂肪酸甲酯(α
‑
sfme或ses)(包括甲酯磺酸盐(mes))、烷基琥珀酸或烯基琥珀酸、十二烯基/十四烯基琥珀酸(dtsa)、氨基酸的脂肪酸衍生物、磺基琥珀酸的二酯和单酯或脂肪酸盐(皂)、及其组合。
[1109]
16.根据段落13
‑
15中任一项所述的清洁组合物,其中该一种或多种表面活性剂是非离子表面活性剂,其选自醇乙氧基化物(ae或aeo)、醇丙氧基化物、丙氧基化的脂肪醇(pfa)、烷氧基化的脂肪酸烷基酯(如乙氧基化的和/或丙氧基化的脂肪酸烷基酯)、烷基酚乙氧基化物(ape)、壬基酚乙氧基化物(npe)、烷基多糖苷(apg)、烷氧基化胺、脂肪酸单乙醇酰胺(fam)、脂肪酸二乙醇酰胺(fada)、乙氧基化的脂肪酸单乙醇酰胺(efam)、丙氧基化的脂肪酸单乙醇酰胺(pfam)、多羟基烷基脂肪酸酰胺、或葡萄糖胺的n
‑
酰基n
‑
烷基衍生物(葡
糖酰胺(ga)、或脂肪酸葡糖酰胺(faga))、及其组合。
[1110]
17.根据段落15或16中任一项所述的清洁组合物,其中该组合物包含一种或多种阴离子表面活性剂和一种或多种非离子表面活性剂。
[1111]
18.一种用于洗涤物品的方法,该方法包括以下步骤:
[1112]
(a)将物品暴露于洗涤液,该洗涤液包含根据段落1至5中任一项所述的多肽或根据段落11至17中所述的组合物;
[1113]
(b)完成至少一个洗涤周期;以及
[1114]
(c)任选地冲洗该物品,
[1115]
其中该物品是纺织品。
[1116]
19.根据段落1
‑
5中任一项所述的多肽或根据段落11
‑
17中所述的清洁组合物用于清洁物品的用途,该清洁通过如下项进行:
[1117]
(a)防止、减少或去除该物品的粘性;
[1118]
(b)防止、减少或去除来自该物品的生物膜或生物膜组分;
[1119]
(c)在该物品的清洁期间防止、减少或去除污垢的再沉积;
[1120]
(d)防止、减少或去除污垢在该物品上的附着;
[1121]
(e)维持或改进该物品的白度;或
[1122]
(f)防止、减少或去除来自该物品的恶臭,
[1123]
其中该物品是纺织品。
[1124]
通过以下实例进一步描述本发明,这些实例不应理解为对本发明的范围进行限制。
[1125]
实例
[1126]
材料与方法
[1127]
菌株
[1128]
使用购自天根(tiangen)(天根生物科技有限公司(tiangen biotech co.ltd.),北京,中国)的大肠杆菌top
‑
10菌株来繁殖本文的表达载体。使用米曲霉mt3568菌株用于编码多肽的基因的异源表达,该多肽与具有磷脂酶活性的多肽具有同源性。米曲霉mt3568是米曲霉jal355的amds(乙酰胺酶)破坏的基因衍生物(wo 02/40694),其中通过用pyrg基因破坏米曲霉乙酰胺酶(amds)基因恢复pyrg营养缺陷型。
[1129]
培养基
[1130]
ypm培养基由10g酵母提取物、20g细菌用蛋白胨(bacto
‑
peptone)、20g麦芽糖、以及补足至1000ml的去离子水构成。
[1131]
lb板由10g的细菌用胰蛋白胨、5g的酵母提取物、10g的氯化钠、15g的细菌用琼脂、以及补足至1000ml的去离子水构成。
[1132]
lb培养基由1g的细菌用胰蛋白胨、5g的酵母提取物及10g的氯化钠、以及补足至1000ml的去离子水构成。
[1133]
cove蔗糖板由342g的蔗糖、20g的琼脂粉、20ml的cove盐溶液、以及补足至1升的去离子水构成。将培养基在15psi下通过高压灭菌进行灭菌15分钟。将该培养基冷却至60℃并且添加10mm乙酰胺、15mm cscl、triton x
‑
100(50μl/500ml)。
[1134]
用于分离的cove
‑
2板/管:30g/l蔗糖、20ml/l cove盐溶液、10mm乙酰胺、30g/l诺
布尔(noble)琼脂(difco,目录号214220)。
[1135]
cove盐溶液由以下构成:26g的mgso4·
7h2o、26g的kcl、26g的kh2po4、50ml的cove痕量金属溶液、以及补足至1000ml的去离子水。
[1136]
cove痕量金属溶液由以下构成:0.04g的na2b4o7·
10h2o、0.4g的cuso4·
5h2o、1.2g的feso4·
7h2o、0.7g的mnso4·
h2o、0.8g的na2moo4·
2h2o、10g的znso4·
7h2o、以及补足至1000ml的去离子水。
[1137]
以pnag提取物(来自木糖葡萄球菌(staphylococcus xylosus)的外部聚合物)作为碳源、氮源和能源的基本培养基(cn
‑
ag培养基)由以下构成:硫酸镁(mgso4)0.2g、氯化钙(cacl2)0.02g、磷酸二氢钾(kh2po4)1.0g、磷酸氢二钾(k2hpo4)1.0g、氯化铁(fecl3)0.05g、补足至1000ml的水、以及pnag提取物。
[1138]
测定
[1139]
dna酶活性的测试
[1140]
测定原理:实验装置基于通过阴离子交换色谱法分离脱氧核糖核酸(dna)片段。dna与柱的结合是由分子骨架中的磷酸基团引起的,并且片段的分离是通过使用线性盐梯度的洗脱步骤诱导的。因此,预期洗脱顺序大致遵循dna片段的大小,由于磷酸基团含量最高,最大的分子最后在盐梯度中被洗脱。通过在260nm处的吸收监测阴离子交换柱的洗脱顺序。双链和单链dna均在此波长下吸收。然而,由于增色效应,单链dna将显示出更强的吸收特性。
[1141]
测定执行:用于测量dna酶活性的合适的底物是来自鲑鱼睾丸的脱氧核糖核酸钠盐(d1626西格玛公司(sigma))。将其以1mg/ml的浓度溶解于20mm tris(ph 8.5)缓冲液中。优选地在使用前一天制备底物溶液,并在5℃下放置过夜。这样可确保溶液均匀,使用移液器易于操作和抽吸该均匀的溶液。使用2mm mgcl2+0.01%triton x
‑
100将待测试活性的候选酶稀释至适当浓度,并与底物溶液1:1混合。然后将样品在30℃下在热混合器上振荡(500rpm)孵育,并且通过添加200mm edta(ph≈8)来终止反应混合物,其中反应混合物与edta的比率为9:1。使用阴离子交换色谱法(例如,东曹生命科学公司(tosoh bioscience)的dna
‑
stat hplc柱(10x 4.6,5μm,零件号0021962))分析所得的dna降解曲线。将10μl的样品注射到用20mm tris ph 8.5(缓冲液a)平衡的柱上。使用0.5ml/min的流速以线性梯度分离dna片段分离(缓冲液b:缓冲液a+1m nacl):在15分钟内0
‑
60%b;在20分钟内60%
‑
100%b;100%b持续5分钟;以及最后,0%b持续5分钟。使用配备有二极管阵列检测器的agilent 1100系列分析型hplc在260nm处监测dna片段的分离。装置中包括dna、edta和空白样品。
[1142]
如下所示,这些多肽显示出dna酶活性。
[1143]
成熟蛋白seq id no:核酸酶家族来源15s1
‑
p1玉蜀黍狭壳柱孢27s1
‑
p1塔形栾背芽突霉9s1
‑
p1里氏木霉3s1
‑
p1钩状木霉6s1
‑
p1宽肋羊肚菌
72s1
‑
p1嗜碱枝顶孢
[1144]
实例1:本发明的细菌s1
‑
p1或en_ns核酸酶的克隆、表达和发酵
[1145]
对从表1中列出的单个细菌菌株的纯培养物的染色体dna和从在含有pnag提取物的基本培养基(参见培养基)(在ph 7.5和30℃下)上选择的自来水源宏基因组富集物中提取的dna进行纯化,并使用lllumina测序技术对其进行全基因组测序。在这些基因组的组装中鉴定了编码s1
‑
p1或en_ns核酸酶seq id no:30、33、36、39、42、45、78和81的编码序列seq id no:28、31、34、37、40、43、76和79。
[1146]
表1
[1147][1148]
*基因核苷酸序列
[1149]
将具有dna seq id no’:28、31、34、37、40和43的s1
‑
p1核酸酶基因和具有dna seq id no’:76和79的en_ns核酸酶基因进行克隆并在枯草芽孢杆菌中转化且表达为分泌酶。对于每个基因,将编码天然分泌信号肽的序列替代为编码克劳氏芽孢杆菌分泌信号的序列(具有以下氨基酸序列:seq id no:105:mkkplgkivastallisvafsssiasa)。此外,该基因包括融合在编码核酸酶的羧基末端氨基酸残基上的6xhis标签的编码序列,该6xhis标签用于纯化。
[1150]
出于异源表达的目的,将用于表达具有seq id no:30、33、36、39、42、45、78和81的每个多肽的所有s1
‑
p1核酸酶和en_ns核酸酶基因构建体制备为线性整合构建体,其中这些基因通过pcr在两个枯草芽孢杆菌同源染色体区域之间与强启动子和氯霉素抗性标记进行融合。通过soe pcr进行融合(horton,r.m.,hunt,h.d.,ho,s.n.,pullen,j.k.和pease,l.r.(1989)engineering hybrid genes without the use of restriction enzymes,gene splicing by overlap extension gene[不使用限制酶,使用重叠延伸剪接术工程化杂合基因]gene[基因]77:61
‑
68)。专利申请wo 2003095658中也描述了soe pcr方法。在三联启动子系统(如wo 99/43835中所描述)的控制下表达这些基因,该启动子系统由包含稳定化序列的地衣芽孢杆菌α
‑
淀粉酶基因(amyl)的启动子、解淀粉芽孢杆菌α
‑
淀粉酶基因(amyq)的启动子和苏云金芽孢杆菌cryiiia启动子组成。将线性pcr构建体转化到枯草芽孢杆菌中。在每ml补充有6μg氯霉素的lb板上选择转化体。
[1151]
在30℃下在250rpm振荡下,将包含编码seq id no:30、33、36、39、42、45、78和81之一的s1
‑
p1核酸酶的整合表达构建体的重组枯草芽孢杆菌克隆在3l烧瓶中培养3天,该烧瓶含有500ml基于酵母提取物的培养基。将每种培养液以20,000x g离心20分钟,并且将上清液小心地与丸粒化材料倾析分开。使用过滤器过滤每种上清液,并如下所述从过滤的上清液中纯化en_ns核酸酶。
[1152]
将来自每种发酵液的过滤的上清液的ph调节至ph 7.5
‑
8.0,将样品搅拌30分钟并通过0.2μm膜过滤,并且将滤液施加至5ml histrap
tm
excel柱上。在加载样品之前,这些柱在5个柱体积(cv)的50mm tris ph 8.0中平衡。为了去除未结合的材料,将这些柱用5cv的50mm hepes ph 7.0洗涤,并且用50mm hepes ph 7.0+0.75m咪唑对结合表达的蛋白质进行洗脱。将洗脱的蛋白质在约50ml的hiprep
tm
26/10脱盐柱上进行脱盐,将该脱盐柱使用3cv的50mm hepes ph 7.0+100mm nacl进行平衡。该缓冲液也用于将表达的蛋白质从环转移至脱盐柱。根据峰分级洗脱表达的蛋白质,以在一个管中获得样品。流速为10ml/min。通过在280nm处的最大吸光度获得蛋白质浓度的估算值,并通过sds
‑
page分析评估样品的纯度。
[1153]
实例2:本发明的真菌s1
‑
p1核酸酶的克隆、表达和发酵
[1154]
从多种真菌菌株中克隆了十一个编码核酸酶的基因,这些核酸酶属于pfam定义的蛋白家族(命名为“s1
‑
p1_核酸酶”并且具有参考编号pf02265(r.d.finn等人,nucleic acids research[核酸研究](2016),d44:d279
‑
d285)),这些真菌菌株从环境样品中分离或获得自如下表2和3中所描述的培养物收集物。
[1155]
表2
[1156]
菌株来源dna seq id no:*成熟蛋白seq id no宽肋羊肚菌日本46奶灰青霉日本1012塔形栾背芽突霉英国2527
[1157]
*基因核苷酸序列
[1158]
表3
[1159][1160]
*基因核苷酸序列
[1161]
对于大多数菌株,通过本领域技术人员已知的标准方法分离染色体dna,并将其用于全基因组测序。用idba或spades基因组组装软件组装全基因组序列(peng,y.等人
bioinformatics[生物信息学].(2012),28:1420
‑
1428和bankevich,a.等人j comput biol[计算生物学杂志].(2012)19(5):455
‑
77),并用genemark 2.3c基因预测软件在基因组上注释基因(ter
‑
hovhannisyan v.等人genome res[基因组研究].(2008)18(12):1979
‑
90.)。对于里氏木霉,从ncbi基因组数据库(国家生物技术信息中心(national center for biotechnology information),https://www.ncbi.nlm.nih.gov/)下载了登录号为prjna207855的rut
‑
c30的组装基因组序列,并用genemark 2.3c进行注释。还从rut
‑
c30中分离了染色体dna,以便能够进行后续克隆。
[1162]
针对与pf 02265结构域的相似性,检索从全基因组序列上注释的基因预测的蛋白质序列集。上表2和表3中列出了在该检索中鉴定出的十一种蛋白质,以及它们各自的核苷酸和肽序列的seq id no。使用基因特异性引物(其也在起始密码子的5’附近附加kozak翻译起始序列“tcacc”),通过pcr扩增从基因组dna克隆编码这些肽的基因。将扩增的dna片段克隆到已经用bamhi和xhoi消化的曲霉属表达载体pmstr57(wo 04/032648)中。
[1163]
对克隆的编码核酸酶的基因进行测序并确认其与基因组序列中发现的相应基因相同,并通过christensen等人,1988,biotechnology[生物技术]6,1419
‑
1422和wo 04/032648中描述的方法转化到米曲霉菌株(wo11/057140)中。基于由表达载体中的选择性标记赋予的能力,在从原生质体再生期间选择转化体,以利用乙酰胺作为氮源,并且随后在选择下将这些转化体再分离两次。
[1164]
通过在96孔深孔微量滴定板中在30℃在0.25ml的ypg培养基(wo05/066338)中或dap
‑
4c
‑
1培养基(wo 12/103350)中将转化体培养4天并通过sds
‑
page监测重组表达来评估重组核酸酶的产生。
[1165]
为了大规模产生重组s1
‑
p1核酸酶,针对每个基于重组产率的核酸酶选择单个曲霉属转化体,并将大部分转化体在含有150ml的dap
‑
4c
‑
1培养基的500ml带挡板烧瓶中进行培养。将培养物在旋转台上在30℃的温度以150rpm振荡4天。将从具有seq id no:69的深红虫草中产生s1
‑
p1核酸酶的重组转化体改为在26℃培养,并将从奥斯特罗帕芭芭拉中产生s1
‑
p1核酸酶的转化体在26℃下在dap
‑
2c
‑
1培养基(wo 04/032648)中培养。将培养液通过穿过0.22um过滤单元与细胞材料分离。
[1166]
如下进行重组表达的s1
‑
p1核酸酶的色谱纯化,这些s1
‑
p1核酸酶源自宽肋羊肚菌、奶灰青霉、塔形栾背芽突霉、里氏木霉、玉蜀黍狭壳柱孢、深红虫草、膝曲瓶霉和奥斯特罗帕芭芭拉:
[1167]
将来源于各自分离的培养液的每个过滤样品的ph调节至约ph 7.5,并添加1.8m硫酸铵(ams)。将这些样品施加至explorer上的5ml hitrap
tm
phenyl(hs)柱上。在加载之前,该柱已在5个柱体积(cv)的50mm hepes+1.8m ams(ph 7)中平衡。为了去除未结合的材料,将该柱用5cv的50mm hepes+1.8m ams(ph 7)进行洗涤。使用50mm hepes+20%异丙醇ph 7将靶蛋白从柱洗脱到10ml环中。从该环中,将样品加载到已经用3cv的50mm hepes+100mm nacl ph 7.0平衡的脱盐柱(hiprep
tm
26/10脱盐)上。将靶蛋白用50mm hepes+100mm nacl ph 7.0洗脱,选择相关级分,并基于色谱图进行合并。流速为5ml/min。通过测量280nm处的吸收来估计最终样品中的蛋白质浓度。
[1168]
实例3:青霉属和木霉属来源的s1
‑
p1真菌核酸酶的克隆、表达和发酵
[1169]
核酸酶(s1
‑
p1核酸酶)来源于通过标准微生物分离技术从环境样品分离的真菌菌
株。鉴别菌株并基于它们的内部转录间隔区(its)序列对分类进行指定(参见表4)。
[1170]
表4
[1171]
菌株来源dna seq id no*成熟蛋白seq id no埃默森青霉中国5254钩状木霉中国13
[1172]
*基因核苷酸序列
[1173]
通过qiaamp dna血液迷你试剂盒(qiaamp dna blood mini kit)(凯杰公司(qiagen),希尔登,德国)分离来自各个菌株的染色体dna(表1)。使用illumina技术将5μg染色体dna发送进行全基因组测序。基因组测序,随后的读取的装配和基因发现(即基因功能的注释)对于本领域技术人员是已知的并且该服务是可商购的。分析了来自pfam数据库家族pf02265的推定的核酸酶(s1
‑
p1_核酸酶)的基因组序列。该分析鉴定了2个编码推定的核酸酶的基因,这些基因随后被克隆并在米曲霉中重组表达。这2个基因通过pcr从上述分离的真菌基因组dna中扩增。根据制造商的说明书,通过与in
‑
fusion
tm
cf脱水克隆试剂盒(克隆技术实验室有限公司(clontech laboratories,inc.),山景城(mountain view),加利福尼亚州,美国)连接,将这种纯化的pcr产物克隆到之前消化的表达载体中。使用连接混合物转化大肠杆菌top10化学感受态细胞。选择含有seq id no:52和1的正确菌落并通过dna测序验证(由中国北京的诺赛基因有限公司(sinogenomax company limited)进行)。将包含seq id no:52和1的菌落在3ml的、每ml补充有100μg的氨苄青霉素的lb培养基中培养过夜。根据制造商的说明,使用凯杰公司旋转迷你制备型(spin miniprep)试剂盒(目录27106)(凯杰股份有限公司(qiagen gmbh),希尔登,德国)纯化质粒dna。米曲霉的原生质体是根据wo 95/002043制备的。将100μl的原生质体与2.5
‑
10μg的包含seq id no:52和1的每个曲霉属表达载体和250μl的60%peg 4000、10mm cacl2、和10mm tris
‑
hcl(ph 7.5)分别混合,并且轻轻混合。将混合物在37℃孵育30分钟并且将这些原生质体涂布到cove蔗糖板上用于选择。在37℃孵育4
‑
7天后,将4个转化体的孢子接种到3ml的ypm培养基中。
[1174]
在30℃培养3天后,使用4%
‑
20%tris
‑
甘氨酸凝胶(英杰公司(invitrogen corporation),卡尔斯巴德,加利福尼亚州,美国)通过sds
‑
page分析培养液,以鉴定产生最大量的重组核酸酶的转化体。
[1175]
将最好的转化体的孢子涂布于用于再分离的cove
‑
2板上,以便分离单个菌落。然后将单个菌落涂布于cove
‑
2管上直到孢子形成。
[1176]
在80rpm搅拌下在30℃温度下,将来自最好表达的转化体的孢子在摇瓶的2400ml的ypm培养基中培养3天。使用0.2μm过滤装置通过过滤收获培养液。过滤的发酵液用于酶表征。
[1177]
实例4:曲霉属来源的s1
‑
p1真菌核酸酶的克隆、表达和发酵
[1178]
如下克隆了编码s1
‑
p1核酸酶的野生型基因(米曲霉)(表5):
[1179]
表5
[1180]
菌株dna seq id no*成熟蛋白seq id no米曲霉4648
[1181]
*基因核苷酸序列
[1182]
使用引物5
’‑
gacgcggccgcaccatgccgcgcttactccc[seq id no:100]和5
’‑
gacgcgatcgctcaagagggctgactcg[seq id no:101],从来源于米曲霉菌株(ifo4177)的dna扩增野生型s1
‑
p1_核酸酶基因,这些引物分别具有识别限制性核酸内切酶位点noti和sgfi的突出端。将扩增的dna(988个碱基对长)用限制性核酸内切酶noti和sgfi消化,并且将所得的977个碱基对产物克隆到曲霉属表达载体pcols1202的相应限制性位点中(描述于专利wo 15025055实例2中)。如所描述的,将所得的载体(命名为pjal1349)转化到米曲霉菌株rung237中并表达。
[1183]
实例5:本发明的en_ns真菌核酸酶的克隆、表达和发酵
[1184]
从雷塞氏篮状菌的菌株cbs398.68中克隆了编码核酸酶的基因,该核酸酶属于pfam定义的蛋白家族(命名为“核酸内切酶_ns”并且具有参考编号pf01223(r.d.finn等人,nucleic acids research[核酸研究](2016),d44:d279
‑
d285)),该菌株最初在英国分离并获得自cbs
‑
knaw(真菌生物多样性中心(fungal biodiversity centre),乌得勒支(utrecht),荷兰)。
[1185]
从雷塞氏篮状菌菌株中分离染色体dna,并通过本领域技术人员已知的标准方法对该菌株的全基因组进行测序和组装。用genemark 2.3c基因预测软件在组装的基因组序列上注释基因(ter
‑
hovhannisyan v.等人genome res[基因组研究].(2008)18(12):1979
‑
90.)。
[1186]
针对与pf01223结构域的相似性,基于在整个基因组序列上的基因注释检索预测的蛋白质序列(指定为seq id no:99)。使用基因特异性引物(其也在起始密码子的5’附近附加kozak翻译起始序列“tcacc”),通过pcr扩增从基因组dna克隆编码该蛋白质的基因。将扩增的dna片段克隆到已经用bamhi和xhoi消化的曲霉属表达载体pmstr57(wo 04/032648)中。
[1187]
对克隆的编码核酸酶的基因进行测序并确认其与基因组序列中发现的相应基因相同,然后通过christensen等人,1988,biotechnology[生物技术]6,1419
‑
1422和wo 04/032648中描述的方法转化到米曲霉菌株(wo11/057140)中。基于由表达载体中的选择性标记赋予的能力,在从原生质体再生期间选择转化体,以利用乙酰胺作为氮源,并且随后在选择下将这些转化体再分离两次。
[1188]
通过在96孔深孔微量滴定板中在30℃在0.25ml的dap
‑
4c
‑
1培养基(wo 12/103350)中将转化体培养5天并通过sds
‑
page监测重组表达来评估来自雷塞氏篮状菌的重组核酸内切酶_ns核酸酶的产生。
[1189]
实例6:进化枝和系统发育树的构建
[1190]
s1_p1_核酸酶系统发育树
[1191]
如pfam(pf02265,pfam版本31.0,finn(2016).nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285)中所定义的,从含有s1
‑
p1_核酸酶结构域的本发明的多肽序列构建系统发育树。系统发育树是从含有至少一个s1
‑
p1_核酸酶结构域的成熟多肽序列的多重比对构建。使用muscle算法版本3.8.31(edgar,2004.nucleic acids research[核酸研究]32(5):1792
‑
1797)对序列进行比对,并且使用fasttree版本2.1.8(price等人,2010,plos one[公共科学图书馆
·
综合]5(3))构建树并使用itol(letunic和bork,2007.bioinformatics[生物信息学]23(1):127
‑
128)对树进行可视化。
[1192]
含有s1
‑
p1_核酸酶结构域的多肽包含几个保守基序。一个实例是[hq][filvy]x[gaqs]dx[htgsa][qvm]p[lfm]h(seq id no:102),其位于与钩状木霉(seq id no:3)中的位置116至126对应的位置,其中在位置116的h和在位置120的d涉及金属离子结合,并且在位置127的h涉及底物结合。
[1193]
包含在s1_p1_核酸酶结构域多肽中的另一个基序是g[ga]nx[vilfy]x[vlm](seq id no:103),其位于seq id no:3中的位置133至139,其中在位置133的g涉及核苷结合。
[1194]
可以将包含s1
‑
p1_核酸酶结构域的多肽进一步分成多个不同的子簇或进化枝,其中我们定义了下面列出的进化枝。
[1195]
plhvg进化枝
[1196]
可以将含有s1
‑
p1_核酸酶结构域的多肽分成不同的子簇,其中子簇由一个或多个短序列基序定义,以及通过含有如pfam(pf02265,pfam版本31.0finn(2016).nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285)中定义的s1
‑
p1_核酸酶结构域定义。
[1197]
我们将包含基序p[lm]h[va][ga](seq id no:112)的一个子簇表示为plhvg进化枝。其位于产酶溶杆菌中的位置124至128(seq id no:33)。含有s1
‑
p1_核酸酶结构域以及此基序的所有细菌来源的多肽序列将被表示为属于plhvg进化枝。
[1198]
plhvg进化枝的多肽的实例包括具有seq id no:30、seq id no:33、seq id no:36、seq id no:39、seq id no:42和seq id no:45的那些。
[1199]
plhde进化枝
[1200]
从含有s1
‑
p1_核酸酶结构域的多肽定义另一个子簇。我们将包含基序plh[dn]e(seq id no:113)的另一个子簇表示为plhde进化枝。其位于钩状木霉中的位置124至128(seq id no:3),其中在位置126的h在进化枝中是完全保守的,并且涉及核苷结合。含有s1
‑
p1_核酸酶结构域以及此基序的所有真菌来源的多肽序列将被表示为属于plhde进化枝。
[1201]
plhde进化枝的多肽的实例包括具有seq id no:3、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:21、seq id no:48、seq id no:51、seq id no:54、seq id no:60、seq id no:66、seq id no:69、seq id no:72和seq id no:75的那些。
[1202]
核酸内切酶_ns系统发育树
[1203]
如pfam(pf01223,pfam版本31.0,finn(2016).nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285)中所定义的,从含有核酸内切酶_ns结构域的本发明的多肽序列构建系统发育树。系统发育树是从含有至少一个核酸内切酶_ns结构域的成熟多肽序列的多重比对构建。使用muscle算法版本3.8.31(edgar,2004.nucleic acids research[核酸研究]32(5):1792
‑
1797)对序列进行比对,并且使用fasttree版本2.1.8(price等人,2010,plos one[公共科学图书馆
·
综合]5(3))构建树并使用itol(letunic和bork,2007.bioinformatics[生物信息学]23(1):127
‑
128)对树进行可视化。
[1204]
含有核酸内切酶_ns结构域的多肽包含几个保守基序。一个实例是[yv][dn]rgh(seq id no:114),其位于与帚青霉(seq id no:87)中的位置123至127对应的位置,其中在位置127的组氨酸在进化枝中是完全保守的,并且推定涉及底物结合。
[1205]
另一个实例是[sadn]r[gs]h(seq id no:104),其位于与脱支芽孢杆菌(seq id no:81)中的位置154至157对应的位置。
[1206]
可以将包含核酸内切酶_ns结构域的多肽进一步分成多个不同的子簇或进化枝,其中我们定义了下面列出的进化枝。
[1207]
ydrgh进化枝
[1208]
可以将含有核酸内切酶_ns结构域的多肽分成不同的子簇,其中子簇由一个或多个短序列基序定义,以及通过含有如pfam(pf01223,pfam版本31.0finn(2016).nucleic acids research[核酸研究],database issue[数据库卷]44:d279
‑
d285)中定义的核酸内切酶_ns结构域定义。
[1209]
我们将包含基序ydrghq[av](seq id no:115)的一个子簇表示为ydrgh进化枝。其位于帚青霉(seq id no:87)中的位置123至129。含有核酸内切酶_ns结构域以及上述基序的所有真菌来源的多肽序列将被表示为属于ydrgh进化枝。
[1210]
ydrgh进化枝的多肽的实例包括具有seq id no:87、seq id no:93、seq id no:96和seq id no:102的那些。
[1211]
drhgl进化枝
[1212]
从含有核酸内切酶_ns结构域的多肽定义另一个子簇。我们将包含基序[dna]r[gsc]h[li](seq id no:116)的子簇表示为drhgl进化枝。其位于卷须链霉菌(seq id no:90)中的位置129至133。含有核酸内切酶_ns结构域以及基序[dna]r[gsc]h[li](seq id no:116)的所有细菌来源的多肽序列将被表示为属于drhgl进化枝。
[1213]
可以在drhgl进化枝的成员中鉴定的另一个基序是[rienlg][yf][rhn]v(seq id no:117),其位于与卷须链霉菌(seq id no:90)中的位置191至194对应的位置。
[1214]
drhgl进化枝的多肽的实例包括具有seq id no:90、seq id no:81、seq id no:84、seq id no:108和seq id no:111的那些。
[1215]
实例7:多肽的dna酶活性
[1216]
检查下面列出的克隆的和表达的多肽的dna酶活性。使用荧光淬灭的寡核苷酸探针通过荧光确定dna酶活性(相对荧光单位,rfu)。该探针在核酸酶降解后发出信号(dnasealert
tm
试剂盒,整合dna技术有限公司(integrated dna technologies,inc.),科拉尔维尔,爱荷华州,美国)。
[1217]
简言之,将dna酶在milli
‑
q水中的0.01%triton溶液中稀释至0.6ppm,并在ph 2、3、4、5、6、7、8、9、10和11下用ph通用缓冲液(100mm乙酸、100mm mes、100mm hepes、100mm甘氨酸、2mm cacl2、2mm mgcl2)进一步1:1稀释。通过将25μl的dnasealert
tm
底物添加到100μl的0.3ppm dna酶样品中开始反应。在22℃使用synergy h1酶标仪(美国伯腾仪器有限公司(biotek))(在536nm处激发,在590nm处发射)测量动力学曲线15min。
[1218]
下表6示出了2min后通过荧光确定的dna酶活性的最适ph(以近似最适ph给出,四舍五入至最接近的整数ph值)。在给定的ph值下,含有dnasealert
tm
荧光淬灭的寡核苷酸底物且不含酶的对照中的背景可以忽略不计。
[1219]
表6
[1220]
seq id no.供体生物最适ph15玉蜀黍狭壳柱孢621深红虫草557奥斯特罗帕芭芭拉5
27塔形栾背芽突霉59里氏木霉424膝曲瓶霉518玉蜀黍狭壳柱孢412奶灰青霉4
[1221]
实例8:多肽的dna酶活性
[1222]
检查下面列出的克隆的和表达的多肽的dna酶活性。使用荧光淬灭的寡核苷酸探针通过荧光确定dna酶活性(相对荧光单位,rfu)。该探针在核酸酶降解后发出信号(dnasealert
tm
试剂盒,整合dna技术有限公司,科拉尔维尔,爱荷华州,美国)。
[1223]
简言之,将dna酶在2mm mes ph 6.5+0.0025%brij l23中稀释至大约0.2
‑
2ppm。在ph 4、5、6、7、8或9下将ph通用缓冲液(80mm乙酸、80mm mes、80mm hepes、80mm tris、10mm mgcl2、0.0050%brij l23)与dnasealert
tm
底物溶液(1小瓶溶解于15ml milli
‑
q水中)以5:3的比率混合。通过将20μl的dna酶样品添加到80μl底物/缓冲液混合物中开始反应。在室温使用flash平板读数仪(赛默科技公司(thermoscientific))(在535nm处激发,在556nm处发射)测量动力学曲线15min。
[1224]
下表7示出了dna酶活性的最适ph(以近似最适ph给出,四舍五入至最接近的整数ph值)。在给定的ph值下,含有dnasealert
tm
荧光淬灭的寡核苷酸底物且不含酶的对照中的背景可以忽略不计。
[1225]
表7
[1226]
seq id no.供体生物来源最适ph108芽孢杆菌属物种丹麦7111婴儿链球菌瑞典7
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1