改进的重组凝集素蛋白制备方法与流程
该申请对于2018年9月7日提交的第201821008382号印度临时专利申请和于2019年1月14日提交的第201921001559号印度临时专利申请的权益进行了声明,其全部内容通过引用包含在本文中。
【技术领域】
本发明是关于一种重组凝集素蛋白以及一种重组凝集素蛋白制备方法,特别是一种粗重组凝集素蛋白纯化方法。
背景技术:
凝集素属于碳水化合物结合蛋白,是对其他分子的糖基具有高度特异性的高分子。凝集素在细胞和分子水平上进行识别,并在涉及细胞、碳水化合物和蛋白质的生物识别现象中发挥许多不同的作用。凝集素为二价或多价碳水化合物结合蛋白,能够结合和沉淀糖蛋白并凝集红细胞。在动物体内发现的凝集素通常有助于细胞相互作用,而植物凝集素则能够抵御潜在捕食者或病原体。一些凝集素可以检测与肿瘤相关的聚糖,因此有可能作为恶性肿瘤的生物标志物,并可能有助于研究癌细胞系中糖基化基序的变化。纯化后的凝集素在临床环境中很重要,因为它们可用于血型鉴定。有些存在于人类红细胞上的糖脂和糖蛋白可采用凝集素进行识别。许多凝集素可用作指示恶性生长早期检测的生物标志物或用作自噬诱导剂,而其他凝集素还表现出通过细胞凋亡抑制癌细胞生长的能力。由于细胞增殖不受调节,有些碳水化合物部分在癌细胞上以抗原的形式表达。凝集素在癌症治疗中用作药物载体,因为它们能够与恶性肿瘤特异性结合。此外,由于凝集素还能够调节癌症相关通路,因此它们有可能用作癌症诊断和治疗药物。
凝集素能够与多种抗原结合,抗原已在癌细胞表面进行表征;大多数抗原都是针对特定类型的癌症,凝集素与这些抗原的结合可以通过诱导癌细胞凋亡而抑制癌细胞生长。目前,大多数市场上可买到的凝集素来自植物和其他真核生物。
齐整小核菌凝集素(srl)是从土生植物病原真菌齐整小核菌的菌核体中分离出来的凝集素。srl对thomsen-friedenreich(tf)抗原和tn抗原具有特异性。tf抗原是一种二糖(galβ1→3galnac-α-ser/thr),在各种不同人类癌细胞的细胞表面上过表达。tn抗原是一种单糖(galnac-α-)。由于对tf和tn抗原的特异性,srl已经证明能够与人类结肠癌、卵巢癌和白血病细胞结合。srl的晶体结构已经确定(leonidas等人,《分子生物学杂志》,2007年5月11日;368(4):1145-61)。
虽然凝集素作为抗癌工具有许多优势,但它们仍然有许多局限性,如缺乏选择性、质量和性能不一致以及不易规模化生产。此外,经常报道植物凝集素可与一系列不同的聚糖结构结合,因此缺乏许多应用所需的选择性。而且,在使用植物凝集素时,逐批质量差异也很常见。产品的质量取决于植物材料的分离方法,以及起始植物材料本身的质量。
从天然来源中分离凝集素是不可靠的,因为这样获得的凝集素与期望的性质不一致。进一步从天然来源中分离蛋白质的过程费用高且难度大。分离自然产生的凝集素所用的技术产量一般非常低,特别是在蛋白质浓度低时。这些技术有时还不能区分同一种凝集素的异构体。因此,所得的产物为混合物,有很大的不确定性。从这个意义上来说,通过重组dna技术生产重组凝集素的优点是可提供单纯蛋白质,在极短的时间内具有更高且一致的产量,表征准确,同时易于规模化生产。利用rdna技术,可以将产生相关蛋白质的基因转移到合适的宿主体内。这样,与传统方法相比,蛋白质的生产和分离需要的时间和精力更少。
wo2010/095143公开了重组凝集素变体rec-2和rec-3,其分别通过替换3个或5个氨基酸而从天然srl序列中获得。这些变体的晶体结构均有报道(peppa等人,《分子杂志》,2015年6月12日;20(6):10848-65)。
wo2014/203261公开了通过替换12个氨基酸而从天然srl序列中获得的重组凝集素变体。
印度专利申请350/mum/2009(pct申请wo2010/095143)首次公开了从来源于齐整小核菌的seqidno.2(在350/mum/2009中被命名为seqid1)天然氨基酸序列中获得的seqidno.1氨基酸序列(在350/mum/2009中被命名为seqid2)。wo2010/095143描述了重组凝集素在大肠杆菌细胞中的实验室规模生产,其中重组凝集素的基因编码被克隆到表达载体中。然而,所述方法存在某些缺点,包括难以控制溶解氧量和ph等培养参数以及缺乏对蛋白质表达的控制。此外,培养物产生的细胞数量少,因此导致纯化后的蛋白的总产量低。此外,所述方法无法实现工业上的规模化生产。
具有seqidno.1氨基酸序列的凝集素与来源于齐整小核菌的天然凝集素相比具有高稳定性和高溶解性,并表现出了癌细胞结合特性。凝集素在研究、医学和生化技术中有多种用途。例如,具有seqidno.1氨基酸序列的凝集素拥有很高的药用潜力。因此,需要设计出一种产量更高、成本效益更高、更易于规模化和/或效率更高的重组凝集素生产方法。
本发明已在其设计时考虑到了这些问题。
技术实现要素:
本发明的主要目的是克服现有技术参考文献的缺点,并设计出一种高效制备seqidno.1氨基酸序列的方法。
本发明的另一个目的是提供一种产量高、成本效益高且可使用容易获得的原料进行生产的方法。
本发明还有一个目的是提供一种易于规模化制备seqidno.1氨基酸序列的方法。
本发明还有一个目的是提供一种生产高纯度seqidno.1氨基酸序列的方法。
本发明的一个方面提供了一种制备重组凝集素蛋白的方法,所述方法包括在培养的宿主细胞中表达由重组凝集素基因编码的重组凝集素蛋白,其中表达在使细胞倍增时间不超过160分钟的条件下进行。在一些实施例中,表达在使细胞倍增时间至少为100分钟的条件下进行。
在一个实施例中,所述方法包括在不超过22℃的温度下,在培养的宿主细胞中表达由重组凝集素基因编码的重组凝集素蛋白。在另一个实施例中,表达在至少15℃且不超过22℃的温度下进行。
在一些实施例中,用于表达重组凝集素的宿主细胞为大肠杆菌。在一些实施例中,重组凝集素蛋白选自seqidno.1、seqidno.3、seqidno.4或与其中任何一种序列具有至少60%、70%、80%、90%、95%、97%、98%或99%的同源性的氨基酸序列。
在一些实施例中,宿主细胞培养物的体积至少为10l。
在一些实施例中,所述方法包括培养宿主细胞,其中所述培养包括:在蛋白表达之前使宿主细胞生长的生长期,以及进行蛋白表达的表达期。在另一些实施例中,生长期的温度高于表达期的温度。在另一些实施例中,从生长期到表达期所经历的温度下降时间至少为4小时且不超过7小时。
在一些实施例中,表达期通过添加浓度至少为0.1mm且不超过0.7mm的诱导剂进行诱导。在其他实施例中,所述诱导剂以不超过0.5mm的浓度添加到培养物中。在其他一些实施例中,表达期在培养物光密度至少为25且不超过40的情况下通过添加诱导剂进行诱导。
在一些实施例中,所述方法包括在培养物光密度至少为25且不超过40时通过添加诱导剂诱导的表达期,其中添加的诱导剂的浓度至少为0.1mm且不超过0.7mm。
本发明的另一方面提供了一种培养宿主细胞的方法,其中表达期通过添加浓度至少为0.1mm且不超过0.7mm的诱导剂进行诱导,并且其中表达在使细胞倍增时间不超过160分钟的条件下进行。在一些实施例中,所述诱导剂以不超过0.5mm的浓度添加到培养物中。
本发明的另一方面提供了一种培养宿主细胞的方法,其中表达期在培养物光密度至少为25且不超过40的情况下通过添加诱导剂进行诱导,并且其中表达在使细胞倍增时间不超过160分钟的条件下进行。
在一些实施例中,重组凝集素蛋白选自seqidno.1、seqidno.3、seqidno.4或与其中任何一种序列具有至少60%、70%、80%、90%、95%、97%、98%或99%的同源性的氨基酸序列。
在某些实施例中,光密度用于度量培养的宿主细胞群,并且在600nm下进行测量。
在一些实施例中,诱导剂为iptg。
本发明还提供了一种制备重组凝集素蛋白的方法,所述方法包括在培养的宿主细胞中表达由重组凝集素基因编码的重组凝集素蛋白,其中表达在使细胞倍增时间不超过160分钟的条件下进行,并且其中宿主细胞的体积至少为10l。
本发明的另一方面提供了一种制备重组凝集素的方法,其中所述方法包括:
a)可选的,将重组凝集素基因克隆到表达载体中并将所述表达载体插入宿主细胞中;
b)在合适的培养基中培养所述宿主细胞,其中所述培养包括在25℃到40℃的温度下进行的生长期和表达由重组凝集素基因编码的重组凝集素蛋白的表达期,其中所述生长期的温度为15℃到30℃并且所述表达期内维持的碳氮比为3∶1到6∶1;
c)可选的,分离(b)中表达的所述重组凝集素蛋白以获得粗重组凝集素蛋白;以及
d)可选的,纯化所述粗重组凝集素蛋白以获得重组凝集素蛋白分离物。
在一个实施例中,步骤(a)中的表达载体如图1所示。在另一个实施例的步骤(b)中,碳源在诱导期以至少0.5gl-1h-1且不超过2gl-1h-1的速率添加到培养物中,其中所述碳源为葡萄糖或甘油。或者在步骤(b)中,氮源在诱导期以至少0.4gl-1h-1且不超过1.5gl-1h-1的速率添加到培养物中,其中所述氮源为胰蛋白胨、蛋白胨或酵母提取物。
在另一个实施例中,步骤(c)中的粗重组凝集素蛋白分离是通过离心、然后破坏细胞表面进行的。在另一个实施例中,步骤(d)中的粗重组凝集素蛋白纯化包括至少一个色谱分离步骤。在另一个实施例中,所述至少一个色谱分离步骤包括阴离子交换色谱法和/或阳离子交换色谱法。或者,所述至少一个色谱分离步骤包括疏水作用色谱法。在另一个实施例中,步骤(d)中的粗重组凝集素蛋白纯化包括一个过滤步骤。
在一些实施例中,重组凝集素蛋白选自seqidno.1、seqidno.3、seqidno.4或与其中任何一种序列具有至少60%、70%、80%、90%、95%、97%、98%或99%的同源性的氨基酸序列。在一些实施例中,宿主细胞培养物的体积至少为10l。
本发明的另一方面提供了一种纯化粗重组凝集素蛋白的方法,其中所述方法包括:
a)使用阴离子交换色谱法对粗重组凝集素蛋白进行初步纯化,以获得第一纯化洗脱液;
b)使用疏水作用色谱法对所述第一纯化洗脱液进行选择性纯化,以获得第二纯化洗脱液;
c)使用阳离子交换色谱法对所述第二纯化洗脱液进行选择性纯化,以获得第三纯化洗脱液;
d)使用阴离子交换色谱法进一步纯化所述第二或第三纯化洗脱液,以获得第四纯化洗脱液;以及
e)通过渗滤更换所述第四纯化洗脱液的缓冲液,以获得纯化的重组凝集素蛋白分离物。
在一些实施例中,粗重组凝集素蛋白通过上述方法获得。在一些实施例中,重组凝集素蛋白选自seqidno.1、seqidno.3、seqidno.4或与其中任何一种序列具有至少60%、70%、80%、90%、95%、97%、98%或99%的同源性的氨基酸序列。
在一些实施例中,宿主细胞培养物的体积至少为10l。
本发明的另一方面提供了一种使用上述方法生产的重组凝集素蛋白。
本发明的另一方面提供了一种制备含引发剂甲硫氨酸的重组凝集素含量低于20%的重组凝集素蛋白质的方法,其中所述方法包括至少其中一项以下条件:
a)表达温度至少为15℃且不超过22℃;
b)表达(即诱导)期至少为10小时;
c)碳源添加到培养物中的速率为0.5到2gl-1h-1;
d)氮源添加到培养物中的速率为0.4到1.5gl-1h-1;
e)诱导剂浓度至少为0.1mm且不超过0.5mm;
f)使用至少一个色谱分离步骤纯化粗重组凝集素蛋白。
本发明的最后一个方面提供了一种含引发剂甲硫氨酸的重组凝集素含量低于20%的重组凝集素蛋白。也就是说,提供了一种重组凝集素蛋白混合物,其中不到20%的重组凝集素蛋白聚合物含有引发剂甲硫氨酸。在特定实施例中,凝集素蛋白聚合物在其它方面符合本发明的其它方面。本发明还提供了使用本发明的方法制备的重组凝集素蛋白。具体地说,其提供了含引发剂甲硫氨酸的重组凝集素含量低于20%的重组凝集素蛋白。
【附图说明】
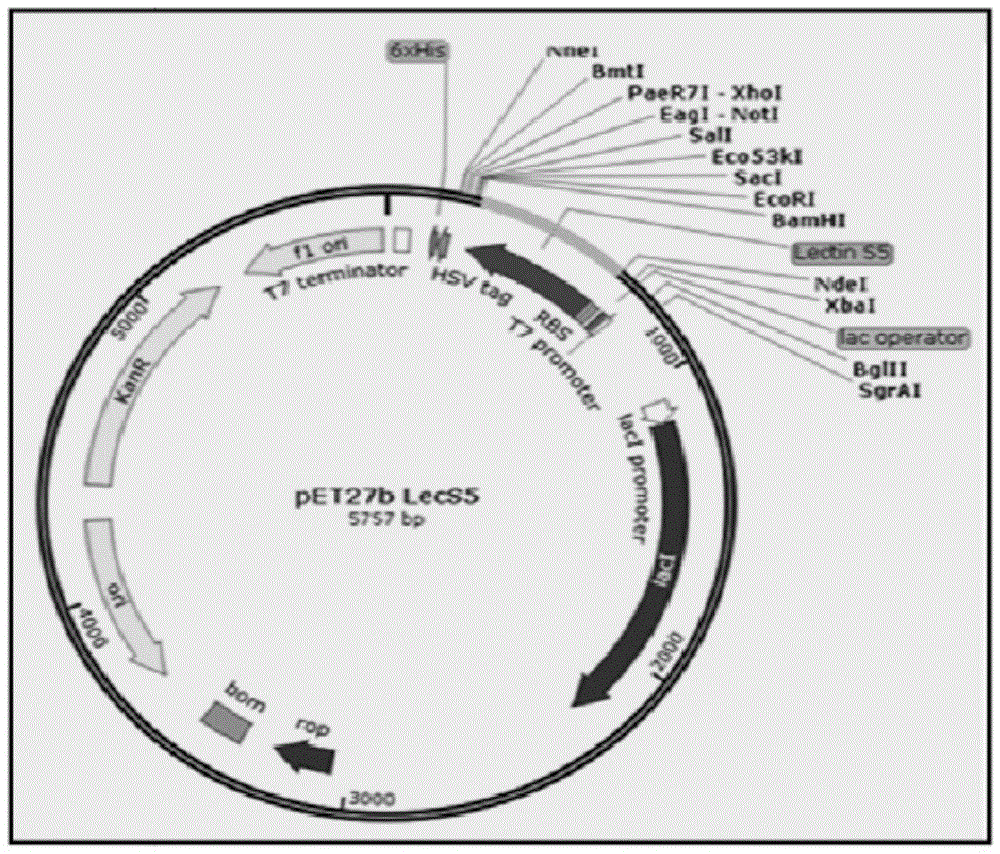
图1是含有编码seqidno.1氨基酸序列的seqidno.5核苷酸序列的pet27b载体的注解图。
图2是对含有seqidno.1氨基酸序列的纯化重组凝集素的sds-page分析。
图3是对含有seqidno.1氨基酸序列的纯化重组凝集素的蛋白印记分析。
表1是对不同发酵条件下获得的甲硫氨酸凝集素的比例分析。
表2是不同发酵条件下大肠杆菌的倍增时间。
【具体实施方式】
本文所用术语“倍增时间”系指细胞数量倍增所需的时间段,例如,一个细胞增殖为两个细胞所需的时间段,或细胞群倍增所需的时间段。本领域的技术人员可以理解的一点是,倍增时间可以用2的自然对数除以生长指数来计算。
本文所提及的“重组”产物系指基因工程产物。可以理解的一点是,基因工程是对基因的非自然操纵。因此,重组产物是非自然环境(例如宿主细胞,其中的产物在自然界中不存在)中存在或合成的产物。本文所用术语“蛋白”系指氨基酸残基聚合物。
在本发明的上下文中,“生长期”系指宿主细胞生长至所需群体密度的培养期。
本文所用术语“表达期”系指宿主细胞中表达重组凝集素的培养期。可以理解的一点是,可以通过表达期相对于生长期的表达增加来区分表达期和生长期。
本文所用术语“凝集素”系指碳水化合物结合蛋白。
本文所用术语“氨基酸”系指天然存在的和合成的氨基酸,以及具有类似于天然存在的氨基酸的功能的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是那些由遗传密码编码的氨基酸,包括蛋白氨基酸。天然存在的氨基酸也包括那些在细胞中转译后修饰的氨基酸。合成氨基酸包括非经典氨基酸,如硒代半胱氨酸和吡咯赖氨酸。通常而言,合成氨基酸并非蛋白氨基酸。
本文所用术语“同源性”或“同源”系指在给定区域或部分上至少部分一致性的两个或多个参照实体。同源或一致的区域或领域系指具有同源或相同的两个或多个参照实体的一部分。
因此,当两个序列在一个或多个序列区域上完全相同时,它们在这些区域中具有一致性。实质同源性系指在结构或功能上保守的分子,其具有或预计具有标准分子的一个或多个结构或功能(例如,生物功能或活性)的至少部分结构或功能,或与之同源的标准分子的相关/对应区域或部分。
本发明的第一个方面提供了一种制备重组凝集素蛋白的方法,所述方法包括在培养的宿主细胞中表达由重组凝集素基因编码的重组凝集素蛋白,其中表达在使细胞倍增时间不超过160分钟的条件下进行。
在一些实施例中,重组凝集素基因不是天然存在的基因。重组凝集素蛋白可能不具有天然存在的凝集素蛋白的氨基酸序列。例如,重组凝集素蛋白可能不包括seqidno.2氨基酸序列或由其组成。
在一些实施例中,表达在使细胞倍增时间至少为100分钟的条件下进行。
本发明人发现,通过在限制宿主细胞倍增时间的培养条件下表达重组凝集素蛋白,可获得更高水平的可溶性蛋白。本发明人还发现,此类表达条件导致重组凝集素中引发剂甲硫氨酸的切割增加,从而导致不含引发剂甲硫氨酸的蛋白的产量增加。通过提供一种可产生更多量的可溶性蛋白(甲硫氨酸已被从中切除)的方法,这样可以减少对蛋白进行下游加工的需要,这在很大一部分蛋白以不溶性包涵体的形式表达的情况下是必要的。这降低了所述方法的复杂性,提高了效率,并使所述方法在经济上更加可行。
本文所用术语“可溶性”系指以可溶性或至少部分可溶性形式表达的修饰凝集素蛋白。在一个实施例中,修饰凝集素蛋白的可溶性通过可表达修饰凝集素蛋白的宿主细胞的细胞裂解及随后对裂解上清液和沉淀进行的sds-page分析予以测定。裂解上清液中若存在修饰凝集素蛋白,则表明修饰凝集素蛋白可溶。裂解上清液和沉淀中若存在修饰凝集素蛋白,则表明修饰凝集素蛋白部分可溶。在一个实施例中,本文所用术语“可溶性”系指不形成包涵体的修饰凝集素蛋白。使用上述方法,沉淀中若存在修饰凝集素蛋白,则表明修饰凝集素蛋白系以包涵体的形式表达。
本文所用术语“引发剂甲硫氨酸的切割”系指从氨基酸序列中除去n端(引发剂)甲硫氨酸。在一个实施例中,引发剂甲硫氨酸的切割由甲硫氨酸胺肽酶(map)催化。在一个实施例中,引发剂甲硫氨酸的切割通过使用本领域技术人员已知的质谱分析予以测定。
本文所用术语“引发剂甲硫氨酸的切割增加”系指相对于对照组,引发剂甲硫氨酸切割程度的增加。在一个实施例中,其系指相对于对照组,引发剂甲硫氨酸切割程度增加至少5%、10%、25%或50%。在一个实施例中,对照组为seqidno.2序列的凝集素蛋白。在一些实施例中,提供了含引发剂甲硫氨酸的重组凝集素(即甲硫氨酸-凝集素)含量低于50%、40%、30%、20%或10%的重组凝集素蛋白(即凝集素蛋白聚合物的混合物)。换句话说,本发明的方法能够生产至少50%、60%、70%、80%或90%不含甲硫氨酸的重组凝集素蛋白(即不含引发剂甲硫氨酸残基的蛋白)。
可以理解的一点是,宿主细胞的倍增时间将受到许多因素的影响,例如培养温度、培养基、营养物的补料速率和宿主细胞的类型。本领域技术人员可以改变这些参数中的一个或多个,以实现所需的倍增率。
可用于控制宿主细胞倍增时间的其中一个参数是进行表达的温度。在一些实施例中,重组凝集素的表达在不超过30℃、不超过25℃、不超过22℃、不超过21℃、不超过20℃、不超过19℃或不超过18℃的温度下进行。
在一些实施例中,重组凝集素的表达在至少15℃、至少16℃或至少17℃的温度(在本文中也称为“表达温度”)下进行。在一些实施例中,表达温度为18℃。
在低于25℃(例如18℃)的温度下进行蛋白质表达已被发现是特别有利的,因为其有助于最大限度地减少包含引发剂甲硫氨酸残基的蛋白的产生量。当宿主细胞为嗜温菌(例如大肠杆菌)时,尤其如此。“在较低温度(例如约18℃)下进行表达是有益的”这一事实尤其令人惊讶,因为该温度远低于重组蛋白表达常用的宿主细胞(例如大肠杆菌)的最佳生长温度。
如本领域所知,宿主细胞培养物的温度可通过将(例如烧瓶或生物反应器中的)培养物放置在具有所需温度的环境(例如水浴或温控室)中进行控制。
在表达重组凝集素蛋白之前,宿主细胞可在培养物中生长至所需的群体密度。因此,在一些实施例中,所述方法包括培养宿主细胞,其中所述培养包括:
-在蛋白表达之前使宿主细胞生长的生长期;以及
-进行蛋白表达的表达期。
在生长期,理想情况是宿主细胞快速繁殖,以在随后的表达期最大化蛋白生产。宿主细胞在生长期的倍增时间可能低于其在生长期的倍增时间(即,细胞在生长期繁殖更快)。例如,宿主细胞在生长期的倍增时间可能不超过100分钟。可以理解的一点是,细胞在生长期的倍增时间取决于细胞是处于生长延滞期(在此期间,倍增时间相对较长)还是指数期(在此期间,倍增时间相对较短)。
在一些实施例中,生长期温度是高于表达期温度的。在一些实施例中,生长期(或者至少其中的一段时间)的温度至少为25℃、30℃或35℃。在一些实施例中,生长期(或者其中的一段时间)的温度不超过40℃或不超过38℃。
因此,可以理解的一点是,在一些实施例中,该方法包括,将培养温度从生长期温度降低至表达期温度。温度可以在几个小时内逐渐降低。例如,可以在至少2小时、至少4小时或至少6小时的时间内逐渐降低温度。在一些实施例中,温度是在不超过6或7小时的时间内逐渐降低的。
温度还可以在整个生长期内降低。例如,在生长期的第一阶段,可以为第一温度(例如30℃),而在生长期的第二阶段,温度可以降低至表达期温度(例如,从30℃降至18℃)。可以通过向培养物中添加诱导剂来促使重组凝集素蛋白开始表达。因此,表达期可以定义为宿主细胞培养物中含有诱导剂的阶段。该阶段也可以被称为“诱导期”。
如本领域中已知,诱导剂是调节基因表达的一种分子。重组凝集素基因可以由操纵序列控制。如果没有诱导剂,阻遏物和操纵序列相互结合,或者激活子的激活作用被降低,则基因表达会被抑制。如果有诱导剂,可以防止基因表达被抑制,或者可以使基因表达被激活。因此,可以通过由诱导剂调节的操纵序列来控制重组凝集素基因,使重组凝集素蛋白的表达得到严格控制,从而避免“泄漏”表达。众所周知的可诱导性表达系统实例包括阿拉伯糖操纵子和乳糖操纵子。在乳糖操纵子中,阻遏物与乳糖操纵基因的结合可阻止下游基因的转录。可以通过使用异乳糖或其模拟iptg(异丙基β-d-1-硫代半乳糖苷)来启动蛋白表达,其会与乳糖阻遏物结合并从乳糖操纵子中释放出来,从而允许操纵子内的基因转录。其他可诱导操纵子都将是本领域技术人员已知的操纵子。
因此,在一些实施例中,重组凝集素基因由乳糖操纵子控制。在此类实施例中,诱导剂包括iptg。
可以以至少0.1mm、至少0.2mm或至少0.25mm的浓度将iptg添加到培养物中。
在一些实施例中,iptg的浓度小于1mm。iptg的浓度可以不大于0.7mm,或不大于0.5mm。使用较低浓度的iptg可能有利于维持低表达水平,这一点被认为有助于有效地裂解引发剂甲硫氨酸。
一旦宿主细胞在生长期增加到所需的密度,就可以添加诱导剂。宿主细胞的数量可以通过测量培养物的光密度(od)来确定。在一些实施例中,当od600(在600nm处测量的培养物的光密度)至少达到25、30、35、38或40时,添加诱导剂(即,表达期开始)。在一些实施例中,当od600至少达到25但不超过40时,添加诱导剂。
在本领域众所周知的是,在分批培养中,细胞最初的生长是为了形成所需的细胞群。在这一阶段,重点是细胞生长的扩增,而不是重组蛋白的合成。通常,诱导的时机取决于所需细胞群活跃生长的时期,在此期间,细胞中可用于蛋白质合成的核糖体的数量达到最大。形成所需的细胞群后,添加诱导剂后即可产生重组蛋白。因此,诱导的时机对于重组蛋白的生产率很重要。诱导的时机取决于宿主细胞的类型、培养基的类型、培养条件和重组蛋白的类型等因素。
在一些实施例中,在添加表达期诱导剂之前,生长期至少为4小时、6小时、8小时或9小时。
表达期(即添加诱导剂后的培养时间)可以至少为10小时、12小时、16小时、20小时、24小时、30小时或35小时。在一些实施例中,表达期长达40小时。
在较低温度下表达时,较长的表达期更为有利,因为细胞的生长速度缓慢,因此倍增时间更长。因此,延长表达期可以让更多的细胞得到生长,还可以对因温度较低导致的低生长速率进行一定的补偿。
在不受理论约束的情况下,认为更长的表达(诱导)期和延长倍增时间可以使表达蛋白的量稳定增长。由于宿主细胞内的代谢条件,有足够的时间通过甲硫氨酸氨基肽酶(map)促进引发剂甲硫氨酸的裂解,从而最大化无甲硫氨酸重组蛋白的产量。
可以理解的一点是,技术人员能够为给定的宿主细胞选择合适的培养条件,包括含有必需营养以支持细胞生长和蛋白质表达的合适培养基。在一些实施例中,细胞在液体培养基中培养。用于培养微生物细胞的合适液体培养基包括lysogeny/luria(lb)培养基。
培养基中的碳氮比最好能保持在3:1至6:1的水平。这一比例可以通过控制培养物的补料速度来维持。
细胞生长和蛋白质表达所需的养分需求至少部分取决于细胞群密度、培养温度、诱导剂的量和所需的蛋白质表达速率等因素。因此,可以通过细胞养分供给速率来控制生长速率,从而控制蛋白质的表达速率。
在一些实施例中,会在表达期以不超过2gl-1h-1或不超过1.5gl-1h-1的速率向培养物中添加碳源。可以在表达过程中以至少0.5gl-1h-1或0.8gl-1h-1的速率添加碳源。
碳源可以包含甘油或由甘油组成。此外/或者,还可以使用葡萄糖或右旋糖等其他碳源。
在一些实施例中,会在表达期以不超过1.5gl-1h-1或不超过1gl-1h-1的速率向培养物中添加氮源。可以在蛋白质表达过程中以至少0.4gl-1h-1或0.6gl-1h-1的速率添加氮源。
现已发现,将碳和/或氮的供应限制在上述参数内,可以优化细胞生长和蛋白表达的速度,从而使蛋白基本上能够以可溶形式表达,而大多数蛋白则缺乏引发剂甲硫氨酸。相反,还发现不受控的补料会导致蛋白表达速率提高和甲硫氨酸裂解不完全。
在一些实施例中,本发明中的方法能够产生至少80%、至少85%或至少90%的无甲硫氨酸重组凝集素蛋白(即缺少引发剂甲硫氨酸残基的蛋白)。
在一些实施例中,该方法包括以下条件中的一个或多个或全部:
-表达温度至少为15℃但不超过22℃(例如18℃);
-至少10小时的表达(即诱导)期;
-以0.5-2gl-1h-1的速率将碳源添加到培养物中
-以0.4-1.5gl-1h-1的速率将氮源添加到培养物中
-诱导剂浓度至少为0.1mm但不超过0.5mm。
表达期、生长期或在表达及生长期可以将碳和/或氮源添加到培养物中。
在一些实施例中,天然srl氨基酸序列(seqidno.2)的第1、14、34、113和123位中,至少有一处发生了重组凝集素蛋白的改变,如wo2010/095143(通过引用包含在本文中)所述。在一些实施例中,相对于天然srl,重组凝集素蛋白在这些位置上均发生了改变。
重组凝集素蛋白可能包含以下氨基酸序列或由其组成:
(i)seqidno.1;
(ii)seqidno.3;
(iii)seqidno.4;或
(iv)与seqidno.1、3或4同源度达到至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少98%或至少99%的氨基酸序列。
seqidno.1表示齐整小核菌凝集素氨基酸序列的变体(wo2010/095143中记录的rec-2)。
seqidno.2表示天然齐整小核菌凝集素氨基酸序列。
seqidno.3表示齐整小核菌凝集素氨基酸序列的变体(wo2010/095143中记录的rec-3)。
seqidno.4表示齐整小核菌凝集素氨基酸序列的变体(在wo2014/203261中记录)。
在一个实施例中,使用采用默认参数的blastp算法来确定两个序列之间的“同源性”百分比(altschul等人,《核酸研究杂志》,1997年9月1日;25(17):3389-402)可通过以下网址在线了解blast算法:https://blast.ncbi.nlm.nih.gov/blast.cgi。在另一实施例中,通过embossneedle算法,采用默认参数来确定两个序列之间的同源性百分比,以便开展序列全局比对。可以通过以下网址在线了解embossneedle算法:https://www.ebi.ac.uk/tools/psa/emboss_needle/。
除非另有说明,否则术语“同源性”可与本规范中的术语“一致性”互换使用。
根据seqidno.5可知,重组凝集素基因可能包含核苷酸序列或由其组成。然而,可以理解的一点是,由于遗传密码的简并性,存在很多可以产生相同氨基酸序列的替代核苷酸序列。
在一些实施例中,重组凝集素基因包含在质粒或载体等表达构建体中。表达构建体可以进一步包含选择标记,其使得能够选择携带能够编码重组凝集素基因的构建体的宿主细胞。选择标记可以是抗生素,例如卡那霉素。在此类实施例中,培养基还包含一种抗生素。
在细菌细胞中用于基因表达的适用人工质粒包括pet载体,尽管技术人员也了解其他表达载体。在一些实施例中,载体为pet27b。
在一些实施例中,宿主细胞培养物的体积至少为10升(l)、20l、30l、40l、50l或100l。表达在工业发酵罐中进行。
在一些实施例中,该方法还包括将重组凝集素基因(例如,含seqidno.5序列的基因)克隆到表达载体中这一步骤。技术人员已经掌握了分子克隆技术,并且在某些教科书中进行了描述,例如sambrook和russell的“分子克隆:实验室手册”。
宿主细胞可以是微生物细胞,例如细菌、古细菌、酵母菌或真菌。在一些实施例中,宿主细胞为大肠杆菌等细菌。特别优选的菌株是大肠杆菌bl21de3gold菌株。
在一些实施例中,该方法还包括将表达载体插入宿主细胞中这一步骤。可以使用转化或电穿孔等本领域技术人员通常已经掌握的技术来实现。
在一些实施例中,该方法还包括分离已表达重组凝集素蛋白这一步骤。通过分离这一步骤可以获得粗重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)。分离可能包括离心步骤,例如对宿主细胞进行离心处理以获得细胞团。分离还包括将细胞沉淀团块置于缓冲液中再悬浮,合适的缓冲液对于本领域中技术人员而言是已知的。分离步骤可能包括再悬浮细胞团的裂解,例如通过使用匀浆器破坏细胞膜。在约16,000-20,000psi的压力下,细胞裂解是有选择地进行的。
在一些实施例中,该方法还包括对粗重组凝集素蛋白进行纯化。纯化会导致重组凝集素蛋白分离物的产生。可以通过任何合适的技术进行纯化,比如离心法(例如超速离心)、尺寸排阻色谱法、离子交换色谱法、电泳法、亲和色谱法、过滤法(例如透滤)和高效液相色谱法(hplc)或其组合。
因此,在一些实施例中,该方法包括:
a)可选的,将重组凝集素基因克隆到表达载体中并将所述表达载体插入宿主细胞中;
b)在合适的培养基中培养所述宿主细胞,其中所述培养包括在25℃到40℃的温度下进行的生长期和表达由重组凝集素基因编码的重组凝集素蛋白的表达期,其中所述生长期的温度为15℃到30℃并且所述表达期内维持的碳氮比为3:1到6:1;
c)可选的,分离(b)中表达的所述重组凝集素蛋白以获得粗重组凝集素蛋白;以及
d)可选的,纯化所述粗重组凝集素蛋白以获得重组凝集素蛋白分离物。
在一些实施例中,对粗重组凝集素蛋白进行纯化至少需要采用一个色谱步骤。在一些实施例中,所采用的(至少一个)色谱步骤中包括离子交换色谱法和/或疏水作用色谱法。
在一些实施例中,对粗重组凝集素蛋白进行纯化时包括:
i)通过阴离子交换色谱法对粗重组凝集素蛋白进行初步纯化,以获得第一次纯化洗脱液;
ii)通过疏水作用色谱法对第一次纯化洗脱液进行有选择的纯化,以获得第二次纯化洗脱液;
iii)通过阳离子交换色谱法对第二次纯化洗脱液进行有选择的纯化,以获得第三次纯化洗脱液;
iv)通过阴离子交换色谱法进一步纯化第二或第三次纯化洗脱液以获得第四次纯化洗脱液;和
v)通过透滤法对第四次纯化洗脱液的缓冲液进行更换,以获得纯化的重组凝集素蛋白分离物。
通过上述纯化步骤有利于获得高纯度(97-99%)的重组凝集素蛋白,而无需化学或酶处理。
在本发明的第二方面,提供了含seqidno.5核苷酸序列的表达构建体。
在本发明的第三方面,提供了包含本发明第三方面表达构建体的宿主细胞。
除非另有说明,否则本文所述的任何实施例均可以以任何方式在本发明的任何方面进行组合。
在一些特定的实施例中,本发明涉及制备重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)的过程,该过程包括:
a.对核苷酸序列(例如seqidno.5序列)进行克隆,在嵌入载体的同时,将重组凝集素蛋白编入重组宿主细胞,以制备克隆体;
b.对步骤(a)中制备的克隆体进行分批补料发酵,使重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)在适当的培养基中进行表达(初始温度约25℃至40℃,诱导期温度约15℃至30℃),其补料速率应确保碳源与氮源之比为3:1至6:1,以获得发酵产物;
c.对步骤(b)中获得的发酵产物进行分离和澄清,以获得粗重组凝集素蛋白(例如,含seqidno.1氨基酸序列的蛋白);和
d.有选择地对步骤(c)中获得的粗重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)进行纯化。纯化包括以下步骤:
i.通过阴离子交换色谱法对粗重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)进行初步纯化,以获得第一次纯化洗脱液;
ii.通过疏水作用色谱法对步骤i中获得的第一次纯化洗脱液进行有选择的纯化,以获得第二次纯化洗脱液;
iii.通过阳离子交换色谱法对步骤ii中获得的第二次纯化洗脱液或步骤i中获得的第一次纯化洗脱液进行纯化,以获得第三次纯化洗脱液;
iv.通过阴离子交换色谱法对步骤iii中获得的第三次纯化洗脱液或步骤ii中获得的第二次纯化洗脱液进行纯化,以获得纯化洗脱液;
v.通过透滤法将步骤iv中获得的纯化洗脱液的缓冲液进行交换,以获得作为纯产物的重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)。
本发明还涉及在合适的培养基中对重组细菌细胞进行分批补料发酵,以获得发酵产物,其中发酵过程中碳源的补料速率为0.5-2gl-1h-1,而氮源的补料速率为0.4-1.5gl-1h-1。
本发明还涉及对粗重组凝集素(例如含seqidno.1氨基酸序列的蛋白)进行纯化的过程,该过程包括:
a.通过阴离子交换色谱法对粗重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)进行初步纯化,以获得第一次纯化洗脱液;
b.通过疏水作用色谱法对步骤i中获得的第一次纯化洗脱液进行有选择的纯化,以获得第二次纯化洗脱液;
c.通过阳离子交换色谱法对步骤(b)中获得的第二次纯化洗脱液或步骤(a)中获得的第一次纯化洗脱液进行纯化,以获得第三次纯化洗脱液;
d.通过阴离子交换色谱法对步骤(c)中获得的第三次纯化洗脱液或步骤(b)中获得的第二次纯化洗脱液进行纯化,以获得纯化洗脱液;
e.通过透滤法将步骤(d)中获得的纯化洗脱液的缓冲液进行交换,以获得作为纯产物的重组凝集素蛋白(例如含seqidno.1氨基酸序列的蛋白)。
本发明还涉及生产重组凝集素(含seqidno.1的氨基酸序列)用的克隆体,在嵌入载体的同时,将seqidno.5核苷酸序列纳入并将seqidno.1氨基酸序列编入重组宿主细胞。
本发明还涉及对按照本文披露的过程制备、含seqidno.1氨基酸序列的重组凝集素。
在一些实施例中,在有利情况下,本发明中的方法可以使预期产物的产率大于90%、95%或97%。
当使用阴离子交换色谱法等标准方法进行测量时,产物重组凝集素蛋白的纯度至少可以达到90%、95%、97%或99%。
本发明涉及重组凝集素(含seqidno.1氨基酸序列的蛋白)的制备过程,该过程包括:
a.对seqidno.5核苷酸序列进行克隆,在嵌入载体的同时,将seqidno.1氨基酸序列编入重组宿主细胞,以制备克隆体;
b.对步骤(a)中制备的克隆体进行分批补料发酵,使重组凝集素(例如具有seqidno.1氨基酸序列的蛋白)在适当的培养基中进行表达(初始温度约25℃至40℃,诱导期温度约15℃至30℃),其给料速率应确保碳源与氮源之比为3:1至6:1,以获得发酵产物;
c.对步骤(b)中获得的发酵产物进行分离和澄清,以获得粗重组凝集素(例如,具有seqidno.1氨基酸序列的蛋白);和
d.对步骤(c)中获得的粗重组凝集素(例如具有seqidno.1氨基酸序列的蛋白)进行纯化。纯化包括以下步骤:
i.通过阴离子交换色谱法对粗重组凝集素(例如具有seqidno.1氨基酸序列的蛋白)进行初步纯化,以获得第一次纯化洗脱液;
ii.通过疏水作用色谱法对步骤i中获得的第一次纯化洗脱液进行有选择的纯化,以获得第二次纯化洗脱液;
iii.通过阳离子交换色谱法对步骤ii中获得的第二次纯化洗脱液或步骤i中获得的第一次纯化洗脱液进行纯化,以获得第三次纯化洗脱液;
iv.通过阴离子交换色谱法对步骤iii中获得的第三次纯化洗脱液或步骤ii中获得的第二次纯化洗脱液进行纯化,以获得纯化洗脱液;
v.通过透滤法将步骤iv中获得的纯化洗脱液的缓冲液进行交换,以获得作为纯产物的重组凝集素(例如含seqidno.1氨基酸序列的蛋白)。
含seqidno.1氨基酸序列的重组凝集素的克隆和表达
根据本发明的一个方面,用于产生含seqidno.1氨基酸序列的重组凝集素的宿主细胞可以是细菌细胞或酵母菌。细菌细胞最好是大肠杆菌,特别是bl21de3gold菌株。通过seqidno.5氨基酸序列为重组凝集素编码的seqidno.5核苷酸序列可以克隆到载体中,最好是pet27b。然后可以将质粒转化并在宿主大肠杆菌bl21de3gold中表达。
发酵工艺
在一个典型实施例中,让含有质粒pet27b(含重组凝集素蛋白编码用核苷酸序列)的大肠杆菌bl21de3gold菌株在含有luriahivegbroth(20g/l)、na2hpo4(7.5g/l)、右旋糖(5g/l)、mgso4·7h2o(1g/l)、终浓度20mμg/ml的卡那霉素、0.1%(v/v)痕量金属溶液(含feso4、znso4、cocl2、namoo4、cacl2、mncl2、cuso4或h3bo3的盐酸)的接种培养基中生长。将细胞置于30-40℃下生长12-16小时,以此来制备接种物。利用大肠杆菌bl21de3gold菌株对重组体进行分批补料发酵时,可以在含有酵母提取物(10g/l)、右旋糖(5g/l)、kh2po4(3g/l)、k2hpo4(12.5g/1)、(nh4)2s04(5g/1)、nacl(0.5g/1)、mgs04·7h2o(1g/l)和0.1%(v/v)的痕量金属溶液(含feso4、znso4、cocl2、namoo4、cacl2、mncl2、cuso4或h3bo3的盐酸)的生产培养基中进行。可以添加卡那霉素至终浓度达到20μg/ml。开始补料时可以用合适的碳源(例如葡萄糖或甘油,最好为50%(w/v)的甘油)和氮源(例如胰蛋白胨、蛋白胨或酵母提取物,最好是40%(w/v)的酵母提取物)。log5小时好偶可以以预定的补料速度开始补料。发酵过程中碳源的补料速率可以为0.5-2gml-1h-1,氮源的补料速率可以为0.4-1.5gml-1h-1,使c:n比保持在3:1至6:1的范围内,最好使c:n比为4:1。由于参数是特定批量所特有的,因此本领域技术人员可以根据适用性来改变速率和量。
生长初期温度可以为25℃-40℃,通过一系列柱色谱法进行纯化后,诱导期温度可以为15℃-30℃。生长初期的温度可以保持在25℃-40℃左右,最好为37℃左右。可以降低诱导期的温度,并保持在15℃-30℃左右,最好为22℃左右。
培养物的初期生长可以在约1-2vvm的通气量下进行,使溶解氧保持在50%-60%,用氢氧化钠等碱性物质使ph值保持在6.6-7.2。总培养时间可以是20-50小时或30-40小时,最好为36小时左右。碳源和氮源的供给可以持续到培养时间结束为止。
重组凝集素蛋白(例如含有seqidno.1氨基酸序列的蛋白)的表达可以通过利用乳糖或异丙基-β-d-硫代半乳糖苷(iptg)等诱导剂诱导宿主细胞(例如大肠杆菌)培养液来进行,iptg的浓度最好为50μm-1500μm,最好为1000μm左右。可以在20-50(在约600nm下测量,最好为30-50左右)的细胞密度下诱导培养物。
重组凝集素蛋白的表达可以通过对总细胞裂解物和裂解上清液进行sds-page分析来验证。重组蛋白的表达约占总蛋白的50%-60%,并以可溶形式在细胞质中表达。通过sds-page分析,重组凝集素蛋白的产物至少约为5-9g/l的发酵液。
可溶性重组凝集素蛋白的分离可以通过离心法收集细胞以获得细胞团,然后将细胞重悬于合适的缓冲液中,然后将其预冷至6℃-10℃左右的温度。细胞破碎可以在均质器(minidebee)上进行,可以选择在16,000-20,000psi左右的高压下进行。可以对由此获得的细胞裂解物进行进一步处理,例如通过使用不同的色谱法来纯化可溶性重组凝集素蛋白。
重组凝集素蛋白的纯化
从发酵过程中获得的细胞裂解物中提取的重组凝集素蛋白的纯化工艺包括以下步骤:
a柱1:阴离子交换色谱法
b柱2:疏水作用色谱法
c柱3:阳离子交换色谱法
d柱4:阴离子交换色谱法
在一些实施例中,使用0.1μm左右的切向流过滤系统对细胞裂解物进行澄清后获得总细胞裂解物和澄清溶液。
在一些实施例中,使用cellufinemaxq-r、source30q、source15q和deae琼脂糖等树脂对澄清的细胞裂解物进行阴离子交换柱色谱分析。可以用合适的缓冲液平衡该柱,例如含有约10-30mm的tris、约0.5-2mm的edta,ph值约为7.5-9.0的缓冲液。上样后,可用电导率约为4-8ms/cm的缓冲液洗涤色谱柱。可以用含有约10-30mmtris、约0.5-2mmedta、电导率约为15-20ms/cm的氯化钠的缓冲液进行洗脱。
在一些实施例中,有选择地对从阴离子交换柱获得的蛋白进行疏水作用柱色谱分析。使用的树脂可以是cellufinemax丁基、丁基琼脂糖、苯基琼脂糖等。可以用约20-30mm的乙酸钠缓冲液平衡色谱柱,该缓冲液中含有约0.5-2m的硫酸铵,约0.5-2mm的edta,ph值约为4-5。可以用约20-30mm的乙酸钠缓冲液进行洗脱,该缓冲液中含有约0.5-2mm的edta,约10-20g/l的硫酸铵,ph值约为4-5,电导率约为2-100ms/cm。疏水作用柱色谱法后获得的或从阴离子交换柱获得的洗脱液可随后使用spsepharose、cmsepharose、cellufinemaxs-h等树脂进行阳离子交换柱色谱分析。可以用约20-30mm的乙酸钠缓冲液平衡色谱柱,该缓冲液中含有约0.5-2.0mm的edta,ph值约为4-5。洗脱缓冲液中可包含约20-30mm的乙酸钠,约0.5-2mm的edta,约0.3-1m的氯化钠,ph值在4-5左右。在洗脱之前,可以在15-25%范围内做不连续梯度。可以在50-80%范围内以不连续梯度进行洗脱。
在一些实施例中,以1:2-1:5的比例将通过阳离子交换色谱法获得的洗脱液用注射用水(wfi)或纯净水(pw)稀释。然后可以用ph值为11.0的氢氧化钠、tris缓冲液或甘氨酸缓冲液将蛋白液的ph值调节至7.5-8.5左右,然后使用切向流过滤系统与ph值为7.5-8.5的tris缓冲液进行缓冲液交换,直至电导率下降到1-5ms/cm左右为止。然后可以对蛋白液进行阴离子交换柱色谱分析。可以使用cellufinemaxq-r、sourceq15、sourceq30或deae琼脂糖等树脂。可以用约20-30mm的ph值约为7.5-8.5的tris缓冲液平衡色谱柱。可以用含有约20-30mm的tris,约0.3-1m的氯化钠,ph值约为7.5-8.5的缓冲液进行洗脱。可以用3-20个柱体积的缓冲液以15%左右的线性梯度来进行洗脱。用3、5或10kda截止膜进行透滤后,以此获得的洗脱液可以采用tris缓冲盐水、磷酸盐缓冲盐水、醋酸盐缓冲液等适当缓冲液进行缓冲液交换。
经过缓冲液更换的蛋白可以存储在约2-8℃的温度下,以保持生物活性。或者,第二次阴离子交换色谱分析后获得的洗脱液可以与注射用水进行缓冲交换,随后再冻干,以获得粉末形式的蛋白。
重组凝集素蛋白的纯度可以通过阴离子交换高效液相色谱法进行检查。一系列色谱分离后获得的含seqidno.1氨基酸序列的重组凝集素蛋白的纯度达到97%-99%。含有seqidno.1氨基酸序列(含未加工引发剂甲硫氨酸)的重组凝集素蛋白的百分比约为10-15%(相对于无met凝集素的相对丰度)。
因此,本发明提供了一种在载体中实现重组凝集素蛋白(例如seqidno.1)表达的方法,通过该方法可以对蛋白表达及其在宿主细胞中的可溶性表达进行严格调控。本发明中的工艺是可控制可扩展的,并且克服了先前方法的缺点。因此,本发明中描述了一种工业上可扩展的方法,用于按克生产重组凝集素。
因此,本发明的主要目的是克服现有技术参考文献的缺点,并设计出一种高效制备seqidno.1氨基酸序列的方法。
含有seqidno.1氨基酸序列的重组凝集素的产物可以是1.5-3.0g/l的发酵液。因此,本发明的另一个目的是提供一种产量高、成本效益高且可使用容易获得的原料进行生产的方法。由于制备大量含seqidno.1氨基酸序列的重组凝集素所需的原材料价格非常低廉,所以本工艺的成本效益较高。而且,该工艺不需要很高或很低的温度或昂贵的仪器。因此,该工艺的成本效益较高且易于扩展。
本发明还涉及在合适的培养基中对重组细菌细胞进行分批补料发酵,以获得发酵产物,其中发酵过程中碳源的补料速率为0.5-2gl-1h-1,而氮源的补料速率为0.4-1.5gl-1h-1。
生长/发酵初期温度可以为25℃-40℃左右,通过一系列柱色谱法进行纯化后,在随后的诱导期,该温度降低至15℃-30℃左右。
在一些实施例中,培养物的初期生长可以在约1-2vvm的通气量下进行,使溶解氧保持在50%-60%,用氢氧化钠等碱性物质使ph值保持在6.6-7.2。在一些实施例中,生长初期的温度维持在25℃-40℃左右。在诱导期,温度可以降低至并维持在15℃-30℃左右。发酵时间可以至少为20-50小时左右。碳源和氮源的供给可以持续到发酵时间结束为止。
在一些实施例中,使用cellufinemaxq-r、source30q、source15q和deae琼脂糖等树脂对澄清的细胞裂解物进行阴离子交换柱色谱分析。可以用缓冲液平衡该柱,例如含有约10-30mmtris缓冲液、约0.5-2mmedta,ph值约为7.5-9.0的缓冲液。上样后,可用电导率约为4-8ms/cm的缓冲液洗涤色谱柱。可以用含有10-30mm的tris、0.5-2mm的edta、电导率为15-20ms/cm的氯化钠的缓冲液进行洗脱。
在一些实施例中,有选择地对从阴离子交换柱获得的蛋白进行疏水作用柱色谱分析。使用的树脂可以是cellufinemax丁基、丁基琼脂糖、苯基琼脂糖等。可以用20-30mm的乙酸钠缓冲液平衡色谱柱,该缓冲液中含有约0.5-2m的硫酸铵,约0.5-2mm的edta,ph值约为4.0-5.0。可以用约20-30mm的乙酸钠缓冲液进行洗脱,该缓冲液中含有约0.5-2mm的edta,约10-20g/l的硫酸铵,ph值约为4-5,电导率约为2-100ms/cm。疏水作用柱色谱法后获得的或从阴离子交换柱获得的洗脱液可随后使用spsepharose、cmsepharose、cellufinemaxs-h等树脂进行阳离子交换柱色谱分析。可以用约20-30mm的乙酸钠缓冲液平衡色谱柱,该缓冲液中含有约0.5-2.0mm的edta,ph值约为4-5。洗脱缓冲液中可包含约20-30mm的乙酸钠,约0.5-2mm的edta,约0.3-1m的氯化钠,ph值在4-5左右。在洗脱之前,可以在15-25%范围内做不连续梯度。可以在50-80%范围内以不连续梯度进行洗脱。
以1:2-1:5左右的比例将通过阳离子交换色谱法获得的洗脱液用注射用水(wfi)或纯净水(pw)稀释。然后可以用ph值为11.0的氢naoh、tris缓冲液或甘氨酸缓冲液将蛋白液的ph值调节至8左右,然后使用切向流过滤系统与ph值为7.5-8.5的tris缓冲液进行缓冲液交换,直至电导率下降到1-5ms/cm左右为止。然后可以对蛋白液进行阴离子交换柱色谱分析。可以使用cellufinemaxq-r、sourceq15、sourceq30或deae琼脂糖等树脂。可以用约20-30mm的ph值约为7.5-8.5的tris缓冲液平衡色谱柱。可以用含有约20-30mm的三羟甲基氨基甲烷,约0.3-1m的氯化钠,ph值约为7.5-8.5的缓冲液进行洗脱。可以用3-20个柱体积的缓冲液以15%左右的线性梯度来进行洗脱。用3、5或10kda截止膜进行透滤后,以此获得的洗脱液可以采用tris缓冲盐水、磷酸盐缓冲盐水、醋酸盐缓冲液等适当缓冲液进行缓冲液交换。经过缓冲液更换的蛋白可以存储在2-8℃的温度下,以保持生物活性。或者,第二次阴离子交换色谱分析后
获得的洗脱液可以与注射用水进行缓冲交换,随后再冻干,以获得粉末形式的蛋白。含seqidno.1氨基酸序列的重组凝集素蛋白的纯度可以通过阴离子交换高效液相色谱法进行检查。一系列色谱分离后获得的含seqidno.1氨基酸序列的重组凝集素的纯度达到97%-99%。含有seqidno.1氨基酸序列(含未加工引发剂甲硫氨酸)的重组凝集素的百分比约为10-15%(相对于无met凝集素的相对丰度)。
本发明涉及生产重组凝集素(含seqidno.1的氨基酸序列)用的克隆体,在嵌入载体的同时,将seqidno.5核苷酸序列纳入并将seqidno.1氨基酸序列编入重组宿主细胞。
示例
此处所给示例用以说明本发明的最佳实施方式,并且不以任何方式限制本发明的范围。
示例1:在pet27b载体中克隆凝集素序列seqidno.5和在大肠杆菌bl21de3表达
含seqidno.1氨基酸序列的重组凝集素已于先前克隆到pet20b载体(如wo2010/095143a2专利中披露的)中,由核苷酸序列(seqidno.5)为其编码,而该核苷酸序列则被次克隆到pet27b载体中。在pet20b中克隆的含seqidno.5的大肠杆菌bl21de3细胞是在luriahivegbroth(印度孟买海美迪)中培养的。按照生产商的说明,使用genejet质粒小提试剂盒(thermoscientific)从细胞中分离质粒。用限制酶ndel和bamhi(新英格兰生物实验室)酶切质粒pet20b。酶切质粒经过琼脂糖凝胶电泳法处理,并使用genejet凝胶提取试剂盒(赛默科技)从凝胶上洗脱释放的插入片段。利用相似的方法分离载体pet27b并用相同的限制酶(ndel和bamhi)进行酶切。从pet20b(seqidno:5)释放的插入片段被克隆到pet27b载体(pet27b-lec)中并转化到大肠杆菌bl21de3(gold)中。通过菌落pcr筛选克隆体,并将阳性克隆进一步用于表达分析。阳性克隆在37℃的hivegluriabroth中生长,用0.25mm的iptg在1-1.2细胞密度(od600nm)下进行诱导,进一步生长4小时。通过sds-page分析确认了含seqidno.1氨基酸序列的重组凝集素的表达。通过对分离质粒进行dna测序证实了载体pet27b中插入片段的序列。制备了阳性克隆的甘油原液并将其在-80℃下保存。
示例2:发酵工艺
将甘油原液中的培养物接种到含有2%hivegluriabroth、0.75%na2hp04、0.5%右旋糖和卡那霉素(20μg/ml)的培养基中。培养物在30±2℃和110rpm的转速下生长16小时。将大约300ml培养物接种到2.3l含1%酵母提取物(w/v)、1.2%右旋糖(w/v)、0.3%kh2po4(w/v)、1.25%k2hpo4(w/v)、0.5%(nh4)2so4(w/v)、0.05%nacl(w/v)、0.1%mgso4·7h2o(w/v)、0.1%(v/v)痕量金属溶液、卡那霉素(20μ/ml)的生产培养基中。在5l发酵罐(biostatb,赛多利斯)中进行发酵,通气量为1-2vvm,溶氧量保持在50-60%,用碱性物质使ph值保持在6.6-7.0。初期生长在37℃的温度下进行。在诱导期温度逐渐降低并保持在22℃。5log小时后以预定补料速率开始碳源(甘油)和氮源(酵母提取物)补料,使c:n比保持在4:1范围内。用1mm的iptg以-45(od600)的细胞密度诱导培养。继续发酵至24小时,并以9000rpm的转速离心15分钟,以获得培养液。由发酵液获得的细胞群的湿重为372g。
示例3:将含seqidno.1氨基酸序列的重组凝集素从细胞中分离
将细胞团以1:10(w/v)的比例悬浮在裂解缓冲液(25mmtris,1mmedta,ph8.5)中,并在顶置式搅拌器中搅拌至少2小时,以形成均匀的悬浮液。通过在-18000psi转速实现高压均质化,以裂解悬浮细胞团。在15℃下以9000rpm的转速使细胞裂解液离心15分钟。保留所得上清液,并进一步处理以纯化含seqidno.1氨基酸序列的重组凝集素。
示例4:通过微滤除去核酸杂质并澄清蛋白液
搅拌15-30分钟,用至少0.025%的聚乙烯亚胺处理上清液。使用25mmtris缓冲液(含1mm的edta,ph8.0±0.5)预先平衡的面积为3600cm2的0.1μm中空纤维对聚乙烯亚胺处理后获得的总细胞裂解液进行澄清在整个澄清过程中,跨膜压保持在5-10psi。用上述平衡缓冲液以步进模式对渗余物进行透滤,以回收含seqidno.1氨基酸序列的重组凝集素。对于含seqidno.1氨基酸序列的重组凝集素,回收率在90%以上。回收总蛋白为84.4g(通过280nm处的光密度测得)。通过hplc测量的目的蛋白的纯度为49.4%。
示例5:通过离子交换色谱法进行蛋白纯化(柱1)
将澄清的蛋白液加到用含1mmedta、ph值为8.0±0.5的25mmtris缓冲液预平衡的cellufinemaxq-r树脂上。上样后,用平衡缓冲液洗涤,然后用含有1-3g/lnacl的平衡缓冲液洗涤。用含1mmedta、11-15g/lnacl、ph值为8±0.5的25mmtris缓冲液洗脱蛋白。在此柱上回收的总蛋白为41.6g活性蛋白,纯度为77.4%。
示例6:通过疏水作用色谱法进行蛋白沉淀和纯化(hic-柱2)
用乙酸将柱1洗脱液的ph调至4.5,然后进行硫酸铵沉淀。然后对溶液进行离心处理,在hic树脂(cellufinemaxbutyl)上处理澄清的上清液,以进行进一步纯化。用含有1mmedta、0.5-2m硫酸铵的ph值为4.5的25mm乙酸钠缓冲液平衡色谱柱,然后进行蛋白液上样。上样后,用平衡缓冲液洗涤,然后用含有25mm乙酸钠、1mmedta、15g/l硫酸铵的ph值为4.5的洗脱缓冲液洗脱。从柱2上洗脱的总蛋白有27.5g,纯度为90.3%。
示例7:通过阳离子交换色谱法进行蛋白纯化(柱3)
用纯化水稀释从柱2上获得的蛋白,直至导电率达到20ms/cm左右,然后将其加到预先用含1mmedta、ph值为4.5的25mm乙酸钠缓冲液平衡的spsepharoseff树脂上。上样后,用平衡缓冲液对色谱柱进行洗涤,然后按不连续梯度用20%的含25mm乙酸钠、1mmedta、0.5mnacl、ph值为4.5的洗脱缓冲液进行洗脱。用50-70%(不连续梯度)的洗脱缓冲液进行洗脱。从该柱共回收到24.6g纯度为93.0%的蛋白。在3kda膜上对柱3洗脱液进行缓冲液交换,以从ph值为8.0的25mmtris缓冲液中获得蛋白。
示例8:通过阴离子交换色谱法进行蛋白纯化
缓冲液交换后,获得20.9g蛋白,并加到source30q树脂上进行处理。用ph值为8.0的25mmtris缓冲液平衡色谱柱,然后进行蛋白溶液上样。上样后,用平衡缓冲液洗涤色谱柱。然后用ph值为8.0的含25mmtris、0.5mnacl的15个柱体积的洗脱缓冲液以线性梯度进行洗脱。用hplc分析时,显示出>99.0%的纯度,出现单峰值。考虑到280nm下的10d等于1mg,按照280nm处的光密度测得的总共有9.0克。最后的洗脱液用tbs缓冲液(50mmtris缓冲液、150mmnacl、ph值为7.8)进行缓冲液交换。
示例9:含seqidno.1氨基酸序列的重组凝集素的物化特性
通过sds-page和hplc分析确认了含seqidno.1氨基酸序列的重组凝集素的纯度。通过hplc分析确认了含seqidno.1氨基酸序列的重组凝集素的纯度为97-99%。对含seqidno.1氨基酸序列的重组凝集素进行sds-page分析后可知其为分子量为-16kda的单条带。通过蛋白免疫印迹证实了蛋白的id,并且通过血凝反应和(使用各种肿瘤细胞系进行)体外细胞测定证实了其生物活性。含seqidno.1氨基酸序列的纯化凝集素重组凝集素的分子量为16044da。
示例10:发酵工艺条件
将根据前述示例的甘油原液的培养物接种到含有2%hivegluria液体、0.75%na2hp04、0.5%葡萄糖和卡那霉素(20μg/ml)的培养基中。对于第一至第三批,培养物在37℃和110rpm的转速下生长16小时。
对于第四批和第五批,将根据前述示例的甘油原液的培养物接种到如上所述的培养基中,除了培养物在30℃和110rpm的转速下生长19小时外。
然后将大约300ml培养物接种到2.3l生产培养基中。
生产培养基如示例2所述,除了每批中的下述差异(如表1所示)外:
表1:不同发酵条件下蛋氨酸凝集素的比例分析。
第一至第三批:根据示例2,生产培养基含有葡萄糖(12g/l)。第四至第五批:生产培养基含有10g/l葡萄糖,而不是示例2中所述的1.2%葡萄糖。
对于每批,在5l发酵罐(biostatb,赛多利斯)中进行发酵,通气量为1-2vvm,溶氧量保持在50-60%,用碱保持ph值在6.6-7.0。
生产培养基的温度最初保持在37℃,条件如下:
第一至第二批——在对数第4小时,温度逐渐降至22℃。该温度在诱导期保持不变,以1mmiptg开始诱导。总批料运行时间为25小时。
在4个对数小时后开始添加碳源(甘油)和氮源(酵母提取物)。加入第一批的甘油总量为102g/l,加入第二批的甘油总量为75g/l。
第三批——在第5个小时温度逐渐降至18℃。该温度在诱导期保持不变,以1mmiptg开始诱导。总批料运行时间为25小时。
诱导期加入第三批的甘油总量为70g/l。
对于第一至第三批,接种到生产培养基4-6小时后将诱导剂加入。诱导剂的加入启动了诱导(表达)期。
第四至第五批:接种到生产培养基之后,在第6小时温度逐渐降至18℃。该温度在诱导(表达)期保持不变,在接种后九小时以0.25mmiptg开始诱导。总批料运行时间为33(第八批)或48(第9批)小时。
在诱导期,加入到第四批的甘油总量为35g/l,而加入到第五批的甘油总量为40g/l。
通过以9000rpm的转速离心分离15分钟收获培养液,并根据本发明分离和纯化重组凝集素。然后分析分离的凝集素中蛋氨酸凝集素的比例。
第一批中分离的凝集素有50%以上是蛋氨酸凝集素。这一比例在第二批降至26%,第三批中降至16%,第四批中降至13%,第五批中降至12%。
示例11:倍增时间
大肠杆菌的倍增时间在样品发酵过程中的不同时间点和温度下测定,即接种到生产培养基中后。结果如表2所示。在本示例中,接种后9小时加入诱导剂iptg。因此,对于本示例,生长期将被视为9小时之前的时间点,表达期将被视为添加诱导剂时和之后的时间点。
表2不同发酵条件下大肠杆菌的倍增时间
*包括初始延滞期和指数期;
示例12:重组凝集素纯化
在本示例中,重组凝集素从示例10中产生的培养液中分离和纯化。
将培养液在15℃以9000rpm的转速离心分离15分钟。将获得的沉淀重悬于裂解缓冲液(25mmtris,1mmedta,ph8.0)中。通过在18000psi的高压均化切割细胞。使用切割缓冲液预平衡的0.1微米中空纤维澄清切割物。将澄清的蛋白质溶液进行一系列色谱步骤以纯化重组凝集素。
阴离子交换色谱法:将澄清的蛋白质溶液装载在cellufinemaxq-r柱上,用25mmtris、1mmedta和ph8.0平衡,结合强度为60-80mg/ml。装载后,采用2-3倍柱体积的平衡缓冲液洗涤柱。此外,采用含有氯化钠的平衡缓冲液洗涤柱子,氯化钠的电导率为~5ms/cm.采用含氯化钠的25mmtris、1mmedta和ph8.0缓冲液洗脱结合蛋白,氯化钠的电导率为18-20ms/cm。整个峰被收集为一个单独的部分,其中包含目的蛋白质和一些其他杂质。
阳离子交换色谱法:通过阴离子交换色谱法获得的洗脱液用琼脂糖凝胶速流柱进行阳离子交换色谱法。用乙酸将洗脱液的ph值调至4.5。然后将蛋白质装载到琼脂糖凝胶速流柱上,用含有1mmedta、ph4.5(缓冲液a)的25mm醋酸钠缓冲液平衡,树脂上结合强度为40-50mg/ml。装载后,采用2-3倍柱体积的平衡缓冲液洗涤柱。然后按不连续梯度采用20%缓冲液b洗涤柱子(缓冲液b:缓冲液a+0.5mnacl)。按不连续梯度采用70%缓冲液b进行洗脱。然后将洗脱液以1:1的比例用水立即稀释,以防止蛋白质聚集。洗脱的蛋白质采用25mmtris、ph8.0缓冲液进行缓冲液交换,使用3kda膜。
阴离子交换色谱法:将缓冲液交换蛋白装载到30q源树脂上后,采用25mmtris缓冲液(ph8.0)平衡柱子,然后加载蛋白溶液。加载后,用平衡缓冲液洗涤柱子。然后通过给出包含25mmtris、0.5mnacl、ph8.0、15个柱体积的洗脱缓冲液的线性梯度来进行洗脱。最后的洗脱液用tbs缓冲液(50mmtris缓冲液、150mmnacl、ph7.8)进行缓冲液交换。通过高效液相色谱(hplc)分析洗脱蛋白质的纯度和浓度。
序列总汇
seqidno.1:
tykitvrvyqtnpdaffhpvektvwkyanggtwtitddqhvltmggsgtsgtlrfhadngesftatfgvhnykrwcdivtnlaadetgmvinqqyysqknreearerqlsnyqvknakgrnfqivyteaegndlhanliig
seqidno.2:
tykitvrvyqtnpnaffhpvektvwkyanggtwtitddqhvltmggsgtsgtlrfhadngesftatfgvhnykrwcdivtnlaadetgmvinqqyysqknreearerqlsnyevknakgrnfeivyteaegndlhanliig
seqidno.3:
vykitvrvyqtnpdaffftpvektvwkyanggtwsitddqhvltmggsgtsgtlrfhadngesftatfgvhnykrwcdivtnlaadetgmvinqqyysqknreearerqlsnyqvknakgrnfqivyteaegndlhanliig
seqidno.4:
vykitvrvyqtnpdaffhpvektvwkyadggtwsitddqhvltmggsgtsgtlrfhadngesftatfgvhdykrwcdivtdlaadetgmvinqeyysekdreearerqnsnyevkdakgrnfeivyteaegndlhadliig
seqidno:5:
atgacctataaaattaccgtgcgcgtgtatcagaccaacccggatgcctttttccatccggtggaaaaaaccgtgtggaaatatgcgaatggcggtacctggacgattacggatgatcagcatgtgctgacgatgggtggtagcggtaccagcggcaccctgcgttttcacgcagataatggcgaaagcttcaccgccacctttggtgtgcataattataaacgctggtgtgatattgtgaccaacctggcagcggatgaaaccggcatggttattaatcagcagtattatagtcagaaaaaccgcgaagaagcgcgtgaacgccagctgagtaactatcaggtgaaaaatgcgaaaggccgtaacttccagattgtttataccgaagcggaaggcaatgatctgcatgcgaacctgattatcggc
本发明的一方面内容如下:
1.一种制备重组凝集素蛋白的方法,该方法包括:
在培养物的宿主细胞中表达由重组凝集素基因编码的重组凝集素蛋白,其中表达是在细胞具有不超过160分钟倍增时间的条件下进行。
2.根据第1点中的所述方法,在细胞具有至少100分钟倍增时间的条件下进行表达。
3.根据第1或第2点的所述方法,在不超过22℃的温度下进行表达。
4.根据第1至第3点中的任一方法,至少15℃的温度下进行表达。
5.根据第1至第4点中的任一方法,该方法包括培养宿主细胞,所述培养包括:
-在蛋白质表达之前宿主细胞生长的生长期;和
-进行蛋白质表达的表达期,其中生长期在高于进行表达期的温度下进行。
6.根据第5点的所述方法,其中生长期在至少25℃且不超过40℃的温度下进行。
7.根据第5或第6点的所述方法,其中在至少4小时且不超过7小时的时间内将温度从生长期降至表达期。
8.根据第1至第7点中的任一方法,其中通过向培养物加入诱导剂来启动重组凝集素蛋白的表达。
9.根据第8点的所述方法,其中所述诱导剂以至少0.1mm且不超过0.5mm的浓度添加到所述培养物中。
10.根据第8或第9点的所述方法,其中诱导剂包括iptg。
11.根据第1至第10点中的任一方法,其中表达进行至少10小时。
12.根据第1至第11点中的任一方法,其中在表达期间,以不超过2gl-1h-1的速率向培养物中加入碳源和/或以不超过1.5gl-1h-1的速率向培养物中加入氮源。
13.根据第12点的所述方法,其中碳源以至少0.5gl-1h-1的速率加入到培养物中。
14.根据第12或第13点的所述方法,其中氮源以至少0.4gl-1h-1的速率加入到培养物中。
15.根据第12至第14点中的任一方法,其中所述碳源包括甘油或由甘油组成。
16.根据第1至第15点中的任一方法,其中所述重组凝集素蛋白包含选自以下的氨基酸序列:
i)seqidno.1;
ii)seqidno.3;
iii)seqidno.4;或
iv)与i)、ii)或iii)具有至少60%同源性的氨基酸序列。
17.根据第16点的所述方法,其中iv)的氨基酸序列是与i)、ii)或iii)具有至少70%、80%、90%、95%或99%同源性的氨基酸序列。
18.根据第1至第17点中的任一方法,其中该方法还包括在表达重组凝集素蛋白的步骤之后分离粗重组凝集素蛋白的步骤。
19.根据第18点的所述方法,其中该方法进一步包括纯化粗重组凝集素蛋白。
20.根据第19点的所述方法,其中纯化粗蛋白包括至少一个色谱步骤。
21.根据第20点的所述方法,其中至少一个色谱步骤包括阴离子交换色谱法和/或阳离子交换色谱法。
22.根据第20或第21点的所述方法,其中至少一个色谱步骤包括疏水作用色谱法。
23.根据第19至第22点中的任一方法,其中纯化粗重组凝集素蛋白包括过滤步骤。
24.根据第1至第23点中的任一方法,其中宿主细胞是大肠杆菌。
25.根据第1至第24点中的任一方法,其中宿主细胞包含含有重组凝集素基因的表达载体。
26.根据第1至第25点中的任一方法,其中宿主细胞培养物的体积至少为10l。
27.根据第26点的所述方法,其中表达在工业发酵罐中进行。
sequencelisting
<110>unichemlaboratoriesltd
<120>animprovedprocessforthepreparationofrecombinantprotein
<130>pn835073wo
<160>5
<170>patentinversion3.5
<210>1
<211>141
<212>prt
<213>artificialsequence
<220>
<223>invitro
<400>1
thrtyrlysilethrvalargvaltyrglnthrasnproaspalaphe
151015
phehisprovalglulysthrvaltrplystyralaasnglyglythr
202530
trpthrilethraspaspglnhisvalleuthrmetglyglysergly
354045
thrserglythrleuargphehisalaaspasnglygluserphethr
505560
alathrpheglyvalhisasntyrlysargtrpcysaspilevalthr
65707580
asnleualaalaaspgluthrglymetvalileasnglnglntyrtyr
859095
serglnlysasnarggluglualaarggluargglnleuserasntyr
100105110
glnvallysasnalalysglyargasnpheglnilevaltyrthrglu
115120125
alagluglyasnaspleuhisalaasnleuileilegly
130135140
<210>2
<211>141
<212>prt
<213>artificialsequence
<220>
<223>invitro
<400>2
thrtyrlysilethrvalargvaltyrglnthrasnproasnalaphe
151015
phehisprovalglulysthrvaltrplystyralaasnglyglythr
202530
trpthrilethraspaspglnhisvalleuthrmetglyglysergly
354045
thrserglythrleuargphehisalaaspasnglygluserphethr
505560
alathrpheglyvalhisasntyrlysargtrpcysaspilevalthr
65707580
asnleualaalaaspgluthrglymetvalileasnglnglntyrtyr
859095
serglnlysasnarggluglualaarggluargglnleuserasntyr
100105110
gluvallysasnalalysglyargasnphegluilevaltyrthrglu
115120125
alagluglyasnaspleuhisalaasnleuileilegly
130135140
<210>3
<211>141
<212>prt
<213>artificialsequence
<220>
<223>invitro
<400>3
valtyrlysilethrvalargvaltyrglnthrasnproaspalaphe
151015
phehisprovalglulysthrvaltrplystyralaasnglyglythr
202530
trpserilethraspaspglnhisvalleuthrmetglyglysergly
354045
thrserglythrleuargphehisalaaspasnglygluserphethr
505560
alathrpheglyvalhisasntyrlysargtrpcysaspilevalthr
65707580
asnleualaalaaspgluthrglymetvalileasnglnglntyrtyr
859095
serglnlysasnarggluglualaarggluargglnleuserasntyr
100105110
glnvallysasnalalysglyargasnpheglnilevaltyrthrglu
115120125
alagluglyasnaspleuhisalaasnleuileilegly
130135140
<210>4
<211>141
<212>prt
<213>artificialsequence
<220>
<223>invitro
<400>4
valtyrlysilethrvalargvaltyrglnthrasnproaspalaphe
151015
phehisprovalglulysthrvaltrplystyralaaspglyglythr
202530
trpserilethraspaspglnhisvalleuthrmetglyglysergly
354045
thrserglythrleuargphehisalaaspasnglygluserphethr
505560
alathrpheglyvalhisasptyrlysargtrpcysaspilevalthr
65707580
aspleualaalaaspgluthrglymetvalileasnglnglutyrtyr
859095
serglulysasparggluglualaarggluargglnasnserasntyr
100105110
gluvallysaspalalysglyargasnphegluilevaltyrthrglu
115120125
alagluglyasnaspleuhisalaaspleuileilegly
130135140
<210>5
<211>426
<212>dna
<213>artificialsequence
<220>
<223>invitro
<400>5
atgacctataaaattaccgtgcgcgtgtatcagaccaacccggatgcctttttccatccg60
gtggaaaaaaccgtgtggaaatatgcgaatggcggtacctggacgattacggatgatcag120
catgtgctgacgatgggtggtagcggtaccagcggcaccctgcgttttcacgcagataat180
ggcgaaagcttcaccgccacctttggtgtgcataattataaacgctggtgtgatattgtg240
accaacctggcagcggatgaaaccggcatggttattaatcagcagtattatagtcagaaa300
aaccgcgaagaagcgcgtgaacgccagctgagtaactatcaggtgaaaaatgcgaaaggc360
cgtaacttccagattgtttataccgaagcggaaggcaatgatctgcatgcgaacctgatt420
atcggc426
- 还没有人留言评论。精彩留言会获得点赞!