经修饰的AOX1启动子变体
经修饰的aox1启动子变体
技术领域
1.本发明涉及原创的醇氧化酶1(aox1)基因启动子变体,其已被增强或具有重新设计的调控机制,凭借启动子工程化设计,其使用乙醇作为唯一的碳源和能源。
背景技术:
2.生产过程的生产率是工业生物技术应用中的重要标准。宿主微生物能够产生所需重组蛋白的能力取决于启动子结构。启动子基因是在启动子结构内的dna核苷酸序列,其引发并持续进行重组蛋白的合成,并且是蛋白表达所必需的上游dna元件。启动子基因上可用的转录因子结合位点的数量、品质、功能位置以及与这些位置结合的转录因子及它们之间的相互作用是启动子结构的基本组成部分。启动子基因的强度决定了宿主细胞的重组蛋白生产能力。理想的重组蛋白生产系统是在强且受调控的启动子基因下以受控方式进行高产量生产的系统。受调控的启动子使细胞生长阶段和重组蛋白产生阶段能够彼此分离,从而增强了该过程的控制潜力。此外,通过将这两个阶段分离,还防止了重组蛋白在生物反应器中的积累对细胞生长及其活力的负面影响。
3.使用酵母巴斯德毕赤酵母(p.pastoris)进行重组蛋白的工业化生产始于1981年,在最近10年中,对该酵母进行了大量研究。饲料工业中使用的植酸酶(phytex,sheridan,in,usa)、蛋白质组学研究用的胰蛋白酶(roche applied science,德国)、水分析和处理用的硝酸还原酶(the nitrate elimination co.,lake linden,mi,usa)、用于植物油脱胶的磷脂酶c(verenium,san diego,ca,usa/dsm,荷兰)、用于保健研究和用作真皮填充剂的胶原蛋白(fibrogen,san francisco,ca,usa)和蛋白酶k(thermo scientific,waltham,ma,usa)是现有技术中已经在用巴斯德毕赤酵母生产的重组蛋白(ahmad等,2014)。fda(美国)批准的首个生物制药产品(艾卡拉肽)已于2009年上市销售。用巴斯德毕赤酵母生产的也已获得fda和ema(eu)的批准;开发生物药物新的生产方法的研究及其批件申请仍在继续。
4.巴斯德毕赤酵母是一种甲醇营养型酵母,其可以使用甲醇作为唯一碳源来生长。由于其甲醇营养特性,甲醇利用途径中的基因大量表达,并且已从该甲醇利用途径中获得了巴斯德毕赤酵母最常用的强aox1启动子p
aox1
。aox1酶催化甲醇氧化为甲醛,这是利用甲醇的第一步。aox1启动子(p
aox1
)在甲醇的存在下被强烈诱导,并被不同的碳源(例如乙醇、葡萄糖和甘油)抑制。然而,用甲醇(一种有毒的醇)来诱导p
aox1
会导致生物过程操作中的风险,并且食品和制药业中所生产的重组蛋白中可能存在甲醇残留的可能性限制了该启动子的使用。由于要在食品工业中使用的重组蛋白产品的提纯成本一直在增加,食品工业中纯度水平不高的粗制酶的普遍使用限制了甲醇的使用。美国国家职业安全与健康研究所(niosh)允许的工作环境甲醇极限限值(tlv)为200ppm,而乙醇的该限值为1000ppm。此外,甲醇的致死剂量为0.3
‑
1g/kg,而乙醇的致死剂量为7,060g/kg。乙醇是人类历史上最早生产的传统生物技术产品之一;而且由于它已在化学、制药和食品工业中使用多年,因此被认为是安全的,并且就安全过程应用而言,它不需要特殊的预防措施。
5.通过确定酵母巴斯德毕赤酵母基因组中的基因序列功能,已鉴定出了启动子基因,并且由于其工业潜力,野生型或经修饰的启动子基因序列已获得专利。
6.在现有技术的专利us 6,730,499 b1中,公开了用甲醇和/或甲胺诱导的巴斯德毕赤酵母甲醛脱氢酶(fld1)启动子。该专利提出,由于fld1启动子可以以与p
aox1
相当的水平进行生产,因此它可以替代p
aox1
。巴斯德毕赤酵母翻译延伸因子(tef)启动子基因和用该组成型启动子生产重组蛋白的方法已由专利us7816509b2保护。巴斯德毕赤酵母野生型adh1基因以及用该基因生产重组蛋白的方法已获得专利,专利号为us8222386b2。酵母巴斯德毕赤酵母的调节型gut1(甘油激酶)启动子基因已获得专利,专利号为us8785613b2。
7.在现有技术的专利申请wo 2017/021541 a1中,描述了通过缺失、插入或替换突变而形成的巴斯德毕赤酵母高亲和力葡萄糖转运蛋白(gth1)基因启动子(pg1)变体(pg1
‑
x)。
8.巴斯德毕赤酵母das启动子变体已获得专利,专利号为us20110129874a1。这些变体是通过缺失一些启动子基因区域或插入一些位于启动子内部的上游激活序列(uas)基因元件而获得的。
9.突变体aox1启动子已获得专利,专利号为us9279129b2。在该研究中,已鉴定出位于启动子基因上的hap1、hsf、hap234、abaa、stre、rapt、adr1、mat1 mc、gcr1和qa
‑
1f的转录因子结合位点,并已缺失或重复这些序列以产生显示出野生型aox1启动子的6%至160%活性的aox1突变(hartner等,2008)。
10.本发明涉及已被增强的或具有经修饰的调控机制的原创醇氧化酶1(aox1)基因启动子变体。
技术实现要素:
11.本发明的主要目的是提供一种用于在工业生物技术应用中在受控的生物加工条件下实现高产率的重组蛋白生产的遗传工具。实现高产率生物过程的最重要的遗传工具是强启动子。本发明的启动子变体是原创的aox1启动子变体,与野生型p
aox1
相比,所述变体在甲醇和乙醇诱导条件下均提供增强的生产能力。
12.本发明的启动子变体的基本优点是它们是强力且受调控的系统。除此之外,本发明的p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)和p
aox1
‑
mod
(p
maox1
)变体可用乙醇诱导,而乙醇通常是野生型aox1启动子的阻遏物。乙醇对于食品和制药业而言提供重要优势,因为它是一种廉价的碳源,并且不会对生产过程中工作的人员造成毒性风险。
13.与工业中使用甲醇开发的生物过程的基于野生型aox1启动子的系统相比,本发明的启动子变体能够以更高的产率生产重组蛋白。通过用不同的碳源调控启动子的活性(开启)状态和非活性(关闭)状态而提供了高效的过程控制,使得能够提供过程要求,例如高产物收率、产物稳定性和细胞毒性蛋白的产生。本发明具有在工业生物技术过程中同时提供成本优势和时间优势的潜力。
附图说明
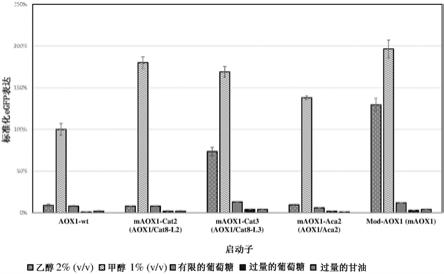
14.图1.用原创aox1启动子变体构建的巴斯德毕赤酵母菌株以及与之相比的用p
aox1
‑
wt
构建的细胞在不同的碳源下的egfp表达相对于用p
aox1
‑
wt
(%)
m
构建的细胞中的egfp表达标准化。
具体实施方式
15.本发明涉及乙醇和甲醇诱导条件下的巴斯德毕赤酵母醇氧化酶1(aox1)启动子变体,其在野生型巴斯德毕赤酵母aox1启动子(seq id no.1)的核苷酸1至840(
‑
940至
‑
100)内包含至少一个突变。
16.本发明的aox1启动子变体通过包括以下步骤的方法构建:通过替换位于aox1启动子的功能性靶区域中的核苷酸,整合在巴斯德毕赤酵母野生型aox1启动子上非天然存在的转录因子结合位点。
17.本发明所要求的两个方面是:
18.(i)对转录因子结合位点(tfbs)修饰的设计,以及
19.(ii)通过功能分析来选择要整合至巴斯德毕赤酵母aox1启动子中的位置。
20.设计启动子变体的巴斯德毕赤酵母醇氧化酶(aox1)启动子的方法还包括选自以下的突变:a)在核苷酸94至110(
‑
847至
‑
831)、141至160(
‑
800至
‑
781)、312至330(
‑
629至
‑
611)、355至380(
‑
586至
‑
561)、501至521(
‑
440至
‑
420)、640至658(
‑
301至
‑
283)、674至693(
‑
267至
‑
248)和1至840(
‑
940至
‑
100)中的任何位置,整合cat8转录因子结合位点(tfbs),特别是整合“ttccgttcgtccga”基因序列或与该序列具有至少80%相似性的其他基因序列;b)在核苷酸1至840(
‑
940至
‑
100)之间的任何位置,整合aca1或aca2 tfbs,特别是整合“gcctattgtagacgtcaaccc”核苷酸序列或与该序列具有至少80%的相似性的其他基因序列;c)在核苷酸94至693(
‑
847至
‑
248)内的由seq id no.2指定的突变,及其组合。
21.启动子变体的构建是通过核苷酸突变,即缺失、替换、插入和/或倒位来进行的。
22.生产过程的效率是工业生物技术应用中的重要标准。宿主微生物产生所需重组蛋白的能力取决于启动子结构。理想的生产系统是允许利用强且受调控的启动子基因以受控方式进行高产量生产的系统。受调控的启动子使细胞生长阶段和重组蛋白产生阶段能够彼此分离,从而增强了该过程的控制潜力。此外,通过将这两个阶段分离,还防止了重组蛋白的积累对细胞生长及活力的影响。
23.在巴斯德毕赤酵母中,通常使用aox1启动子系统p
aox1
。当使用p
aox1
时,需要将有毒的醇甲醇送入生物反应器中,这会带来风险。在食品和制药业生产的重组蛋白中可能残留甲醇,这限制了该方法的使用。乙醇是人类历史上最早生产的传统生物技术产品之一。由于乙醇已在化学、制药和食品工业中使用多年,因此认为它是无害的,并且就安全过程应用而言,它不需要特殊的预防措施。使用乙醇作为替代,本发明的p
aox1
‑
mod
(p
maox1
)和p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)能够分别提供甲醇诱导的野生型p
aox1
的生产能力的130%和74%。换句话说,虽然野生型p
aox1
被乙醇阻遏并且不显示任何活性,但是本发明的启动子变体p
aox1
‑
mod
(p
maox1
)和p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)能够用乙醇进行重组蛋白生产。由于乙醇是本发明的启动子变体p
aox1
‑
mod
(p
maox1
)和p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)的诱导剂,这增加了本发明的变体的工业意义,因为乙醇既廉价又具有无毒无害特性。
24.本发明的启动子变体的重要的新特征是它们比巴斯德毕赤酵母野生型aox1启动子(p
aox1
‑
wt
)更强,因此它们能够进行更高量的重组蛋白生产。与甲醇诱导下的巴斯德毕赤酵母野生型p
aox1
相比,本发明的启动子变体能够提供多出38%至97%的重组蛋白产量。自1981年以来,一直在用酵母巴斯德毕赤酵母进行甲醇诱导下的野生型p
aox1
控制的重组蛋白生产。与甲醇诱导条件下的野生型p
aox1
相比,本发明的所有启动子变体p
aox1
‑
mod
(p
maox1
)、
tfbs、adr1tfbs和aca1 tfbs。虽然野生型aox1启动子被乙醇阻遏,但所设计的p
aox1
‑
mod
(p
maox1
)变体在乙醇诱导下与用甲醇诱导的野生型p
aox1
获得的重组蛋白生产水平相比能够实现更高的重组蛋白生产能力。除此之外,p
aox1
‑
mod
(p
maox1
)启动子仍然保持了甲醇可诱导的性质,并且在用甲醇时,产量能够比野生型aox1启动子高97%。
31.启动子变体
‑
2设计:p
aox1
‑
cat2
(p
aox1/cat8
‑
l2
)(seq id no.3)
32.在p
aox1
‑
cat2
(p
aox1/cat8
‑
l2
)启动子变体设计中,位于野生型aox1启动子中启动子基因起始位置起第三列的mxr1(甲醇表达调控因子1)tfbs被替换为cat8 tfbs序列。在甲醇发酵中,该启动子变体的重组蛋白产量能够比野生型aox1启动子多80%。
33.启动子变体
‑
3设计:p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)(seq id no.4)
34.用cat8 tfbs序列置换位于野生型aox1启动子中启动子基因起始位置起第五列的mxr1 tfbs,由此构建了p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)启动子变体。aox1启动子的调控已因单个基因区域中的修饰而改变,虽然p
aox1
被乙醇阻遏,但用乙醇作为替代时,p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)能够发挥p
aox1
在甲醇下显示出的生产能力的74%。除此之外,与p
aox1
相比,它不会失去受甲醇调控的能力,并且在甲醇诱导下它可以提供比p
aox1
多69%的产量。
35.启动子变体
‑
4设计:p
aox1
‑
aca
(p
aox1/aca2
)(seq id no.5)
36.用非天然存在于野生型aox1启动子上的aca1/2tfbs进行整合而设计了启动子变体p
aox1
‑
aca
(p
aox1/aca2
)。在甲醇诱导下,p
aox1
‑
aca
(p
aox1/aca2
)的产量能够比p
aox1
高38%。
37.实施例
38.实施例1
39.材料与方法
40.实施例1.1
41.设计aox1启动子变体并与报告基因egfp基因一同克隆
42.使用两步重叠延伸聚合酶链反应(oe
‑
pcr)方法来构建aox1启动子变体,使用下表中给出的设计引物构建了p
aox1
‑
mod
(p
maox1
)、p
aox1
‑
cat2
(p
aox1/cat8
‑
l2
)、p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)和p
aox1
‑
aca
(p
aox1/aca2
)启动子变体。
43.44.表1:设计的引物核苷酸序列,用于将adr1、cat8和aca2 tfbs整合至所设计的启动子变体中并与将这些启动子变体与egfp一同克隆。
45.使用增强型绿色荧光蛋白(egfp)基因作为报告基因,来确定aox1启动子变体下的基因表达水平。使用上表中给出的引物,通过oe
‑
pcr方法扩增了egfp基因和aox1启动子变体基因。防止了启动子和egfp基因序列之间的任何核苷酸添加。使用合适的限制性酶消化经扩增的启动子变体和egfp基因片段,并通过连接反应将它们克隆至带有zeocin
tm
抗性基因和aox1转录终止子模块的载体。
46.将构建的质粒转化到已用氯化钙法制备的化学感受态大肠杆菌dh5α细胞中(sambrook和russell,2001)。使用含有zeocin
tm
的选择性lb琼脂培养基来选择推定的阳性克隆,并在分离质粒后,通过基因测序分析来验证所构建的重组载体。
47.实施例1.2
48.用带有启动子变体的重组载体转化巴斯德毕赤酵母并评估启动子变体的表达能力
49.根据制造商的建议,使用bglii限制性酶将含有aox1启动子变体和egfp报告基因的重组载体线性化,并用线性化的基因片段转染用氯化锂法制备的感受态巴斯德毕赤酵母x33细胞(invitrogen,2000)。再生后,将转化体接种到含有zeocintm的选择性ypd琼脂培养基中。转化后,通过菌落pcr来验证带有包含启动子变体基因和egfp报告基因的表达盒的推定克隆,并从每个菌株中选择至少10个个体用于评估启动子变体的生产能力。
50.所述表达盒包含至少一个aox1启动子变体和至少编码蛋白(肽)或功能性核苷酸的核酸分子,所述启动子变体和核酸分子形成单拷贝或多拷贝表达盒。这些核酸分子和启动子可操作地连接在一起。
51.携带zeocin
tm
抗性基因和aox1转录终止子模块的载体在表达盒中包含巴斯德毕赤酵母醇氧化酶1(aox1)启动子变体和至少一个核酸分子。
52.在25℃下将巴斯德毕赤酵母细胞在yp培养基(10g/l酵母提取物,20g/l蛋白胨)中以280rpm预培养20小时,然后转移到生产培养基中。在预培养结束时,离心收集细胞并转移至生产培养基中。为了评估启动子变体的表达能力,使用了分别包含5种不同的碳源的最小培养基(6.3g/l(nh4)2hpo4;0.8g/l(nh4)2so4;0.49g/l mgso4*7h2o;2.64g/l kcl;0.0535g/l cacl2*2h2o;22g/l柠檬酸一水合物;1.47ml/l ptm1;2ml/l生物素(0.2g/l);20ml nh4oh(25%))。下表列出了在生产试验中使用的不同底物和生产参数。将包含25%(v/v)m2p试剂盒多糖和0.7%(v/v)酶(m2p
‑
labs gmbh,德国)混合物的生产培养基用于有限的葡萄糖条件。
53.条件id初始od
600
值生产底物生产时间过量甘油g0.12g/l甘油20小时过量葡萄糖d0.12g/l甘油20小时有限的葡萄糖x1有限的葡萄糖浓度20小时甲醇m11%(v/v)甲醇20小时乙醇e12%(v/v)乙醇20小时
54.表2:为了用巴斯德毕赤酵母比较启动子变体的egfp生产能力而采用的生产测试参数。
55.在24深孔板(24深孔板,whatman,英国)中的2ml含不同碳源的生产培养基中,以280rpm的混合速度在25℃的温度下培养细胞20小时。在第20小时结束时,将巴斯德毕赤酵母细胞在磷酸盐缓冲盐溶液中稀释至od
600
值为0.4。
56.使用guava easycyte
tm
(millipore)流式细胞仪测量每单位细胞的平均egfp荧光,由此确定细胞内egfp产量值。在流式细胞仪中,在488nm激发egfp,并在525nm处收集发射值。在每次测量中,使用fsc和ssc值考虑了来自10,000个细胞的荧光信号,选择了定义图中酵母菌簇的细胞,并门控出在fsc
‑
h和fsc
‑
a值方面显示出线性回归的细胞,以选择单线态。使用基于门控出的群体的细胞体积和几何平均值的荧光强度来计算egfp荧光,由此确定细胞的特定egfp合成水平。与在1%(v/v)甲醇中的野生型p
aox1
‑
wt
下的egfp表达相比,计算了相对egfp表达水平。
57.这些细胞包含至少一个巴斯德毕赤酵母醇氧化酶1(aox1)启动子变体,至少一个表达盒和至少一个载体。所述细胞是真核细胞,特别是酵母细胞,优选甲醇营养型酵母细胞,优选选自由毕赤酵母属、念珠菌属、汉逊酵母属和球拟酵母属(toruplosis)组成的组的酵母细胞,尤其是巴斯德毕赤酵母细胞。
58.重组蛋白、肽或功能性核酸通过以下步骤表达;
59.·
生产aox1启动子变体,
60.·
通过添加egfp报告基因来产生表达盒,
61.·
生产重组载体启动子变体,
62.·
用重组载体转化真核细胞,特别是酵母细胞,优选甲醇营养型酵母细胞,优选选自由毕赤酵母属、念珠菌属、汉逊酵母属和球拟酵母属组成的组的酵母细胞,尤其是巴斯德毕赤酵母细胞,并在合适的培养基中培养转化的细胞,
63.·
优选地,进行所述蛋白、肽或功能性核酸分子的可诱导表达,
64.·
分离所产生的蛋白、肽或功能性核酸分子。
65.实施例2
66.结果
67.用摇瓶生物反应器实验测试了在本发明的启动子变体下的重组蛋白(egfp)产生。将所设计的启动子变体的生产能力与常用的巴斯德毕赤酵母p
aox1
‑
wt
进行比较,结果列于表3中。用3个巴斯德毕赤酵母生物重复品评估了不同碳源对启动子变体活性的影响,并由此评估对重组蛋白的生产效率的影响。下表中给出了启动子变体的生产率,将在1%(v/v)甲醇诱导下p
aox1
‑
wt
产生的egfp产量确定为100单位,并且变体的生产率相对于该值。
[0068][0069]
表3:在不同的碳源下所设计的p
aox1
变体在酵母巴斯德毕赤酵母中的egfp生产能力。e:2%(v/v)乙醇,m:1%(v/v)甲醇,x:有限的葡萄糖,d:过量葡萄糖(2g/l),g:过量甘油(2g/l)
[0070]
在补充有甲醇的成分确定的最小培养基中,与野生型aox1启动子相比,原创aox1
启动子变体的重组蛋白(egfp)生产能力显著提高。在甲醇发酵中,启动子变体p
aox1
‑
cat2
(p
aox1/cat8
‑
l2
)、p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)、p
aox1
‑
aca
(p
aox1/aca2
)和p
aox1
‑
mod
(p
maox1
)表现出的egfp产量分别比p
aox1
‑
wt
多80%、69%、38%和97%。除此之外,尽管乙醇阻遏p
aox1
‑
wt
并因此阻遏重组蛋白生产,但是本发明的原创启动子变体p
aox1
‑
cat3
(p
aox1/cat8
‑
l3
)和p
aox1
‑
mod
(p
maox1
)是乙醇可诱导的,并且在用乙醇作为替代性碳源和能源时,分别能够表现出甲醇诱导的p
aox1
‑
wt
的生产能力的74%和130%。虽然与p
aox1
‑
wt
相比所设计的启动子变体能够在乙醇或甲醇诱导下达到很高的生产能力,但它们仍保留了其在葡萄糖和甘油的存在下受到阻遏的可调控特性。在实验室规模条件下进行的重组蛋白生产实验证明了原创aox1启动子变体在生物技术过程中的工业潜力和重大意义。
[0071]
参考文献
[0072]
ahmad,m.,hirz,m.,pichler,h.,&schwab,h.(2014).protein expression in pichiapastoris:recent achievements and perspectives for heterologous protein production.applied microbiology and biotechnology,98(12),5301
‑
5317.
[0073]
cheng,c.,kacherovsky,n.,dombek,k.m.,camier,s.,thukral,s.k.,rhim,e.,young,e.t.,1994.identification of potential target genes for adr1p through characterization of essential nucleotides in uas1.mol.cell.biol.14,3842
–
52.
[0074]
hartner,f.s.,ruth,c.,langenegger,d.,johnson,s.n.,hyka,p.,et al.(2008).promoter library designed for fine
‑
tuned gene expression in pichiapastoris.nucleic acids research,36(12),e76
‑
e76.
[0075]
invitrogen(2010),easyselect
tm pichia expression kit for expression of recombinant proteins using ppicz and ppiczαin pichiapastoris
[0076]
roth,s.,kumme,j.,and sch
ü
ller,h.j.(2004).transcriptional activators cat8 and sip4 discriminate between sequence variants of the carbon source
‑
responsive promoter element in the yeast saccharomycescerevisiae.current genetics,45(3),121
‑
128.
[0077]
sambrook,j.,russell,d.w.(2001)“molecular cloning:a library manual”,3
rd
edn.,cold spring harbor library press,cold spring harbor,new york.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1