包含脂肪干细胞和明胶的生物材料及其制备方法与流程
包含脂肪干细胞和明胶的生物材料及其制备方法
发明领域
1.本发明涉及干细胞领域及其在多维生物材料生产中的用途。特别地,本发明涉及包含脂肪干细胞(asc)的生物材料、制备和使用这种生物材料用于治疗的方法。
2.发明背景
3.组织工程涉及通过使用活细胞来恢复组织结构或功能。一般过程包括细胞分离和增殖,然后是其中使用了支架材料的再植入程序。间充质干细胞提供了成熟组织细胞的良好替代品,并具有许多优势,例如可作为骨和软骨组织再生的细胞来源。
4.根据定义,干细胞的特征在于其能够进行自我更新并且能够进行多向分化并形成终末分化细胞。理想情况下,用于再生医学应用的干细胞应符合以下标准:(i)应大量存在(数百万个至数十亿个细胞);(ii)可以通过微创程序收集和收获;(iii)可沿着多个细胞谱系途径以可再生的方式进行分化;(iv)可以安全有效地移植到自体宿主或同种异体宿主中。
5.研究表明,干细胞具有分化为中胚层、内胚层和外胚层来源的细胞的能力。msc的可塑性通常是指保留在干细胞内的跨越谱系屏障并采用其他组织所特有的细胞的表型、生化和功能特性的固有能力。例如,可以从骨髓和脂肪组织中分离成体间充质干细胞。
6.脂肪干细胞具有多种功能,并具有深度再生能力。以下术语已用于标识相同的脂肪组织细胞群:脂肪干/基质细胞(asc);脂肪成体干细胞(adas)、脂肪成体基质细胞、脂肪来源的基质细胞(adsc)、脂肪基质细胞(asc)、脂肪间充质干细胞(admsc)、成脂肪细胞、周细胞、前脂肪细胞、脂肪组织提取细胞(pla)。使用这种多样化的命名法已导致文献上的重大混乱。为了解决这个问题,国际脂肪应用技术协会达成共识,采用术语“脂肪干细胞”(asc)来标识分离的、塑性黏附的多能细胞群。
7.组织重建包括骨和软骨重建,还包括真皮、表皮和肌肉重建。当前,每种组织缺损都应采用特定的治疗方法来治疗,每种方法都需要不同的发展。
8.因此,在本领域中仍然需要用于组织重建和/或再生的组织工程材料,该材料是完全生物相容的并且为指定的应用提供适当的机械特征,尽管可用于广泛的组织。因此,本发明涉及由分化成多维结构的asc与明胶制成的移植物。
技术实现要素:
9.本发明涉及具有多维结构的生物材料,该生物材料包括分化的脂肪干细胞(asc)、细胞外基质和明胶。
10.在一个实施方案中,明胶是猪明胶。在一个实施方案中,明胶为颗粒形式。在一个实施方案中,明胶的平均直径为约50μm至约1000μm,优选约75μm至约750μm,更优选约100μm至约500μm。
11.在一个实施方案中,生物材料是三维的。
12.在某些实施方案中,生物材料是可模塑的或可成形的。
13.在一个实施方案中,将asc分化为选自成骨细胞、软骨细胞、角质细胞、成肌纤维细
胞、内皮细胞和脂肪细胞的细胞。
14.本发明还涉及包含如上所述的多维生物材料的医疗装置或药物组合物。
15.本发明的另一个方面是一种用于生产如上所述的多维生物材料的方法,其包括以下步骤:
16.‑
使脂肪干细胞(asc)增殖,
17.‑
使第四代asc发生分化,和
18.‑
进行多维诱导,优选3d诱导。
19.本发明还涉及可通过如上所述的方法获得的多维生物材料。
20.本发明的另一个目的是如上所述的生物材料,其用于治疗组织缺损。在一个实施方案中,所述组织选自骨、软骨、真皮、表皮、肌肉、内皮和脂肪组织。
21.定义
22.在本发明中,以下术语具有以下含义:
23.‑
值之前的术语“约”表示为该值的正负10%。
24.‑
术语“脂肪组织”是指任意脂肪组织。脂肪组织可以是褐色或白色脂肪组织,其源自皮下、网膜/内脏、乳腺、性腺或其他脂肪组织位点。优选地,脂肪组织是皮下白色脂肪组织。这样的细胞可以包含原代细胞培养物或永生化细胞系。脂肪组织可以来自具有脂肪组织的任何活的或死的生物。优选地,脂肪组织是动物的,更优选地是哺乳动物的,最优选地,脂肪组织是人的。脂肪组织的方便来源是吸脂手术,但是,脂肪组织的来源或分离脂肪组织的方法对本发明不重要。
25.‑
如本文所用,术语“脂肪干细胞”是指脂肪组织的“非脂肪细胞”部分。细胞可以是新鲜的,也可以是培养中的。“脂肪干细胞”(asc)是指源自脂肪组织的基质细胞,其可以用作多种不同细胞类型的前体,例如但不限于脂肪细胞、骨细胞、软骨细胞的前体。
26.‑
术语“再生”或“组织再生”包括但不限于由本公开的asc生长、产生或重建新细胞类型或组织。在一个实施方案中,这些细胞类型或组织包括但不限于骨原细胞(例如成骨细胞)、软骨细胞、内皮细胞、心肌细胞、造血细胞、肝细胞、脂肪细胞、神经元细胞和肌管。在特定的实施方案中,术语“再生”或“组织再生”是指由本公开的asc产生或重建骨原细胞(例如成骨细胞)。
27.‑
如本文所用,术语“生长因子”是促进组织生长、细胞增殖、血管形成等的分子。在特定的实施方案中,术语“生长因子”包括促进骨组织的分子。
28.‑
如本文所用,术语“培养的”是指在体外、体内或离体环境中经历细胞分裂或未经历细胞分裂的一种或多于一种细胞。体外环境可以是本领域已知的适合于体外维持细胞的任何培养基,例如合适的液体培养基或琼脂。适用于细胞培养的体外环境的具体实例描述于culture of animal cells:a manual of basic techniques(3rd edition),1994,r.i.freshney(ed.),wiley
‑
liss,inc.;cells:a laboratory manual(vol.1),1998,d.l.spector,r.d.goldman,l.a.leinwand(eds.),cold spring harbor laboratory press;和animal cells:culture and media,1994,d.c.darling,s.j.morgan john wiley and sons,ltd.中。
29.‑
术语“汇合度”是指细胞培养表面(例如培养皿或培养瓶)中贴壁细胞的数量,即,被细胞覆盖的表面的比例。汇合度为100%表示表面完全被细胞覆盖。在一个实施方案中,
表述“细胞达到汇合”或“细胞是汇合的”是指细胞覆盖表面的80%至100%。在一个实施方案中,表述“细胞亚汇合”是指细胞覆盖了表面的60%至80%。在一个实施方案中,表述“细胞过度汇合”是指细胞覆盖至少100%的表面和/或100%汇合度下持续数小时或数天。
30.‑
术语“冷藏”是指以低于对象正常生理温度的温度进行的治疗。例如,在约
‑
196℃至约+32℃选择一个或多于一个温度,持续延长的时间段,例如至少约一个小时、至少约一天、至少约一周、至少约4周、至少约6个月等。在一个实施方案中,“冷藏”是指在低于0℃的温度下进行处理。冷藏可以手动进行,或者优选地使用能够执行冷藏程序的专门设备来进行。在一个实施方案中,术语“冷藏”包括本领域中称为“冷冻”和“深低温保藏”的方法。技术人员将理解,冷藏方法可包括其他步骤,包括为此目的添加试剂。
31.‑
如本文所用,术语“非胚胎细胞”是指未从胚胎分离的细胞。非胚胎细胞可以分化或不分化。非胚胎细胞可以指几乎任何体细胞,例如从动物子宫外分离的细胞。这些实例并不意味着是限制性的。
32.‑
如本文所用,术语“分化的细胞”是指已从非特异性表型发展为特异性表型的前体细胞。例如,脂肪干细胞可以分化为骨原细胞。
33.‑
如本文所用,术语“分化培养基”是指在本发明的培养系统中用于产生分化细胞的化合物的集合之一。化合物的作用方式无限制。例如,该试剂可以通过诱导或协助表型的改变,促进具有特定表型的细胞的生长或阻止其他表型的生长来辅助分化过程。它也可以作为可能在培养基中的或由细胞群合成的其他因子的抑制剂,否则其他因子将导致分化为不期望的细胞类型的分化途径。
34.‑
术语“处理”、“治疗”或“缓解”是指其中目的是预防或减缓(减轻)骨缺损的治疗性治疗。需要治疗的患者包括已经患有该疾病的患者以及易于患该疾病的患者或待预防骨缺损的患者。如果对象在接受根据本发明的方法的治疗量的生物材料后,患者表现出以下一种或多于一种情况的可观察到的和/或可测量的减少或缺失时,则成功地“治疗”了对象的骨缺损:减少了骨缺损和/或在某种程度上缓解了与骨缺损有关的一种或多于一种症状;降低发病率和死亡率,并改善生活质量问题。可以通过医师熟悉的常规程序容易地测量用于评估疾病的成功治疗和改善的上述参数。
35.在所公开的生物材料的治疗用途中,“同种异体”疗法中,供体和受体是同一物种的不同个体,而“自体”疗法中,供体和受体是同一个体,并且在“异种”疗法中,供体来源于与受体不同物种的动物。
36.‑
术语“有效量”是指足以产生有益或期望结果,包括临床结果的量。有效量可以施用一次或多于一次。
37.‑
术语“对象”是指哺乳动物,优选人。对象的实例包括人、非人灵长类、狗、猫、小鼠、大鼠、马、牛及其转基因物种。在一个实施方案中,对象可以是“患者”,即温血动物,更优选为人,他/她/它在等待接收或正在接受医疗护理,或曾经/正在/将要成为医疗手术的目标,或被监测疾病的发展。在一个实施方案中,对象是成年人(例如18岁以上的人类对象)。在另一个实施方案中,对象是儿童(例如18岁以下的人类对象)。在一个实施方案中,对象是男性/雄性。在另一个实施方案中,所述对象是女性/雌性。
38.‑
术语“生物相容的”是指与诸如细胞、细胞培养物、组织或生物体的生物系统相容的无毒材料。
具体实施方式
39.本发明涉及具有多维结构的生物材料,该生物材料包含脂肪干细胞(asc)、细胞外基质和明胶。
40.如本文中所使用的,术语“具有多维结构的生物材料”可以在整个本发明中被术语“多维生物材料”代替。
41.在一个实施方案中,细胞是从脂肪组织中分离出来的,在下文中被称为脂肪干细胞(asc)。
42.在一个实施方案中,asc组织是动物来源的,优选哺乳动物来源的,更优选人来源的。因此,在一个实施方案中,asc为动物asc,优选为哺乳动物asc,更优选为人asc。在优选的实施方案中,asc是人asc。
43.从脂肪组织中分离干细胞的方法在本领域中是已知的,并且例如在zuk等人(tissue engineering.2001,7:211
‑
228)中公开。在一个实施方案中,通过吸脂从脂肪组织分离asc。
44.作为实例,可以通过穿刺活检或吸脂术吸取来收集脂肪组织。可以首先通过用磷酸盐缓冲液(pbs)全面地洗涤组织样品来从脂肪组织中分离asc,磷酸盐缓冲盐水(pbs)任选包含抗生素,例如1%青霉素/链霉素(p/s)。然后将样品置于具有胶原酶的无菌组织培养板中以进行组织消化(例如,在含2%p/s的pbs中的i型胶原酶),并在37℃,5%co2下孵育30分钟。胶原酶活性可以通过添加培养基(例如含有10%血清的dmem)中和。分解后,可以将样品转移到试管中。通过离心样品(例如,以2000rpm的速度离心5分钟)获得包含asc的基质血管级分(svf)。为完成基质细胞与原代脂肪细胞的分离,可大力振摇样品以彻底破坏团粒并混合细胞。可以重复离心步骤。旋转并吸出胶原酶溶液后,可将团粒重悬于裂解缓冲液中,在冰上孵育(例如10分钟)、洗涤(例如用pbs/2%p/s)并离心(例如以2000rpm离心5分钟)。然后可以吸出上清液,将细胞团粒重悬于培养基(例如基质培养基,即α
‑
mem,补充有20%fbs、1%l
‑
谷氨酰胺和1%p/s)中,并过滤细胞悬浮液(例如,通过70μm细胞过滤器)。最终可以将含有细胞的样品涂布在培养板上,并在37℃,5%co2下孵育。
45.在一个实施方案中,本发明的asc从脂肪组织的基质血管级分分离。在一个实施方案中,脂肪吸取物可以在室温下保持数小时,或在使用前在+4℃下保持24小时,或在0℃以下,例如
‑
18℃下长期保存。
46.在一个实施方案中,asc可以是新鲜的asc或冷藏的asc。新鲜的asc是未经冷藏处理的分离的asc。冷藏asc是经过冷藏处理的分离的asc。在一个实施方案中,冷藏处理是指低于0℃的任何处理。在一个实施方案中,可在
‑
18℃、
‑
80℃或
‑
180℃下进行冷藏处理。在具体的实施方案中,所述冷藏处理可以是超低温保藏。
47.作为冷藏处理的一个实例,可以在约80%至90%汇合度时收获asc。经过洗涤和从培养皿上分离的步骤后,可以在室温下用冷藏保存介质沉淀细胞并放入小瓶中。在一个实施方案中,冷藏保存介质包含80%的胎牛血清或人血清、10%的二甲基亚砜(dmso)和10%的dmem/ham’s f
‑
12。然后,将小瓶在
‑
80℃下保存过夜。例如,可以将小瓶放置在酒精冷冻容器中,将小瓶以每分钟约1℃的速度缓慢冷却,直到达到
‑
80℃。最后,可以将冷冻的小瓶转移到液氮容器中进行长期保存。
48.在一个实施方案中,asc是分化的asc。在一个实施方案中,将asc分化为选自成骨
细胞、软骨细胞、角质细胞、内皮细胞、成肌纤维细胞和脂肪细胞的细胞。在另一个实施方案中,将asc分化为选自成骨细胞、软骨细胞、角质细胞、内皮细胞和成肌纤维细胞的细胞。在另一个实施方案中,将asc分化为选自成骨细胞、软骨细胞、角质细胞和成肌纤维细胞的细胞。在另一个实施方案中,将asc分化为选自成骨细胞、软骨细胞、角质细胞和内皮细胞的细胞。在另一个实施方案中,将asc分化为选自成骨细胞、软骨细胞和角质细胞的细胞。在另一个实施方案中,将asc分化为选自成骨细胞和软骨细胞的细胞。
49.在一个实施方案中,asc是成骨分化的acs。换句话说,在优选的实施方案中,asc分化为骨原细胞。换句话说,在优选的实施方案中,asc是在成骨培养基中分化的。在特定的实施方案中,asc分化为成骨细胞。
50.控制和评估成骨分化的方法是本领域已知的。例如,本发明的细胞或组织的骨分化的评估可以通过骨钙素和/或磷酸盐的染色(例如用冯库萨染色);通过对磷酸钙进行染色(例如用茜素红);通过磁共振成像(mri);通过测量矿化基质的形成;或通过测量碱性磷酸酶活性来进行。
51.在一个实施方案中,通过在成骨分化培养基(md)中培养asc来进行asc的成骨分化。
52.在一个实施方案中,成骨分化培养基包含人血清。在特定的实施方案中,成骨分化培养基包含人血小板裂解物(hpl)。在一个实施方案中,成骨分化培养基不包含任何其他动物血清,优选除人血清之外不包含其他血清。
53.在一个实施方案中,成骨分化培养基包含或组成为补充有地塞米松、抗坏血酸和磷酸钠的增殖培养基。在一个实施方案中,成骨分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。在一个实施方案中,所有培养基均不含动物蛋白。
54.在一个实施方案中,增殖培养基可以是本领域普通技术人员已知的设计为支持细胞生长的任意培养基。如本文所用,增殖培养基也称为“生长培养基”。生长培养基的实例包括但不限于mem、dmem、imdm、rpmi1640、fgm或fgm
‑
2、199/109培养基、hamf10/hamf12或mccoy’s 5a。在一个优选的实施方案中,增殖培养基是dmem。
55.在一个实施方案中,成骨分化培养基包含或组成为补充有l
‑
丙氨酰
‑
l
‑
谷氨酰胺(ala
‑
gln,也称为或)、hpl、地塞米松、抗坏血酸和磷酸钠的dmem。在一个实施方案中,成骨分化培养基包含或组成为补充有l
‑
丙氨酰
‑
l
‑
谷氨酰胺、hpl、地塞米松、抗坏血酸和磷酸钠的dmem、青霉素、链霉素和两性霉素b。
56.在一个实施方案中,成骨分化培养基包含或组成为补充有l
‑
丙氨酰
‑
l
‑
谷氨酰胺、hpl(约5体积/体积%)、地塞米松(约1μm)、抗坏血酸(约0.25mm)和磷酸钠(约2.93mm)的dmem。在一个实施方案中,成骨分化培养基包含或组成为补充有l
‑
丙氨酰
‑
l
‑
谷氨酰胺、hpl(约5体积/体积%)、地塞米松(约1μm)、抗坏血酸(约0.25mm)和磷酸钠(约2.93mm)的dmem、青霉素(约100u/ml)和链霉素(约100μg/ml)。在一个实施方案中,成骨分化培养基还包含两性霉素b(约0.1%)。
57.在另一个实施方案中,asc是成软骨分化的asc。换句话说,在优选的实施方案中,asc分化为成软骨细胞。换句话说,在优选的实施方案中,asc是在成软骨培养基中分化的。在特定的实施方案中,asc分化为软骨细胞。
58.控制和评估成软骨分化的方法是本领域已知的。例如,本发明的细胞或组织的成
软骨分化可以通过阿尔辛蓝染色来评估。
59.在一个实施方案中,通过在成软骨分化培养基中培养asc来进行成软骨分化。
60.在一个实施方案中,成软骨分化培养基包含或组成为dmem、hpl、丙酮酸钠、its、脯氨酸、tgf
‑
β1和地塞米松。在一个实施方案中,成软骨分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。
61.在一个实施方案中,成软骨分化培养基包含或组成为dmem、hpl(约5体积/体积%)、地塞米松(约1μm)、丙酮酸钠(约100μg/ml)、its(约1x)、脯氨酸(约40μg/ml)和tgf
‑
β1(约10ng/ml)。
62.在另一个实施方案中,asc是成角质分化的asc。换句话说,在优选的实施方案中,asc分化为成角质细胞。换句话说,在优选的实施方案中,asc是在成角质培养基中分化的。在一个特定的实施方案中,asc分化为角质细胞。
63.控制和评估成角质分化的方法是本领域已知的。例如,本发明的细胞或组织的成角质分化可以通过广谱角蛋白(pankeratin)或cd34染色来评估。
64.在一个实施方案中,通过在成角质分化培养基中培养asc来进行向角质细胞的分化。
65.在一个实施方案中,成角质分化培养基包含或组成为dmem、hpl、胰岛素、kgf、hegf、氢化可的松和cacl2。在一个实施方案中,成角质分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。
66.在一个实施方案中,成角质分化培养基包含或组成为dmem、hpl(约5体积/体积%)、胰岛素(约5μg/ml)、kgf(约10ng/ml)、hegf(约10ng/ml)、氢化可的松(约0.5μg/ml)和cacl2(约1.5mm)。
67.在另一个实施方案中,asc是成内皮分化的asc。换句话说,在优选的实施方案中,asc是在成内皮培养基中分化的。在特定的实施方案中,asc分化为内皮细胞。
68.控制和评估成内皮分化的方法是本领域已知的。例如,本发明的细胞或组织的成内皮分化可以通过cd34染色来评估。
69.在一个实施方案中,通过在成内皮分化培养基中培养asc来进行向内皮细胞的分化。
70.在一个实施方案中,成内皮分化培养基包含或组成为ebmtm
‑
2培养基、hpl、hegf、vegf、r3
‑
igf
‑
1、抗坏血酸、氢化可的松和hfgfb。在一个实施方案中,成内皮分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。
71.在一个实施方案中,成内皮分化培养基包含或组成为ebmtm
‑
2培养基、hpl(约5体积/体积%)、hegf(约0.5ml)、vegf(约0.5ml)、r3
‑
igf
‑
1(约0.5ml)、抗坏血酸(约0.5ml)、氢化可的松(约0.2ml)和hfgfb(约2ml)、试剂盒clonetics
tm
egm
tm
‑
2mv bulletkit
tm
cc
‑
3202(lonza)的试剂。
72.在另一个实施方案中,asc是成肌纤维分化的asc。换句话说,在优选的实施方案中,asc分化为肌纤维形成细胞。换句话说,在优选的实施方案中,asc是在成肌纤维培养基中分化的。在特定的实施方案中,asc分化为成肌纤维细胞。
73.控制和评估成肌纤维分化的方法是本领域已知的。例如,本发明的细胞或组织的成肌纤维分化可以通过α
‑
sma染色来评估。
74.在一个实施方案中,通过在肌纤维形成分化培养基中培养asc来进行向成肌纤维细胞的分化。
75.在一个实施方案中,成肌纤维分化培养基包含或组成为dmem:f12、丙酮酸钠、its、rpmi 1640维生素、tgf
‑
β1、谷胱甘肽、mem。在一个实施方案中,成肌纤维分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。
76.在一个实施方案中,成肌纤维分化培养基包含或组成为dmem:f12、丙酮酸钠(约100μg/ml)、its(约1x)、rpmi 1640维生素(约1x)、tgf
‑
β1(约1ng/ml)、谷胱甘肽(约1μg/ml)、mem(约0.1mm)。
77.在另一个实施方案中,asc是成脂分化的asc。换句话说,在优选的实施方案中,asc分化为成脂细胞。换句话说,在优选的实施方案中,asc是在成脂培养基中分化的。在特定的实施方案中,asc分化为脂肪细胞。
78.控制和评估成脂分化的方法是本领域已知的。例如,本发明的细胞或组织的成脂分化可以通过油红染色来评估。
79.在一个实施方案中,通过在成脂分化培养基中培养asc来进行向脂肪细胞的分化。
80.在一个实施方案中,成脂分化培养基包含或组成为dmem、hpl、地塞米松、胰岛素、吲哚美辛和ibmx。在一个实施方案中,成脂分化培养基还包含抗生素,例如青霉素、链霉素、庆大霉素和/或两性霉素b。
81.在一个实施方案中,成脂分化培养基包含或组成为dmem、hpl(约5%)、地塞米松(约1μm)、胰岛素(约5μg/ml)、吲哚美辛(约50μm)和ibmx(约0.5mm)。
82.在一个实施方案中,asc是晚期传代的脂肪干细胞。如本文所用,术语“晚期传代”是指至少在4代之后分化的脂肪干细胞。如本文所用,4代是指第四代,即在将细胞重悬于新鲜培养基之前,第四次通过将细胞从培养容器的表面上分离来分裂细胞。在一个实施方案中,晚期传代的脂肪干细胞在4代、5代、6代或多于6代之后分化。在优选的实施方案中,在4代之后分化asc。
83.原代细胞的初代称为0代(p0)。根据本发明,p0代是指来自沉淀的基质血管级分(svf)中的细胞悬浮液接种到培养容器上。因此,p4代是指将细胞从培养皿表面(在p1、p2、p3和p4)分离4次(例如,用胰蛋白酶消化),然后重悬在新鲜培养基中。
84.在一个实施方案中,本发明的asc在增殖培养基中培养直至第四代。在一个实施方案中,本发明的asc在第四次传代后在分化培养基中培养。因此,在一个实施方案中,在p1代、p2代和p3代,将asc从培养容器的表面分离,然后在增殖培养基中稀释至合适的细胞密度。仍然根据该实施方案,在p4代,将asc从培养容器的表面分离,然后在分化培养基中稀释至合适的细胞密度。因此,根据该实施方案,在p4,本发明的asc在分化前(即在分化培养基中培养之前)达到汇合之前,不在增殖培养基中进行重悬和培养,而是直接重悬并在分化培养基中培养。
85.在一个实施方案中,将细胞保持在分化培养基中至少直至它们达到汇合,优选70%至100%汇合度,更优选80%至95%汇合度。在一个实施方案中,将细胞在分化培养基中维持至少5天,优选至少10天,更优选至少15天。在一个实施方案中,将细胞在分化培养基中维持5天至30天,优选10天至25天,更优选15天至20天。在一个实施方案中,每2天更换分化培养基。然而,如本领域中已知的,一个供体与另一个供体的细胞生长速率可能略有不
同。因此,分化的持续时间和更换培养基的次数可能因供体而异。
86.在一个实施方案中,取决于所使用的分化培养基,将细胞维持在分化培养基中至少直至形成不同的组织。
87.例如,可以将细胞保持在成骨分化培养基中至少直到形成类骨质,即在骨组织成熟之前形成的骨基质的未矿化的有机部分。
88.培养参数例如温度、ph、o2含量、co2含量和盐度可以根据现有技术中可用的标准方案进行调节。
89.在一个实施方案中,本发明的明胶是猪明胶。如本文所用,术语“猪明胶”可以由“猪肉明胶”或“猪的明胶”代替。在一个实施方案中,明胶是猪皮明胶。
90.在一个实施方案中,本发明的明胶为颗粒、珠、球、微球等形式。
91.在一个实施方案中,本发明的明胶未构造成形成预定的3d形状或支架,例如立方体。在一个实施方案中,本发明的明胶不具有预定的形状或支架。在一个实施方案中,本发明的明胶不具有立方体的形式。在一个实施方案中,明胶,优选猪明胶,不是3d支架。在一个实施方案中,本发明的生物材料是无支架的。
92.在一个实施方案中,本发明的明胶是大孔微载体。
93.猪明胶颗粒的实例包括但不限于g、s、spongostan和cutanplast。在一个实施方案中,本发明的明胶是g或s。
94.在一个实施方案中,本发明的明胶,优选猪明胶的平均直径为至少约50μm,优选为至少约75μm,更优选为至少约100μm,更优选为至少约130μm。在一个实施方案中,本发明的明胶,优选猪明胶的平均直径为至多约1000μm,优选至多约750μm,更优选至多约500μm。在另一个实施方案中,本发明的明胶,优选猪明胶的平均直径为至多约450μm,优选至多约400μm,更优选至多约380μm。
95.在一个实施方案中,本发明的明胶,优选猪明胶的平均直径为约50μm至约1000μm,优选约75μm至约750μm,更优选约100μm至约500μm。在另一个实施方案中,本发明的明胶,优选猪明胶的平均直径为约50μm至约500μm,优选为约75μm至约450μm,更优选为约100μm至约400μm。在另一个实施方案中,本发明的明胶,优选猪明胶的平均直径为约130μm至约380μm。
96.评估根据本发明的明胶颗粒的平均直径的方法是本领域已知的。这样的方法的实例包括但不限于粒度分析法,特别是使用合适的筛的粒度分析法;沉积测量法;离心技术;激光衍射;以及图像分析,特别是通过带有远心透镜的高性能相机进行的图像分析等。在一个实施方案中,对于150cm2的容器,以约0.1cm3至约5cm3,优选约0.5cm3至约4cm3,更优选约0.75cm3至约3cm3的浓度添加明胶。在一个实施方案中,对于150cm2的容器,以约1cm3至约2cm3的浓度添加明胶。在一个实施方案中,对于150cm2的容器,以约1cm3、1.5cm3或2cm3的浓度添加明胶。
97.在一个实施方案中,对于150cm2的容器,以约0.1g至约5g,优选约0.5g至约4g,更优选约0.75g至约3g的浓度添加明胶。在一个实施方案中,对于150cm2的容器,以约1g至约2g的浓度添加明胶。在一个实施方案中,对于150cm2的容器,以约1g、1.5g或2g的浓度添加明胶。
98.在一个实施方案中,将本发明的明胶在细胞分化后添加到培养基中。在一个实施
方案中,将本发明的明胶在细胞亚汇合时添加到培养基中。在一个实施方案中,将本发明的明胶在当细胞过度汇合时添加到培养基中。在一个实施方案中,将本发明的明胶在细胞在分化后达到汇合时添加到培养基中。换句话说,在一个实施方案中,将本发明的明胶在细胞在分化培养基中达到汇合时添加到培养基中。在一个实施方案中,将本发明的明胶在p4之后至少5天,优选10天,更优选15天添加到培养基中。在一个实施方案中,将本发明的明胶在p4之后5天至30天,优选10天至25天,更优选15天至20天添加到培养基中。
99.在一个实施方案中,根据本发明的生物材料是二维的。在该实施方案中,本发明的生物材料可以形成小于1mm的薄膜。
100.在本发明的范围内,表述“小于1mm”包括0.99mm、0.95mm、0.9mm、0.8mm、0.75mm、0.7mm、0.6mm、0.5mm、0.4mm、0.3mm、0.2mm、0.1mm和小于0.1mm。在一些实施方案中,表述“小于”可以被表述“少于”所代替。
101.在另一个实施方案中,根据本发明的生物材料是三维的。在该实施方案中,本发明的生物材料可以形成厚度为至少1mm的厚膜。生物材料的大小可以与用途相适应。
102.在本发明的范围内,表述“至少1mm”包括1mm、1.2mm、1.3mm、1.5mm、1.6mm、1.75mm、1.8mm、1.9mm、2mm、2.25mm、2.5mm、2.75mm、3mm、3.5mm、4mm、4.5mm、5mm和大于5mm。在一些实施方案中,表述“至少1mm”可以被表述“等于或大于1mm”所代替。
103.在一个实施方案中,本发明的生物材料不包括支架。如本文所用,术语“支架”是指模拟天然哺乳动物组织,包括人和动物组织的孔隙率、孔径和/或功能的结构,例如模拟细胞外基质结构的天然哺乳动物骨或支架。这种支架的实例包括但不限于人造骨、胶原海绵、水凝胶,例如蛋白质水凝胶、肽水凝胶、聚合物水凝胶和木基纳米纤维素水凝胶等。在一个实施方案中,本发明的生物材料不包括人造骨。在一个实施方案中,本发明的生物相容性材料不是人造骨。在一个实施方案中,本发明的生物材料不包括人造真皮和/或表皮。在一个实施方案中,本发明的生物相容性材料不是人造真皮和/或表皮。
104.在一个实施方案中,本发明的多维生物材料不归于模仿天然细胞外基质结构的支架。在一个实施方案中,本发明的生物材料不包括模拟天然细胞外基质结构的支架。
105.在一个实施方案中,本发明的生物材料的多维是归于通过本发明的脂肪组织干细胞合成了细胞外基质。
106.在一个实施方案中,本发明的生物材料包含细胞外基质。在一个实施方案中,本发明生物材料的细胞外基质衍生自asc。
107.如本文所用,术语“细胞外基质”是指非细胞三维大分子网络。ecm的基质组分彼此结合以及与细胞黏附受体结合,从而形成在组织或本发明的生物材料中的细胞驻留于其中的复杂网络。
108.在一个实施方案中,本发明的细胞外基质包含胶原、蛋白聚糖/糖胺聚糖、弹性蛋白、纤连蛋白、层黏连蛋白和/或其他糖蛋白。在特定的实施方案中,本发明的细胞外基质包含胶原。在另一个特定的实施方案中,本发明的细胞外基质包含蛋白聚糖。在另一个特定的实施方案中,本发明的细胞外基质包含胶原和蛋白聚糖。在一个实施方案中,本发明的细胞外基质包含生长因子、蛋白聚糖、分泌因子、细胞外基质调节物和糖蛋白。
109.在一个实施方案中,本发明生物材料内的asc形成了组织,在本文中称为asc组织。
110.在一个实施方案中,asc组织是细胞化的互连组织。在一个实施方案中,生物相容
性材料,优选生物相容性颗粒,被整合在细胞化的互连组织中。在一个实施方案中,生物相容性材料,优选生物相容性颗粒,分散在asc组织内。
111.在一个实施方案中,本发明的生物材料的特征在于通过明胶形成的互连组织。在一个实施方案中,本发明的生物材料的特征在于明胶周围的矿化作用。
112.在一个实施方案中,当使用成骨分化培养基时,本发明的生物材料具有与具有骨钙素表达和矿化特性的真实骨相同的特性。根据该实施方案,本发明的生物材料包括骨细胞。还根据该实施方案,本发明的生物材料包含骨细胞和细胞外基质。还根据该实施方案,本发明的生物材料包含骨细胞和胶原。还根据该实施方案,本发明的生物材料包含骨基质。
113.在一个实施方案中,本发明的生物材料使得生物材料的细胞的分化达到终点,并且当植入时生物材料的表型将保持不变。
114.在一个实施方案中,本发明的生物材料包含生长因子。在一个实施方案中,本发明的生物材料包含vegf和/或sdf
‑
1α。
115.在一个实施方案中,根据本发明的生物材料是矿化的。如本文所用,术语“矿化”或“骨组织矿物质密度”是指每平方厘米由生物材料形成的骨或“骨样”组织的矿物质的量,也以百分比表示。因此,如本文所用,术语“矿化”或“骨组织矿物质密度”是指每平方厘米生物材料的矿物质的量,也以百分比表示。
116.评估生物材料的矿化度的方法是本领域已知的。此类方法的实例包括但不限于微型计算机断层扫描(微型ct)分析、成像质谱、钙黄绿素蓝染色、骨矿物质密度分布(bmdd)分析等。
117.在一个实施方案中,本发明生物材料的矿化随着生物材料的成熟度而增加。如本文所用,术语“生物材料的成熟度”是指用明胶培养的持续时间。换句话说,生物材料的成熟度对应于多维诱导的时间。
118.在一个实施方案中,本发明生物材料的矿化度小于1%。在一个实施方案中,在成骨分化培养基中的成熟度少于12周时获得小于1%的矿化度。在一个实施方案中,在成骨分化培养基中的成熟度少于或等于8周时获得小于1%的矿化度。
119.在一个实施方案中,本发明生物材料的矿化度为约1%至约20%,优选约1%至约15%,更优选约1%至约10%,甚至更优选约1%至约5%。在一个实施方案中,本发明生物材料的矿化度为约1%至约4%或3%。在本发明的范围内,表述“约1%至约20%”涵盖约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%和约20%。
120.在另一个实施方案中,本发明生物材料的矿化度为至少1%或1.24%。在一个实施方案中,在成骨分化培养基中的成熟度超过或等于12周时获得至少1%或2.24%的矿化度。
121.在另一个实施方案中,本发明生物材料的矿化度为至少2%、2.5%或2.77%。在一个实施方案中,在成骨分化培养基中的成熟度超过或等于25周时获得至少2%、2.5%或2.77%的矿化度
122.在一个特定的实施方案中,本发明的生物材料的矿化度为约0.07%。在另一个特定的实施方案中,本发明的生物材料的矿化度为约0.28%。在另一个特定的实施方案中,本发明的生物材料的矿化度为约0.33%。在另一个特定的实施方案中,本发明的生物材料的矿化度为约1.24%。在另一个特定的实施方案中,本发明的生物材料的矿化度为约2.77%。
123.本发明还涉及用于产生多维结构的方法,该多维结构包含分化的脂肪干细胞(asc)、细胞外基质和明胶。
124.在一个实施方案中,根据本发明的用于生产生物材料的方法包括以下步骤:
125.‑
使细胞增殖,
126.‑
使细胞分化,和
127.‑
进行多维诱导。
128.在一个实施方案中,根据本发明的用于生产生物材料的方法包括以下步骤:
129.‑
使asc增殖,
130.‑
使asc成骨分化,和
131.‑
进行3维诱导。
132.在一个实施方案中,根据本发明的用于生产生物材料的方法包括以下步骤:
133.‑
从对象中分离细胞,优选asc;
134.‑
使细胞,优选asc增殖,
135.‑
使增殖的细胞,优选asc分化,和
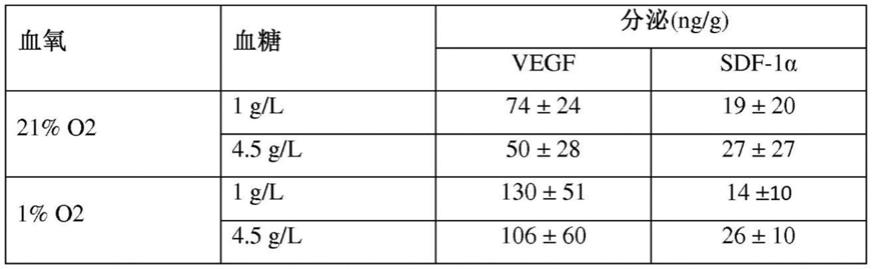
136.‑
在明胶的存在下培养分化的细胞,优选asc。
137.在一个实施方案中,用于生产本发明生物材料的方法还包括在细胞增殖步骤之前进行的分离细胞的步骤,所述细胞优选为asc。在一个实施方案中,用于生产本发明生物材料的方法还包括在细胞增殖步骤之前进行的分离细胞的步骤,所述细胞优选为asc。
138.在一个实施方案中,增殖步骤在增殖培养基中进行。在特定的实施方案中,增殖培养基是dmem。在一个实施方案中,增殖培养基补充有ala
‑
gln和/或人血小板裂解物(hpl)。在一个实施方案中,增殖培养基还包含抗生素,例如青霉素和/或链霉素。
139.在一个实施方案中,增殖培养基包含或组成为补充有ala
‑
gln和hpl(5%)的dmem。在一个实施方案中,增殖培养基包含或组成为补充有ala
‑
gln、hpl(5体积/体积%)、青霉素(100u/ml)和链霉素(100μg/ml)的dmem。
140.在一个实施方案中,增殖步骤如上所述进行。在一个实施方案中,增殖步骤进行至p8。在一个实施方案中,增殖步骤持续至p4、p5、p6、p7或p8。因此,在一个实施方案中,细胞增殖步骤包括至少3代。在一个实施方案中,细胞增殖步骤包括至多7代。在一个实施方案中,细胞增殖步骤包括3代至7代。在一个特定的实施方案中,增殖步骤进行至p4。因此,在一个实施方案中,细胞增殖步骤包括从培养容器的表面分离细胞,然后在传代p1、p2和p3中将它们在增殖培养基中进行稀释。在增殖至p6的实施方案中,细胞增殖的步骤包括从培养容器的表面分离细胞,然后在传代p1、p2、p3、p4和p5中将它们在增殖培养基中进行稀释。
141.在一个实施方案中,增殖步骤持续使细胞传代3次、4次、5次、6次或7次所必需的时间。在特定的实施方案中,增殖步骤持续使细胞传代3次所必需的时间。在一个实施方案中,增殖步骤持续到细胞在最后一次传代后达到汇合为止,优选70%至100%的汇合度,更优选80%至95%的汇合度。在一个实施方案中,增殖步骤持续到细胞在第三次、第四次、第五次、第六次或第七次传代后达到汇合为止。
142.在有利的实施方案中,本发明方法的关键步骤是在添加明胶之前在分化培养基中培养细胞,优选asc。这样的步骤对于使asc分化为骨原细胞是必需的。另外,该步骤对于获得多维结构是必需的。
143.在一个实施方案中,在p4、p5、p6、p7或p8之后进行分化步骤。在一个实施方案中,在细胞未汇合时进行分化步骤。在特定的实施方案中,在p4、p5、p6、p7或p8之后进行分化步骤,且无需培养至细胞汇合。
144.在一个实施方案中,在p4、p5、p6、p7或p8时进行分化步骤。在一个实施方案中,在细胞未汇合时进行分化步骤。在特定的实施方案中,在p4、p5、p6、p7或p8时进行分化步骤,且无需培养至细胞汇合。
145.在一个实施方案中,分化步骤是通过在分化培养基中孵育细胞来进行的。在一个实施方案中,分化步骤是通过在成骨、成软骨、成肌纤维或成角质的分化培养基中,优选在成骨、成软骨或成肌纤维的分化培养基中,更优选在成骨或成软骨的分化培养基中,更优选在成骨分化培养基中孵育细胞来进行的。在一个实施方案中,分化步骤是通过将从培养皿表面分离的细胞重悬于分化培养基中来进行的。
146.在一个实施方案中,在分化培养基中将asc孵育至少3天,优选至少5天,更优选至少10天,更优选至少15天。在一个实施方案中,在分化培养基中将asc孵育5天至30天,优选10天至25天,更优选15天至20天。在一个实施方案中,每2天更换分化培养基。在本发明的范围内,表述“至少3天”涵盖3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天和大于35天。
147.在一个实施方案中,通过在分化培养基中添加如上文所限定的明胶来进行多维诱导,优选3d诱导的步骤。在一个实施方案中,在多维诱导,优选3d诱导的步骤中,将细胞保持在分化培养基中。
148.在一个实施方案中,当细胞在分化培养基中达到汇合,优选70%至100%汇合度,更优选80%至95%汇合度时,进行多维诱导,优选3d诱导的步骤。
149.在另一个实施方案中,当出现形态变化时,进行多维诱导,优选3d诱导的步骤。在一个实施方案中,取决于所使用的分化培养基,当至少一种独特的组织出现时,进行多维诱导,优选3d诱导的步骤。例如,当使用成骨分化培养基时,且当形成至少一个类骨质节结时,进行多维诱导,优选3d诱导的步骤。如本文所用,术语“类骨质”是指在骨组织成熟之前形成的骨基质的未矿化的有机部分。
150.在另一个实施方案中,当细胞达到汇合时,进行多维诱导,优选3d诱导的步骤。
151.在一个实施方案中,将本发明的细胞和明胶孵育至少5天,优选至少10天,更优选至少15天。在一个实施方案中,将本发明的细胞和明胶孵育10天至30天。在本发明的范围内,表述“至少5天”涵盖5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天和大于35天。
152.在另一个实施方案中,将本发明的细胞和明胶孵育至少1周、2周、3周、4周、8周、12周、25周或34周。
153.在一个实施方案中,在多维诱导,优选3d诱导的步骤中,每2天更换一次培养基。
154.本发明还涉及可通过根据本发明的方法获得的多维生物材料。在一个实施方案中,多维生物材料是通过根据本发明的方法获得的。在一个实施方案中,多维生物材料是通过根据本发明的方法生产的。在一个实施方案中,可获得的或通过本发明的方法获得的生
物材料旨在植入人体或动物体内。在一个实施方案中,植入的生物材料可以是自体来源的或同种异体的。在一个实施方案中,本发明的生物材料可以被植入骨、软骨、真皮、肌肉、内皮或脂肪组织区域。在一个实施方案中,该生物材料可以被植入人体或动物体的不规则区域中。
155.在一个实施方案中,本发明的生物材料是均匀的,这意味着在整个组织中该生物材料的结构和/或构造是相似的。在一个实施方案中,该生物材料具有植入天然疾病区域所需的期望的处理和机械特性。在一个实施方案中,可获得的或通过本发明的方法获得的生物材料可以用外科器械拿起而不被撕裂。
156.本发明的另一个目的是一种医疗器械,其包括根据本发明的生物材料。
157.另一个目的是药物组合物,其包含根据本发明的生物材料和至少一种药学上可接受的载体。
158.本发明还涉及根据本发明生物材料或药物组合物,其用作药物。
159.本发明涉及本发明生物材料作为医疗装置或包括在医疗装置中或在药物组合物中的任何用途。在一些实施方案中,本发明的生物材料、医疗装置或药物组合物是腻子状材料,其可以在使用前进行操作和成型。
160.本发明还涉及包含分化的脂肪干细胞(asc)、细胞外基质和明胶的具有多维结构的生物材料、包含它们的医疗装置或药物组合物,其用于在有需要的对象中治疗组织缺损。
161.本发明的另一方面还涉及包含分化的脂肪干细胞(asc)、细胞外基质和明胶的具有多维结构的生物材料、包含它们的医疗装置或药物组合物用于治疗组织缺损的用途。本发明的又一个方面还涉及包含分化的脂肪干细胞(asc)、细胞外基质和明胶的具有多维结构的生物材料、包含它们的医疗装置或药物组合物用于制备或制造用于治疗组织缺损的药物的用途。
162.本发明进一步涉及一种在有需要的对象中治疗组织缺损的方法,该方法包括向对象施用治疗有效量的根据本发明的生物材料、医疗装置或药物组合物。
163.本发明的另一方面一种在有需要的对象中进行组织重建的方法,该方法包括向对象施用治疗有效量的根据本发明的生物材料、医疗装置或药物组合物。如本文所用,术语“组织重建”可以由“组织修复”或“组织再生”代替。
164.在一个实施方案中,术语“组织”包含或组成为骨、软骨、真皮、表皮、肌肉、内皮和脂肪组织。因此,在一个实施方案中,组织缺损包含或组成为骨、软骨、真皮、表皮、肌肉、内皮和脂肪组织缺损。
165.在一个实施方案中,组织重建选自骨重建、软骨重建、真皮重建、表皮重建、肌肉或肌源性重建、内皮重建和成脂重建。
166.骨和真皮和/或表皮重建的实例包括但不限于真皮重建、创面愈合、糖尿病溃疡治疗如糖尿病足溃疡治疗、烧伤后病变重建、放射后病变重建、乳腺癌或乳房畸形后的重建。
167.真皮和/或表皮重建的实例包括但不限于真皮重建、创面愈合、糖尿病溃疡治疗如糖尿病足溃疡治疗、烧伤后病变重建、放射后病变重建、乳腺癌或乳房畸形后的重建。
168.软骨重建的实例包括但不限于膝软骨重建、鼻或耳重建、肋骨或胸骨重建。
169.肌源性重建的例子包括但不限于骨骼肌重建、腹壁破裂后重建、下肢缺血性肌肉损伤后重建、与膜隔室综合征(cs)相关的重建。
170.内皮重建的实例包括但不限于用于血管吻合术例如静脉动脉硬化分流术的血管斑的再细胞化。
171.成脂重建的实例包括但不限于美学手术、嫩肤术、脂质填充重建。
172.申请人证明,在植入部位存在矿化组织的情况下,本发明的生物材料具有成骨性。
173.在一个特定方面,本发明涉及本发明的生物材料、医疗装置或药物组合物,其用于治疗骨缺损。在一个特定方面,本发明涉及本发明的生物材料、医疗装置或药物组合物,其用于骨重建。在一个实施方案中,本发明的生物材料用于用人体或动物体填充骨腔。
174.在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于治疗软骨缺损。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于治疗软骨重建。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于膝关节软骨成形术、鼻或耳的重建、肋骨或胸骨的重建。
175.申请人证明了本发明的生物材料具有更快的表皮和真皮重建、引起免疫应答和增加弹性蛋白纤维数量的优点。而且,在植入本发明的生物材料之后形成的疤痕不是肥厚性的。
176.在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于治疗真皮和/表皮缺损。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于真皮重建。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于皮肤重建。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于真皮重建、创面愈合、糖尿病溃疡治疗如糖尿病足溃疡治疗、烧伤后病变重建、放射后病变重建、乳腺癌或乳房畸形后的重建。在具体的实施方案中,本发明的生物材料、医疗装置或药物组合物用于治疗真皮创面,优选糖尿病性真皮创面。
177.在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于促进创面的闭合。在一个实施方案中,本发明的生物材料、医疗装置或药物组合物用于减少创面的厚度,特别是在创面愈合期间减少创面的厚度。
178.在特定实施方案中,本发明的生物材料、医疗装置或药物组合物用于治疗大疱性表皮松解症、先天性巨痣和/或先天性皮肤发育不良。
179.在另一个方面,本发明涉及本发明的生物材料、医疗装置或药物组合物用于重建或美容手术的用途。
180.在一个实施方案中,本发明的生物材料可以用作同种异体植入物或作为自体植入物。在一个实施方案中,本发明的生物材料可以用于组织移植。
181.在一个实施方案中,已经对对象进行了组织缺损的治疗。在另一个实施方案中,尚未对对象的组织缺损进行治疗。
182.在一个实施方案中,对象对用于组织缺损的至少一种其他治疗无反应。
183.在一个实施方案中,对象是糖尿病患者。在一个实施方案中,对象患有糖尿病性创面。
184.在一个实施方案中,对象是成年人,即18岁或大于18岁。在另一个实施方案中,对象是儿童,即18岁以下。
185.在一个实施方案中,在组织重建的过程中,将本发明的生物材料、医疗装置或药物组合物施用于有需要的对象。
186.在一些实施方案中,本发明的生物材料、医疗装置或药物组合物通过手术植入例如通过夹子或套管针;或通过腹腔镜手术施用于有需要的对象。
187.本发明还涉及试剂盒,其包括根据本发明的生物材料、药物组合物或医疗装置以及合适的固定装置。合适的固定装置的实例包括但不限于外科用胶,组织胶或任何外科用的生物相容性、无毒且可生物吸收的黏合剂组合物。
188.附图的简要说明
189.图1a至图1b是显示生物材料的宏观视图的照片。图1a:在骨分化培养基中培养2.5周时的由猪明胶(cultispher g)和asc形成的生物材料。图b:在骨分化培养基中培养7.5周时的由猪明胶(cultispher g)和asc形成的生物材料。
190.图2a至图2b是显示在骨分化培养基中培养7.5周时的由猪明胶(cultispher g)和asc形成的生物材料的苏木精
‑
伊红染色照片。图2a:原始放大倍数x5。图2b:放大倍数x10。
191.图3a至图3b是显示在骨分化培养基中培养7.5周时的由猪明胶(cultispher g)和asc形成的生物材料的冯库萨染色照片。图3a:原始放大倍数。图3b:放大倍数x10。
192.图4a至图4b是显示在骨分化培养基中培养7.5周时的由猪明胶(cultispher g)和asc形成的生物材料的骨钙素表达的照片。图4a:原始放大倍数。图4b:放大倍数x10。
193.图5a至图5l是显示与在mp中的asc(mp)相比,在骨分化培养基中由asc和cultipher g(生物材料)形成的本发明生物材料中基因表达的图。图5a:ang;图5b:angpt1;图5c:ephb4;图5d:edn1;图5e:thbs1;图5f:ptgs1;图5g:lep;图5h:vegfa;图5i:vegfb;图5j:vegfc;图5k:id1;和图5l:timp1。*:p<0.05。
194.图6a至图6d是显示在骨分化培养基中由asc和cultipher g形成的不同成熟度水平的本发明生物材料的照片。图6a:4周;图6b:8周;图6c:12周;和图6d:25周。矿化在透明显示的3d基质中以黄色显示。
195.图7是在裸大鼠中植入后第29天,在骨分化培养基中培养7.5周时的由猪明胶(cultispher g或s)和asc形成的生物材料的“植入部位”的放射照片。
196.图8是在wistar大鼠中植入后第29天,在骨分化培养基中培养7.5周时的由猪明胶(cultispher g或s)和asc形成的生物材料的“植入部位”的照相照片。
197.图9是显示了在骨分化培养基中培养7.5周时的由猪明胶(cultispher g或s)和asc形成的生物材料的冯库萨染色的照片。
198.图10是显示了在骨分化培养基中培养7.5周时的由猪明胶(cultispher s)和asc的生物材料的苏木精
‑
伊红染色的照片。
199.图11是显示了在裸大鼠中植入后第29天,在骨分化培养基中培养7.5周时的由猪明胶(cultispher s)和asc形成的生物材料的冯库萨染色的照片。
200.图12a至图12b是示出裸大鼠中的“植入部位”的射线照片。图12a:植入在骨分化培养基中培养7.5周时由猪明胶(cultispher g或s)和asc形成的生物材料后第29天。图12b:植入仅由猪明胶(cultispher g或s)形成的生物材料后第29天。
201.图13a至图13c是显示在第0天(d0)、第15天(d15)、第23天(d23)和第34天(d34)大鼠腿部创面愈合的照片。图13a:未植入;图13b:单独植入cultispher s颗粒后;和图13c:植入在骨分化培养基(c)中培养8周时的由猪明胶(cultispher s)和asc形成的生物材料后。左肢:缺血性腿;右肢:非缺血性腿。
202.图14是显示了与固定为100%的假手术相比较,未经处理的(假手术)或单独使用cultispher s颗粒(cultispher)处理的或在骨分化培养基中培养8周时的由猪明胶(cultispher s)和asc形成的的生物材料(生物材料)处理的非缺血性腿(黑条)和缺血性腿(白条)中创面大小的曲线下面积(auc)的直方图。
203.图15a至图15b是显示单独用cultispher s颗粒处理后(正方形)或在骨分化培养基中培养8周时的由猪明胶(cultispher s)和asc形成的生物材料处理后(圆形)、或未经处理的(假手术,三角形)从第0天至第34天的创面面积百分比的图。图15a:在非缺血性腿上;图15b:在缺血性腿上。
204.图16a至图16b是示出在未处理的(假手术,左)、仅使用cultispher s颗粒(中)处理或本发明的生物材料处理(右)的创面完全闭合的天数的图。图16a:非缺血性腿;图16b:缺血性腿。
205.图17a至图17c是显示缺血性腿治疗后第0天至第34天的淋巴细胞cd3(黑色线)和巨噬细胞cd68(灰色线)的数量的图。图17a:未处理(假手术对照)。图17b:单独使用cultispher s颗粒。图17c:在骨分化培养基中培养8周时的由猪明胶(cultispher s)和asc形成的生物材料。
206.图18a至图18b是显示在未处理(假手术对照)、单独植入cultispher s颗粒(cultisphers)后以及植入骨分化培养基中培养8周时的由猪明胶(cultispher s)和asc形成的生物材料后第15天和第34天的创面厚度的图。图18a:在缺血性模型中。图18b:在非缺血性模型中。
207.图19a至图19d是直方图,显示了在单独用cultispher s颗粒(虚线的直方图)或用在骨分化培养基中培养8周时的由猪明胶(cultispher s)和asc形成的生物材料(黑色直方图)、或者未处理(假手术,条纹直方图)治疗后第1天、5天、15天和34天在非缺血性腿上的表皮和真皮分数。图19a:非缺血性腿的核心的表皮分数。图19b:非缺血性腿的外周的表皮分数。图19c:非缺血性腿的核心的真皮分数。图19d:非缺血性腿的外周心的真皮分数。
208.图20a至图20d是显示在不同培养基中用asc和颗粒获得的结构的照片。图20a:成骨培养基;图20b:成软骨培养基;图20c:成肌纤维培养基;和图20d:成角质培养基。评估了结构形式(1.)、可抓握性(2.)、苏木精
‑
伊红染色(3.)和组织特异性染色(4.),即针对成骨培养基的骨钙素(oc)、针对成软骨培养基的阿尔辛蓝(ab)、针对成肌纤维培养基的α
‑
sma和针对成角质培养基的cd34。
209.实施例
210.通过以下实施例进一步说明本发明。
211.实施例1:本发明生物材料的生产
212.1.1.分离hasc
213.在知情同意和血清学筛查后,根据coleman技术,通过吸脂术在腹部区域收集人皮下脂肪组织。
214.从刚获得的脂肪组织中立即分离出人脂肪干细胞(hasc)。脂肪吸取物可以在+4℃下保存24小时,或在
‑
80℃下保存长于24小时。
215.首先,为了质量控制目的,分离出一部分脂肪吸取物,并测量脂肪吸取物的剩余体积。然后,通过在hbss中制备的胶原酶溶液(nb 1,serva electrophoresis gmbh,海德堡,
德国)消化脂肪吸取物(终浓度为约8u/ml)。用于消化的酶溶液的体积是脂肪组织体积的两倍。消化在37℃
±
1℃下进行50分钟至70分钟。在15分钟至25分钟后进行第一次间歇摇动,在35分钟至45分钟后进行第二次摇动。通过添加mp培养基(增殖培养基或生长培养基)来停止消化。mp培养基包含dmem培养基(4.5g/l葡萄糖和4mm的ala
‑
gln;sartorius stedim biotech,哥廷根,德国),并补充有5%人血小板裂解物(hpl)(体积/体积)。dmem是一种标准的培养基,其包含盐、氨基酸、维生素、丙酮酸和葡萄糖,经碳酸盐缓冲液缓冲,并且具有生理ph(7.2至7.4)。使用的dmem包含ala
‑
gln。人血小板裂解物(hpl)是用于刺激间充质干细胞(例如hasc)体外生长的生长因子丰富来源。
216.将消化的脂肪组织离心(500g,10分钟,室温),并除去上清液。将沉淀的基质血管级分(svf)重悬于mp培养基中,并通过200μm至500μm的滤网。将过滤的细胞悬液第二次离心(500g,10分钟,20℃)。将含有hasc的沉淀重悬于mp培养基中。可以保留一小部分细胞悬液用于细胞计数,并将全部剩余的细胞悬液用于接种一个75cm2的t
‑
培养瓶(称为传代p0)。进行细胞计数(仅供参考),以估计接种细胞的数量。
217.分离步骤的次日(第1天),将生长培养基从75cm2的t
‑
培养瓶中取出。用磷酸盐缓冲液冲洗细胞3次,然后将新鲜制备的mp培养基加入培养瓶中。
218.1.2.人脂肪干细胞的生长和扩增
219.在增殖阶段,将hasc传代4次(p1、p2、p3和p4),以便为该过程的后续步骤获得足够量的细胞。
220.在p0和第四代(p4)之间,将细胞培养在t
‑
培养瓶上,并用新鲜的mp培养基饲养。当汇合度≥70%且≤100%(目标汇合度:80%至90%)时,将细胞传代。将来自1批的所有细胞培养受体同时进行传代。在每次传代中,用重组的不含动物细胞的解离酶tryple(选择1x;对于75cm2培养瓶使用9ml,对于150cm2培养瓶使用12ml),将细胞从培养容器中分离出来。在37℃
±
2℃下进行tryple消化5分钟至15分钟,并通过添加mp培养基终止。
221.然后将细胞离心(500g,5分钟,室温),然后重悬于mp培养基中。收集收获的细胞以保证得到均质细胞悬液。重悬后,计数细胞。
222.然后在第p1、p2和p3代中,将剩余的细胞悬液在mp培养基中稀释至合适的细胞密度,并接种在较大的组织培养表面上。在这些步骤中,75cm2的培养瓶接种15ml体积的细胞悬液,而150cm2的培养瓶接种30ml体积的细胞悬液。在每次传代中,接种0.5x104个细胞/cm2至0.8x104个细胞/cm2的细胞。在不同的代之间,每3天至4天更换一次培养基。从一个供体到另一个供体的细胞行为和生长速率可能略有不同。因此,两次传代之间的持续时间以及代之间的培养基更换次数可能会因供体而异。
223.1.3.成骨分化
224.在p4代(即第四代),将细胞第二次离心,并重悬于md培养基(分化培养基)中。重悬后,第二次计数细胞,然后在md培养基中稀释至合适的细胞密度,然后将70ml体积的细胞悬液接种在150cm2培养瓶中,并注入成骨md培养基。根据该方法,第四次传代后将细胞直接培养于成骨md培养基中。因此,当细胞尚未达到汇合时,加入成骨md培养基。
225.成骨md培养基由补充有地塞米松(1μm)、抗坏血酸(0.25mm)和磷酸钠(2.93mm)的增殖培养基(dmem,ala
‑
gln,5%的hpl)构成。
226.一个供体和另一个供体的细胞行为和生长速率可能略有不同。因此,成骨分化步
骤的持续时间和代之间的培养基更换次数可能因供体而异。
227.1.4.多维诱导细胞
228.当细胞达到汇合时,如果出现形态学改变,并且如果在培养瓶中观察到至少一个类骨质结节(即在骨组织成熟之前形成的未矿化的骨基质有机部分),则开始进行3d诱导。
229.暴露于成骨md培养基后,向含有汇合贴壁骨原细胞单层的培养容器以对于150cm2的容器为1cm3、1.5cm3和2cm3的浓度缓慢均匀地撒上明胶颗粒(cultispher
‑
g和cultispher
‑
s,percell biolytica,astorp,瑞典),。
230.将细胞保持在md培养基中。在多维诱导过程中,每3天至4天进行常规培养基更换。通过小心地防止除去明胶颗粒和发展中的结构来进行那些介质更换。
231.实施例2:生物材料的表征
232.2.1.材料和方法
233.2.1.1结构/组织学
234.测试了由asc和cultispher g和s颗粒获得的3d结构的形成。将cultispher颗粒添加到来自6个不同供体的第4代的汇合的asc。测试了不同的体积:对于每个150cm2的容器为1cm3、1.5cm3、2cm3的颗粒。将细胞维持在分化培养基(dmem、4.5g/l葡萄糖、ultra谷氨酰胺+1%青霉素/链霉素+0.5%两性霉素ab+地塞米松(1μm)、抗坏血酸(0.25mm)和磷酸钠(2.93mm)中,并每3天至4天更换培养基。
235.为了比较mp和md中的培养,在添加颗粒后5天、14天和8周对md中的3d结构进行活检。
236.为了评价细胞密度,在添加cultispher颗粒后4周、8周和12周对3d结构进行活检。
237.将它们固定在甲醛中,并准备用于苏木精
‑
伊红染色、masson三色染色、骨钙素染色和冯库萨染色。
238.分别在骨钙素染色和冯库萨染色的载玻片上评估组织的骨分化和矿化。用苏木精
‑
伊红染色和masson三色染色评估细胞外基质的组织结构、细胞密度和存在。
239.2.1.2生物活性
240.生物活性的体外研究通过(i)终产物中生长因子vegf、igf1、sdf
‑
1α的提取和定量和(ii)低氧和高血糖条件(例如糖尿病创面的愈合条件)下本发明生物材料的生长因子分泌能力/生长因子含量进行评估。另外,(iii)通过qrt
‑
pcr在分子水平上体外表征了本发明生物材料的生物活性特性。
241.生长因子含量
242.为了评估形成的组织的生物活性,在添加明胶(1.5cm3)后第4周和第8周进行活检,以进行蛋白质提取和定量。根据供应商的说明,通过比色法(bca蛋白质测定试剂盒,thermofisher scientific)和elisa(人quantikine elisa试剂盒,rd systems)对vegf、sdf1α、igf1的总蛋白和生长因子的含量进行定量。
243.低氧和高血糖下的培养
244.为了评估本发明的生物材料的生物活性以及血氧和高血糖对这种3d结构的生物活性的影响,用pbs对第8周时形成的具有cultispher g(1.5cm3)和来自3个供体的asc的组织活检样品进行两次冲洗,并一式两份放入6孔板10ml md中,该md含有4.5g/l(高血糖条件)或1g/l(正常血糖条件)葡萄糖不含hpl。将板置于37℃下缺氧(1%o2)或常氧(21%o2)、
5%co2下72小时。然后收获上清液,以分别通过比色法(bca蛋白质测定试剂盒,thermofisher scientific)和elisa(人quantikine elisa试剂盒,rd systems)定量bmp2、bmp7、vegf、sdf
‑
1α、igf1、fgfb的总蛋白质和生长因子。处理组织以进行蛋白质提取、纯化以及总蛋白质和生长因子含量的定量。
245.qrt
‑
pcr
246.通过分析涉及血管生成和血管新生的基因的表达,研究了本发明生物材料的促血管新生潜力。分析了处于不同状态的脂肪干细胞的基因表达:在增殖培养基中的脂肪干细胞(无表型取向,mp),在没有颗粒的经典成骨培养基(md)中的脂肪干细胞、最后是本发明的生物材料中的脂肪干细胞(考虑到诱导由细胞外基质形成3维无支架结构,具有1.5cm3的颗粒的脂肪干细胞)。
247.使用qiazol裂解试剂(qiagen,德国希尔登)和precellys均质机(bertin仪器,法国montigny
‑
le
‑
bretonneux)从增殖培养基(mp)(n=4,不同来源的人脂肪组织)中培养的≥2000个asc中和从约1cm2的本发明生物材料的活检样品(n=5)中提取总rna。根据制造商的说明,使用rneasy mini试剂盒(qiagen,hilden,德国)纯化rna,并另外进行柱上dna酶消化。使用分光光度计(spectramax 190,molecular devices,加利福尼亚,美国)确定rna的质量和含量。使用rt2rna第一链试剂盒(qiagen,hilden,德国)由0.5μg总rna合成cdna,以通过商用pcr阵列(人rt2profiler分析
‑
血管生成)获得成骨和血管生成基因表达谱。使用abi quantstudio 5系统(applied biosystems)和sybr green rox mastermix(qiagen,hilden,德国)检测扩增产物。根据δδct方法进行定量。将每个样品的最终结果相对于三个管家基因(actb、b2m和gapdh)的表达水平平均值进行归一化。
248.2.1.3生物材料成熟度对其性能的影响
249.通过矿化水平评估、组织学评估(细胞密度确定)和生物活性评估(生长因子vegf、igf1、sdf
‑
1α的提取和定量)来评估生物材料(也称为“组织”)成熟度对其特性的影响。生物材料的成熟度在本文中是指将asc与cultispher颗粒一起在分化培养基中培养的持续时间。
250.在添加cultispher颗粒后4周(1个供体)、8周(6个供体)、12周(3个供体)和25周(1个供体)进行了3d结构活检,并将其在甲醛中固定以进行微型ct扫描仪分析。使用外围定量ct机(skyscan 1172g,bruker微型
‑
ct nv,比利时kontich)来评估3d结构的矿化。
251.此外,将组织活检样品(4周(n=3)、8周(n=8)、12周(n=3)和25周(n=1))固定在甲醛中,准备用于苏木精
‑
伊红染色、masson三色染色和冯库萨染色。
252.2.2.结果
253.2.2.1结构/组织学
254.当将cultispher颗粒与hasc一起在增殖培养基中培养时,没有获得3d结构。由于未发现宏观3d结构,因此未进行显微结构分析。
255.与增殖培养基相反,将cultispher与asc一起在成骨分化培养基中培养时显示出片状3d结构的形成(图1a)。此外,这种结构易于用镊子夹持(图1b)。
256.将cultispher与asc一起在成骨分化培养基中培养时的组织学检查显示,颗粒之间存在细胞化的互连的组织。此外,在颗粒的孔中发现了细胞外基质和细胞(图2a和图2b)。冯库萨染色显示存在单独的矿化颗粒。相反,细胞外基质未被冯库萨染色(图3a和图3b)。最
后,在互连的组织中发现骨钙素表达(图4a和图4b)。
257.2.2.2生物活性
258.生长因子的含量和分泌
259.在单独的cultispher g和s中未发现蛋白质含量。仅检测到痕量的igf
‑
1,但低于elisa方法的定量下限。
260.在成骨分化培养基中一起培养的cultispher与asc的活检上清液中检测到的igf
‑
1和bmp7水平低于elisa方法的定量下限,同时测量到痕量的bmp2和fgfb。相反,发现vegf和sdf
‑
1α大量分泌。
261.发现培养条件对生长因子分泌无显著影响(表1)。
[0262][0263]
表1:培养条件对本发明生物材料的vegf和sdf
‑
1α分泌的影响
[0264]
在成骨分化培养基中一起培养的cultispher与asc的活检样品的蛋白质提取物中检测到的bmp2、bmp7和fgfb水平低于elisa方法的定量下限。相反,发现igf
‑
1、vegf和sdf
‑
1α中的含量很高。
[0265]
发现培养条件对vegf含量无显著影响。然而,与其他组相比,在葡萄糖为4.5g/l、常氧条件(21%o2)下,igf
‑
1含量较低(p<0.05)。与低氧相比(1和4.5g/l葡萄糖),常氧和正常血糖条件下的sdf
‑
1α含量更高(p<0.05)(表2)。
[0266][0267]
*:p<0.05,与其他组相比
[0268]
**:p<0.05,与1%的o2(1g/l和4.5g/l)相比
[0269]
表2:培养条件对本发明生物材料的vegf、sdf
‑
1α和igf1含量的影响
[0270]
qrt
‑
pcr分析
[0271]
在通过qrt
‑
pcr分析的84种促血管生成基因中,有13种mrna在不同培养条件间发生变化。与增殖培养基中的asc相比,在本发明的生物材料中,有10个基因被上调(ang、angpt1、ephb4、edn1、lep、thbs1、ptgs1、vegfa、vegfb和vegfc),并且发现与mp中的asc相比,在本发明的生物材料中,有两个基因被下调(id1、timp1)(图5)。
[0272]
与mp中的asc相比,在本发明的生物材料中发现血管生成素(ang和angpt1)mrna的显著更高的表达(图5a和b)。血管生成素信号传导促进血管生成,通过该过程从先前存在的血管形成新的动脉和静脉(fagiani e等人,cancer lett,2013)。
[0273]
与mp中的asc相比,在本发明的生物材料中,在血管生成中起重要作用的跨膜蛋白ephb4(肝配蛋白受体b4)、有效的血管收缩剂内皮素(edn1)(wu mh,nature,2013)、血管舒张剂血小板应答蛋白1(thbs1)和调节内皮细胞的环氧合酶1(ptgs1/cox
‑
1)显著上调(分别为图5c、d、e和f)。
[0274]
与mp中的asc相比,在本发明的生物材料中,瘦素(lep)mrna(血管生成的重要增强剂和vegf表达的诱导剂;bouloumie a等人,circ.res.1998;sierra
‑
honigmann mr等人,science(new york,n.y.)1998)也是过表达的(图5g)。
[0275]
最后,与mp中的asc相比,在本发明生物材料中,asc中的血管内皮生长因子a、b和c的mrna(vegfa/b/c)的表达也显著提高(分别为图5h、i和j)。vegf是调节血管发育和血管生成的最重要的生长因子之一。由于骨是高度血管化的器官(血管生成是成骨过程中的重要调节剂),因此vegf也会对骨发育和产后骨修复产生积极影响(hu k等人,bone 2016)。
[0276]
相反,与mp中的asc相比,在本发明的生物材料中,与体内血管生成减少有关的dna结合蛋白抑制剂(id1)和金属肽酶抑制剂1(timp1)(reed mj等人microvasc res 2003)被下调(分别为图5k和l)。
[0277]
总体而言,这些分子分析表明,当细胞嵌入本发明生物材料中的3d基质中时,asc的促血管生成潜力被上调。
[0278]
2.2.3生物材料成熟度对其性能的影响
[0279]
矿化水平评估
[0280]
3d移植物在第4周、第8周、第12周和第25周的宏观照片显示出相同的宏观结构(图6a和图6b),并在微型
‑
ct中进行了分析。确定矿化体积的百分比:第4周为0.07%,第8周为0.28%+/
‑
0.33%,第12周为1.24%+/
‑
0.35%,第25周为2.77%(图6c和图6d)。
[0281]
因此,成熟度越高,矿化度越高。
[0282]
组织学评估
[0283]
发现组织成熟度对细胞含量无影响,因为在所分析的不同组织中定量了相似的细胞密度(数据未显示)。
[0284]
相较而言,组织中ecm的比例随成熟度增加而增加,第4周的ecm比例明显较低,而第25周的ecm比例较高(在4周、8周/12周和25周时,ecm分别为28
±
7%和33
±
11%/34
±
11%和56土8%(p<0.05))(表3)。
[0285] 个细胞/mm2ecm(%)4周160
±
10428
±
7*8周175
±
8633
±
1112周177
±
7034
±
1125周191
±
7756
±
8*
[0286]
*:p<0.05,与其他组相比
[0287]
表3:在不同的成熟时间对本发明的生物材料进行的组织形态分析。
[0288]
在成熟的第12周和第25周发现较高的矿化度,如更明显的冯库萨染色所示(数据
未显示)。
[0289]
生物活性评估
[0290]
在蛋白质提取、纯化和通过elisa对生长因子(vegf、igf1、sdf
‑
1α)进行定量后,研究了成熟4周、8周、12周和25周时该生物材料的生物活性(表4)。
[0291] vegf(ng/ml)igf(ng/ml)sdf
‑
1α(ng/m1)4周117
±
7108
±
17105
±
428周102
±
9150
±
83189
±
18012周181
±
12436
±
18663
±
2725周12894424
[0292]
表4:成熟4周、8周、12周和25周时组织中蛋白质和生长因子的含量
[0293]
实施例3:体内血管新生和成骨特性的研究
[0294]
3.1.材料和方法
[0295]
3.1.1使用裸大鼠进行的体内实验
[0296]
在第0天,将十份本发明生物材料的复制品(如实施例1中所述在7.5周的成熟过程中与1.5cm3的cultispher g或s一起培养的asc)缝合在裸大鼠的烧烙过的腰部肌肉上。植入后第29天,收集生物材料以进行图像和组织学进行分析。
[0297]
3.1.2使用wistar大鼠进行的体内实验
[0298]
在第0天,将十份本发明生物材料的复制品(如实施例1中所述在7.5周的成熟过程中与1.5cm3的cultispher g或s一起培养的asc)缝合在wistar大鼠的烧烙过的腰部肌肉上。植入后第29天,收集生物材料以通过图像和组织学进行分析。
[0299]
在实验期间,每天检查动物的一般临床状态。
[0300]
使用用于小动物成像的高分辨率x射线微型ct系统skyscan1076进行30个样品的矿化分析。使用ctvol和ctan软件(skyscan)进行进行三维重建扫描和矿化组织分析。
[0301]
对肌肉样品进行了组织学分析,以评估产品的体内血管新生和骨诱导特性(苏木精
‑
伊红、masson三色、冯库萨(以精确地确定组织中矿化的位置)、人体组织标记物ku80(以确认是动物组织中的细胞的人类来源)和cd3(以描述组织中cd3+免疫细胞的重新分配)染色)。
[0302]
3.2.结果
[0303]
3.2.1使用裸大鼠进行的体内实验
[0304]
在体内实验过程中,未发现任何不适迹象或明显病变,这表明该产品未对动物造成不良影响。
[0305]
在第29天进行的放射照片中,在裸大鼠中观察到不透射线的结构,这表明存在矿化现象(图7)。
[0306]
在裸大鼠样品中突出显示了人细胞的存在。当存在时,人细胞在两组中平均占到植入部位(不包括边缘)的细胞的一半。除了边缘处仅存在大鼠细胞,来自大鼠和人的细胞均匀地分布在植入部位。
[0307]
3.2.2使用wistar大鼠进行的体内实验
[0308]
在wistar大鼠中,在第29天进行的放射照片上观察到不透射线的结构,这表明存在矿化现象(图8)。
[0309]
矿化分析表明在每个植入部位均存在矿化组织。
[0310]
冯库萨染色表明矿化位于颗粒上(图9)。
[0311]
实施例4:体内生物活性研究
[0312]
4.1.材料和方法
[0313]
4.1.1样品准备
[0314]
准备十个约0.5g生物材料的样品(如实施例1中所述在8周的成熟过程中与1.5cm3的cultispher s一起培养的asc),以用于植入10只裸大鼠的椎旁肌肉组织中。另外,将2个约0.5g的cultispher s颗粒样品用作对照。
[0315]
为了评估样品中生长因子的含量,准备生物材料样品以用于蛋白质提取和定量(vegf、igf1、sdf
‑
1α)。
[0316]
为了评估生物材料的质量,将一个样品在甲醛中固定以进行苏木精
‑
伊红(he)和冯库萨(vk)染色。脱细胞治疗功效的评估通过对he染色后组织中的细胞数进行计数来评估。
[0317]
4.1.2动物设施中的安置
[0318]
将动物饲养在经过兽医机构批准的“centre pr
é
clinique atlanthera”动物设施中,并按照目前的现行法规进行所有实验程序(2013年2月1日用于实验目的的动物的第2013
‑
118号法令)。在研究开始之前,使动物适应至少7天,在此期间每天跟踪动物的总体状况。将动物圈养在装在标准尺寸的塑料盒中的装有空调的动物房中。人工日间/夜间照明周期设置为12小时光照和12小时黑暗。所有动物都可以自由饮水,并随意进食商业饲料。通过耳标(环)识别每只动物。
[0319]
4.1.3实验方案
[0320]
在第0天,将生物材料的复制品缝合在10只裸大鼠的烧烙过的腰部肌肉上,而将单独的颗粒植入1只裸大鼠的烧烙过的腰部肌肉内。植入后第29天,收集含有生物材料的肌肉,以通过图像和组织学进行分析。
[0321]
植入腰部肌肉
[0322]
将动物完全麻醉以在最佳条件下进行手术。在手术前约30分钟开始注射丁丙诺啡的镇痛步骤,然后在第二天再次进行注射。
[0323]
手术:对于每只动物,沿着腰椎水平处沿脊柱进行纵向皮肤切口。对于1只大鼠,在皮肤切口的两侧进行肌肉定位(即对腰部肌肉进行定位)。对植入部位进行烧烙。仅将颗粒植入这些部位中。对于10只大鼠,将生物材料缝合在烧烙过的腰部肌肉上。手术后,使用手术钉缝合皮肤创面。
[0324]
临床随访
[0325]
在实验期间,每天检查动物的总体临床状态。每周两次,进行了详细的临床随访,重点是:呼吸、眼睛、心血管、胃肠道症状;运动活动和行为;痉挛迹象;评估皮肤;植入部位的炎症。
[0326]
此外,在详细的临床随访的同时,每周两次测量体重。
[0327]
最终程序和验尸分析
[0328]
在第29天,通过放血处死动物并进行宏观评估。在尸检过程中,观察尸体的外表,并记录了任何病理性液体损失、且记录了认证的可能的内部病变异常。
[0329]
大幅度打开胸腔和腹腔以评估内脏器官的任何病变,重点是心脏、肾、脾、肝和肺。
[0330]
植入部位的宏观评估
[0331]
暴露出肌肉植入部位,并针对局部组织反应以及植入物的存在和定位(射线照相分析)进行了详细的宏观评估。
[0332]
去除肌肉植入部位。将外植体在室温下于中性缓冲福尔马林溶液中固定48小时。
[0333]
3d组织形态分析
[0334]
使用用于小动物成像的高分辨率x射线微型ct系统skyscan1076进行样品的矿化分析。
[0335]
使用以下参数在室温下扫描肌肉样品:源电压:50kv;旋转步骤:0.5
°
;像素大小:18μm;每个位置1帧。
[0336]
使用ctvol和ctan软件(skyscan)进行三维重建扫描和矿化组织分析。
[0337]
在每个样品中,确定与骨矿化组织(阈值40/255)相似的信号量(标识为骨体积:bv)。使用的“组织体积”值是配制的植入物的体积。
[0338]
组织病理学和2d组织形态学分析
[0339]
为了评估产品的体内血管生成和骨诱导性质,对肌肉样品进行了组织学分析。
[0340]
将经福尔马林固定的外植体在15%edta中脱钙13天。然后,将样品脱水并包埋在石蜡中。使用显微切片机切割4μm至5μm的切片,并在载玻片上铺展。以相距150μm的两个不同水平进行切片。
[0341]
在这两个切片区域进行了苏木精
‑
伊红(he)、masson三色(mt)和cd146的免疫组织化学检查(使用了石蜡包埋或冷冻的样品切片)。
[0342]
使用数字载玻片扫描仪(nanozoomer,hamamatsu)获取完整染色切片的图像。使用ndpview2软件对血管(trichrome masson,cd146)占据的面积进行定量:根据组织特征手动划定目标区域,以在切片上定义“植入部位”的区域。手动勾勒每个血管以量化目标区域中血管所占据的面积。报告了在“植入部位”的总面积,与血管相对应的表面积和血管数。
[0343]
4.2.结果
[0344]
4.2.1组织学分析
[0345]
he染色后确定组织中的细胞数(图10):1465
±
504个细胞/mm2。
[0346]
组织的冯库萨染色显示出颗粒上的较少矿化(图11)。
[0347]
4.2.2生物材料生物活性的体内研究
[0348]
未发现不适迹象或明显病变,这表明该产品未对动物造成不良影响。在实验过程中记录的动物体重表明,所有动物在第2天都没有出现体重增加,然后在第2天至28天期间出现了规律的体重增加。经常观察到刚手术后体重没有增加,并且不认为这表明所测试产品有任何毒性。第2天至第28天期间观察到的常规体重增加证实了这些颗粒不影响动物的新陈代谢。在体内实验结束时,尸检未发现任何宏观器官病变。
[0349]
植入部位的矿物质含量
[0350]
在第29天进行的放射线照片上,在植入生物材料的所有部位均观察到不透射线的结构,从而表明存在矿化(图12)。
[0351]
为了量化矿化组织在肌肉中的形成百分比,使用用于小动物成像的高分辨率x射线微型ct系统skyscan1076进行“植入部位”矿化分析。结果列于表5。
[0352]
样品bv 40/255(mm3)tv(mm3)bv/tv(%)ng
‑
98776.7677514.68210.1492ng
‑
98822.7560518.19650.0439ng
‑
989121.3495470.93640.2577ng
‑
990137.0365724.16180.1892ng
‑
99144.8830519.49130.0864ng
‑
99223.1673560.83240.0413ng
‑
99348.1291496.73990.0969ng
‑
99421.2821791.30640.0269ng
‑
995123.9947638.33530.1942ng
‑
99652.9368561.47980.0943
[0353]
表5:用于小动物成像的高分辨率x射线微型ct系统skyscan1076的结果
[0354]
分析表明,在植入生物材料的每个部位均存在显著含量的矿化组织,其中bv/tv的平均值为0.118。
[0355]
植入物的新血管形成
[0356]
检查纤维结缔组织中毛细血管的存在,以记录新血管形成。
[0357]
对masson三色染色后的植入物内的和肌肉与植入部位之间的交界处的血管数/面积和血管密度进行了定量。
[0358]
通过masson三色染色发现具有生物材料的植入物已血管化,并且数量为40.8土18.5个血管/mm2。
[0359]
实施例5:高血糖/缺血性异种大鼠模型的体内功效研究
[0360]
5.1.材料和方法
[0361]
5.1.1动物
[0362]
250g至300g的56只wistar雌性大鼠腹膜内接受链脲佐菌素(50mg/kg)。链脲佐菌素施用后七天至十天,通过血糖试纸测量尾静脉血中的血糖水平。葡萄糖水平>11.1mm的大鼠被认为是高血糖的,并被纳入研究(n
‑
42只大鼠)中。
[0363]
如levign
é
等人(biomed res int 2013)所述,在每只大鼠的左肢中诱发缺血。穿过在剃过的腹股沟区域中的纵向切口,从髂总动脉至隐性动脉切开髂外和股动脉。为了引起缺血条件,将切开的动脉从左肢髂总动脉中切除,而保留右肢动脉,并将该肢视为非缺血的。所有外科手术均在手术显微镜下进行(carl zeiss,jena,德国),通过使动物吸入5%异氟烷诱导麻醉并通过3%异氟烷维持麻醉。
[0364]
将动物随机分为3组:
[0365]
‑
假手术组(n=10只雌性wistar大鼠);
[0366]
‑
cultispher组(n=10只雌性wistar大鼠),即仅为颗粒;
[0367]
‑
生物材料组(n=14只雌性wistar大鼠),即asc与明胶颗粒形成的组织。
[0368]
5.1.2测试物
[0369]
准备14个约0.5g的cultispher颗粒的样品,进行γ射线辐照。
[0370]
准备14个约2cm2的生物材料的样品(如实施例1中所述在8周的成熟过程中与1.5cm3的cultispher s一起培养的asc)以用于植入。
[0371]
为了评估样品中生长因子的含量,准备一个生物材料样品以用于蛋白质提取和定量(vegf、igf1、sdf
‑
1α)。
[0372]
为了评估生物材料的质量,将样品固定在甲醛中以用于苏木精
‑
伊红(he)染色。脱细胞治疗功效的评估通过对he染色后组织中的细胞数进行计数来评估。
[0373]
5.1.3创面愈合的宏观评估
[0374]
在植入后第0天、第15天、第24天和第34天拍摄腿的照片。
[0375]
为了量化创面闭合,由两个独立的操作员使用image j软件通过图像分析来测量创面面积。根据在d0和d34期间的每个时间点测量的创面面积计算曲线下面积,并通过与固定为100%的假手术组比较进行表示。
[0376]
5.1.4创面愈合的微观评估
[0377]
解剖腿以去除创面组织,并且使其最后呈横向取向,以获得具有整个组织厚度的组织学切片。制备5μm的组织学切片,并用he染色以对表皮(op
‘
t veld rc等人,biomaterials 2018)和真皮(yates c等人,biomaterials 2007)进行评分:
[0378]
在创面的三个代表性部位(中心和周围)对表皮愈合进行评分:
[0379]
‑
0:上皮细胞无迁移,
[0380]
‑
1:部分迁移,
[0381]
‑
2:完全迁移,且没有角质化/部分角质化,
[0382]
‑
3:完全迁移,且完全角质化,
[0383]
‑
4:晚期过度肥厚。
[0384]
在创面的三个代表性部位(中心和周围)对真皮愈合进行评分:
[0385]
‑
0:没有愈合,
[0386]
‑
1:炎性浸润,
[0387]
‑
2:肉芽组织存在
‑
纤维化和血管生成,
[0388]
‑
3:胶原沉积代替肉芽组织>50%,
[0389]
‑
4:肥大性纤维化反应。
[0390]
此外,还进行了masson三色染色,以通过组织形态测定法评估血管区域,并进行了cd3、cd68免疫染色以评估免疫和炎症反应。另外,进行ku80染色以鉴定植入后人细胞的存在。
[0391]
5.2.结果
[0392]
在接受链脲佐菌素注射的56只大鼠中,有42只发展为高血糖并被选为研究对象,而14只表现为低血糖并产生手术并发症,因此被排除在研究之外。
[0393]
5.2.1创面愈合的宏观评估
[0394]
创面的宏观图片如图13所示。与其他组(假手术对照组(图13a)和单独使用颗粒组,图13b)相比,在生物材料组(图13c)中,从术后第15天(d15)起可以观察到更好的创面愈合。这种差异对于缺血性(左肢)和非缺血性创面(右肢)都是可见的。
[0395]
非缺血性创面的曲线下面积结果如图14所示。与未经处理的动物相比,单独植入cultispher的创面愈合分别降低了23%。相比之下,在用本发明生物材料治疗的组中发现了更好的创面愈合(25%)。
[0396]
d0至d34的非缺血性创面和缺血性创面的创面面积变化如图15所示(分别为a和
b)。注意,与其他组相比,用本发明的生物材料处理的创面从d21到d34呈现出更少的未愈合组织。当用本发明的生物材料治疗时,在非缺血性和缺血性的情况下,创面的完全闭合明显更快(分别为图16a和图16b)。
[0397]
用于评估炎症反应的组织形态计量学结果如图17所示。这些结果表明,与假手术对照(图17a)和单独使用cultispher s(图17b)相比,用本发明的生物材料处理的边界、中心和总缺血创面的淋巴细胞cd3(黑线)更高(图17c)。cd3通常可以破坏感染和功能异常的细胞。
[0398]
此外,巨噬细胞cd68(灰色线)在d10附近达到峰值(图17c),类似于假手术对照(图17a)和单独使用的cultispher s(图17b)。cd68具有巨噬细胞的特征,被认为会侵染组织部位并清除细胞碎片和感染。
[0399]
这两个观察结果证实,通过免疫诱导,本发明生物材料的植入导致创面闭合动力学的增加。
[0400]
还评估了创面的厚度(图18)。在缺血性模型中(图18a),植入后创面的厚度从d15减小到d34,显示出回缩。在非缺血性模型中(图18b),植入后创面的厚度从d15减小到d34,但更重要的是,与假手术对照和单独使用的cultisphers相比,创面的厚度没有增加。该结果突出了当植入本发明的生物材料时没有过度生长的情况。
[0401]
5.2.2创面愈合的微观评估
[0402]
在图19a、图19b、图19c和图19d中示出了在每个时间点在非缺血创面上评估的表皮和真皮评分。与其他组相比,发现本发明的生物材料的真皮和表皮评分更快。
[0403]
实施例6:测试不同的分化培养基
[0404]
6.1.材料和方法
[0405]
研究了分化培养基对形成的3d结构的影响。asc与1.5cm3的cultispher s在不同的分化培养基中一起培养4周:成骨(与实施例1相同)、成软骨(dmem、5%hpl、100μg/ml丙酮酸钠、its 1x、40μg/ml脯氨酸、10ng/ml tgf
‑
β1、1μm地塞米松)、成角质(dmem、5%hpl、5μg/ml胰岛素、10ng/ml kgf、10ng/ml hegf、0.5μg/ml氢化可的松、1.5mm cacl2)和成肌纤维(dmem:f12、100μg/ml丙酮酸钠、1x its、1x rpmi 1640维生素、1ng/ml tgf
‑
β1、1μg/ml谷胱甘肽、0.1mm mem)。将培养物维持4周,每3天至4天更换分化培养基。
[0406]
在第4周,在甲醛中固定组织活检标本,以进行苏木精
‑
伊红染色、masson三色染色和冯库萨染色。另外,进行组织特异性染色(骨钙素、阿尔辛蓝、广谱角蛋白、cd34、α
‑
sma)。
[0407]
为了评估形成的组织的生物活性,在添加cultispher的4周后进行活检,来进行蛋白质提取和定量。通过比色法(bca蛋白质测定试剂盒,thermofisher scientific)定量总蛋白质和生长因子含量(vegf和sdf
‑
1α)。
[0408]
6.2.结果
[0409]
成骨培养基中的asc和cultispher s作为成骨分化的阳性对照。观察到大的可抓握3d结构的形成。组织学分析显示在细胞化互连组织中的颗粒整合和基质的骨钙素阳性染色(图20a)。
[0410]
在成软骨培养基中的培养快速地(仅几天后)显示出形成了强度高且厚实的3d结构,该结构易于抓握且耐机械力。组织学分析显示在细胞化的互连组织中的颗粒整合以及对阿尔辛蓝呈阳性的基质(图20b)。
[0411]
成肌纤维分化培养基允许形成3d结构。形成的结构可以抓握,但很脆弱。再次,组织学分析显示细胞化互连组织中的颗粒整合和基质的α
‑
sma阳性染色(图20c)。
[0412]
成角质培养基中的asc和颗粒形成了大的、平面的和薄的3d结构。最终变得非常脆弱且难以处理(图20d)。
[0413]
(表6)
[0414]
分化培养基3d结构可抓握坚固性互连组织成骨+++/
‑
+成软骨++++成肌纤维++/
‑
+/
‑
+成角质++/
‑ꢀ
+
[0415]
表6:在测试的分化培养基中形成的结构的特征
[0416]
因此,在所有由asc和明胶形成的生物材料样品中都观察到了3d结构,并测试了所有分化培养基。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1