根据染色动力学来检测至少一种微生物的方法和装置以及检测支持物与流程
根据染色动力学来检测至少一种微生物的方法和装置以及检测支持物
1.本发明涉及在固相中检测诸如细菌、酵母和霉菌类型等微生物的领域。
2.本发明主要适用于工业微生物学领域,例如但不限于制药、生物技术、化妆品或食品加工工业,或用于临床或环境微生物学。
3.本发明更具体地涉及一种用于在合适的支持物上的固相中极早期地检测微生物而无需培养繁殖所述微生物的装置和方法。
4.当前实施了许多技术来检测待测样品中的污染物,例如细菌。
5.最老且最常规的方法包括:将样品(可选地在过滤后)放置在营养琼脂生长培养基的表面上,该培养基对一种或多种微生物具有或多或少的选择性。
6.然后将所述培养基在合适的温度下温育以使所需的微生物生长,通常生长长达数天,而后由操作者“手动”计数肉眼可见的菌落。
7.这种方法尽管高度灵敏并且允许在原始样品中检测到单一的活的可培养污染物,但其缺点是需要较长的温育时间才能通过肉眼检测到在琼脂上形成的菌落。
8.代替固体琼脂,另一种可行的方法涉及在液体培养基中接种,在温育后,通过例如比浊法来检测其中的微生物生长,由此测得的吸光度与培养基中存在的微生物浓度成比例。
9.液相检测技术的缺点是它们无法检测到低于106或107个细胞/ml的微生物浓度。因此,必须将样品再次温育一段可变的时间以达到这种细胞浓度。
10.还应注意,在应激(例如热应激)的作用下或由于样品中存在抑制剂,某些微生物可能需要特别长的时间来繁殖,从而进一步延后了使用常规培养技术可以检测到它们的时刻。
11.现有技术中的另一种已知方法涉及进行聚合酶链式反应(也称为pcr扩增)来扩增dna或rna序列,由此确定样品中特定微生物的存在。
12.但是,这些方法的缺点是需要多条核酸链,即样品中的多个污染微生物,通常至少数十个微生物。因此,这样的方法的灵敏度不如基于微生物生长的常规培养技术。
13.因此,近年来,为了提高微生物检测速度,同时试图保持常规的基于生长的技术的灵敏度,已经开发并完善了许多方法。
14.这些方法大多数都基于检测特定荧光化学物质、荧光团或荧光染料所发出的荧光,利用不同的染色技术将它们与所要检测的微生物的细胞功能或结构(核酸、蛋白、酶等)关联起来。
15.这些方法需要实施特定的检测装置,例如用于“deft”(直接落射荧光滤光器技术)的显微镜或细胞仪。
16.因此,流式细胞术技术现在通常用于检测和计数样品中存在的微生物。
17.在这种技术中,可以用荧光团染色并悬浮在液体中的细胞或颗粒以单细胞流的形式被依次逐个分离。然后使它们以高速逐个通过光源,例如来自激光器的光束。
18.由细胞漫射和发出的光,在用荧光团染色并在给定波长下激发后的情况下是荧光
性的,并且由构成细胞仪的光学装置的反射镜和滤光镜系统引导至一组光检测器。这些检测器特别地装有光电倍增管,它将光信号转换成电信号,然后可由计算机分析电信号以产生关于例如细胞的物理特征的相关数据。
19.当前可商购的流式细胞仪能够每秒实时分析数百个细胞或“事件”,并且其中一些装置可以配置为允许根据光学特性对细胞或颗粒进行分选。
20.但是,无论是实施流式细胞术还是显微镜技术,稀有事件的检测往往是复杂的。
21.实际上,流式细胞术的灵敏度有限,在最佳情况下,估计其灵敏度为102至103个细胞/ml悬浮液,并且是基质依赖性的。
22.在“deft”技术中,使待分析的样品通过膜来过滤,该膜保留可能包含在所述样品中的微生物。
23.然后将微生物用与dna或rna相互作用的荧光染料(例如吖啶橙)染色,然后使用落射荧光显微镜对膜的多个视场进行目视分析来对微生物计数。
24.在荧光显微镜检中,为了获得代表性的结果,经估算在直径为25mm的膜上必须存在至少104个细胞,应注意计数仅对膜的一小部分进行(小于总尺寸的10%),并且细胞的均匀分布是假定的而不是确定的。
25.但是,在工业或临床微生物学的某些应用中,对样品中单一污染物或几种污染物存在的早期检测可能特别重要。实际上,在这类工业中制造和/或转化的产品特别敏感,特别是由于其最终目的(食品、消费者保健等)。因此,必须尽量快速地确保其微生物品质无可挑剔,或者,如果不是这种情况,则必须能够快速鉴定污染源。
26.特别由于这些原因,近些年开发了固相细胞计数法,也称为激光扫描细胞计数法,其适用于可过滤样品。特别而言,其是欧洲专利文件ep 0713087的主题。
27.在该方法中,在合适的膜上过滤样品的第一步之后,潜在地存在于所述膜上的任何微生物都要经过使用荧光团染色的步骤。
28.然后,通过激光束扫描膜的整个表面,以激发荧光团,并通过测量发射的荧光来计数待分析的原始样品中潜在存在的任何活的微生物。
29.名为chemscan rdi(注册商标)的装置用于执行这种固相细胞计数法。
30.然而,当前可商购的用于执行固相细胞计数技术的装置以及必需的试剂特别昂贵并且需要大量投资。结果,并非所有实验室都可以使用此技术。
31.而且,一旦进行了微生物的检测和计数,所用试剂对细胞代谢的毒性作用能够阻碍用于鉴定所述微生物的后续培养。
32.还应注意,这种固相细胞计数法仅适用于可过滤的基质,从将样品放置到固体支持物上到获得存在于所述固体支持物上的微生物的计数结果所需的时间是相对较长的,实际上,根据应用,该所需时间经估计至少为90分钟,且最长可达4小时。
33.最后,无论是使用流式细胞术还是固相细胞计数技术,检测到的假阳性率仍然相对较高。实际上,非微生物的惰性颗粒(例如灰尘)也可能发出自然荧光,或者甚至与荧光染料结合以发出干扰性荧光。
34.这构成了迄今为止的现有方法的真实缺陷:根据应用领域,被证明是假阳性的样品需要进一步检查,这些检查是非常耗时的,并且还能够产生显著的财务影响,特别是在上述检查期间必须关闭生产线(例如,生物制药的生产线)的情况下。
35.通常,用荧光团进行细胞染色的方法需要由合格的人员来处理样品,并且要求处理荧光试剂以使其与待检测的微生物接触,这不可避免地产生污染样品的风险。
36.还应该注意的是,所有这些操作以及在样品制备前进行的工作(特别包括过滤、活化、染色和洗涤等),都不可避免地需要操作人员花费大量的处理时间,这同样地延迟了检测到潜在污染的时间。
37.本发明提出一种用于极早地(在必要时几乎瞬时地)检测在待分析的原始样品中潜在地存在的一种或多种微生物的方法和装置,由此提供了至少部分地克服现有技术的各种上述缺点的可能性。
38.本发明的方法和装置基于利用以受控方式递送的细胞标记物来检测和分析潜在微生物的染色动力学,而无需特别易于造成样品污染的耗时的手动操作。
39.为此目的,本发明涉及一种在固体检测支持物上检测存在于待分析样品中的属于细菌、酵母或霉菌类型的至少一种微生物的方法,所述微生物凭借至少一种细胞标记物来显现,所述方法至少包括以下步骤,依次为:
40.a)将所述待分析样品放置在所述固体检测支持物上;
41.b)用能够显现出所述至少一种细胞标记物的光辐射来照射所述检测支持物至少一次;
42.c)利用光学成像装置,以至少10mm长乘以至少10mm宽的视场为目标,采集所述检测支持物的至少一部分上的所述样品的第一阶段p0中的至少一个图像i0;
43.d)通过所述检测支持物进行所述至少一种细胞标记物的受控释放,从而使所述标记物与所述微生物接触;
44.e)在所述标记物的受控释放步骤之后,在至少一个后续阶段pi中,利用所述光学装置对所述检测支持物的已在p0阶段采集过图像的每个部分采集图像i
i
(i≥1),从而根据所述微生物的染色动力学的变化来检测所述至少一种微生物;
45.f)对于所述检测支持物的每个部分,在p0采集的所述图像i0和至少一个后续阶段p
i
采集的每个图像i
i
之间,进行比较分析,并得出在所述样品中是否存在至少一种微生物的结论。
46.优选地,每次在p0、p
i
阶段采集图像时,用光辐射局部地照射所述检测支持物。
47.在一个特别有利的实例实施方式中,本发明的方法至少包括以下步骤,依次为:
48.a1)将所述待分析样品放置在所述固体检测支持物上;
49.b1)用能够显现出所述至少一种细胞标记物的光辐射来局部地照射所述检测支持物;
50.c1)与照射步骤b1)同时地,利用光学成像装置,以至少10mm长乘以至少10mm宽的视场为目标,采集所述检测支持物的至少一部分上的所述样品的第一阶段p0中的至少一个图像i0、i
’0;
51.d1)通过所述检测支持物进行所述至少一种细胞标记物的受控释放,从而使所述标记物与所述微生物接触;
52.e1)在所述细胞标记物的受控释放步骤d1)后少于5秒的时间内,用能够显现出所述至少一种细胞标记物的所述光辐射来局部地照射所述检测支持物;
53.f1)与照射步骤e1)同时地,在所述标记物的受控释放步骤之后,在至少一个后续
阶段p1中,利用所述光学装置对所述检测支持物的已在p0阶段采集过图像的每个部分采集图像i1、i
’1;
54.g1)用所述光辐射再次局部地照射所述检测支持物至少一次;
55.h1)与照射步骤g1)同时地,在至少一个第二后续阶段p2中,利用所述光学装置对所述检测支持物的已在p0和p1阶段采集过图像的每个部分采集图像i2、i
’2,从而根据所述微生物的染色动力学的变化来检测所述至少一种微生物;
56.i1)对于所述检测支持物的每个部分,在p0采集的所述图像i0、i
’0和至少两个后续阶段p1和p2采集的所述图像i1、i
’1、i2、i
’2之间,进行比较分析,并得出在所述样品中是否存在至少一种微生物的结论。
57.根据本发明的方法的特定的非限制性特征:
58.‑
沿着不同的路径使检测支持物经历n次位移,以将所述检测支持物在空间上划分成n+1个部分,在至少两个阶段p0和p
i
中采集其图像,其中n是小于或等于20的整数;
59.‑
在图像采集步骤c)和e)或c1)、f1)和h1)中,使用分辨率至少等于20百万像素、优选大于100百万像素的光学成像装置;
60.‑
如果在步骤f)或i1)中得出的结论是所述样品中存在至少一种微生物,则对所述样品中存在的微生物进行计数;
61.‑
所述细胞标记物是荧光标记物;
62.‑
在步骤d)或d1)中以受控方式释放的所述细胞标记物以固体形式(例如粉末形式)包封在包封元件中,并且所述检测支持物包含用于溶解所述标记物的溶剂;
63.‑
所述细胞标记物以液体形式包封在包封元件中;
64.‑
所述包封元件是热敏的,并且在步骤d)或d1)中,包封在所述热敏包封元件中的细胞标记物的受控释放通过以下方式来进行:使所述热敏包封元件经受能够熔化所述热敏包封元件的温度升高,例如将温度从环境温度升高到45℃的最高温度;
65.‑
将液体溶液中的细胞标记物以受控方式输送至含有待分析样品的固体检测支持物;
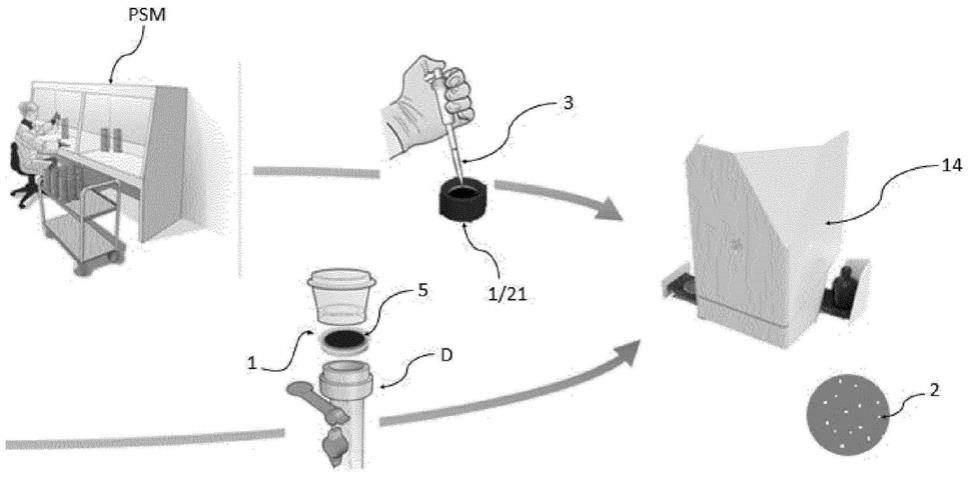
66.‑
将体积为10μl至2,000μl的所述待分析样品直接放置在所述检测支持物上;
67.‑
通过截止阈值为0.2μm至0.45μm、优选截止阈值等于0.3μm的滤膜过滤所述待分析样品,所述滤膜直接位于所述检测支持物中。
68.本发明还涉及一种区分已接收了待分析样品的检测支持物上的灰尘和微生物的方法,其特征在于:
69.‑
在每次图像采集之后,测量所检测到的发光的像素或像素簇的亮度;
70.‑
比较在不同图像中检测到的每个发光的像素或像素簇的亮度;
71.‑
鉴定出在染色动力学期间在至少两个连续图像中亮度基本不变的像素或像素簇;
72.‑
对在染色动力学期间亮度改变的像素或像素簇进行分析和计数。
73.本发明还涉及一种用于检测存在于待分析样品中的属于细菌、酵母或霉菌类型的至少一种微生物的装置,该装置能够实施本发明的检测方法,并且至少包括:
74.‑
固体检测支持物,其旨在接收可能包含至少一种微生物的所述待分析样品;
75.‑
存储所述微生物的至少一种细胞标记物的元件;
76.‑
用于以受控方式释放所述细胞标记物以使所述标记物与所述待分析样品接触的元件;
77.‑
照射所述检测支持物的元件;
78.‑
用于采集所述检测支持物的至少一部分的图像的光学装置,所述光学装置具有至少10mm长乘以至少10mm宽的视场;
79.‑
用于将所述光学装置采集的图像存储在存储器中并对其进行比较和分析的元件,从而根据所述至少一种微生物的染色动力学的变化来检测潜在地存在于所述样品中的所述至少一种微生物。
80.优选地,本发明的装置包括用于将所述检测支持物位移到所述光学成像装置下方的元件。
81.有利地,在本发明的检测装置中:
82.‑
所述固体检测支持物包括搁置在玻璃纤维支持盘上的至少一个滤膜;
83.‑
用于存储细胞标记物的所述元件包括在检测支持物中,并且由包封在包封元件中的所述细胞标记物所形成的微囊层组成,所述微囊层设置在所述玻璃纤维支持盘和所述滤膜之间;在这种情况下,用于以受控方式释放细胞标记物的所述元件包括加热元件以及温度控制和调节元件,其能够在装置内部产生温度升高并且能够熔化包封有细胞标记物的所述包封元件。
84.‑
所述细胞标记物储存元件由与检测支持物分开的液体细胞标记物溶液储库组成,并且所述检测装置包括用于将所述细胞标记物从所述储存元件输送至所述检测支持物的元件;在这种情况下,用于以受控方式释放细胞标记物的所述元件可以包括至少一个控流泵;
85.‑
所述光学成像装置具有约0.5mm或等于0.5mm的焦深;
86.‑
所述光学成像装置基于cmos传感器相机,
87.‑
所述光学成像装置具有25mm
×
25mm的视场;
88.‑
所述光学成像装置的分辨率至少等于20百万像素、优选大于100百万像素。
89.本发明还涉及一种能够在本发明的检测方法中实施或能够形成本发明的检测装置的组成部分的检测支持物,所述检测支持物至少由以下组成:刚性基底,其中至少一条液体馈送线路和至少一条液体抽吸和排放线路穿过该刚性基底,所述馈送线路凭借从所述基底伸出的出口延伸,并一方面穿过在所述基底上方的刚性可渗透支持元件中开出的第一孔口、另一方面穿过在由玻璃纤维制成的柔性支持盘中开出的第二孔口,所述盘位于所述刚性可渗透支持元件上并支持截止阈值为0.2μm至0.45μm的能够保留微生物的滤膜,所述检测支持物还包括夹紧环,所述夹紧环被固定成与所述基底一体化并将所述基底、所述刚性可渗透支持元件、所述支持盘和所述滤膜保持在一起。
90.本发明具有许多优点。一方面,本发明的方法基于对微生物的染色动力学的评估,使得在制备样品后最多几分钟或几十分钟内即可几乎立即检测到在所述样品中是否存在一种或多种活微生物,而无需进行培养,同时以极其可靠的方式区分这些微生物与潜在的伪像,例如灰尘等。
91.另一方面,本发明仅需要对样品进行很少的处理,并且在任何情况下都完全不需要处理细胞标记物,而所述处理的操作是复杂的,需要合格的人员并且产生不可忽略的污
染所述样品的风险。
92.从下面参照附图给出的本发明的非限制性实施方式的详细描述中,本发明的其他特征和优点将变得显而易见,在附图中:
93.‑
图1示意性地示出了将样品放置在固体检测支持物上的两个具体实施方式的不同步骤,这些步骤可以在本发明的检测至少一种微生物的方法中执行;
94.‑
图2示意性地示出了执行本发明的检测方法的各个步骤的具体方法,特别包括:将样品放置在检测支持物上,在对所述样品染色之前采集p0图像,然后在以受控方式释放细胞标记物后依次采集p1至p4的多个图像,并对各图像进行比较分析以产生分析结果;
95.‑
图3a和3b分别示意性地示出了可用于本发明的方法或装置中的检测支持物的两个非限制性示例实施方式的完整分解图和贯穿中间截面的透视图;
96.‑
图4a和4b分别示意性地示出了可用于本发明的方法或装置中的检测支持物的一个实施方式的完整分解图和贯穿中间截面的透视图,所述实施方式与图3a和3b所示的实施方式不同并且是特别优选的;
97.‑
图5显示了本发明检测方法的一个具体实施方式,其中使待测样品与微囊形式的包封的细胞标记物接触,并在外部刺激的作用下以受控方式释放细胞标记物,从而允许检测样品中潜在存在的微生物;
98.‑
图6示出了在培养阶段之后对枯草芽孢杆菌微菌落的一系列图像采集,左侧i0图像在释放细胞标记物之前已经采集,而其他图像i1至i5则在所述标记物的受控释放后以固定间隔采集,从而允许通过这些连续的图像采集来评估枯草芽孢杆菌菌落的染色动力学;
99.‑
图7显示了对检测支持物的一系列五个连续的图像采集,用符号i'0至i'4表示,在检测支持物上一方面存在灰尘,另一方面存在测试样品中的待检测细胞,在这种情况下为属于念珠菌属白色念珠菌物种的酵母。根据本发明的方法,在释放细胞标记物之前(图像i'0)和在以受控方式释放该标记物之后(图像i'1至i'4)对所述支持物拍照;该图还显示了三条曲线pr1、pr
2a
和pr
2b
,它们与图像i'0至i'4的采集并行地图示了染色后由能够吸收细胞标记物(pr1)的灰尘和酵母(pr
2a
和pr
2b
)发出的光强度随时间的变化(以灰度表示,代表像素的亮度,并以0(黑色)至255(白色)编码),尤其是随着图像的连续采集(两个连续的图像采集间隔20秒)的变化,从而显示出染色后的灰尘发出的光强度突然增加到强且随时间稳定的强度,而酵母发出的光强度随着标记物被细胞同化而逐渐增加,直到达到最大强度的峰值,然后光强度下降(也称为光漂白)。
100.如附图中的图1至图7所示,本发明首先涉及一种在固体检测支持物1,21上检测潜在地但不一定存在于待测样品3中的至少一种微生物2或多种微生物2的方法。
101.在本发明的检测方法中,在预先的培养阶段之后使所述一种或多种微生物2(不论以单细胞形式还是以微菌落形式存在)与至少一种细胞标记物4接触。
102.在下文的描述中,术语“细胞标记物”应理解为是一种能够通过发光、特别是通过荧光、可选地通过生物发光、或者甚至通过染色来显现出潜在地存在于待测原始样品中的微生物的物质,应当理解,该细胞标记物可以优选为能够仅显现出活微生物或能够区分活微生物和非活微生物、或者甚至能够仅染色某些感兴趣的病原微生物的荧光标记物。
103.应当注意,待测样品3可以源自例如但不限于制药或食品加工业,或者可以由临床或医学微生物学中的人类来源的样品或环境来源的样品组成,并且在所述样品3中要检测
的微生物2主要属于细菌、酵母或霉菌类型。
104.在本发明的检测方法的第一步a)中,将待测品3放置在所述固体检测支持物1,21上,所述固体检测支持物1,21优选包括至少一个滤膜5,25。
105.在图1底部所示的本发明的方法的步骤a)的一个示例性实施方式中,待分析的样品3由液体基质组成,其体积可以为1ml至500ml,使其通过包括至少一个滤膜5的检测支持物1来过滤,所述支持物1位于适合于过滤的装置d上。
106.所述膜5具有足够的截止阈值以保留潜在地存在于样品3中的任何微生物2,并且一方面主要去除所述样品3的残留液体,另一方面可选地去除其中包含的尺寸小于截止阈值的杂质。
107.因此,不论选择用于执行本发明的方法的第一步a)的实施方式如何,所述膜5,25的截止阈值优选为0.20至0.45μm。甚至更优选地,该膜5,25的截止阈值等于0.30μm或约为0.30μm。
108.这样的截止阈值使得可以将可能存在于样品3中的尺寸在约0.5至约10μm之间变化的细菌、酵母和霉菌类型的所有微生物2都保留在所述膜5,25的表面上。
109.但是,应该指出的是,使用这样的截止阈值不仅促进了微生物2与样品3其余部分的分离,而且还提高了最初也存在于所述样品3中的大多数惰性颗粒(例如灰尘)的保留率。
110.在本发明的方法的步骤a)的第二示例性实施方式(图中未示出)中,通过合适的过滤装置d上的滤膜5过滤体积在1至500ml之间的液体样品3,所述膜5的截止阈值为0.20μm至0.45μm,优选等于0.3μm。
111.一旦样品3已经被过滤,将滤膜5从过滤装置d上移除以放置在检测装置1上。
112.所述检测支持物1还可以补充有至少一个由可渗透材料(例如玻璃纤维)制成的支持盘13。
113.附图3a和3b中特别示出了这样的支持盘13,在支持盘13上可选地搁置有已从装置d上移除的滤膜5,从而在该示例性实施方式中形成固体检测支持物1。
114.在应用于体积更小的样品3(通常为10至2,000μl或更小)的第三示例性实施方式中,所述样品3被直接接种在至少包括膜5,25和支持盘13,23的检测支持物1,21上,如图1的上部所示。
115.然后,优选地,将所述检测支持物1插入能够执行本发明的方法的全自动检测装置14中。所述装置14将在下文中更详细地描述。
116.应当注意,在一个特别有利的示例性实施方式中,放置样品3的步骤a)所使用的检测支持物21被配置为优选地允许在滤膜25上放置10至2,000μl的小体积的样品3,或直接过滤大于2,000μl(通常至多100ml)的更大体积的样品3,而无需使用专用于此操作且在检测装置14外部的过滤装置d。
117.即使在将小体积放置在滤膜上的情况下,样品3也可以在检测装置14中以自动方式过滤。
118.在下面的描述中,将参照图4a和4b详细描述检测支持物21。
119.应当注意,以常规方式,将样品3处理并放置在支持物1,21上的这些操作可以优选地由操作人员在无菌气氛中进行,例如通过在生物安全橱bsc中进行所述操作,如图1中可见。
green cmfda*”,氧化还原标记物,例如刃天青或四唑鎓盐,或试剂盒例如“live/dead viability*”试剂盒中的细胞标记物,本段中提及的后面带星号的试剂名称为注册商标。
135.也可以使用来自上述细胞标记物的多种细胞标记物的组合。
136.应当注意,在本发明的方法中使用荧光细胞标记物4的情况下,光辐射6选自激光束和一个或多个发光二极管,后一种方案是特别优选的。
137.在本方法的替代性实施方式中,在步骤d)中,还可以使存在的一种或多种潜在微生物2与至少一种非荧光但可见的可检测细胞标记物4接触。
138.所述细胞标记物4可以进一步由生物发光标记物组成,应当理解,在这种情况下,本发明的检测微生物的方法通过去除一个或多个照射检测支持物1,21的步骤来实施。换言之,除了照射支持物之外,本说明书中详细描述的本发明的方法的所有其他步骤、替代性实施方式和示例性实施方式均适用于利用生物发光来检测微生物的方法(如果证明适用且可行的话),当然,其使用合适的生物发光标记物。
139.在任何情况下,特别有利的是,在受控释放步骤d)的第一种精确且非限制性的实施方式中,在本发明的方法中将以受控方式释放的细胞标记物4被包封在包封元件8中,由此有利地形成直径为例如约100μm的微囊、微珠或微球9。
140.优选地,包封元件8对外部刺激10的施加是敏感的,从而使其破裂并释放细胞标记物4。
141.因此,优选地,包封元件8是由热敏脂质蜡形成的,并且所包封的标记物4的释放是通过向所述包封元件8逐渐施加升温来实现的,以使得包封元件8熔化并释放出标记物4与所要检测的潜在的微生物2接触。
142.在这种情况下,所述热敏包封元件8所经受的温度可以从环境温度逐渐升高到不超过45℃的温度,超过该阈值可能破坏某些微生物2。
143.在本发明中,细胞标记物4的释放优选地以自动化方式进行,从而使其免于构成污染源的任何手动操作,并且被控制为以足够量的标记物4和正确的动力学发生释放,从而高效地染色微生物2。
144.根据第一替代性实施方式,细胞标记物4以液体形式包封,因此微囊9除所述标记物4外还包含用于溶解其的溶剂。
145.在第二替代性实施方式中,细胞标记物4以固体形式、特别是粉末形式包封。在释放细胞标记物4后,将其置于合适的溶解溶剂(例如水)的存在下,从而可以发生对微生物2的染色。
146.优选地,在该替代性实施方式中,用于溶解固体细胞标记物4的溶剂包含在玻璃纤维支持盘13中,并且样品3所通过的滤膜5设置在所述支持盘13上方。
147.因此,一旦滤膜5已放置在支持盘13上方(在对样品3进行外部过滤之后),或者一旦已在检测支持物1中的滤膜5上直接放置并过滤了样品3,则无论样品3的体积如何,在包含细胞标记物4的微囊9的层位于所述膜5和所述盘13之间的情况下,所述支持盘13都会浸渍有足够的溶剂以允许在细胞标记物4从其囊9中释放出(例如通过升温来释放)时会溶解。该示例在图3b中示出。
148.在图3b所示的构造中,支持盘13也可以用合适的溶剂浸渍,并保持在能够熔化包封层8的温度下,从而释放出固体粉末形式的被包封的细胞标记物4,同时使其溶解以显现
出膜5上微生物2的潜在存在。
149.在任何情况下,当包含固体或液体形式的细胞标记物4的微囊9的层位于支持盘13上方时,在所述微囊9破裂后,其主要功能是通过扩散使所述标记物4在膜5下方的分布均匀化,膜5本身放置在微囊9层的上方。因此,本发明的方法将显现出在所述膜5处可能存在的每种微生物2。
150.还应当注意,在步骤d)的该实施方式中,以及当在固体检测支持物1(其同样可以由包围微囊9的层的至少一个支持盘13和滤膜5形成)上直接进行放置小体积(10至2,000μl)的样品3的步骤a)时,所述支持盘13还具有支持所述微囊9的功能,以防止微囊在放置过程中与过滤液一起排出。
151.在图3a中,微囊9的层放置在例如由玻璃纤维制成的支持盘13的下方,并且在细胞标记物4以受控方式释放时,所述盘13确保所述微囊9或细胞标记物4的毛细扩散以及这些扩散的微胶囊9在滤膜5下方的均匀分布。
152.通过破坏包含所述标记物4的包封元件8来以受控方式释放细胞标记物4的实施方式尽管被证明是特别令人感兴趣的,但不能认为是本发明方法的步骤d)的唯一实施方式。
153.实际上,在该步骤d)的第二实施方式中,细胞标记物4以液体溶液的形式并且以受控的自动化方式直接输送,例如以用适当手段(例如控流泵)控制的流速输送,以使其与存在于检测支持物1,21的滤膜5,25的表面上的一种或多种微生物2接触。
154.在这种情况下,无论选择何种模式使细胞标记物4以受控方式与一种或多种微生物2接触,所述标记物4(无论其优选地是荧光的还是生物发光的或其他)都优选对潜在地存在于膜5上的微生物2具有最小限度的毒性。
155.实际上,如果在实施该方法的过程中以及在某些应用中(特别是在工业制药领域中)检测到样品3有污染,则随后鉴定所检测到的微生物2的能力可能会特别受关注。
156.因此,图2所示的这种鉴定步骤12可以如下进行:在检测之后培养样品3,特别是通过移除滤膜5,25并将其放置在合适的营养琼脂上以使微生物繁殖,然后执行本领域技术人员熟知的常规鉴定方法,例如质谱法。
157.在本发明的检测一种或多种微生物的方法中,在以受控方式释放至少一种细胞标记物4的步骤结束时,在步骤e)中以及在阶段p0之后的至少一个阶段p
i
中,采集至少一个图像i
i
,其中i是大于或等于1的整数。
158.图6和图7分别示出了在阶段p0期间以及在p0之后的多个后续阶段期间采集的连续图像i0至i5和i'0至i'4。
159.在适当时,将在至少一个后续阶段p
i
中采集的每个图像i
i
分割成所述检测支持物1,21的多个部分。
160.这样连续的图像采集,即在通过控释细胞标记物4而对微生物2进行染色之前采集一个图像(例如i0)、并在该释放之后采集至少另一个图像(i
i
),使得可以表征这些微生物2的染色动力学,即,所述微生物的行为变化,特别而言,优选荧光变化、可选地为生物发光的变化,这些变化对应于在第一次采集图像i0(无标记物4)和释放标记物后至少第二次采集图像i
i
之间微生物对标记物4的同化。
161.这使得可以将惰性颗粒(例如,容易发出例如天然荧光的灰尘)的行为与在执行所述方法时被有效染色的微生物2的行为区分开。
162.实际上,在利用荧光细胞标记物4来显现出潜在微生物2的这种前提下,在所述标记物4的受控释放之前的图像i0以及在该释放后的至少在一个图像i
i
中,将能够看到并检测到天然发荧光并保留在滤膜5上的惰性颗粒或灰尘,而所述微生物2将仅能够在图像i
i
中、特别是在图像i1或i'1中看到和检测到。
163.在随后的步骤f)中,对所述图像i0和i
i
、特别是至少i1或i'1进行比较分析,这将得出在原始样品3中是否存在微生物2的结论。
164.考虑到在阶段p0期间所述检测支持物1,21沿着不同的路径经历了n次位移的前提,在阶段p
i
期间使该支持物1,21再次经历n次相同的位移,使得在p0和p
i
分别采集的图像i0和i
i
可以在后续的比较分析步骤(步骤f))中进行比较。
165.此外,类似的逻辑适用于后续图像(如果存在的话)。
166.实际上,在图6和图7所示的一个优选实施方式中,在第一后续阶段p1期间进行图像i1、i'1的第一采集之后,在可变的时间之后,约几秒钟到几十秒钟,例如10到30秒,对所述支持物1的已在阶段p0和p1期间采集过图像的每个部分再次采集图像i2、i'2。
167.因此,在本发明的检测方法中,在控释细胞标记物4的步骤d)之后且在比较分析图像i0、i'0;i1、i'1;i2、i'2等的步骤f)之前,可以适宜地且有利地重复多次采集图像i
i
的步骤e),图像i
i
的连续采集间隔10至30秒(优选等于20秒)的时间。
168.不言自明,每个图像由装置14存储在存储器中,用于后续的处理操作,特别是用于比较。
169.优选地,在比较分析步骤f)之前,将本方法的步骤e)连续重复三次,从而在后续的图像采集阶段p1、p2和p3期间,对检测支持物1,21的已在p0采集过图像的每个部分分别生成三个图像i1,i'1;i2,i'2;i3,i'3。
170.甚至更优选地,对检测支持物1,21的已在阶段p0查看过的每个部分,生成从i1到i5或从i'1到i'5的五个图像(但图像i'5未在图7中示出)。
171.因此,在将样品3放置到检测支持物1,21上之后并且还在首次采集阶段p0中的图像i0之后,通过以特别原始的方式释放细胞标记物4,假定存在于所述样品3中的微生物2将在短时间(约几分钟)内被染色,优选与单细胞标记物阶段一样早,这对应于微生物2对细胞标记物4的同化反应的动力学,从而通过在各个阶段p0、p1等期间对染色后的支持物1、2连续采集图像i0,i'0;i1,i'1等而获得快速检测结果。
172.根据在该方法的步骤d)中使用的细胞标记物4的特性,其被微生物2同化的生化反应可以特别地是酶促反应或氧化还原反应,或者甚至是将所述标记物插入核酸碱基之间的反应。
173.对潜在地存在于待测样品3中的微生物2的染色动力学的表征还使得可以快速地将易于天然发出荧光的惰性颗粒或灰尘的行为与所述微生物2的行为区分开,从而与现有技术中提出的系统相比显著减少了假阳性。
174.从上面还清楚的是,本发明方法的实施允许检测可能包含在原始样品3中的对应于cfu(即,根据领域技术人员所使用的术语,集落形成单位)的单一污染物。
175.在对第一阶段p0期间采集的图像i0;i
’0与至少图像i
i
(例如,图像i1;i'1)进行比较分析的步骤f)的结束时,得出所述样品3是否被污染的结论,这已在说明书上文中提及,并且其有利地借助于图像检测和处理算法11来实现。
176.还应当注意的是,当在分析步骤f)中检测到至少一种污染性微生物2的存在时,可以执行对存在于样品3中和检测支持物1,21上的一种或多种微生物2进行计数的步骤g)。
177.该可选步骤g)也可以由算法11来执行。
178.因此,该算法11必须特别地允许通过评估所述微生物2随时间的行为变化并通过将其与任何潜在的伪像(特别是灰尘)区分开来尽可能准确地快速检测出在图像i1、i'1、i2、i'2等中是否存在微生物2,然后必须允许对这些微生物2进行计数。
179.此外,算法11优选能够检测尺寸约等于或小于光学成像装置7的传感器的分辨率的要素(灰尘、微生物等)。
180.这是本发明的主要优点之一:使用基于微生物2对细胞标记物4的同化作用的动力学的方法,在一定程度上克服了光学分辨率要求。
181.实际上,可以在单个像素上检测到由染色动力学引起的荧光强度变化。因此,微生物2的尺寸不必大于像素的尺寸。在一些情况下,由比像素小的微生物2发出的光强度刚好足以照亮所述像素。尽管该强度可能不足以确定地检测微生物2,但是染色期间的强度变化对于其检测而言可能是足够的。
182.优选地,在细胞标记物4的受控释放之后,执行采集检测支持物1,21的图像i
i
的步骤e),其在释放所述标记物4之后的时间延迟通常为20至300秒,在用例如吖啶橙染色的情况下优选为80至160秒。
183.在标记物4的受控释放之后、因此在所述标记物4与潜在地存在于检测支持物上的微生物2接触之后的这种时间延迟(之后再采集图像i
i
)使得可以确保所述微生物2已正确同化了所述标记物4。
184.在一个非常优选的示例性实施方式中,在进行每个图像采集(既包括在第一阶段p0中步骤b)对图像i0、i'0的初次采集,也包括在至少一个后续阶段p
i
中进行的对图像i
i
的采集)的同时或几乎同时,用能够显现细胞标记物4的光辐射6局部地照射检测支持物1,21。
185.换言之,在图像采集阶段p0和p
i
之外,可以不用光辐射6照射检测支持物1,21。
186.应当注意的是,优选地,本发明的方法至少包括以下步骤,依次为:
187.a1)将待分析的样品3放置在所述固体检测支持物1,21上;
188.b1)用能够显现出所述至少一种细胞标记物4的光辐射6来局部地照射所述检测支持物1,21;
189.c1)与照射步骤b1)同时地,利用分辨率至少等于20百万像素且视场为至少10mm长、至少10mm宽的光学成像装置7,采集所述检测支持物1,21的至少一部分上的所述样品3的第一阶段p0中的至少一个图像i0、i
’0;
190.d1)通过所述检测支持物1,21进行所述细胞标记物4或一系列细胞标记物4或试剂的受控释放,从而使所述标记物4与所述微生物2接触;
191.e1)在所述细胞标记物4的受控释放步骤d1)后少于5秒的时间内,用能够显现出所述至少一种细胞标记物4的所述光辐射6来局部地照射所述检测支持物1,21;
192.f1)与照射步骤e1)同时地,在所述标记物4的受控释放步骤之后,在至少一个后续阶段p1中,对所述检测支持物1,21的已在p0阶段采集过图像的每个部分采集图像i1、i
’1;
193.g1)用所述光辐射6再次局部地照射所述检测支持物1,21至少一次;
194.h1)与照射步骤g1)同时地,在至少一个第二后续阶段p2中,对所述检测支持物1,
21的已在p0阶段采集过图像i0、i
’0和在p1阶段采集过图像i1、i
’1的每个部分采集图像i2、i
’2,从而根据所述微生物2的染色动力学的变化来检测所述至少一种微生物2;
195.i1)对于所述检测支持物1,21的每个部分,在p0采集的所述图像i0、i
’0和至少两个后续阶段p1和p2采集的所述图像i1、i
’1;i2、i
’2之间,进行比较分析,并得出在所述样品3中是否存在至少一种微生物2的结论。
196.采集图像i2、i'2的步骤g1)和h1)优选在采集图像i1、i'1的步骤f1)后20至300秒、优选80至160秒的时间内执行。
197.应当注意,说明书上文所述的步骤a)至f)的替代性实施方式或优选实例也适用于上文段落中所呈现的方法的相应步骤a1)至i1)。
198.这种方法特别受关注,因为在一方面它可以有效地区分:
199.‑
第一类惰性颗粒或灰尘,它们天然发出例如荧光或生物发光,并且在细胞标记物4的受控释放步骤d1)之前的第一阶段p0采集的图像i0、i'0中,将观察到这些颗粒或灰尘;
200.‑
第二类惰性颗粒或灰尘,它们不是自发荧光的(因此在图像i0、i'0中不可见),但是在细胞标记物4的受控释放后会迅速吸收细胞标记物4,因此该灰尘在图像i1、i'1中清晰可见;
201.‑
潜在地存在于待分析的原始样品3中的一种或多种微生物2,其在图像i0、i'0中不可见,但低光强度下可以在图像i1、i'1中开始出现,然后在更高的光强度下在图像i2、i'2以及潜在的后续图像中清晰可见,可以理解的是,可以根据需要将步骤g1)和h1)重复多次,以在后续阶段p2、p3等中采集图像。
202.图7示出了图像i'0至i'4的一系列采集,并且将这些图像(特别是图像i'1至i'4)中的一些可见要素与曲线pr1、pr
2a
和pr
2b
匹配,这些曲线示出了在细胞标记物4以受控方式释放并与所述要素(在这种情况下为存在于样品3中和固体检测支持物1,21上的灰尘和白色念珠菌酵母)接触的时刻(横坐标为0)之后,所讨论的要素的光强度随时间的变化。
203.在细胞标记物4的受控释放步骤之前采集的图像i'0中没有可见要素。因此,该图像i'0表明在所述原始样品3中没有天然发光的灰尘。
204.在接下来的图像i'1至i'4中,在染色后可以看到存在于所述样品3中的一些要素具有强且随时间基本恒定的光强度。在这种情况下,在连续图像i'1至i'4之间的比较得出以下结论:这是吸收了细胞标记物的灰尘,并且与所鉴定的光点相关联地图示出了其曲线pr1。
205.在染色后连续的图像i'1至i'4中,还可以看到其他要素,在这种情况下为微生物,其光强度显示在曲线pr
2a
和pr
2b
上,且随时间逐渐增加直到达到强度峰值为止,这对应于微生物2(在这种情况下为白色念珠菌酵母)对细胞标记物4的逐渐同化,之后该光强度也以逐渐的方式下降,这与光漂白现象相对应。
206.应该注意的是,当在本发明方法的第一步a1)中将天然发光的惰性颗粒(例如灰尘)放置在检测支持物1,21上时,它将在图像i'0和所有后续图像i'
i
中可见。因此,通过实施本发明的检测方法,也可以将这种灰尘与微生物2区分开。
207.本发明还涉及一种装置14,该装置用于自动检测潜在地存在于待测样品3中的属于细菌、酵母或霉菌类型的至少一种微生物2,并且能够执行上述检测方法的步骤。
208.有利地,本发明的装置14至少包括:
209.‑
固体检测支持物1,21,其用于接收可能包含至少一种微生物2的所述待分析样品
3。该支持物1,21优选由至少一个供样品3通过的滤膜5,25以及其上搁置有膜5,25的支持盘13、23组成。
210.在图3a和3b所示的实施方式中,检测支持物1可以补充有保护盖16和用于将支持物1的所有元件保持在刚性支持板18上的元件,该保持元件能够为箍17的形式
211.在另一个实施方式中,如图4a和4b更具体所示,包含搁置在玻璃纤维支持盘23上的滤膜25的检测支持物21补充有:
212.·
支持元件24,该支持元件是刚性的并且特别由塑料材料制成,并且通过存在多个圆形穿孔和/或长方形(oblong)穿孔而具有可透性,所述刚性支持元件24在下文的描述中也称为排液器24;后者的形状和尺寸与支持盘23和滤膜25的形状或尺寸相似或有些相似。
213.·
刚性基底26,其由例如塑料材料制成,一方面,馈送液体(在此情况下是细胞标记物4)的馈送线路26a穿过所述刚性基底26,所述线路26a凭借从所述基底26伸出的出口26b延伸,并穿过在排液器24中开出的第一孔口24a和在由例如玻璃纤维制成的支持盘23中开出的第二孔口23a;另一方面,用于液体的抽吸和排放线路26c穿过所述刚性基底26,该线路26c通过适当的方式连接到接收器以接收排放的残留液体,以进行后续处理或将其销毁。
214.·
夹紧环27,其将检测支持物21的所有部件保持在一起使得它们彼此成为一体;为此,夹紧环27和基底26优选具有螺纹,并且所述夹紧环27能够夹紧检测支持物21的所有部件。
215.·
垫圈28,可以添加该垫圈以确保对检测支持物21的防漏密封。
216.‑
存储所述微生物2的至少一种细胞标记物4的元件。
217.在图3a和3b所示的一个实施方式中,存储元件19包括在检测支持物1中。更具体而言,这种存储元件19优选位于滤膜5的下方,并且优选位于所述膜5和玻璃纤维支持盘13之间。这种存储元件19也在图5中示出,并且有利地采取微囊9的层的形式,该层中的每个微囊9由包封在包封元件8中的细胞标记物4形成。该储存元件19也可以适宜地位于玻璃纤维支持盘13的下方,因此滤膜5直接搁置在支持盘13上。
218.在检测装置14包括图4a和4b中所示的检测支持物21的另一实施方式中,用于存储细胞标记物4的元件由标记物4的液体溶液的储库组成,该储库与所述检测支持物21分开,因此所述装置14包括用于将细胞标记物4从所述存储元件输送到所述检测支持物21的元件。输送液体形式的细胞标记物4的这些元件因此通过适当的连接手段连接到检测支持物21的基底26的液体馈送线路26a。经由馈送线路26a,然后经由基底26的出口26b(其经由孔口24a穿过排液器24并经由孔口23a穿过支持盘23),液体形式的细胞标记物4在这种情况下将被直接输送到所述支持盘23的顶部,并位于可能包含待检测微生物2的滤膜25下方。
219.‑
用于以受控方式释放所述细胞标记物4的元件15,以使所述标记物4与待分析的所述样品3接触。
220.在用于存储至少一种细胞标记物4的元件采取微囊9的层的形式的实施方式中,这样的元件可以包括例如加热检测支持物1的元件,并与控制和调节温度的常规元件相联,由此施加升温以熔化包封元件8并释放出标记物4。
221.在另一个示例性实施方式中,优选为液体形式的细胞标记物4可以在适当的时候从单独的储库由下方(特别是由支持盘13、23下方)逐渐输送至检测支撑物1,21,并借助于
该盘13、23通过毛细作用来扩散,从而使标记物4与能够保留在膜5,25上的微生物2接触。图2中以注射器形式图示的控释元件15可以由抽吸液体标记物4的元件和调节馈送流速的元件(例如控流泵)组成。
222.‑
照射所述检测支持物1,21的元件6,其能够显现出细胞标记物4,特别是基于激光束或者甚至更优选地基于大功率发光二极管;
223.‑
光学装置7,其用于对所述检测支持物1,21的至少一部分采集图像,并位于该支持物1,21上方,所述光学装置7的分辨率优选至少等于20百万像素、更优选至少等于等于100百万像素。该光学装置7更优选具有约0.5mm或等于0.5mm的焦深,以克服与待观察的检测支持物1的平整度有关的缺陷。有利的是,它由具有cmos传感器的相机组成,并具有尺寸为例如至少10mm长、至少10mm宽,甚至更优选为25*25mm的视场。
224.在必须将检测支持物1,21划分为多个部分来在染色前后采集图像并观看更宽的视野的情况下,检测支持物1,21还可以与用于使所述检测支持物1,21位移到该光学成像装置7下方的元件配合。这些位移元件未在图中示出。
225.‑
用于存储在存储器中的元件,其用于比较和分析由光学装置7采集的图像,从而根据所述至少一种微生物2的染色动力学的变化来检测潜在地存在于所述样品3中的所述至少一种微生物2。这种分析元件优选包含图像检测和处理算法11。
226.图4a和4b示出了固体检测支持物21的一个特别优选的实施方式,该固体检测支持物21用于接收可能包含至少一种微生物2的所述待分析样品3,可以在本发明的检测方法中实施,或者可以是能够实施该方法的步骤的检测装置14的一部分。
227.如图4a和4b所示,该检测支持物21包括至少一个供使样品3穿过的滤膜25,和其上搁置有膜25的玻璃纤维支持盘23。
228.这种检测装置还设置有刚性支持元件24或排液器24,其通过过多个圆形穿孔和/或长方形穿孔而具有可透性。位于所述滤膜25下方的玻璃纤维支持盘23搁置在该排液器24上。因此,支持盘23、排液器24和滤膜25这三个元件有利地具有基本上圆形的形状,以及相似或略相似的尺寸。
229.这种刚性可渗透支持件24特别保持了由其支持的柔性元件盘23和膜25的平整度,所述柔性元件在实施本发明的方法时、或者因在所述膜25的表面上放置样品3、因抽吸残留液体等而能够变形。此外,由于存在许多穿孔,可以通过该支持件24排出液体。
230.所述刚性支持件或排液器24本身安装在刚性基底26上,至少一条液体馈送线路26a穿过该刚性基底,并且至少一条液体抽吸和排放线路26c穿过该刚性基底。
231.所述馈送线路26a用来将液体细胞标记物4输送至检测支持物21,所述线路26a还凭借从所述基底26伸出的出口26b延伸,并一方面穿过在排液器24中开出的第一孔口24a、另一方面穿过在玻璃纤维支持盘23中开出的第二孔口23a,从而使液体细胞标记物4与滤膜25直接接触,并因此与其中可能包含的微生物2接触。
232.除了馈送线路26a之外,至少一个用于液体的抽吸和排放线路26c也穿过基底26,无论该液体是与滤膜25接触之后多余的液体细胞标记物4还是任何其他液体,例如,经膜25过滤后的样品3的残留液体或洗涤液。
233.夹紧环27将检测支持物21的所有部件保持在一起,使得它们彼此成为一体,并且可选地,垫圈28补充了所述支持物21。
234.应当注意的是,不论对于检测支持物1,21选择何种实施方式,滤膜5,25都有利地是深色的,优选是黑色的,这是为了允许借助于发射光和所述滤膜5,25的暗阴影之间的反差来最佳地显现细胞标记物4的荧光或生物发光。
235.如果为了检测单细胞阶段的细胞或微生物2而实施本发明的检测方法或检测装置14,则优选由聚酯或聚碳酸酯制成的膜5,25,而为了检测微菌落形式的细胞簇,在培养阶段后,优选的是由硝酸纤维素或酯制成的膜5,25。
236.一般而言,如果被证明是适当和可行的,则上述用于检测方法的元件可以应用于本发明的检测装置以及检测支持物1,21,反之亦然。
237.不言而喻,本发明不限于以上示出和描述的实例,在不脱离本发明的范围的情况下,可以对其进行替换和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1