分离装置及使用该分离装置对分离对象物进行分离的方法与流程
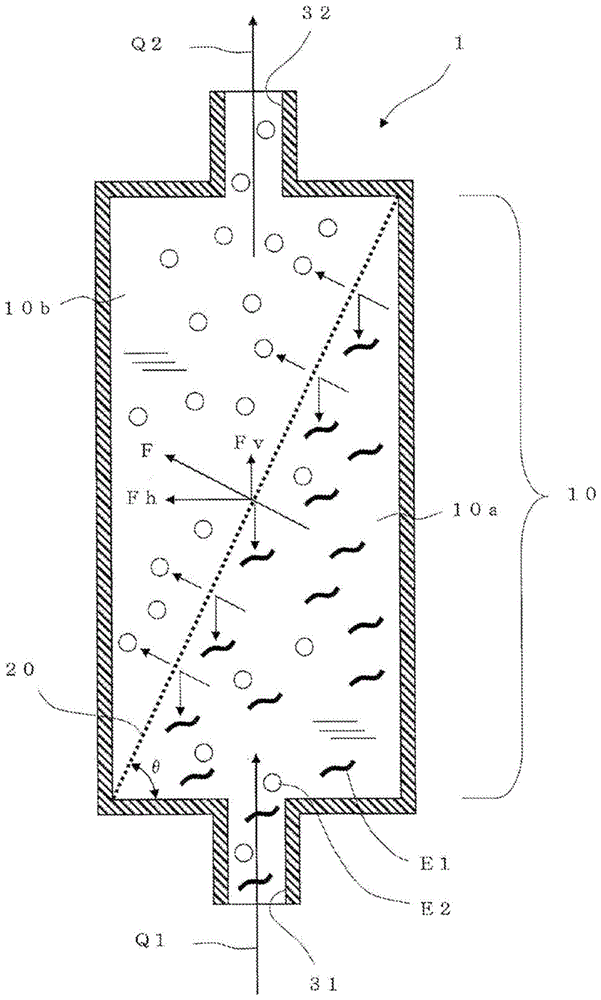
本发明涉及用于将通过使用微细的支架材料进行的粘附性细胞的悬浮培养得到的悬浮液中的分离对象物从液体中分离的分离装置、及其用途。
背景技术:
:近年来,报道了下述技术:使提高了向水中的分散性的、由多糖类(壳多糖(chitin)等非水溶性多糖类)形成的纳米纤维分散于液体培养基中而作为微细的支架材料,将动植物细胞及/或组织以悬浮状态进行培养(专利文献1)。通过使用前述的纳米纤维作为支架材料,将间充质干细胞、脂肪祖细胞等粘附性细胞以粘附于该纳米纤维的状态进行培养,从而能够将该细胞在静置的状态下悬浮培养。该纳米纤维在液体培养基中是不溶性的,具有在该液体培养基中悬浮、使细胞粘附的活性。因此,在使用了该纳米纤维的悬浮培养中,粘附于该纳米纤维的间充质干细胞、脂肪祖细胞显示出长期的存活性,在维持其性状的同时在该纳米纤维上良好地增殖。现有技术文献专利文献专利文献1:国际公开第2015/111686号技术实现要素:发明所要解决的课题前述的纳米纤维是生物降解性的,可以利用分解构成该纳米纤维的多糖类(例如壳多糖)的酶(多糖类分解酶)来进行分解。本申请的发明人着眼于此点,发现若在液体培养基中对培养细胞所粘附的纳米纤维应用前述多糖类分解酶,则能够在不使用蛋白质分解酶、即抑制对培养细胞的损伤的同时,分离培养细胞。然而,使用多糖类分解酶来分离在粘附于前述纳米纤维上的状态下生长的培养细胞时,需要利用该多糖类分解酶将前述纳米纤维充分分解、使残留的培养细胞沉降并进行回收这样的工艺。已获知在这样的回收工艺中会产生下述额外的问题:伴随着培养大量的细胞,多糖类分解酶也被大量需要;未分解的多糖类残留,混杂在回收的培养细胞中。另外还获知,对于利用培养细胞在液体培养基中因自重而沉降这一点的工艺而言,回收需要较长时间,因此不理想;对于利用离心分离的工艺而言,培养细胞受到损伤,因此不理想。另一方面,在细胞培养中,有时将由经培养的细胞生产的体液因子(培养细胞分泌至液体培养基中的物质、通过溶解培养细胞而得到的物质等)作为应回收的对象物。例如,对在悬浮于液体培养基中的微细支架材料上附着的细胞分泌至液体培养基中的物质进行回收的情况下,需要将(支架材料和在其上附着的培养细胞)、与(液体培养基)分离并回收液体培养基。另外,对培养细胞中包含的物质进行回收的情况下,需要利用试剂将培养细胞溶解在液体培养基中,将(支架材料)与(溶解了培养细胞的液体培养基)分离并回收该(溶解了培养细胞的液体培养基)。如前述那样液体为通过对象物的情况下,作为不利用离心分离的简单的回收方法,可考虑使用多孔性的过滤器、仅使液体通过并进行回收的方法。然而,已获知在使用多孔性的过滤器的方法中,该过滤器由于(支架材料和在其上附着的培养细胞)或(支架材料)而快速堵塞,因此需要频繁地更换过滤器,难以高效地回收液体培养基本身。本发明的目的在于,消除前述的问题,提供在使用了微细的支架材料的粘附性细胞的悬浮培养中能够将分离对象物更高效地分离而得到通过对象物的分离装置、及使用该分离装置的分离对象物的分离方法。用于解决课题的手段本发明的主要构成如下所述。〔1〕一种分离装置,其用于从通过使用了微细的支架材料的粘附性细胞的悬浮培养得到的悬浮液分离该悬浮液中包含的固态分离对象物,该分离装置具有分离室,该分离室至少具有第1室和第2室,第1室与第2室被分离用网状结构分隔开,以进入该分离装置内的前述悬浮液中的液体从第1室通过前述分离用网状结构而移动至第2室、然后从该分离装置流出的方式构成内部流路,前述分离用网状结构具有以抑制前述分离对象物的通过的方式预先确定的大小的网眼,将前述分离用网状结构以前述悬浮液中的液体通过前述网眼时的该液体的行进方向具有垂直向上的方向成分的方式配置在前述分离室中。〔2〕如前述〔1〕所述的分离装置,其中,前述悬浮液中包含应与前述液体一起通过前述分离用网状结构的固态通过对象物,前述分离用网状结构具有以抑制前述分离对象物的通过、并且允许前述通过对象物的通过的方式预先确定的大小的网眼。〔3〕如前述〔2〕所述的分离装置,其中,前述悬浮液中的液体为液体培养基,前述分离对象物为利用将支架材料与粘附性细胞分离的试剂而在液体培养基中从细胞剥离的支架材料,通过对象物为从支架材料剥离的粘附性细胞。〔4〕如前述〔3〕所述的分离装置,其中,前述支架材料为由非水溶性多糖类形成的纳米纤维,前述粘附性细胞为选自由犬肾小管上皮细胞(mdck细胞)、中国仓鼠卵巢细胞(cho细胞)、及间充质干细胞(msc)组成的组中的细胞。〔5〕如前述〔2〕所述的分离装置,其中,前述悬浮液中的液体为液体培养基,分离对象物为附着有在液体培养基中经悬浮培养的粘附性细胞的支架材料,通过对象物为在悬浮培养中从细胞释放至液体培养基中的体液因子。〔6〕如前述〔2〕所述的分离装置,其中,前述悬浮液中的液体为含有经悬浮培养的粘附性细胞的细胞溶解物的液体,分离对象物为由于该细胞的溶解而残留在前述液体中的支架材料,通过对象物为由于该粘附性细胞的溶解而释放至前述液体中的、来源于该粘附性细胞的物质。〔7〕如前述〔1〕~〔6〕中任一项所述的分离装置,其中,前述分离用网状结构为片状,或者具有袋形状。〔8〕如前述〔1〕~〔7〕中任一项所述的分离装置,其中,第1室具有:用于使前述悬浮液从外部流入第1室的第1流入端口,用于使洗涤液或试剂从外部流入第1室的第2流入端口,和用于使分离对象物从第1室流出至外部的流出端口。〔9〕如前述〔1〕~〔8〕中任一项所述的分离装置,其中,第2室位于第1室的上方,第1室至少具有用于使前述悬浮液从外部流入的流入端口,该流入端口设置于第1室的侧壁。〔10〕如前述〔9〕所述的分离装置,其中,前述流入端口的中心轴线位于第1室的室内的总高度的40%以上的高度处。〔11〕如前述〔9〕或〔10〕所述的分离装置,其中,在第2室的上方还具有向上方层叠的1个以上的房室作为分离室,前述1个以上的房室中的和第2室相邻的房室、与第2室由额外的分离用网状结构分隔开,前述1个以上的房室为2个以上的房室的情况下,上下相邻的房室彼此由额外的其他分离用网状结构分隔开,越是位于更靠上方位置的分离用网状结构的网眼,则该网眼的开口面积变得越小,以进一步抑制前述分离对象物的通过。〔12〕如前述〔11〕所述的分离装置,其中,前述悬浮液中包含应与前述液体一起通过前述分离用网状结构的固态通过对象物,以允许前述通过对象物的通过的方式预先确定了位于最上方的分离用网状结构的网眼的大小。〔13〕一种方法,其使用前述〔1〕~〔12〕中任一项所述的分离装置,从通过使用了微细的支架材料的粘附性细胞的悬浮培养得到的悬浮液分离该悬浮液中包含的固态分离对象物。〔14〕如前述〔13〕所述的方法,其中,前述悬浮液中包含应与前述液体一起通过前述分离装置的分离用网状结构的固态通过对象物,前述分离用网状结构具有以抑制前述分离对象物的通过、并且允许前述通过对象物的通过的方式预先确定的大小的网眼,所述方法具有对通过该分离用网状结构的前述通过对象物进行回收的工序。〔15〕如前述〔13〕或〔14〕所述的方法,其中,前述悬浮液中的液体在通过前述分离装置的分离用网状结构时的流速为0.01mm/秒~25mm/秒。发明的效果本发明的分离装置(以下,也称为该分离装置)中,以悬浮液中的液体通过分离用网状结构的网眼时的该液体的行进方向具有垂直向上的方向成分的方式配置该分离用网状结构。由此,分离用网状结构的入口侧的面成为悬垂(overhang)面或朝向下方的面,因此,不能通过网眼而被该分离用网状结构捕获的分离对象物由于重力而从该分离用网状结构剥落并沉降。例如,悬浮培养中使用的微细的支架材料、细胞附着于该支架材料上而得的物质具有在液体培养基中缓缓地沉降的趋势,因此,它们被分离用网状结构捕获后,显示出由于重力而从分离用网状结构剥离并在液体中下降的趋势。因此,分离用网状结构的堵塞被抑制,能够实现高效的分离对象物的分离或除去,还能够高效地获取通过对象物。支架材料为由非水溶性多糖类形成的纳米纤维、培养细胞为间充质干细胞的情况下,该分离装置的有用性变得显著。该纳米纤维缓缓地沉降,并且,通过使用将非水溶性多糖类分解的酶,从而即使不使其完全消化,也易于从培养细胞剥离。由此,能够进一步减小培养细胞受到的损伤。若针对这样得到的悬浮液(纳米纤维和培养细胞以相互分离的状态包含于液体中的悬浮液)应用本发明的分离装置,则能够在抑制堵塞的同时从该悬浮液高效地分离纳米纤维,可以高效地回收损伤少的培养细胞。不仅上述那样的培养细胞的回收,在对悬浮培养中由细胞释放至液体培养基中的体液因子进行回收的情况、对通过该细胞的溶解而释放至前述液体中的来源于该细胞的物质进行回收的情况下,本发明的分离装置也能够在抑制堵塞的同时高效地分离悬浮液中的固态分离对象物,因此其有用性变得显著。附图说明[图1]图1为概略地示出基于本发明的分离装置的优选方式的一个例子的截面图。图中,用粗点线表示分离用网状结构的截面。该点线中的点彼此的间隔与实际的网眼的大小无关。分离对象物由暗示作为支架材料的纳米纤维的波型符号表示,通过对象物使用暗示从支架材料剥离的培养细胞的白色圆形符号表示(图2、图9、图10也同样)。[图2]图2为概略地示出该分离装置的优选方式的其他例子的截面图。[图3]图3为概略地示出该分离装置的优选方式的其他例子的端面图。该图中,为了使图简单化,用粗实线描绘出分离室的壁部。省略了分离对象物、通过对象物的图示。[图4]图4为概略地示出该分离装置的优选方式的其他例子的截面图。[图5]图5为示出作为分离用网状结构使用的筛网的构成的图。图5(a)为示出筛网的片材面的规定区域的局部放大图,图5(b)为图5(a)的x1-x1截面图。图5(b)中,对线材的截面施加了阴影线。[图6]图6为示出作为分离用网状结构使用的多孔膜的构成的图。图6(a)为示出多孔膜的片材面的规定区域的局部放大图,图6(b)为图6(a)的x2-x2截面图。图6(b)中,对膜部分的截面施加了阴影线。[图7]图7为示出该分离装置的优选方式的其他例子的图。图7(a)是为了展现该分离装置的内部而除去了侧壁部的图,图7(b)为图7(a)的x3-x3截面图。[图8]图8为示出该分离装置的优选方式的其他例子的图。图8(a)是为了展现该分离装置的内部而除去了侧壁部的图。图8(b)为示意性地示出图8(a)的分离装置的构成的一个例子的立体图。图8(c)为示意性地示出图8(a)的分离装置的构成的其他例子的立体图。[图9]图9为示出该分离装置的优选方式的其他例子的截面图。[图10]图10为示出该分离装置的优选方式的其他例子的截面图。[图11]图11为示出使用该分离装置构成的细胞培养系统的一个例子的框图及配管图。图中,用箭头表示管路和液体的流动的方向。[图12]图12为例示使用该分离装置从悬浮液回收细胞的工艺的流程图。[图13]图13为例示使用该分离装置从悬浮液回收液体培养基的工艺的流程图。[图14]图14为例示使用该分离装置回收溶解了细胞的液体培养基的工艺的流程图。[图15]图15为示出本发明的实施例1中制作的该分离装置的照片图。[图16]图16为示出本发明的实施例2的结果的显微镜照片图。[图17]图17为示出本发明的实施例3的结果的显微镜照片图。[图18]图18为本发明的实施例5中的步骤1至步骤4的各工序中得到的悬浮液的显微镜照片图。具体实施方式首先,详细说明本发明的分离装置。本发明的分离装置用于从通过使用了微细的支架材料的粘附性细胞的悬浮培养得到的悬浮液分离该悬浮液中包含的固态分离对象物。分离对象物可以是应丢弃的物质,也可以是应利用的物质。图1所示的例子中,为了进行说明,将成为悬浮培养中的支架材料的微细的纳米纤维作为分离对象物示出,将从其剥离的细胞(经悬浮培养的细胞)作为通过对象物示出。如图1所示,该分离装置1具有分离室10,该分离室10至少具有第1室10a和第2室10b。第1室10a与第2室10b被分离用网状结构20分隔开。图1的例子中,从侧向观看分离室时的形状为产生滞留等的角部(死角空间)少的圆形,但也可以为椭圆形、适当地赋予了圆度的四边形等。第1室10a中,设置有用于使悬浮液q1流入的流入端口31,第2室10b中,设置有用于使从分离用网状结构20通过的液体q2流出的流出端口32。该分离装置的整体的内部流路以下述方式构成:液体进入内部,从第1室10a通过分离用网状结构20的网眼移动至第2室10b,然后,向外部流出。分离用网状结构20具有以抑制分离对象物e1的通过的方式预先确定的大小的网眼。关于通过对象物e2,在后文中说明。这里重要的特征是,以悬浮液中的液体通过分离用网状结构20的网眼时的该液体的行进方向f具有垂直向上的方向成分fv的方式,在分离室10中配置分离用网状结构20。图1的例子中,液体的行进方向f还具有水平方向成分fh。图1的例子中,分离用网状结构20为平坦的片状筛网。该分离用网状结构以第2室10b侧的面成为倾斜面的方式倾斜配置,因此,该分离用网状结构的第1室10a侧的面成为悬垂面。分离用网状结构的第1室10a侧的面可以并非整面成为悬垂面,该分离用网状结构也可以通过弯曲、屈曲而局部包含并非悬垂面的面。另外,流入端口31并非必须设置于分离室的最下部,流出端口32并非必须设置于分离室的最上部。图1的构成中,即使在流入端口31设置于第1室10a的上部且流出端口32设置于第2室10b的下部的情况、流入端口31设置于比流出端口32更高的位置的情况下,悬浮液中的液体通过分离用网状结构20的网眼时的该液体的行进方向f也具有垂直向上的方向成分fv。通过以上的构成,捕获于分离用网状结构20的第1室10a侧的面处的分离对象物e1从该分离用网状结构剥落并沉降。因此,抑制了该分离用网状结构的网眼被分离对象物e1堵塞,悬浮液中的液体、通过对象物e2能够高效地通过分离用网状结构,被取出至该分离装置外而回收。本发明中所谓的“通过使用了微细的支架材料的粘附性细胞的悬浮培养得到的悬浮液”中,包括以下液体。(a)粘附性细胞以附着于支架材料的状态溶解或分散的液体(例如,保持悬浮培养的状态原样的液体、从其中仅将液体培养基除去规定量而得的液体等)。(b)利用降低支架材料与粘附性细胞的粘附能力的试剂,粘附性细胞从支架材料剥离、该细胞与支架材料独立地分散的液体。(c)粘附性细胞被细胞溶解试剂溶解、由此溶解或分散有从粘附性细胞剥离的支架材料和来源于被溶解的粘附性细胞的物质的液体。(d)支架材料被分解支架材料的试剂分解、由此分散有从支架材料剥离的细胞和被分解的支架材料的液体。该分离装置能够以高效地分离固体、仅使液体通过的方式使用,但前述悬浮液中也可以包含应与液体一起通过分离用网状结构的固态通过对象物。图1的例子中,如上述(b)那样,利用试剂使细胞e2从支架材料e1剥离,该细胞e2成为固态通过对象物。这样的情况下,分离用网状结构20的网眼的大小以不仅只抑制分离对象物e1的通过、而且允许通过对象物e1的通过的方式预先确定。作为悬浮液、分离对象物和通过对象物,可例示以下情况。(a)悬浮液中的液体为液体培养基,分离对象物为附着有细胞的支架材料。在该情况下,没有固态通过对象物,可以用于例如单纯的分离对象物的浓缩、在悬浮培养中从细胞释放至液体培养基中的体液因子的回收。(b)悬浮液中的液体为液体培养基,分离对象物为利用将支架材料与粘附性细胞分离的试剂而在液体培养基中从细胞剥离的支架材料,固态通过对象物为从支架材料剥离的细胞。(c)悬浮液中的液体为含有利用溶解细胞的试剂溶解的该细胞的液体,分离对象物为由于该细胞的溶解而残留在前述液体中的支架材料。没有固态通过对象物,由于该细胞的溶解而释放至前述液体中的来源于该细胞的物质为回收对象物。以下例示悬浮培养的粘附性细胞、液体培养基、用于悬浮培养的支架材料、将该支架材料与粘附性细胞分离的试剂、从粘附性细胞释放至液体培养基中的体液因子、溶解细胞的试剂、由于细胞的溶解而释放至液体中的该细胞中的物质。(悬浮培养)通过将粘附性细胞以附着于液体培养基中的适当的支架材料(以下详细说明)的状态进行培养,能够对粘附性细胞进行悬浮培养(三维培养)。本发明中,细胞的悬浮是指,细胞不粘附于培养容器的状态(非粘附),无论细胞是否沉降。关于对粘附性细胞进行悬浮培养时的温度,若是动物细胞,则通常为25至39℃,优选为33至39℃(例如37℃)。co2浓度通常在培养的气氛中为4至10体积%,优选为4至6体积%。培养期可以根据培养的目的而适当地设定。粘附性细胞的悬浮培养可以使用通常用于细胞培养的培养皿、培养瓶、塑料袋、teflon(注册商标)袋、皿、陪替氏培养皿(petridish)、组织培养用皿、多皿、微孔培养板、微孔板、多片板(multiplate)、多孔板、腔室载玻片(chamberslide)、管、盘、培养袋、滚瓶等培养容器来实施。为了使附着于支架材料的粘附性细胞不向培养容器粘附,这些培养容器优选是细胞低粘附性的。作为细胞低粘附性的培养容器,可以使用培养容器的表面未基于提高与细胞的粘附性的目的而进行人工处理(例如,基于细胞外基质等的包被处理)的容器、或培养容器的表面基于降低与细胞的粘附性的目的而进行了人工处理的容器。需要更换培养基时,可以通过进行离心分离、过滤处理而将细胞分离,然后将新鲜的培养基添加至该细胞。或者,可以通过进行离心、过滤处理而将细胞适当地浓缩,然后将新鲜的培养基添加至该浓缩液。例如,进行离心分离时的重力加速度(g)为100至400g,进行过滤处理时使用的过滤器的细孔的大小为10μm至100μm,但不限于此。粘附性细胞的培养也可以利用在机械控制下且在封闭环境下自动执行细胞接种、培养基更换、细胞图像获取、培养细胞回收、能够在控制ph、温度、氧浓度等的同时实现高密度培养的生物反应器、自动培养装置来进行。(悬浮培养的粘附性细胞)所谓“粘附性细胞”,是在存活、增殖中需要容器壁等支架的细胞。前述悬浮培养的粘附性细胞没有特别限定,例如,可举出干细胞、祖细胞、成体非干细胞、原代培养细胞、细胞株、癌细胞等。所谓干细胞,是兼具自体自身复制能力和分化为其他多个系统的细胞的能力的细胞。作为粘附性的干细胞的例子,不限于以下,可举出例如间充质干细胞、神经干细胞、造血干细胞、肝干细胞、胰脏干细胞、肌干细胞、生殖干细胞、肠干细胞、癌症干细胞、毛囊干细胞等成体干细胞等。间充质干细胞是指具有向骨细胞、软骨细胞及脂肪细胞中的全部或几种分化的能力的干细胞。间充质干细胞在骨髓、末梢血、脐带血、脂肪组织等组织中以低频率存在,可使用已知的方法从这些组织中分离。祖细胞是指处于从上述干细胞分化为特定的体细胞、生殖细胞的中途阶段的细胞。作为粘附性的祖细胞的例子,不限于以下,可举出例如脂肪祖细胞、前体心肌细胞、前体内皮细胞、神经祖细胞、肝祖细胞、胰脏祖细胞、肾脏祖细胞等。作为粘附性的成体非干细胞的例子,不限于以下,包括例如成纤维细胞、骨细胞、骨周细胞、角质形成细胞、脂肪细胞、间质细胞、上皮细胞、表皮细胞、内皮细胞、血管内皮细胞、肝实质细胞、软骨细胞、卵丘细胞、神经系统细胞、神经胶质细胞、神经元、少突胶质细胞、小胶质细胞、星形胶质细胞、心脏细胞、食道细胞、肌肉细胞(例如平滑肌细胞或骨骼肌细胞)、胰脏β细胞、黑色素细胞等。原代培养细胞是指处于将从生物体分离的细胞、组织接种、到进行第一次传代之前的培养的状态的细胞。原代培养细胞可以是从例如皮肤、肾脏、脾脏、肾上腺、肝脏、肺、卵巢、胰脏、子宫、胃、结肠、小肠、大肠、膀胱、前列腺、精巢、胸腺、肌肉、结缔组织、骨、软骨、血管组织、血液、心脏、眼、脑或神经组织等任意的组织采集的细胞。细胞株是指通过生物体外的人工操作而获得了无限的增殖能力的细胞。本发明中使用的粘附性细胞优选可举出犬肾小管上皮细胞(mdck细胞)、中国仓鼠卵巢细胞(cho细胞)、间充质干细胞(msc),更优选可举出间充质干细胞,但不限于这些。另外,粘附性细胞的来源也没有特别限定,可以是来源于动物及植物中任一者的细胞。作为动物,没有限定,可举出例如鱼类、两栖动物类、爬行动物类、鸟类、泛甲壳动物类、六足类(hexapoda)、哺乳类等,优选为哺乳类。作为哺乳类的例子,没有限定,可举出大鼠、小鼠、兔、豚鼠、松鼠、仓鼠、田鼠、鸭嘴兽、海豚、鲸、犬、猫、山羊、牛、马、绵羊、猪、大象、普通狨、松鼠猴、猕猴、黑猩猩、人等。作为植物,只要所采集的细胞可进行液体培养即可,没有特别限定。例如,可举出生产生药类(例如皂角苷、生物碱类、小檗碱、东莨菪苷、植物甾醇等)的植物(例如药用人参、长春花、莨菪、黄连、颠茄等);生产用作化妆品·食品原料的色素、多糖体(例如花青色素、红花色素、茜草色素、藏红花色素、黄酮类等)的植物(例如蓝莓、红花、茜草、藏红花等);或产生医药品原材料的植物等,但不限于这些。本发明中,优选使用哺乳类的粘附性细胞。(液体培养基)前述悬浮培养中可利用的液体培养基可以根据使用的粘附性细胞的种类等来适当地选择,例如,以哺乳类的粘附性细胞的培养为目的的情况下,可以将哺乳类细胞的培养中通常使用的培养基用作本发明的培养基组合物中包含的培养基。作为哺乳类细胞用的培养基,例如可举出杜氏改良eagle培养基(dulbecco’smodifiedeagle’smedium;dmem)、hamf12培养基(ham’snutrientmixturef12)、dmem/f12培养基、mccoy5a培养基(mccoy’s5amedium)、eaglemem培养基(eagle’sminimumessentialmedium;emem)、αmem培养基(alphamodifiedeagle’sminimumessentialmedium;αmem)、mem培养基(minimumessentialmedium)、rpmi1640培养基、伊思柯夫改良杜氏培养基(iscove’smodifieddulbecco’smedium;imdm)、mcdb131培养基、william培养基e、ipl41培养基、fischer’s培养基、stempro34(invitrogen公司制)、x-vivo10(cambrex公司制)、x-vivo15(cambrex公司制)、hpgm(cambrex公司制)、stemspanh3000(stemcelltechnologies公司制)、stemspansfem(stemcelltechnologies公司制)、stemlineii(sigmaaldrich公司制)、qbsf-60(qualitybiological公司制)、stemprohescsfm(invitrogen公司制)、mtesr1或2培养基(stemcelltechnologies公司制)、sf-900ii(invitrogen公司制)、opti-pro(invitrogen公司制)等。(用于悬浮培养的支架材料)用于前述悬浮培养的支架材料只要能使粘附性细胞悬浮培养即可,没有特别限定,优选使用由非水溶性多糖类构成的纳米纤维、微载体珠等。在微载体珠的担载体表面上使细胞成活、对包含该珠的培养基进行搅拌并以悬浮状态培养的方法通常也被称为“微载体培养”、“悬浮培养”等,本说明书中,该培养方法也包括在“悬浮培养”中。本说明书中,“纳米纤维”是指平均纤维直径(d)为0.001至1.00μm的纤维。本发明中使用的纳米纤维的平均纤维直径优选为0.005至0.50μm,更优选为0.01至0.05μm,进一步优选为0.01至0.02μm。可用于悬浮培养的纳米纤维的长径比(l/d)由平均纤维长度/平均纤维直径得到,没有特别限定,通常为2~500,优选为5~300,更优选为10~250。另外,也包括它们以二次集合体的形式缔合而成的纤维。使用纳米纤维对粘附性细胞进行悬浮培养的情况下,可以向培养基中添加另行制备的粘附性细胞并均匀地混合。此时的混合方法没有特别限制,例如可举出吹吸等采用手动进行的混合、使用磁力搅拌器、旋涡混合器(vortexmixer)、微孔板混合器、振荡机等设备的混合。混合后,可以将得到的细胞悬浮液以静置状态培养,也可以根据需要一边旋转、振荡或搅拌一边进行培养。其转速和频率可以根据本领域技术人员的目的来适当地设定。例如,将粘附性细胞从传代培养回收,使用合适的细胞解离液分散至单一细胞或与其相近的状态,将被分散的粘附性细胞悬浮于培养基中,对其进行悬浮培养(优选悬浮静置培养)。优选方式中,纳米纤维在与液体培养基混合时,在保持一次纤维直径的同时使该纳米纤维在该液体中分散,不会实质性地提高该液体的粘度,实质性地保持附着于纳米纤维的细胞,具有防止沉降而附着于培养容器的效果。所谓不实质性地提高液体的粘度,是指液体的粘度不超过8mpa·s。此时的该液体的粘度(即,下述的本发明的培养基组合物的粘度)为8mpa·s以下,优选为4mpa·s以下,更优选为2mpa·s以下。包含纳米纤维的液体的粘度例如可以在25℃条件下采用音叉振动式粘度测定(sv-1a,a&dcompanyltd.)来评价。作为构成纳米纤维的非水溶性多糖类,可举出纤维素、半纤维素等纤维素类;壳多糖、脱乙酰壳多糖(chitosan)等壳多糖类物质等,但不限于这些。非水溶性多糖类优选为纤维素、壳多糖或脱乙酰壳多糖,更优选为壳多糖。纤维素是指葡萄糖的6元环即d-吡喃葡萄糖以β-1,4糖苷键键合而成的天然高分子化合物。作为原料,可以使用例如来源于木材、竹、麻、黄麻、大麻槿、棉、农作物·食物残渣等植物的纤维素、或细菌纤维素、刚毛藻属(cladophora)、灰色植物(灰胞藻属)、法囊藻属、海鞘纤维素等微生物产生或动物产生的纤维素。对于来源于植物的纤维素而言,被称为微纤丝的非常细的纤维进一步成束而阶段性地形成原纤、薄层(lamellar)、纤维细胞这样的高级结构。另外,对于细菌纤维素而言,作为从菌细胞分泌的纤维素的微纤丝以其原本的粗细度形成微细的网状结构。本发明中,棉、细菌纤维素等高纯度的纤维素原料可直接作为原料使用,来源于除此以外的植物的纤维素等优选使用经过分离·纯化的纤维素。本发明中优选使用的纤维素为棉纤维素、细菌纤维素、牛皮纸浆纤维素、微晶纤维素等。壳多糖类物质是指选自由壳多糖及脱乙酰壳多糖组成的组中的1种以上的糖类。构成壳多糖及脱乙酰壳多糖的主要的糖单元分别为n-乙酰氨基葡萄糖及氨基葡萄糖,一般而言,n-乙酰氨基葡萄糖的含量多、对于酸性水溶液为难溶性的是壳多糖,氨基葡萄糖的含量多、对于酸性水溶液为可溶性的是脱乙酰壳多糖。本说明书中,出于方便起见,将n-乙酰氨基葡萄糖在构成糖中所占的比例为50%以上者称为壳多糖,将小于50%者称为脱乙酰壳多糖。从达成高悬浮作用的观点考虑,n-乙酰氨基葡萄糖在构成壳多糖的糖单元中所占的比例越高则越理想。n-乙酰氨基葡萄糖在构成壳多糖的糖单元中所占的比例优选为80%以上,更优选为90%以上,进一步优选为98%以上,最优选为100%。作为壳多糖的原料,可以使用例如虾、蟹、昆虫、贝、蘑菇等多种生物资源。本发明中使用的壳多糖可以是来源于蟹壳、虾壳的壳多糖等具有α型晶体结构的壳多糖,也可以是来源于海螵蛸(cuttlebone)的壳多糖等具有β型晶体结构的壳多糖。蟹、虾的外壳被作为产业废弃物处理的情况较多,从容易获得且有效利用的观点考虑,其作为原料是优选的,但为了除去作为杂质包含的蛋白质、灰分等而需要脱蛋白工序及脱灰工序。因此,本发明中,优选使用已经施以脱基质处理的纯化甲壳质。纯化甲壳质已有贩售。通过粉碎上述的含有非水溶性多糖类的原料,能够得到由该非水溶性多糖类构成的纳米纤维。粉碎方法没有限定,为了微细化至实现符合本发明目的的后述的纤维直径·纤维长度,优选高压均化器、磨床(石臼)、或者珠磨机等介质搅拌磨等能够得到强剪切力的方法。其中,优选使用高压均化器进行微细化,期望使用例如日本特开2005-270891号公报、日本专利第5232976号中公开的那样的湿式粉碎法进行微细化(粉碎化)。具体而言,可以使用通过将使原料分散而成的分散液从一对喷嘴以高压分别喷射并使其碰撞来将原料粉碎的装置、例如starburstsystem(suginomachinelimited制的高压粉碎装置)、nanovater(吉田机械兴业(株)的高压粉碎装置)来实施。使用前述的高压均化器将原料微细化(粉碎化)时,微细化、均质化的程度取决于向高压均化器的超高压腔室压送的压力、通过超高压腔室的次数(处理次数)、及水分散液中的原料的浓度。压送压力(处理压力)没有特别限定,通常为50~250mpa,优选为150~245mpa。另外,微细化处理时的水分散液中的原料的浓度没有特别限定,通常为0.1质量%~30质量%,优选为1质量%~10质量%。微细化(粉碎化)的处理次数没有特别限定,也取决于前述水分散液中的原料的浓度,原料的浓度为0.1~1质量%时,处理次数为10~100次左右可充分地进行微细化,但为1~10质量%时,有时需要进行10~1000次左右。前述微细化处理时的水分散液的粘度没有特别限制,例如,非水溶性多糖类为α壳多糖的情况下,该水分散液的粘度的范围为1~100mpa·s,优选为1~85mpa·s(利用25℃条件下的音叉振动式粘度测定(sv-1a,a&dcompanyltd.))。另外,微细化处理时的水分散液中的非水溶性多糖类的粒径也没有特别限制,例如,非水溶性多糖类为α壳多糖的情况下,该水分散液中的α壳多糖的平均粒径的范围为0.5~200μm,优选为30~150μm(利用激光衍射/散射式粒径分布测定装置la-960(堀场制作所))。需要说明的是,关于可用于悬浮培养的纳米纤维的制备方法,记载于wo2015/111686等中。作为能用于悬浮培养的微载体珠,只要能在其表面上使粘附性细胞成活、并且维持及增殖,就没有特别限定,可以使用已知的微珠。珠的形状可举出球状、长球状、椭圆体状等,没有特别限定。作为所述微载体珠的例子,可举出玻璃珠、聚苯乙烯珠、陶瓷珠等,但不限于这些。微载体珠已有贩售,根据培养的粘附性细胞的种类等而适当地选择最合适的微载体珠即可。使用微载体珠对粘附性细胞进行悬浮培养的情况下,可以向含有微载体珠的培养基中添加另行制备的粘附性细胞并均匀地混合。此时的混合方法没有特别限制,例如可举出吹吸等采用手动进行的混合、使用磁力搅拌器、旋涡混合器(vortexmixer)、微孔板混合器、振荡机等设备的混合。混合后,将得到的细胞悬浮液在旋转、振荡或搅拌的同时进行培养,维持使细胞已成活的微载体珠悬浮的状态。其转速、频率可以根据本领域技术人员的目的来适当地设定。(将支架材料与粘附性细胞分离的试剂)作为将支架材料与粘附性细胞分离的试剂,只要是能够将支架材料与粘附性细胞分离的试剂即可,没有特别限定。作为将支架材料与粘附性细胞分离的试剂的例子,可举出“将支架材料分解的试剂”、“使细胞的粘附能力降低的试剂”等,但不限于这些。作为将支架材料分解的试剂,只要能将支架材料分解从而将支架材料与粘附性细胞剥离即可,没有特别限定。例如,使用纤维素纳米纤维作为支架材料的情况下,作为其分解酶,可以使用纤维素酶(内切葡聚糖酶(ec3.2.1.4)(“eg”)、外切葡聚糖酶或纤维二糖水解酶(ec3.2.1.91)(“cbh”)、β-葡萄糖苷酶([β]-d-葡萄糖苷葡萄糖水解酶;ec3.2.1.21)(“bg”))。纤维素原料中包含大量半纤维素的情况下,优选除了纤维素酶以外还添加木聚糖酶、甘露聚糖酶作为用于分解半纤维素的酶。另外,使用壳多糖或脱乙酰壳多糖作为非水溶性多糖类的情况下,作为其分解酶,可以使用壳多糖酶(chitinase)、壳二糖酶、壳聚糖酶(chitosanase)、β-1,3-葡聚糖酶等。也可以组合使用多种将支架材料分解的试剂。例如,使用壳多糖或脱乙酰壳多糖作为非水溶性多糖类的情况下,作为其分解试剂,可使用选自由壳多糖酶、壳二糖酶、壳聚糖酶、及β-1,3-葡聚糖酶组成的组中的2、3或4种酶的混合物。yatalase(takarabioinc.)是包含壳多糖酶、壳二糖酶、壳聚糖酶、及β-1,3-葡聚糖酶的混合物,可以优选作为将壳多糖或脱乙酰壳多糖分解的试剂使用。例如,支架材料为由非水溶性多糖类形成的纳米纤维的情况下,针对附着于该纳米纤维的粘附性细胞的悬浮液,添加该非水溶性多糖类的分解酶,将混合物孵育足以使粘附性细胞剥离的时间。该剥离中,不必使用会对所培养的细胞造成损伤的螯合剂(edta)、蛋白质分解酶(胰蛋白酶、胶原酶)。基于非水溶性多糖类的分解酶的孵育温度通常为20℃~37℃。孵育时间也取决于酶的种类等,但通常为5~60分钟。若纳米纤维发生分解,粘附性细胞从纳米纤维剥离,则可以通过供于本发明的分离装置,从而高效地回收剥离的粘附性细胞。另外,使细胞的粘附能力降低的试剂只要能使细胞的粘附能力降低,就没有特别限定。作为所述试剂,可以使用胰蛋白酶、胶原酶、透明质酸酶、弹性蛋白酶、及链霉蛋白酶等蛋白质分解酶、edta等作为使细胞的粘附能力降低的试剂。例如,支架材料为微载体珠的情况下,针对附着于该微载体珠的粘附性细胞的悬浮液,添加该试剂,将混合物孵育足以使粘附性细胞的粘附减少的时间。在该试剂的存在下的悬浮液的孵育温度通常为20℃~37℃。孵育时间也取决于酶的种类等,但通常为5~60分钟。若由于粘附性细胞的粘附能力的降低而使得粘附性细胞从支架材料剥离,则可以通过供于本发明的分离装置,从而高效地回收剥离的粘附性细胞。(从粘附性细胞释放至液体培养基中的体液因子)对于产生所期望的体液因子的粘附性细胞,以使其附着于由非水溶性多糖类形成的纳米纤维的状态实施悬浮培养,使用本发明的分离装置从培养物(例如培养上清液)中分离作为目标的体液因子,由此能够得到该体液因子。作为体液因子,可举出抗体、酶(尿激酶等)、激素(胰岛素等)、细胞因子(干扰素、白细胞介素、肿瘤坏死因子、集落刺激因子、生长因子等)、疫苗的抗原、其他生理活性物质(蛋白质、肽等),但不限于这些。产生体液因子的粘附性细胞中包括皮肤细胞、软骨细胞、肝细胞、胰脏细胞、肾细胞、间充质干细胞、脂肪细胞等非转化细胞、导入了编码该体液因子的基因、与有用物质的生物合成相关的基因而得到的转化细胞。产生所期望的体液因子的粘附性细胞优选为向细胞外分泌该体液因子的细胞。作为产生体液因子的粘附性细胞,具体而言,可举出导入了编码该体液因子的基因、与该体液因子的生物合成相关的基因而得到的hek293、cho-k1、bhk-21、mdck、vero、hepg2、mcf-7等,但不限于这些。用于生产重组蛋白质等体液因子的细胞是本领域技术人员公知的。(细胞溶解用试剂)作为细胞溶解试剂,只要具有将细胞的膜破坏或溶解而使细胞内包含的所期望的物质向细胞外溶出的作用,就没有特别限定,可以从该
技术领域:
中已知的化合物、组合物之中适当地选择使用。作为细胞溶解试剂,具体而言,可举出有机溶剂、促溶盐、表面活性剂等,但不限于这些。需要说明的是,作为细胞溶解试剂,可以使用1种试剂,也可以使用两种以上的试剂。(由于粘附性细胞的溶解而释放至液体中的该细胞中的物质)由于细胞的溶解而释放至液体中的物质包括细胞中所含的所有物质,没有特别限定,作为一个例子,可举出未被分泌至经培养的粘附性细胞的细胞外的蛋白质、病毒、核酸分子等。(分离用网状结构的配置姿态)图1的例子中,分离用网状结构是网状部分为片状(即,薄的平板状)的筛网,该分离用网状结构的第1室10a侧的面(下表面)成为悬垂面,相对于水平面仅倾斜仰角θ。为这样的构成时,虽然也根据分离室的形状的不同而不同,但由于分离用网状结构斜着横穿分离室,因此大多情况下该分离用网状结构的面积(存在网眼的面的面积)变得更大,即使流量多也可以降低线流速,故而优选。另外,若进入至第1室的液体的液流相对于分离用网状结构形成角度而碰撞,则还能够期待附着于分离用网状结构的分离对象物容易因该液体的液流而剥离这样的作用。另一方面,图2的例子中,分离用网状结构与图1的例子同样地是网状部分为片状的筛网,但该分离用网状结构的第1室10a侧的面(下表面)成为水平面(仰角θ为0度),朝向正下方的方向(换言之,悬浮液中的液体通过分离用网状结构20的网眼时的该液体的行进方向f仅具有垂直向上的方向成分fv)。就这样的方式而言,作用于被网眼捕获的分离对象物的重力全部作为与分离用网状结构的下表面垂直地撕扯的力而作用于该分离对象物,因此能够最有效地消除堵塞,是优选的。分离用网状结构的下表面与水平面之间的角度(图1的仰角θ)为0度以上且小于90度即可,在如图1的方式那样将分离用网状结构倾斜地配置并且使液体从下方流入第1室的情况下,从期待附着于分离用网状结构的分离对象物容易因该液体的液流而剥离这样的作用、抑制由分离对象物导致的堵塞的观点考虑,45度≤θ<90度为仰角θ的优选范围。如上所述,使分离用网状结构的下表面为水平面的方式(仰角θ=0度)、和使分离用网状结构的下表面为倾斜的悬垂面的方式各有优点,因此,可以根据用途、分离室的内部形状来选择优选方式。图3为图2的方式的变形,分离用网状结构20的下表面成为水平面(仰角θ为0度),并且,以该分离用网状结构的面积(存在网眼的面的面积)变得更大的方式扩宽了分离室。图3(a)的方式中,流入端口31设置于第1室的中央,流出端口32也设置于第2室的中央,液体从正下方进入第1室,向正上方通过分离用网状结构,从第2室向正上方流出。另一方面,图3(b)的方式中,流入端口31设置于第1室的侧面,流出端口32设置于与流入端口31的位置呈相反侧的、第2室的侧面,液体从侧向进入第1室,向正上方通过分离用网状结构,从第2室向侧向流出。图3的例子中,分离室的形状为在角部设置了圆度的圆柱状(旋转中心轴为纸面的纵向),但优选以液流在分离用网状结构的整面上进一步扩展的方式适当地确定该分离室的形状。(分离用网状结构的形状)分离用网状结构的形状(网状部分的形状)不仅可以是图1、图2所示那样的平坦的片状,也可以是图4中例示那样的袋的形状。图4(a)例示的方式中,以袋的开口朝向下方的方式配置分离用网状结构20,该袋的内部为第1室10a的一部分或全部,该袋的外部为第2室10b。图4(a)的例子中,该袋的内部为第1室10a的全部,若该袋的位置在分离室内向上方移动,则该袋的内部变为第1室10a的一部分。该袋的壁部相互面对的内表面并非彼此平行,而是随着从前述开口在袋内向深处行进,该内表面彼此之间的距离逐渐变窄。由此,该袋的内表面全部成为倾斜的悬垂面或朝向正下方的面。图4(b)例示的方式中,以袋的开口朝向上方的方式配置分离用网状结构20,该袋的外部为第1室10a,该袋的内部为第2室10b的一部分或全部。图4(b)的例子中,该袋的内部为第2室10b的全部,若该袋的位置在分离室内向下方移动,则该袋的内部变为第2室10b的一部分。该袋的壁部相互面对的内表面并非彼此平行,而是随着从前述开口在袋内向深处行进,该内表面彼此之间的距离逐渐变窄。由此,该袋的外表面全部成为倾斜的悬垂面或朝向正下方的面。(分离用网状结构的网的结构)分离用网状结构具有以分离对象物无法通过的方式(即,以分离对象物被捕获的方式)预先确定的大小的网眼。由此,与液体一起进入该分离装置内的固体中的、具有意欲分离的大小的分离对象物不能通过分离用网状结构的网眼,滞留在第1室中。因此,能够将滞留在第1室中的分离对象物分离。从悬浮液分离出来的分离对象物可以是应被废弃的物质,也可以是应回收利用的物质。分离用网状结构可以是将线材编织而成的筛网,也可以是在膜面上设置多个贯通孔而成的多孔膜。对于筛网而言,各种线径的线材及具有各种开口率的原材料被廉价地贩售,另外,为由圆线(截面形状为圆形的线材)形成的筛网时,抑制细胞等柔软的分离对象物被切断而通过网眼这样的现象,将其拦截的可能性变高,因此优选。以下,对筛网进行说明,但也可以利用多孔膜达成同样的构成。(分离用网状结构的贯通孔的开口形状的当量圆直径)分离用网状结构的贯通孔(网眼)的开口形状的当量圆直径根据分离对象物及通过对象物的不同而不同。例如,分离对象物为聚苯乙烯珠等作为悬浮培养的支架材料使用的粒状物、球状物(例如,cellbind(注册商标)表面微载体(粒径125~212μm,corning公司制)、通过对象物为从该支架材料剥离的细胞时,贯通孔的开口形状的当量圆直径设为该珠不能通过的尺寸,优选为20μm~200μm左右,更优选为20μm~100μm,进一步优选为20μm~50μm。没有通过对象物而仅为液体时,贯通孔的开口形状的当量圆直径可以更小。若是分离对象物为附着于前述珠的状态的犬肾小管上皮细胞(mdck细胞)、中国仓鼠卵巢细胞(cho细胞)、间充质干细胞(msc)等细胞、没有通过对象物而仅使液体通过的情况,则贯通孔的开口形状的当量圆直径可例示1μm~20μm左右。分离对象物为作为mdck细胞、cho细胞、msc等的悬浮培养的支架材料使用的由非水溶性多糖类形成的纳米纤维、通过对象物为从该支架材料剥离的细胞时,贯通孔的开口形状的当量圆直径优选为10μm~200μm左右,更优选为20μm~100μm,进一步优选为20μm~50μm。没有通过对象物而仅为液体时,贯通孔的开口形状的当量圆直径可以更小。另外,若是分离对象物为附着于前述纳米纤维的状态的mdck细胞、cho细胞、msc等细胞、没有通过对象物而仅使液体通过的情况,则贯通孔的开口形状的当量圆直径优选为1μm~200μm左右,更优选为5μm~100μm,进一步优选为10μm~50μm。以上的尺寸为各分离对象物、通过对象物的一个例子。可以根据各分离对象物的尺寸、通过对象物的尺寸、通过对象物的有无,以抑制该分离对象物的通过的方式适当地确定。以下,例示针对粘附性细胞为msc、支架材料为纳米纤维的情况的各部的优选尺寸等,对于除此以外的其他的细胞、支架材料而言,也可以分别适当地变更为相应的尺寸。仅规定前述的当量圆直径时,狭缝那样细长的开口形状、像迷宫那样套叠的开口形状也被包括进来,分离对象物以外的应通过的固体也全部被捕获。因此,本发明中,在仅对支架材料进行分离的情况下,除了前述的当量圆直径的限定之外,将该开口形状为能收容直径10μm~200μm的圆(以下,称为收容圆)的形状这一点也加入限定条件。本文中,所谓开口形状能将收容圆进行收容,也包括收容圆内切于开口形状的情况、收容圆与开口形状一致的情况。收容圆的直径更优选为直径20μm~100μm,进一步优选为直径20μm~50μm。开口形状为圆形的情况下,收容圆的直径=当量圆直径,除此以外的情况下,收容圆的直径<当量圆直径。另外,对在支架材料上附着有细胞的物质进行分离的情况下,除了前述的当量圆直径的限定之外,将该开口形状为能收容直径1μm~200μm的收容圆的形状这一点也加入限定条件。收容圆的直径更优选为直径5μm~100μm,进一步优选为直径10μm~50μm。(网眼的开口形状)分离用网状结构的网眼的开口形状没有特别限定,可以为三角形、四边形、六边形、其他的多边形、异形等,作为通常的廉价且高品质的筛网的开口形状,可举出正方形。在从正面观察筛网的片材面的情况下,如图5(a)所示,可见纵线与横线以直线交叉,并且,网眼也看起来呈平面正方形。微观地观察各个网眼时,纵线与横线以彼此交错的方式被三维地编织,因此,构成包围一个正方形网眼200的4条边的4根线材(2根纵线(201、202)和2根横线(211、212))如图5(b)所示,各自在筛网的厚度方向上大幅地起伏。该正方形开口的4条边中的彼此相对的2条平行边之间的距离w1可以为前述收容圆的直径。线材的直径可以根据分离对象物来变更,但大致是同样的,优选为10μm~100μm左右,更优选为30μm~80μm。线材的材料可举出尼龙、聚丙烯、聚乙烯、聚酯、ptfe、eva、pps、peek、芳族聚酰胺、不锈钢等。分离对象物为经培养的粘附性细胞(细胞块)的情况下,可以通过使线材更粗来抑制细胞被线材切断,另外,也可以将通过分离用网状结构的液体的流速减慢从而抑制细胞被线材切断。通过使配置分离用网状结构的分离室的容积更大,使液流的截面积比其他的管路的截面积更大,使分离用网状结构的网眼的开口面积的总和比其他的管路的截面积更大,从而使通过分离用网状结构的液体培养基的流速变慢,可抑制细胞被分离用网状结构分割。由此,细胞被分离用网状结构捕获,滞留在第1室10a中。分离用网状结构的网眼的开口面积的总和优选为其他的配管用管的截面积的0.01倍~1000倍左右,更优选为0.1倍~500倍左右。例如,配管用管的截面积为1mm2~50mm2左右的情况下,分离用网状结构的网眼的开口面积的总和优选为0.01mm2~50000mm2左右。(多孔膜)分离用网状结构可以为多孔膜。多孔膜如图6(a)、(b)所示,构成为具有在膜厚度的方向上贯通的多个贯通孔200、和作为该贯通孔彼此之间的隔壁的横梁部220。贯通孔200与前述的筛网同样地具有抑制分离对象物通过的大小的开口形状。横梁部220是位于相邻的贯通孔彼此之间的材料部分(从膜除去贯通孔后的残余部)。该横梁部以形成网状的方式一体地相连。多孔膜的贯通孔200的开口形状、开口面积、横梁部的宽度可以与上述的筛网的开口形状、开口面积、线材的粗细同样。作为多孔膜的制造方法,可例示树脂成型、冲孔、对膜的蚀刻、电铸等。(分离用网状结构的面积、分离室的容积)分离用网状结构的面积(面向第1室且存在网眼的区域的面积)根据该分离装置的用途(小规模的实验用、大规模的产业用)来确定即可,没有特别限定,例如为小规模的实验用时,可例示100~5000mm2左右作为优选范围,为大规模的产业用时,可例示5000~50000mm2左右作为优选范围。分离室的容积也根据该分离装置的用途来确定即可,没有特别限定,例如为小规模的实验用时,可例示1000~50000mm3左右作为优选范围,为大规模的产业用时,可例示50000~500000mm3左右作为优选范围。(分离室的形状、端口、分离用网状结构的位置)分离室的形状没有特别限定,可举出圆柱状、棱柱状(长方体)、板状(圆板、四方形的板状)、块状(球状、椭圆球状、与长方体接近的形状)、异形等。这样的分离室中的流入端口、分离用网状结构、流出端口的位置也没有特别限定,优选以下述方式构成内部流路:进入至该分离装置内的悬浮液中的液体在较低的阻力下顺畅地从第1室理想地通过分离用网状结构而移动至第2室,然后从该分离装置流出。另外,优选以进入至该分离装置内的悬浮液中的液体相对于分离用网状结构更大范围地扩展并通过该离用网状结构的方式确定分离室的形状和端口的位置。(分离室的壁部的材料)构成分离室的壁部的材料没有特别限定,可举出聚苯乙烯、聚丙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯、丙烯酸系材料、硅、聚偏氟乙烯等有机高分子材料、不锈钢等金属材料。从能廉价地成型、以及对高压釜、伽马射线的耐性的观点考虑,可例示聚丙烯、聚碳酸酯、丙烯酸系材料作为优选材料。(用于将分离用网状结构配置在分离室内的构成)作为用于将分离用网状结构配置在分离室内的构成,没有特别限定,例如可举出:以分开的部件的形式准备第1室和第2室,利用它们夹住分离用网状结构并进行固定的构成;在一个分离室内插入具有粘接材料的分离用网状结构,利用粘接材料将分离用网状结构粘接固定于该分离室的内壁,从而将该分离室分成第1室和第2室的构成;等等。粘接可以是使用粘接剂的粘接、部件本身彼此的熔接等。(第1室具有多个出入端口的方式)该分离装置中,根据目的,可以在第1室、第2室分别设置有多个端口。图7所示的方式例中,第1室设置有3个端口(第1流入端口311、第2流入端口312、及流出端口313),第2室仅设置有流出端口32。图7所示的方式例中,分离室的外形为圆板状(圆柱状),各端口位于分离室的外周侧面上隔开角度为90度的间隔的位置。图8所示的方式例也同样,第1室设置有3个端口(第1流入端口314、第2流入端口315、及流出端口316),第2室仅设置有流出端口32。图8所示的方式例中,分离室的形状为长方体状(薄板状),各端口在分离室的外周侧面的4个面中的彼此相对的2个面上各设置了2个。作为图8(a)所示的方式的更具体的例子,可例示图8(b)所示的方式及图8(c)所示的方式。图8(b)所示的方式中,分离室为具有8个顶点(c11、c12、c13、c14、c31、c32、c33、c34)的长方体状(使薄的四边形板水平躺倒这样的形状)。该分离室被水平配置的方形的片状分离用网状结构20分隔为下侧的第1室10a、和上侧的第2室10b。该分离用网状结构20的4个顶点为c21、c22、c23、c24。第1室中的第1流入端口314及第2流入端口315位于侧面(c22、c23、c33、c32)内,第1室中的流出端口316位于侧面(c21、c24、c34、c31)内。另外,第2室的流出端口32位于侧面(c11、c14、c24、c21)内。图8(c)所示的方式中,分离室为具有8个顶点(c41、c42、c43、c44、c51、c52、c53、c54)的长方体状(使薄的四边形板垂直立起这样的形状)。该分离室被倾斜地配置的方形的片状分离用网状结构20分隔为下侧的第1室10a、和其斜上侧的第2室10b。方形的片状分离用网状结构20的4个顶点为c41、c52、c53、c44。第1室中的第1流入端口314及第2流入端口315位于侧面(c41、c51、c52)内,第1室中的流出端口316位于侧面(c44、c54、c53)内。另外,第2室的流出端口32位于侧面(c44、c53、c43)内。图7、图8中的任意方式中,第1流入端口均为用于使悬浮液从外部流入第1室的端口。另外,第2流入端口为用于使洗涤液、试剂等从外部流入第1室的端口。作为前述试剂,可举出细胞剥离液(例如,能将支架材料分解的试剂)、用于将细胞溶解的细胞溶解试剂等。另外,设置于第1室的流出端口为用于使在分离用网状结构的作用下残留于第1室内的分离对象物流出至外部的端口。通过设置这些端口,从而可以在分离室的第1室上连接外部的试剂容器,从而在第1室中实现由该试剂的应用导致的支架材料的剥离、细胞的溶解。另外,若在第1室上连接其他的外部容器,则也可以使残留于第1室内的分离对象物移动至该外部容器,能够实现适合于封闭体系的培养系统的流路构建。(第1室的流入端口的位置)图9所示的方式例中,第2室10b位于第1室10a的上方,片状的分离用网状结构20水平配置。因此,通过分离用网状结构20的网眼时的液体的行进方向f为垂直向上的方向。图9所示的方式例中,第1室至少具有用于使悬浮液q1从外部流入的流入端口31,该流入端口31设置于第1室的侧壁。由此,分离室的底面变得平坦,能够稳定地配置在基座面上。另外,作为优选方式,流入端口的中心轴线的高度h1位于第1室的室内的总高度h1的40%以上的高度、优选为60%以上的高度处。由此,在第1室内,在比流入端口31的中心轴线的高度h1更靠下方处存在空间。通过该空间的存在、和从设置于侧面的流入端口流入的悬浮液q1的流动,从而在第1室10a内,分离对象物和通过对象物理想地循环,能够使分离对象物在从分离用网状结构剥落的同时积存于前述空间。积存于该空间的分离对象物不会成为新流入的通过对象物的障碍。另外,流入端口31未设置于第1室的底面,因此,新流入的悬浮液也不会将积存于该空间底部的分离对象物向上方吹起。因此,通过对象物理想地从分离用网状结构通过。流入端口的中心轴线的高度h1的上限为流入端口的开口的上端与分离用网状结构的下表面接触的位置。即,若将开口的口径设为d,则流入端口的中心轴线的高度h1的上限为从分离用网状结构的下表面仅下降d/2的位置。设置于第2室的流出端口32的位置没有特别限定,如图9所示的方式例那样,可以设置于第2室的侧面。图9所示的方式例中,设置于第1室的流入端口31、和设置于第2室的流出端口32被设置在分离室的侧面中的彼此呈相反侧的面上,但也可以设置在彼此相同的一侧的面上。流入端口31和流出端口32的位置优选考虑到配管作业、管所占的配管空间而适当地确定。(分离室被2个以上的分离用网状结构分成3个以上的方式)图9的方式中,分离室被1个分离用网状结构分成2个,但也可以在第2室的上方进一步设置向上方层叠的1个以上的房室作为分离室。前述1个以上的房室中的和第2室相邻的房室、与第2室由额外的分离用网状结构分隔开。另外,前述1个以上的房室为2个以上的房室的情况下,上下相邻的房室彼此由额外的其他分离用网状结构分隔开。图10所示的方式例中,在图9所示的第2室的上方,进一步设置有向上方层叠的房室10c作为分离室。第2室10b位于第1室10a的上方,在它们之间水平地配置有片状的分离用网状结构21,第3室10c位于第2室10b的上方,在它们之间水平地配置有片状的分离用网状结构22。换言之,分离室被2个分离用网状结构21、22分成3个房室10a、10b、10c。流出端口设置在位于最上方的房室(第3室10c)。在这样的构成中,越是位于更靠上方位置的分离用网状结构的网眼,则该网眼的开口面积变得越小,以进一步抑制前述分离对象物的通过。由此,较之分离用网状结构为单个的情况而言,增高流量时的分离能力(即,即使增高流量,也阻止分离对象物而不使其通过的性能)提高,因此优选。(上下重叠多个的方式2)图10所示的方式中,悬浮液q1中仅分散有作为固体的分离对象物e1的情况下,位于最上方的分离用网状结构22的网眼的大小的下限没有特别限定,优选为应通过的液体能以较小的阻力高效地通过这样的大小。另一方面,图10所示的方式中,悬浮液q1中作为固体不仅包含分离对象物e1、而且包含固态通过对象物e2的情况下,位于最上方的分离用网状结构22的网眼的大小可规定为能够在抑制分离对象物e1的通过的同时使通过对象物e2通过的大小。如此,通过在多段设置分离用网状结构的方式,可以使最初的分离用网状结构21的网眼较大,在通过该分离用网状结构21时进行粗筛分而先仅将大的分离对象物除去,因此,即使相对增高流量,分离能力也不会降低,故而优选。(使用本发明的分离装置的细胞培养系统)图11为示出使用该分离装置构成的细胞培养系统的一个例子的框图及配管图。图中,用箭头表示管路和液体的流动的方向。图11例示的构成中,支架材料和在其上附着的细胞由该分离装置从悬浮液中分离,仅包含体液因子的液体培养基通过而被回收,或者,从细胞剥离的支架材料由该分离装置从悬浮液分离,包含细胞的液体培养基通过而被回收。图的例子中,送液泵s1、s2为管泵,容器110、120、160、170为柔软的袋,将容器彼此连接的配管为软质管,能够进行不会使细胞、液体培养基露出于外部空气的封闭体系中的细胞培养和细胞的分离、回收。液体培养基容器110中收容了分散有支架材料的液体培养基。液体培养基容器110介由配管p1与细胞培养容器120连接,在配管p1的路径上设置有送液泵s1,分散有支架材料(例如,以壳多糖为主成分的纳米纤维)的液体培养基被送至细胞培养容器120。另一方面,在细胞培养容器120中,从细胞注入端口130,向该容器内仅注入规定量的用于接种的粘附性细胞(例如,mdck细胞、cho细胞、msc),在细胞培养容器120内进行悬浮培养。该细胞培养系统整体配置于培养箱内,被保持于适当的温度(例如,33℃~39℃)。图11例示的细胞培养系统如下所述地工作。首先,仅回收包含体液因子(例如,inf-β、外泌体)的液体培养基的情况下,包含附着有细胞的支架材料的悬浮液从细胞培养容器120通过配管p2,被送入该分离装置1的第1室10a中。因此,附着有细胞的支架材料残留于第1室10a,仅液体培养基通过分离用网状结构20并进入第2室10b,从该分离装置流出。该液体培养基通过配管p3、切换阀150、配管p4,被收容于液体(上清液)回收容器160。该步骤也可用于细胞培养容器120内的细胞(附着于支架材料)的浓缩。例如,该情况下,对送液泵s2进行操作以使得输送方向相反,使残留于第1室10a的浓缩物返回至细胞培养容器120,从液体培养基容器110再次送入液体培养基,由此能够在细胞培养容器120内持续进行培养。接下来,从经悬浮培养的粘附性细胞分离支架材料并回收包含细胞的液体培养基的情况下,为了从该粘附性细胞剥离支架材料,从试剂注入端口140向细胞培养容器120内送入试剂(例如,yatalase)。此时,对送液泵s2进行操作而使得输送方向相反。支架材料与细胞已剥离的悬浮液从细胞培养容器120通过配管p2,被送入该分离装置1的第1室10a中。因此,支架材料被分离而残留于第1室10a(在第1室内还残留有液体培养基),细胞和液体培养基通过分离用网状结构20并进入第2室10b,从该分离装置流出。细胞和液体培养基通过配管p3、切换阀150、配管p5,被收容于细胞回收容器170。这些回收操作可以将细胞培养系统取出至培养箱外来进行,也可以在培养箱内进行。图11所示的系统不过是一个例子,也可以以使经培养的细胞与液体培养基一同在不与外部空气直接接触的情况下通过该分离装置的分离用网状结构(或者,在进入该分离装置的第1室之后,不使其通过分离用网状结构)并在容器彼此之间移动(或者,返回至原来的容器)的方式,将必要数目的容器用配管连接。上述的细胞培养系统中可使用的容器没有特别限定,可例示细胞培养等中使用的柔软的袋、硬质的塑料、玻璃制的瓶、培养瓶等作为优选例。根据培养规模,可以使用适当的搅拌装置(例:振荡器、桨式搅拌器等)。各容器的容量根据系统的用途(小规模的实验用、大规模的产业用)来确定即可,没有特别限定,例如为小规模的实验用时,可例示10ml(毫升)~1000ml左右作为优选范围,为大规模的产业用时,可例示1l~1000l左右作为优选范围。送液泵没有特别限定,可举出注射器、管泵等作为优选例。使用透气袋、带有通气孔盖的培养瓶作为容器的情况下,培养箱优选使用能控制内部的温度和气体浓度(尤其是co2浓度)的装置。另外,容器为非透气性的封闭容器的情况下,通过培养基更换等来控制液体培养基中的co2浓度,由此可以使用仅进行温度控制的培养箱。(分离方法)能够提供一种方法,其使用上述的本发明的分离装置,从通过使用了微细的支架材料的粘附性细胞的悬浮培养得到的悬浮液,将该悬浮液中包含的固态分离对象物理想地分离。如上所述,悬浮液中包含的固体、应分离的对象物、与应通过的对象物的组合涉及多种。例如,在悬浮液中的液体为液体培养基、分离对象物为附着有粘附性细胞的支架材料的情况下,没有固态通过对象物,该方法可用于液体的简单除去(浓缩)、在悬浮培养中从粘附性细胞释放至液体培养基中的体液因子的回收。分离对象物也可以为回收对象物。在悬浮液中的液体为液体培养基、分离对象物为利用将支架材料与粘附性细胞分离的试剂而在液体培养基中从粘附性细胞剥离的支架材料的情况下,通过对象物(回收对象物)为从支架材料剥离的粘附性细胞。在悬浮液中的液体为含有利用溶解粘附性细胞的细胞溶解试剂进行了溶解的该细胞的液体、分离对象物为由于该细胞的溶解而残留在前述液体中的支架材料的情况下,通过对象物(回收对象物)为由于该细胞的溶解而释放至前述液体中的、来源于该细胞的物质。(流速、流量)悬浮液中的液体在通过该分离装置的分离用网状结构时的流速没有特别限定,但从提高分离性并且抑制堵塞的方面考虑,优选为0.01mm/秒~25mm/秒,更优选为0.1mm/秒~15mm/秒,进一步优选为1mm/秒~10mm/秒。对于从分离用网状结构的面积(作为网而有效地发挥作用的部分的面积)每1cm2中通过的液体的流量而言,从提高分离性并且抑制堵塞的方面考虑,优选为1~10ml/min,更优选为2~5ml/min,进一步优选为3ml/min。后述的实施例3是以30ml/min实施的,分离用网状结构的面积为约12cm2,由此,分离用网状结构的面积每1cm2中的流量为2.5ml/min。(分离及回收例1:经悬浮培养的移植用msc的回收)图12为示出使用本发明的分离装置来回收经悬浮培养的移植用msc的情况下的工艺的一个例子的流程图。如该流程图所示,首先,使用支架材料(例如壳多糖纳米纤维)对细胞进行悬浮培养。接下来,将悬浮液(在液体培养基中分散有附着有细胞的支架材料)送入该分离装置,由此使规定量的液体培养基通过,从而能够将附着有细胞的支架材料浓缩。此时,可以回收从该分离装置通过的液体培养基(培养上清液)。接下来,注入含有将支架材料分解的酶(例如yatalase)的溶液,孵育规定时间,由此将支架材料表面分解,使细胞从支架材料剥离。在注入酶溶液前,可以用pbs(-)(磷酸缓冲液)等进行洗涤。接下来,将培养基或pbs(-)进行送液,捕获支架材料,仅使细胞通过,由此回收该细胞。此时,相对于分离用网状结构的筛网面而沿着与重力方向相反的方向送液,由此能够实现有效的细胞回收。接下来,对回收液进行离心分离,除去上清液,由此仅回收细胞。(分离及回收例2:回收悬浮培养后的液体培养基的情况)图13为示出使用本发明的分离装置来回收悬浮培养后的液体培养基的情况下的工艺的一个例子的流程图。如该流程图所示,使用支架材料对粘附性细胞进行悬浮培养后,向本发明的分离装置中送入悬浮液(在液体培养基中分散有附着有粘附性细胞的支架材料),由此除去附着有细胞的支架材料,能够实现液体培养基(培养上清液)的回收。附着有粘附性细胞的支架材料可以送回至培养容器并再次供于悬浮培养。(分离及回收例3:回收来源于经培养的细胞的物质的情况)图14为示出使用本发明的分离装置、在悬浮培养后回收来源于经培养的细胞的物质的情况下的工艺的一个例子的流程图。如该流程图所示,首先,使用支架材料对细胞进行悬浮培养。接下来,将悬浮液(在液体培养基中分散有附着有细胞的支架材料)送入该分离装置,使液体培养基通过,将附着有粘附性细胞的支架材料浓缩。此时,可以根据需要而回收从该分离装置通过的液体培养基(培养上清液)。接下来,利用细胞溶解试剂将细胞溶解。结果,悬浮液中包含从细胞剥离的支架材料及细胞溶解物。接下来,利用本发明的分离装置除去支架材料,使包含细胞溶解物的液体通过,回收该液体。实施例[制备例1](包含壳多糖纳米纤维的培养基组合物的制备)将根据上述专利文献1(国际公开第2015/111686号)的记载而制备的2质量%壳多糖纳米纤维(生物质纳米纤维binfi-s(ビンフィス),suginomachinelimited)以成为1%(w/v)的方式混合在超纯水(milli-q水)中,使其悬浮。然后,将这些水溶液于121℃进行20分钟高压釜灭菌。将得到的1%(w/v)壳多糖纳米纤维分散液以最终浓度成为0.01或0.02%(w/v)的方式添加在间充质干细胞增殖培养基2(#c-28009,takarabioinc.制)(以下,有时也表述为培养基)中,使其悬浮,由此制备壳多糖纳米纤维以分散状态被包含的培养基组合物(以下,表述为cnf培养基组合物)。[实施例1](分离装置的制作)如图15的照片图中示出的外观那样,将50ml锥形管(falcon(r),corning公司制)在45ml刻度的位置处切断为上侧部分和下侧部分,使下侧部分上下颠倒,将下端的圆锥状部分从下方插入至上侧部分,将该上侧部分的内部作为第1室10a。在前述的第1室10a的上方连接具有流入端口31的连接环(connectorring)31r,在其上依次层叠连接3个细胞滤网(pluristrainer(注册商标),pluriselectlifescience公司制)21a、22a、23a,进一步在其上连接上下开口的圆锥台状的筒(funnel,pluriselectlifescience公司制)10d,得到本发明的分离装置。前述3个细胞滤网各自的分离用网状结构(筛网)的方形开口的当量圆直径从下方起依次为100μm、60μm、20μm。该分离装置中,细胞滤网21a的筛网与细胞滤网22a的筛网之间的空间为第2室10b,细胞滤网22a的筛网与细胞滤网23a的筛网之间的空间为第3室10c,其上的圆锥台状的筒10d的内部为第4室。本实施例的分离装置就结构上的概念而言是与图10所示的分离装置同样的。[实施例2](使用分离装置的细胞与支架材料的分离)使用实施例1中制作的分离装置,研究了细胞与支架材料的分离。将经培养的来源于人骨髓的间充质干细胞(c-12974,takarabioinc.制)以成为100万个细胞/10ml的方式与制备例1中制作的配合有0.02%(w/v)壳多糖纳米纤维的培养基组合物进行悬浮,然后填充至10ml注射器(泰尔茂公司制)中。将其与分离装置的连接环横部的端口连接,进行注入。接下来,将填充有40ml间充质干细胞增殖培养基2的50ml注射器(泰尔茂公司制)与端口连接,以0.5ml/sec的流速注入培养基,由此,相对于筛网以与重力方向相反的方式从下方流通。回收流入至funnel部的培养基,对回收液进行离心分离(300×g,3分钟)后,除去上清液。向残留的沉降物中加入培养基10ml,进行再悬浮,使用celltiter-glo(promega公司),利用平板读取器(tecan公司制)对悬浮液的细胞中包含的atp量进行定量。将对分离操作前的培养后细胞悬浮液进行测定而得到的rlu值作为基准(细胞回收率100%),与进行了分离操作时得到的rlu值进行比较,算出细胞回收率。结果,细胞回收率为89%。另外,利用倒置显微镜观察了回收后的悬浮液及分离装置下部的残渣,结果确认了在回收后的悬浮液中几乎观察不到壳多糖纳米纤维。图16(a)、(b)示出各显微镜照片。图16(a)为示出从该分离装置通过的液体中包含的固体的显微镜照片图,图16(b)为示出残留于该分离装置的第1室的液体中包含的固体(残渣)的显微镜照片图。[比较例1](利用细胞滤网的细胞与支架材料的分离)将连接环连接于50ml锥形管上,依次载置20μm、60μm、100μm的细胞滤网和funnel并进行固定。将经培养的来源于人骨髓的间充质干细胞(c-12974,takarabioinc.制)以成为100万个细胞/10ml的方式与制备例1中制作的配合有0.02%(w/v)壳多糖纳米纤维的培养基组合物进行悬浮,然后用电动移液器(violamodisposablepipette)进行抽吸,使其通过funnel而缓慢地排出至细胞滤网上。接下来,将无填充的10ml注射器与连接环横部的端口连接,缓慢地拉动注射器的活塞,由此将锥形管内减压,向细胞滤网中通液。接下来,将40ml的间充质干细胞增殖培养基2通过funnel而缓慢地注入细胞滤网上,将无填充的50ml注射器与连接环横部的端口连接,缓慢地拉动注射器的活塞,由此将锥形管内减压,向细胞滤网中通液。对锥形管内的培养基进行离心分离(300×g,3分钟)后,将上清液除去。向残留的沉降物中加入培养基10ml,进行再悬浮,使用celltiter-glo(promega公司),利用平板读取器(tecan公司制)对悬浮液的细胞中包含的atp量进行定量。将对分离操作前的培养后细胞悬浮液进行测定而得到的rlu值作为基准(细胞回收率100%),与进行了分离操作时得到的rlu值进行比较,算出细胞回收率。结果,细胞回收率为52%。由此认为,由于从上部依次供于过滤器,壳多糖纳米纤维以覆盖筛网的形式将其堵塞,阻碍了细胞的通过。另外,对经再悬浮的液体进行目视观察时,看到了与细胞不同的悬浮物,由此确认了壳多糖纳米纤维的混入,也可知分离不充分。由此表明了利用实施例1中制作的分离装置形状在实施例2中实施的分离回收方法的有效性。[实施例3](使用袋型细胞滤网的细胞与支架材料的分离)使用作为市售品的一个构件的骨髓液过滤器(kaneka公司制),研究了细胞与支架材料的分离。将经培养的来源于人骨髓的间充质干细胞(c-12974,takarabioinc.制)以成为100万个细胞/10ml的方式与制备例1中制作的配合有0.02%(w/v)壳多糖纳米纤维的培养基组合物进行悬浮,然后填充至10ml注射器中。将其与骨髓液过滤器的一端连接,沿从下部向上部的方向进行送液。接下来,替换安装至填充有25ml培养基的50ml注射器,沿从下部向上部的方向进行送液,将从上部的流路流出的培养基回收至50ml锥形管中。对回收液进行离心分离(300×g,3分钟)后,将上清液除去。向残留的沉降物中加入培养基10ml,进行再悬浮,利用细胞计数器(tc-20,bio-rad公司制)来计测细胞数,结果,与回收前的细胞数相较而言为86%的回收率。另外,使用celltiter-glo(promega公司),利用平板读取器(tecan公司制)对悬浮液的细胞中包含的atp量进行定量。将对分离操作前的培养后细胞悬浮液进行测定而得到的rlu值作为基准(细胞回收率100%),与进行了分离操作时得到的rlu值进行比较,算出细胞回收率。结果,细胞回收率为83%。另外,利用倒置显微镜观察了回收后的悬浮液及分离装置下部的残渣,结果确认了在悬浮液中几乎观察不到壳多糖纳米纤维。图17(a)、(b)示出各显微镜照片。图17(a)为示出从该分离装置通过的液体中包含的固体的显微镜照片图,图17(b)为示出残留于该分离装置的第1室的液体中包含的固体(残渣)的显微镜照片图。将上述实施例2、4及比较例1的结果汇总于表1中。在比较例1中,观察到支架材料在回收液中的残留较多,与之相对,在实施例2、4中,确认了几乎无残留。另外,实施例2、4中,通过从下部流通,细胞变得不易与外部空气接触,能够防止细胞在回收过程中干燥,从而能够达成高效的回收。[表1]回收率(%)支架材料残留※1空气接触※2实施例289○○实施例383○○比较例152××※1...○:回收液中的支架材料混入为极少量,×:回收液中的支架材料混入多※2...○:在空气中暴露少,×:时常暴露于空气中[实施例4]将经培养的来源于人骨髓的间充质干细胞(c-12974,takarabioinc.制)以成为40000个细胞/ml的方式接种于上述制备例1中制作的配合有0.01%(w/v)壳多糖纳米纤维的培养基组合物及未添加培养基,然后,以每1个孔为2ml的方式注入6孔平底超低粘附表面微孔培养板(corning公司制,#3471)的孔中。各板在co2培养箱(37℃,5%co2)内以静置状态培养,持续进行5天。在第5天进行细胞回收的操作。培养后,将该细胞/壳多糖纳米纤维悬浮液回收至15ml离心管中,进行离心分离(220×g,3分钟)。将上清液除去后,添加3ml的d-pbs(#045-29795,fujifilmwakopurechemicalcorporation制),洗涤后,进行离心分离(220×g,3分钟)。接着,使作为将支架材料分解的试剂的yatalase(#t017,takarabioinc.制)以成为1%(w/v)的方式溶解于d-pbs中。将向dmem(低葡萄糖)(#041-29775,fujifilmwakopurechemicalcorporation制)中加入1%(w/v)yatalase溶液(最终浓度0.4%)及trypleselect(1×)(#12563029,thermofisherscientific公司制)(最终浓度0.1×)而得的剥离溶液(样品1)、加入1%(w/v)yatalase溶液(最终浓度0.4%)而得的剥离溶液(样品2)以2ml/15ml离心管进行添加。另外,作为对照的样品,仅添加了2ml的dmem(低葡萄糖)(样品3)。在悬浮后再次接种于6孔平底超低粘附表面微孔培养板,在co2培养箱(37℃,5%co2)内静置1小时。接着,将剥离的细胞、壳多糖纳米纤维及培养基回收至15ml离心管中,进行离心分离(220×g,3分钟)。将上清液除去后添加3ml的d-pbs,在洗涤后进行离心分离(220×g,3分钟)。将上清液除去后添加2ml培养基,接种于6孔粘附表面微孔培养板(corning公司制,#3516),在co2培养箱(37℃,5%co2)内静置3小时。在3小时后回收上清液及壳多糖纳米纤维,进行离心分离(220×g,3分钟)。将上清液除去后添加atp试剂500μl(celltiter-glotmluminescentcellviabilityassay,promega公司制)。另外,对于粘附于6孔粘附表面微孔培养板的细胞,添加2ml的d-pbs来进行洗涤,将其除去后添加atp试剂500μl。使用enspire(perkinelmer公司制)进行发光值(rlu)的测定,算出100×(微孔培养板上的rlu)/(微孔培养板中的rlu+壳多糖纳米纤维中的rlu),由此算出基于剥离溶液的回收率。结果,在样品1及样品2中,各自能够回收78%及69%的细胞。另一方面,在未对剥离溶液进行处置的对照组中,回收率为5%。由以上的结果表明,通过使用将支架材料分解的试剂,能够简便地将经悬浮培养的粘附细胞从支架材料剥离,进而,能够高效地回收该剥离的细胞。[实施例5](系列地进行了从分散培养至细胞与支架材料的分离及细胞回收的研究)<<步骤1:培养工序>>将经培养的来源于人骨髓的间充质干细胞(c-12974,takarabioinc.制)以成为10000个细胞/ml的方式接种于上述制备例1中制作的0.01%(w/v)cnf培养基组合物,然后,以每1个孔为10ml的方式注入6孔平底超低粘附表面微孔培养板(corning公司制,#3471)的孔中的4个孔中。各板在co2培养箱(37℃,5%co2)内以静置状态培养,持续进行5天。<<步骤2:基材与细胞的粗分离工序>>将培养后的悬浮液(40ml)回收至50ml锥形管中,进行离心分离(300×g,3分钟),将上清液(35ml)除去。接着,添加通过向密度梯度调整液(percollplus,gehealthcare公司制)(45ml)中加入10×pbs(-)(5ml)而得到的等渗percoll液(10ml),通过吹吸进行混合后,进行离心分离(400×g,10分钟),由此,细胞未附着的基材沉淀,仅附着于基材的细胞组分留在上层。将该上层(10ml)回收至50ml锥形管中,加入pbs(-)(40ml)进行稀释后,进行离心分离(400×g,3分钟),将上清液(40ml)除去,由此进行洗涤。<<步骤3:从基材剥离细胞的工序>>接着,加入细胞剥离用酶(accumax,nacalaitesque公司制)(10ml),在co2培养箱(37℃,5%co2)内静置,由此从基材剥离细胞。<<步骤4:基材与细胞的分离·细胞回收>>接着,将向得到的悬浮液中加入培养基(10ml)而得的液体填充至50ml注射器(nipro公司制),与作为市售品的一个构件的骨髓液过滤器(kaneka公司制)的一端连接后,沿从下部向上部的方向进行送液,接着,替换安装至填充有25ml培养基的50ml注射器,沿从下部向上部的方向进行送液,将从上部的流路流出的培养基的全部量(约40ml)回收至50ml锥形管中。对其进行离心分离(300×g,3分钟),将上清液(35ml)除去,由此进行浓缩并回收细胞。步骤1至4的各工序中得到的悬浮液的显微镜照片示于图18。产业上的可利用性通过本发明,可提供在使用了微细的支架材料的粘附性细胞的悬浮培养中能够将分离对象物更高效地分离而得到通过对象物的分离装置。通过使用该分离装置,能够提供将分离对象物理想地分离的方法,可以使通过对象物理想地通过,并将回收对象物理想地回收。本申请以在日本提出申请的特愿2018-170092(申请日:2018年9月11日)为基础,其内容全部包括在本说明书中。附图标记说明1分离装置10分离室10a第1室10b第2室20分离用网状结构f通过分离用网状结构的网眼时的液体的行进方向fv行进方向f的垂直向上的方向成分。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1