含有属于帕拉普氏菌属的细菌作为有效成分的用于抑制胰蛋白酶活性的组合物的制作方法
本发明涉及含有属于帕拉普氏菌属(paraprevotella)的细菌作为有效成分的、用于抑制胰蛋白酶活性的组合物。另外,本申请主张对美国专利临时申请62/728908号(2018年9月10日申请)和美国专利临时申请62/794145号(2019年1月18日申请)的优先权,这些申请的公开内容通过参照而引用到本申请说明书中。
背景技术:
认为人的消化道内生息有约100兆个肠内细菌。这导致远多于约37兆个人体细胞的肠内细菌与我们共存,形成肠道菌群。自从提倡肠内细菌学以来,进行了各种研究。实际上,通过近年的使用无菌动物的实验表明,肠道菌群对宿主免疫系统的成熟、宿主的功能带来各种影响。例如,肠内细菌通过与病原性微生物竞争niche而贡献于病原性微生物的定植、增殖的抑制。另外,肥胖的人的肠内细菌中的拟杆菌门(bacteroidetes)少,移植了其粪便的无菌小鼠的体脂增加。
此外,由于悉生生物技术的普及,肠内细菌全体中各个细菌种对宿主免疫系统的影响的详细研究也开始被报告。例如,从健常者分离的梭菌纲(clostridia)群的17种菌株在小鼠大肠中诱导调节性t细胞,缓和宿主的炎症(非专利文献1)。另外,在小鼠小肠中生息的分节细菌(分节丝状菌,segmentedfilamentousbacteria(sfb))通过粘附于小肠上皮而强烈地诱导th17细胞(非专利文献2)。进而,从克罗恩病(crohn病、cd)患者的唾液分离出的肺炎克雷伯菌(klebsiellapneumonia)通过异位地定植于小鼠大肠,从而强烈地诱导th1细胞,引发大肠炎(非专利文献3)。这样,关于肠内细菌与宿主免疫系统的研究变多,另一方面,着眼于各个肠内细菌种和存在于粪便中的宿主来源的蛋白质的详细研究较少(非专利文献4~7)。
另外,在宿主来源的蛋白质中,胰蛋白酶作为由胰脏分泌的蛋白质分解酶之一已知。最近显示,大肠以远的活性型胰蛋白酶的残存参与各种疾病的发病、恶化。具体地,报告了在炎症性肠疾病(inflammatoryboweldisease、ibd)患者、特别是cd患者的粪便中,胰蛋白酶以维持其活性的状态残存(非专利文献8、9)。另外,提示了作为人的肠内细菌的大的构成要素已知的拟杆菌属(bacteroides)在ibd患者中减少(非专利文献9),构成拟杆菌属(bacteroides)的某种细菌参与粪便中的胰蛋白酶的失活(非专利文献10),但基本没有详细的研究。
鉴于这样的现状,如果可以分离能够抑制胰蛋白酶活性的细菌,则作为针对ibd的新的治疗战略,可以期待与抑制胰蛋白酶活性的细菌疗法的开发相关的可能性,但这样的细菌尚未被分离。
现有技术文献
非专利文献
非专利文献1:atarashi,k.etal.nature500,232-236,doi:10.1038/nature12331(2013).
非专利文献2:atarashi,k.etal.cell163,367-380,doi:10.1016/j.cell.2015.08.058(2015).
非专利文献3:atarashi,k.etal.science358,359-365,doi:10.1126/science.aan4526(2017).
非专利文献4:palm,n.w.etal.cell158,1000-1010,doi:10.1016/j.cell.2014.08.006(2014).
非专利文献5:kawamoto,s.etal.immunity41,152-165,doi:10.1016/j.immuni.2014.05.016(2014).
非专利文献6:planer,j.d.etal.nature534,263-266,doi:10.1038/nature17940(2016).
非专利文献7:bunker,j.j.etal.immunity43,541-553,doi:10.1016/j.immuni2015.08.007(2015).
非专利文献8:vandemerwe,j.p.&mol,g.j.digestion24,1-4,doi:10.1159/000198767(1982).
非专利文献9:midtvedt,t.etal.plosone8,e66074,doi:10.1371/journal.pone.0066074(2013).
非专利文献10:ramare,f.,hautefort,i.,verhe,f.,raibaud,p.&iovanna,.applenvironmicrobiol62,1434-1436(1996).
技术实现要素:
发明要解决的课题
本发明鉴于上述现有技术所具有的课题而做出的,目的在于分离能够抑制胰蛋白酶活性的细菌,提供含有该细菌作为有效成分的、用于抑制胰蛋白酶活性的组合物。
用于解决课题的手段
本发明者们为了实现上述目的反复进行了深入研究,结果,对于spf小鼠和无菌小鼠(germ-free小鼠、gf小鼠)的盲肠内容物进行全面的蛋白质分析(蛋白质组分析),鉴定了713种宿主来源的蛋白质。与spf小鼠相比,gf小鼠的盲肠内容物中45种蛋白质有意义地多地存在。其中,着眼于存在量确认了特别显著的差异的作为蛋白质分解酶的胰蛋白酶(anionictrypsin-2(阴离子胰蛋白酶2):prss2)。
胰蛋白酶是由胰脏的外分泌腺分泌的消化道酶,是强烈的蛋白质分解酶,被提示了与原因不明的ibd的关联。因此,研究了胰脏组织中的作为胰蛋白酶前体的胰蛋白酶原的表达量和分泌量,但没有确认spf小鼠与gf小鼠之间的差异。另一方面,对于肠内容物中的胰蛋白酶活性,对于小肠没有确认显著性差异,但对于盲肠以远,在spf小鼠中确认了有意义的活性降低。由以上考虑,肠内细菌是降低盲肠以远的胰蛋白酶活性的因子。
接着,将健常人志愿者6名的粪便样本施与gf小鼠,制成人菌群定植小鼠,结果每个样本组的粪便中的胰蛋白酶活性不同。于是,进行了使粪便中的胰蛋白酶活性降低的菌株的鉴定。将胰蛋白酶活性降低程度最大的人菌群定植小鼠的盲肠内容物施与别的gf小鼠,在施与各种抗菌谱的抗生素的同时,评价粪便中的胰蛋白酶活性。其结果是,在施与了氨苄青霉素的小鼠组中,确认了粪便中的胰蛋白酶活性的有意义的降低。其中,对于胰蛋白酶活性降低程度最大的小鼠,将盲肠内容物所含的菌在厌氧条件下培养,分离出降低胰蛋白酶活性的菌35株。进而,进行降低胰蛋白酶活性的责任菌的锁定。基于上述的施与各种抗菌谱的抗生素时的小鼠粪便中的肠内细菌的相对占有率与胰蛋白酶活性值的斯皮尔曼(spearman)顺位相关分析,进行菌株的锁定,搞清楚了paraprevotellaclara(p.clara)、parabacteroidesmerdae(p.merdae,粪副拟杆菌)、和bacteroidesuniformis(b.uniformis,单形拟杆菌)3种菌株降低胰蛋白酶活性,另外最终发现p.clara单菌是胰蛋白酶活性抑制中的责任菌。
进而,对于属于帕拉普氏菌属(paraprevotella)的其他细菌(p.xylaniphila)进行评价,结果表明了与p.clara同样地能够抑制胰蛋白酶活性。
本发明是基于该见解而创作的,涉及含有属于帕拉普氏菌属(paraprevotella)的细菌作为有效成分的、用于抑制胰蛋白酶活性的组合物,更详细地提供以下发明。
<1>用于抑制胰蛋白酶活性的组合物,含有属于帕拉普氏菌属(paraprevotella)的细菌作为有效成分。
<2>根据<1>所述的组合物,所述属于帕拉普氏菌属(paraprevotella)的细菌是选自paraprevotellaclara和paraprevotellaxylaniphila中的至少1种细菌。
<3>根据<1>所述的组合物,所述属于帕拉普氏菌属(paraprevotella)的细菌是具有由序列号1~3中的任一项所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<4>根据<1>所述的组合物,所述属于帕拉普氏菌属(paraprevotella)的细菌是选自
以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株paraprevotellaclara1c4株、
paraprevotellaclarajcm14859t株和
paraprevotellaxylaniphilajcm14860t株
中的至少1种细菌株。
<5>根据<1>~<4>中的任一项所述的组合物,进一步含有选自粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌。
<6>根据<5>所述的组合物,所述粪副拟杆菌(parabacteroidesmerdae)是具有由序列号4所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌,所述单形拟杆菌(bacteroidesuniformis)是具有由序列号5所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<7>根据<5>所述的组合物,所述粪副拟杆菌(parabacteroidesmerdae)是以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株),所述单形拟杆菌(bacteroidesuniformis)是以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。
<8>以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株(paraprevotellaclara1c4株)。
<9>以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株)。
<10>以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。
另外,以前就提示,在大肠中残存的活性型胰蛋白酶与作为溃疡性大肠炎、克罗恩病已知的ibd的发病、症状的恶化相关。于是,本发明者们使用大肠炎模型小鼠,验证了基于上述3种菌株的抑制胰蛋白酶活性的效果的炎症的缓和。在使il-10基因缺损小鼠感染产气肠杆菌(enterobacteraerogenes)而诱导大肠炎的模型中,确认了通过施与上述3种菌株而其发病被抑制的倾向。另外,在dss诱导大肠炎模型中,大肠炎的发病有意义地被抑制。
因此,基于该见解,本发明还提供用于治疗、改善或预防以下由胰蛋白酶活性引起的疾病的药物组合物、和方法。
<11>用于治疗、改善或预防由胰蛋白酶活性引起的疾病的药物组合物,含有选自属于帕拉普氏菌属(paraprevotella)的细菌、粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌作为有效成分。
<12>根据<11>所述的药物组合物,属于帕拉普氏菌属(paraprevotella)的细菌是选自paraprevotellaclara和paraprevotellaxylaniphila中的至少1种细菌。
<13>根据<11>所述的药物组合物,属于帕拉普氏菌属(paraprevotella)的细菌是具有由序列号1~3中的任一项所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<14>根据<11>所述的药物组合物,属于帕拉普氏菌属(paraprevotella)的细菌是选自
以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株(paraprevotellaclara1c4株)、
paraprevotellaclarajcm14859t株和
paraprevotellaxylaniphilajcm14860t株
中的至少1种细菌株。
<15>根据<11>~<14>的任一项所述的药物组合物,所述粪副拟杆菌(parabacteroidesmerdae)是具有由序列号4所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<16>根据<11>~<14>的任一项所述的药物组合物,所述粪副拟杆菌(parabacteroidesmerdae)是以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株)。
<17>根据<11>~<16>的任一项所述的药物组合物,所述单形拟杆菌(bacteroidesuniformis)是具有由序列号5所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<18>根据<11>~<16>的任一项所述的药物组合物,所述单形拟杆菌(bacteroidesuniformis)是以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。
<19>根据<11>~<18>的任一项所述的药物组合物,所述由胰蛋白酶活性引起的疾病是炎症性肠疾病。
<20>根据<19>所述的药物组合物,所述炎症性肠疾病是溃疡性大肠炎(uc:ulcerativecolitis)和克罗恩病(cd:crohn’sdisease)的任1种疾病。
<21>治疗、改善或预防对象中的由胰蛋白酶活性引起的疾病的方法,其中,使该对象摄取选自属于帕拉普氏菌属(paraprevotella)的细菌、粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌。
<22>根据<21>所述的方法,属于帕拉普氏菌属(paraprevotella)的细菌是选自paraprevotellaclara和paraprevotellaxylaniphila中的至少1种细菌。
<23>根据<21>所述的方法,属于帕拉普氏菌属(paraprevotella)的细菌是具有由序列号1~3中的任一项所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<24>根据<21>所述的方法,属于帕拉普氏菌属(paraprevotella)的细菌是选自
以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株(paraprevotellaclara1c4株)、
paraprevotellaclarajcm14859t株和
paraprevotellaxylaniphilajcm14860t株
中的至少1种细菌株。
<25>根据<21>~<24>的任一项所述的方法,所述粪副拟杆菌(parabacteroidesmerdae)是具有由序列号4所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<26>根据<21>~<24>的任一项所述的方法,所述粪副拟杆菌(parabacteroidesmerdae)是以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株)。
<27>根据<21>~<26>的任一项所述的方法,所述单形拟杆菌(bacteroidesuniformis)是具有由序列号5所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
<28>根据<21>~<26>的任一项所述的方法,所述单形拟杆菌(bacteroidesuniformis)是以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。
<29>根据<21>~<28>的任一项所述的方法,所述由胰蛋白酶活性引起的疾病是炎症性肠疾病。
<30>根据<29>所述的方法,所述炎症性肠疾病是溃疡性大肠炎和克罗恩病的任1种疾病。
发明的效果
根据本发明,能够抑制胰蛋白酶活性。特别是能够抑制肠内胰蛋白酶活性。
附图说明
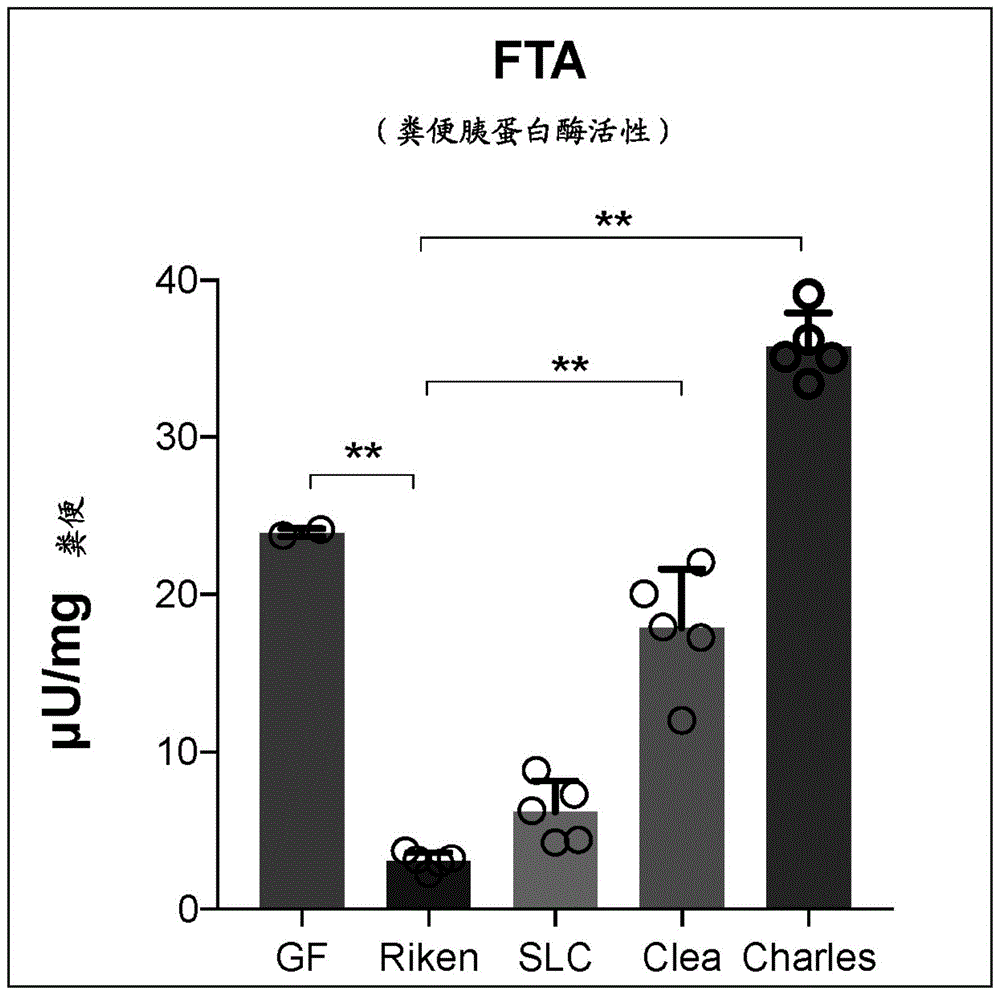
图1是显示对于来源于不同的饲养设施的spf小鼠评价盲肠内容物中(粪便)的胰蛋白酶活性的结果的图。图中,横轴中记载的“gf”、“riken”、“slc”、“clea”和“charles”表示无菌小鼠(gf小鼠)、理研维持的spf小鼠、日本エスエルシー株式会社维持的spf小鼠、日本クレア株式会社维持的spf小鼠和日本チャールズ·リバー株式会社维持的spf小鼠,纵轴表示各盲肠内容物中的胰蛋白酶活性。
图2显示评价日本的健常者志愿者的粪便(a、b、c、cii、d、e、h和g)中的胰蛋白酶活性的结果的图。图中的横轴表示各健常者志愿者,纵轴表示粪便中的胰蛋白酶活性。此外,粪便c和cii的提供者是同一健常者志愿者。
图3是显示将日本的健常者志愿者的粪便(a~f)经口地胃内施与gf小鼠,制作人菌群化小鼠(a~f),评价粪便中的胰蛋白酶活性的结果的图。图中的横轴显示各人菌群化小鼠和gf小鼠,纵轴显示粪便中的胰蛋白酶活性。
图4是显示对于将健常者志愿者的粪便cii经口地胃内施与gf小鼠,在其24小时之后开始通过自由饮水施与作为抗生素(abx)的氨苄青霉素(amp)、泰乐菌素(tylosin)或甲硝唑(mnz)而得的小鼠,经时地评价粪便中的胰蛋白酶活性的结果的图。图中的横轴表示施与抗生素之后的天数,纵轴表示粪便中的胰蛋白酶活性。此外,图中也显示评价仅施与健常者志愿者的粪便cii(未施与抗生素)的gf小鼠(control)、既未施与粪便也未施与抗生素的gf小鼠(gf)的结果。评价的个体数如下。control:amp:mnz:tylosin:gf=4:5:5:4:2。由于amp施与时的活性变化与抗生素未施与组(control)为相同的倾向,因而推测有助于活性降低的菌群是amp耐性菌。于是,由amp施与组的粪便样品进行菌的分离培养,得到下述图5所示的共计35种菌株。接着,将从抗生素施与开始第12天的各个体的菌群通过meta16srdna分析而导出。进而,对于构成菌群的各菌种的相对占有率、与其个体的胰蛋白酶活性值进行相关分析,推定有助于胰蛋白酶活性的降低的菌种。
图5是显示图4所示的从amp施与组的粪便样品分离的共计35种菌株的基于16srdna序列的同源性的系统树。图中的标号自左依次表示所归属的菌种名、16srdna分析的代表otuno.、命名的分离菌株。
图6是显示经时地评价定植有所述分离35种菌的小鼠粪便中的胰蛋白酶活性的结果的图。图中的横轴表示施与菌或粪便之后的天数,纵轴表示粪便中的胰蛋白酶活性。将分离的35种菌施与gf小鼠(图中“35mix”),评价肠内胰蛋白酶活性,结果与菌所来源的粪便的移植(图中“ciihumanfaces”)相比,确认了同等以上的效果。
图7是显示菌群与胰蛋白酶活性的斯皮尔曼相关(spearman’scorrelation)的图。更具体地,是显示对于无相关检验p值满足p<0.05的菌种,按照相关系数ρ的升序表达的结果的图。由斯皮尔曼相关(spearman’scorrelation)推定各个体的粪便中胰蛋白酶活性值与其存在量相关的菌株。其中,着眼于负相关强的9种菌株(由左侧起的9种菌)。
图8是显示对于定植了在图7所示的斯皮尔曼相关(spearman’scorrelation)中确认了强的负相关的9种菌株(9-mix)的小鼠粪便中的胰蛋白酶活性经时地进行评价的结果的图。另外对于下述图9所示的定植了6种菌株(6-mix)或3种菌株(3-mix)的小鼠也同样地进行评价。图中的横轴表示施与各菌混合液(cocktail)之后的天数,纵轴表示粪便中的胰蛋白酶活性。
图9显示在图7所示的斯皮尔曼相关(spearman’scorrelation)中确认了强的负相关的9种菌株的系统树。如图所示,9种菌株分为属于拟杆菌属(bacteroides)的3种菌株(图中“bacteroides”)和除了拟杆菌属(bacteroides)以外的6种菌株(图中“non-bacteroides”)。
图10是显示评价由分离培养菌产生的胰蛋白酶蛋白质的分解的结果的照片。将包含胰蛋白酶的gf小鼠盲肠内容物与各菌混合,在厌氧培养之后,通过蛋白质印迹(westernblotting)评价胰蛋白酶蛋白质的有无。图中,“pc”表示评价小鼠胰脏内容物(包含活性型胰蛋白酶)的结果,“w/obacteria”表示评价gf小鼠盲肠内容物(不与菌混合)的结果。“6-mix”和“3-mix”表示对将图8和9所示的上述6种菌株和3种菌株分别混合而得的小鼠盲肠内容物进行评价的结果。“6strains”显示对于将上述6种菌株(1b2~671b8)分别混合而得的小鼠盲肠内容物进行评价的结果。“3strains”显示对于将上3种菌株(1c4~3h3)分别混合而得的小鼠盲肠内容物进行评价的结果。3mix和作为3mix的构成菌之一的仅p.clara单菌确认了胰蛋白酶蛋白质的消失。即考虑,通过p.clara菌分解胰蛋白酶,从而胰蛋白酶活性被抑制。
图11是对由胰蛋白酶活性抑制菌混合液(cocktail)的定植产生的溃疡性大肠炎(uc)样炎症的发生抑制进行评价的结果的图。对il10-/-小鼠施与上述的胰蛋白酶活性抑制菌3mix或胰蛋白酶活性非抑制菌6mix之后,使其感染诱导uc样肠炎的ka11e12,经时地检测小鼠粪便中的胰蛋白酶活性。图中,横轴显示施与各菌混合液(cocktail)之后的经过时间。纵轴表示粪便中的胰蛋白酶活性。“11e12”表示对il10-/-小鼠仅施与ka11e12的结果,“11e12+6mix”和“11e12+3mix”显示对il10-/-小鼠分别施与3mix和6mix之后,施与ka11e12的结果。“gf”表示对无菌小鼠进行评价的结果。“3mix”表示对il10-/-小鼠仅施与3mix的结果。
图12是显示在图11所示的小鼠中,对ka11e12施与3周之后的肠内炎症水平进行评价的结果的散点图。图中,横轴的标号与图11相同。纵轴表示粪便中的炎症标志物(脂质运载蛋白-2、lcn2)的浓度。
图13是显示对由p.clara及其亲缘菌种产生的胰蛋白酶蛋白质的分解进行评价的结果的照片。图中,“pc”表示对小鼠胰脏内容物(包含活性型胰蛋白酶)进行评价的结果,“w/obacteria”表示对gf小鼠盲肠内容物(不与菌混合)进行评价的结果。“1c4”表示对混合了本发明中分离的p.clara菌株1c4(参照图10)的小鼠盲肠内容物进行评价的结果。“jcm14859”表示对混合了与1c4不同的p.clara菌的其他株的小鼠盲肠内容物进行评价的结果。“jcm14860”表示对混合了作为p.clara菌的亲缘种的p.xylaniphila菌株的小鼠盲肠内容物进行评价的结果。如图13所示,任何株都确认了胰蛋白酶分解活性。属于帕拉普氏菌属(paraprevotella)的菌仅已知上述的2种jcm14859和jcm14860。由此推定,胰蛋白酶分解活性是帕拉普氏菌属(paraprevotella)中共有的活性。
图14是显示通过以胰蛋白酶作为检测对象的蛋白质印迹(westernblotting)对胰蛋白酶(mprss2)与p.clara菌来源的蛋白质的交联试验的结果进而分析而得的结果的照片。图中,“mprss2+p.clara”表示对仅与mprss2孵育而得的p.clara菌的细胞溶解液进行分析的结果,“mprss2+p.claracrosslink”表示对与mprss2孵育、进而实施交联反应而得的p.clara菌的细胞溶解液进行分析的结果,“p.clara”表示不与mprss2孵育地对p.clara的细胞溶解液进行分析的结果,“p.claracrosslink”表示不与mprss2孵育地实施交联反应,对p.clara的细胞溶解液进行分析的结果。“mprss2+egef”表示对添加了mprss2的egef培养基进行分析的结果,“mprss2+p.clara”表示对孵育mprss2和p.clara之后的egef培养基进行分析的结果,“p.claraonly”表示对仅孵育p.clara之后的egef培养基进行分析的结果。图中,“mprss2”表示通过蛋白质印迹(westernblotting)而检测到的mprss2的条带的位置,“reactioncomplex(approx。250kd)”表示与吸附或结合于mprss2(约32kda)而形成的p.clara菌来源的蛋白质(220kda程度)的复合物的条带的位置。“non-specific”表示通过蛋白质印迹(westernblotting)而检测到的非特异性条带的位置。
图15是显示胰蛋白酶活性抑制试验的结果的照片。具体地,是显示将经胰蛋白酶活性抑制剂处理的人prss2(hprss2)(图中“tlck(+)”)或未处理的hprss2(图中“tlck(-)”)、与各菌(p.clara1c4、p.merdae1d4或p.xylaniphila)孵育,通过蛋白质印迹(westernblotting)检测hprss2而得的结果的照片。此外,图中“none”表示在菌不存在下仅孵育胰蛋白酶的结果。
具体实施方式
如后述的实施例所示,搞清楚了属于帕拉普氏菌属(paraprevotella)的细菌抑制胰蛋白酶的活性。因此,本发明提供含有属于帕拉普氏菌属(paraprevotella)的细菌作为有效成分的、用于抑制胰蛋白酶活性的组合物。
“胰蛋白酶”是内肽酶、丝氨酸蛋白酶的一种。另外,是胰液所含的消化酶的一种,具有水解碱性氨基酸的羧基侧的肽键的活性。作为本发明中其活性被抑制的胰蛋白酶不特别限制,优选为阴离子性胰蛋白酶,更优选为anionic-trypsin-2(prss2)。prss2典型地如果是人来源的,则可列举由ncbi参考序列:np_002761所规定的氨基酸序列组成多肽(由ncbi参考序列:nm_002770所规定的碱基序列编码的氨基酸序列组成的多肽),如果是小鼠来源的,则可列举由ncbi参考序列:np_033456所规定的氨基酸序列组成的多肽(由ncbi参考序列:nm_009430所规定的碱基酸序列编码的氨基酸序列组成的多肽)。此外,本发明所涉及的prss2不限于以这些典型的氨基酸序列特定的多肽,也包含功能上为活性的其衍生物、功能上为活性的其片段、其同源体、由在高严格条件或低严格条件下与编码这些多肽的核酸杂交的核酸所编码的变异体。另外,这样的衍生物、片段、同源体或变异体中包含相对于所述特定氨基酸序列有至少60%(优选为70%、更优选为80%、进一步优选为90%、更优选为95%、特别优选为99%)的同源性的多肽。
关于“胰蛋白酶活性”,如上所述,通常是指水解碱性氨基酸(赖氨酸、精氨酸)的羧基侧的肽键的活性。然而,如后述的实施例所示,本发明中,胰蛋白酶活性的抑制通过胰蛋白酶的分解而实现。另外后述的实施例中也显示,该分解通过胰蛋白酶的自身分解(自身消化)的促进而被诱导。因此,在本发明中被抑制的“胰蛋白酶活性”中,自身分解的活性除外。另外,本发明中,“胰蛋白酶活性的抑制”也可以说成是胰蛋白酶分解的促进、胰蛋白酶自身分解的促进。
关于“胰蛋白酶活性的抑制”,只要是本领域技术人员,就能够通过例如,将经标记的底物肽的分解程度通过检测该标记来进行评价(例如,后述的实施例所示的“proteaseactivityassaykit(abcamab111750)”)。另外,也可以如后述的实施例所示,通过以胰蛋白酶作为检测对象的免疫检测法(例如,蛋白质印迹(westernblotting))评价胰蛋白酶的分解的程度来进行。此外,本发明中“抑制”也包含完全的抑制(阻遏)。
本发明的组合物中为了抑制胰蛋白酶活性而作为有效成分包含的“属于帕拉普氏菌属(paraprevotella)的细菌”,是属于拟杆菌门(bacteroidetes)、拟杆菌纲(bacteroidia)、拟杆菌目(bacteroidales)、普雷沃氏菌科(prevotellaceae)、帕拉普氏菌属(paraprevotella)的细菌,可列举例如,paraprevotellaclara(p.clara)、paraprevotellaxylaniphila(p.xylaniphila)。
作为p.clara,可列举例如,以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株(paraprevotellaclara1c4株)、paraprevotellaclarajcm14859t株。
作为p.xylaniphila,可列举例如,paraprevotellaxylaniphilajcm14860t株。
此外,“paraprevotellaclarajcm14859t株”和“paraprevotellaxylaniphilajcm14860t株”从理化学研究所生物资源研究中心(rikenbrc)微生物材料开发室(jcm)获得。
另外,作为属于帕拉普氏菌属(paraprevotella)的细菌,可列举具有由序列号1~3中的任一项所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。此外,序列号1~3所记载的碱基序列分别表示上述paraprevotellaclara1c4株、paraprevotellaclarajcm14859t株和paraprevotellaxylaniphilajcm14860t株的16srrna的序列。
另外,本发明的用于抑制胰蛋白酶活性的组合物除了前述的属于帕拉普氏菌属(paraprevotella)的细菌之外,从使该菌在肠内容易定植这样的观点考虑,也可以进一步含有选自粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌。
作为“粪副拟杆菌(parabacteroidesmerdae)”,可列举例如,以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株)。另外,作为粪副拟杆菌(parabacteroidesmerdae),可列举具有由序列号4所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。此外,序列号4所记载的碱基序列表示上述parabacteroidesmerdae1d4株的16srrna的序列。
作为单形拟杆菌(bacteroidesuniformis),可列举例如,以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。另外,作为单形拟杆菌(bacteroidesuniformis),可列举具有由序列号5所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。序列号5所记载的碱基序列表示上述bacteroidesuniformis3h3株的16srrna的序列。
此外,作为本发明中的“至少90%的同一性”,相对于各碱基序列的同一性优选为95%以上(例如,96%以上、97%以上、98%以上)、特别优选为99%以上。
本发明的组合物所含的细菌可以是活菌,也可以是死菌体。另外,也可以是上述细菌所含的物质(蛋白质、核酸、脂质、糖质、糖链等)、该细菌的分泌产物、由该细菌产生的代谢产物。另外,可以将本发明的组合物复合而使用,在作为结果是联合使用而被摄取或吸收的情况(联合使用组合物的情况)下,前述的细菌也可以分开在2种以上的组合物中存在。
本发明的用于抑制胰蛋白酶活性的组合物可以是用于药物组合物(药品、医药部外品等)、饮食品(包含动物用饲料)、或研究目的(例如,体外、体内的实验)的试剂的形态。另外,本发明的组合物抑制胰蛋白酶活性,因而可作为用于由该活性引起的疾病的治疗、预防或改善的药物组合物、饮食品使用。
本发明的组合物可以通过公知的制剂学方法来制剂化。例如,可以作为胶囊剂、锭剂、丸剂、液剂、散剂、颗粒剂、细粒剂、膜涂覆剂、颗粒(pellet)剂、片(troche)剂、舌下剂、咀嚼剂、含服剂、糊剂、糖浆剂、悬浮剂、酏剂、乳剂、涂布剂、软膏剂、硬膏剂、泥敷剂、经皮吸收型制剂、洗剂、吸引剂、气溶胶剂、注射剂、栓剂等,用于通过包含经口的、非经口的(例如,肠道内、肌肉内、静脉内、气管内、鼻内、经皮、皮内、皮下、眼内、阴道、腹腔内、直肠或吸入)、或它们多种组合的途径的施与。
这些制剂化中,可以适宜组合药理学上或作为饮食品容许的载体,具体为灭菌水、生理盐水、缓冲液、培养基、植物油、溶剂、基剂、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载剂(vehicle)、防腐剂、结合剂、稀释剂、等渗剂、无痛化剂、增量剂、崩解剂、缓冲剂、涂剂、润滑剂、着色剂、甜味剂、粘稠剂、矫味矫臭剂、溶解辅助剂或其他添加剂等。
另外,这些制剂化中,从更有效地诱导肠道内的胰蛋白酶活性等的观点出发,特别在以经口施与为目的的制剂中,也可以与能够将本发明的组合物高效地送达肠道内的组合物组合。对于这样的能送达肠道内的组合物不特别限制,可以适宜采用公知的组合物,可列举例如,ph敏感性组合物、抑制到肠道的释放的组合物(纤维素系聚合物、丙烯酸聚合物和共聚物、乙烯基酸聚合物和共聚物等)、肠道粘膜特异粘附的生物体粘附性组合物(例如,美国专利第6368586号说明书中记载的聚合物)、含有蛋白酶抑制剂的组合物、被肠道内酶特异地分解的组合物)。
另外,在作为药物组合物使用的情况下,可以进一步包含用于由胰蛋白酶活性引起的疾病的治疗、预防或改善的公知的物质(例如,抗炎剂、免疫抑制剂),另外也可以与该物质联合使用。
在使用本发明的组合物作为饮食品的情况下,该饮食品可以是例如,健康食品、功能性食品、特定保健用食品、营养功能食品、功能性标注食品、营养辅助食品、患者用食品、或动物用饲料。作为饮食品的具体例,可列举发酵饮料、包含油分的制品、汤类、乳饮料、清凉饮料水、茶饮料、酒精饮料、饮剂、胶冻状饮料等液状食品,含有碳水化合物的食品、畜产加工食品,水产加工食品;蔬菜加工食品,半固体状食品,发酵食品,点心类,甑制品,微波炉对应食品等。还可列举制备成粉末、颗粒、片剂、胶囊剂、液状、糊状或胶冻状的健康饮食品。其中,本发明中的饮食品的制造可以通过该技术领域公知的制造技术来进行。该饮食品中也可以添加对由胰蛋白酶活性引起的疾病的改善或预防有效的成分(例如,营养素等)。另外,还可以通过与发挥除了该改善等以外的功能的其他成分或其他功能性食品组合而制成多功能性的饮食品。
本发明的组合物的制品(药品、医药部外品、饮食品、试剂等)或其说明书可以附有用于抑制胰蛋白酶活性、或用于治疗、改善或预防由胰蛋白酶活性引起的疾病的宗旨的标注。另外,关于饮食品,可以是为了在形态和对象者等方面与一般食品区别,作为保健功能食品(特定保健用食品、营养功能食品、功能性标注食品)将健康功能的标注附加于本发明的组合物的制品等而得的饮食品。其中“在制品或说明书附加标注”是指在制品的本体、容器、包装等上附加标注,或者在公开制品的信息的说明书、附加文档、宣传物、其他印刷物等上附加标注。另外,本发明的组合物也可以是试剂盒的方式。
另外,如上所述,可以使用上述的细菌等,通过公知的制剂化技术制造药物组合物。因此,本发明还提供本发明的肠内细菌等用于制造用于治疗、改善或预防由胰蛋白酶活性引起的疾病的药物组合物的用途。
<由胰蛋白酶活性引起的疾病的治疗方法等>
本发明还提供抑制对象中的胰蛋白酶活性的方法、抑制该对象中的免疫的方法、或治疗、改善或预防该对象中的由胰蛋白酶活性引起的疾病的方法,其特征在于,使该对象摄取上述的组合物、或成为这些组合物的有效成分的上述的细菌(以下也称为“本发明的药物组合物等或这些组合物的有效成分等”)。
本发明中,“由胰蛋白酶活性引起的疾病”是指由胰蛋白酶活性诱发的疾病,可列举炎症性肠疾病(溃疡性大肠炎、克罗恩病、炎症性肠疾病这样的慢性炎症性肠疾病等)。
本发明中,“治疗、改善”不仅包含由所述疾病的完全恢复,还包含缓和上述疾病的症状、或抑制其进行。“预防”包含使上述疾病的发病抑制或延迟、以及抑制其复发。
本发明的药物组合物等或它们的有效成分等可以以包含人的动物作为对象使用,作为除了人以外的动物不特别限制,可以以各种家畜、家禽、宠物、实验用动物等作为对象。另外,作为本发明的药物组合物等或这些组合物的有效成分等的摄取对象,不仅包含患有由胰蛋白酶活性引起的疾病的对象,还包含有可能罹患该疾病的对象、以及所述疾病的症状缓和或消失(缓解)的对象。
作为本发明的药物组合物等或它们的有效成分等的摄取方法,不特别限制,可以是经口施与,也可以是非经口施与(例如,对肠道内的施与),在经口施与的情况下,从进一步提高本发明的药物组合物等或这些组合物的有效成分等的效果这样的观点考虑,本发明的药物组合物等或这些组合物的有效成分等的摄取对象优选预先通过摄取质子泵抑制剂(ppi)等而使胃酸的产生减少。
另外,在摄取本发明的药物组合物等或这些组合物的有效成分等时,只要是本领域技术人员,就能够根据对象的年龄、体重、疾病的症状、健康状态、组合物的种类(药品、饮食品等)、摄取方法等适宜选择其摄取量。
以上对于用于治疗、改善或预防本发明的由胰蛋白酶活性引起的疾病的组合物、或方法的适合实施方式进行了说明,但该组合物或方法不限于上述实施方式。
如后述的实施例所示,通过施与属于帕拉普氏菌属(paraprevotella)的细菌、粪副拟杆菌(parabacteroidesmerdae)、单形拟杆菌(bacteroidesuniformis),确认了使il-10基因缺损小鼠感染产气肠杆菌(enterobacteraerogenes)而诱导大肠炎的模型中的发病被抑制的倾向。另外,在dss诱导大肠炎模型中,大肠炎的发病也有意义地被抑制。
因此,本发明还提供用于治疗、改善或预防以下的由胰蛋白酶活性引起的疾病的药物组合物、和方法。
用于治疗、改善或预防由胰蛋白酶活性引起的疾病的药物组合物,含有选自属于帕拉普氏菌属(paraprevotella)的细菌、粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌作为有效成分。
使对象摄取选自属于帕拉普氏菌属(paraprevotella)的细菌、粪副拟杆菌(parabacteroidesmerdae)和单形拟杆菌(bacteroidesuniformis)中的至少1种细菌,来治疗、改善或预防该对象中的由胰蛋白酶活性引起的疾病的方法。
<新的细菌>
如后述的实施例所示,下述3种菌株是由本发明者们首次分离培养出的金黄色葡萄球菌株。另外,它们的有用性也如上所述。因此,本发明还提供以下的菌株。
以保藏号nitebp-02775特定的属于paraprevotellaclara的细菌株(paraprevotellaclara1c4株)。
以保藏号nitebp-02776特定的属于粪副拟杆菌(parabacteroidesmerdae)的细菌株(parabacteroidesmerdae1d4株)。
以保藏号nitebp-02777特定的属于单形拟杆菌(bacteroidesuniformis)的细菌株(bacteroidesuniformis3h3株)。
此外,任一细菌株均在2018年8月30日委托国家技术评估学会(nite)专利微生物保藏中心(
实施例
以下,基于实施例更具体地说明本发明,但本发明不限于以下的实施例。另外,本实施例使用以下所示的材料和方法进行。
(无菌小鼠)
将c57bl/6njcl悉生生物小鼠(日本クレア株式会社、4~8周龄)在饲养用塑料隔离箱(无菌隔离箱、株式会社アイシーエム;icm-1b)内、在自由饮水进食条件下饲养1周以上,使其环境驯化。
(spf小鼠)
从理化学研究所生物资源研究中心、日本slc株式会社、日本クレア株式会社、或日本チャールズ·リバー株式会社获得c57bl/6nspf小鼠(4~8周龄),在spf环境下、在自由饮水进食条件下饲养1周以上,使其环境驯化。
(盲肠内容物的蛋白质组分析)
将小鼠在异氟烷麻醉下处死,采集盲肠内容物,在-80℃保存。将冷冻保存的样品在冰上融化,加入5倍重量的ripalysisbufferwithproteaseinhibitorcocktail(コスモ·バイオ株式会社;akr-190)进行充分搅拌。以4℃、15000×g离心20分钟,获得溶存有蛋白质的上清。
将蛋白质溶液与同体积量的30%三氯乙酸(tca)溶液(ナカライテスク;37211-55)混合,在4℃静置30分钟,然后以4℃、15000×g离心20分钟除去上清,获得蛋白质的沉淀物。将对丙酮的再分散和再沉淀重复2次,纯化沉淀。
添加溶解有终浓度12mm脱氧胆酸钠(sdc,ナカライテスク;02889-72)、12mm月桂基硫酸钠(sls,ナカライテスク;31623-32)的100mmtris-hclph9.0缓冲液(ニッポンジーン;316-90385),使得蛋白质浓度为2.0μg/μl,将5秒的超声波处理重复4次进行再溶解。使用takarabcaproteinassaykit(タカラバイオ;t9300a)通过bca法定量蛋白质浓度,定容至1.0μg/μl。
在1.0μg/μl蛋白质溶液20μl中添加100mm二硫苏糖醇(ナカライテスク;14128-91)水溶液2μl,在50℃加热30分钟,还原二硫键。进而添加375mm碘乙酰胺(ナカライテスク;19302-54)水溶液2μl在室温使其反应30分钟,将巯基烷基化。添加400mm半胱氨酸(ナカライテスク;11548-52)水溶液4μl使其反应10分钟,使残存的碘乙酰胺猝灭。添加50mm碳酸氢铵(ナカライテスク;08887-54)水溶液80μl、200ng/μl赖氨酸肽链内切酶(和光纯药;125-05061)溶液2μl、和200ng/μl胰蛋白酶(和光纯药;202-15951)溶液2μl,在37℃使其反应一晚,将蛋白质进行肽片段化。
加入5%三氟乙酸(tfa,ナカライテスク;34901-21)水溶液30μl,然后用乙酸乙酯(ナカライテスク;14747-65)200μl进行液-液提取,除去sdc和sls。通过离心蒸发器处理,除去溶存有机溶剂。加入0.1%tfa水溶液100μl,在室温15000×g离心15分钟,除去不溶物。用c18tips(サーモフィッシャーサイエンティフィック;87782)进行脱盐处理之后,溶解在终浓度3%乙腈(ナカライテスク;00430-25)0.1%甲酸(ナカライテスク;08965-82)水溶液中。使用sciex社tripletof5600系统进行lc-ms测定,利用swathacquisition进行蛋白质组分析。
(小鼠粪便或人健常者志愿者粪便获得)
将健常者志愿者#a~g粪便、或小鼠粪便样品用20体积%甘油溶解pbs稀释至5倍重量,用100μm直径过滤器过滤,将所得的产物作为储存液在-80℃保存。
(粪便中胰蛋白酶活性的测定)
将冷冻粪便样品在常温融化之后,在0.9%nacl水溶液中分散,按照proteaseactivityassaykit(abcamab111750)的方案测定其上清的胰蛋白酶活性。
(人健常者志愿者粪便来源的菌的定植小鼠的制成)
将上述(小鼠粪便或人健常者志愿者粪便获得)制成的储存液在常温融化,用pbs稀释至10倍体积。将200μl的该稀释液经口施与无菌小鼠的胃内。进而在无菌隔离箱内、在自由饮水进食条件下饲养1个月,使移植粪便中的菌定植在该小鼠中。另外,对于这些小鼠,用上述(粪便中胰蛋白酶活性的测定)中记载的方法测定胰蛋白酶活性。
(人健常者志愿者粪便来源的菌的定植小鼠的制成、和利用抗生素施与的定植菌的排除)
在上述(人健常者志愿者粪便来源的菌的定植小鼠的制成)中将自由饮水变成氨苄青霉素、甲硝唑或泰乐菌素的200mg/l水溶液,进一步饲养1个月,进行各抗生素的非耐性菌的排除。用上述(小鼠粪便或人健常者志愿者粪便获得)中记载的方法获得施与过程的小鼠的粪便样品,另外,用上述(粪便中胰蛋白酶活性的测定)中记载的方法测定胰蛋白酶活性。
(由小鼠粪便的dna提取)
在用100μm直径过滤器过滤后的粪便样品液100μl中加入溶解有15mg溶菌酶(sigma-aldrich、lysozymefromchickeneggwhite;l4919)和5μlrnase(thermofisherscientific、purelinkrnasea(20mg/ml);12091-021)的10mmtris/10mmedta缓冲液(ph8.0,以下称为te10)800μl,在37℃振荡1小时。接着,添加achromopeptidase(注册商标,无色肽酶)(wako;015-09951)2000u,在37℃振荡30分钟,进行溶菌。
加入20%sdste10溶液50μl、和溶解有20mg/ml的蛋白酶k(roche,proteinasek,recombinant,pcrgrade;03115852001)的te10溶液50μl,在55℃振荡60分钟。
通过利用苯酚/氯仿/异戊醇(25:24:1)(wako;311-90151)的液-液提取法提取dna,通过乙醇沉淀获得细菌基因组dna。
(小鼠粪便的菌群分析)
对于细菌基因组dna,使用takaraextaq(タカラバイオ;rr001a)进行pcr反应,制成16srdna的illumina社miseq测序用扩增子。引物序列如下(nishijimasetaldnares23125-1332016)。
27forward-mod:
(5’-aatgatacggcgaccaccgagatctacac**index**acactctttccctacacgacgctcttccgatctagrgtttgatymtggctcag-3’)
将与索引(index)序列邻接的两序列示于序列号10和11。
338reverse:
(5’-caagcagaagacggcatacgagat**index**gtgactggagttcagacgtgtgctcttccgatcttgctgcctcccgtaggagt-3’)
将与索引(index)序列邻接的两序列示于序列号12和13。
使用agencourtampure(注册商标)xp(ベックマンコールター;a63882)和minelutepcrpurificationkit(キアゲン;28004)纯化扩增子,使用quant-itpicogreen(注册商标)dsdnaassaykit(サーモフィッシャーサイエンティフィック;p7589)和kapalibraryquantificationkit(ロシュ·ダイアグノスティックス;07960166001)定量扩增子的dna浓度。使用agilent2100バイオアナライザhighsensitivitydna试剂盒(アジレント·テクノロジー;5067-4626)测定各扩增子的混合物的平均dna长度,计算出扩增子的摩尔浓度。按照illumina社的miseq16srdna基因组分析方案,进行文库的变性和杂交溶液的制备,使用miseq(イルミナ;sy-410-1003)和miseqreagentkitv3(イルミナ;ms-102-3003)进行测序。
对于所得的序列数据,对每个样品随机选择品质高的3000read,通过利用operationaltaxonomicunit(otu)代表序列的数据库分析法的菌种归属,获得菌群数据。数据库使用ncbi(https://www.ncbi.nlm.nih.gov/taxonomy)、rdp(https://rdp.cme.msu.edu/),在菌种归属中采用在对各数据库的glsearch(https://nebc.nox.ac.uk/bioinformatics/docs/glsearch.html)的top-hit中同源性最高的结果(nishijimasetaldnares23125-1332016)。
(菌的分离)
将粪便样品施与12天之后的粪便用pbs稀释,使用以下的培养基在10%co2厌氧环境下培养,分离所形成的集落。
以egext.培养基、mgam培养基、schaedler培养基(wako;517-45805)、bl培养基(nissui;5430)cm0619培养基(wilkinst.d.andchalgrens.(1976)antimicrob.agentschemother.10.926-928.)作为基本培养基,使用添加了终浓度5%的马血液或马脱纤维血液的培养基的琼脂平板。特别是对于cm0619培养基,也同样地使用添加了规定的补剂的sr0107选择培养基或sr0108选择培养基(https://www.oxoid.com/uk/blue/prod_detail/prod_detail.asp?pr=cm0619)。
(系统树的制成)
使用统计分析软件r(https://www.r-project.org/)的包ape,基于菌群分析时的归属中使用的otu的代表序列,制成基于所分离的35种菌的16srdna序列的类似度的系统树。
(利用分离35种菌定植的肠内胰蛋白酶活性的抑制)
将上述(菌的分离)分离的各菌用egext.培养基、mgam培养基、schaedler培养基、bl培养基或cm0619培养基分别在37℃,10%co2厌氧环境下培养1~3天。将达到稳定期的菌液分别等体积混和,将200μl经口施与实施例1的无菌小鼠的胃内。在无菌隔离箱内、在自由饮水进食条件下饲养,使菌定植。另外,按照上述(粪便中胰蛋白酶活性的测定)测定胰蛋白酶活性。
(斯皮尔曼(spearman)的顺位相关分析)
对于由粪便施与12天之后的、基于16srdna的肠内菌群分析而得的各构成菌的相对占有率、及其粪便的胰蛋白酶活性值,进行斯皮尔曼(spearman)的顺位相关分析。将菌的相对占有率与胰蛋白酶活性值的相关系数ρ为ρ≤-0.5、且该无相关检验的p值为p<0.05的菌群推定为胰蛋白酶活性抑制菌的候选。
(利用选择菌混合液(cocktail)的肠内胰蛋白酶活性的抑制)
对于在所述(斯皮尔曼(spearman)的顺位相关分析)中推定为胰蛋白酶活性抑制菌的候选的9种菌株,依据上述(利用分离35种菌定植的肠内胰蛋白酶活性的抑制)中记载的方法,进行菌定植小鼠的制成及其肠内胰蛋白酶活性的测定。另外,对于所述9种菌株,区分为拟杆菌属(bacteroides)3种菌株、和非拟杆菌属(bacteroides)6种菌株,进行菌定植小鼠的制成及其肠内胰蛋白酶活性的测定。
(利用胰蛋白酶活性抑制菌混合液(cocktail)的定植6的溃疡性大肠炎(uc)样炎症的发生抑制)
将il10-/-小鼠(4~8周龄、ジャクソン·ラボラトリー)依据上述(无菌小鼠)中记载的方法进行无菌饲养。另外依据上述(利用选择菌混合液(cocktail)的肠内胰蛋白酶活性的抑制)中记载的方法,经口施与分离的拟杆菌属(bacteroides)3种菌株或非拟杆菌属(bacteroides)6种菌株,使其定植。在从该经口施与开始1周之后,按照以下步骤进行uc样的炎症的诱导处置。将由uc患者分离的k.aeromobilis11e12株(atarashik.etalscience358,3592017)用schaedler培养基、在37℃、10%co2厌氧环境下培养1~3天,将达到稳定期的菌液1-2×108cfu/200μl经口施与小鼠的胃内。接下来,在无菌隔离箱内、在自由饮水进食条件下进一步饲养3周,使菌定植。依据上述(粪便中胰蛋白酶活性的测定)中记载的方法进行11e12株施与3周之后的肠内胰蛋白酶活性的测定。另外,作为炎症的指标,通过elisa法测定粪便中的脂质运载蛋白-2水平(abcam;mouselipocalin-2elisakit;ab199083)。
(利用培养菌的胰蛋白酶活性的抑制)
在37℃,10%co2厌氧环境下培养1~3天而达到稳定期的上述(斯皮尔曼(spearman)的顺位相关分析)中筛选的各9种菌的培养液中,同体积量混合将无菌小鼠的盲肠内容物用无菌水稀释50倍而得的含胰蛋白酶液,进而在相同条件下培养12小时。
以10000×g离心15分钟,获得不包含菌体的上清。与上样缓冲液(biorad;1610739)混合,在巯基乙醇还原和热变性处理之后进行sds-tricine-page。接着,在tris-甘氨酸缓冲液中施加电压,向immobilon-ptransfermembrane(merck;iseq07850)转印。使用抗anionictrypsin-2兔抗体作为一抗,使用anti-igg(h+lchain)(rabbit)pab-hrp(mbl;codeno.458)作为二抗,利用通过chemi-lumionesuper(ナカライテスク;02230-14)的化学发光,确认anionictrypsin-2蛋白质的有无。
(利用paraprevotella菌的胰蛋白酶活性的抑制)
从理化学研究所生物资源研究中心(rikenbrc)微生物材料开发室(jcm)获得jcm14859(p.clara株)和jcm14860(p.xylaniphila株),在egext.培养基中分别在37℃、10%co2厌氧环境下培养1~3天。将达到稳定期的菌液依据上述(利用培养菌的胰蛋白酶活性的抑制)中记载的方法进行处理,由蛋白质印迹(westernblotting)的结果评价胰蛋白酶的分解活性。
(p.clara来源的蛋白质与胰蛋白酶的交联试验)
将150μg/mlmprss2/pbs溶液25μl、厌氧条件下在egef培养基中培养而达到稳定期的p.clara1c4株(od600>1.0)150μl、和新鲜的egef培养基75μl混合,在37℃孵育35分钟。以室温、4000×g离心分离5分钟,回收上清(相当于图14中的“supernatant”样品)。在800μl的pbs中将菌再分散之后,以室温、4000×g离心分离、除去上清,从而除去未吸附的mprss2蛋白质。在10mmdsso/pbs水溶液250μl中使菌再分散,在室温静置15分钟,从而在菌构成物和吸附物中形成随机的共价键的交联。进而,加入200mmtris-hcl水溶液(ph8.0)30μl,在室温静置5分钟,从而使未反应的dsso猝灭。以室温、4000×g条件离心分离5分钟,除去上清。在800ul的pbs中使菌再分散,然后在相同条件下离心分离,除去上清进行洗涤。添加1%sds/10mmtris-hcl(ph8.0)/5mmedta组成的细胞溶解液将菌破碎,然后以4℃、20000×g条件离心分离5分钟,作为上清获得细胞破碎液(相当于图14中的“pellet”样品)。将supernatant样品和pellet样品进行蛋白质印迹(westernblotting),用化学发光检测mprss2特异的抗体,从而检测与mprss2结合的蛋白质。此外,本法中使用的试剂等如下。
mprss2:小鼠重组prss2蛋白质(histag)(sinobiological社50383-m08h)
dsso:双琥珀酰亚胺亚砜(thermofisherscientific社a33545)
sds:由10%-sds溶液制备(ナカライテスク社30562-04)
tris-hcl:由1mol/l-tris-盐酸缓冲液(ph8.0)制备(ナカライテスク社06938-44)
edta:由0.5mol/l-edta溶液(ph8.0)制备(ナカライテスク社06894-14)
pbs:dulbecco磷酸缓冲生理盐水(不含ca,mg)(ナカライテスク社14249-95)
wb检测用一抗:anti-6-his,rabbit-poly(フナコシ社a190-114a、稀释400倍而使用)
wb检测用二抗:anti-igg(rabbit)pab-hrp(mblcodeno.458、稀释400倍而使用)
wb检测用试剂:ケミルミワンl(ナカライテスク社07880-54)。
(胰蛋白酶活性抑制试验)
在1mg/mlhprss2/pbs水溶液中添加5倍摩尔量tlck的dmso溶液,在室温静置3小时,制成施加了tlck修饰的不具有胰蛋白酶活性的tlck-hprss2。通过sephadex-g25柱色谱除去未反应的tlck,经过利用超滤膜的浓缩,纯化tclk-hprss2。将在厌氧条件下在egef培养基中培养而达到稳定期的p.clara菌在室温、4000×g条件下离心分离5分钟,并在pbs中将菌再分散,然后将相同条件下的离心分离和上清除去再进行1次,获得除去了egef培养基成分的菌。将分散在pbs中的菌、与tclk-hprss2/pbs溶液混合,在20ng/μltlck-hprss2、菌浓度od=0.9的条件下在厌氧条件的37℃环境静置3小时。将菌液在室温、4000×g条件离心分离5分钟,通过蛋白质印迹(westernblotting)检测其上清中的hprss2。此外,本法中使用的试剂等如下。
hprss2:人prss2/胰蛋白酶2蛋白质(重组)(lsbio社ls-g20167-5)
tlck:胰蛋白酶抑制剂甲苯磺酰-l-赖氨酰-氯甲烷盐酸盐(abcam社ab144542)
sephadex-g25:プレパックディスポーザブルpd-10柱(geヘルスケア社17085101)
wb检测用一抗:anti-prss2/trypsin2antibodyihc-plus(lsbio社ls-b15185-50、稀释400倍而使用)
wb检测用二抗:anti-igg(rabbit)pab-hrp(mblcodeno.458、稀释400倍而使用)
wb检测用试剂:ケミルミワンl(ナカライテスク社07880-54)。
(实施例1)
[无菌小鼠的粪便中活性型胰蛋白酶多]
进行理化学研究所维持的spf小鼠(理研·spf小鼠)和gf小鼠的盲肠内容物的全面的蛋白质分析(shotgunproteomics、蛋白质组分析)。
其结果虽未图示,但检测到713种宿主来源的蛋白质,其中45种的蛋白质在gf小鼠的盲肠内容物中有意义地多地存在。这些之中,特别着眼于显著多地存在、已被报告与ibd的关联的作为蛋白质分解酶的胰蛋白酶(anionictrypsin-2:prss2)。
接着,进行理研·spf小鼠和gf小鼠的、粪便中的胰蛋白酶的活性测定和基于蛋白印迹(westernblotting、wb)的蛋白质的量的评价
其结果虽未图示,但胰蛋白酶活性与理研·spf小鼠相比,在gf小鼠中有意义地高。另外,胰蛋白酶的蛋白质的量在gf小鼠中多。进而,对理研·spf小鼠和gf小鼠的远位大肠的肠管剖面通过免疫组织化学染色进行观察,结果gf小鼠中胰蛋白酶大量地存在。
由以上判明,在gf小鼠的盲肠以远的大肠内,与理研·spf小鼠相比存在大量的活性型胰蛋白酶。
[炎症性肠疾病和炎症模型小鼠的粪便中活性型胰蛋白酶多]
对于日本的罹患溃疡性大肠炎(uc)和克罗恩病(cd)的ibd患者的粪便样品进行胰蛋白酶的活性测定及其蛋白质的量的评价。作为比较对象,评价日本的健常者志愿者的粪便样品。其结果虽未图示,但与健常者的粪便相比,uc、cd的患者的粪便中发现了有意义地多的活性型胰蛋白酶。
另外,评价了作为大肠炎模型小鼠已知的il-10基因缺损小鼠(il10-/-小鼠)的炎症时的粪便中胰蛋白酶活性,结果与wt小鼠的粪便中的胰蛋白酶活性相比,胰蛋白酶活性有意义地高。报告了大肠中残存的活性型胰蛋白酶可能与ibd的发病、其病态的恶化相关。上述的一系列结果支持了现有报告。
[gf小鼠中活性型胰蛋白酶活性在盲肠以远残存]
对于理研·spf小鼠和gf小鼠比较消化道内的不同部位的胰蛋白酶活性。其结果虽未图示,但小肠中两者未发现显著性差异,但在盲肠以远,gf小鼠有意义地高。另外,通过rt-qpcr和wb确认了主要承担胰蛋白酶的分泌的胰脏组织中的胰蛋白酶前体·胰蛋白酶原(prss2)的表达量和分泌量,两者未发现显著性差异。
由一系列的结果考虑,gf小鼠的盲肠以远中的胰蛋白酶活性的亢进起因于由胰脏组织正常分泌的胰蛋白酶的异常残存。作为其要因之一,考虑定植于盲肠以远的肠内细菌的参与。即,设想为在spf小鼠中,定植于盲肠以远的肠内细菌具有减少活性型胰蛋白酶的功能,在gf小鼠中,由于不存在肠内细菌,因而活性型胰蛋白酶残存。
[小鼠的盲肠以远的肠道菌群影响其胰蛋白酶活性]
已知spf小鼠的肠道菌群根据每个饲养设施特有地被维持。因此,为了评价盲肠以远的定植的肠内细菌与其胰蛋白酶活性的关联性,对于来源于不同的饲养设施的spf小鼠,评价盲肠内容物中的胰蛋白酶活性及其菌群。将理研·spf小鼠、与日本エスエルシー株式会社、日本チャールズ·リバー株式会社、和日本クレア株式会社维持的spf小鼠(以下、slc·spf小鼠、charles·spf小鼠和clea·spf小鼠)进行比较。
其结果如图1所示,对于盲肠内容物中的胰蛋白酶活性,理研·spf小鼠和slc·spf小鼠为同等低的水准,charles·spf和clea·spf小鼠与前者2设施的小鼠相比有意义地高。另外,虽未图示,但对于肠道菌群,在理研·spf小鼠和slc·spf小鼠的2组、与charles·spf小鼠和clea·spf小鼠的2组之间,发现了unifrac-pcoa上的显著的差异。由以上判断,伴随着饲养环境差异的肠道菌群的差异影响盲肠以远的胰蛋白酶活性。进而提示,特定的肠内细菌种可能降低胰蛋白酶活性。
[健常者的肠内细菌降低小鼠的胰蛋白酶活性]
由上述的研究提示,特定的肠内细菌种可能在小鼠中降低被怀疑参与大肠的炎症的盲肠以远的胰蛋白酶活性。如果基于假说,则通过使特定的肠内细菌种定植在盲肠以远,能够抑制胰蛋白酶活性,进而期待大肠的炎症的缓和。于是设想将来的临床应用,对于使用人来源的肠内细菌的胰蛋白酶活性的控制进行了研究。
首先,对gf小鼠经口地胃内施与日本的健常者志愿者(供体a~f)的粪便,制成人菌群化小鼠(a~f),评价粪便中的胰蛋白酶活性。
其结果如图3所示,除了b,小鼠粪便中的胰蛋白酶活性为与理研·spf小鼠的情况同等低的水准。由此判定,存在降低小鼠胰蛋白酶的活性的人来源的肠内细菌种。
(实施例2)
[健常者的粪便来源的35种菌株降低小鼠粪便中胰蛋白酶活性]
对于在前述的研究中显示特别低的胰蛋白酶活性的健常者志愿者c的粪便,进行降低盲肠以远的胰蛋白酶活性的细菌种的探索。对gf小鼠经口地胃内施与健常者志愿者c的粪便,从其24小时之后开始,通过自由饮水施与作为抗生素的氨苄青霉素(amp)、泰乐菌素(tylosin)、或甲硝唑(mnz)。
其结果如图4所示,在抗生素非施与组和氨苄青霉素施与组中,粪便中的胰蛋白酶活性与菌的施与前相比显著降低。另一方面,在泰乐菌素施与组和甲硝唑施与组中,粪便中的胰蛋白酶活性较高地维持。由以上结果判明,降低胰蛋白酶活性的肠内细菌种是对氨苄青霉素为耐性、对泰乐菌素和甲硝唑为感受性的菌种。
接着,将氨苄青霉素施与组中胰蛋白酶活性值降低程度最大的个体的盲肠内容物在厌氧腔室内在不同组成的培养基中培养,得到共计432个集落。基于16srrna分析的菌株比对的结果如图5所示,判明了来源于供体c粪便的人肠内细菌35种菌株。
由于所分离的35种菌株占构成供体c的粪便的肠道菌群的菌种的约80%,因而可以期待通过施与给gf小鼠,而形成与供体c的肠内类似的菌群和环境。于是,将该35种菌株分别培养并混合而得的菌液(以下、35-mix)经口地胃内施与gf小鼠,经时地评价盲肠以远的胰蛋白酶活性。
其结果如图6所示,在35-mix施与2天之后,粪便中的胰蛋白酶活性值有意义地降低。即使在施与第9天,粪便中的活性型胰蛋白酶的量也在低水准维持。由以上结果判断,如果施与35-mix,则小鼠的盲肠以远中的胰蛋白酶的活性降低。
[由健常者的粪便分离的9种菌株降低小鼠粪便中胰蛋白酶活性]
在前述的具有降低胰蛋白酶活性的功能的35种菌株中,进行承担其功能的责任菌的鉴定。具体地,在一边施与各种抗生素一边使健常者志愿者供体c的粪便来源的菌定植于gf小鼠的研究中,进行抗生素施与12天之后的基于16srrna分析的肠内细菌的相对占有率与粪便中胰蛋白酶活性值的斯皮尔曼(spearman)顺位相关分析。
其结果在图7所示的斯皮尔曼(spearman)顺位相关分析中与粪便中的胰蛋白酶活性显示负的相关的菌株中,特别着眼于相关系数的显著性概率p<0.05的9种菌株。接着,将该9种菌株分别培养并混合而得的菌液(以下、9-mix)经口地胃内施与gf小鼠,评价粪便中的胰蛋白酶的活性及其蛋白质的量。其结果如图8所示,在9-mix施与组中,粪便中的胰蛋白酶活性有意义地降低。另外虽未图示,但活性型胰蛋白酶的蛋白质的量减少到wb的检出限以下。由以上结果提示,责任菌包含在该9种菌株中。
[由健常者的粪便分离出的3种菌株降低小鼠粪便中胰蛋白酶活性]
前述的9种菌株如图9所示,可以分类为包含拟杆菌属(bacteroides)的3种菌株的组和非拟杆菌属(bacteroides)的6种菌株。考虑在假设降低胰蛋白酶的活性的功能为系统性地保守的情况下,责任菌仅应包含在任一方的组中。于是,与上述研究同样地,对于施与了前者的拟杆菌属(bacteroides)的组(以下、3-mix施与组)和施与了后者的非拟杆菌属(bacteroides)的组(以下、6-mix施与组)进行评价。
其结果如图8所示,在3-mix施与组中,粪便中的胰蛋白酶活性有意义地降低,在6-mix施与组中不减少。由以上结果提示,责任菌包含在上述3种菌株中。
[由健常者的粪便分离出的paraprevotellaclara降低小鼠胰蛋白酶的量]
以责任菌的进一步锁定作为目的,在体外(invitro)使胰蛋白酶与单独培养的菌共存,评价胰蛋白酶的蛋白质的量的变化。
首先,在厌氧腔室内中,将his-tag修饰的重组小鼠胰蛋白酶、与上述认定为责任菌的候选的9-mix、6-mix或3-mix共培养,评价12小时之后的培养液中的胰蛋白酶的蛋白质的量。
其结果虽未图示,但在与9-mix或3-mix的共培养中,确认了胰蛋白酶的减少,在与6-mix的共培养中则未确认。该结果与上述的体内(invivo)的责任菌的锁定研究的结果一致。即,认为该体外(invitro)的评价法对责任菌的进一步锁定是有效的。此外,该体外(invitro)的评价的结果与上述的体内(invivo)的评价的结果一致提示,在胰蛋白酶活性的降低的机制中,宿主的大肠组织不参与,仅细菌参与。
接着,将构成9-mix的各菌以每个单菌与胰蛋白酶共培养,同样地进行评价。其结果如图10所示,仅在与构成3-mix的p.clara1c4株共培养的情况下,确认了胰蛋白酶的蛋白质的量减少。
由一系列的评价结果判断,来源于供体c的粪便的p.clara1c4株是使小鼠的胰蛋白酶的蛋白质的量减少的责任菌。
[paraprevotellaclara减少人的胰蛋白酶的蛋白质的量]
如前所述,体外(invitro)证实了由健常者的粪便分离出的p.clara1c4株减少小鼠的活性型胰蛋白酶的量。接着,将前述的体外(invitro)实验体系应用于人的胰蛋白酶,验证其功能的有效性。即,在厌氧腔室内,将单独培养的p.clara1c4株与重组人胰蛋白酶共培养,通过wb评价12小时之后的胰蛋白酶量。其结果虽未图示,但仅在与p.clara1c4株共培养的情况下,确认了人胰蛋白酶的蛋白质的量的减少。由以上结果判明了,由健常者的粪便分离出的p.clara1c4株减少人的胰蛋白酶的蛋白质的量。
(实施例3)
[通过施与降低胰蛋白酶活性的细菌混合液(cocktail)而大肠组织的炎症被抑制]
使用大肠炎模型小鼠,研究所鉴定的所述3种菌株(3-mix)的炎症的缓和的可能性。大肠炎模型小鼠选择了il10-/-肠炎发病模型和dss诱导模型。对于前者,应用将il10-/-小鼠个体无菌化,然后感染由uc患者的粪便中分离的作为肠炎诱导菌的产气肠杆菌(enterobacteraerogenes)11e12株而得的模型。
将降低胰蛋白酶活性的3-mix、或不参与胰蛋白酶活性的6-mix经口地胃内施与il10-/-gf小鼠,在其7天之后同样地施与产气肠杆菌(enterobacteraerogenes)11e12株单菌的培养液而诱导大肠炎。评价直到施与3周之后的粪便中的胰蛋白酶活性。另外,通过粪便中的脂质运载蛋白浓度、和基于大肠的组织学的观察的炎症得分来评价直到施与3周之后诱导的炎症的程度。
其结果如图11所示,在11e12株施与组、以及11e12株和6-mix施与组中确认了粪便中的高胰蛋白酶活性,与此相对,在11e12株和3-mix施与组中胰蛋白酶活性被抑制得较低。另外,如图12所示,在3-mix施与组中,与6-mix施与组相比,处于粪便中脂质运载蛋白浓度低的倾向。进而,虽未图示,但组织学的炎症得分也有意义地低。
对dss诱导模型小鼠实施同样的研究。对gf小鼠施与3-mix或6-mix,从其14天之后开始,通过自由饮水而施与2.0%dss水溶液7天,诱导了大肠炎。通过体重的变动、基于大肠的组织学的观察的炎症得分、和炎症标志物的表达量来评价直到dss施与10天之后诱导的炎症的程度。其结果是,与6-mix施与组相比,在3-mix施与组中,体重减少的比例低。另外,以tnf-α和il6为代表的各炎症标志物基因的表达量也有意义地低。
由以上的研究结果判断,如果施与3-mix,则大肠组织的炎症被抑制。
(实施例4)
[帕拉普氏菌属(paraprevotella)降低胰蛋白酶活性]
评价在p.clara1c4株中确认的降低胰蛋白酶活性的功能在亲缘菌株中的保守性。
对于从理化学研究所生物资源研究中心(rikenbrc)微生物材料开发室获得的p.clarajcm14859株、和相当于2018年11月时刻的系统树分类中属于帕拉普氏菌属(paraprevotella)的2种中的另一方的paraprevotellaxylaniphila(p.xylaniphila)jcm14860株,验证体外(invitro)的胰蛋白酶活性的降低能力。将来源于小鼠的盲肠内容物的胰蛋白酶溶液与各菌的培养液混合,在厌氧条件下孵育12小时,然后通过wb评价活性型胰蛋白酶的蛋白质的量。
其结果如图13所示,在与任何paraprevotella株混合的情况下,胰蛋白酶的蛋白质的量都为wb的检出限以下。
由以上的结果判断,2018年11月时刻的系统树分类中被分类为帕拉普氏菌属(paraprevotella)的菌种全部降低小鼠来源的活性型胰蛋白酶的量。
(实施例5)
[交联试验]
如图14所示的,将mprss2与p.clara菌混合,仅在用dsso形成交联的情况下,在250kda附近检测到条带。这由于不包含mprss2、在形成交联时没有确认到,所以推定为由mprss2与p.clara菌的构成蛋白质组成的复合蛋白质。如果鉴于mprss2为约32kda的蛋白质,则考虑相对于构成p.clara菌的有220kda左右的蛋白质,胰蛋白酶优先地吸附或结合。
通过该结果考虑,胰蛋白酶蛋白质的分解现象针对帕拉普氏菌属(paraprevotella)菌所保有的特定的蛋白质,在伴有胰蛋白酶结合的现象的同时被诱导。
[胰蛋白酶活性抑制试验]
如图15所示,在将未修饰lck抑制剂的hprss2与帕拉普氏菌属(paraprevotella)菌混合的情况下,hprss2来源的条带变薄,hprss2的分解被诱导。另一方面,在修饰tlck而丧失胰蛋白酶活性的tlck-hprss2的情况下,hprss2的分解不被诱导。鉴于tlck是基于不可逆结合的胰蛋白酶活性抑制剂,则认为由帕拉普氏菌属(paraprevotella)菌产生胰蛋白酶的分解是通过胰蛋白酶的自身分解的促进而实现的。
由以上的[交联试验]和[胰蛋白酶活性抑制试验]的结果可以认为,由帕拉普氏菌属(paraprevotella)菌产生的胰蛋白酶的分解基于胰蛋白酶的自身分解的促进效果,通过胰蛋白酶蛋白质与菌的特定的蛋白质结合而被诱导。
产业可利用性
如以上说明的那样,根据本发明,能够抑制胰蛋白酶活性。因此,在由胰蛋白酶活性引起的疾病(溃疡性大肠炎、克罗恩病等炎症性肠疾病)的治疗和预防等中是有用的。
保藏号
(1)识别标志:1c4
(2)保藏号:nitebp-02775
(3)保藏日:2018年8月30日
(4)保藏机构:国家技术评估学会
(1)识别标志:1d4
(2)保藏号:nitebp-02776
(3)保藏日:2018年8月30日
(4)保藏机构:国家技术评估学会
(1)识别标志:3h3
(2)保藏号:nitebp-02777
(3)保藏日:2018年8月30日
(4)保藏机构:国家技术评估学会
- 还没有人留言评论。精彩留言会获得点赞!