造血干细胞的扩增的制作方法
1.本公开内容涉及用于人类造血干细胞(hsc)扩增的方法和组合物。本公开还涉及包括使用扩增的hsc的治疗方法。
背景技术:
2.造血干细胞(hsc)具有独特的自我更新能力并在血液和免疫系统中产生各种类型的成熟细胞。这些特点为hsc移植提供了广泛的临床应用,尽管hsc的主要来源(人骨髓、动员的外周血和脐带血)作为供体供应仍然有限。这些问题由于需要寻找与受体匹配良好的供体而复杂化,从而增加了确保供体材料的适当和可靠供应的复杂性。此外,患有由基因突变引起的疾病的患者将极大地受益于基因疗法技术,其中自体材料经离体操纵,并且在校正基因缺陷之后被返回。在各种类型的移植类别中,开发hsc离体扩增和基因操作的有效技术可以在现有的供体基础设施之外提供现成的可再生来源,并建立新的基因疗法技术来治疗基因突变引起的疾病。
3.与胚胎干细胞(esc)的情况不同,培养中hsc的扩增通常以原代表型或“干细胞性质”的丧失为代价。目前尚不清楚是否可以应用外源性因素来增强hsc群体的扩增而不丧失“干细胞性质”。因此,仍然需要生成和扩增大量人hsc的方法,以增加作为可再生治疗性来源的移植细胞的可用性。发明概述
4.申请人已开发出从任何来源(包括成人、脐带血、ips细胞、胎儿或胚胎来源)衍生的造血细胞起始群体扩增hsc的方法。在一个实施方案中,该方法优先在造血细胞起始群体中扩增原代hsc。原代hsc具有表型cd34+、cd45ra
‑
、cd90+、cd49f+。
5.以这种方式扩增hsc的能力对于血液学和肿瘤学疾病和病症的移植和其他疗法是有利的。如本文方法中所述,hsc数量可以离体显著增加。一种增加干细胞数量的方法对于经常缺乏足够干细胞的自体供体移植物是有用的。一种增加干细胞数量的方法也使脐带血可用于成人患者,从而扩大了同种异体移植的应用。
6.因此,本公开内容提供了一种扩增造血干细胞的方法,所述方法包括:在间充质谱系前体或干细胞(mlpsc)和至少一种组蛋白去乙酰化酶抑制剂(hdaci)存在下培养造血细胞群体,使得具有表型cd34+的造血干细胞得到扩增。
7.在一个实例中,扩增具有表型cd34+、cd90+的造血干细胞。在另一实施方案中,扩增具有表型cd34+、cd90+、cd45ra
‑
的造血干细胞;在另一实施方案中,扩增具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的造血干细胞;在另一实施方案中,与cd34+、cd49f
‑
的造血干细胞相比,优先扩增cd34+、cd45ra
‑
、cd90+、cd49f+的造血干细胞。
8.在一个实施方案中,cd34+细胞数量增加至少20倍,或至少30倍,或至少40倍,或至少5倍,或至少60倍,或至少70倍或至少80倍或至少90倍或至少100倍表明hsc扩增。
9.在一个实施方案中,起始细胞群培养足以达到cd34+细胞的绝对数量为至少105、106、107、108或109个细胞的时间。
10.在一个实施方案中,当与起始造血细胞群体相比时,cd34+、cd45ra
‑
、cd90+、cd49f+造血干细胞的总数增加至少2倍、或至少5倍、或至少10倍、或至少20倍、或至少30倍、或至少40倍、或至少44倍、或至少50倍。
11.在另一实施方案中,当与起始造血细胞群体相比较时,培养后的总细胞群体中cd34+、cd45ra
‑
、cd90+、cd49f+造血干细胞的百分比为至少1%、或至少1.5%、或至少2%,或至少5%或更高。
12.在一个实施方案中,起始共培养群体包含约3亿、或约4亿、或约5亿或更多个mlpsc。
13.在一个实施方案中,起始共培养群体包含约3000万、或约4000万或约5000万或更多个cd34+细胞。
14.在一个实施方案中,起始共培养群体包含约150万、或约200万、或约250万或更多个cd34+、cd45ra
‑
、cd90+、cd49f+细胞。
15.在一个实施方案中,hdaci选自由丙戊酸(vpa)、曲古抑菌素(tsa)、dls3、ms275、saha和hdac6抑制剂l61组成的组。
16.在一个实施方案中,造血细胞也在选自由以下项目组成的组的一种或多种生长因子的存在下培养:s(scf)、gm
‑
scf、m
‑
csf、g
‑
csf、mgdf、epo、flt3
‑
配体、il
‑
1、il
‑
2、il
‑
3、il
‑
4、il
‑
6、il
‑
7、il
‑
11、tnfα或血小板生成素。
17.在另一实施方案中,造血细胞也在一种或多种干细胞更新剂存在下培养。干细胞更新剂可以是例如sr1或um171。
18.在另一个实施方案中,通过免疫选择分离mlpsc。例如,mlpsc可以是stro
‑
1+间充质前体细胞或其培养扩增后代。在另一实施方案中,间充质谱系前体或干细胞是间充质干细胞或其培养扩增后代。
19.应理解,造血细胞群体可衍生自任何来源,包括骨髓、脐带或脐带血、外周血、肝、胸腺、淋巴、脾或ips细胞。
20.在一个实施方案中,将造血细胞添加到已建立的粘附性mlpsc细胞培养物中。mlpsc可被培养至汇合、再铺板和再培养,以提供饲养层,将造血细胞添加到其中进行共培养。
21.细胞共培养约2天、或3天、或4天、或5天、或6天、或7天或8天或9天或10天或12天或15天或20天或更长的时间。
22.本文描述的培养条件使mlpsc和hsc之间能够接触,从而促进遗传有效载荷(例如异源核酸或crispr系统)从mlpsc转移到hsc。
23.因此,在一个实施方案中,mlpsc包含在培养扩增期间转移到具有表型cd34+的造血干细胞的异源核酸分子。在一个实施方案中,mlpsc包含在培养扩增期间转移到具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的造血干细胞的异源核酸分子。
24.在另一实施方案中,在培养扩增后通过免疫选择分离cd34+、cd45ra
‑
、cd90+、cd49f+细胞,以提供cd34+、cd45ra
‑
、cd90+、cd49f+细胞的富集群体。该细胞群体可用于施用给受试者后的长期更新。
25.在另一实施方案中,在培养扩增后通过免疫选择移除cd34+、cd45ra
‑
、cd90+、cd49f+细胞,以提供cd34+、cd49f
‑
细胞的富集群体。该细胞群体可用于在施用给受试者后
早期中性粒细胞/血小板恢复。
26.在一个实施方案中,cd34+、cd45ra
‑
、cd90+、cd49f+细胞的富集群体经过基因操作,例如通过使用异源核酸转染的基因操作。
27.在一个实施方案中,cd34+、cd49f
‑
细胞的富集群体经过基因操作,例如通过使用异源核酸转染的基因操作。
28.异源核酸可以以表达载体的形式存在。合适的表达载体包括但不限于质粒、噬菌体、自主复制序列(ars)、病毒、着丝粒和人工染色体结构。在一个实例中,表达载体是选自由慢病毒、杆状病毒、逆转录病毒、腺病毒(adv)、腺相关病毒(aav)及其重组形式组成的组的病毒载体。
29.在另一个实施方案中,异源核酸编码选自由凝血因子、激素或细胞因子组成的组的蛋白质。
30.在另一实施方案中,异源核酸包含crispr系统或其组分。例如,crispr系统可包含cas表达载体和对hsc中的内源基因具有特异性的指导核酸序列。例如,crispr系统可包含与对hsc中的内源基因具有特异性的指导核酸序列复合的cas9蛋白。
31.在另一实施方案中,表达载体或crispr系统包含诱导型启动子。
32.在另一个实施方案中,该方法包括将hsc暴露于激活诱导型启动子的试剂中。
33.本公开内容还提供了一种包含通过根据本公开内容的方法获得的hsc的组合物。在一个实施方案中,通过根据本公开内容的方法获得的组合物包含具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的hsc。
34.本公开内容还提供一种组合物,其包含具有以至少1:35、或至少1:30、或至少1:20、或至少1:10、或至少1:5、或至少1:4.5、或至少1:4的各自比例的具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的hsc和mlpsc。
35.本发明还提供一种组合物,其包含具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的hsc和mlpsc,其中具有表型cd34+、cd45ra
‑
cd90+、cd49f+的细胞构成总细胞群体的至少10%或至少20%。
36.在一个实施方案中,组合物还包含hdaci。
37.本发明还提供一种组合物,其包含具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的造血干细胞、mlpsc和hdaci抑制剂。
38.在组合物的一个实施方案中,hsc包含异源核酸分子。
39.在另一个实施方案中,异源核酸编码选自由凝血因子、激素或细胞因子组成的组的蛋白质。
40.在另一实施方案中,异源核酸包含crispr系统或其组分。例如,crispr系统可包含cas表达载体和对hsc中的内源基因具有特异性的指导核酸序列。例如,crispr系统可包含与对hsc中的内源基因具有特异性的指导核酸序列复合的cas9蛋白。
41.在一个实施方案中,具有表型cd34+、cd45ra
‑
、cd90+、cd49f+的hsc构成组合物中细胞总数的至少5%、或至少10%、或至少20%或至少30%。
42.在另一个实施方案中,组合物包含至少105个细胞、至少106个细胞、至少107个细胞、至少108个细胞或至少109个细胞的细胞总数。
43.本公开内容还提供了一种转染hsc的方法,所述方法包括:
在间充质谱系前体或干细胞(mlpsc)和至少一种组蛋白去乙酰化酶抑制剂(hdaci)存在下培养hsc群体,其中mlpsc包含至少一种异源核酸分子,并且其中培养条件允许异源核酸分子从mlpsc转移到hsc。
44.在一个实施方案中,hsc具有表型cd34+。在另一实施方案中,hsc具有表型cd34+、cd45ra
‑
、cd90+、cd49f+。
45.异源核酸可以以表达载体的形式存在。合适的表达载体包括但不限于质粒、噬菌体、自主复制序列(ars)、病毒、着丝粒和人工染色体结构。在一个实例中,表达载体是选自由慢病毒、杆状病毒、逆转录病毒、腺病毒(adv)、腺相关病毒(aav)及其重组形式组成的组的病毒载体。
46.在另一个实施方案中,异源核酸编码选自由凝血因子、激素或细胞因子组成的组的蛋白质。
47.在另一实施方案中,异源核酸包含crispr系统或其组分。例如,crispr系统可包含cas表达载体和对hsc中的内源基因具有特异性的指导核酸序列。例如,crispr系统可包含与对hsc中的内源基因具有特异性的指导核酸序列复合的cas9蛋白。
48.在另一实施方案中,表达载体或crispr系统包含诱导型启动子。
49.在另一个实施方案中,该方法包括将hsc暴露于激活诱导型启动子的试剂。
50.本公开内容还提供了一种组合物,其包含已根据上述方法转染的hsc。
51.本公开内容还提供了一种治疗有此需要的受试者中血液学病症的方法,其包括向受试者施用本公开内容的组合物。
52.如全文所使用的,受试者是指个体。因此,受试者包括例如家养动物,例如猫和狗、牲畜(例如牛、马、猪、绵羊和山羊)、实验动物(例如小鼠、兔子、大鼠和豚鼠)、哺乳动物、非人哺乳动物、灵长类动物、非人灵长类动物、啮齿动物、鸟类、爬行动物、两栖动物、鱼类和任何其他动物。受试者任选地是哺乳动物,例如灵长类动物或人。
53.在一个实施方案中,受试者是人。人可以是成人或儿童患者。
54.应当理解,本公开内容的方法和组合物可用于治疗一系列血液学病症。
55.例如,本公开内容的方法和组合物可用于治疗血小板数量和/或功能的病症,例如血小板减少症,特发性血小板减少性紫癜(itp),或者与病毒感染、药物滥用或恶性肿瘤相关的病症。
56.在另一个实例中,本公开内容的方法和组合物可用于治疗红细胞数量和/或功能的病症,例如贫血。可治疗的贫血的实例包括再生障碍性贫血、自身免疫性溶血性贫血、失血性贫血、库利氏贫血、diamond
‑
blackfan贫血、范可尼贫血(fanconi anaemia)、叶酸盐(叶酸)缺乏性贫血、溶血性贫血、缺铁性贫血、恶性贫血、镰状细胞贫血、地中海贫血或真性红细胞增多症(polycythemia vera)。
57.在一个实例中,本公开内容的方法和组合物用于治疗α或β地中海贫血。
58.在另一个实例中,本公开内容的方法和组合物可用于治疗淋巴细胞数量和/或功能的病症,例如由t细胞或b细胞缺乏引起的病症。淋巴细胞数量和/或功能的病症的实例是aids,白血病,淋巴瘤,霍奇金淋巴瘤,慢性感染如粒性结核病(military tuberculosis),病毒感染,类风湿关节炎,系统性红斑狼疮,或遗传性疾病如无丙种球蛋白血症,digeorge
异常,wiskott
‑
aldrich综合征,或共济失调毛细血管扩张。
59.在另一个实例中,本公开内容的方法和组合物可用于治疗多系骨髓衰竭的病症,这可以是放疗或化疗或恶性置换的结果。例如,病症可以是骨髓纤维化、急性髓细胞白血病(aml)、骨髓增生异常综合征(mds)、急性淋巴细胞白血病(all)、铬粒细胞白血病(cml)、慢性淋巴细胞白血病(cll)、非霍奇金淋巴瘤(nhl)、霍奇金病(hd)、多发性骨髓瘤(mm)或者扩散到骨头的继发性恶性肿瘤。
60.在另一个实例中,本公开内容的方法和组合物可用于治疗先天性代谢错误。例如,先天性代谢错误可选自由黏多糖贮积症、戈谢病、异染性脑白质营养不良(metachromatic leukodystrophies)和肾上腺脑白质营养不良组成的组。
61.本发明适用于广泛的动物。例如,受试者可以是哺乳动物,例如人、狗、猫、马、牛或羊。在一个实施方案中,受试者是人。
62.在另一个实施方案中,本公开内容的方法还包括施用免疫抑制剂。免疫抑制剂可以施用足以使移植的造血细胞发挥功能的时间。免疫抑制剂可选自以下一种或多种,包括但不限于皮质类固醇,例如强的松、布地奈德和强的松龙;钙调神经磷酸酶抑制剂,例如环孢素和他克莫司;mtor抑制剂,例如西罗莫司和依维莫司;imdh抑制剂,例如硫唑嘌呤、来氟米特和霉酚酸酯;生物制剂,例如阿巴西普、阿达木单抗、依那西普、英夫利昔单抗或利妥昔单抗。
63.在一个实例中,免疫抑制剂是环孢霉素。环孢霉素可以以5至40mg/kg体重的剂量施用。
附图说明
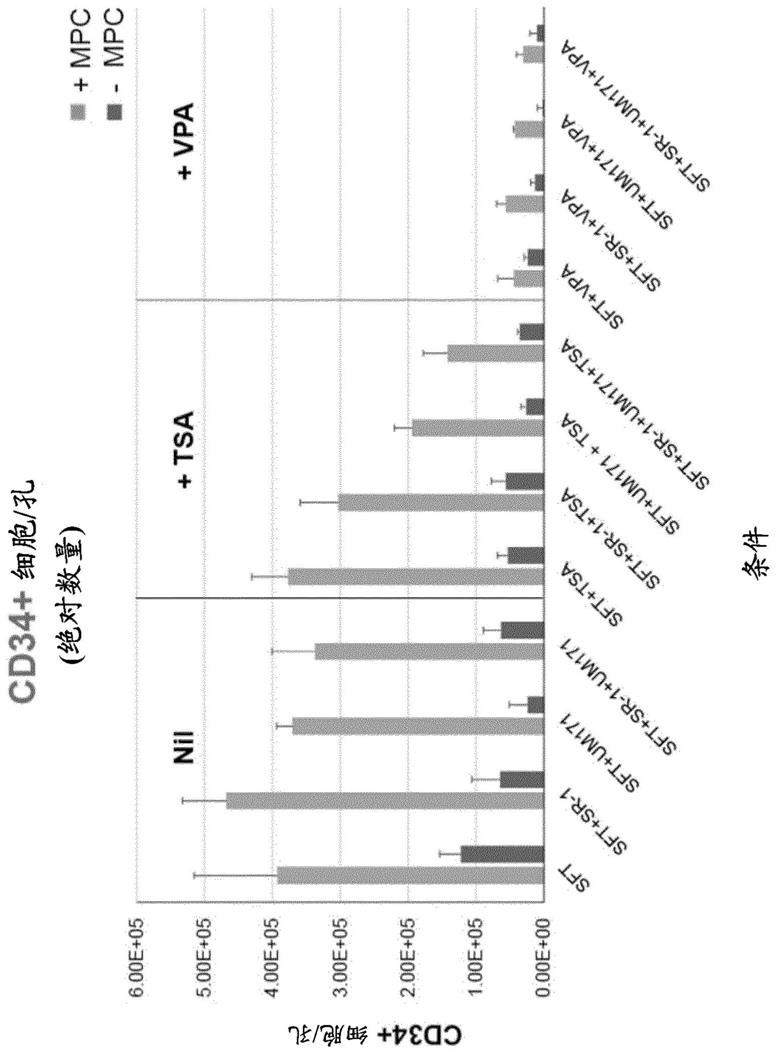
64.图1:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养5天后,每孔cd34+细胞的绝对数量。
65.图2:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养5天后,每孔cd34+cd90+细胞的百分比。
66.图3:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养5天后,每孔cd34+cd90+细胞的绝对数量。
67.图4:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养5天后,每孔显示原代hsc表型(cd34+cd90cd49f+)的细胞的绝对数量。
68.图5:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,每孔cd34+细胞的百分比。
69.图6:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,每孔cd34+细胞的绝对数量。
70.图7:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,每孔cd34+cd45ra
‑
cd90+细胞的百分比。
71.图8:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,每孔cd34+cd45ra
‑
cd90+细胞的绝对数量。
72.图9:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,每孔显示原代hsc表型(cd34+cd90cd49f+)的细胞的绝对数量。
73.图10:在(i)无hdaci;(ii)tsa或(iii)vpa以及存在或不存在mpc的情况下培养10天后,流式细胞术分析每孔显示原代hsc表型(cd34+cd90cd49f+)的细胞。
74.图11:将通过facs分离的cd34+cd38
‑
cd45ra
‑
cd90+cd49f+细胞培养在methoculttm h4435enriched(stem cell technologies)中,并在培养第14天测试集落形成率。总的集落形成率为0.42%。实施方案的描述一般技术和定义
75.在本说明书中,除非另有特别说明或上下文另有要求,否则对单个步骤、物质组合物、步骤组或物质组合物组的引用应包括这些步骤、物质组合物、步骤组或物质组合物组中的一个和复数个(即一个或多个)。
76.本领域技术人员将认识到,本文所述的公开内容易受除具体描述的内容之外的变化和修改的影响。应当理解,本公开内容包括所有这些变化和修改。本公开内容还包括本说明书中单独或共同提及或指示的所有步骤、特征、组合物和化合物,以及所述步骤或特征的任何和所有组合或者任何两个或更多个。
77.本公开内容不限于本文所述具体实施方案的范围,这些实施方案仅用于举例说明。功能等同的产品、组合物和方法显然在本公开内容的范围内。
78.除非另有特别说明,否则本文公开的任何实例应比照任何其他实例而应用。
79.除非另外明确定义,否则本文使用的所有技术和科学术语应被视为具有如本领域(例如,细胞培养、分子遗传学、干细胞分化、免疫学、免疫组织化学、蛋白质化学和生物化学)普通技术人员通常所理解的相同含义。
80.除非另有说明,否则本公开内容中所使用的干细胞、细胞培养和外科技术是本领域技术人员公知的标准程序。此类技术描述和解释于贯穿诸如以下来源的文献中:例如perbal,1984;sambrook&green,2012;brown,1991;glover&hames,1995和1996;ausubel.,1987(包括至今为止的所有更新);harlow&lane,1988;以及coligan等人,1991(包括至今为止的所有更新)。
81.如在本说明书和所附权利要求书中所使用的,单个和单数形式的术语“一种”、“一个”和“该”,例如,可选地包括复数指代,除非内容另有明确说明。
82.本文中使用的术语“受试者”是指哺乳动物,包括人和非人动物。更具体地说,哺乳动物是人。诸如“受试者”、“患者”或“个体”之类的术语是在上下文中可以在本公开内容中互换使用的术语。在某些实例中,受试者可以是成人或儿童(儿科)受试者。
[0083]“有效量”是指在所需的剂量和时间段内有效达到预期的治疗或预防结果的至少一个量。可在一次或多次施用中提供有效量。在本公开内容的一些实例中,术语“有效量”用于指如上文所述的疾病或病况的有效治疗所必需的量。有效量可根据待治疗的疾病或病况以及还根据体重、年龄、种族背景、性别、健康和/或身体状况以及与待治疗哺乳动物相关的其他因素而变化。通常,有效量将落在相对宽的范围内(例如“剂量”范围),该范围可由医疗从业者通过常规试验和实验来确定。有效量可单剂量施用或在治疗期内重复一次或多次的剂量施用。
[0084]
如本文所用,术语“治疗”是指旨在改变在临床病理过程中被治疗的个体或细胞的自然过程的临床干预。治疗的理想效果包括降低疾病进展速度、缓解或缓和疾病状态、以及
疾病减轻或改善预后。例如,如果与疾病相关的一个或多个症状得到减轻或消除,则个体得以成功地“治疗”。
[0085]“造血干细胞移植(hsct)”是包含多能(multipotent)造血干细胞组成的移植物,所述造血干细胞可衍生自例如骨髓或外周血。移植物可包括一些非干细胞,例如,包括dc和/或淋巴细胞的apc。
[0086]
本文中使用的术语“成人”是指18岁及以上的人受试者。
[0087]
此处使用的术语“儿科”是指年龄从出生到17岁(含17岁)的人受试者。
[0088]
本文中使用的术语“移植物”是指选自骨髓、血液(例如全血或外周血单个核细胞(pbmc))、血液制品或其中存在造血细胞的实体器官的生物样品。
[0089]
本文中使用的术语“同种异体的”是指由遗传特征不同于受体的个体捐献的移植物(例如造血细胞),特别是关于在个体细胞表面表达的主要组织相容性复合物(mhc)和次要组织相容性因子方面不同。
[0090]
本文中使用的术语“自体的”是指使用受试者自身细胞的移植物(例如骨髓或外周血中的造血细胞)。通常在受试者接受治疗(如化疗)之前收获细胞,储存并再注入回该受试者体内。
[0091]
术语“和/或”,例如“x和/或y”,应被理解为是指“x和y”或“x或y”,并且应被视为明确地支持两种含义或任何一种含义。
[0092]
如本文所用,除非另有相反说明,术语“约”是指指定值的+/
‑
10%,更优选地+/
‑
5%。
[0093]
在整个说明书中,词语“包含”或其变型如“包括”或“含有”将被理解为暗示包括陈述的元素、整数或步骤,或者元素、整数或步骤的组,但不排除任何其它元素、整数或步骤,或者元素、整数或步骤的组。造血干细胞
[0094]
本文所使用的“造血干细胞”(hsc)是指具有自我更新和分化为更成熟的血细胞的能力的未成熟血细胞,所述更成熟的血细胞包括粒细胞(例如早幼粒细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如网织红细胞、红细胞)、血栓细胞(例如巨核细胞、血小板产生巨核细胞、血小板)和单核细胞(例如单核细胞、巨噬细胞)。
[0095]
本领域已知,此类细胞可以包括或不包括cd34+细胞。cd34+细胞是表达cd34细胞表面标志物的未成熟细胞。认为cd34+细胞包括具有上述干细胞特性的细胞亚群。本领域众所周知,hsc包括多能干细胞、专能干细胞(例如淋巴干细胞)和/或定型于特定造血谱系的干细胞。定型于特定造血谱系的干细胞可以是t细胞系、b细胞系、树突状细胞系、朗格汉斯细胞系和/或淋巴组织特异性巨噬细胞细胞系。
[0096]
能够长期更新和移植的人类hsc被认为是表型上“原代的”,表达cd34、cd49f和cd90。在一个实施方案中,原代细胞具有表型cd34+、cd45ra
‑
、cd90+、cd49f+。在一个实施方案中,它们还缺乏cd38和任何谱系限制性抗原的表达。在一个实施方案中,原代hsc定义为cd34+cd45ra
‑
cd49f+cd90+cd38
‑
lin
‑
细胞(lt
‑
hsc)。间充质谱系前体或干细胞
[0097]
如本文中所用,术语“间充质谱系前体或干细胞”是指未分化的多能细胞,其具有自我更新能力,同时保持多能性和分化成间充质起源(例如成骨细胞、软骨细胞、脂肪细胞、
基质细胞、成纤维细胞和肌腱)或非中胚层起源(例如肝细胞、神经细胞和上皮细胞)的多种细胞类型的能力。
[0098]
术语“间充质谱系前体或干细胞”包括亲本细胞及其未分化后代。该术语还包括间充质前体细胞(mpc)、多能基质细胞、间充质干细胞、血管周围间充质前体细胞及其未分化后代。
[0099]
间充质谱系前体或干细胞可以是自体的、同种异体的、异种的、同系的或同基因的。自体细胞是从将被再植入这些细胞的同一个体分离获得。同种异体细胞是从同一物种的供体分离获得。异种细胞从另一物种的供体分离获得。同系或同基因细胞从基因相同的生物体(如双胞胎、克隆或高度近交的研究动物模型)分离获得。
[0100]
间充质谱系前体或干细胞主要存在于骨髓中,但也被发现存在于多种宿主组织(包括例如,脐带血和脐带、成人外周血、脂肪组织、小梁骨和牙髓)中。
[0101]
可以从宿主组织中分离间充质谱系前体或干细胞并通过免疫选择进行富集。例如,可以用针对stro
‑
1或tnap的抗体进一步处理来自受试者的骨髓抽吸物,以使得能够选择间充质谱系前体或干细胞。在一个实例中,可通过使用simmons&torok
‑
storb,1991中所述的stro
‑
1抗体来富集间充质谱系前体或干细胞。
[0102]
stro
‑
1+细胞是发现于骨髓、血液、牙髓细胞、脂肪组织、皮肤、脾、胰腺、脑、肾、肝、心脏、视网膜、脑、毛囊、肠、肺、淋巴结、胸腺、骨、韧带、肌腱、骨骼肌、真皮和骨膜中的细胞;并且能够分化成种系如中胚层和/或内胚层和/或外胚层。因此,stro
‑
1+细胞能够分化成多种细胞类型,包括但不限于脂肪、骨、软骨、弹性、肌肉和纤维结缔组织。这些细胞所进入的具体谱系定型(lineage
‑
commitment)和分化途径取决于由机械影响和/或内源性生物活性因子(例如生长因子、细胞因子和/或由宿主组织建立的局部微环境条件)产生的各种影响。
[0103]
如本文所使用的术语“富集的”描述了这样的细胞群体,该细胞群体中的一种特定细胞类型的比例或多种特定细胞类型的比例相较于未处理的细胞群体(例如,处于其天然环境中的细胞)是增加的。在一个实例中,富集stro
‑
1+细胞的群体包含至少约0.1或0.5%或1%或2%或5%或10%或15%或20%或25%或30%或50%或75%的stro
‑
1+细胞。在这方面,术语“富集stro
‑
1+细胞的细胞群体”将被视为提供对术语“包含x%stro
‑
1+细胞的细胞群体”的明确支持,其中x%是本文所列举的百分比。在一些实例中,stro
‑
1+细胞可以形成克隆源性集落,例如cfu
‑
f(成纤维细胞)或者其子集(例如,50%或60%或70%或70%或90%或95%)可以具有这种活性。
[0104]
在一个实例中,从包含可选择形式的stro
‑
1+细胞的细胞制备物中富集细胞群体。在这方面,术语“可选择形式”将被理解为意指细胞表达允许选择stro
‑
1+细胞的标志物(例如,细胞表面标志物)。标志物可以是stro
‑
1,但并不一定。例如,如本文描述和/或示例的,表达stro
‑
2和/或stro
‑
3(tnap)和/或stro
‑
4和/或vcam
‑
1和/或cd146和/或3g5的细胞(例如,mpc)也表达stro
‑
1(并且可以是stro
‑1亮
)。因此,细胞是stro
‑
1+的指示并不意味着细胞是通过stro
‑
1表达来选择。在一个实例中,基于至少stro
‑
3表达来选择细胞,例如它们是stro
‑
3+(tnap+)。
[0105]
提及选择细胞或其群体不一定需要从特定组织来源进行选择。如本文所述,可以从多种来源选择或分离或富集stro
‑
1+细胞。也就是说,在一些实例中,这些术语支持从包含stro
‑
1+细胞的任何组织或血管化组织或包含周细胞(例如,stro
‑
1+周细胞)的组织或本
文所列举的任何一种或多种组织进行选择。
[0106]
在一个实例中,本公开内容中的间充质谱系前体或干细胞表达单独或共同地选自由tnap+、vcam
‑
1+、thy
‑
1+、stro
‑
2+、stro
‑
4+(hsp
‑
90β)、cd45+、cd 146+、3g5+组成的组的一种或多种标志物。
[0107]“单独地”意指本公开内容分别地包含所列举的标志物或标志物组,并且尽管个别标志物或标志物组可能未在本文中单独列出,但所附权利要求可以分别地和彼此分开地限定这些标志物或标志物组。
[0108]“共同地”意指本公开内容包含任何数量或组合的所列举的标志物或标志物组,并且尽管这些数量或组合的标志物或标志物组可能未在本文中明确列出,但所附权利要求可以将这些组合或子组合与标志物或标志物组的任何其它组合分别地和彼此分开地限定。
[0109]
被称为给定标志物“阳性”的细胞可以根据标志物存在于细胞表面上的程度表达低等(lo或dim或dull)、中等(中)或高等(亮,bri)水平的该标志物,其中所述术语与荧光强度或细胞分选过程中使用的其它标志物或细胞的流式细胞分析有关。在被分选或分析的特定细胞群体上使用的标志物的上下文中将理解低等(lo或dim或dull)、中等(中)或高等(亮,bri)的区别。被称为给定标志物“阴性”的细胞不一定完全不存在于该细胞中。该术语意指该细胞以相对很低的水平表达标志物,并且其在被可检测地标记时产生非常低的信号或在背景水平(例如使用同种型对照抗体检测的水平)之上检测不到。
[0110]
本文所用的术语“亮”或“bri”是指细胞表面上的标志物在被可检测地标记时产生相对高的信号。虽然不希望受理论限制,但提出了“亮”细胞比样品中的其它细胞表达更多的靶标志物蛋白(例如被stro
‑
1抗体所识别的抗原)。例如,与非亮细胞(stro
‑1lo/dim/dull/中/中等
)相比,通过荧光活化细胞分选(facs)分析测得,stro
‑1bri
细胞在用fitc缀合的stro
‑
1抗体标记时产生更强的荧光信号。在一个实例中,间充质谱系前体或干细胞分离自骨髓并且通过选择stro
‑
1+细胞来富集。在该实例中,“亮”细胞构成起始样品中包含的最明亮标记的骨髓单核细胞的至少约0.1%。在其它实例中,“亮”细胞构成起始样品中含有的最明亮标记的骨髓单核细胞的至少约0.1%、至少约0.5%、至少约1%、至少约1.5%或至少约2%。在一个实例中,stro
‑1亮
细胞相对于“背景”(即stro
‑1‑
细胞)具有高2个对数级的stro
‑
1表面表达。相比之下,stro
‑1lo/dim/dull
和/或stro
‑1中/中等
细胞比“背景”具有高不到2个对数级的stro
‑
1表面表达,通常为约1个对数级或更少。
[0111]
在一个实例中,stro
‑
1+细胞是stro
‑1亮
。在一个实例中,相对于stro
‑1lo/dim/dull
或stro
‑1中/中等
细胞,stro
‑1亮
的细胞是优先富集的。
[0112]
在一个实例中,stro
‑1亮
细胞另外地是tnap+、vcam
‑
1+、thy
‑
1+、stro
‑
2+、stro
‑
4+(hsp
‑
90β)和/或cd146+中的一种或多种。例如,针对一种或多种前述标志物选择细胞和/或显示细胞表达一种或多种前述标志物。在这方面,显示为表达标志物的细胞不需要特别测试,而是对先前富集或分离的细胞进行测试并然后使用,可以合理地认为分离的或富集的细胞也表达相同的标志物。
[0113]
在一个实例中,stro
‑1亮
细胞是如wo 2004/85630中所定义的血管周间充质前体细胞,其特征在于存在血管周标志物3g5。
[0114]
如本文所用,术语“tnap”旨在包括组织非特异性碱性磷酸酶的所有同种型。例如,该术语包括肝同种型(lap)、骨同种型(bap)和肾同种型(kap)。在一个实例中,tnap是bap。
在一个实例中,tnap是指可以结合由根据布达佩斯条约的规定在2005年12月19日以保藏号pta
‑
7282保藏于atcc的杂交瘤细胞系产生的stro
‑
3抗体的分子。
[0115]
此外,在一个实例中,stro
‑
1+细胞能够产生克隆源性cfu
‑
f。
[0116]
在一个实例中,相当大比例的stro
‑
1+细胞能够分化成至少两种不同的种系。细胞可以向其定型的谱系的非限制性实例包括骨前体细胞;肝细胞祖细胞,其具有胆管上皮细胞和肝细胞的多能性;神经限制性细胞,其可以生成进展为少突胶质细胞和星形胶质细胞的神经胶质细胞前体;进展为神经元的神经元前体;心肌和心肌细胞的前体;分泌葡萄糖反应性胰岛素的胰腺β细胞系。其它谱系包括但不限于:成牙质细胞、牙本质产生细胞和软骨细胞,以及以下项目的前体细胞:视网膜色素上皮细胞、成纤维细胞、皮肤细胞如角化细胞、树突状细胞、毛囊细胞、肾管上皮细胞、平滑肌和骨骼肌细胞、睾丸祖细胞、血管内皮细胞、肌腱、韧带、软骨、脂肪细胞、成纤维细胞、骨髓基质、心肌、平滑肌、骨骼肌、周细胞、血管、上皮、神经胶质、神经元、星形胶质细胞和少突胶质细胞。
[0117]
在本公开的一个方面,间充质谱系前体或干细胞是间充质干细胞(msc)。msc可以是均质组合物,或者可以是富集msc的混合细胞群体。可以通过培养粘附的骨髓或骨膜细胞获得均质的msc细胞组合物,并且可以通过利用独特的单克隆抗体鉴定的特异性细胞表面标志物来识别msc。使用塑料粘附技术获得富集msc的细胞群体的方法描述于例如美国专利5486359中。通过常规塑料粘附分离制备的msc依赖于cfu
‑
f的非特异性塑料粘附特性。msc的替代来源包括但不限于血液、皮肤、脐带血、肌肉、脂肪、骨和软骨膜。
[0118]
使用前可以冷冻保存间充质谱系前体或干细胞。
[0119]
间质谱系前体或干细胞的冷冻保存可以使用本领域已知的慢速冷却方法或“快速”冷冻方案进行。优选地,与未冷冻的细胞相比,冷冻保存的方法保持相似的表型、细胞表面标志物和冷冻保存的细胞的生长速率。
[0120]
冷冻保存的组合物可以包含冷冻保存溶液。冷冻保存溶液的ph通常为6.5至8,优选地7.4。
[0121]
冷冻保存溶液可以包括无菌的、无热原的等渗溶液,例如,plasmalyte a
tm
。100ml的plasmalyte a
tm
含有526mg氯化钠,usp(nacl);502mg葡萄糖酸钠(c6h
11
nao7);368mg三水合乙酸钠,usp(c2h3nao2·
3h2o);37mg氯化钾,usp(kcl);和30mg氯化镁,usp(mgcl2·
6h2o)。它不包含抗微生物剂。用氢氧化钠调节ph。ph为7.4(6.5至8.0)。
[0122]
冷冻保存溶液可以包含profreeze
tm
。冷冻保存溶液可以另外地或替代地包含培养基。
[0123]
为了促进冷冻,通常将冷冻保护剂例如二甲基亚砜(dmso)添加到冷冻保存溶液中。理想地,冷冻保护剂对细胞和患者应该是无毒的,非抗原性的,化学惰性的,在解冻后可提供高存活率,并且无需清洗即可移植。但是,最常用的低温保护剂dmso显示一定的细胞毒性。羟乙基淀粉(hes)可用作替代品或与dmso组合使用,以降低冷冻保存溶液的细胞毒性。
[0124]
冷冻保存溶液可包含dmso、羟乙基淀粉、人血清组分和其他蛋白质填充剂(protein bulking agent)中的一种或多种。在一个实例中,冷冻保存的溶液包含约5%人血清白蛋白(hsa)和约10%dmso。冷冻保存溶液可以进一步包含甲基纤维素、聚乙烯吡咯烷酮(pvp)和海藻糖中的一种或多种。
[0125]
在一个实施方案中,将细胞悬浮于42.5%profreeze
tm
/50%αmem/7.5%dmso中并
technologies,温哥华,加拿大)、h3000成分确定的培养基(stemcell technologies,温哥华,加拿大)、scgm(cellgenix,弗莱堡,德国)、sfm(invitrogen)。
[0137]
培养基可包含有效量的一种或多种另外的因子,例如细胞因子。合适的因子包括胰岛素样生长因子(igf)、il
‑
1、il
‑
3、il
‑
6、il
‑
11、g
‑
csf、gm
‑
csf、scf、flt3
‑
l、血小板生成素(tpo)、促红细胞生成素及其类似物。如本文所用,“类似物”包括具有天然存在形式的生物学活性的细胞因子和生长因子的任何结构变体,包括但不限于当与天然存在形式或细胞因子受体激动剂例如针对tpo受体的激动剂抗体(例如,如专利公开wo 2007/145227中详述的vb22b sc(fv)2等)相比时,具有增强或降低的生物学活性的变体。选择细胞因子和生长因子组合以扩增hsc和祖细胞,同时限制终末分化细胞的产生。在一个具体的实施方案中,一种或多种细胞因子和生长因子选自由scf、flt3
‑
l和tpo组成的组。在一个具体的实施方案中,在适于hsc扩增的条件下,在无血清培养基中至少使用tpo。
[0138]
人il6或白细胞介素6,也称为b细胞刺激因子2,已经由(kishimoto,ann.review of 1mm.23:1 2005)描述,并且可以商购获得。已经描述了人scf或干细胞因子,也称为c
‑
kit配体,肥大细胞生长因子或steel因子(smith,m a等人,actahaematologica,105,3:143,2001),并且可以商购获得。flt3
‑
l或flt
‑
3配体(也称为fl)是与flt3受体结合的因子。已经对其进行了描述(hannum c,nature 368(6472):643
‑
8),并且可以商购获得。已经描述了tpo或血小板生成素,也称为巨核细胞生长因子(mgdf)或c
‑
mpl配体(kaushansky k(2006).n.engl.j.med.354(19):2034
‑
45),并且可以商购获得。组合物和施用
[0139]
可以在药学可接受载剂中制备包含hsc的组合物。如本文所用的术语“药学可接受载剂”是指促进间充质谱系前体或干细胞的存储、施用和/或维持其生物学活性的物质组合物。
[0140]
在一个实例中,载剂在受体中不产生显著的局部或全身性不利影响。药学可接受载剂可以是固体或液体。药学可接受载剂的有用实例包括但不限于稀释剂、溶剂、表面活性剂、赋形剂、助悬剂、缓冲剂、润滑剂、佐剂、媒介物、乳化剂、吸收剂、分散介质、包衣、稳定剂、保护性胶体、粘合剂、增稠剂、触变剂(thixotropic agent)、渗透剂、螯合剂、支架、等渗和吸收延迟剂,它们不会影响间充质谱系前体或干细胞的活力和活性。合适载体的选择在本领域技术人员的技术范围内。
[0141]
本公开内容的组合物可以方便地以单位剂型存在并且可以通过本领域公知的任何方法制备。如本文所用的术语“单位剂型”是指适合作为待治疗受试者的单位剂量的物理上离散的单位;每个单位包含预定量的活性化合物,该活性化合物经计算可与药物载剂结合产生所需的治疗或预防作用。间充质谱系前体或干细胞的剂量可以根据诸如待治疗的受试者的疾病状态、年龄、性别和体重的因素而变化。
[0142]
示例性剂量包括至少约1x106个细胞。例如,剂量可包含约1.0
×
106至约1
×
10
10
个细胞,例如约1.1
×
106至约1
×
109个细胞,例如约1.2
×
106至约1
×
108个细胞,例如约1.3x106至大约1x107个细胞,例如约1.4x106至约9x106个细胞,例如约1.5x106至约8x106个细胞,例如约1.6x106至约7x106个细胞,例如约1.7x106至约6x106个细胞,例如约1.8x106至
约5x106个细胞,例如约1.9x106至约4x106个细胞,例如约2x106至约3x106个细胞。
[0143]
在一个实例中,剂量包含约5x105至2x107个细胞,例如约6x106个细胞至约1.8x107个细胞。剂量可以是例如约6
×
106个细胞或约1.8
×
107个细胞。
[0144]
hsc占组合物的细胞群体的至少约5%,至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约55%,至少约60%,至少约65%,至少约70%,至少约75%,至少约80%,至少约85%,至少约90%或至少约95%。
[0145]
本公开内容的组合物可以通过适合于待治疗的特定疾病状态的途径施用。例如,本公开内容的组合物可以全身施用,即肠胃外、静脉内或通过注射施用。本公开内容的组合物可以靶向特定的组织或器官。
[0146]
可以调整剂量方案以提供最佳的治疗应答。例如,可以施用单次推注,可以随时间施用数个分开的剂量,或者可以根据治疗情况的紧急程度按比例减少或增加剂量。为了易于施用和剂量均匀,以单位剂型配制肠胃外组合物可能是有利的。
[0147]
在一些实施方案中,在开始用细胞组合物的疗法之前免疫抑制患者可能不是必需的或期望的。这可以通过使用全身或局部免疫抑制剂来实现,或者可以通过在封装的设备中递送细胞来实现。可以将细胞封装在胶囊中,该胶囊对于细胞所需的营养物和氧气以及治疗因子是可渗透的,而细胞对免疫体液因子和细胞是不可渗透的。优选地,封装剂是低变应原性的,容易且稳定地位于靶组织中,并为植入的结构提供额外的保护。用于减少或消除对移植细胞的免疫应答的这些和其他方式是本领域已知的。作为替代方案,可以对细胞进行基因修饰以降低其免疫原性。
[0148]
应当理解hsc可以与其他有益药物或生物分子(生长因子、营养因子)一起施用。当与其他试剂一起施用时,它们可以与其他试剂在单一药物组合物中施用或在单独的药物组合物中同时或顺序地施用(在其他试剂的施用之前或之后)。可以共同施用的生物活性因子包括抗凋亡剂(例如,epo、epo模拟体、tpo、igf
‑
i和igf
‑
ii、hgf、胱天蛋白酶抑制剂);抗炎剂(例如p38 mapk抑制剂、tgf
‑
β抑制剂、他汀类、il
‑
6和il
‑
1抑制剂、pemirolast
tm
、tranilast
tm
、remicade
tm
、sirolimus
tm
和非甾体抗炎药(nsaid)例如tepoxalin
tm
、tolmetin
tm
、suprofen
tm
);免疫抑制/免疫调节剂(例如钙调神经磷酸酶抑制剂,例如环孢霉素、他克莫司);mtor抑制剂(例如sirolimus
tm
、everolimus
tm
);抗增殖剂(例如硫唑嘌呤、霉酚酸酯);皮质类固醇(例如泼尼松龙、氢化可的松);抗体,例如单克隆抗il
‑
2rα受体抗体(例如,巴利昔单抗、达克珠单抗),多克隆抗t细胞抗体(例如,抗胸腺细胞球蛋白(atg);抗淋巴细胞球蛋白(alg);单克隆抗t细胞抗体okt3));抗血栓形成剂(例如肝素、肝素衍生物、尿激酶、ppack(右旋苯丙氨酸脯氨酸精氨酸氯甲基酮)、抗凝血酶化合物、血小板受体拮抗剂、抗凝血酶抗体、抗血小板受体抗体、阿司匹林、双嘧达莫、鱼精蛋白、水蛭素、前列腺素抑制剂和血小板抑制剂);和抗氧化剂(例如普罗布考、维生素a、抗坏血酸、生育酚、辅酶q
‑
10、谷胱甘肽、l
‑
半胱氨酸、n
‑
乙酰半胱氨酸)以及局部麻醉剂。经基因修饰的细胞
[0149]
在一个实施方案中,hsc或mlpsc经基因修饰例如以表达和/或分泌目标蛋白质,例如提供治疗和/或预防益处的蛋白质。
[0150]
本文中使用的术语“核酸”是指任何长度的核苷酸的聚合形式,核糖核苷酸或脱氧
核糖核苷酸,包含嘌呤和嘧啶碱基或其他天然、化学或生物化学修饰的、非天然的或衍生的核苷酸碱基。本发明实施方案的多核苷酸包括脱氧核糖多核苷酸(dna)、核糖多核苷酸(rna)或核糖多核苷酸的dna拷贝(cdna)的序列,其可从天然来源分离、重组产生或人工合成。多核苷酸的另一个实例是聚酰胺多核苷酸(pna)。多核苷酸和核酸可以以单链或双链存在。多核苷酸的主链可包含糖和磷酸基团,如通常可在rna或dna中发现的,或者修饰或取代的糖或磷酸基团。多核苷酸可包含经修饰的核苷酸,例如甲基化的核苷酸和核苷酸类似物。核苷酸的序列可以被非核苷酸组分中断。由核苷酸制成的聚合物,诸如核酸、多核苷酸和多核苷酸,在本文中也可称为核苷酸聚合物。
[0151]
本公开内容的hsc或mlpsc可经修饰以引入上述引用的核酸。术语“引入”在本公开内容的上下文中用于指根据本公开内容将核酸引入间充质谱系前体或干细胞的细胞核或细胞质中。
[0152]
当通过任何合适的人工操作手段将核酸转移到细胞中时,或当细胞是已经遗传了核酸的最初改变的细胞的后代时,hsc或mlpsc被认为是“经修饰的”。
[0153]
诸如“基因改变的”、“转染的”、“转导的”或“基因转化的”等术语在本发明的上下文中也可以互换使用,以指代经修饰的间充质谱系前体或干细胞。hsc或mlpsc可以以稳定或瞬时的方式进行修饰。
[0154]
在一个实例中,hsc或mlpsc可经修饰以引入表达核酸的载体。本领域已知用于在细胞中表达的许多载体。载体组件通常包括但不限于以下一个或多个:信号序列、编码核酸(例如寡核苷酸)的序列、增强子元件、启动子和转录终止序列。
[0155]
根据本公开内容,示例性表达载体包括质粒、噬菌体、自主复制序列(ars)、病毒、着丝粒、人工染色体、染色体或其他能够在间充质谱系前体或干细胞中表达核酸的结构。
[0156]
用于转染进入间充质谱系前体或干细胞的合适载体质粒包括脂质/dna复合物,如美国专利号5,578,475;6,020,202;和6,051,429中所述的那些。制备dna
‑
脂质复合物的合适试剂包括lipofectamine(gibco/life technologies#11668019)和fugene
tm 6(roche diagnostics corp.#1814443);和lipotaxi
tm
(invitrogen corp.,#204110)。
[0157]
在另一个实例中,hsc或mlpsc经修饰以使用病毒表达载体引入核酸。示例性病毒表达载体包括慢病毒、杆状病毒、逆转录病毒、腺病毒(adv)、腺相关病毒(aav),包括重组形式,例如重组腺相关病毒(raav)及其衍生物,例如自互补aav(scaav)和非整合av。
[0158]
在一个实例中,病毒载体是复制缺陷型的。在这个实例中,复制基因被缺失或替换为具有高活性启动子的表达盒。例如,在av的情形中,e1/e3基因可以被缺失或替换。在aav的情形中,e1a和e1b基因可以被缺失或替换。示范性高活性启动子包括cmv、ef1a、sv40、pgk1、ubc、人β肌动蛋白、cag、tre、uas和ac5。
[0159]
在一个实例中,hsc或mlpsc经修饰以使用av载体或其重组形式引入核酸。各种av血清型可适于修饰细胞以引入核酸。在一个实例中,av血清型1(av1)用于修饰间充质谱系前体或干细胞。在另一个实例中,av2用于修饰间充质谱系前体或干细胞。在其它实例中,av3、av4、av7、av8、av9、av10、av11、av12或av13用于修饰hsc或mlpsc。在另一个实例中,av5用于修饰hsc或mlpsc。在另一个实例中,av6用于修饰间充质谱系前体或干细胞。
[0160]
在一个实例中,hsc或mlpsc经修饰以使用aav载体或其重组形式引入核酸。各种aav血清型也可适用于修饰hsc或mlpsc。
[0161]
在一个实例中,aav血清型1(aav1)用于修饰hsc或mlpsc。在另一个实例中,aav2用于修饰hsc或mlpsc。在其他实例中,aav3、aav4、aav7、aav8、aav9、aav10、aav11、aav12或aav13用于修饰hsc或mlpsc。在另一个实例中,aav5用于修饰hsc或mlpsc。在另一个实例中,aav6用于修饰hsc或mlpsc。
[0162]
可使用本领域已知的各种技术来鉴定最佳载体。在一个实例中,间充质谱系前体或干细胞可与表达绿色荧光蛋白(gfp)的各种载体接触/转染。在此实例中,可基于转染/转导效率、gfp表达水平、细胞向性及/或gfp表达持续性来鉴定最佳载体。
[0163]
本领域已知病毒转导方法(例如美国专利号6,723,561;6,627,442)。各种病毒表达载体系统也可从商业供应商处获得,如miltenyi biotech(macsductin)、sigma aldrich(expressmag)和thermo fisher scientific(virapower)。
[0164]
修饰效率很少为100%,并通常希望富集已经成功修饰的细胞群体。在一个实例中,可以通过利用新基因型的功能特征来富集经修饰的细胞。富集经修饰的细胞的一个示例性方法是利用对药物(例如新霉素)的抗性进行正选择。递送至共培养的hsc
[0165]
在一个实例中,本公开内容包括通过共培养使hsc与已经修饰以包含异源核酸或表达异源核酸的载体的mlpsc接触而将核酸递送至hsc的方法。为免生疑问,递送至hsc细胞的核酸是引入经修饰的间充质细胞系前体或干细胞的核酸。
[0166]
核酸的转移可通过在mlpsc和hsc之间的直接或间接接触进行。在本公开内容的上下文中使用“直接接触”是指hsc和经修饰的mlpsc之间的物理接触以促进核酸转移。例如,靶细胞和经修饰的mlpsc可经由共同连接蛋白(即由hsc和经修饰的间充质谱系前体或干细胞两者表达的连接蛋白)直接接触。在这个实例中,共同连接蛋白促进核酸经由间隙连接从mlpsc转移至hsc。在一个实例中,间隙连接由cx40形成。在另一个实例中,间隙连接由cx43形成。在另一个实例中,间隙连接由cx45、cx32和/或cx37形成。
[0167]
在本公开内容的上下文中使用的“间接接触”是指不直接接触而将核酸从mlpsc递送至hsc。例如,靠近靶细胞的经修饰的mlpsc可与靶细胞间接接触。在一个实例中,与hsc间接接触的经修饰mlpsc可经由外泌体将核酸递送至靶细胞。
[0168]
在另一个实例中,与hsc直接接触的经修饰的mlpsc可经由共同连接蛋白并间接地经由外泌体将核酸递送至靶细胞。
[0169]
在另一个实例中,hsc与经修饰的mlpsc有共同连接蛋白。在一个实例中,hsc表达cx40。在另一个实例中,hsc表达cx43。在另一个实例中,靶细胞表达cx45、cx32和/或cx37。
[0170]
本领域技术人员将理解,在不脱离本公开内容的广泛的一般范围的情况下,可以对上述实施方案进行多种变化和/或修改。因此,本实施方案在所有方面都被认为是举例说明性的而不是限制性的。
实施例
实施例1:间充质谱系前体或干细胞(mlpsc)的免疫选择
[0171]
骨髓(bm)从健康正常成人志愿者(20
‑
35岁)收获。简单地说,从髂后嵴吸取40ml bm到含肝素锂抗凝剂的试管中。
[0172]
骨髓单个核细胞(bmmnc)是使用lymphoprep
tm
(nycomed pharma,奥斯陆,挪威)通
过密度梯度分离制备的,如zannettino等人,1998之前所述。于4℃以400x g离心30分钟后,用移液管移取棕黄色层(buffy layer)并在“hhf”中洗涤三次,“hhf”包含hank's平衡盐溶液(hbss,life technologies,盖瑟斯堡,md),含5%胎牛血清(fcs,csl limited,维多利亚,澳大利亚)。
[0173]
如gronthos&simmons,1995;和gronthos,2003之前所述,随后通过磁激活细胞分选来分离stro
‑
3+(或tnap+)细胞。简而言之,大约1
‑
3x108个bmmnc在封闭缓冲液中在冰上孵育20分钟,该缓冲液由在hhf中的10%(v/v)正常兔血清组成。细胞在封闭缓冲液中与200μl的10μg/ml的stro
‑
3mab溶液在冰上孵育1小时。随后通过400x g离心在hhf中洗涤细胞两次。加入hhf缓冲液中1/50稀释的山羊抗小鼠抗体γ
‑
生物素(southern biotechnology associates,伯明翰,英国)并将细胞在冰上孵育1小时。细胞在如上所述的macs缓冲液(补充有1%bsa、5mm edta和0.01%叠氮化钠的不含ca
2+
和mg
2+
的pbs)中洗涤两次,并在最终体积为0.9ml的macs缓冲液中重新悬浮。
[0174]
将100μl链霉亲和素微珠(miltenyi biotec;bergisch
‑
gladbach,德国)加入细胞悬浮液中,并在冰上孵育15分钟。将细胞悬浮液洗涤两次并在0.5ml的macs缓冲液中再悬浮,随后将其加载到微型macs柱(ms柱,miltenyi biotec)上,并用0.5ml macs缓冲液洗涤三次以回收未结合stro
‑
3mab(于2005年12月19日保藏于美国典型培养物保藏中心(atcc),保藏号pta
‑
7282
‑
参见国际公布wo 2006/108229)的细胞。在添加另外的1ml macs缓冲液后,将柱从磁体上移除,并通过正压分离tnap+细胞。每个级分的等分式样细胞可以用链霉亲和素fitc染色并通过流式细胞术来评估纯度。实施例2:hsc和间充质谱系前体或干细胞(mlpsc)的共培养
[0175]
细胞:cb cd34+(stem cell technologies)
[0176]
培养基:stemspan sfem(stem cell technologies),补充有:
·
人类低密度脂蛋白(stem cell technologies)10μg/ml
·
生长因子(
‘
sft’):οrhu scf 100ng/mlοrhu
‑
flt3配体100ng/mlοrhu tpo 50ng/mlο(所有重组细胞因子均来自r&d systems)
[0177]
小分子:sr1(500nm);um171(35nm);曲古抑菌素a(tsa,50nm);丙戊酸(vpa,500μm)(全部来自stem cell technologies)
[0178]
测定条件:第
‑
1天将mpc(mcbcc006)以50,000个/孔铺板在2个24孔板中,在α
‑
mem/10%fbs中第0天将每孔10,000个cd34+细胞铺板在两个24孔板的每个孔中。首先对含mpc的孔洗涤,以去除fbs培养基。将剩余的cd34+细胞在t
‑
25培养瓶中在stemspan/sft/sr
‑
1+um171中以相同浓度培养。这是为了提供用于建立流式细胞仪分析的大量细胞,并为多色分析定义电子补偿设置。第3天通过去除1.5ml培养基并用2.0ml新鲜培养基+添加剂替代来对所有组供料。
第5天流式细胞仪分析:从各孔收获1.5ml培养基。对于悬浮液(无mpc)组,通过首先上下吹吸培养基以完全悬浮cd34+细胞,其后移取1.5ml悬浮液来实现。对于+mpc组,以保持mpc饲养层完好的方式重新悬浮cd34+细胞。从各孔移取细胞后,用2.0ml新鲜培养基+添加剂替换。对所有孔进行细胞计数。这不仅需要确定通过facs分析鉴定的群体发生率,而且还需要确定其绝对数量。第8天通过移除2.0ml的培养基并用2.0ml新鲜培养基和添加剂替换来对所有组供料。第10天流式细胞仪分析:收获各孔的全部内容物。对于悬浮液(无mpc)组,通过首先上下吹吸培养基以完全悬浮cd34+细胞,其后移取悬浮液来实现。对于+mpc组,首先收获在悬浮液中的cd34+细胞(如上关于第5天所述)。然后,通过在37℃短暂暴露(5min)于在pbs中的0.05%胰蛋白酶
‑
edta,将附着在mpc层上的cd34+细胞脱离,在10%fbs中将胰蛋白酶淬灭,脱离的细胞与先前收获的悬浮液级分合并以代表第10天收获。流式细胞术分析:
[0179]
进行4色流式细胞术分析,以便根据对脐带血描述的表型cd34+cd45ra
‑
cd90+cd49f+对cd34+细胞和相关亚群(包括候选造血干细胞(hsc))进行识别和定量(notta等,(2011)science 333:218
‑
221)。所有抗体缀合物均按制造商推荐的浓度使用。
[0180]
如上所述,在第5天和第10天,使用在stemspan/sft/sr
‑
1+um171中的cd34+细胞的大量培养建立流式细胞术分析设置,并建立补偿设置。进行以下抗体/抗体组合的染色:1.单独的细胞2.pe
‑
cy7/fitc/pe/apc同种型(集合)3.cd34
‑
pecy74.cd45ra
‑
fitc5.cd90
‑
pe6.cd49f
‑
apc7.cd34
‑
pecy7/cd45ra
‑
fitc/igg1
‑
pe同种型/cd49f
‑
apc8.cd34
‑
pecy7/cd45ra
‑
fitc/cd90
‑
pe/大鼠igg2a同种型
‑
apc9.cd34
‑
pecy7/cd45ra
‑
fitc/cd90
‑
pe/cd49f
‑
apc每组用4色板(9)染色。结果
[0181]
在存在以下项目,存在和不存在免疫选择的mpc的情况下培养脐带血衍生的cd34+hsc:sftsft+vpasft+sr
‑
1sft+sr
‑
1+um171sft+um171sft+sr
‑
1+tsasft+tsasft+sr
‑
1+vpa:
sft+um171+tsasft+um171+vpasft+sr
‑
1+um171+tsasft+sr
‑
1+um171+vpa。
[0182]
图1至图4中显示了培养第5天的cd34+细胞和各种亚群的数量结果,包括候选hsc表型(cd34+cd45ra
‑
cd90+cd49f+),图5至图9显示了培养第10天的结果。图10显示了培养第10天的流式细胞术分析结果。
[0183]
图9显示了mpc和hdaci(tsa或vpa)的存在导致具有原代hsc表型cd34+cd45ra
‑
cd90+cd49f+的cd34+细胞比没有mpc或hdaci的cd34+细胞显著更大的扩增。
[0184]
图10显示了cd34+细胞与mpc的共培养与hdaci显著协同作用,以增强具有原代表型cd34+cd45ra
‑
cd90+cd49f+的hsc的生成。
[0185]
这些结果表明,原代hsc的数量显著增加,尤其是在培养过程中。例如,共培养细胞的起始群体包括约100,000个mpc和约10,000个cd34+细胞。在这10,000个cd34+细胞中,约500个具有原代表型cd34+cd45ra
‑
cd90+cd49f+。例如,与mpc、sfv和vpa共培养10天后,cd34+细胞的数量增加到约800,000个细胞,并且cd34+cd45ra
‑
cd90+cd49f+细胞的数量增加到约22,000个细胞。这意味着在10天时间内cd4+cd90+cd49f+细胞的数量增加约44倍。
[0186]
在10天时间内,培养中的mpc数量保持恒定(约100,000个细胞)。因此cd34+cd45ra
‑
cd90+cd49f+细胞:mpc的比率在10天时间内从1:200增加到1:4.5。
[0187]
为了进行比较,本公开内容之前用于扩增cd34+细胞的本领域方法涉及在存在sft、sr
‑
1和um171且不存在mpc的情况下培养cd34+细胞(boitano等人(2010)science 329:1345
‑
1348;fares等人(2014)science 345:1509
‑
1512)。如图9所示,在这些条件下经过10天培养时间后,存在的cd34+cd45ra
‑
cd90+cd49f+细胞的数量非常低(少于约800个细胞)。与mpc、sfv、vpa共培养10天后,通过facs分离cd34+cd38
‑
cd45ra
‑
cd90+cd49f+细胞。这些分离的细胞随后在methoculttm h4435 enriched(stem cell technologies)中培养,该培养基是完全的基于甲基纤维素的培养基,含有il
‑
3、il
‑
6、g
‑
csf、gm
‑
csf、scf和epo,并且可用于集落形成单位(cfu)测定中造血祖细胞的生长和计数。在培养第14天对集落进行评分并测试集落形成率。如图11所示,分离的cd34+cd38
‑
cd45ra
‑
cd90+cd49f+细胞含有克隆源性造血祖细胞,其产生红系祖细胞(bfu
‑
e)、粒细胞
‑
巨噬细胞祖细胞(cfu
‑
gm、cfu
‑
g和cfu
‑
m)以及多能粒细胞、类红细胞(erythroid)、巨噬细胞和巨核细胞祖细胞(cfu混合物)。总体集落形成率为0.42%。实施例3:来自外周血或脐带血的cd34+细胞的扩增
[0189]
将约2500万个mpc在无动物组分的培养基中培养扩增约5天,以获得包含约4
‑
5亿个mpc的细胞群体。然后将mpc洗涤并安置与从需要hsc移植的受试者的外周血或从脐带血中获得的约5000万个cd34+细胞共培养。在这个阶段,在总cd34+群体中有大约250万个表型cd34+cd45ra
‑
cd90+cd49f+的原代hsc。然后将这些细胞在无血清培养基中在hdac抑制剂存在下共培养约10天的时间,之后表型cd34+cd45ra
‑
cd90+cd49f+的hsc已扩增至约100,000,000个细胞。
[0190]
在此阶段,总细胞群体可用于施用至需要hsc移植的受试者。
[0191]
替代地,可以通过免疫选择,例如使用结合cd49f抗原的抗体,分离cd34+cd45ra
‑
cd90+cd49f+细胞,以提供这些细胞的纯化群体,其特别适合长期更新和植入。对剩余的细胞群体(从中已耗尽cd34+cd45ra
‑
cd90+cd49f+细胞)富集cd34+cd49
‑
细胞,这些细胞对早期中性粒细胞/血小板恢复特别有用。
[0192]
免疫选择的cd34+cd45ra
‑
cd90+cd49f+细胞可通过例如用含有编码治疗性蛋白的基因序列的病毒载体转导或通过使用crispr系统等进行基因修饰。参考文献ausubel,f.m.(编).(1987,包括至今为止的所有更新).current protocols in molecular biology.new york:john wiley&sons.brown,t.a.(编).(1991).essential molecular biology:a practical approach(vol.1和2).oxford:irl press at oxford university press.coligan,j.e.,kruisbeek,a.m.,margulies,d.h.,shevach,e.m.,&strober,w.(编).(1991,包括至今为止的所有更新).current protocols in immunology.new york:john wiley&sons.glover,m.,&hames,b.d.(编).(1995and 1996).dna cloning:a practical approach(vols.1
‑
4).gronthos(2003).journal of cell science,116(pt 9),1827
‑
1835.gronthos&simmons(1995).blood,85(4),929
‑
940.harlow,e.,&lane,d.(1988).antibodies:a laboratory manual.new york:cold spring harbor laboratory press.perbal,b.v.(1984).a practical guide to molecular cloning.new york:wiley.sambrook,j.,&green,m.r.(2012).molecular cloning:a laboratory manual(第四版).new york:cold spring harbour laboratory press.zannettino等人,(1998).blood,92(8),2613
‑
2628.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1