用于制造烟酰胺衍生物的重组微生物和方法、以及其中使用的载体与流程
本发明涉及用于制造烟酰胺单核苷酸(nmn,nicotinamidemononucleotide)等烟酰胺衍生物(nam衍生物,nicotinamidederivative)的新型重组微生物、以及用于制造nam衍生物的新型制造方法,同时涉及在它们中使用的新型载体。
背景技术:
烟酰胺腺嘌呤二核苷酸(nad,nicotinamideadeninedinucleotide)是来自核糖和烟酰胺的核苷酸。已知nad在生物体内的各种氧化还原反应中作为辅酶发挥功能,起到需氧呼吸(氧化磷酸化)的中心作用。在生物体内nad可采取氧化型(nad+)和还原型(nadh)这2种状态。在本说明书中,只要没有特别说明,则术语“nad”总括性地表示氧化型(nad+)和还原型(nadh)这两者。
存在多个nad的生物合成途径,但在哺乳类细胞中主要是以烟酰胺(nam)为起始物质、由此经过2个阶段的酶反应而合成nad的途径。在第1阶段,细胞内所摄取的nam在5-磷酸核糖-1-焦磷酸(prpp)的存在下通过烟酰胺磷酸核糖转移酶(nampt(nicotinamidephosphoribosyltransferase):nmn合成酶)转换成烟酰胺单核苷酸(nmn)和焦磷酸(p-pi)。在接下来的第2阶段,前一阶段中得到的nmn在腺苷三磷酸(atp,三磷酸腺苷)的存在下通过烟酰胺/烟酸单核苷酸腺苷酰转移酶(nmnat)转换成nad。
这里,已知在上述生物合成途径中作为nad的前体的nmn具有线粒体的激活或所谓长寿基因即sirtuin基因的激活等各种功能。特别是在生物体内,认为由于随着年龄增加nmn生成能力下降,nad也减少,线粒体的活性降低或细胞核的损伤加剧。而且,还报道了nmn与胰岛素抵抗性、糖尿病、癌症、阿尔茨海默病等衰老相关疾病有关。因此,nmn作为各种研究工具或nad的合成中间体、以及药效成分等受到关注。
另外,nmn不仅作为nad的合成中间体、还作为烟酰胺核苷(nr,nicotinamideriboside)或烟酸单核苷酸(namn,nicotinatemononucleotide)等各种烟酰胺衍生物(nam衍生物)的合成中间体来预见其应用。
[化学式1]
作为nmn的合成方法,以往已知有基于有机合成的方法、基于nad的降解的方法、使用微生物的合成生物学方法等。
基于有机合成的方法是由d-核糖经过多个步骤合成nmn的方法(专利文献1:美国专利申请公开第2018/0291054号说明书)。然而,在该方法中,因需要几个阶段的合成步骤,故合成要花费时间和成本。
基于nad的降解的方法是无需分离由酵母生物合成的nad而直接用酶进行降解而得到nmn的方法(专利文献2:国际公开第2017/200050号)。然而,在该方法中,每个菌体的nmn的产率非常差。
使用微生物的合成生物学方法是通过对大肠杆菌等宿主微生物进行基因重组,构建表达与酶(nampt:nmn合成酶)同样的酶的重组微生物,使用得到的重组微生物来合成nmn的方法,上述nmn合成酶催化上述哺乳类中的nad的主要生物合成系统的第1阶段、即由nam和prpp通过nampt向nmn转换(专利文献3:国际公开第2015/069860号;非专利文献1:mariescu等人,scientificreports,august16,2018,第8卷,no.1,第12278页)。然而,在该方法中,为了生产nmn需要长时间,而且得到的nmn的量少,无法得到足以实用的产率。
现有技术文献
专利文献
专利文献1:美国专利申请公开第2018/0291054号说明书;
专利文献2:国际公开第2017/200050号;
专利文献3:国际公开第2015/069860号;
非专利文献
非专利文献1:mariescu等人,scientificreports,august16,2018,第8卷,no.1,第12278页。
技术实现要素:
发明所要解决的课题
鉴于以上的背景,要求有效地合成烟酰胺单核苷酸(nmn)等烟酰胺衍生物(nam衍生物)。
用于解决课题的手段
鉴于上述课题,本发明人对使用微生物的以往的nmn的合成生物学生产系统进行验证,为了对其改良进行了深入研究,结果发现了:通过向宿主微生物中重组导入具有优异活性的特定的酶作为成为nmn的生物合成的关键的酶(nampt)并使其表达,增强nmn的合成效率,从而使nmn的生产效率显著改善。另外,还发现了:通过向宿主微生物中重组导入具有优异活性的特定蛋白作为促进nmn合成的反应物即nam或其衍生物即na(需要说明的是,有时将nam和na统称为“烟酸(niacin)”。)被宿主微生物细胞摄取的蛋白(烟酸转运体,niacintransporter)、和/或促进nmn等nam衍生物从宿主微生物细胞中分泌的蛋白(nam衍生物转运体)并使其表达,增强nam被宿主微生物细胞摄取的效率,从而使nmn的生产效率进一步改善。另外,还发现了:通过向宿主微生物中重组导入具有优异活性的特定的酶作为构成nmn合成的又一反应物即prpp的生物合成系统的一系列酶组中的1种或2种的酶并使其表达,增强prpp的合成效率,从而也使nmn的生产效率进一步改善。而且,还发现了:利用这样的nmn系统,不仅是nmn就连nad、nr、namn等其他的nam衍生物也可高效率地进行制造。各种本发明是基于这些新的见解而完成的。
即,本发明涉及以下内容。
[1]重组微生物,其是用于产生烟酰胺衍生物的微生物,其中,
上述微生物表达由烟酰胺和5-磷酸核糖-1-焦磷酸生成烟酰胺单核苷酸的烟酰胺磷酸核糖转移酶(nampt)、和/或通过载体转化而成,该载体担载编码上述nampt的氨基酸序列的核酸,同时
基于上述nampt的由烟酰胺转换成烟酰胺单核苷酸的效率为人nampt的5倍以上。
[2][1]的重组微生物,其中,上述nampt由多肽构成,该多肽与seqidno:3或seqidno:6所示的氨基酸序列具有80%以上的序列相似性。
[3][1]或[2]的重组微生物,其中,上述微生物进一步表达促进烟酸和/或烟酰胺的细胞内摄取的烟酸转运体、和/或通过载体转化而成,该载体担载编码上述烟酸转运体的氨基酸序列的核酸,同时
上述烟酸转运体使基于宿主微生物的烟酸和/或烟酰胺的细胞内摄取效率增加至1.1倍以上。
[4][3]的重组微生物,其中,上述烟酸转运体由多肽构成,该多肽与seqidno:9或seqidno:12所示的氨基酸序列具有80%以上的序列相似性。
[5][1]~[4]的重组微生物,其中,上述微生物进一步表达促进烟酰胺衍生物的胞外分泌的烟酰胺衍生物转运体、和/或通过载体转化而成,该载体担载编码上述烟酰胺衍生物转运体的氨基酸序列的核酸,同时
上述烟酰胺衍生物转运体使基于宿主微生物的烟酰胺衍生物的胞外分泌效率增加至3倍以上。
[6][5]的重组微生物,其中,上述烟酰胺衍生物转运体由多肽构成,该多肽与seqidno:15所示的氨基酸序列具有80%以上的序列相似性。
[7][1]~[6]的重组微生物,其中,上述微生物进一步表达促进由葡萄糖-6-磷酸合成5-磷酸核糖-1-焦磷酸的途径的1种或2种以上的酶、和/或通过载体进一步转化而成,该载体担载编码上述1种或2种以上的酶的氨基酸序列的核酸。
[8][7]的重组微生物,其中,上述1种或2种以上的酶是选自磷酸葡萄糖异构酶、葡萄糖-6-磷酸脱氢酶、6-磷酸葡萄糖酸内酯酶、6-磷酸葡萄糖酸脱氢酶、核糖-5-磷酸异构酶和磷酸核糖焦磷酸合成酶的1种或2种以上的酶。
[9][8]的重组微生物,其中,
上述磷酸葡萄糖异构酶是与seqidno:18所示的氨基酸序列具有80%以上的序列相似性的多肽,
上述葡萄糖-6-磷酸脱氢酶是与seqidno:21所示的氨基酸序列具有80%以上的序列相似性的多肽,
上述6-磷酸葡萄糖酸内酯酶是与seqidno:24所示的氨基酸序列具有80%以上的序列相似性的多肽,
上述6-磷酸葡萄糖酸脱氢酶是与seqidno:27所示的氨基酸序列具有80%以上的序列相似性的多肽,
上述核糖-5-磷酸异构酶是与seqidno:30或33所示的氨基酸序列具有80%以上的序列相似性的多肽,
上述磷酸核糖焦磷酸合成酶是与seqidno:36所示的氨基酸序列具有80%以上的序列相似性的多肽。
[10][1]~[9]的重组微生物,其中,上述烟酰胺衍生物选自烟酰胺单核苷酸、烟酰胺腺嘌呤二核苷酸、烟酰胺核苷、烟酸单核苷酸、烟酰胺腺嘌呤二核苷酸磷酸和烟酸腺嘌呤二核苷酸。
[11][1]~[10]的重组微生物,其中,重组微生物为大肠杆菌或酵母。
[12]用于产生烟酰胺衍生物的方法,该方法包括:对[1]~[11]的重组微生物供给烟酰胺,回收通过上述微生物生成的烟酰胺衍生物。
[13][12]的方法,该方法进一步包括:纯化所回收的烟酰胺衍生物。
[14]载体,其是担载核酸的载体,该核酸编码由烟酰胺和5-磷酸核糖-1-焦磷酸生成烟酰胺单核苷酸的烟酰胺磷酸核糖转移酶(nampt)的氨基酸序列,其中,上述核酸包含与seqidno:2或seqidno:5所记载的核苷酸序列具有80%以上的序列同一性的核苷酸序列。
[15]载体,其是担载核酸的载体,该核酸编码促进烟酸和/或烟酰胺的细胞内摄取的烟酸转运体的氨基酸序列,其中,上述核酸包含与seqidno:8或seqidno:11所记载的核苷酸序列具有80%以上的序列同一性的核苷酸序列。
[16]载体,其是担载核酸的载体,该核酸编码促进烟酰胺衍生物的胞外分泌的烟酰胺衍生物转运体的氨基酸序列,其中,上述核酸包含与seqidno:14所记载的核苷酸序列具有80%以上的序列同一性的核苷酸序列。
发明效果
根据本发明,可有效地合成nmn等nam衍生物。
附图说明
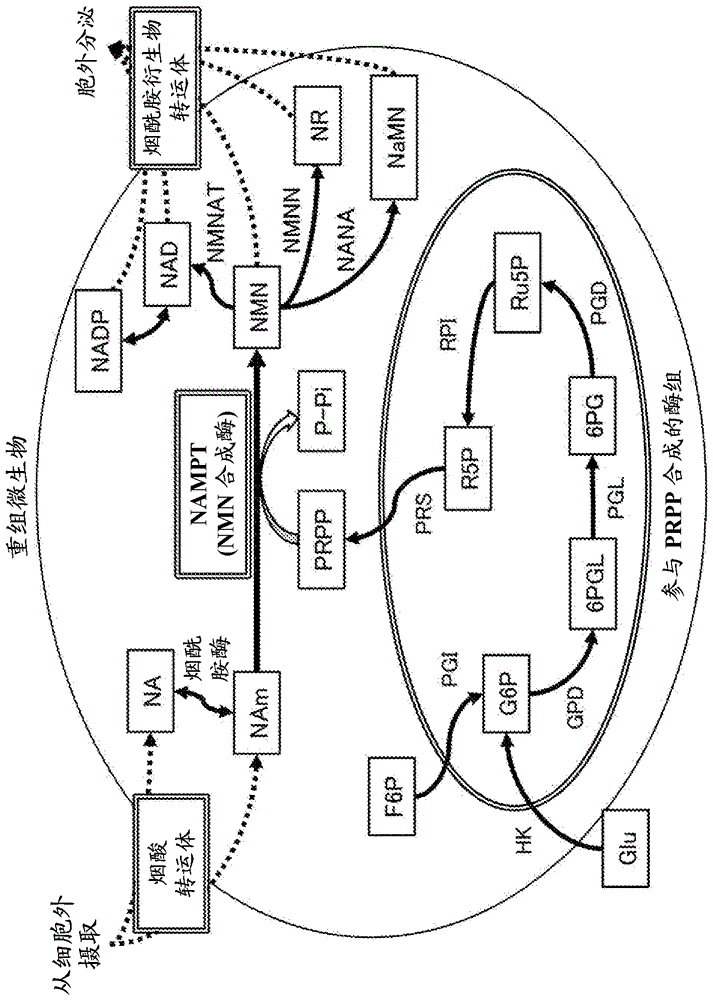
[图1]图1是示意性地表示本发明所涉及的nam衍生物的合成生物学生产系统的例子的图。
具体实施方式
以下,结合具体的实施方式详细地说明本发明。但本发明并不受以下所公开的实施方式的束缚,在不脱离本发明宗旨的范围内,能够以任意的方式进行实施。
需要说明的是,本公开中引用的专利公报、专利申请公开公报和非专利文献,其全部内容均通过引用而纳入本公开中以用于所有目的。
另外,在本公开中,“核酸”还包括核糖核酸、脱氧核糖核酸、或任一种核酸的修饰物,另外还包括单链或双链的任一种。另外,本公开中的核酸(基因)可使用根据本领域技术人员已知的公共机关的数据库或本说明书中公开的核苷酸序列制作的引物或探针等,按照本领域技术人员已知的任意方法进行调制。例如,通过利用各种pcr以及本领域技术人员已知的其他的dna扩增技术,可容易地以该基因的cdna的形式得到。或者,如果是本领域技术人员,可根据本说明书中公开的序列信息,适当利用现有技术来合成核酸。
另外,在本公开中,核酸或基因“编码”蛋白或多肽是指使这样的蛋白或多肽以具备其活性的状态表达。另外,本公开中的“编码”包括以下两者:将本发明所涉及的蛋白编码为连续的结构序列(外显子);以及经由适当的间隔序列(内含子)编码该蛋白。
另外,在本公开中,关于核酸或基因的克隆、或载体的设计和制作、向细胞内的转化、蛋白或多肽的表达等基因工程学方法,例如可参照sambrook,j.等人,molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989等的记载。
[i.概要]
首先,从本发明的概要开始说明。
如上所述,作为使用微生物以合成生物学方式制造烟酰胺单核苷酸(nmn)的尝试,提出了以下方法:通过对大肠杆菌等宿主微生物进行基因重组,构建表达与上述哺乳类中的烟酰胺腺嘌呤二核苷酸(nad)的主要生物合成系统同样的酶的重组微生物,使用所得的重组微生物合成nmn(专利文献3:国际公开第2015/069860号;非专利文献1:mariescu等人,scientificreports,august16,2018,第8卷,no.1,第12278页)。然而,这样的以往方法中存在以下课题:不仅生产nmn需要长时间,而且所得的nmn的量低,无法得到足以实用的产率。
本发明涉及基于使用微生物的以往的nmn的合成生物学生产系统的nam衍生物合成系统,通过将参与nam衍生物的合成和/或转运的各种酶和/或转运蛋白导入到微生物中使其表达,使nmn等nam衍生物的生产效率提高。
利用图1对本发明的一个方案所涉及的nam衍生物的合成生物学生产系统的例子更具体地进行说明。但图1终归是示例,本发明并不限于图1所示的合成系统。
图1所示的合成生物学的nam衍生物合成系统包括在宿主微生物细胞内由一系列酶组构成的nam衍生物的合成系统。如图1所示,nmn合成系统的主要反应途径是将nam和prpp转换成nmn和p-pi的反应途径。
作为nam衍生物合成系统的主要反应途径的一种反应物的nam从宿主微生物的细胞外摄取到细胞内。另外,同样从宿主微生物的细胞外摄取到细胞内的na和nam通过烟酰胺酶相互转换。
作为nam衍生物合成系统的主要反应途径的另一种反应物的prpp是由从宿主微生物的细胞外摄取到细胞内的葡萄糖(glu)经过以下一系列的反应途径来合成。
・通过己糖激酶(hk)由葡萄糖(glu)磷酸化成葡萄糖-6-磷酸(g6p)。
・通过磷酸葡萄糖异构酶(pgi)由果糖-6-磷酸(f6p)转换成葡萄糖-6-磷酸(g6p)。
・通过葡萄糖-6-磷酸脱氢酶(gpd)由g6p转换成6-磷酸葡萄糖酸-1,5-内酯(6pgl)。
・通过6-磷酸葡萄糖酸内酯酶(pgl)由6pgl转换成6-磷酸葡萄糖酸(6pg)。
・通过6-磷酸葡萄糖酸脱氢酶(pgd)由6pg转换成核酮糖-5-磷酸(ru5p)。
・通过核糖-5-磷酸异构酶(rpi)由ru5p转换成核糖-5-磷酸(r5p)。
・通过磷酸核糖焦磷酸合成酶(prs)由r5p转换成5-磷酸核糖-1-焦磷酸(rrpp)。
另外,通过上述主反应生成的nmn通过nmnat转换成nad、通过烟酰胺核苷酸酰胺酶(nana)转换成烟酸单核苷酸(namn)、通过烟酰胺单核苷酸-5-核苷酸酶(nmnn)转换成烟酰胺核苷,适当地向细胞外分泌。
根据本发明的一个方案,通过向宿主微生物中重组导入具有优异活性的特定的酶作为成为nmn的生物合成的关键的酶(nampt:nmn合成酶)并使其表达,增强nmn的合成效率,从而改善nam衍生物的生产效率。
根据本发明的优选方案,对于上述nam衍生物合成系统,通过向宿主微生物中重组导入具有优异活性的特定蛋白作为促进nam和/或na(烟酸)被宿主微生物细胞摄取的转运蛋白(烟酸转运体)并使其表达,增强烟酸被宿主微生物细胞摄取的效率,从而进一步改善nam衍生物的生产效率。
根据本发明的另一优选方案,对于上述nam衍生物合成系统,通过向宿主微生物中重组导入具有优异活性的特定的酶作为进一步构成nmn合成的又一个反应物即prpp的生物合成系统的一系列酶组(gpi、gpd、pgl、pgd、rpi和prs)中的1种或2种的酶并使其表达,增强prpp的合成效率,从而进一步改善nam衍生物的生产效率。
根据本发明的又一优选方案,对于上述nam衍生物合成系统,通过向宿主微生物中重组导入具有优异活性的特定蛋白作为促进nam衍生物从宿主微生物细胞分泌的转运蛋白(nam衍生物转运体)并使其表达,增强所产生的nam衍生物从宿主微生物细胞分泌的效率,从而进一步改善nam衍生物的生产效率。
特别是,在本发明中,对于上述nam衍生物合成系统,通过将上述特定的nampt(nmn合成酶)、烟酸转运体、nam衍生物转运体、和prpp合成酶(gpi、gpd、pgl、pgd、rpi和prs)中的多个、优选全部组合起来导入到重组微生物中,从而使最终的nam衍生物的生产效率得到格外改善。
作为通过本发明的合成系统制造的nam衍生物,并不限于这些,除nmn以外,还可列举:nad、烟酰胺核苷(nr)、烟酸单核苷酸(namn)、烟酰胺腺嘌呤二核苷酸磷酸(nadp)、烟酸腺嘌呤二核苷酸等。
在下一章以后的记载中,主要对通过本发明的合成系统合成nmn的情况进行说明,关于合成除nmn以外的nam衍生物的情况,以下也有概述。
例如,基于本发明的合成系统的nad的合成,可通过按照与上述同样的步骤向插入有用于nmn合成的一系列基因的宿主微生物中进一步重组导入将nmn转换成nad的烟酰胺/烟酸单核苷酸腺苷酰转移酶(nmnat)并使其表达,增强由nmn转换成nad的效率来实现合成。
另外,基于本发明的合成系统的nadp的合成,可通过按照与上述同样的步骤向插入有用于nmn合成的一系列基因的宿主微生物中进一步重组导入上述的nmnat、和将nad转换成nadp的nad+激酶并使其表达,增强由nmn转换成nad的效率和由nad转换成nadp的效率来实现合成。
另外,基于本发明的合成系统的nr的合成,可按照与上述同样的步骤向插入有用于nmn合成的一系列基因的宿主微生物中进一步重组导入将nmn转换成nr的烟酰胺单核苷酸-5-核苷酸酶(nmnn)并使其表达,增强由nmn转换成nr的效率来实现合成。
另外,基于本发明的合成系统的namn的合成,可通过按照与上述同样的步骤向插入有用于nmn合成的一系列基因的宿主微生物中进一步重组导入将nmn转换成namn的烟酰胺核苷酸酰胺酶(nana)并使其表达,增强由nmn转换成namn的效率来实现合成。
根据使用了具有以上构成的本发明的nam衍生物合成系统的方法,与以往的合成生物学的nmn的生产方法相比,可大幅地改善nmn等nam衍生物的生产效率。例如,根据后述的实施例所示的结果可知:在使用了本发明的nam衍生物合成系统的方法中,与以往的基于合成生物学方法的nmn的产量相比,生产超过10倍的量的nmn。另外,在使用了本发明的nam衍生物的合成系统的方法中,副产物减少,nmn等nam衍生物的选择性也优异。
[ii.酶]
接下来,对本发明中使用的参与nam衍生物的生产的酶进行说明。
需要说明的是,在本公开中,2个氨基酸序列的“相似性”是指在比对两个氨基酸序列时在各对应位点同一或类似的氨基酸残基出现的比率,2个氨基酸序列的“同一性”是指在比对两个氨基酸序列时在各对应位点同一的氨基酸残基出现的比率。
需要说明的是,2个氨基酸序列的“相似性”和“同一性”例如可利用emboss程序包(emboss:theeuropeanmolecularbiologyopensoftwaresuite,rice等人,2000,trendsgenet.16:276-277)(优选5.00版或其以后)的needle程序,采用needleman-wunsch算法来确定(needlemanandwunsch,1970,j.mol.biol.48:443-453)。
另外,作为类似的氨基酸,例如可列举:在以下记载的基于结构/特性/侧链的种类等的分类中属于同一组的氨基酸。
芳族氨基酸:f、h、w、y;
脂肪族氨基酸:i、l、v;
疏水性氨基酸:a、c、f、h、i、k、l、m、t、v、w、y;
带电氨基酸:d、e、h、k、r等:
带正电的氨基酸:h、k、r;
带负电的氨基酸:d、e;
极性氨基酸:c、d、e、h、k、n、q、r、s、t、w、y;
小型氨基酸:a、c、d、g、n、p、s、t、v等:
超小型氨基酸:a、c、g、s;
具有脂肪族侧链的氨基酸:g、a、v、l、i;
具有芳族侧链的氨基酸:f、y、w;
具有含硫侧链的氨基酸:c、m;
具有脂肪族羟基侧链的氨基酸:s、t;
具有碱性侧链的氨基酸:k、r、h;
酸性氨基酸和它们的酰胺衍生物:d、e、n、q。
(1)催化由nam和prpp合成nmn的酶(nmn合成酶):
作为催化由nam和prpp合成nmn的nmn合成酶(nampt),以往已知有来自各种微生物的各种酶。进而,可适当选择这样的已知的酶进行使用。
在本发明中,优选使用具有优异活性的特定的酶作为nmn合成酶(nampt)。这是由于:若nampt的活性低,则由作为底物的nam和prpp生产nmn的选择率下降。另外,原因还在于:需要生产nmn的时间,受nmn的降解和转换的影响,产量有可能下降。以下,有时将这样的高活性的nmn酶适当称为“本发明的nmn合成酶”。但本发明中可使用的nmn合成酶(nampt)并不限于以下。
具体而言,本发明的nmn合成酶(nampt),其由nam转换成nmn的效率(nampt转换效率)与人nampt的nampt转换效率相比通常为5倍以上、其中优选为7倍以上、进一步优选为9倍以上。如后述的[实施例]的栏中所示,根据本发明人的研究,在表达转换效率为2倍或3倍的nampt的菌体中,与表达人nampt的菌体同样地没有确认到nmn的生产,但在表达转换效率为6倍的nampt的菌体中,与表达人nampt的菌体相比确认到nmn的生产显著增加。
作为测定nampt的nampt转换效率的方法的具体例子,例如可列举以下的方法。即,在prsfduet-1中插入有用于表达nampt的基因,将所得质粒转化到大肠杆菌(escherichiacoli:以下适当记作“e.coli”。)bl21(de3)株中而制作构建株,并接种(植菌)在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行16小时的培养。将30ml培养液转移到50ml的锥形管中,在3000g下离心分离5分钟,回收菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收菌体。实施该操作2次。回收菌体用15ml细胞裂解缓冲液(mbl公司制造)进行悬浮,按照通常推荐的方法调制菌体裂解液(lysate)。使用蛋白测定bradford试剂(和光纯药(株)制造)测定菌体裂解液的od595,用水稀释菌体裂解液使od595为0.1。以该稀释液作为nampt溶液,依据cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的一步测定法来测定nampt活性。在测定中可使用spectramaxrid3多功能酶标仪(moleculardevices公司制造)等。本发明中,在30℃下每5分钟测定450nm的吸光度直到60分钟为止,选择斜率达最大值的3点的吸光度,将所得斜率定义为nampt转换效率。
然而,nampt转换效率的测定方法并不限于上述的具体例子,只要是给予同等的值的方法,也可采用其他的评价方法。
其中,本发明的nmn合成酶优选为由下述的多肽构成的酶:即具有seqidno:3或seqidno:6所示的氨基酸序列的多肽、或者具有与其类似的氨基酸序列的多肽。
这里,seqidno:3是来自鞘氨醇盒菌·ci株(sphingopyxissp.c-1)的nampt的氨基酸序列,seqidno:1是编码seqidno:3的nampt的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式实施最优化而制作的、编码seqidno:3的nampt的核苷酸序列一并见seqidno:2。
另外,seqidno:6是来自松噬几丁质菌(chitinophagapinensis)的nampt的氨基酸序列,seqidno:4是编码seqidno:6的nampt的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:6的nampt的核苷酸序列一并见seqidno:5。
具体而言,本发明的nmn合成酶优选由具有下述的氨基酸序列的多肽构成:即相对于seqidno:3或seqidno:6所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
(2)促进烟酸的细胞内摄取的转运蛋白(烟酸转运体):
作为促进nam和/或na(烟酸)的细胞内摄取的转运体(烟酸转运体),以往也已知有来自各种微生物的各种转运蛋白。进而,可适当选择这样的已知的转运蛋白进行使用。
本发明中,优选使用具有优异活性的特定的转运蛋白作为烟酸转运体。这是由于:若烟酸转运体的烟酸摄取效率低,则与prpp反应的nam在细胞内的存在量少,因此由作为底物的nam和prpp生产nmn的选择率下降。另外,原因还在于:需要生产nmn的时间,受nmn的降解和转换的影响,产量有可能下降。有时将这样的烟酸摄取效率优异的转运蛋白适当称为“本发明的烟酸转运体”。但本发明中可使用的烟酸转运体并不限于以下。
具体而言,本发明的烟酸转运体优选使基于宿主微生物的烟酸和/或烟酰胺的细胞内摄取效率(烟酸摄取效率)与不表达该烟酸转运体的宿主微生物的烟酸摄取效率相比通常增加至1.1倍以上、其中1.2倍以上。若烟酸摄取效率增加,则与不表达烟酸转运体的宿主微生物相比,nam的相应于浓度的细胞内存在量增多,结果是,nmn产量增加。
作为测定烟酸转运体的烟酸摄取效率的方法的具体例子,例如可列举以下的方法。即,在pcdfduet-1中插入有用于依次表达来自大肠杆菌(e.coli)k12的prs、rpib、rpia、gnd、pgl、zwf和pgi的基因,将所得质粒转化到根据大肠杆菌(e.coli)bl21(de3)株构建的、表达nampt转换效率为200以上的nampt的株中而制作构建株,再向该株中转化在pacycduet-1中插入有用于表达烟酸转运体的基因而得的质粒,制作构建株并进行使用。将构建株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行16小时的培养。之后,将培养液转移到50ml的锥形管中,在3000g下离心分离5分钟,回收菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收菌体。实施该操作2次。所回收的菌体用lb培养基进行悬浮使od600为10,加入到100ml三角烧瓶中使达到10ml,向其中装料使烟酰胺为1g/l、d-葡萄糖为0.4g/l、磷酸缓冲液(ph6.2)为0.005mol/l,在30℃、200rpm下进行反应。于从反应起1小时后和2小时后采集反应液,在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收上清。通过hplc分析所回收的这些液体,对nmn量进行定量。使用所得的nmn定量值,通过下述式(1)可求出烟酸转运体的烟酸摄取效率。
[数学式1]
但基于烟酸转运体的烟酸摄取效率的测定方法并不限于上述的具体例子,只要是给予同等的值的方法,也可采用其他的评价方法。
其中,本发明的烟酸转运体优选为由下述的多肽构成的酶:即具有seqidno:9或seqidno:12所示的氨基酸序列的多肽、或者具有与其类似的氨基酸序列的多肽。
这里,seqidno:9是来自洋葱伯克霍尔德菌(burkholderiacenocepacia)的烟酸转运体的氨基酸序列,seqidno:7是编码seqidno:9的烟酸转运体的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:9的烟酸转运体的核苷酸序列一并见seqidno:8。
另外,seqidno:12是来自肺炎链球菌(streptococcuspneumoniae)tigr4株的烟酸转运体的氨基酸序列,seqidno:10是编码seqidno:12的烟酸转运体的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:12的烟酸转运体的核苷酸序列一并见seqidno:11。
具体而言,本发明的烟酸转运体优选由具有下述的氨基酸序列的多肽构成:即相对于seqidno:9或seqidno:12所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
(3)促进nam衍生物的胞外分泌的转运蛋白(nam衍生物转运体):
作为促进nmn合成的产物即nmn、和/或由其衍生而合成的nr或namn等nam衍生物的胞外分泌的转运体(nam衍生物转运体),以往也已知有来自各种微生物的各种转运蛋白。进而,可适当选择这样的已知的转运蛋白进行使用。
本发明中,优选使用具有优异活性的特定的转运蛋白作为nam衍生物转运体。这是由于:若基于nam衍生物转运体的nam衍生物的分泌效率低,则nmn在细胞内残留,因此受nmn的降解和转换的影响,产量有可能下降。另外,原因还在于:若基于nam衍生物转运体的nam衍生物的分泌效率高,则所生产的nmn存在于细胞外,因此可期待大幅地简化回收方法。有时将这样的nam衍生物分泌效率优异的转运蛋白适当称为“本发明的nam衍生物转运体”。但本发明中可使用的nam衍生物转运体并不限于以下。
具体而言,本发明的nam衍生物转运体优选使基于宿主微生物的烟酰胺衍生物的胞外分泌效率(nam衍生物分泌效率)与不表达该nam衍生物转运体的宿主微生物的nam衍生物分泌效率相比通常增加至3倍以上、其中5倍以上、进一步为7倍以上。
作为测定基于nam衍生物转运体的nam衍生物分泌效率的方法的具体例子,特别以分泌nmn作为nam衍生物的nam衍生物转运体(nmn转运体)为例,例如可列举以下的方法。即,在pcdfduet-1中插入有用于依次表达来自大肠杆菌(e.coli)k12的prs、rpib、rpia、gnd、pgl、zwf和pgi的基因,将所得质粒转化到根据大肠杆菌(e.coli)bl21(de3)株构建的、表达nampt转换效率为200以上的nampt的株中而制作构建株,再向该株中转化在pacycduet-1中插入有用于表达nmn转运体的基因而得的质粒,制作构建株并进行使用。将构建株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行16小时的培养。之后,将培养液转移到50ml的锥形管中,在3000g下离心分离5分钟,回收菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收菌体。实施该操作2次。所回收的菌体用lb培养基进行悬浮使od600为10,再加入到100ml的三角烧瓶中使达到10ml,向其中装料使烟酰胺为1g/l、d-葡萄糖为0.4g/l、磷酸缓冲液(ph6.2)为0.005mol/l,在30℃、200rpm下进行反应。于反应2小时后采集反应液,1份是在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收上清。另1份未进行冷冻处理,在12000rpm下离心分离3分钟,回收上清。通过hplc来分析所回收的这些液体,对nmn量进行定量。使用所得的nmn定量值,通过下述式(2)可求出nmn转运体的nmn分泌效率。
[数学式2]
另外,在分泌除nmn以外的nam衍生物的nam衍生物转运体的情况下,也可利用基于此的方法求出nam衍生物的分泌效率。
然而,基于nam衍生物转运体的nam衍生物分泌效率的测定方法并不限于上述的具体例子,只要是给予同等的值的方法,也可采用其他的评价方法。
其中,本发明的nam衍生物转运体优选为由下述的多肽构成的酶:即具有seqidno:15所示的氨基酸序列的多肽、或者具有与其类似的氨基酸序列的多肽。
这里,seqidno:15是来自蕈状芽孢杆菌(bacillusmycoides)的nam衍生物转运体(nmn转运体)的氨基酸序列,seqidno:13是编码seqidno:15的nam衍生物转运体的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:15的nam衍生物转运体的核苷酸序列一并见seqidno:14。
具体而言,本发明的nam衍生物转运体优选由具有下述的氨基酸序列的多肽构成:即相对于seqidno:15所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
(4)参与由g6p合成prpp的酶(gpi、gpd、pgl、pgd、rpi和prs):
作为参与由g6p合成prpp的酶、即磷酸葡萄糖异构酶(pgi)、葡萄糖6-磷酸脱氢酶(gpd)、6-磷酸葡萄糖酸内酯酶(pgl)、6-磷酸葡萄糖酸脱氢酶(pgd)、核糖-5-磷酸异构酶(rpi)和磷酸核糖焦磷酸合成酶(prs)(将它们适当地统称为“prpp合成相关酶”。),以往也已知有来自各种微生物的各种酶,还根据各种宿主微生物进行了各种最优化。进而,可适当选择这样的已知的酶进行使用。
以下列举本发明中特别优选使用的prpp合成相关酶的例子。但本发明中可使用的prpp合成相关酶并不限于以下。
作为磷酸葡萄糖异构酶(pgi),是由下述的多肽构成的酶:即具有seqidno:18所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:18是来自大肠杆菌(e.coli)的酶pgi的氨基酸序列,seqidno:16是编码seqidno:18的酶pgi的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:18的酶pgi的核苷酸序列一并见seqidno:17。
具体而言,优选使用由具有下述的氨基酸序列的多肽构成的pgi:即相对于seqidno:18所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
作为葡萄糖6-磷酸脱氢酶(gpd),是由下述的多肽构成的酶:即具有seqidno:21所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:21是来自大肠杆菌(e.coli)的酶zwf的氨基酸序列,seqidno:19是编码seqidno:21的酶zwf的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:21的酶zwf的核苷酸序列一并见seqidno:20。
具体而言,优选使用由具有下述氨基酸序列的多肽构成的gpd:即相对于seqidno:21所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
作为6-磷酸葡萄糖酸内酯酶(pgl),是由下述的多肽构成的酶:即具有seqidno:24所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:24是来自大肠杆菌(e.coli)的酶pgl的氨基酸序列,seqidno:22是编码seqidno:24的酶pgl的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:24的酶pgl的核苷酸序列一并见seqidno:23。
具体而言,优选使用由具有下述氨基酸序列的多肽构成的pgl:即相对于seqidno:24所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
作为6-磷酸葡萄糖酸脱氢酶(pgd),是由下述的多肽构成的酶:即具有seqidno:27所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:27是来自大肠杆菌(e.coli)的酶gnd的氨基酸序列,seqidno:25是编码seqidno:27的酶gnd的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:27的酶gnd的核苷酸序列一并见seqidno:26。
具体而言,优选使用由具有下述氨基酸序列的多肽构成的pgd:即相对于seqidno:27所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
作为核糖-5-磷酸异构酶(rpi),是由下述的多肽构成的酶:即具有seqidno:30或seqidno:33所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:30是来自大肠杆菌(e.coli)的酶rpia的氨基酸序列,seqidno:28是编码seqidno:30的酶rpia的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:30的酶rpia的核苷酸序列一并见seqidno:29。
另外,seqidno:33是来自大肠杆菌(e.coli)的酶rpib的氨基酸序列,seqidno:31是编码seqidno:33的酶rpib的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:33的酶rpib的核苷酸序列一并见seqidno:32。
具体而言,优选使用由具有下述的氨基酸序列的多肽构成的rpi:即相对于seqidno:30或seqidno:33所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
作为磷酸核糖焦磷酸合成酶(prs),是由下述的多肽构成的酶:即具有seqidno:36所示的氨基酸序列的多肽、或具有与其类似的氨基酸序列的多肽。
这里,seqidno:36是来自大肠杆菌(e.coli)的酶prs的氨基酸序列,seqidno:34是编码seqidno:36的酶prs的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:36的酶prs的核苷酸序列一并见seqidno:35。
具体而言,优选使用由具有下述的氨基酸序列的多肽构成的prs:即相对于seqidno:36所示的氨基酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的相似性(优选为同一性)的氨基酸序列。
需要说明的是,不必考虑上述的nmn合成酶、烟酸转运体、nam衍生物转运体、和/或prpp合成酶(gpi、gpd、pgl、pgd、rpi和prs)的来源。即,这些酶和转运体可分别是宿主生物内源性具有的,也可通过基因重组等人为地使对于宿主生物为外源性的酶和转运体表达。
另外,上述的具有高活性的本发明的酶和转运体、特别是本发明的nmn合成酶可在宿主生物内表达后通过提取或分离等常规方法进行回收,还可适合用于酶反应等其他用途。
[iii.载体]
接下来,对用于表达本发明中使用的参与nmn的生产的酶的载体进行说明。
根据本发明的一个方面,制作担载核酸的载体,该核酸编码上述的nmn合成酶、烟酸转运体、nam衍生物转运体、和/或prpp合成酶(gpi、gpd、pgl、pgd、rpi和prs)的氨基酸序列,使用这样的载体将这些酶/转运体导入到宿主生物中。对载体所担载的酶/转运体的组合没有限定。可将各酶/转运体分别担载于个别的载体,也可将两种以上的酶/转运体集中担载于一个载体。
本发明中的载体的一个例子为:担载编码上述本发明的nmn合成酶(nampt)的氨基酸序列的核酸的载体。有时将这样的载体适当称为“本发明的nmn合成酶载体”或“本发明的nampt载体”。
其中,本发明的nmn合成酶载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的nmn合成酶的核酸:即与seqidno:2或seqidno:5所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
本发明中的载体的另一个例子为:担载编码上述本发明的烟酸转运体的氨基酸序列的核酸的载体。有时将这样的载体适当称为“本发明的烟酸转运体载体”。
其中,本发明的烟酸转运体载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的烟酸转运体的核酸:即与seqidno:8或seqidno:11所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
本发明中的载体的另一个例子为:担载编码上述本发明的烟酸转运体的氨基酸序列的核酸的载体。有时将这样的载体适当称为“本发明的nam衍生物转运体载体”。
其中,本发明的nam衍生物转运体载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的nam衍生物转运体的核酸:即相对于seqidno:14所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
本发明中的载体的又一个例子为:担载编码上述的prpp合成酶、具体为gpi、gpd、pgl、pgd、rpi和prs中的1种或2种以上的氨基酸序列的核酸的载体。有时将这样的载体适当统称为“本发明的prpp合成酶载体”。另外,对具体的酶载体赋予与所担载的核酸对应的酶名称,有时适当称为“本发明的gpi酶载体”等。
其中,本发明的gpi载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的gpi的核酸:即与seqidno:17所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
另外,本发明的gpd载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的gpd的核酸:即与seqidno:20所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
另外,本发明的pgl载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的pgl的核酸:即与seqidno:23所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
另外,本发明的pgd载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的pgd的核酸:即与seqidno:26所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
另外,本发明的rpi载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的rpi的核酸:即与seqidno:29或32所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
另外,本发明的prs载体优选担载具有下述的核苷酸序列的核酸作为编码本发明的prs的核酸:即与seqidno:35所示的核苷酸序列具有80%以上、其中85%以上、进一步为90%以上、尤其是95%以上、或96%以上、或97%以上、或99%以上、特别是100%的同一性的核苷酸序列。
需要说明的是,在本公开中,担载两种以上的酶的核酸的载体用斜线隔开酶名称进行表示。例如“gpi/gpd/pgl/pgd/rpi/prs载体”是指担载编码gpi、gpd、pgl、pgd、rpi和prs的氨基酸序列的核酸的载体。
在本公开中,载体只要具有编码对应的酶的氨基酸序列的核酸区(以下,有时适当称为“编码区”。)即可,对其形式没有限定,例如可以是直链状载体,也可以是闭链环状载体。另外,应该被宿主细胞的基因组摄取的dna可一并包含在单一载体中,也可分开包含在多个载体中。
在本公开中,对载体的复制能力也没有特别限定。例如,载体可以是自我复制型载体、即存在于宿主细胞的染色体外、且不依赖染色体复制而独立地进行复制的载体。作为这样的自我复制型载体的例子,可列举:质粒载体、染色体外元件、微型染色体、人工染色体等。这种情况下,载体除了包含编码上述的酶的核酸以外,通常还包含自我复制所必需的功能元件、例如复制起点等。对复制起点的种类没有限定,作为可在大肠杆菌宿主细胞内使用的复制起点的例子,可列举:puc起点、rsf起点、p15a起点、coldf13起点、cole1起点、pbr322起点、pacyc起点、psc101起点、f1起点、m13起点、bac载体的起点、pac载体的起点、和粘粒载体起点等,作为可在酵母宿主细胞内使用的复制起点的例子,可列举:2μ起点、ars等。
或者,本公开中的载体可以是:不具有自我复制能力,若被导入到宿主细胞内则插入到宿主细胞的基因组内、并与宿主基因组一起被复制的载体。这种情况下,应该被宿主细胞的基因组摄取的核酸可一并包含在单一载体中,也可分开包含在多个载体中。作为这样的不具有自我复制能力的载体的例子,可列举:病毒载体、噬菌体载体、粘粒载体、fosmid载体等。
这样的不具有自我复制能力的载体可按照通过同源重组准确地插入到宿主细胞的所期望的染色体内的所期望的位置的方式构成。这种情况下,只要以由一对侧翼序列夹入应该被宿主细胞的基因组摄取的核酸的方式构成即可,该一对侧翼序列具有与该所期望的插入位置的两侧的核苷酸序列互补的核苷酸序列。对各侧翼序列的长度没有特别限定,例如可以是50个碱基以上、或100个碱基以上、或200个碱基以上。在同源重组中,也可使用各种已知的重组酶,可示例:λ噬菌体的red重组酶或rac原噬菌体的rece/rect重组酶等。
或者,这样的不具有自我复制能力的载体可按照通过非同源重组插入到宿主细胞的基因组内的方式构成。这种情况下,只要以由来自土壤杆菌属(agrobacterium)的t-dna的rb序列和lb序列、或各种已知的转座子序列夹入应该被宿主细胞的基因组摄取的核酸的方式构成即可。另外,还可利用基因组编辑技术将所期望的核酸插入到宿主细胞的基因组内。
本发明中的载体除了具有上述的酶的编码区、和自我复制用序列或基因组内插入用序列以外,还可具有具其他功能的核酸区。作为例子,可列举:控制编码区的表达的调控序列、或选择标志基因、多克隆位点等。
作为调控序列,可列举:启动子、核糖体结合序列、增强子、顺式元件、终止子等。作为这样的调控序列,可根据使用的宿主细胞的种类或酶的尺寸等适当选择任意的序列进行使用。对具体例子没有限定,例如可列举以下的调控序列。
作为可在大肠杆菌宿主细胞内使用的启动子的例子,可列举:trp启动子、lac启动子、pl启动子、pr启动子、tac启动子、t7启动子、t5启动子等,作为可在酵母宿主细胞内使用的启动子的例子,可列举:gal1启动子、gal10启动子、热休克蛋白启动子、mfα1启动子、pho5启动子、pgk启动子、gap启动子、adh启动子、aox1启动子等。
可在各种宿主细胞内使用的核糖体结合序列只要是在蛋白开始生物合成时由dna转录的mrna在宿主细胞内可与核糖体结合的核糖体的结合位点即可,可使用任意的已知序列。
作为可在大肠杆菌宿主细胞内使用的终止子的例子,可列举:t7终止子、fd噬菌体终止子、t4终止子、四环素耐性基因的终止子、大肠杆菌trpa基因的终止子等,作为可在酵母宿主细胞内使用的终止子的例子,可列举:pgk1终止子、cyc1终止子、dit1终止子等。
需要说明的是,这些启动子、核糖体结合序列、终止子等调控序列优选以可操作地与上述的酶的编码区进行连接、并在这些调控序列的控制下从上述的编码区表达酶的方式构成。
或者,也可以宿主细胞或载体所具有的启动子、增强子、终止子等调控序列与上述的酶的编码区被可操作地连接的方式构成,以在这些宿主细胞或载体所具有的调控序列的控制下从上述的编码区表达酶的方式构成。
选择标志基因用于确认适当地进行了将载体导入到宿主细胞内或(在不具有自我复制能力的载体的情况下)插入到基因组内而使用。作为这样的选择标志基因,可根据使用的宿主细胞的种类等适当选择任意的序列进行使用。对具体例子没有限定,作为可在大肠杆菌宿主细胞内使用的选择标志的例子,可列举:ampr、tetr、cmr、kmr、spcr、smr、hygr、gmr、rifr、zeocinr、blasticidinr等,作为可在酵母宿主细胞内使用的选择标志的例子,可列举:ura3、trp1、sup4、ade2、his3、leu2、lys2、kanmx、aur1-c、cyh2、can1、pdr4和hphmx等。
需要说明的是,这样的选择标志基因优选以在宿主细胞内适当地表达的方式与启动子、增强子、终止子等调控序列可操作地进行连接,且以可自主表达的盒(cassette)的方式构成。用于表达这样的选择标志基因的调控序列可与用于表达上述的酶的调控序列分开准备,也可使用通用的调控序列。
利用载体进行宿主细胞的转化后,在只有表达选择标志的细胞可存活的选择条件下培养转化细胞,从而可只选择适当地进行了将载体导入到宿主细胞内或(在不具有自我复制能力的载体的情况下)插入到基因组内的转化细胞。
[iv.重组微生物]
接下来,对本发明中用于生产nmn的重组微生物进行说明。
本发明的一个方面涉及表达上述的本发明的nmn合成酶、烟酸转运体、nam衍生物转运体、和/或prpp合成酶(gpi、gpd、pgl、pgd、rpi和/或prs)的重组微生物。有时将这样的酶适当称为“本发明的重组微生物”。
本发明的重组微生物可通过使用上述的本发明的载体转化宿主微生物而得到。对本发明的重组微生物及其宿主微生物的生物种没有特别限定,优选为细菌或真菌。对具体例子没有限定,作为细菌的例子,可列举:埃希氏菌(大肠杆菌)属(escherichia)、葡萄球菌(葡萄球菌)属(staphylococcus)、芽孢杆菌属(bacillus)、假单胞菌属(pseudomonas)、变形杆菌属(proteus)、棒状杆菌属(corynebacterium)、放线菌属(actinomyces)等,优选大肠杆菌(e.coli)等的埃希氏菌(大肠杆菌)属或棒状杆菌属等。另一方面,作为真菌的例子,可列举:酵母、丝状菌等,优选酵母。作为酵母的例子,可列举:酵母属(saccharomyces)、念珠菌属(candida)、耶氏酵母属(yarrowia)、毕赤酵母属(pichia)、克鲁维酵母属(kluyveromyces)等。
需要说明的是,根据宿主微生物的种类,有时具有表达nampt、烟酸转运体、nam衍生物转运体、和/或相当于prpp合成酶的内源性酶的能力。这种情况下,可利用这样的内源性nampt、烟酸转运体、nam衍生物转运体、和/或prpp合成酶进行nmn的生物合成。然而,即使在宿主微生物具有表达nampt、烟酸转运体、nam衍生物转运体、和/或相当于prpp合成酶的内源性酶的能力的情况下,从更高度地表达这些酶/转运体、且提高最终的nam衍生物的生产效率的观点来看,也优选对宿主微生物进行基因重组以使表达这些酶/转运体。
具体而言,根据本发明的一个方案,希望重组微生物以至少表达本发明的nmn合成酶的方式进行基因重组。另外,本发明的重组微生物更优选以表达本发明的nam衍生物转运体和/或烟酸转运体的方式进行基因重组。另外,本发明的重组微生物优选以表达prpp合成酶、具体为gpi、gpd、pgl、pgd、rpi和prs中的至少任一个的方式进行基因重组,更优选以表达其中的任意2个、3个、4个或5个的方式进行基因重组,进一步优选以表达gpi、gpd、pgl、pgd、rpi和prs的全部6个的方式进行基因重组。
另外,通过使本发明的重组微生物增殖而得到的后代只要维持表达上述本发明的nmn合成酶、烟酸转运体、nam衍生物转运体、和/或prpp合成酶的能力,则相当于本发明的重组微生物。
本发明的重组微生物只要具有表达上述本发明的nmn合成酶、烟酸转运体、nam衍生物转运体、和/或prpp合成酶的能力即可,可考虑目标nam衍生物的生产效率而加入各种修饰。
作为这样的修饰的例子,可列举:通过基因重组敲除(knockout)或击倒(knockdown)会导致目标nam衍生物的产生效率下降的各种酶。
例如,在制造目标的nam衍生物为nmn的情况下,上述的将nmn转换成其他各种nam衍生物的酶、具体而言为将nmn转换成nad的烟酰胺/烟酸单核苷酸腺苷酰转移酶(nmnat)、将nmn转换成烟酸单核苷酸(namn)的烟酰胺核苷酸酰胺酶(nana)、将nmn转换成烟酰胺核苷(nr)的烟酰胺单核苷酸-5-核苷酸酶(nmnn)等酶均不需要,这些酶的存在反倒有可能导致nmn的生产效率的下降。因此,优选敲除或击倒这些酶的基因以防止或减少其表达,使所合成的nmn不被转换成其他的nam衍生物。
另外,在制造目标的nam衍生物为除nmn以外的衍生物、例如nad、namn、nr等的情况下,优选(例如,通过从外部导入基因等手段)促进将nmn转换成所期望的nam衍生物的酶的基因,同时敲除或击倒将nmn转换成除其以外的衍生物的酶的基因以防止或减少其表达,使所合成的nmn不被转换成除所期望的nam衍生物以外的nam衍生物。而且,还可使用本发明的菌体所生产的nmn,通过转换成所期望的nam衍生物的酶反应或化学反应来制造。
需要说明的是,在本技术领域已知有各种通过重组敲除或击倒各种酶的基因的方法。
作为其他修饰的例子,可列举:为了促进作为nmn合成反应的反应物的nam的细胞内摄取、或促进所生产的nmn从细胞分泌,可取代上述的烟酸转运体和/或nam衍生物转运体等的重组导入表达,或者,在这些重组导入表达的同时对重组微生物的细胞表面进行物理处理或化学处理或其两者。作为这样的物理处理,并不限于这些,例如可列举:菌体的冷冻处理、干燥处理、超声波处理等方法。作为这样的化学处理,并不限于这些,例如可列举:添加tritonx-100、tritonx-114、np-40、tween-20、tween-80、chaps等表面活性剂、添加醇类或二甲苯等有机溶剂、mn2+限制培养等方法。
[v.nam衍生物的制造方法]
接下来,对使用上述的重组微生物生产nam衍生物的方法进行说明。
本发明的一个方面涉及制造方法,其是用于生产nam衍生物的方法,该制造方法包括:向上述本发明的重组微生物中供给nam,回收通过上述微生物生成的nam衍生物。有时将这样的制造方法适当称为“本发明的nam衍生物的制造方法”。
以下,主要以nam衍生物为nmn、宿主微生物为大肠杆菌的情形为例,对本发明的nam衍生物的制造方法的各种步骤和条件进行说明,但本发明的nam衍生物的制造方法的步骤和条件并不限于以下所说明,可适当加以变更进行实施。
对向本发明的重组微生物中供给nam的方法没有特别限定。例如,只要在培养基中培养本发明的重组微生物的状态下可直接向培养基中加入nam即可。但考虑到nam衍生物的生产效率和回收效率,优选通过离心分离等去除培养基,将所得的本发明的重组微生物另外加入到具有适合于反应的组成的反应液中进行发酵。另外,供给可一并进行,也可连续或断续地进行供给。
对生产nam衍生物时的反应液的组成没有限制,例如只要在用于培养的各种培养基、磷酸缓冲液、磷酸缓冲生理盐水(pbs)等水溶液或水中包含本发明的重组微生物、和成为nam衍生物合成反应的底物的nam作为最少成分即可。但是,为了促进nam衍生物的制造,优选包含成为重组微生物的营养源的葡萄糖、甘油、果糖、淀粉、废糖蜜等有机碳源或碳酸盐等无机碳源、和磷酸二氢钾或磷酸氢二钾等磷酸盐作为磷成分。另外,可适当加入矿物质、氮源、atp等。
作为各种培养基,只要是对nam衍生物的生产没有不良影响的培养基即可,可使用通常已知的合成培养基或天然培养基。
对反应液的成分比率没有限定,例如如下所述。
对本发明的重组微生物的细胞数没有特别限定,但若过少,则成为稀释状态下的反应,故反应有时无法充分进行,若过多,则有时会发生除生产目标nam衍生物以外的副反应。因此,若以在适合于其微生物的波长下测定的光学浓度(od)表示细胞数,则通常od优选为1以上、od更优选为5以上、od进一步优选为10以上。另外,od优选为500以下,od更优选为300以下。例如,在大肠杆菌的情况下,使用在600nm的波长下测定的od。
对nam的浓度没有特别限定,但若浓度低,则微生物内所摄取的nam量变少,因此所期望的反应有时无法显著地进行。另外,若浓度高,则有时会对微生物形成负担。因此,通常为10mg/l以上、其中优选为100mg/l以上、进一步为1000mg/l以上,另外,通常为300g/l以下,其中优选为250g/l以下、进一步为200g/l以下。
对碳源的浓度没有特别限定,若浓度低,则有时在微生物内无法进行足够的代谢。另外,若浓度高,则有时会对微生物形成负担。因此,通常为10mg/l以上、其中优选为50mg/l以上、进一步为100mg/l以上,另外,通常为300g/l以下、其中优选为250g/l以下、进一步为200g/l以下。
对磷成分没有特别限定,但若浓度低,则有时在微生物内无法进行足够的代謝。另外,若浓度高,则有时会对微生物形成负担。因此,通常为0.1mmol/l以上、其中优选为0.5mmol/l以上、进一步为1mmol/l以上,另外,通常为10mol/l以下、其中优选为5mol/l以下、进一步为1mol/l以下。
关于其他的成分,也优选结合所使用的微生物或反应液的成分量而适量加入。
反应液的这些成分可全部同时地进行混合,也可按照任意的顺序逐次地进行混合。例如,可首先混合除本发明的重组微生物和nam以外的成分,调制基本组成的反应液,再向其中加入本发明的重组微生物,在本发明的重组微生物开始细胞活动和增殖的时间点,加入作为反应物的nam,以开始nam衍生物的合成反应。
需要说明的是,只要是在不妨碍nam衍生物合成反应的范围内,则在预培养本发明的重组微生物时所使用的培养基也可多少残留一些而混入在反应液中。
反应液的ph只要适当调节成本发明的重组微生物的最适ph即可,但从重组微生物的耐久性或nam衍生物的稳定性的观点来看,通常为2以上、其中优选为3以上,另外,出于同样的理由,通常为9以下、其中优选为8以下。需要说明的是,为了调节ph,例如可使用碳酸钙、无机或有机的酸、碱溶液、氨、ph缓冲液等ph调节剂。
对生产nam衍生物时的反应条件没有限定,例如如下所述。
反应时的温度只要适当调整成本发明的重组微生物的最适温度即可,但从使反应进行的观点来看,通常为15℃以上、其中优选为20℃以上,另外,从重组微生物的耐久性或nam衍生物的稳定性的观点来看,通常为50℃以下、其中优选为40℃以下。
对反应时的压力也没有特别限定,通常为常压。
反应时的气氛只要选择本发明的重组微生物的最适气氛即可,例如为环境气氛下、需氧性气氛下、低氧气氛下、厌氧性气氛下等。
在反应时可适当对反应液施加振荡或搅拌。
反应时间还根据本发明的重组微生物的种类或反应液的组成、反应条件等而不同,若反应时间过短,则nam衍生物的生产有时无法充分地进行。另外,若反应时间过长,则所产生的nam衍生物有可能发生转换或降解。因此,通常反应0.1小时以上、其中优选0.3小时以上、进一步0.5小时以上,另外,反应时间通常设为120小时以下、其中优选为96小时以下、进一步为72小时以下。
反应方式可根据使用的微生物或反应条件采用通常已知的方法。例如可列举:间歇式、连续间歇式、微流控反应器式、环流反应器式、一次性使用式等。
反应后,回收通过本发明的重组微生物生产的nam衍生物。通常,所生产的nam衍生物会透过本发明的重组微生物的细胞膜而分泌到反应液中,所以只要从反应液中分离/纯化nam衍生物即可。
对分离/纯化的方法没有特别限定,可采用去除菌体、去除发酵培养上清中的杂质、纯化和目标物的回收步骤等常规方法。另外,这些步骤也可单独使用,但优选将2种以上组合进行使用。
去除菌体的步骤可采用通常已知的方法。具体而言,可列举:离心分离、膜分离等。
去除发酵培养上清中的杂质的步骤可采用通常已知的方法。具体而言,可列举:活性炭处理、过滤(具体而言,包括基于反渗透膜、纳米过滤膜(nanofiltrationmembrane,纳滤膜)、精密过滤膜、超滤膜过滤膜(超滤膜)、精密过滤膜(microfiltrationmembrane,微孔滤膜)等的过滤)处理、离子交换树脂等。
纯化和目标物的回收步骤可采用通常已知的方法。具体而言,可列举:亲和柱色谱、减压浓缩、膜浓缩、冷冻干燥、溶剂提取、蒸馏、用色谱柱进行分离的方法、用离子交换柱进行分离的方法、高效液相色谱(hplc)法、通过重结晶使其析出的方法等。
这些步骤可组合进行使用。例如,可适合采用通过组合离心分离、活性炭处理、离子交换树脂、纳米过滤膜处理、重结晶而进行的分离/纯化等。
对进行分离/纯化时的ph的范围没有特别限定,从nam衍生物的稳定性的观点来看,通常为2以上、其中优选为3以上,另外,通常为9以下、其中优选为8以下的范围。需要说明的是,ph的调节可采用通常已知的方法,例如可使用碳酸钙、无机或有机的酸、碱溶液、氨、ph缓冲液等ph调节剂。
对进行分离/纯化时的温度没有特别限定,作为下限,通常为10℃以上、其中优选为15℃以上、进一步为20℃以上。若低于上述下限,则nam衍生物有时会析出,所期望的分离/纯化步骤变得困难。另一方面,作为上限,通常为50℃以下、其中优选为45℃以下、进一步为40℃以下。若高于上述上限,则nam衍生物有时会降解。然而,在各种分离/纯化步骤中进行加热或冷却的情况下,可暂时偏离上述的适合范围。
对分离/纯化中进行重结晶时的ph没有特别限定,从nam衍生物的稳定性以及结晶化的容易程度的观点来看,优选将ph调节至2~5的范围,更优选将ph调节至2~4的范围。对调节ph时使用的酸没有限定,例如可使用盐酸、磷酸、酒石酸、苹果酸、苯甲酸、乙酸、琥珀酸、葡萄糖酸等酸。其中,可适合地使用盐酸。
需要说明的是,在本发明的重组微生物的细胞内残留有nam衍生物的情况下,可通过均质化、溶菌酶、超声波处理、冷冻融解、弗氏压碎器(frenchpressing)和其他的化学、机械或物理的细胞破坏方法等方法破坏细胞膜,使nam衍生物释放到反应液中,之后供于nam衍生物的分离/纯化。
[vi.其他]
以上,结合具体的实施方式详细地说明了本发明,但本发明并不受上述的实施方式的束缚,在不脱离本发明宗旨的范围内,能够以任意的方式进行实施。
实施例
以下,列举实施例以进一步详细地说明本发明。但本发明并不受以下实施例的束缚,在不脱离本发明宗旨的范围内,能够以按任意的方式进行实施。
[i.测定条件]
・nmn定量:
装置:lcms-2020((株)岛津制作所制造);
检测器:254nm;
柱:tskgelamide-80、3μm、4.6mm×50mm;
柱温:30℃;
注入量:5μl;
流动相:
a:0.1%甲酸水溶液;
b:含0.1%甲酸的乙腈/甲醇(75/25)。
<条件>
流量:1ml/分钟(恒定);
流动相比:0→2分钟(b=98%(恒定))、2→6分钟(b=98→60%)、6→8分钟(b=60→45%)、8→12分钟(b=45→60%)、12→15分钟(b=60→98%);
测定时间:15.1分钟。
定量方法:将nmn标准品用水调制成0g/l、0.01g/l、0.05g/l、0.1g/l、0.25g/l、1g/l、2.5g/l,由通过这些测定得到的nmn面积值制作标准曲线,根据各样品的nmn面积值定量了nmn。需要说明的是,低于0.01g/l视为定量限。
・菌体浓度(od):
装置:uvmini-1240((株)岛津制作所制造);
测定波长:600nm;
比色皿(cell):1.5ml的一次性比色皿(disposablecell)(材质:ps)。
测定方法:用水稀释菌体液使测定值落入0.05至小于1.0的范围内。在比色皿中加入以同样的混合比稀释的1ml培养基,放入装置内进行零点校正,之后将所调制的1ml样品液加入到比色皿中,放入装置内测定od600。
[ii.材料]
・大肠杆菌:
bl21(de3)株(neb公司制造)。
・载体:
prsfduet-1(novagen公司制造);
pcdfduet-1(novagen公司制造);
pacycduet-1(novagen公司制造)。
・合成基因:
来自松噬几丁质菌(chitinophagapinensis)的nampt(烟酰胺磷酸核糖转移酶:nmn合成酶);
来自鞘氨醇盒菌·ci株(sphingopyxissp.c-1)的nampt;
来自智人(homosapiens)的nampt;
来自洋葱伯克霍尔德菌(burkholderiacenocepacia)的niap(烟酸转运体);
来自肺炎链球菌(streptococcuspneumoniae)tigr4株的niax(烟酸转运体);
来自蕈状芽孢杆菌(bacillusmycoides)的pnuc(烟酰胺单核苷酸转运体,ニコチンアミノモノヌクレオチド輸送体);
来自大肠杆菌(e.coli)k12的pgi(磷酸葡萄糖异构酶);
来自大肠杆菌(e.coli)k12的zwf(葡萄糖6-磷酸脱氢酶);
来自大肠杆菌(e.coli)k12的pgl(6-磷酸葡萄糖酸内酯酶);
来自大肠杆菌(e.coli)k12的gnd(6-磷酸葡萄糖酸脱氢酶);
来自大肠杆菌(e.coli)k12的rpia(核糖-5-磷酸异构酶);
来自大肠杆菌(e.coli)k12的rpib(核糖-5-磷酸异构酶);
来自大肠杆菌(e.coli)k12的prs(磷酸核糖焦磷酸合成酶)。
需要说明的是,seqidno:39是来自智人(homosapiens)的nampt的氨基酸序列,seqidno:37是编码seqidno:39的nampt的天然基因的核苷酸序列。需要说明的是,发明人根据该天然基因的核苷酸序列以改善宿主微生物中的表达和作用的方式施行最优化而制作的、编码seqidno:39的nampt的核苷酸序列一并见seqidno:38。
・培养基成分、底物成分:
d-葡萄糖(nakalaitesque(株)制造);
烟酰胺(东京化成工业(株)制造);
pbs((株)nippongene制造);
磷酸缓冲液:调制1m的磷酸二氢钾(nakalaitesque(株)制造)和1m的磷酸氢二钾(nakalaitesque(株)制造),进行混合使达到ph6.2,进行高压釜灭菌而调制。
lb培养基:混合成氯化钠(nakalaitesque(株)制造)为10g/l、胰蛋白胨(nakalaitesque(株)制造)为10g/l、干燥酵母提取物(nakalaitesque(株)制造)为5g/l,进行高压釜灭菌而调制。
m9培养基:混合成磷酸氢二钠(nakalaitesque(株)制造)为48mm、磷酸二氢钾(nakalaitesque(株)制造)为22mm、氯化铵(nakalaitesque(株)制造)为19mm、氯化钠(nakalaitesque(株)制造)为8.6mm,进行高压釜灭菌而调制。
[iii.载体的构建]
・prsf-namptcp的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自松噬几丁质菌(chitinophagapinensis)的nampt的合成基因(seqidno:5),所述引物对分别包含可与用限制酶ncoi和ecori消化处理的prsfduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的prsfduet-1进行连接,得到了prsf-namptcp。
(namptcp用引物对)
・正向引物(seqidno:40):
aggagatataccatgaccaaagaaaacctgattctgctggcagatgca;
・反向引物(seqidno:41):
gctcgaattcggatcttagatggttgcgtttttacggatctgctcaaa。
・prsf-namptssc的构建
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自鞘氨醇盒菌·ci株(sphingopyxissp.c-1)的nampt的合成基因(seqidno:2),上述引物对分别包含可与用限制酶ncoi和ecori消化处理的prsfduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的prsfduet-1进行连接,得到了prsf-namptssc。
(namptssc用引物对)
・正向引物(seqidno:42):
aggagatataccatgaagaatctgattctggccaccgatagctataaa
・反向引物(seqidno:43):
gctcgaattcggatcttaacgaccttcgctacgtttacgaactgcatc
・prsf-nampths的构建
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自智人(homosapiens)的nampt的合成基因(seqidno:38),所述引物对分别包含可与用限制酶ncoi和ecori消化处理的prsfduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的prsfduet-1进行连接,得到了prsf-nampths。
(nampths用引物对)
・正向引物(seqidno:44):
aggagatataccatgaatccggcagcagaagccgaatttaacattctg
・反向引物(seqidno:45):
gctcgaattcggatcttaatgatgtgctgcttccagttcaatgttcag
・pcdf-prs→pgi的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自大肠杆菌(e.coli)k12的pgi、zwf、pgl、gnd、rpia、rpib和prs的各合成基因(seqidno:17、20、23、26、29、32、35),所述引物对分别包含可连接的同源区以及除prs以外与pcdfduet-1相同的rbs区。最初,利用gibsonassembly系统将prs、rpib、rpia和gnd的片段与用限制酶ncoi和saci消化处理的pcdfduet-1进行连接。接下来,将所得载体用限制酶saci进行消化处理,再利用gibsonassembly系统来连接pgl、zwf和pgi的片段,得到了pcdf-prs→pgi。
(pgi用引物对)
・正向引物(seqidno:46):
cgtgatggtcgtagctggaatgaatttgaataaaaggagatataccatgaagaacattaatccgacacag;
・反向引物(seqidno:47):
acttaagcattatgcggccgcaagcttgtcgacctgcaggcgcgccgttaaccacgccaggctttataac。
(zwf用引物对)
・正向引物(seqidno:48):
gtcagggtccgatgtgggttgttgttaatgcacattaaaaggagatataccatggcagttacccagaccg;
・反向引物(seqidno:49):
ttattcaaattcattccagctacg。
(pgl用引物对)
・正向引物(seqidno:50):
agaaggtgtgtttcatacagaatggctggactaaaaggagatataccatgaaacagaccgtgtatattgc;
・反向引物(seqidno:51):
ttaatgtgcattaacaacaaccc。
(gnd用引物对)
・正向引物(seqidno:52):
tggtacaccggatggtgttaaaaccattgtgaaataaaaggagatataccatgagcaaacagcagattgg;
・反向引物(seqidno:53):
cattatgcggccgcaagcttgtcgacctgcaggcgcgccgagctcttagtccagccattctgtatgaaac。
(rpia用引物对)
・正向引物(seqidno:54):
caattaccgcaattgaacagcgtcgcaattaaaaggagatataccatgacccaggatgaactgaaaaaag;
・反向引物(seqidno:55):
ttatttcacaatggttttaacaccatc。
(rpib用引物对)
・正向引物(seqidno:56):
aatgaagaaagcattagcgccatgtttgaacattaaaaggagatataccatgaaaaaaatcgcctttggc;
・反向引物(seqidno:57):
ttaattgcgacgctgttc。
(prs用引物对)
・正向引物(seqidno:58):
attcccctgtagaaataattttgtttaactttaataaggagatataccgtgccggatatgaaactgtttg;
・反向引物(seqidno:59):
ttaatgttcaaacatggcgc。
・pcdf-pgi→prs的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自大肠杆菌(e.coli)k12的pgi、zwf、pgl、gnd、rpia、rpib和prs的合成基因(seqidno:17、20、23、26、29、32、35),所述引物对分别包含可连接的同源区以及除pgi以外与pcdfduet-1相同的rbs区。最初,利用gibsonassembly系统将pgi、zwf、pgl和gnd的片段与用限制酶ncoi和saci消化处理的pcdfduet-1进行连接。接下来,将所得载体用限制酶saci进行消化处理,再利用gibsonassembly系统来连接rpia、rpib和prs的片段,得到了pcdf-pgi→prs。
(pgi用引物对)
・正向引物(seqidno:60):
tcccctgtagaaataattttgtttaactttaataaggagatataccatgaagaacattaatccgacacag;
・反向引物(seqidno:61):
ttaaccacgccaggctttataac。
(zwf用引物对)
・正向引物(seqidno:62):
atggtctgattaatcgttataaagcctggcgtggttaaaaggagatataccatggcagttacccagaccg;
・反向引物(seqidno:63):
ttattcaaattcattccagctacg。
(pgl用引物对)
・正向引物(seqidno:64):
ccgtgatggtcgtagctggaatgaatttgaataaaaggagatataccatgaaacagaccgtgtatattgc;
・反向引物(seqidno:65):
ttaatgtgcattaacaacaaccc。
(gnd用引物对)
・正向引物(seqidno:66):
tcagggtccgatgtgggttgttgttaatgcacattaaaaggagatataccatgagcaaacagcagattgg;
・反向引物(seqidno:67):
cattatgcggccgcaagcttgtcgacctgcaggcgcgccgagctcttagtccagccattctgtatgaaac。
(rpia用引物对)
・正向引物(seqidno:68):
aaggtgtgtttcatacagaatggctggactaaaaggagatataccatgacccaggatgaactgaaaaaag;
・反向引物(seqidno:69):
ttatttcacaatggttttaacaccatc。
(rpib用引物对)
・正向引物(seqidno:70):
ggtacaccggatggtgttaaaaccattgtgaaataaaaggagatataccatgaaaaaaatcgcctttggc;
・反向引物(seqidno:71):
ttaattgcgacgctgttc。
(prs用引物对)
・正向引物(seqidno:72):
aagcaattaccgcaattgaacagcgtcgcaattaaaaggagatataccgtgccggatatgaaactgtttg;
・反向引物(seqidno:73):
tcgacttaagcattatgcggccgcaagcttgtcgacctgcaggcgcgccgttaatgttcaaacatggcgc。
・pacyc-pgi→prs的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自大肠杆菌(e.coli)k12的pgi、zwf、pgl、gnd、rpia、rpib和prs的合成基因(seqidno:17、20、23、26、29、32、35),所述引物对分别包含可连接的同源区以及除pgi以外与pacycduet-1相同的rbs区。最初,利用gibsonassembly系统将pgi、zwf、pgl和gnd的片段与用限制酶ncoi和saci消化处理的pacycduet-1进行连接。接下来,将所得载体用限制酶saci进行消化处理,再利用gibsonassembly系统来连接rpia、rpib和prs的片段,得到了pacyc-pgi→prs。
(pgi用引物对)
・正向引物(seqidno:60:同上);
・反向引物(seqidno:61:同上)。
(zwf用引物对)
・正向引物(seqidno:62:同上);
・反向引物(seqidno:63:同上)。
(pgl用引物对)
・正向引物(seqidno:64:同上);
・反向引物(seqidno:65:同上)。
(gnd用引物对)
・正向引物(seqidno:66:同上);
・反向引物(seqidno:67:同上)。
(rpia用引物对)
・正向引物(seqidno:68:同上);
・反向引物(seqidno:69:同上)。
(rpib用引物对)
・正向引物(seqidno:70:同上);
・反向引物(seqidno:71:同上)。
(prs用引物对)
・正向引物(seqidno:72:同上);
・反向引物(seqidno:73:同上)。
・pacyc-prs→pgi的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自大肠杆菌(e.coli)k12的pgi、zwf、pgl、gnd、rpia、rpib和prs的各合成基因(seqidno:17、20、23、26、29、32、35),所述引物对分别包含可连接的同源区以及除prs以外与pacycduet-1相同的rbs区。最初,利用gibsonassembly系统将prs、rpib、rpia和gnd的片段与用限制酶ncoi和saci消化处理的pacycduet-1进行连接。接下来,将所得载体用限制酶saci进行消化处理,再利用gibsonassembly系统来连接pgl、zwf和pgi的片段,得到了pacyc-prs→pgi。
(pgi用引物对)
・正向引物(seqidno:46:同上);
・反向引物(seqidno:47:同上)。
(zwf用引物对)
・正向引物(seqidno:48:同上);
・反向引物(seqidno:49:同上)。
(pgl用引物对)
・正向引物(seqidno:50:同上);
・反向引物(seqidno:51:同上)。
(gnd用引物对)
・正向引物(seqidno:52:同上);
・反向引物(seqidno:53:同上)。
(rpia用引物对)
・正向引物(seqidno:54:同上);
・反向引物(seqidno:55:同上)。
(rpib用引物对)
・正向引物(seqidno:56:同上);
・反向引物(seqidno:57:同上)。
(prs用引物对)
・正向引物(seqidno:58:同上);
・反向引物(seqidno:59:同上)。
・pacyc-niapbc的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自洋葱伯克霍尔德菌(burkholderiacenocepacia)的niap的合成基因(seqidno:8),所述引物对分别包含可与用限制酶ncoi和ecori消化处理的pacycduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的pacycduet-1进行连接,得到了pacyc-niapbc。
(niapbc用引物对)
・正向引物(seqidno:74):
aggagatataccatgcctgcagcaaccgcacc;
・反向引物(seqidno:75):
gctcgaattcggatcttagcttgctttatctgctgctgttgccggataac。
・pacyc-niaxspt的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自肺炎链球菌(streptococcuspneumoniae)tigr4株的niax的合成基因(seqidno:11),所述引物对分别包含可与用限制酶ncoi和ecori消化处理的pacycduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的pacycduet-1进行连接,得到了pacyc-niaxspt。
(niaxspt用引物对)
・正向引物(seqidno:76):
aggagatataccttgagcggtctgctgtatcacaccagcgtttatgcag;
・反向引物(seqidno:77):
gctcgaattcggatcttagcgacgtttacgcagaactttataaactgcc。
・pacyc-pnucbm的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自蕈状芽孢杆菌(bacillusmycoides)的pnuc的合成基因(seqidno:14),所述引物对分别包含可与用限制酶ncoi和ecori消化处理的pacycduet-1连接的同源区。利用in-fusion克隆法将其与用限制酶ncoi和ecori消化处理的pacycduet-1进行连接,得到了pacyc-pnucbm。
(pnucbm用引物对)
・正向引物(seqidno:78):
aggagatataccatggttcgtagtccgctgtttctgctgattagcagc;
・反向引物(seqidno:79):
gctcgaattcggatcttagatgtagttgttcacgcgttcacgttctttatg。
・prsf-namptcp+pnucbm的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自蕈状芽孢杆菌(bacillusmycoides)的pnuc的合成基因(seqidno:14),所述引物对分别包含可与用限制酶bglii和avrii消化处理的prsf-namptcp连接的同源区。利用in-fusion克隆法将其与用限制酶bglii和avrii消化处理的prsf-namptcp进行连接,得到了prsf-namptcp+pnucbm。
(pnucbm用引物对part2)
・正向引物(seqidno:80):
tattagttaagtataagaaggagatatacaatggttcgtagtccgctgtttctgctgattagcagc;
・反向引物(seqidno:81):
atgctagttattgctcagcggtggcagcagttagatgtagttgttcacgcgttcacgttctttatg。
・pcdf-pgi→prs+nipbc的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自洋葱伯克霍尔德菌(burkholderiacenocepacia)的niap的合成基因(seqidno:8),所述引物对分别包含可与用限制酶bglii和avrii消化处理的pcdf-pgi→prs连接的同源区。利用in-fusion克隆法将其与用限制酶bglii和avrii消化处理的pcdf-pgi→prs进行连接,得到了pcdf-pgi→prs+nipbc。
(niapbc用引物对part2)
・正向引物(seqidno:82):
tattagttaagtataagaaggagatatacaatgcctgcagcaaccgcacc;
・反向引物(seqidno:83):
atgctagttattgctcagcggtggcagcagttagcttgctttatctgctgctgttgccggataac。
・prsf-nampths+pnucbm的构建:
使用下述引物对,通过pcr扩增已将密码子最优化以在大肠杆菌(e.coli)中表达的、来自蕈状芽孢杆菌(bacillusmycoides)的pnuc的合成基因(seqidno:14),所述引物对分别包含可与用限制酶bglii和avrii消化处理的prsf-nampths连接的同源区。利用in-fusion克隆法将其与用限制酶bglii和avrii消化处理的prsf-nampths进行连接,得到了prsf-nampths+pnucbm。
(pnucbm用引物对part2)
・正向引物(seqidno:80:同上);
・反向引物(seqidno:81:同上)。
[iv.生产株的构建]
・bl21/prsf-namptcp株(实施例1)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp,得到了bl21/prsf-namptcp株。
・bl21/prsf-namptssc株的制作:
利用热休克法向bl21(de3)株中导入prsf-namptssc,得到了bl21/prsf-namptssc株。
・bl21/prsf-namptcp/pcdf-prs→pgi株(实施例2、7)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp和pcdf-prs→pgi,得到了bl21/prsf-namptcp/pcdf-prs→pgi株。
・bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pgi→prs株(实施例3)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp和pcdf-prs→pgi与pacyc-pgi→prs,得到了bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pgi→prs株。
・bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株(实施例4、8)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp和pcdf-prs→pgi与pacyc-niapbc,得到了bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株。
・bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株(实施例5、9)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp和pcdf-prs→pgi与pacyc-niaxspt,得到了bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株。
・bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株(实施例6、10)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp和pcdf-prs→pgi与pacyc-pnucbm,得到了bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株。
・bl21/prsf-namptcp+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株(实施例11)的制作:
利用热休克法向bl21(de3)株中导入prsf-namptcp+pnucbm和pcdf-pgi→prs+niapbc与pacyc-prs→pgi,得到了bl21/prsf-namptcp+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株。
・bl21/prsf-nampths株(比较例2)的制作:
利用热休克法向bl21(de3)株中导入prsf-nampths,得到了bl21/prsf-nampths株。
・bl21/prsf-nampths+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株(比较例3)的制作:
利用热休克法向bl21(de3)株中导入prsf-nampths+pnucbm和pcdf-pgi→prs+niapbc与pacyc-prs→pgi,得到了bl21/prsf-nampths+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株。
[v-1.烟酰胺单核苷酸(nmn)的生产1]
・实施例1(使用bl21/prsf-namptcp株的nmn的生产):
将bl21/prsf-namptcp株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时。将培养液加入到装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷(nakalaitesque(株)制造)使其终浓度为0.1mm,在25℃、200rpm下进行了16小时的培养。之后,将培养液转移到50ml锥形管中,在3000g下离心分离5分钟,回收了菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收了菌体。实施了该操作2次。所回收的菌体用lb培养基进行悬浮使od600为10,再加入到100ml三角烧瓶中使达到10ml,向其中装料使烟酰胺为1g/l、d-葡萄糖为0.4g/l、磷酸缓冲液(ph6.2)为0.005mol/l,在30℃、200rpm下进行反应。于2小时后采集反应液,在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收了上清。通过hplc分析所回收的该液体时,nmn量为0.03g/l。
・实施例2(使用bl21/prsf-namptcp/pcdf-prs→pgi株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp/pcdf-prs→pgi株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.18g/l。
・实施例3(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pgi→prs株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pgi→prs株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.22g/l。
・实施例4(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.21g/l。
・实施例5(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.23g/l。
・实施例6(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.36g/l。
・实施例7(使用bl21/prsf-namptcp/pcdf-prs→pgi株的nmn的生产):
除了将烟酰胺由1g/l变更为2g/l、d-葡萄糖由0.4g/l变更为1.0g/l、磷酸缓冲液(ph6.2)由0.005mol/l变更为0.01mol/l以外,与实施例2同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.20g/l。
・实施例8(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株的nmn的生产):
除了将bl21/prsf-namptcp/pcdf-prs→pgi株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株以外,与实施例7同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.31g/l。
・实施例9(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株的nmn的生产):
除了将bl21/prsf-namptcp/pcdf-prs→pgi株变更为bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niaxspt株以外,与实施例7同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.33g/l。
・实施例10(使用bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株的nmn的生产):
除了用m9培养基代替lb培养基来悬浮所回收的菌体使od600为10以外,与实施例6同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.12g/l。
・比较例1(使用bl21(de3)株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21(de3)株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量在定量限以下。
・比较例2(使用bl21/prsf-nampths株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-nampths株以外,与实施例1同样地进行反应,通过hplc分析所回收的液体时,nmn量在定量限以下。
[v-2.烟酰胺单核苷酸(nmn)的生产2]
・实施例11(使用bl21/prsf-namptcp+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株的nmn的生产):
除了将bl21/prsf-namptcp株变更为bl21/prsf-namptcp+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株以外,与实施例1同样地回收了菌体。所回收的菌体用m9培养基进行悬浮使od600为40,加入到100ml三角烧瓶中使达到10ml,向其中装料使烟酰胺为7g/l、d-葡萄糖为21g/l、磷酸缓冲液(ph6.2)为0.05mol/l,在30℃、200rpm下进行反应。于8小时后采集反应液,在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收了上清。通过hplc分析所回收的该液体时,nmn量为6.52g/l。
・比较例3(使用bl21/prsf-nampths+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株的nmn生产):
除了将bl21/prsf-namptcp+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株变更为bl21/prsf-nampths+pnucbm/pcdf-pgi→prs+niapbc/pacyc-prs→pgi株以外,与实施例11同样地进行反应,通过hplc分析所回收的液体时,nmn量为0.04g/l。
[vi.烟酰胺单核苷酸(nmn)的纯化1]
对已预处理的含nmn的500mllb培养基边在400rpm下搅拌边用2小时进行nf膜过滤(synder公司制造、nf-s),并进行膜浓缩至50ml。对所得浓缩液进行整夜的冷冻干燥,从而得到了6.3g含nmn的粗品。将所得粗品溶解于15ml的miliq水中,用0.22μm的滤器过滤后进行hplc制备,从而得到了含nmn的组分(fraction,馏分)(纯度:64.56%)。将含nmn的组分再次冷冻干燥后进行hplc制备,将所得的nmn含量高的组分用1n的hcl调节至ph=3,并进行冷冻干燥,得到了nmn(纯度:>99%)。
・制备条件:
装置:agilentinfinity1200制备hplc;
溶剂:a=100%h2o+0.1%ch3cooh
b=95%mecn/5%h2o+0.1%ch3cooh;
柱:zic-hilic、21.2mmi.d.×150mm、5μm、2根连接;
保护柱:inertsustainamide、7.6mmi.d.×30mm;
柱温:rt℃;
流速:22.0ml/分钟;
检测波长:260、200nm(pda)(在260nm下uv触发制备);
梯度条件:时间(分钟) bsolv.(%)
0.00 84.00
50.0 84.00
50.1 45.00
58.0 45.00
58.1 84.00
65.0 stop(停止);
组分体积:8.0ml。
・分析条件:
装置:岛津it-tof/ms;
溶剂:a=100%h2o+0.1%ch3cooh
b=95%mecn/5%h2o+0.1%ch3cooh;
柱:zic-hilic、4.6mmi.d.×150mm、5.0μm;
柱温:25℃;
流速:1.2ml/分钟;
检测波长:200、260nm(pda);
梯度条件:时间(分钟) bsolv.(%)
0.00 90.00
4.00 90.00
21.0 50.00
25.0 50.00
25.1 90.00
30.0 stop;
雾化器气体流量:1.5ml/分钟;
cdl温度:200℃;
热模块温度(heatblocktemperature):200℃;
检测器电压:1.65kv;
ms检测范围:event1ms100~600
event2ms/ms70~500。
[vii.参考评价]
・nampt转换效率的评价:
将bl21/prsf-namptcp株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行了16小时的培养。将30ml培养液转移到50ml锥形管中,在3000g下离心分离5分钟,回收了菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收了菌体。实施了该操作2次。所回收的菌体用15ml细胞裂解缓冲液(mbl公司制造)进行悬浮,按照通常推荐的方法调制了裂解液。使用蛋白测定bradford试剂(和光纯药(株)制造)测定裂解液的od595,用水稀释裂解液使od595为0.1。以该稀释液作为nampt溶液,按照cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的一步测定法测定了nampt的转换效率。测定中使用了spectramaxrid3多功能酶标仪(moleculardevices公司制造)。结果,nampt的转换效率为230。
接下来,除了将bl21/prsf-namptcp株变更为bl21/prsf-namptssc株以外,同样地操作,测定了nampt的转换效率。结果,nampt的转换效率为170。
作为比较,除了将bl21/prsf-namptcp株变更为bl21(de3)株以外,同样地操作,测定了nampt的转换效率。结果,nampt的转换效率为9。
另外,用水稀释人nampt(使用cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的人nampt)使od595为0.1,以所得的稀释液作为nampt溶液,按照cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的一步测定法测定了nampt的转换效率。结果,nampt的转换效率为22。
・niap的烟酰胺摄取效率的评价:
将bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-niapbc株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行了16小时的培养。之后,将培养液转移到50ml锥形管中,在3000g下离心分离5分钟,回收了菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收了菌体。实施了该操作2次。所回收的菌体用lb培养基进行悬浮使od600为10,再加入到100ml三角烧瓶中使达到10ml,向其中装料使烟酰胺为1g/l、d-葡萄糖为0.4g/l、磷酸缓冲液(ph6.2)为0.005mol/l,在30℃、200rpm下进行反应。于反应1小时后和2小时后采集反应液,在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收了上清。通过hplc分析所回收的这些液体,对nmn量进行定量。结果,niap的烟酰胺摄取效率为81%。
另外,在使用bl21/prsf-namptcp/pcdf-prs→pgi株同样地进行评价时,niap的烟酰胺摄取效率为66%。
・pnuc的烟酰胺单核苷酸分泌效率的评价:
将bl21/prsf-namptcp/pcdf-prs→pgi/pacyc-pnucbm株接种在装有5mllb培养基的试管中,在37℃、200rpm下培养了12小时,之后将培养液接种在装有200mllb培养基的500ml三角烧瓶中使od600为0.03,在37℃、200rpm下进行培养,在od600为0.4的时间点添加异丙基-β-硫代半乳糖吡喃糖苷使其终浓度为0.1mm,在25℃、200rpm下进行了16小时的培养。之后,将培养液转移到50ml锥形管中,在3000g下离心分离5分钟,回收了菌体。再加入1×pbs进行洗涤,在3000g下离心分离5分钟,回收了菌体。实施了该操作2次。所回收的菌体用lb培养基进行悬浮使od600为10,再加入到100ml三角烧瓶中使达到10ml,向其中装料使烟酰胺为1g/l、d-葡萄糖为0.4g/l、磷酸缓冲液(ph6.2)为0.005mol/l,在30℃、200rpm下进行反应。于反应2小时后采集反应液,其中1份在-30℃下冷冻后使其溶解,在12000rpm下离心分离3分钟,回收了上清。另1份未进行冷冻处理,在12000rpm下离心分离3分钟,回收了上清。通过hplc分析所回收的这些液体,对nmn量进行定量。结果,pnuc的烟酰胺单核苷酸分泌效率为81%。
另外,在使用bl21/prsf-namptcp/pcdf-prs→pgi株同样地进行评价时,pnuc的烟酰胺单核苷酸分泌效率为11%。
・除nmn以外的nam衍生物的生产:
在含有实施例11中得到的反应8小时后的nmn的反应液中加入腺苷三磷酸(atp)、烟酰胺单核苷酸腺苷酰转移酶1(nmnat1)(使用cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的atp和nmnat1),在30℃下进行反应时,确认到nad+的生成。再加入醇脱氢酶(adh)和乙醇(使用cyclexrnampt比色测定试剂盒第2版(mbl公司制造)的adh和乙醇),在30℃下进行反应时,确认到nadh的生成。
・烟酰胺单核苷酸(nmn)的纯化2:
对通过离心分离去除了菌体的含nmn的lb培养基进行活性炭处理,之后,分离去除活性炭,得到了处理液。进行nf膜过滤以从其处理液中去除高分子量的杂质,再用离子交换树脂处理滤液以去除杂质。接下来,将处理液用nf膜进行浓缩,再对其浓缩液进行离心浓缩,从而得到了含nmn的浓缩液。最终,在含nmn的浓缩液中添加5mol/l的盐酸水溶液调节至ph=3~4,之后适量添加乙醇,进行了重结晶操作。回收所析出的固体,以高纯度得到了nmn的晶体(hplc纯度>95%)。
产业实用性
根据本发明,可有效地生产nmn等nam衍生物。其中,nmn作为各种研究工具或nad的合成中间体、以及药效成分等具有有用性,因此本发明在产业上的价值高。
- 还没有人留言评论。精彩留言会获得点赞!