用于改善抗VEGF抗体对VEGF与VEGF-R1的结合的抑制的方法与流程
本发明涉及了用于调节抗vegf抗体以便提供抗vegf抗体的变体的方法,这些变体表现出对vegf与vegf-r1的结合的改善的抑制;以及由所述方法提供的抗体。
背景技术:
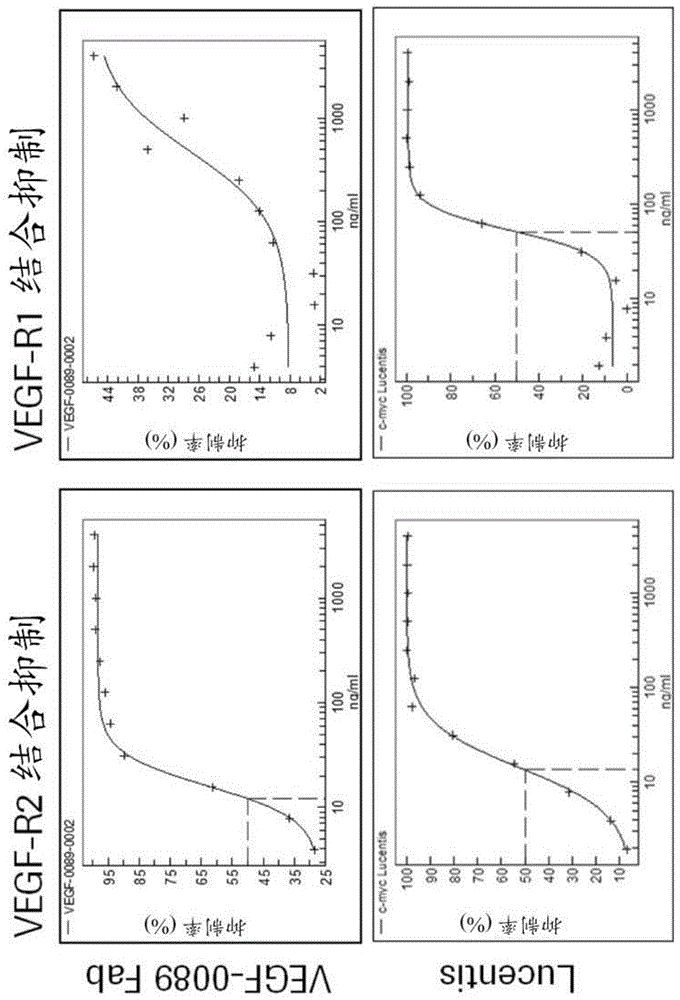
:已获准临床应用的抗vegf抗体(诸如和)抑制vegf与两种受体vegf-r1(flt-1,fms样酪氨酸激酶)和vegf-r2(kdr/flk-1,胎肝激酶)的结合。vegf-r1和vegf-r2是密切相关的受体酪氨酸激酶(rtk)。需要调节抗vegf抗体以使其表现出所需的特征(例如抑制vegf与两种受体的结合)的方法。技术实现要素:本发明涉及一种改善结合vegf的抗体对vegf与vegf-r1的结合的抑制的方法,该抗体包含由vh和vl结构域的同源对形成的抗原结合位点,其中抗体结合至vegf分子中与vegf-r1结合区和vegf-r2结合区重叠的vegf的表位。本发明的方法包括:(a)提供对被结合至vegf的所述抗体的第一抗原结合位点和第二抗原结合位点结合的vegf二聚体的复合物(vegf二聚体-抗体-复合物)的三级结构的分析;(b)鉴别位于所述抗体的vh结构域或vl结构域中的至少一个氨基酸残基,其中在vegf二聚体-抗原-复合物中,第一抗原结合位点内的所述氨基酸残基和第二抗原结合位点内的所述氨基酸残基在空间上紧邻布置;以及(c)将步骤b)中鉴别出的所述至少一个氨基酸残基取代为i)具有较小侧链体积的氨基酸;和/或ii)具有带不同电荷的侧链的氨基酸。借助本发明的方法,可通过其氨基酸序列中(特别是在不参与抗原结合的区域中)的一些修饰来改善由某些抗vegf抗体介导的对vegf与vegf-r1的结合的抑制。在一个实施例中,抗体结合至与vegf-a121的二聚体上的构象性表位相同或重叠的表位,其中vegf-a121包含seqidno:21的氨基酸序列,其中表位包含:vegf二聚体内单个vegf-a121分子中的一个中的氨基酸f17、m18、d19、y21、q22、r23、y25、h27、p28、i29、e30、m55、n62、l66、n100、k101、c102、e103、c104、r105和p106;以及vegf二聚体内单个vegf-a121分子中的另一个中的氨基酸e30、k48、m81和q87。在一个实施例中,表位通过x射线晶体学进行测量。在一个实施例中,具有较小侧链体积的氨基酸在侧链中包含的碳原子数少于在步骤c)中取代的氨基酸的碳原子数。在一个实施例中,具有较小侧链体积的氨基酸选自d、e、s、t、n、g、a、v、i和l。在一个实施例中,具有带正电荷的侧链的氨基酸被具有带负电荷的侧链的氨基酸或具有不带电荷的侧链的氨基酸取代。在一个实施例中,具有带负电荷的侧链的氨基酸被具有带正电荷的侧链的氨基酸或具有不带电荷的侧链的氨基酸取代。在一个实施例中,具有不带电荷的侧链的氨基酸被具有带正电荷的侧链的氨基酸或具有带负电荷的侧链的氨基酸取代。在一个实施例中,所述至少一个经取代的氨基酸残基位于所述抗体的重链可变结构域中。本发明的另一方面是一种由本发明的方法提供的结合至vegf的抗体。本发明的另一方面是一种由本发明的方法提供的结合至vegf并且抑制vegf与vegf-r1的结合的抗体。本发明的另一方面是一种结合至vegf的抗体,该抗体具有包含seqidno:12的vh结构域以及包含seqidno:2的vl结构域。本发明的另一方面是一种结合至vegf的抗体,该抗体具有包含seqidno:15的vh结构域以及包含seqidno:2的vl结构域。附图说明图1:如实例1所述,在抗体fab片段存在下,vegf与vegf-r1和vegf-r2的结合所受到的抑制(vegf:vegf-r2/r1抑制spr)。图2:根据实例2所述,通过x射线晶体学测得的与抗vegf抗体vegf-0089所形成的复合物中的vegf二聚体(紫色)的晶体结构。红色圆圈突出显示了vegf-0089的vh结构域中紧邻的区域。图3:根据实例2所述,通过x射线晶体学测得的vegf-a121的二聚体中被vegf-0089fab片段结合的表位氨基酸(seqidno:21)。与vegf-0089fab片段在的距离内接触的每个vegf-a121分子中包含的氨基酸位置以黑色突出显示。图4:在实例2中测得的与vegf-r1结构域2所形成的复合物中人vegf-a121二聚体以及与vegf-0089fab所形成的复合物中人vegf-a121二聚体的晶体结构叠加图。图5:在实例2中测得的与vegf-r2结构域2和3所形成的复合物中人vegf-a121二聚体以及与vegf-0089fab所形成的复合物中人vegf-a121二聚体的晶体结构叠加图。图6:如实例3所述,在抗vegf抗体存在下,对vegf与vegf-r1的结合的抑制(0.34nmvegf)。图7:如实例3所述,在抗vegf抗体存在下,对vegf与vegf-r1的结合的抑制(0.7nmvegf)。图8:如实例3所述,在抗vegf抗体存在下,对vegf与vegf-r2的结合的抑制(0.34nmvegf)。图9:如实例3所述,在抗vegf抗体存在下,对vegf与vegf-r2的结合的抑制(0.7nmvegf)。具体实施方式1.定义除非本文中另有定义,否则与本发明结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文中另有要求,否则单数术语应包括复数,并且复数术语应包括单数。本公开的方法和技术通常根据本领域中熟知的常规方法进行。通常,与本文所述的生物化学、酶学、分子和细胞生物学、微生物学、遗传学以及蛋白质和核酸化学和杂交相关的术语和技术是本领域熟知和常用的那些。除非本文中另有定义,否则术语“包含”应包括术语“由……组成”。本文的术语“抗体”以最广泛的含义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所需的抗原结合活性即可。木瓜蛋白酶消化完整抗体产生两个相同的抗原结合片段,称为“fab”片段,其各自包含重链可变结构域和轻链可变结构域(分别为vh和vl)以及轻链的恒定结构域(cl)和重链的第一恒定结构域(ch1)。因此,术语“fab片段”是指包括vl结构域和cl结构域的轻链以及包括vh结构域和ch1结构域的重链片段的抗体片段。“经分离的”抗体为已自其自然环境的组分中分离的抗体。在一些实施例中,如通过例如电泳(例如,sds-page、等电聚焦(isoelectricfocusing,ief)、毛细管电泳)或色谱(例如,离子交换或反相hplc)方法测定的,将抗体纯化至大于95%或99%的纯度。关于评估抗体纯度的方法的综述,请参见例如flatman等人,j.chromatogr.b848:79-87(2007)。“抗体片段”是指完整抗体以外的分子,其包含完整抗体的一部分,该部分结合完整抗体所结合的抗原。抗体片段的实例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双体抗体;线性抗体;单链抗体分子(例如,scfv);以及由抗体片段形成的多特异性抗体。术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,其中每个结构域包含四个保守框架区(fr)和三个高变区(hvr)(包括互补决定区(cdr))(参见例如kindt等人,kubyimmunology,第6版,w.h.freemanandco.,第91页(2007))。“互补位”或“抗原结合位点”在本文中可互换使用,是指抗体中识别并且结合抗原的部分。抗原结合位点由来自抗体的重链可变结构域和轻链可变结构域的若干单独的氨基酸残基组成,这些氨基酸残基在fv区的三级结构中在空间上紧邻布置。在一个实施例中,抗原结合位点定义为一组包含在同源vh/vl对中的六个cdr。如本文所用的术语“互补决定区”或“cdr”是指抗体可变结构域中在序列上高变并且含有抗原接触残基的每个区域。通常,抗体包含六个cdr:三个在vh结构域中(cdr-h1、cdr-h2、cdr-h3),且三个在vl结构域中(cdr-l1、cdr-l2、cdr-l3)。除非另有说明,否则可变结构域中的cdr残基和其他残基(例如,fr残基)在本文中根据kabat编号系统(kabat等人,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991))进行编号。出于本文目的的“受体人框架”是这样的框架,其包含来源于如下所定义的人免疫球蛋白框架或人共有框架的轻链可变结构域(vl)框架或重链可变结构域(vh)框架的氨基酸序列。如本文所用的“框架”或“fr”是指除cdr残基以外的可变结构域氨基酸残基。可变结构域的框架通常由以下四个框架结构域组成:fr1、fr2、fr3和fr4。因此,cdr和fr氨基酸序列通常在(a)vh结构域中以如下序列出现:fr1—cdr-h1—fr2—cdr-h2—fr3—cdr-h3—fr4;并且(b)在vl结构域以如下序列出现:fr1—cdr-l1—fr2—cdr-l2—fr3—cdr-l3—fr4。血管内皮生长因子(vegf)是生长因子胱氨酸结家族的同二聚体成员。除非另外指明,否则如本文所使用的术语“vegf”是指来自任何脊椎动物来源的任何天然vegf,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如小鼠和大鼠)。该术语涵盖“全长”、未经处理的vegf,以及在细胞中经过处理产生的任何形式的vegf。该术语还涵盖vegf的天然存在变体,例如剪接变体或等位基因变体。示例性人vegf的氨基酸序列示出于seqidno:18中。如本文所用的术语“vegf二聚体”是指两种相同的vegf分子的同二聚体。由与vegf二聚体结合的两种相同抗体分子形成的复合物在本文中称为“vegf二聚体-抗体-复合物”。vegf二聚体-抗体-复合物中包含的“第一抗原结合位点和第二抗原结合位点”是指包含在vegf二聚体-抗体-复合物中包含的两个抗体中的每一个的vh/vl对中的抗原结合位点。例如,当vegf二聚体-抗体-复合物中两个抗vegf抗体中的一个的抗原结合位点为“第一抗原结合位点”时,两个抗vegf抗体中的另一个的抗原结合位点自动成为“第二抗原结合位点”。vegf通过与细胞表面的酪氨酸激酶受体(vegf受体或“vegfr”)结合来刺激细胞应答,导致它们发生二聚化并且通过转磷酸化活化(尽管位点、时间和程度有所不同)。vegf-r1和vegf-r2是密切相关的受体酪氨酸激酶(rtk)。vegf-a与vegfr-1(flt-1)结合(与vegf-r1的结构域2相互作用),并且与vegfr-2(kdr/flk-1)结合(与vegf-r2的结构域2和3相互作用(见图4和图5)。如本文所用的vegf分子或vegf二聚体的“vegf-r1结合区”和“vegf-r2结合区”分别是指vegf上与vegf-r1的结构域2或与vegf-r2的结构域2和3相互作用的氨基酸。术语“抗vegf抗体”和“结合vegf的抗体”是指这样的抗体,其能够以足够的亲和力结合vegf,使得所述抗体可用作靶向vegf的诊断和/或治疗剂。在一个实施例中,例如通过表面等离子体共振(spr)所测量的,抗vegf抗体与不相关的非vegf蛋白的结合程度小于该抗体与vegf的结合程度的约10%。在某些实施例中,与vegf结合的抗体具有≤1nm或≤0.15nm的解离常数(kd)。当抗体具有1μm或更小的kd时,称该抗体“特异性结合”至vegf。抗vegf抗体与vegf的结合可抑制vegf与其受体(vegf-r1或vegf-r2或两者)的结合。对vegf与vegf-r1或vegf-r2的抑制可通过本领域中已知的方法诸如elisa或spr进行评估。蛋白质的“三级结构”是蛋白质的三维形状。三级结构表现出具有一个或多个蛋白质二级结构的单一多肽链“骨架”,即蛋白质结构域。氨基酸侧链可通过多种方式相互作用和键合。特定蛋白质内侧链的相互作用和键决定了它的三级结构。如本文所用的“vegf二聚体-抗体-复合物的三级结构”意指所述复合物的三维形状。位于vegf二聚体-抗体-复合物的三维结构内的“紧邻”的氨基酸残基为来源于两个抗vegf抗体的氨基酸残基,它们以一定方式在空间上布置在所述复合物的三维形状中,使得它们之间的距离为至多其中不包括在相应的抗vegf抗体的各个结构域(即vh或vl)的氨基酸序列中彼此相邻的氨基酸。“亲和力”是指分子(例如,抗体)的单个结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另有说明,否则如本文所用,“结合亲和力”是指内在结合亲和力,其反映了结合对的成员(例如,抗体和抗原)之间的1:1相互作用。分子x对其配偶体y的亲和力一般可由解离常数(kd)表示。亲和力可以通过本领域已知的常规方法测量,包括本文所述的那些方法。本文将描述用于测量结合亲和力的具体说明性和示例性实施例。术语“表位”表示抗vegf抗体结合的蛋白质或非蛋白质抗原上的位点。表位既可以由连续的氨基酸段形成(线性表位),也可以包含例如由于抗原的折叠(即通过蛋白质抗原的三级折叠)而在空间上接近的非连续的氨基酸(构象性表位)。在蛋白质抗原暴露于变性剂后,线性表位通常仍被抗vegf抗体结合,而构象性表位在用变性剂处理后通常被破坏。表位以独特的空间构象包含至少3个、至少4个、至少5个、至少6个、至少7个,或8-10个氨基酸。可以使用本领域常规的方法来筛选与特定表位结合的抗体(即,与相同表位结合的那些抗体),所述方法为诸如但不限于丙氨酸扫描、肽印迹(参见meth.mol.biol.248(2004)443-463)、肽切割分析、表位切除、表位提取、抗原的化学修饰(参见prot.sci.9(2000)487-496)和交叉阻断(参见“antibodies”,harlow和lane(coldspringharborpress,coldspringharb.,ny)。基于抗原结构的抗体谱分析(asap)(也称为修饰辅助谱分析(map))允许基于来自与vegf特异性结合的大量单克隆抗体的每一种抗体与经化学修饰或酶修饰的抗原表面的结合谱来对该大量单克隆抗体进行分箱(参见例如us2004/0101920)。每个箱中的抗体与相同表位结合,该表位可以是与另一个箱所代表的表位明显不同或部分重叠的独特表位。竞争性结合也可用于容易地确定抗体是与vegf的相同表位结合还是与参考抗vegf抗体竞争结合。例如,与参考抗体“与相同表位结合的抗体”所指的抗体在竞争测定中将参考抗vegf抗体与其抗原的结合阻断达50%或更多,并且相反地,在竞争测定中参考抗体将该抗体与其抗原的结合阻断达50%或更多。同样例如,为了确定抗体是否与参考抗vegf抗体结合相同表位,使参考抗体在饱和条件下与vegf结合。在去除过量的参考抗vegf抗体后,评估所讨论的抗vegf抗体与vegf结合的能力。如果在参考抗vegf抗体饱和结合后该抗体能够与vegf结合,则可以得出结论,所讨论的抗vegf抗体结合与参考抗vegf抗体不同的表位。但是,如果所讨论的抗vegf抗体在参考抗vegf抗体饱和结合后不能与vegf结合,则所讨论的抗vegf抗体可能与参考抗vegf抗体所结合的表位相同的表位结合。可以使用常规实验(例如,使用elisa、ria、表面等离子体共振、流式细胞术,或在本领域中可得的任何其他定量或定性抗体结合测定进行的肽突变和结合分析)来确认所讨论的抗体是与相同表位结合还是只是由于空间原因而被阻碍无法结合。此测定应以两种设置进行,即两种抗体均为饱和抗体。如果在这两种设置中,只有第一(饱和)抗体能够结合vegf,则可以得出结论,所讨论的抗vegf抗体和参考抗vegf抗体竞争结合vegf。在一些实施例中,如果如在竞争结合测定中所测量,1倍、5倍、10倍、20倍或100倍过量的一种抗体抑制另一种抗体的结合达至少50%、至少75%、至少90%或甚至99%或更高,则认为两种抗体与相同或重叠的表位结合(参见例如,junghans等人,cancerres.50(1990)1495-1502)。在一些实施例中,如果抗原中减少或消除一种抗体的结合的基本上全部氨基酸突变还减少或消除另一种抗体的结合,则这两种抗体被视为与相同表位结合。如果减少或消除一种抗体的结合的氨基酸突变中仅有子集减少或消除另一种抗体的结合,则这两种抗体被视为具有“重叠的表位”。“经分离的”核酸是指已自其自然环境的组分中分离的核酸分子。分离的核酸包括这样的核酸分子,其包含在通常含有所述核酸分子的细胞中,但所述核酸分子存在于染色体外或与其天然染色体位置不同的染色体位置处。“编码抗体的分离的核酸”是指编码抗体重链和轻链(或其片段)的一个或多个核酸分子,包括在单一载体或单独的载体中的此类核酸分子,以及存在于宿主细胞中一个或多个位置的此类核酸分子。如本文所用的术语“载体”是指能够载运与其相连的另一核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及整合入其已被引入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作链接的核酸的表达。此类载体在本文中称为“表达载体”。术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指外源核酸已被引入其中的细胞,包括此类细胞的子代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和来源于所述原代转化细胞的子代,不考虑传代次数。子代可能不与亲本细胞的核酸内容物完全一致,而是可能含有突变。本文包括如在原始转化细胞中筛选或选择的具有相同功能或生物学活性的突变子代。可根据共同的侧链特性将氨基酸分组:(1)疏水性侧链:正亮氨酸、met(m)、ala(a)、val(v)、leu(l)、ile(i);不带电荷的亲水性侧链(在本领域也称为“中性”亲水性侧链):cys(c)、ser(s)、thr(t)、asn(n)、gln(q);带负电荷的侧链(在本领域也称为“酸性”侧链):asp(d)、glu(e);带正电荷的侧链(在本领域中也称为“碱性”侧链):his(h)、lys(k)、arg(r);芳香族侧链:trp(w)、tyr(y)、phe(f);以及包含影响链取向的残基的侧链:gly(g)、pro(p)。当提及氨基酸修饰时,“具有较小侧链体积”的氨基酸是指侧链体积小于位于待修饰位置的原始氨基酸的氨基酸。在某些实施例中,具有较小侧链体积的氨基酸在侧链中包含的碳原子数少于待修饰位置的原始氨基酸的碳原子数。2.具体实施方式本发明涉及一种改善结合vegf的抗体对vegfvegf-r1的结合的抑制的方法,该抗体包含由vh和vl结构域的同源对形成的抗原结合位点,其中抗体结合至vegf分子中与vegf-r1结合区和vegf-r2结合区重叠的vegf的表位。本发明的方法包括:(a)提供对被结合至vegf的所述抗体的第一抗原结合位点和第二抗原结合位点结合的vegf二聚体的复合物(vegf二聚体-抗体-复合物)的三级结构的分析;(b)鉴别位于所述抗体的vh结构域或vl结构域中的至少一个氨基酸残基,其中在vegf二聚体-抗原-复合物中,第一抗原结合位点内的所述氨基酸残基和第二抗原结合位点内的所述氨基酸残基在空间上紧邻布置;以及(c)将步骤b)中鉴别出的所述至少一个氨基酸残基取代为i)具有较小侧链体积的氨基酸;和/或ii)具有带不同电荷的侧链的氨基酸。本发明的方法用于调节结合至vegf分子中与vegf-r1结合区和vegf-r2结合区重叠的vegf的表位的抗vegf抗体。在一个实施例中,当vegf与vegf-r1结合时,所述表位包含与vegf-r1的结构域2相互作用的氨基酸。在一个实施例中,当vegf与vegf-r1结合时,所述表位包含与vegf-r2的结构域2和3相互作用的氨基酸。在一个实施例中,所述抗vegf抗体结合至表位,该表位与具有seqidno:01的vh和seqidno:02的vl的特征的抗体(如本文所述的抗体vegf-0089)结合的表位重叠。在一个实施例中,所述抗vegf抗体与本文所述的抗体vegf-0089结合至相同的表位,如通过x射线晶体学所测得的。在一个实施例中,所述抗vegf抗体与抗体vegf-0089结合至相同的表位,如本文所述,如实例3中所述的通过x射线晶体学所测得的。在一个实施例中,所述表位为vegf-a121的二聚体内的构象性表位,其中vegf-a121包含seqidno:21的氨基酸序列,其中表位包含:vegf二聚体内单个vegf-a121分子中的一个中的氨基酸f17、m18、d19、y21、q22、r23、y25、h27、p28、i29、e30、m55、n62、l66、n100、k101、c102、e103、c104、r105和p106;以及vegf二聚体内单个vegf-a121分子中的另一个中的氨基酸e30、k48、m81和q87。根据seqidno:21所示的vegf-a121氨基酸序列中氨基酸的位置进行编号(另见图6)。在本发明的方法内,提供了对vegf二聚体-抗体-复合物的三级结构的分析。三级结构可由本领域已知的方法提供。在一个实施例中,三级结构由x射线晶体学提供(如本文的实例3中所述)。在本发明的方法中,鉴别出所述抗体的vh结构域和/或vl结构域中在vegf二聚体-抗体-复合物内紧邻的氨基酸残基。在一个实施例中,“紧邻”是指距离为或更小。在一个实施例中,“紧邻”是指距离为或更小。该至少一个氨基酸残基被视为适于修饰。在一个实施例中,在步骤(b)中鉴别出的此类至少一个氨基酸残基位于所述抗体的重链可变结构域中。在一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的重链cdr内。在一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的h-cdr2内。在一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的重链fr内。在一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的h-fr3内。在本发明的方法中,此类氨基酸残基被相比于待改善的抗vegf抗体中包含的氨基酸残基具有较小侧链体积的氨基酸取代。替代性地,此类氨基酸残基被具有带不同电荷的侧链的氨基酸取代。在某些实施例中,在本发明的方法的步骤(c)中,多于一个氨基酸残基被取代。在这种情况下,此类至少两个氨基酸残基可彼此独立地被具有较小侧链体积的氨基酸或具有带不同电荷的侧链的氨基酸取代。在一个实施例中,所述具有较小侧链体积的氨基酸选自d、e、s、t、n、g、a、v、i和l。在一个实施例中,氨基酸被具有带不同电荷的侧链的氨基酸取代。在一个实施例中,选自r、k和h的氨基酸被选自d和e的氨基酸取代。在一个实施例中,选自r、k和h的氨基酸被选自c、s、t、n和q的氨基酸取代。在一个实施例中,选自e和d的氨基酸被选自k、r和h的氨基酸取代。在一个实施例中,选自e和d的氨基酸被选自c、s、t、n和q的氨基酸取代。在一个实施例中,选自c、s、t、n和q的氨基酸被选自k、r和h的氨基酸取代。在一个实施例中,选自c、s、t、n和q的氨基酸被选自e和d的氨基酸取代。在一个实施例中,步骤a)的所述抗vegf抗体结合至人vegfa。在一个实施例中,步骤a)的所述抗vegf抗体结合至seqidno:18的人vegf。在一个方面,通过本发明的方法改善的抗vegf抗体包含:(a)cdr-h1,其包含seqidno:03的氨基酸序列;(b)cdr-h2,其包含seqidno:04的氨基酸序列;(c)cdr-h3,其包含seqidno:05的氨基酸序列;(d)cdr-l1,其包含seqidno:06的氨基酸序列;(e)cdr-l2,其包含seqidno:07的氨基酸序列;以及(f)cdr-l3,其包含seqidno:08的氨基酸序列。包含这组cdr氨基酸序列的一个示例性抗体是本文中称为“vegf-0089”的抗性。在一个实施例中,所述抗体的特征在于包含seqidno:01的vh和包含seqidno:02的vl。在这一方面的一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的h-cdr2内。在一个实施例中,所述至少一个氨基酸残基具有kabat位置52a。在一个实施例中,来自kabat位置52a的氨基酸残基通过被c、s、t、n或q取代来修饰。在一个实施例中,步骤c)包括n52as取代。在这一方面的一个实施例中,在步骤(b)中鉴别出的该至少一个氨基酸残基位于所述抗体的h-fr3内。在一个实施例中,所述至少一个氨基酸残基选自kabat位置72、74和75。在一个实施例中,kabat位置72、74和75的一个、两个或三个氨基酸经过修饰。在一个实施例中,kabat位置72通过被k、r、h、c、s、t、n或q取代来修饰。在一个实施例中,kabat位置72通过被n取代来修饰。在一个实施例中,kabat位置74通过被a取代来修饰。在一个实施例中,kabat位置75通过被d、e、c、s、t、n或q取代来修饰。在一个实施例中,kabat位置75通过被d或e取代来修饰。在本发明的一个实施例中,在步骤(c)之后,该方法包括步骤(d),在该步骤中,比较vegf与包含在步骤(c)中引入的取代的抗vegf抗体以及不包含所述取代的抗vegf抗体(即亲本抗vegf抗体)的vegf-r1的结合。本发明还涉及由本发明的方法提供的抗vegf抗体。本发明进一步涉及由本发明的方法提供的结合至vegf并且抑制vegf与vegf-r1的结合的抗vegf抗体。在一个实施例中,由本发明的方法提供的抗体为分离的抗体。此类抗vegf抗体可使用本领域中已知的重组方法(例如us4,816,567中所述,如实例1中所述在真核细胞诸如hek293细胞中的重组表达)来生产。对于这些方法,提供了编码抗体的一种或多种分离的核酸。在某些实施例中,本文提供的抗体为抗体片段。在一个实施例中,抗体片段是fab、fab'、fab'-sh或f(ab')2片段,特别是fab片段。在某些实施例中,本文提供的抗体为全长抗体。在一个实施例中,抗体为igg1抗体。本发明进一步涉及编码由本发明的方法提供的抗vegf抗体的核酸。本发明进一步涉及包含本发明的核酸的宿主细胞。氨基酸序列描述实例提供以下实例以帮助理解本发明,本发明的真正范围在所附权利要求中阐明。应当理解的是,在不脱离本发明精神的前提下,可以对阐明的程序进行修改。实例1:所生成的人抗vegf抗体(抗vegf-0089)的表征如本文所用的抗体“vegf-0089”来源于roche专有转基因兔,如ep17211032.2中所概述。vegf-0089包含seqidno:01的vh结构域和seqidno:02的vl结构域。对于后续分析,抗体vegf-0089作为fab片段(在本文中称为“vegf-0089fab片段”或简称为“vegf-0089fab”)生成,其具有人vh和vl结构域以及来源于兔的轻链(clκ)和重链(ch1)的恒定结构域。vegf-0089fab片段的重链的氨基酸序列为seqidno:10。vegf-0089fab片段的轻链的氨基酸序列为seqidno:11。为重组表达抗体,将编码vh或vl的pcr产物作为cdna克隆到表达载体中并且瞬时转化到hek-293细胞中。利用如下所述的表面等离子体共振(spr)评估抗体vegf-0089fab片段的vegf结合。通过表面等离子体共振(spr)测定抗体结合亲和力使用标准的胺偶联化学方法,在500-1000共振单位(ru)的表面密度结果将抗his捕获抗体(gehealthcare28995056)固定到s系列传感器芯片c1(gehealthcare29104990)上。使用hbs-p+(10mmhepes,150mmnaclph7.4,0.05%表面活性剂p20)作为运行和稀释缓冲液,将测量温度分别设定为25℃和37℃。将hvegf-a121捕获到表面,所得捕获水平在5ru至35ru的范围内。在120s内注入抗vegf抗体的稀释系列(0.37nm–30nm),以30μl/min的流速监测解离至少600s。通过在60s内注入10mm甘氨酸(ph1.5)使表面再生。通过减去空白注射并通过减去从没有捕获hvegf-a121的对照流通池获得的应答来校正大折射率偏差。使用biacore评估软件内的langmuir1:1结合模型计算速率常数。结果,测得的vegf-0089fab片段的kd为134pm(在25℃的温度)。为进一步表征抗体,评估在vegf-0089fab片段存在下vegf与其受体vegf-r1和vegf-r2的结合所受到的抑制,如下所述:在抗体fab片段存在下,vegf与vegf-r1和vegf-r2结合的抑制(vegf:vegf-r2/r1抑制elisa)用0.25μg/ml生物素化vegf-r1或0.5μg/ml生物素化vegf-r2(内部制得,各25μl/孔,在dpbs(1x)中(pan,#p04-36500))涂布384孔链霉亲和素板(nunc/microcoat#11974998001)。将平板在室温下孵育1h。同时,将浓度为0.7nm的vegf-121-his(内部制得)与不同稀释度(12x1:2稀释步骤,从浓度500nm开始)的抗体一起孵育。该预孵育步骤在384孔pp板(weidmannmedicaltechnology,#23490-101)中在1xosep缓冲液(双蒸水,10x,roche,#11666789001+0.5%牛血清白蛋白级分v,不含脂肪酸,roche,#10735086001+0.05%吐温20)中进行。将平板在室温下孵育1h。用90μl/孔pbst缓冲液(双蒸水,10xpbsroche#11666789001+0.1%吐温20)将涂布有vegf-r1/vegf-r2的链霉亲和素板洗涤3次后,将25μl来自vegf-抗体预孵育板的样品转移至涂布有链霉亲和素的平板上,随后在室温下孵育1h。用90μl/孔pbst缓冲液洗涤3次后,加入在1xosep中的25μl/孔检测抗体(抗hispod,bethyl,#a190-114p,1:12000)。在室温下孵育1h后,用90μlpbst缓冲液将平板洗涤3次。同时将25μltmb(roche,#11835033001)加入所有孔中。在室温下孵育10min后,利用tecansafire2酶标仪在370nm/492nm下检测信号。作为对照并且代表临床中使用的现有技术抗vegf抗体,在相同条件下对(兰尼单抗,包含seqidno:19的重链氨基酸序列和seqidno:20的轻链氨基酸序列)进行评估。结果如图1所示。结果表明,vegf-0089fab片段能够完全阻断vegf与vegf-r2的结合。vegf-0089fab片段不完全阻断vegf与vegf-r1的结合。如图2所示,现有技术抗体能够完全阻断vegf与两种受体(vegf-r2和vegf-r1)的结合。实例2:抗体vegf-0089与vegf二聚体的复合物中的x射线晶体学以及表位测定根据本领域中已知的标准方法,对如上所述的vegf-0089fab片段的晶体结构进行分析。vegf-0089fab片段与vegf-a121的复合物中的x射线晶体学以如下执行:二聚体复合物vegf-a121-vegf-0089fab的复合物形成和纯化。为形成复合物,将vegf-0089fab片段与人vegf-a121(peprotech)以1.1:1的摩尔比混合。在4℃过夜孵育16小时后,利用superdex200(16/600)柱和20mmmes、150mmnacl(ph6.5),经由凝胶过滤层析法对复合物进行纯化。将包含二聚体复合物的级分合并,并且浓缩至1.44mg/ml。二聚体vegf-a121-vegf-0089fab复合物的结晶。初始结晶试验在座滴蒸气扩散装置中在21℃以11.5mg/ml的蛋白质浓度进行。在0.1mtrisph8.5、0.2mliso4、1.26m(nh4)2so4中,晶体在1天内出现。板状晶体在一周内生长至最终尺寸为150μm×100μm×30μm。直接从筛选板上收获晶体,未采取任何进一步优化步骤。数据采集和结构确定。为采集数据,将晶体在加入15%乙二醇(作为冷冻保护剂)的沉淀剂溶液中在100k下快速冷却。使用pilatus6m检测器在swiss光源(villigen,switzerland)的光束线x10sa,在波长下采集衍射数据。利用xds(kabsch,w.actacryst.d66,133-144(2010))处理数据,并且用sadabs(bruker)进行缩放。晶体属于空间群c2,细胞轴为β=104.54°,并且衍射至分辨率为用phaser(mccoy,a.j,grosse-kunstleve,r.w.,adams,p.d.,storoni,l.c.,和read,r.j.j.appl.cryst.40,658-674(2007)),使用fab片段和vegf的相关内部结构的坐标作为搜索模型,通过分子置换法确定结构。来自ccp4套装(collaborativecomputationalproject,number4actacryst.d50,760-763(1994))和buster(bricogne,g.,blanc,e.,brandl,m.,flensburg,c.,keller,p.,paciorek,w.,roversi,p.,sharff,a.,smart,o.s.,vonrhein,c.,womack,t.o.(2011))的程序。利用buster2.9.5版(英国cambridge:globalphasingltd)对数据进行后续细化。借助coot(emsley,p.,lohkamp,b.,scott,w.g.和cowtan,k.actacrystd66,486-501(2010)),使用不同电子密度手动重建蛋白质。两种结构的数据采集和细化统计汇总于表10中。所有图形显示均使用pymol(delanoscientific,paloalto,ca,2002)完成。表1:数据采集和结构细化统计1括号中的值是指最高分辨率bin。2rmerge=σ|i-<i>|/σi,其中i为强度。3rwork=σ|fo-<fc>|/σfo,其中fo为观察值,并且fc为计算出的结构因子幅值。4rfree基于细化过程中省略总数据的5%计算得出。与人vegf-a121二聚体所形成的复合物中两个vegf-0089fab片段的晶体结构的示意图如图2所示。vegf-a121二聚体中距离在内的氨基酸残基与抗体vegf-0089fab片段形成被vegf-a121二聚体的vegf-0089fab结合的构象性表位。vegf-a121的氨基酸序列为seqidno:21。图3中突出显示了vegf二聚体中两种vegf-a121分子的表位中包含的氨基酸图示。抗体vegf-0089fab与vegf-a121二聚体上的以下表位结合:-vegf二聚体内单个vegf-a121分子中的一个中的氨基酸f17、m18、d19、y21、q22、r23、y25、h27、p28、i29、e30、m55、n62、l66、n100、k101、c102、e103、c104、r105和p106;以及-vegf二聚体内单个vegf-a121分子中的另一个中的氨基酸e30、k48、m81和q87。与vegf-r1结构域2所形成的复合物以及与vegf-0089fab片段所形成的复合物中人vegf二聚体的晶体结构叠加图如图4所示。该叠加图示出本发明的vegf-0089抗体的轻链与vegf-r1的结构域2叠加。与vegf-r2结构域2和3所形成的复合物以及与vegf-0089fab片段所形成的复合物中人vegf二聚体的晶体结构叠加图如图5所示。该叠加图示出本发明的vegf-0089抗体的轻链与vegf-r2的结构域2叠加。因此,x射线数据表明,被vegf-0089抗体结合的表位与vegf中与vegf-r1和vegf-r2结合的区域重叠。从图2所示的vegf二聚体-抗体-复合物的三级结构可以看出,抗体的vh结构域内的两个区域(即h-cdr2和h-fr3)在空间上彼此紧邻。如果一个fab片段已经结合,该结构可能在空间上阻碍第二抗体与vegf二聚体的结合。不受该理论的约束,观察到该抗体不能(完全)阻断vegf与vegf-r1的结合可能源于这种可疑的空间位阻。预计仅一个fab片段而不是两个已结合的fab片段仍然能够与vegf-r1结合,因为已知vegf-r1被vegf以强亲和力结合。值得注意的是,已知vegf-r2被vegf以弱亲和力结合,支持vegf与vegf-r2的结合被vegf-0089阻断的观察结果。实例3:提供vegf-0089的变体基于上述理论,对vegf-0089抗体进行修饰,以便促进两种抗体分子同时与vegf二聚体结合。基于该理论,生成了抗体vegf-0089的以下抗体变体。表1:所生成的候选抗体和对照抗体中的氨基酸序列和氨基酸修饰克隆并且表达抗体的fab片段,如实例1中所述。重链和轻链的氨基酸序列如表2所示。表2:抗vegf抗体的氨基酸序列重链轻链vegf-0089fabseqidno:10seqidno:11vegf-0112fabseqidno:14seqidno:11vegf-p1ad8674fabseqidno:17seqidno:11检测在改善的抗体fab片段存在下vegf与vegf-r1以及vegf-r2的结合,如实例1中所述。对表2中列出的所有抗体fab片段进行检测。结果如图6和图7所示。实例4:vegf-0089的改善的变体的vegf结合亲和力使用如实例1中所述的相同方法,通过spr测定抗体的亲和力。所指示的抗体的结果如表3所示。表3:抗vegf抗体的亲和力25℃的kd[pm]37℃的kd[pm]vegf-0089fab143110vegf-0112fab7485当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1