BTN3A结合蛋白及其用途
btn3a结合蛋白及其用途
背景技术:
1.迄今为止,已经提出了依赖于t细胞调节的各种治疗和疫苗策略;针对ctla
‑
4、pd
‑
1和pd
‑
l1的几种免疫调节抗体已经被全世界多个管理机构批准用于临床使用。尽管这些药物代表了癌症治疗中的主要进步,但对于大部分对目前可用的治疗没有响应的癌症患者群体仍然存在未满足的医疗需求。
2.btn3a1、btn3a2和btn3a3同种型在淋巴细胞和外周血单核细胞(pbmc)上表达。此外,文献和数据库分析表明,btn3a成员在血液来源的各种肿瘤(诸如急性髓性白血病(aml))和实体瘤(诸如乳腺癌、结肠癌、卵巢癌,胃癌和胰腺导管腺癌(pdac))中广泛表达。pdac组织的免疫组织化学分析证实了btn3a在所有测试的肿瘤样品中的表达,而在对照胰腺正常组织中不存在或几乎检测不到。此外,免疫组织化学显示上皮btn3a表达与高度严重上皮卵巢癌患者的较好预后显著相关,且与较高密度的浸润性t细胞相关。
3.此外,对来自具有39个恶性肿瘤的总体生存结果的约18,000例人类肿瘤的表达特征的分析,鉴定肿瘤浸润性γδt细胞(典型地,vγ9vδ2t细胞)为最显著有利的癌症范围预后特征(gentles等,2015)。这些数据已通过最近的研究证实,显示大量肿瘤浸润性vγ9vδ2 t淋巴细胞与结直肠或前列腺腺癌或血液恶性肿瘤患者队列中的有利结果相关(tosolini等,2017)。
4.研究表明,结合靶细胞的抗btn3a抗体触发源自实体瘤的vγ9vδ2t细胞的活化(对于综述,参见blazquez等,2018)。考虑到γδt细胞(典型地,vγ9vδ2 t细胞)对抗肿瘤应答的强大潜力,btn3a
‑
抗体介导的肿瘤细胞的引发和致敏对于vγ9vδ2 t细胞的杀伤成为了治疗癌症(用于实体和血液恶性肿瘤)的有吸引力的和新的治疗机会。
5.专利公开wo2012080351、ep2651441、ep2946791、us20140322235、wo2012080769涉及能够活化或抑制vγ9vδ2 t细胞的细胞溶解功能、细胞因子产生和增殖的抗cd277的各种抗体。
6.特别地,wo2012080769描述了称为诸如mab20.1和7.2的特异性单克隆鼠抗体,其具有活化vγ9vδ2 t细胞的细胞溶解功能、细胞因子产生和增殖的能力,以及它们在治疗癌症和感染病症中的用途。另外,wo2012080769描述了称为mab 103.2的特异性鼠单克隆抗体,其具有抑制vγ9vδ2 t细胞的细胞溶解功能、产生和增殖的相反活性。因此,这类鼠抗体mab 103.2和相应的嵌合的和人源化形式被认为可用于治疗炎性疾病。
7.palakodeti等,2012描述了mab 103.2的scfv片段(journal of biological chemistry,287(39),pages 32780
‑
32790)。
8.发明人如今惊讶地发现,mab 103.2的一些片段,诸如fab或f(ab’)2片段显示出对于btn3a的活化特性,且能够活化vγ9vδ2 t细胞的细胞溶解功能、细胞因子产生和/或增殖。
9.因此,本公开涉及包含mab 103.2的此类活化抗体片段的btn3a结合蛋白及其在制备用于治疗癌症病症的新型药物中的用途,特别是易于用活化γδt细胞(典型地,vγ9vδ2 t细胞)治疗的癌症。
10.发明简述
11.本公开涉及分离的btn3a结合蛋白,其包含至少一种btn3a抗体片段,所述btn3a抗体片段具有:
12.i.重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;和,
13.ii.轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:5或seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3;
14.且其中所述btn3a结合蛋白具有以下特性:
15.i.如通过生物层干涉测量法(bli)技术所测量,其以10nm或更小的k
d
,优选5nm或更小的k
d
结合人btn3a1,和/或,
16.ii.如在cd107脱粒测定中所测量,其在与癌细胞,诸如daudi或skov
‑
3细胞共培养中诱导γδt细胞(诸如vγ9vδ2 t细胞)的活化,其中ec
50
为10nm或更低,优选1nm或更低,和/或,
17.iii.其诱导pbmc中γδt细胞(诸如vγ9vδ2 t细胞)的活化和增殖。
18.在特定的实施方案中,所述btn3a抗体片段包含
19.(i)seq id no:18的重链可变区,和,
20.(ii)seq id no:19的轻链可变区。
21.在可与前述实施方案组合的特定的实施方案中,所述抗btn3a抗体片段选自scfv、fab或(fab)
’2片段。
22.在可与前述实施方案组合的特定的实施方案中,本公开的所述btn3a结合蛋白与btn3a的结合是一价或二价的。
23.在可与前述实施方案组合的特定的实施方案中,本公开的所述btn3a结合蛋白基本上由选自scfv、fab或f(ab)
’2片段的btn3a抗体片段组成,例如其由包含seq id no:18的vh结构域和seq id no:19的vl结构域的scfv组成。
24.在可与前述实施方案组合的特定的实施方案中,所述btn3a结合蛋白是包含与一个或多个其他蛋白质结构域融合的所述btn3a抗体片段的融合蛋白。
25.所述btn3a结合蛋白可用作药物,例如,用于治疗癌症,典型地是易于用γδt细胞(典型地vγ9vδ2 t细胞)治疗的癌症。
26.在可与前述实施方案组合的特定的实施方案中,所述btn3a结合蛋白可用于治疗(i)实体瘤和/或(ii)血液癌症。
27.因此,本公开还涉及药物组合物,其包含与一种或多种药学上可接受的赋形剂、稀释剂或载体组合的如上定义的btn3a结合蛋白,任选地包含其他活性成分。
28.本公开还提供了用于在宿主细胞中重组产生如上定义的btn3a结合蛋白的表达载体,其包含编码所述抗btn3a结合蛋白的一种或多种核酸。
29.在特定的实施方案中,编码所述抗btn3a结合蛋白的所述核酸包含如上定义的所述btn3a抗体片段的重链和轻链的编码序列,典型地为seq id no:18和19。
30.本公开还涉及包含如上定义的表达载体的宿主细胞。
31.此外,本公开的一部分是用于产生如上定义的btn3a结合蛋白的方法,其包括:(i)培养如上定义的宿主细胞,用于通过所述宿主细胞表达所述蛋白质;任选地(ii)纯化所述
蛋白质并配制所述蛋白质。
32.本公开的另一方面涉及用于离体或体内诱导γδt细胞(典型地vγ9vδ2 t细胞)的增殖和/或活化的方法,所述方法包括,任选地在其他btn3a表达细胞,诸如btn3a表达肿瘤细胞的存在下,将有效量的如上定义的btn3a结合蛋白与所述γδt细胞(典型地vγ9vδ2 t细胞)接触。
33.发明详述
34.定义
35.为使本文更容易理解,首先定义某些术语。在整个发明详述中还阐述了其他的定义。
36.如本文所用,术语“btn3a”具有其在本领域中的一般含义且是指人btn3a多肽,其包括seq id no:23的btn3a1、seq id no:24的btn3a2或seq id no:25的btn3a3。
[0037]“多肽”、“肽”和“蛋白质”可互换使用且广泛地指任何长度的氨基酸残基的聚合物,而不考虑修饰(例如,磷酸化或糖基化)。该术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的类似物或模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物。该术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。多肽可被修饰,例如通过添加糖残基以形成糖蛋白质。术语“多肽”、“肽”和“蛋白质”明确地包括糖蛋白质以及非糖蛋白质。在特定的实施方案中,术语“多肽”和“蛋白质”是指可由基因编码并用细胞表达系统(诸如哺乳动物宿主细胞)通过重组方式翻译的任何多肽或蛋白质。
[0038]
本文所用的术语“重组蛋白”包括通过重组方法制备、表达、产生或分离的蛋白质,诸如(a)分离自动物(例如小鼠)的抗体或由其制备的杂交瘤(下文进一步描述),所述动物是人免疫球蛋白基因的转基因的或转染色体的,(b)分离自宿主细胞的蛋白质,所述宿主细胞被转化以表达相应蛋白,例如分离自转染瘤等。
[0039]
本文所用的术语“抗体”是指免疫球蛋白质分子和免疫球蛋白质分子的免疫活性部分,即含有特异性结合抗原的抗原结合位点的分子。
[0040]
在啮齿类和灵长类动物的天然抗体中,两条重链通过二硫键彼此连接,并且每条重链通过二硫键与轻链连接。有两种类型的轻链,λ和κ。存在五种主要重链类别(或同种型),其决定抗体分子的功能活性:igm、igd、igg、iga和ige。每条链含有不同的序列结构域。在典型的igg抗体中,轻链包括两个结构域,一个可变结构域(vl)和一个恒定结构域(cl)。重链包括四个结构域,一个可变结构域(vh)和三个恒定结构域(ch1、ch2和ch3,统称为ch)。轻链(vl)和重链(vh)的可变区决定了对抗原的结合识别和特异性。轻链(cl)和重链(ch)的恒定区结构域赋予重要的生物学性能,诸如抗体链缔合、分泌、跨胎盘转移、补体结合和与fc受体(fcr)的结合。
[0041]
fv片段是免疫球蛋白质fab片段的n
‑
末端部分,并由一条轻链和一条重链的可变部分组成。抗体的特异性在于抗体结合位点和抗原决定簇之间的结构互补性。抗体结合位点由主要来自超变区或互补决定区(cdr)的残基组成。有时,来自非超变区或骨架区(fr)的残基可参与抗体结合位点,或影响总体结构域结构,并由此影响结合位点。互补决定区或cdr指共同决定天然免疫球蛋白质结合位点的天然fv区的结合亲和力和特异性的氨基酸序
列。免疫球蛋白质的轻链和重链各自具有三个cdr,分别命名为l
‑
cdr1、l
‑
cdr2、l
‑
cdr3和h
‑
cdr1、h
‑
cdr2、h
‑
cdr3。因此,抗原结合位点典型地包括六个cdr,包括来自重链和轻链v区中每一个的cdr组。骨架区(fr)是指插入cdr之间的氨基酸序列。因此,轻链和重链的可变区典型地包含以下序列的4个骨架区和3个cdr:fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4。
[0042]
抗体可变区中的残基通常根据kabat等设计的系统编号。该系统在kabat等,1987,sequences of proteins of immunological interest,us department of health and human services,nih,usa中提出(kabat等,1992,下文称为“kabat等”)。在本说明书中使用该编号系统。kabat残基命名并不总是直接对应于seq id序列中氨基酸残基的线性编号。实际的线性氨基酸序列可能含有比在严格kabat编号中更少或更多的氨基酸,其对应于基本可变结构域结构的结构组分(无论是骨架区还是互补决定区(cdr))的截短或插入。通过抗体序列中的同源性残基与“标准”kabat编号序列的比对,可确定给定抗体中氨基酸残基的正确kabat编号。根据kabat编号系统,重链可变结构域的cdr位于31
‑
35号残基(h
‑
cdr1)、50
‑
65号残基(h
‑
cdr2)和95
‑
102号残基(h
‑
cdr3)。根据kabat编号系统,轻链可变结构域的cdr位于24
‑
34号残基(l
‑
cdr1)、50
‑
56号残基(l
‑
cdr2)和89
‑
97号残基(l
‑
cdr3)。
[0043]
如本文所用,术语“抗体片段”,更具体地是指本文公开的抗体的抗原结合结构域。抗体片段包括但不限于fv、fab、f(ab’)2、fab’、dsfv、scfv、sc(fv)2和双抗体、vhh等。如本文所用,术语“k
assoc”或“k
a”意欲是指特定抗体
‑
抗原相互作用的结合速率,而本文所用的术语“k
assoc”或“k
a”意欲是指特定抗体
‑
抗原相互作用的解离速率。
[0044]
本文所用的术语“k
d”意欲是指解离常数,其由k
d
与k
a
的比率(即k
d
/k
a
)获得,并由摩尔浓度(m)表示。抗体的k
d
值可用本领域已知的方法来测定。一种测定蛋白质或抗体k
d
的方法是例如通过用表面等离子体共振,或用生物传感器系统(诸如系统)。通过表面等离子体共振(spr)的简单结合相互作用分析需要将配体固定至传感器芯片表面,随后将目标分析物添加至流过配体表面的缓冲液中。配体和分析物的相互作用通过spr仪器(典型地,系统)测量折射率随时间的变化。由此,可得到结合(k
a
)或解离(k
d
)和平衡解离(k
d
)常数。亲和力,特别是k
d
也可通过系统评估。平台基于生物层干涉测量法(bli)技术。bli技术的原理基于从两个表面——固定化蛋白质层和内部参照层——反射的白光的光学干涉图案。固定在生物传感器尖端表面上的配体与溶液中的分析物间的结合在生物传感器尖端处产生光学厚度的增加,这导致以纳米测量的干涉图案的偏移。波长偏移(δλ)是生物层的光学厚度变化的直接量度,当在一段时间内测量该偏移且将其量值绘制为时间的函数时,可获得经典的缔合/解离曲线。这种相互作用是实时测量的,使得监测结合特异性、缔合速率和解离速率以及浓度。(参见abdiche等2008,也参见结果中的详情)。亲和力测量典型地在25℃下进行。
[0045]
如本文所用,术语“结合特异性”是指抗体以100nm或更小,10nm或更小,5nm或更小的k
d
可检测地结合抗原重组多肽(诸如重组btn3a1多肽)的能力,如通过表面等离振子共振(spr)所测量。例如如实施例中所测定(参见表1、2、4、5和6)或通过生物层干涉测量法(bli)技术所测量的。在一些实施方案中,如通过spr所测量的,抗体以10
‑3pm
‑
100nm,尤其10pm
‑
100nm,尤其10pm
‑
100nm,或10
‑3pm
‑
10nm,尤其1pm
‑
10nm,尤其10pm
‑
10nm,或1pm
‑
5nm,尤其10pm
‑
5nm或100pm
‑
5nm的k
d
结合btn3a1。在其他实施方案中,如通过生物层干涉测量法
(bli)技术所测量的,抗体以10
‑3pm
‑
100nm,尤其10pm
‑
100nm,尤其10pm
‑
100nm,或10
‑3pm
‑
10nm,尤其1pm
‑
10nm,尤其10pm
‑
10nm,或1pm
‑
5nm,尤其10pm
‑
5nm或100pm
‑
5nm的k
d
结合btn3a1。
[0046]“与btn3a以外的抗原交叉反应”的抗体意欲是指,以10nm或更低、1nm或更低、或100pm或更低的k
d
结合btn3a以外的抗原的抗体。“不与特定抗原交叉反应”的抗体意欲是指,以100nm或更大的k
d
,或1μm或更大的k
d
,或10μm或更大的k
d
与该抗原结合的抗体,所述亲和力例如用类似的表面等离子体共振(spr)测量或用生物层干涉测量法(bli)技术测量,如实施例中公开的。在某些实施方案中,这种不与抗原交叉反应的抗体在标准结合测定中表现出对这些蛋白质的基本上不可检测的结合。
[0047]
根据本公开的分离的btn3a结合蛋白是指与btn3a具有结合特异性的蛋白质。btn3a结合蛋白可与其他抗原(诸如来自其他物种的相关btn3a分子)具有交叉反应性。此外,分离的btn3a蛋白可基本上不含其他细胞物质和/或化学物质。
[0048]
短语“识别抗原的抗体”和“对抗原具有特异性的抗体”在本文中与术语“特异性结合抗原的抗体”可互换使用。
[0049]
特异性可进一步表现为,例如,结合特异性抗原的亲和力/亲合力与非特异性结合其他不相关分子(在这种情况下,特异性抗原为btn3a多肽)的亲和力/亲合力的比为约10:1、约20:1、约50:1、约100:1、10,000:1或更大。如本文所用,术语“亲和力”是指抗体与表位结合的强度。典型地,亲和力通过抗体对btn3a1的k
d
值来评估。
[0050]
本公开涉及出人意料的发现,btn3a结合抗体(源自mab 103.2)的某些片段(先前已知其对btn3a的抑制特性)表现出活化特性。此类具有活化特性的片段包括mab 103.2的fab和f(ab’)2片段。本公开还提供了表现出类似活化特性的此类mab 103.2抗体片段的人源化形式。
[0051]
本文所用的“人源化抗体”广泛地包括由具有可变区和恒定区的非人细胞制备的抗体,所述可变区和恒定区已被改变为更接近地类似于由人细胞制备的抗体。例如,通过改变非人抗体氨基酸序列以掺入人种系免疫球蛋白序列中发现的氨基酸。本发明的人源化抗体可包括不由人种系免疫球蛋白序列(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)编码的氨基酸残基,例如在cdr中。
[0052]
在特定的实施方案中,本文所用的术语“人源化抗体”还包括抗体,其中源自另一哺乳动物物种(诸如小鼠)的种系的cdr序列已被移植至人的框架序列上。在其他特定的实施方案中,如本文所用的术语“人源化抗体”还包括抗体,其中seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr2、seq id no:3的h
‑
cdr3、seq id no:4的l
‑
cdr1、seq id no:5或17的l
‑
cdr2和seq id no:6的l
‑
cdr3已被移植至人的框架序列上。
[0053]
如本文所用,术语“活化抗体”是指能够直接或间接诱导效应细胞的免疫功能的抗体,例如诱导促炎、细胞溶解和/或免疫应答。特别地,如本文所用,活化btn3a抗体片段至少具有在与癌细胞(诸如daudi细胞和/或skov
‑
3细胞)的共培养中诱导γδt细胞(典型地vγ9vδ2 t细胞)活化的能力,如在cd107脱粒测定中所测量的,例如如以下实施例中所述,其中ec
50
为10nm或更低,优选1nm或更低,例如0.1nm或更低。因此,根据本技术,ec
50
(半数最大有效浓度)在剂量应答曲线下建立,且表示观察到最大效应(即:活化的vγ9vδ2 t细胞的最大比例)的50%时活化btn3a抗体片段的浓度。如实施例中所示,vγ9vδ2t细胞细胞毒性的评
估通过流式细胞仪评估其膜表面的cd107受体来进行。剂量
‑
反应曲线典型地通过在37℃下在抗体片段存在下与daudi或skov
‑
3细胞共培养4小时后定量cd107阳性vγ9vδ2 t细胞来建立。在一些实施方案中,ec
50
为10
‑4nm
‑
10nm,尤其10
‑4nm
‑
1nm,尤其10
‑4nm
‑
0.1nm,或10
‑3nm
‑
10nm,10
‑3nm
‑
1nm或10
‑3nm
‑
0.1nm。
[0054]
如本文所用,术语“受试者”包括任何人或非人的动物。术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人灵长类、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。
[0055]
根据本技术的抗体片段对增殖和/或活化的作用也可典型地通过将pbmc与所述抗体片段一起孵育来测试。然后典型地通过流式细胞仪跟踪免疫细胞增殖和活化。例如,可用用于体外细胞标记的celltrace violet dye
tm
的染料稀释来追踪若干细胞世代。在37℃下将浓度为60nm(
±
20%)的抗体片段与pbmc孵育5天可典型地导致vγ9vδ2 t细胞的显著增殖(例如导致总vγ9vδ2 t细胞群体的至少20%,尤其是至少30%或35%的增加)。
[0056]
γδt细胞(典型地,vγ9vδ2 t细胞)的活化后,可评估表达活化标志物cd25的vγ9vδ2 t细胞的比例。典型地,观察到表达活化标志物cd25的vγ9vδ2 t细胞的比例显著增加。
[0057]
如本文所用,术语“优化的”是指使用生产细胞或生物体,通常是真核细胞,例如中国仓鼠卵巢细胞(cho)或人细胞中优选的密码子来改变核苷酸序列以编码氨基酸序列。将优化的核苷酸序列工程化以完全或尽可能多地保留由起始核苷酸序列最初编码的氨基酸序列。由优化的核苷酸序列编码的氨基酸序列也称为优化的。
[0058]
如本文所用,考虑到空位的数目和每个空位的长度,两个序列之间的同一性百分比是序列共有的相同位置的数目的函数(即,%同一性=相同位置的数目/位置的总数
×
100),其需要被引入以实现两个序列的最佳比对。如下所述,可使用数学算法完成序列的比较和两个序列之间同一性百分比的确定。
[0059]
可用needleman和wunsch算法(needleman和wunsch)确定两个氨基酸序列之间的同一性百分比。
[0060]
两个核苷酸或氨基酸序列之间的百分比同一性也可用例如算法(诸如emboss needle(配对比对;可于www.ebi.ac.uk))来确定。例如,emboss needle可与blosum62矩阵一起使用,“空位开放罚分”为10,“空位延伸罚分”为0.5,假“末端空位罚分”,“末端空位开放罚分”为10,“末端空位延伸罚分”为0.5。通常,“百分比同一性”是匹配位置的数目除以比较位置的数目并乘以100的函数。例如,如果10个序列位置中的6个在比对后在两个比较序列间是相同的,那么同一性是60%。%同一性通常在进行分析的查询序列的全长上确定。具有相同一级氨基酸序列或核酸序列的两个分子是相同的,与任何化学和/或生物修饰无关。
[0061]
btn3a抗体片段
[0062]
在特定的实施方案中,本公开的btn3a结合蛋白包含至少一种btn3a抗体片段,所述btn3a抗体片段具有:
[0063]
(i)重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;和,
[0064]
(ii)轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:5的l
‑
cdr2和seq id no:6的l
‑
cdr3。
[0065]
在另一个特定的实施方案中,本公开的btn3a结合蛋白包含至少一种btn3a抗体片段,所述btn3a抗体片段具有:
[0066]
(i)重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;和,
[0067]
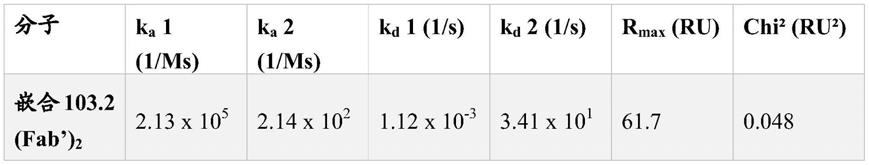
(ii)轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3。
[0068]
在特定的实施方案中,此类btn3a抗体片段基本上不含抗体的fc区,例如,其不包括对应于抗体的ch2和ch3区的fc片段,典型地,其不包括由从238位
‑
243位的氨基酸(用kabat编号)限定的片段。
[0069]
用kabat编号(kabat等,1992,下文称为“kabat等”)描绘本公开的btn3a抗体片段的cdr区。为便于阅读,h
‑
cdr1、h
‑
cdr2、h
‑
cdr3是指vh区的3个cdr,l
‑
cdr1、l
‑
cdr2、l
‑
cdr3指vl区的3个cdr。典型地,所述抗btn3a抗体片段是具有如wo2012/080351公开的mab 103.2的vh和vl的抗体片段,或具有seq id no:1的hcdr1、seq id no:2的h
‑
cdr
‑
2、seq id no:3的h
‑
cdr3、seq id no:4的l
‑
cdr1、seq id no:5或seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3的嵌合的或人源化抗体片段。
[0070]
鼠mab 103.2可从cncm保藏号为i
‑
4403的杂交瘤获得。
[0071]
在优选的实施方案中,所述btn3a抗体片段是scfv、fab或(fab’)2片段,其包含
[0072]
(i)重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;例如,seq id no:7的vh,和,
[0073]
(ii)轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:5的l
‑
cdr2和seq id no:6的l
‑
cdr3;例如,seq id no:8的vl。
[0074]
在优选的实施方案中,所述btn3a抗体片段是scfv、fab或(fab’)2片段,其包含
[0075]
(i)重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;例如,seq id no:18的vh,和,
[0076]
(ii)轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3;例如,seq id no:19的vl。
[0077]
因此,本发明涉及这样的btn3a抗体片段本身,其具有活化特性,即具有以下的有利特性:
[0078]
(i)如通过生物层干涉测量法(bli)技术,或通过表面等离振子共振所测量的,它们以10nm或更小的k
d
,优选5nm或更小的k
d
结合人btn3a1,和
[0079]
(ii)其在与癌细胞(诸如daudi和/或skov
‑
3细胞)共培养中诱导γδt细胞(典型地,vγ9vδ2 t细胞)的活化,如在cd107脱粒测定中所测量的,其中ec
50
为10nm或更低,优选1nm或更低,和/或,
[0080]
(iii)其诱导pbmc中γδt细胞(典型地,vγ9vδ2 t细胞)的活化和增殖。
[0081]
此类活化btn3a抗体片段的实例包括但不限于fab、fab’、fab
’‑
sh、f(ab’)2、fv、unibody和scfv片段、双抗体、单域、vhh或纳米抗体和保留fab或f(ab’)2片段的有利活化特性的其他功能片段。
[0082]
在特定的实施方案中,其为一价抗体片段,诸如fab或fab’。
[0083]
在其他特定的实施方案中,其为二价抗体片段,诸如(fab’)2。
[0084]
在其他特定的实施方案中,其为scfv抗体片段。
[0085]
术语“双抗体”是指具有两个抗原结合位点的小抗体片段,该片段包含与同一条多肽链(vh
‑
vl)中的轻链可变域(vl)连接的重链可变域(vh)。通过用太短以至于不允许同一条链上两个结构域之间配对的接头,这些结构域被迫与另一条链的互补结构域配对并产生两个抗原结合位点。
[0086]
单域抗体或vhh是包含重链可变结构域的全部或一部分的抗体片段,所述重链可变结构域与vh抗体片段相比突变为可溶的。
[0087]
抗体片段可通过多种技术制备,包括但不限于完整抗体的蛋白质水解消化以及通过本文所述的重组宿主细胞产生。
[0088]
优选地,本公开的btn3a抗体片段是嵌合的或人源化抗体片段。典型地,将非人抗体人源化以降低对人的免疫原性,同时具有至少与亲本非人抗体相同或相似的亲和力(或优异的亲和力)。在一些实施方案中,本公开的抗体是wo2012/080351中公开的亲本抗体mab 103.2的人源化抗体片段。
[0089]
通常,人源化抗体包含一个或多个可变结构域,其中cdr(或其部分)源自非人抗体,例如鼠mab 103.2,任选地在一个cdr中具有一个氨基酸取代以降低免疫原性,特别地,在l
‑
cdr2中,诸如seq id no:17的l
‑
cdr2,其中鼠l
‑
cdr2的异亮氨酸被丙氨酸取代,且fr(或其部分)源自具有突变以降低免疫原性的鼠抗体序列。人源化抗体任选还包含人恒定区的至少一部分。
[0090]
在某些实施方案中,具有vh和vl序列的根据本公开的活化btn3a抗体片段可用于通过修饰vh和/或vl序列或与其连接的恒定区来分别产生新的活化btn3a抗体片段。因此,在根据本发明的至少一些实施方案的另一方面,活化抗btn3a抗体片段的结构特征用于产生在结构上相关的活化btn3a抗体片段,所述抗体片段至少保留活化btn3a抗体片段的活化特性。例如,如上讨论,根据本发明的至少一些实施方案,mab 103.2的6个cdr区或其具有seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;seq id no:4的l
‑
cdr1、seq id no:5或seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3的突变形式可与已知的框架区重组组合以产生其他的、重组工程化的活化抗btn3a抗体片段。用于工程化方法的起始材料是具有seq id no:7和seq id no:8的mab 103.2的vh和/或vl序列或具有seq id no:18和seq id no:19的其人源化形式中的一种或多种。
[0091]
改变的抗体的功能特性可用本领域可用的和/或本文所述的标准测定法来评估。在根据本发明的至少一些实施方案的工程化抗体的方法的某些实施方案中,可依据活化抗btn3a抗体片段编码序列的全部或部分随机地或选择性地引入突变,且可对于结合活性和/或其他所需的功能特性(诸如活化特性)筛选所得的经修饰的活化抗btn3a抗体片段。
[0092]
突变方法在本领域中已有描述。例如,short的pct公开wo02/092780描述了用饱和诱变、合成连接装配或其组合产生和筛选抗体突变的方法。或者,lazar等的pct公开wo03/074679描述了用计算筛选方法来优化抗体的生理化学特性的方法。
[0093]
优选地,所述btn3a抗体片段是人源化btn3a抗体片段,其包含:
[0094]
(i)seq id no:18的重链可变区,和,
[0095]
(ii)seq id no:19的轻链可变区。
[0096]
更具体地,本公开涉及人源化btn3a结合抗体片段,所述人源化btn3a结合抗体片
段是scfv片段,所述scfv片段包含
[0097]
(i)seq id no:18的重链可变区,和,
[0098]
(ii)seq id no:19的轻链可变区。
[0099]
上述公开的btn3a抗体片段特别地可用于制备用于治疗癌症和感染性病症的药物的方法中。
[0100]
此类药物特别地包括重组btn3a结合蛋白或双特异性分子,其包含作为btn3a的结合和活化结构域的、上文公开的活化btn3a抗体片段。
[0101]
下文描述了此类btn3a结合蛋白的进一步细节。
[0102]
btn3a结合蛋白
[0103]
本公开的btn3a结合蛋白包含至少一种btn3a结合抗体片段,所述btn3a结合抗体片段具有
[0104]
(i)重链可变区(vh),其包含seq id no:1的h
‑
cdr1、seq id no:2的h
‑
cdr
‑
2和seq id no:3的h
‑
cdr3;和,
[0105]
(ii)轻链可变区(vl),其包含seq id no:4的l
‑
cdr1、seq id no:5或seq id no:17的l
‑
cdr2和seq id no:6的l
‑
cdr3。
[0106]
所述btn3a结合蛋白有利地具有以下特性:
[0107]
(i)如通过表面等离子共振或生物层干涉测量法(bli)技术所测量的,其以10nm或更小的k
d
,优选5nm或更小的k
d
结合人btn3a1,和/或,
[0108]
(ii)其在与癌细胞(诸如daudi或skov
‑
3细胞)的共培养中诱导γδt细胞γδt细胞(典型地vγ9vδ2 t细胞)的活化,如在cd107脱粒测定中所测量的,其中ec
50
为10nm或更低,优选1nm或更低,例如0.1nm或更低,和/或,
[0109]
(iii)其诱导pbmc中γδt细胞(典型地vγ9vδ2 t细胞)的活化和增殖。
[0110]
在特定的实施方案中,对btn3a的结合特异性和关于对btn3a的活化特性基本上由包含在此类btn3a结合蛋白中的所述btn3a抗体片段提供。
[0111]
特别地,在特定的实施方案中,所述btn3a结合蛋白是下式(i)的融合蛋白:
[0112]
ab103.2
‑
l
‑
x(i)
[0113]
其中
[0114]
‑
ab103.2是如前述部分公开的活化btn3a抗体片段,例如scfv或fab片段,
[0115]
‑
l是共价键或接头,典型地,肽接头,
[0116]
‑
x是多肽链。
[0117]
‑
x或
‑
l
‑
x可与ab103.2的至少一条多肽链的n
‑
末端或c
‑
末端融合。
[0118]
‑
x或
‑
l
‑
x也可通过二硫键或其他共价连接与其他多肽键合。
[0119]
在特定的实施方案中,x可选自用于增加蛋白质在血液中的半衰期或稳定性的多肽,诸如fc片段或其他免疫球蛋白衍生片段,或血清白蛋白。
[0120]
如本文所用,术语“融合蛋白”是指通过基因融合获得的重组蛋白,例如通过编码不同蛋白质的单独功能域的至少两个基因片段的遗传融合。例如,本公开的活化btn3a抗体片段的至少重链可变区(vh)的编码区与多肽x的编码区基因融合,且所述活化btn3a抗体片段的相应轻链可变区(vl)由另一编码区单独提供,以获得包含与多肽x融合的fab的融合蛋白。
[0121]
或者,本公开的活化btn3a抗体片段的scfv的编码区与多肽x的编码区基因融合。
[0122]
根据本公开,
‑
x或l
‑
x不是与ab103.2抗体片段连接的抗体的fc区。特别地,本公开表明,具有与相应fab n
‑
末端连接的天然fc区的全长mab 103.2抗体对btn3a具有抑制特性,与显示btn3a活化特性的相应fab区相反。
[0123]
在特定的实施方案中,所述btn3a抗体片段不与免疫球蛋白质fc区的n
‑
末端共价连接,类似于天然全长抗体结构。
[0124]
典型地,当ab103.2是scfv片段,例如包含seq id no:7的vh和seq id no:8的vl或seq id no:18的vh和seq id no:19的vl的scfv片段时,x可以是与scfv片段的n
‑
末端融合的另一条多肽链。
[0125]
双特异性或多特异性分子
[0126]
在另一方面,本文还公开了双特异性或多特异性分子,其包含如前文部分公开的btn3a结合蛋白和/或活化btn3a抗体片段。
[0127]
btn3a结合抗体片段可衍生化或连接至另一功能分子,例如另一肽或蛋白质(例如另一抗体或受体的配体),以产生结合至少两个不同结合位点或靶分子的双特异性分子。实际上,抗体片段可被衍生化或连接到一个以上的其他功能分子,以产生结合至两个以上不同结合位点和/或靶分子的多特异性分子;此类多特异性分子也被如本文所用的术语“双特异性分子”所涵盖。
[0128]
为产生双特异性分子,如上文公开的btn3a结合抗体片段或btn3a结合融合蛋白可功能性连接(例如,通过化学偶联、基因融合、非共价关联或其他方式)至一种或多种其他结合分子,诸如另一种抗体,抗体片段,肽或结合模拟物,如此产生双特异性分子。
[0129]
因此,本公开包括双特异性分子,其包含至少一种对btn3a的第一结合特异性和对第二靶表位的第二结合特异性。
[0130]
双特异性分子形式的实例包括bite、双亲和力再靶向抗体、同二聚体“knob
‑
in
‑
hole”抗体和三功能抗体。对于包含至少一种第一结合特异性的抗体片段的常见双特异性抗体形式的不同结构的综述,参见例如sedykh等的综述,2018(drug design,development and therapy,195
‑
208,特别参见图3)。
[0131]
此外,对于其中双特异性分子是多特异性的实施方案,除了第一和第二靶表位之外,该分子还可包括另外的结合特异性。
[0132]
在一个实施方案中,对于对btn3a靶表位的第一结合特异性,本文公开的双特异性分子包含至少一种本文公开的btn3a结合抗体片段,包括,例如fab、fab’、f(ab’)2、fv、unibody或单链fv。所述抗体也可是轻链或重链二聚体,或其任何最小片段,诸如ladner等的美国专利号4,946,778中所述的fv或单链或vhh构建体。
[0133]
可用于本文公开的双特异性分子的其他抗体是鼠、嵌合的、人源化或重组人单克隆抗体。
[0134]
本公开的双特异性分子可用本领域已知的方法通过将结合特异性的组分缀合来制备。例如,双特异性分子的每种结合特异性部分可分别产生,然后彼此缀合。当结合特异性部分是蛋白质或肽时,多种偶联剂或交联剂可用于共价缀合。交联剂的实例包括protein a、碳二亚胺、n
‑
琥珀酰亚胺基
‑
s
‑
乙酰基硫代乙酸酯(sata)、5,5
’‑
二硫代双(2
‑
硝基苯甲酸)(dtnb)、邻苯二甲酰亚胺(opdm)、n
‑
琥珀酰亚胺基
‑3‑
(2
‑
吡啶基二硫代)丙酸酯(spdp)
和磺基琥珀酰亚胺基4
‑
(n
‑
马来酰亚胺甲基)环己
‑1‑
羧酸酯(磺基
‑
smcc)(karpovsky等,1984;liu等,1985)。其他方法包括brennan等,1985;glennie等,1987;paulus,1985中描述的方法。
[0135]
或者,两种结合特异性都可在相同的载体中编码,并在相同的宿主细胞中表达和装配。
[0136]
在其他实施方案中,双特异性分子是式i的融合蛋白,其中x包含用于另一结合特异性的另一抗体片段。
[0137]
本公开的双特异性分子可以是包含一个单链抗体和结合决定簇的单链分子,或者包含两个结合决定簇的单链双特异性分子。
[0138]
双特异性分子与其特异性靶标的结合可通过例如酶联免疫吸附测定(elisa)、放射免疫测定(rea)、facs分析、生物活性测定(例如生长抑制和凋亡)、octet
tm
系统或western blot测定或spr测量来确认。这些测定方法中的每一种通常通过采用对目标复合物具有特异性的标记试剂(例如抗体)来检测特定目标蛋白质
‑
抗体复合物的存在。
[0139]
天然地,双特异性(或多特异性)分子被设计为以保留原始btn3a抗体片段的活化特性。
[0140]
编码本公开的btn3a抗体片段、btn3a结合蛋白或双特异性分子的核酸分子
[0141]
本文还公开了编码本公开的btn3a抗体片段、btn3a结合蛋白或双特异性分子的核酸分子。
[0142]
核酸分子的实例是编码如前述部分中公开的btn3a抗体片段的可变轻链和重链氨基酸序列的那些,并用遗传密码且任选地考虑取决于宿主细胞种类的密码子偏倚。
[0143]
典型地,编码seq id no:7的vh和seq id no:8的vl的核酸分子以及编码seq id no:18的vh和seq id no:19的vl的核酸分子是本公开的一部分。在特定的实施方案中,所述核酸分子编码嵌合的和人源化的fab或btn3a结合抗体片段,且包含分别具有seq id no:9的hcdr1、seq id no:10的hcdr2,seq id no:11的hcdr3的vh编码序列和分别具有seq id no:12的lcdr1、seq id no:13或20的lcdr2和seq id no:14的lcdr3的vl编码序列。
[0144]
在特定的实施方案中,所述核酸分子编码嵌合fab或scfv btn3a抗体片段且包含seq id no:15的vh编码序列和seq id no:16的vl编码序列。
[0145]
在特定的实施方案中,所述核酸分子编码人源化fab或scfv btn3a抗体片段且包含seq id no:21的vh编码序列和seq id no:22的vl编码序列。
[0146]
本公开还涉及源自具有被优化用于在哺乳动物细胞(例如cho或hek细胞系)中的蛋白质表达的后者序列的核酸分子。
[0147]
核酸可存在于完整细胞、细胞裂解物中,或可以是部分纯化或基本上纯的形式的核酸。当通过标准技术,包括碱/sds处理、cscl带、柱层析、琼脂糖凝胶电泳和其他本领公知的技术(ausubel等,1988)从其他细胞组分或其他污染物(例如其他细胞核酸或蛋白质)中纯化出来时,核酸是“分离的”或“基本上纯的”。本公开的核酸可以是,例如dna或rna,且可含有或可不含有内含子序列。在一个实施方案中,核酸可存在于载体(诸如噬菌体展示载体)中,或存在于重组质粒载体中。
[0148]
本公开的核酸可用标准分子生物学技术获得。一旦获得编码例如vh和vl区段的dna片段,可通过标准重组dna技术进一步操作这些dna片段,例如将可变区基因转化为全长
抗体链基因、fab片段基因或scfv基因。
[0149]
在这些操作中,编码vl或vh的dna片段(例如分别为seq id no:15和16的vh和vl,或分别为seq id no:21和22的vh和vl)被可操作地连接至另一dna分子,或连接至编码另一蛋白质的片段,诸如抗体恒定区或柔性接头。如上下文所用,术语“可操作地连接”是指两个dna片段以功能性方式连接,例如,使得由两个dna片段编码的氨基酸序列保留在阅读框内,或使得蛋白质在所需启动子的控制下表达。
[0150]
为产生scfv基因,将编码vh和vl的dna片段可操作地连接至编码柔性接头的另一片段,例如编码氨基酸序列(gly4
‑
ser)3或(gly4
‑
ser)4,使得vh和vl序列可被表达为连续单链蛋白,其中vl和vh区通过柔性接头连接(bird等,1988;huston等,1988;mccafferty等,1990)。
[0151]
产生btn3a结合抗体片段、btn3a结合蛋白或双特异性分子的转染瘤的产生
[0152]
本公开的btn3a结合抗体片段、btn3a结合蛋白或双特异性分子可用例如本领域公知的重组dna技术和基因转染方法的组合在宿主细胞转染瘤中产生(morrison,1985)。
[0153]
例如,为表达结合蛋白,可通过标准分子生物学或生物化学技术(例如,dna化学合成、pcr扩增或用表达目标抗体的杂交瘤的cdna克隆)获得编码所述结合蛋白的dna,且可将dna插入表达载体中,使得基因可操作地连接至转录和翻译控制序列。在本文中,术语“可操作地连接”意欲是指将基因连接至载体中,使得载体内的转录和翻译控制序列发挥其调节抗体基因的转录和翻译的预期功能。选择表达载体和表达控制序列以使得与所用的表达宿主细胞相容。如果结合蛋白包括不同的多肽,例如编码作为btn3a结合抗体片段的fab的vl基因和作为btn3a结合抗体片段的fab的另一vh基因的序列,vh和vl编码基因可被插入至单独的载体中,或更典型地,两个基因都被插入至相同的表达载体中。通过标准方法将基因插入至表达载体中(例如,连接抗体基因片段和载体上的互补限制性位点,或平端连接(如果不存在限制性位点))。通过将此类vh、vl或scfv序列插入至已编码相应x或l
‑
x多肽的表达载体中,使得vh、vl或scfv片段可操作地连接至载体内的x或l
‑
x多肽编码序列,本文所述的活化btn3a结合抗体片段的vh、vl或scfv序列可用于产生上文公开的式(i)的融合蛋白。另外地或可选地,重组表达载体可编码促进相应结合蛋白从宿主细胞分泌的信号肽。
[0154]
信号肽可以是免疫球蛋白信号肽或异源信号肽(即,来自非免疫球蛋白蛋白质的信号肽)。
[0155]
此外,本文公开的重组表达载体携带控制宿主细胞中结合蛋白的表达的调节序列。术语“调节序列”意欲包括控制抗体链基因转录或翻译的启动子、增强子和其他表达控制元件(例如聚腺苷酸化信号)。此类调节序列描述于例如goeddel的出版物(goeddel,1990)中。本领域技术人员将理解,表达载体的设计,包括调节序列的选择,可取决于诸如待转化的宿主细胞的选择,所需蛋白质的表达水平等因素。用于哺乳动物宿主细胞表达的调节序列包括指导哺乳动物细胞中高水平蛋白质表达的病毒元件,诸如源自巨细胞病毒(cmv)、猿猴病毒40(sv40)、腺病毒(例如腺病毒主要晚期启动子(admlp))和多瘤病毒的启动子和/或增强子。或者,可用非病毒调节序列,诸如泛素启动子或p
‑
珠蛋白启动子。此外,调节元件由来自不同来源的序列组成,诸如srα启动子系统,其含有来自sv40早期启动子的序列和1型人t细胞白血病病毒的长末端重复序列(takebe等,1988)。
[0156]
另外,本公开的重组表达载体可携带其他的序列,诸如在宿主细胞中调节载体复
制的序列(例如复制起点)和可选择标志基因。可选择标志基因有助于选择已引入宿主细胞的载体(参见例如axel等的美国专利号4,399,216、4,634,665和5,179,017)。例如,典型地,可选择标志基因赋予引入了载体的宿主细胞对药物(诸如g418、潮霉素或氨甲蝶呤)的抗性。可选择标志基因包括二氢叶酸还原酶(dhfr)基因(用于具有氨甲蝶呤选择/扩增的dhfr
‑
宿主细胞)和neo基因(用于g418选择)。
[0157]
为表达结合蛋白,通过标准技术将表达载体转染至宿主细胞中。术语“转染”的各种形式意欲涵盖常用于将外源dna引入至原核或真核宿主细胞的各种技术,例如电穿孔、磷酸钙沉淀,deae
‑
葡聚糖转染等。理论上可能可在原核或真核宿主细胞中表达本公开的结合蛋白。讨论了重组蛋白在真核细胞,例如哺乳动物宿主细胞、酵母或丝状真菌中的表达,因为此类真核细胞,特别是哺乳动物细胞,比原核细胞更可能装配和分泌正确折叠和免疫活性的抗体。
[0158]
在特定的实施方案中,根据本公开的克隆或表达载体包含分别编码至少seq id no:7的vh和seq id no:8的vl的核酸或分别编码至少seq id no:18的vh和seq id no:19的vl的核酸,其可操作地连接至合适的启动子序列。
[0159]
用于表达本公开的重组抗体的哺乳动物宿主细胞包括中国仓鼠卵巢(cho细胞),包括与dhfr可选择标志(如kaufman和sharp,1982中所述)一起使用的dhfr
‑
cho细胞(urlaub和chasin,1980中所述)、chok1 dhfr+细胞系、nso骨髓瘤细胞、cos细胞和sp2细胞,例如具有gs xceed
tm
基因表达系统(lonza)的gs cho细胞系或hek细胞。当将编码抗体基因的重组表达载体引入哺乳动物宿主细胞中时,通过将宿主细胞培养足以在宿主细胞中表达抗体的一段时间,并任选地将抗体分泌至培养基中,所述宿主细胞生长于所述培养基中。抗体可例如在其分泌后用标准蛋白质纯化方法(shukla等,2007)从培养基中回收和纯化。
[0160]
在特定的实施方案中,本公开的宿主细胞是用具有scfv片段的编码序列的表达载体转染的宿主细胞,例如至少包含seq id no:7的vh和seq id no:8的vl,或seq id no:18的vh和seq id no:19的vl的scfv片段,其可操作地连接至合适的启动子序列。典型地,此类表达载体编码包含seq id no:15的vh编码序列和seq id no:16的vl编码序列,或seq id no:21的vh编码序列和seq id no:22的vl编码序列的scfv。
[0161]
然后可在用于表达和产生btn3a结合蛋白的合适条件下进一步培养后者宿主细胞。
[0162]
或者,无细胞表达系统可用于产生此类btn3a结合蛋白。典型地,无细胞表达蛋白质或抗体的方法已有描述(stech等,2017)。
[0163]
药物组合物
[0164]
在另一方面,本公开提供组合物,例如药物组合物,其含有与药学上可接受的载体一起配制的,如上公开的活化btn3a抗体片段和/或btn3a结合蛋白或双特异性分子。此类组合物可包括如上所述的抗体片段或结合蛋白或双特异性分子的一种或(例如,两种或更多种不同的)组合。
[0165]
本文公开的药物组合物也可在组合疗法中施用,即与其他试剂组合。例如,组合疗法可包括本公开的活化btn3a结合抗体片段和/或btn3a结合蛋白或双特异性分子,与至少一种抗病毒剂、抗炎剂或另一种抗增殖剂组合。可用于组合疗法的治疗剂的实例在下文下一部分中更详细地描述。
[0166]
如本文所用,“药学上可接受的载体”包括生理学上相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。载体应适用于静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(例如,通过注射或输注)。在一个实施方案中,所述载体应适用于皮下途径。根据施用途径,活性化合物(即抗体片段、btn3a结合蛋白或双特异性分子)可用材料包被以保护化合物免受酸和可能使化合物失活的其他天然条件的作用。
[0167]
无菌磷酸盐缓冲盐水是药学上可接受的载体的一个实例。其他合适的载体是本领域技术人员公知的(remington和gennaro,1995)。制剂可进一步包括一种或多种赋形剂、防腐剂、增溶剂、缓冲剂、白蛋白质以预防小瓶表面的蛋白质损失等。
[0168]
药物组合物的形式、施用途径、剂量和给药方案自然取决于待治疗的病症、疾病的严重程度、患者的年龄、体重和性别等。
[0169]
本公开的药物组合物可配制用于局部、口服、肠胃外、鼻内、静脉内、肌内、皮下或眼内等。
[0170]
优选地,药物组合物含有载体,其对于能够注射的制剂是药学上可接受的。这些可特别地是等渗的、无菌的盐水溶液(磷酸钠或磷酸二钠、氯化钠、氯化钾、氯化钙或氯化镁等或此类盐的混合物),或干燥的、尤其是冻干的组合物,根据情况加入无菌水或生理盐水后,允许构建可注射溶液。
[0171]
用于施用的剂量可调整为各种参数的函数,特别地作为所用的施用方式、相关病理学或所需的治疗持续时间的函数。
[0172]
为制备药物组合物,可将有效量的抗体片段、btn3a结合蛋白或双特异性分子溶解或分散在药学上可接受的载体或水性介质中。
[0173]
适用于注射用的药物形式包括无菌水溶液或分散体;包括芝麻油、花生油或水性丙二醇的制剂;以及用于临时制备无菌可注射溶液或分散体的无菌粉末或冻干物。在所有情况下,所述形式必须是无菌的,且必须是易于注射的流体。其在生产和储存条件下必须是稳定的,且必须在防治微生物(诸如细菌和真菌)污染作用下保存。
[0174]
作为游离碱或药理上可接受的盐的活性化合物的溶液可与表面活性剂(诸如羟丙基纤维素)在适当混合的水中制备。也可在甘油、液体聚乙二醇及其混合物和油中制备分散体。在普通的储存和使用条件下,这些制剂含有防腐剂以预防微生物的生长。
[0175]
可用于制剂中的药学上可接受的盐包括酸加成盐(与蛋白质的游离氨基一起形成),其与无机酸诸如,例如盐酸或磷酸形成,或与有机酸如乙酸、草酸、酒石酸、扁桃酸等形成。与游离羧基形成的盐也可源自无机碱诸如,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,和有机碱,如异丙胺、三甲胺、组氨酸、普鲁卡因等。
[0176]
载体还可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其适合的混合物和植物油的溶剂或分散介质。例如,通过用包衣(诸如卵磷脂),在分散体的情况下通过维持所需的粒度和通过用表面活性剂,可维持适当的流动性。可通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来实现预防微生物的作用。在许多情况下,优选包括等渗剂,例如糖或氯化钠。可注射组合物的延长吸收可通过在组合物中用延迟吸收的试剂,例如单硬脂酸铝和明胶来实现。
[0177]
无菌可注射溶液通过将所需量的活性化合物与上文列举的各种其他成分(如需要)一起掺入合适的溶剂中,然后过滤灭菌来制备。通常,通过将各种无菌的活性成分掺入
至含有基础分散介质和来自上文列举的那些的所需的其他成分的无菌载体中来制备分散体。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其产生活性成分加上任何来自此前无菌过滤的溶液的其他所需成分的粉末。
[0178]
还考虑了用于直接注射的更高浓度或高度浓缩的溶液的制备,其中设想用dmso作为溶剂以使得极快速地渗透,将高浓度的活性剂递送至小肿瘤区域。
[0179]
在配制时,溶液将以与剂量制剂相容的方式和以治疗有效的量施用。所述制剂可容易地以各种剂量形式施用,诸如上述可注射溶液的类型,但也可用药物释放胶囊等。
[0180]
对于在水溶液中的肠胃外施用,例如,如果需要,溶液应当被适当地缓冲,且首先用足够的盐水或葡萄糖使液体稀释液等渗。这些特别的水溶液尤其适用于静脉内、肌内、皮下和腹膜内施用。在这方面,根据本公开内容,可用的无菌水性介质是本领域技术人员已知的。例如,可将一个剂量溶解在1ml等渗氯化钠溶液中,并加入至1000ml皮下输液中或在建议的输注部位注射(参见例如,“remington’s pharmaceutical sciences”,15th edition,pages 1035
‑
1038and 1570
‑
1580)。根据所治疗的受试者的病症,必然会发生剂量的一些变化。在任何情况下,负责施用的人员将确定个体受试者的适合剂量。
[0181]
本公开的活化btn3a抗体片段、重组btn3a结合蛋白或双特异性分子可在治疗性混合物中配制以包含每个剂量约0.0001
‑
1.0mg,或约0.001
‑
0.1mg,或约0.1
‑
1.0或甚至1.0
‑
约10mg。也可施用多个剂量。
[0182]
本公开的btn3a结合蛋白的用途和方法
[0183]
本公开的活化btn3a抗体片段,btn3a结合蛋白和双特异性分子具有体外和体内诊断和治疗用途。
[0184]
特别地,本公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子可活化γδt细胞(例如,vγ9vδ2 t细胞)的细胞溶解功能、细胞因子产生和/或增殖,如在癌细胞诸如daudi细胞和/或skov
‑
3的存在下的cd107脱粒测定中所示。更特别地,本公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子可诱导vγ9vδ2活化,其典型地通过在癌细胞(诸如daudi细胞和/或skov
‑
3)的存在下的细胞毒性的改进(例如,通过cd107脱粒测定测量的)来评估,和/或可促进vγ9vδ2t细胞增殖和活化,如本文所述的pbmc内的增殖测定(参见cell trace violet
tm
稀释测定)和活化测定(通过跟踪cd25活化标志)所示。
[0185]
因此,这些活化片段可用于克服在癌症患者中和在慢性感染期间观察到的免疫抑制机制,或可用于离体活化患者的γδt细胞(典型地vγ9vδ2 t细胞)以用于其在患者中的再施用。
[0186]
特别地,本公开的活化btn3a抗体片段、btn3a结合蛋白和双特异性分子可用于离体、体外或体内诱导γδt细胞(典型地vγ9vδ2 t细胞)的增殖和/或活化的方法中。例如,所述方法包含,任选地在其他btn3a表达细胞(诸如btn3a表达肿瘤细胞)的存在下,将如前述部分公开的有效量的所述活化btn3a抗体片段、btn3a结合蛋白或双特异性分子与所述γδt细胞(典型地vγ9vδ2 t细胞)接触。
[0187]
更具体地,可将这些分子施用于培养物中的细胞,例如体外或离体,或在受试者中(例如体内),以治疗、预防或诊断多种病症(包括癌症或感染病症)。
[0188]
如本文所用,术语“癌症”,“过度增殖”和“肿瘤”是指具有自主生长能力的细胞,即以快速增殖的细胞生长为特征的异常状态或病症。过度增殖和肿瘤性疾病状态可分类为病
理性的,即表征或构成疾病状态,或可分类为非病理性的,即与正常状态的偏离但不与疾病状态相关。该术语包括所有类型的癌性生长或致癌过程、转移组织或恶性转化的细胞、组织或器官,而与组织病理学类型或浸润性阶段无关。
[0189]
术“癌症”或“肿瘤”包括各种器官系统的恶性肿瘤,诸如影响肺、乳腺、甲状腺、淋巴、胃肠道和生殖泌尿道的恶性肿瘤,以及腺癌,包括恶性肿瘤(诸如大多数结肠癌、肾细胞癌、前列腺癌和/或睾丸肿瘤、非小细胞肺癌、小肠癌和食道癌的腺癌)。
[0190]
优选的癌症是那些易于用活化的γδt细胞治疗的癌症。
[0191]
癌症的实例包括但不限于血液恶性肿瘤,诸如b细胞淋巴瘤、t细胞淋巴瘤、非霍奇金淋巴瘤(nhl)、b
‑
nhl、t
‑
nhl、慢性淋巴细胞性白血病(cll)、小淋巴细胞淋巴瘤(sll)、套细胞淋巴瘤(mcl)、nk细胞淋巴肿瘤和髓样细胞系肿瘤。
[0192]
非血液癌症的实例包括但不限于结肠癌、乳腺癌、肺癌、脑癌、前列腺癌、头颈癌、胰腺癌、膀胱癌、结肠直肠癌、骨癌、宫颈癌、肝癌、口腔癌、食道癌、甲状腺癌、肾癌、胃癌、睾丸癌和皮肤癌。
[0193]
感染性病症的实例包括但不限于病毒、细菌、寄生虫或真菌感染,诸如慢性肝炎、肺部感染、下呼吸道感染、支气管炎、流行性感冒、肺炎和性传播疾病。
[0194]
病毒感染的实例包括但不限于肝炎(hav、hbv、hcv)、单纯疱疹(hsv)、带状疱疹、hpv、流感(flu)、aids和aids相关综合征、水痘(水痘病毒)、普通感冒、巨细胞病毒(cmv)感染、天花(variola)、科罗拉多蜱虫热、登革热、埃博拉出血热、手足口病、拉沙热、麻疹、马尔堡出血热、传染性单核细胞增多症、腮腺炎、诺如病毒、脊髓灰质炎、进行性多灶性白质脑病(pml)、狂犬病、风疹、sars、病毒性脑炎、病毒性肠胃炎、病毒性脑膜炎、病毒性肺炎、西尼罗河病和黄热病。细菌感染的实例包括但不限于肺炎、细菌性脑膜炎、霍乱、白喉、结核、炭疽、肉毒杆菌中毒、布鲁氏菌病、弯曲菌病、斑疹伤寒、淋病、李斯特菌病、莱姆病、风湿热、百日咳(whooping cough)、鼠疫、沙门氏菌病、猩红热、志贺氏菌病、梅毒、破伤风、沙眼、土拉菌病、伤寒热和尿路感染。实例还包括由鲍氏考克斯菌(coxiella burnetii),流产布鲁氏菌(brucella abortus),tropheryma whipplei,结核分枝杆菌(mycobacterium tuberculosis)和卡纳特分枝杆菌(mycobacteriumcanettii)引起的细菌感染。
[0195]
寄生虫感染的实例包括但不限于疟疾、利什曼病、锥虫病、恰加斯病、隐孢子虫病、筋膜炎、丝虫病、阿米巴感染、贾第鞭毛虫病、蛲虫感染、血吸虫病、绦虫病、弓形虫病、毛虫病和锥虫病。真菌感染的例子包括但不限于念珠菌病、曲霉病、球孢子菌病、隐球菌病、组织胞浆菌病和足癣。
[0196]
因此,本公开涉及在有需要的受试者中治疗上文公开的病症之一的方法,所述方法包括治疗有效量的如上文公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子,典型地,包括具有seq id no:18的vh和seq id no:19的vl的scfv或fab。
[0197]
如上公开的用途的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子可作为唯一的活性成分施用,或与例如作为佐剂联合施用,或与其他药物(例如白介素、抗病毒、抗炎剂或细胞毒性、抗增殖、化疗或抗肿瘤剂)组合施用,例如用于治疗或预防上述疾病。
[0198]
例如,如上公开的用途的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子可与化疗、抗肿瘤剂或免疫治疗剂组合使用。
[0199]
合适的抗肿瘤剂可包括但不限于烷基化剂(诸如环磷酰胺、甲氯胺酮、苯丁酸氮
芥、美法仑、亚硝基脲、替莫唑胺)、蒽环类药物(诸如柔红霉素、阿霉素、表柔比星、伊达比星、米托蒽醌、戊柔比星)、紫杉烷类(诸如紫杉醇、多西他赛)、埃博霉素、拓扑异构酶i的抑制剂(诸如伊立替康或托泊替康)、拓扑异构酶ii的抑制剂(诸如依托泊苷、替尼泊苷或他氟泊苷)、核苷酸类似物和前体类似物(诸如阿扎胞苷、硫唑嘌呤、卡培他滨、阿糖胞苷、氟尿嘧啶、吉西他滨、羟基脲、巯基嘌呤、甲氨蝶呤或硫鸟嘌呤)、肽类抗生素(诸如卡铂、顺铂和奥沙利铂)、类视黄醇(诸如维甲酸、阿利维a酸、贝沙罗汀)、长春花生物碱和衍生物(诸如长春碱、长春新碱、长春地辛、长春瑞滨)、靶向疗法,诸如激酶抑制剂(诸如依鲁替尼、依达拉西布、厄洛替尼、吉非替尼、伊马替尼、维拉非尼、维莫非尼)、蛋白酶体抑制剂(诸如硼替佐米、卡非佐米)、组蛋白脱乙酰基酶抑制剂(诸如伏立诺他或罗米地辛)。
[0200]
白介素的实例包括但不限于il
‑
2或il
‑
15。
[0201]
术语“il
‑
2”具有其一般含义且是指人白介素
‑
2。
[0202]
术语“il
‑
15”具有其一般含义且是指人白介素
‑
15。
[0203]
免疫治疗剂的实例包括但不限于磷酸抗原(例如唑来膦酸或其他双膦酸盐)、抗pd
‑
1抗体、抗pd
‑
l1抗体、抗btla抗体、抗ctla
‑
4抗体。
[0204]
术语“pd
‑
1”具有其在本领域中的一般含义,且是指程序性死亡
‑
1受体。术语“pd
‑
1”还指i型跨膜蛋白,其属于cd28
‑
b7信号转导受体家族,所述受体包括cd28、细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)、诱导型共刺激物(icos)以及b和t淋巴细胞衰减子(btla)(greenwald等,2005;riley且2005年6月)。
[0205]
术语“btla”具有其在本领域中的一般含义,且是指b和t淋巴细胞衰减子。术语“btla”也指cd272,其为cd28
‑
b7信号转导受体家族的成员,所述受体包括cd28、细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)、诱导型共刺激物(icos)和程序性死亡
‑
1受体(pd
‑
1)(greenwald等,2005;riley且2005年6月)。
[0206]
术语“pd
‑
l1”具有其一般含义,且是指程序性死亡配体1,也称为cd274或b7
‑
h1(chemnitz等,2004)。
[0207]
术语“ctla
‑
4”具有其一般含义,且是指细胞毒性t淋巴细胞相关蛋白4,也称为cd152(brunet等,1987)。
[0208]
术语“抗pd
‑
1抗体”具有其在本领域中的一般含义,且是指对pd
‑
1或pd
‑
l1具有结合亲和力且对pd
‑
1具有拮抗活性的抗体,即,其抑制与pd
‑
1相关的信号转导级联且抑制pd
‑
1配体结合(pd
‑
l1;pd
‑
12)。此类抗pd
‑
1抗体优先分别以高于其与cd28
‑
b7信号转导受体家族(cd28;ctla
‑
4;icos;btla)的其他亚型或同种型相互作用的更高的亲和力和功效使得pd
‑
1失活。用于确定化合物是否为pd
‑
1拮抗剂的测试和测定是本领域技术人员公知的,诸如greenwald等,2005;riley且2005年6月中所述。
[0209]
此类抗pd
‑
1抗体的实例包括但不限于尼古拉单抗(nivolumab),派姆单抗(pembrolizumab),阿维鲁单抗(avelumab),德瓦鲁单抗(durvalumab)或阿特珠单抗(atezolizumab)。
[0210]
术语“抗btla抗体”具有其在本领域中的一般含义,且是指对btla具有结合亲和力和拮抗活性的抗体,即其可抑制与btla相关的信号转导级联反应。用于确定化合物是否为btla拮抗剂的测试和测定是本领域技术人员公知的,例如描述于(greenwald等,2005;riley且2005年6月)。
[0211]
在一些实施方案中,抗btla抗体选自国际专利申请wo2010/106051;wo2011/014438;wo2017/144668中描述的那些。
[0212]
在一些实施方案中,抗btla抗体是btla抗体(btla 8.2),其可从诸如wo2010/106051中公开的以cncm保藏号i
‑
4123保藏的杂交瘤或包含btla 8.2的6个cdr的其他抗btla抗体获得。
[0213]
在一些实施方案中,所述抗btla抗体是wo2011/014438中公开的mab 4c7。
[0214]
在一些实施方案中,抗btla抗体是wo2017/144668中公开的mab629.3,或其人源化形式或其变体。
[0215]
根据前述内容,本公开在又一方面中提供:
[0216]
如上文定义的方法,包括例如同时或依次共施用治疗有效量的本公开的btn3a抗体片段或结合蛋白或双特异性分子,和至少一种第二药物物质,所述第二药物物质是例如如上文所示的抗病毒剂或抗增殖剂或免疫治疗剂(诸如抗pd
‑
1或抗btla抗体)。
[0217]
由组合物(例如,本文公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子)和用途说明书组成的试剂盒也在本公开的范围内。试剂盒可进一步包含至少一种其他试剂,或一种或多种其他抗体或蛋白质。试剂盒典型地包括指示试剂盒内容物的预期用途的标签。术语标签包括在试剂盒上或与试剂盒一起提供的,或以其他方式伴随试剂盒的任何书写或记录材料。所述试剂盒还可包含用于诊断患者是否属于将对如上定义的btn3a结合蛋白治疗应答的人群的工具。
[0218]
另一种治疗策略是基于本文公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子作为选择性扩增和/或活化γδt细胞(典型地vγ9vδ2 t细胞),包括分离自人受试者的vγ9vδ2 t细胞的试剂的用途。
[0219]
因此,本公开涉及用于治疗有需要的受试者的方法,其包括:
[0220]
(a)分离包含γδt细胞(例如,vγ9vδ2 t细胞)的血细胞,包括vγ9vδ2 t细胞,例如来自受试者的血液样品的pbmc;
[0221]
(b)在如本文公开的活化btn3a抗体片段、btn3a结合蛋白或双特异性分子中的任一种,和至少一种肿瘤(典型地表达btn3a表达肿瘤细胞)或辅助细胞的存在下,体外扩增所述γδt细胞,
[0222]
(c)收集扩增的γδt细胞,
[0223]
(d)任选地,配制扩增的γδt细胞并向受试者施用治疗有效量的所述γδt细胞(因此典型地vγ9vδ2 t细胞)。
[0224]
现通过以下实施例进一步说明已充分描述的本发明,这些实施例仅仅是说明性的并不意味着进一步限制。
具体实施方式
[0225]
材料和方法
[0226]
i.用以其不同形式(igg、fab和f(ab’)2)的103.2抗体的嵌合形式进行的实验
[0227]
1.fab和f(ab’)2片段的制备
[0228]
a.用于f(ab’)2产生的胃蛋白酶的消化
[0229]
50%浆液中的固定化胃蛋白酶(thermo scientific kit,cat.n
°
44988)通过将浆
液以5000g高速旋转2min,将缓冲液交换至消化缓冲液(20mm乙酸钠ph 4.4)。弃去上清液,将浆液重悬于1ml消化缓冲液中,然后以5000g高速旋转2分钟。该步骤再重复四次(总共5次树脂洗涤)。然后将树脂重悬于消化缓冲液中,直到原始的浆液体积。
[0230]
103.2嵌合抗体用5或10ml zeba spin柱(依据抗体量)缓冲液交换至消化缓冲液中,并根据制造商使用说明用vivaspin浓缩器(10,000mwco)浓缩至3mg/ml。然后,将抗体与固定在树脂上的胃蛋白酶混合并在37℃下高速旋转孵育1.5
‑
2小时。
[0231]
将消化混合物以5000g高速旋转2分钟。除去上清液并用合适的注射器和0.22μm的小过滤器(merck millipore,millex cat n
°
slgv004sl)过滤至新的管中。用1ml pbs洗涤树脂,以5000g高速旋转1分钟。除去上清液,过滤并与先前的上清液合并。重复洗涤步骤。
[0232]
消化并过滤的上清液用hiload 16/600 200pg尺寸的排阻柱纯化,用10mm乙酸钠、100mm氯化钠,ph5.5作为流动相。将对应于洗脱的f(ab’)2片段的级分合并、浓缩并无菌过滤。
[0233]
通过sds
‑
page、分析sec和od
280nm
读数来分析f(ab’)2片段(数据未显示)。
[0234]
b.木瓜蛋白酶消化用于产生fab
[0235]
50%浆液中的固定化木瓜蛋白酶(thermo scientific kit,cat.n
°
20341)通过将浆液在5000g下高速旋转2分钟,将缓冲液交换到消化缓冲液(20mm磷酸钠、10mm edta、150mm半胱氨酸ph 7.0)中。弃去上清液,将浆液重悬于较大体积的消化缓冲液中,随后以5000g再高速旋转2分钟。该步骤再重复四次(总共5次树脂洗涤)。然后将树脂重悬于消化缓冲液中,直至原始的浆液体积。
[0236]
103.2嵌合抗体用5或10ml zeba spin柱(依据抗体量)缓冲液交换至消化缓冲液中,并根据制造商使用说明用vivaspin浓缩器(10,000mwco)浓缩至3mg/ml。然后,将抗体与固定在树脂上的木瓜蛋白酶混合并在37℃下高速旋转孵育42小时。
[0237]
将消化混合物以5000g高速旋转2分钟。除去上清液并用合适的注射器和0.22μm小过滤器(merck millipore,millex cat n
°
slgv004sl)过滤到新的管中。将树脂用pbs洗涤三次,以5000g高速旋转1分钟,在每个循环收集并合并上清液。然后用合适的注射器和0.22μm小过滤器将合并的级分过滤到新的管中。
[0238]
首先将消化并过滤的上清液缓冲液交换至1xdpbs,ph7.4中,然后首先用protein a柱纯化以除去fc和未消化的mab,然后用尺寸排阻(sec)柱,用10mm乙酸钠,100mm nacl,ph 5.5作为流动相进行精制步骤。将对应于洗脱的fab片段的级分合并、浓缩并无菌过滤。
[0239]
通过sds
‑
page、分析性sec和od
280nm
读数分析fab片段(数据未显示)。
[0240]
2.用biacore测定嵌合103.2fab和f(ab’)2片段的亲和力
[0241]
为评估嵌合103.2fab和f(ab’)2与人btn3a1结合的亲和力,用运行biacore t200控制软件v2.0.1和评价软件v3.0(ge healthcare,uppsala,sweden)的biacore t200(序列号1909913)仪器进行单周期动力学分析。所有单周期动力学实验在25℃下用含有0.1%bsa的hbs
‑
p+运行缓冲液(ph7.4)(ge healthcare,little chalfont,uk)运行。
[0242]
将人btn3a1 his
‑
标记的抗原(sino biological,beijing,china)在运行缓冲液中稀释至0.4μg/ml的终浓度。在每个循环开始时,用his捕获试剂盒(ge healthcare,little chalfont,uk)用标准胺化学以10μl/min的流速将btn3a1
‑
his捕获至预偶联的cm5传感器芯片的fc2上。约17ru或8ru的固定化水平(rl),获得约25ru的r
max
的不同理论值分别
用于分析物fab和f(ab’)2。然后使表面稳定。用纯化的样品(fab和f(ab’)2)以40μl/min的流速获得单周期动力学数据以使任何潜在的传质作用最小化。从fc2的信号中减去来自参照通道fc1(无抗原捕获)的信号,以校正与参照表面的非特异性结合中的差异。对于在各浓度间没有再生的所有样品,用0.617nm
‑
50nm的五点三倍稀释范围。减去btn3a1
‑
his空白运行(无分析物)的信号以校正表面稳定性中的差异。每次监测5次递增浓度注射的结合期240秒,且在分析物最后一次注射后测量单解离期2000秒。芯片表面的再生通过两次注射10mm甘氨酸
‑
hcl ph 1.5,然后稳定240秒来进行。
[0243]
与分析物的不同化合价一致下,用fab样品的1:1模型和f(ab’)2样品的二价分析物模型拟合原始传感图。获得的动力学常数在表1和表2中详述。
[0244]
3.嵌合103.2(igg、fab和f(ab’)2)在vγ9vδ2 t细胞脱粒测定中的功效
[0245]
该测定由测量嵌合的抗体103.2及其fab和f(ab’)2形式对daudi burkitt’s淋巴瘤细胞系的vγ9vδ2 t细胞脱粒的活化或抑制作用(harly等,2012)组成。通过用唑来膦酸(1μm)和il
‑
2(200ui/ml)培养11
‑
13天,从健康供体的pbmc扩增vγ9vδ2 t细胞。在第5天、第8天和此后每2天添加il
‑
2。在培养开始时测定vγ9vδ2 t细胞的百分比,且在培养时间通过流式细胞仪评估直至其达到至少80%。在该步骤中,将vγ9vδ2 t细胞冷冻并储存。然后用冷冻的vγ9vδ2 t细胞于在对daudi细胞系(e:t比例1:1)的细胞脱粒测定中,其中在10μg/ml的103.2嵌合抗体及其不同形式的存在下,将细胞在37℃共培养4小时。pma(20ng/ml)加上ionomycin(1μg/ml)的活化作为vγ9vδ2 t细胞脱离测定的阳性对照,并且培养基单独作为阴性对照。在共孵育4小时结束时,通过流式细胞仪分析细胞以评估cd107a(lamp
‑
1,溶酶体相关膜蛋白
‑
1)+cd107b(lamp
‑
2)阳性的vγ9vδ2 t细胞的百分比。cd107在活化诱导的颗粒胞吐后被动员至细胞表面,因此表面cd107的测量是用于鉴定最近脱粒的细胞溶解t细胞的敏感标记物。
[0246]
所得结果描述于表3中。
[0247]
ii.103.2抗体的人源化
[0248]
1.不同人源化变体的设计和构建
[0249]
a.人源化可变区序列的设计
[0250]
用swiss pdb产生鼠103.2抗体v区的结构模型并分析以鉴定v区中可能对抗体的结合性质是必需的重要“限制”氨基酸。包含在cdr内的大多数残基(用kabat和chothia定义)连同许多框架残基被认为是重要的。鼠103.2的vh和vκ序列含有典型的框架残基且cdr1、2和3模体与许多鼠抗体相当。
[0251]
从上述分析中,103.2的人源化序列被认为是可在cdr之外的替代残基的宽范围内产生,但在cdr序列内仅有一个狭窄的可能残基范围选择。初步分析表明,来自几种人抗体的相应序列区段可组合以产生与鼠序列中的cdr相似或相同的cdr。对于cdr外部和侧翼的区域,广泛选择的人序列区段被鉴定为新的人源化v区的可能组分。
[0252]
b.cd4+t细胞表位回避
[0253]
基于结构分析,选择可用于产生103.2人源化变体的一大组初步序列区段,并用itope
tm
技术用于与人mhc ii类等位基因结合的肽的计算机分析(perry等,2008),且用已知抗体序列相关的t细胞表位的tced
tm
(bryson等,2010)进行分析。丢弃被鉴定为对人mhc ii类的显著非人种系结合物或被tced
tm
的评分显著命中的序列区段。这产生了一组减少的区
段,并且再次如上所述地分析这些片段的组合,以确保区段间的连接不含有潜在的t细胞表位。将所选的序列区段装配成完整v区序列,其缺乏显著的t细胞表位。然后选择五个重链(vh1
‑
vh5)和四个轻链(vκ1
‑
vκ4)序列用于哺乳动物细胞中的基因合成和表达。
[0254]
c.103.2人源化变体的构建
[0255]
将103.2人源化变体合成为具有侧翼限制酶位点,用于克隆至人igg4(s241p、l248e)重链和κ轻链的表达载体系统。将vh区克隆在mlu i和hind iii限制性位点间,且将vκ区克隆在bssh ii和bamh i限制性位点间。通过测序确认所有构建体。
[0256]
2.抗体的表达
[0257]
用maxcyte电穿孔系统(maxcyte inc.,gaithersburg,usa)将来自相应的无内毒素dna的嵌合103.2(vh0/vκ0)、两种对照组合(vh0/vκ1、vh1/vκ0)和人源化重链及轻链的组合(总共23对)瞬时转染到freestyle
tm cho
‑
s细胞(thermofisher,loughborough,uk)中。用oc
‑
400处理组件对每种抗体进行转染。细胞回收后,将细胞以3
×
106个细胞/ml稀释至含有8mml
‑
谷氨酰胺(thermofisher,loughborough,uk)和1
×
次黄嘌呤
‑
胸苷(thermofisher,loughborough,uk)的cd opti
‑
cho培养基(thermofisher,loughborough,uk)中。转染后24小时,将培养温度降低至32℃并添加1mm丁酸钠(sigma,dorset,uk)。通过添加3.6%(按起始体积)饲料(2.5%cho cd高效饲料a(thermofisher,loughborough,uk)、0.5%yeastolate(bd biosciences,oxford,uk)、0.25mm glutamax(thermofisher,loughborough,uk)和2g/l葡萄糖(sigma,dorset,uk)每天饲喂培养物。通过igg elisa监测igg上清液浓度,并在收获上清液前将转染物培养达14天。
[0258]
3.初步选择:与人btn3a1结合的103.2人源化变体的单周期动力学分析
[0259]
为评估所有103.2人源化变体的结合并选择对人btn3a1具有最高亲和力的抗体,用运行biacore t200评价软件v2.0.1(uppsala,sweden)的biacore t200(序列号1909913)对来自转染细胞培养物的上清液进行单周期动力学分析。
[0260]
基于通过elisa从上清液滴定获得的浓度,将抗体在2%bsa/pbs中稀释至2μg/ml的终浓度。在每个循环开始时,将抗体上样至protein a芯片(ge healthcare,little chalfont,uk)的fc2、fc3和fc4上。以10μl/min的流速捕获igg,得到约146.5ru的固定化水平(rl),获得约50ru的r
max
的理论值。然后使表面稳定。用btn3a1
‑
his作为分析物(sino biologicalcat.no.15973
‑
h08h),在30μl/min的流速下,及用hbs
‑
p+(ge healthcare,little chalfont,uk)作为运行缓冲液,获得单周期动力学数据以将任何潜在的传质作用最小化。用嵌合的抗体进行多个重复以检查动力学周期中表面和分析物的稳定性。从fc2,fc3和fc4的信号中减去来自参照通道fc1(无抗体)的信号,以校正与参照表面的非特异性结合中的差异。使在各浓度间没有再生的1.56nm
‑
25nm btn3a1的三点四倍稀释范围。每次监测三次递增浓度的btn3a1注射的结合期240秒,且在最后一次注射btn3a1后测量单解离期2000秒。protein a表面的再生通过两次注射10mm甘氨酸
‑
hcl ph1.5,然后稳定240秒来进行。
[0261]
减去来自每个抗体空白运行(无btn3a1)的信号以校正表面稳定性中的差异。
[0262]
4.所选抗体的纯化
[0263]
选择具有最佳亲和力和最佳itope
tm
评分的六种103.2人源化变体用于进一步分析。
[0264]
还基于它们相应的氨基酸序列计算了六种103.2人源化变体中每一种的等电点(pi)。
[0265]
将六种103.2所选的人源化变体(vh4/vκ2、vh4/vκ3、vh4/vκ4、vh5/vκ2、vh5/vκ3、vh5/vκ4)与vh0/vκ0嵌合和最保守的人源化变体(vh1/vκ1)一起进行纯化用于进一步的测定测试。在protein a琼脂糖柱上从细胞培养物上清液中纯化抗体,然后用10mm乙酸钠、100mm氯化钠,ph 5.5作为流动相和最终制剂缓冲液进行尺寸排阻层析(sec)(ge healthcare,little chalfont,uk)。基于预测的氨基酸序列,用消光系数(ec
(0.1%)
)通过od
280nm
定量样品。
[0266]
通过在凝胶上样2μg每种抗体,用sds
‑
page分析抗体(数据未显示)。
[0267]
5.所选人源化变体的表征
[0268]
a.竞争elisa分析
[0269]
测试纯化的变体与重组人btn3a1
‑
his(sino biological cat.no.15973
‑
h08h)的结合,同时竞争相应的鼠抗体,103.2。将嵌合(vh0/vκ0)和无关的人igg4(s241p、l248e)在每个板上测试和用于比较。
[0270]
将btn3a1在1xpbs中稀释至0.5μg/ml且将100μl/孔在96孔elisa板上在4℃下涂覆过夜。第二天,将板用1xpbs/0.05%tween(pbs
‑
t)洗涤3次,并用200μl 2%奶/pbs在室温下封闭1小时。在稀释96孔板中,将固定浓度的鼠抗体103.2(0.15μg/ml终浓度)以等体积添加至四倍滴定系列的测试抗体(从80μg/ml(40μg/ml终浓度)开始稀释至封闭缓冲液中)中。用pbs
‑
t洗涤nunc elisa板3次后,将100μl鼠/测试抗体混合物添加至elisa板。在室温下孵育1小时后,将板用pbs
‑
t洗涤3次,并在室温下施加在封闭缓冲液中以1:1000稀释的100μl抗小鼠fchrp标记的二抗(sigma,dorset,uk)1小时以检测结合的鼠抗体。用pbs
‑
t将板洗涤3次,然后添加100μl tmb底物并在室温下孵育5分钟。用100μl 3.0m盐酸终止反应,并立即用dynex读板器在450nm下读取吸光度。
[0271]
将结果作图,计算每种变体的ic
50
值,并通过将人源化变体的ic
50
除以在相同板上测定的嵌合抗体的ic
50
来计算相对ic
50
值(数据未显示)。
[0272]
b.热稳定性分析
[0273]
为评估六种所选的103.2人源化变体的热稳定性,用基于荧光的热移位测定来确定熔解温度(蛋白质结构域的50%未折叠时的温度)。
[0274]
将所有六种纯化的103.2人源化抗体与嵌合(vh0/vκ0)抗体和人源化变体(vh1/vκ1)一起在含有orange(thermofisher,loughborough,uk)的配制缓冲液(10mm醋酸钠、100mm氯化钠,ph5.5)中以1:1000的稀释度稀释至0.1mg/ml的终浓度,并在56分钟的时间内在steponeplus实时pcr体系(thermofisher,loughborough,uk)上经历25℃
‑
99℃的温度梯度。10mm乙酸钠、100mm氯化钠,ph5.5用作阴性对照。用蛋白质热稳定性软件(version 1.2)分析熔解曲线(数据未显示)。
[0275]
c.多周期循环动力学分析
[0276]
用运行biacore t200评价软件v2.0.1(uppsala,sweden)的biacore t200(序列号1909913)仪器,对六所种选的人源化103.2变体(vh4/vκ2、vh4/vκ3、vh4/vκ4、vh5/vκ2、vh5/vκ3、vh5/vκ4)以及嵌合抗体和人源化变体vh1/vκ1进行多周期动力学分析。
[0277]
将纯化的抗体在2%bsa/pbs中稀释至2μg/ml的浓度。在每个循环开始时,以约
146.5ru的密度(rl)(获得约50ru的r
max
理论值)在protein a上捕获每种抗体。捕获后,在注射btn3a1抗原(sino biological cat.no.15973
‑
h08h)之前使表面稳定。btn3a1在0.1%bsa/hbs
‑
p+(运行缓冲液)中以12
‑
0.375nm的两倍稀释范围滴定。监测结合期360秒和解离期45分钟(2700秒)。用40μl/min的流速获得动力学数据以将任何潜在的传质作用最小化。在每个循环结束时用两次注射10mm甘氨酸
‑
hcl ph 1.5进行protein a表面的再生。对每个测试的抗体进行两个空白(无btn3a1)和单一浓度分析物的重复的测试,以检查动力学循环中表面和分析物的稳定性。嵌合抗体运行两次。从fc2,fc3和fc4的信号中减去来自参照通道fc1的信号,以校正与参照表面的非特异性结合中的差异。另外,减去每个fc的空白运行以校正任何抗原非依赖性信号变化,诸如偏移。用具有全局r
max
参数且无大量信号(恒定ri=0ru)的一对一结合数学模型拟合传感图。
[0278]
通过将103.2人源化变体的k
d
除以相同芯片上的嵌合抗体的k
d
来计算与103.2嵌合抗体相比的相对k
d
(数据未显示)。
[0279]
d.对人pbmc的结合测定
[0280]
表征人源化变体与从健康供体血液分离的人pbmc的结合。用lymphoprep(axis
‑
shield,dundee,uk)密度离心从血沉棕黄层分离pbmc。然后将pbmc冷冻并储存在
‑
80℃或液氮中待用。
[0281]
将100μl的细胞以1x106个细胞/ml转移至新的u形底96孔板的各孔中,然后将板离心并弃去上清液。
[0282]
在pbs 2mm edta中制备抗体的系列稀释液,0.001μg/ml
‑
150μg/ml。将人pbmc重悬于50μl制备的稀释的测试抗体滴定系列中。
[0283]
在4℃下在黑暗中孵育30分钟后,将板离心并用pbs 2mm edta以150μl/孔洗涤沉淀两次,随后将沉淀重悬于50μl由1/100稀释的山羊抗人抗体(pe标记)和1/500稀释于pbs 2mm edta中的活的/死的纯ir组成的混合物中。
[0284]
在4℃下在黑暗中孵育15分钟后,将板离心并用pbs 2mm edta以150μl/孔洗涤沉淀一次,随后将沉淀重悬于200μl pbs 2mm edta中。在bd lsr fortessa细胞仪上分析细胞。用flowjo软件(version 10,flowjo,llc,ashland,usa—数据未显示)分析数据。
[0285]
e.vγ9vδ2 t细胞脱粒测定
[0286]
使用与第i.3部分所述的相同方案。
[0287]
总之,在结合测定、热稳定性研究和功能测试中获得的结果允许选择参照人源化候选物:具有c
‑
末端赖氨酸缺失的(根据kabat命名法编号)103.2vh4/vk4 igg1 l247f l248e p350s,本文也称为hu103.2。
[0288]
iii.用以其不同形式(igg、fab和f(ab’)2)的103.2抗体(hu103.2)的人源化形式进行的实验
[0289]
用在人源化过程之后选择的参照人源化候选物进行所有以下实验,所述参照人源化候选物对应于103.2vh4/vk 4igg 1l247 fl248ep350sdk,在本文中也称为hu103.2。
[0290]
1.fab和f(ab’)2片段的制备
[0291]
使用与第i.1部分所述相同的方案。
[0292]
2.用biacore测定103.2抗体(hu103.2)的人源化形式(igg、fab和f(ab’)2)的亲和力
[0293]
为评估以其不同形式(fab、f(ab’)2和igg)的参照人源化103.2抗体(hu103.2)对人btn3a1的亲和力,用运行biacore t200对照软件v2.0.1和评估软件v3.0(ge healthcare,uppsala,sweden)的biacore t200(serial no.1909913)仪器进行周期环动力学分析。所有单周期动力学实验在25℃下用含有0.1%bsa的hbs
‑
p+运行缓冲液(ph 7.4)(ge healthcare,little chalfont,uk)运行。
[0294]
将人btn3a1 his
‑
标记的抗原(sino biological,beijing,china)在运行缓冲液中稀释至0.4μg/ml的终浓度。在每个循环开始时,用his捕获试剂盒(ge healthcare,little chalfont,uk)用标准胺化学以10μl/min的流速将人btn3a1
‑
his捕获至预偶联的cm5传感器芯片的fc2上。约34ru、16ru或11ru的固定化水平(rl),获得约50ru的r
max
的不同理论值分别用于分析物fab、f(ab’)2和igg。然后使表面稳定。用纯化的样品(fab、f(ab’)2和igg)以40μl/min的流速获得单周期动力学数据以将任何潜在的传质作用最小化。从fc2的信号中减去来自参照通道fc1(无抗原捕获)的信号,以校正与参照表面的非特异性结合中的差异。减去人btn3a1
‑
his空白运行(无分析物)的信号以校正表面稳定性中的差异。每次监测5次递增浓度注射的缔合期240秒,在分析物最后一次注射后测量单解离期1400秒。芯片表面的再生通过两次注射10mm甘氨酸
‑
hcl ph1.5,然后稳定240秒来进行。
[0295]
与分析物的不同价态一致情况下,用fab样品的1:1模型和f(ab’)2的二价分析物模型和igg样品拟合原始传感图。
[0296]
获得的动力学值列于表4、表5和表6中。
[0297]
3.用octet
tm
测定103.2抗体(hu103.2)的人源化形式(igg、fab和f(ab’)2)的亲和力
[0298]
为评估以其不同形式(fab、f(ab’)2和igg)的先导人源化103.2抗体对人btn3a1的亲和力,使用生物层干涉测量技术。用octetred96(fortebio)在黑色96孔板(greiner)中在30℃下以1000rpm振荡来进行所有运行(包括上样、平衡、传感器结合/浸入分析物、解离和再生)。fab2g传感器(抗人ch1;fortebio),首先用0.2ml动力学缓冲液(pbs ph 7.4,0.02%tween20和0.1%bsa)水合10分钟,然后加载103.2抗体或片段的人源化形式(2μg/ml)。监测抗体或片段与各种浓度的人btn3a1(60、30、15、7.5、3.75和1.87nm)的结合300秒,然后在动力学缓冲液中解离,典型地,500秒。用1:1模型的octetrred系统软件(version 7.1)进行数据拟合和常数测量。用具有不相关抗体的对照来评估靶蛋白质的非特异性结合的缺乏。
[0299]
获得的动力学值列于表7中。
[0300]
4.活化和增殖测定
[0301]
从3个健康供体分离pbmc,用celltrace violet染料染色,并在37℃,5%co2下与67nm的不同人源化103.2形式(igg、fab和f(ab’)2)孵育5天。然后,通过流式细胞仪分析观察不同免疫亚群的活化和增殖。
[0302]
所得结果总结于表8中。
[0303]
5.vγ9vδ2 t细胞脱粒测定
[0304]
使用与第i.1部分所述相同的方案。将分离自3个不同健康供体的vγ9vδ2 t细胞扩增并与两种不同细胞系共孵育:daudi(淋巴瘤细胞系)和skov
‑
3(卵巢癌细胞系)。在该测定中测试了几种剂量的103.2的不同人源化形式(igg1、fab和f(ab’)2)。
[0305]
每种形式获得的ec
50
值(对应于获得最大作用的50%所需的片段浓度,即活化的v
γ9vδ2 t细胞的最大比例的50%)列于表9中。
[0306]
结果
[0307]
i.用103.2fab和f(ab’)2片段的嵌合形式进行的实验
[0308]
1.fab和f(ab’)2片段的制备
[0309]
通过sds
‑
page、分析性sec和用于qc分析的od
280nm
读数分析fab和f(ab’)2片段。对于纯化的fab和f(ab’)2片段没有观察到聚集(数据未显示)。
[0310]
2.用biacore测定嵌合的103.2fab和f(ab’)2片段的亲和力
[0311]
用biacore评估嵌合的103.2fab和f(ab’)2片段对人btn3a1的亲和力。获得的动力学常数列于表1中(f(ab’)2片段)和表2中(fab片段)。
[0312]
表1:用biacore评估嵌合103.2f(ab’)2片段对人btn3a1的亲和力获得的动力学值
[0313][0314]
表2:用biacore评估嵌合103.2fab片段对人btn3a1的亲和力获得的动力学值
[0315][0316]
103.2嵌合形式以一价形式获得的k
d
值在纳摩尔范围内。
[0317]
3.嵌合103.2(igg、fab和f(ab’)2)在vγ9vδ2 t细胞脱粒测定中的功效
[0318]
嵌合103.2片段诱导vγ9vδ2 t细胞毒性的功效在脱粒测定中评估,其中vγ9vδ2 t细胞与daudi细胞共孵育。vγ9vδ2 t细胞在其表面表达cd107的比例在表3中详述。
[0319]
表3:在以其不同形式(igg、fab和f(ab’)2)的嵌合103.2抗体(10μg/ml)存在下,对靶癌细胞(daudi细胞)的脱粒vγ9vδ2 t细胞(cd107+细胞)的百分比
[0320][0321]
*列出的数字是用从3个不同健康供体获得的值以对应于10μg/ml的剂量计算的平均值。
[0322]
如所预期,其全长形式的103.2抗体通过降低脱粒的vγ9vδ2 t细胞的级分至在未刺激的(无靶标,无抗体)vγ9vδ2 t细胞中观察到的水平而显示出强拮抗剂作用。
[0323]
令人惊讶的是,通过增强vγ9vδ2 t细胞脱粒,f(ab’)2和fab形式显示出相反的作
用。这种作用是完全出人意料的。
[0324]
ii.103.2抗体的人源化
[0325]
1.人源化变体的初步选择
[0326]
设计并产生总共23对人源化vh和vl区用于初步选择。
[0327]
基于用biacore评估的抗体亲和力、itope
tm
评分和人源百分比,选择具有最佳亲和力和最佳itope
tm
评分的六种103.2人源化变体用于进一步分析(数据未显示)。
[0328]
2.所选的人源化变体的表达和纯化
[0329]
产生、纯化并通过sds
‑
page分析所选的人源化变体。在sds
‑
page上观察到对应于典型抗体谱的条带。
[0330]
3.所选人源化变体的表征
[0331]
首先,测试纯化的103.2人源化变体与重组人btn3a1的结合,同时与鼠形式竞争。所有测试的人源化变体具有估计的嵌合两倍以内的ic
50
(数据未显示)。
[0332]
然后,用基于荧光的热移位测定评估六种所选的103.2人源化变体的热稳定性。在该测定中,所有抗体变体显示两个不同的未折叠事件,其中较高的tm随着人源化程度的增加而增加。
[0333]
用biacore测试六种所选的103.2人源化变体的亲和力。在该实验中,所有103.2人源化变体显示出在103.2嵌合抗体的两倍内的亲和力(数据未显示)。
[0334]
在分离自健康供体的人pbmc上,通过流式细胞仪评估每种人源化变体的结合。验证了每种抗体与膜展示蛋白结合的能力,且每种变体获得的ec
50
值相当(数据未显示)。
[0335]
最后,进行脱粒测试以评价每种人源化变体的功效,且每种抗体获得的ec
50
值相似(数据未显示)。
[0336]
基于所有产生的数据,选择一种前导人源化变体用于对应于vh4/vk4的免疫原性评估。将可变区移植至igg1 fc
‑
沉默部分(包括突变l247f、l248e、p350s、dk(c末端赖氨酸缺失))。将产生的最终人源化候选抗体片段命名为hu103.2。
[0337]
iii.用以其不同形式(igg、fab和f(ab’)2)的103.2抗体(hu103.2)人源化形式进行的实验
[0338]
1.fab和f(ab’)2片段的制备
[0339]
通过sds
‑
page、分析性sec和用于qc分析的od
280nm
读数分析fab和f(ab’)2片段。对于纯化的fab和f(ab’)2片段没有观察到聚集(数据未显示)。
[0340]
2.用biacore测定以其不同形式(igg、fab和f(ab’)2)的103.2抗体(hu103.2)人源化形式的亲和力
[0341]
通过biacore评估以其不同形式(igg、fab和f(ab’)2)的人源化103.2抗体对人btn3a1的亲和力。获得的igg形式的动力学值列于表4中,f(ab’)2片段的列于表5中,fab形式的列于表6中。
[0342]
表4:用biacore评估人源化103.2全长(hu103.2)抗体对人btn3a1的亲和力获得的动力学值
[0343][0344]
表5:用biacore评估人源化103.2(hu103.2)f(ab’)2片段对人btn3a1的亲和力获得的动力学值
[0345][0346]
表6:用biacore评估人源化103.2(hu103.2)fab片段对人btn3a1的亲和力获得的动力学值
[0347][0348]
人源化103.2(hu103.2)以一价形式获得的k
d
值大约在纳摩尔范围内,意味着在人源化过程中没有亲和力损失。
[0349]
3.用octet测定以其不同形式(igg、fab和f(ab’)2)的103.2抗体(hu103.2)人源化形式的亲和力
[0350]
以其不同形式(igg、fab和f(ab’)2)的人源化103.2抗体对人btn3a1的亲和力也用octetred96进行。获得的动力学值列于表7中。
[0351]
表7:用octetred96评估人源化103.2片段(igg、fab、f(ab’)2)对人btn3a1的亲和力获得的动力学值
[0352]
[0353]
人源化103.2片段以不同形式(igg、fab和f(ab’)2)获得的k
d
值在纳摩尔范围内。
[0354]
4.活化和增殖测定
[0355]
以其不同形式(igg1、fab和f(ab’)2)的人源化103.2抗体(hu103.2)对pbmc内不同免疫亚群的活化和增殖的作用通过用流式细胞仪在不同免疫细胞表面检测增殖和活化标志物来评估。
[0356]
未观察到任何抗体片段对b细胞、cd4和cd8 t细胞的作用。然而观察到vγ9vδ2 t细胞的增殖和活化两者。反映细胞分裂分析的细胞示踪紫分裂值和在其表面表达cd25的细胞的比例总结在表8中。
[0357]
表8:vγ9vδ2 t细胞增殖和活化的分析
[0358][0359][0360]
*列出的数字是用从3个健康供体获得数值计算的平均值。
[0361]
尽管人源化103.2抗体(hu103.2)的全长形式对vγ9vδ2 t细胞没有作用,但fab和f(ab’)2片段诱导它们的增殖(如反映细胞分裂的ctv稀释度的增加所示)和它们的活化(由表达cd25受体(其为活化标志物)的vγ9vδ2 t细胞的增加所反映)。
[0362]
5.vγ9vδ2 t细胞脱粒测定
[0363]
在脱粒测定中评估以其不同形式(igg、fab和f(ab’)2)的人源化103.2抗体(hu103.2)的功效。测试每种形式的不同剂量并测定ec
50
值,且列于表9中。
[0364]
表9:以其不同形式(igg、fab和f(ab’)2)的人源化103.2抗体(hu103.2)在以daudi或skov
‑
3作为靶细胞的vγ9vδ2 t细胞脱粒测定中获得的ec
50
值
[0365][0366]
*列出的数字是用从3个健康供体获得数值计算的平均值。
[0367]
**如所预期,全长形式的hu103.2显示出强的拮抗剂作用且未获得ec
50
值。
[0368]
hu103.2 fab和f(ab’)2片段显示出对vγ9vδ2 t细胞的强激动剂作用,其中fab片段的ec
50
值在亚纳摩尔范围内,而f(ab’)2片段的ec
50
值在亚皮摩尔范围内。
[0369]
同样,完全出人意料的是hu103.2显示出与全长抗体一样强的拮抗剂作用,而其fab和f(ab’)2形式显示出相反的作用。
[0370]
序列表
[0371]
表10和表11:用于实施本发明的可用的氨基酸和核苷酸序列的简要描述
[0372]
表10
[0373][0374]
表11:
[0375]
[0376][0377]
参考文献
[0378]
ausubel,f.m.,brent,r.,kingston,r.e.,moore,d.d.,seidman,j.g.,and struhl,k.(1988).current protocols in molecular biology(john wiley&sons).
[0379]
bird,r.e.,hardman,k.d.,jacobson,j.w.,johnson,s.,kaufman,b.m.,lee,s.m.,lee,t.,pope,s.h.,riordan,g.s.,and whitlow,m.(1988).single
‑
chain antigen
‑
binding proteins.science 242,423
–
426.
[0380]
blazquez,j.
‑
l.,benyamine,a.,pasero,c.,and olive,d.(2018).new insights into the regulation of vγ9vδ2 t cells by btn3a and other btn/btnl in tumor immunity.front.immunol.9.
[0381]
brennan,m.,davison,p.f.,and paulus,h.(1985).preparation of bispecific antibodies by chemical recombination of monoclonal immunoglobulin g1 fragments.science 229,81
–
83.brunet,j.
‑
f.,denizot,f.,luciani,m.
‑
f.,roux
‑
dosseto,m.,suzan,m.,mattei,m.
‑
g.,and golstein,p.(1987).a new member of the immunoglobulin superfamily—ctla
‑
4.nature 328,267
–
270.
[0382]
bryson,c.j.,jones,t.d.,and baker,m.p.(2010).prediction of immunogenicity of therapeutic proteins.biodrugs 24,1
–
8.
[0383]
chemnitz,j.m.,parry,r.v.,nichols,k.e.,june,c.h.,and riley,j.l.(2004).shp
‑
1 and shp
‑
2associate with immunoreceptor tyrosine
‑
based switch motif of programmed death 1upon primary human t cell stimulation,but only receptor ligation prevents t cell activation.the journal of immunology 173,945
–
954.
[0384]
gentles,a.j.,newman,a.m.,liu,c.l.,bratman,s.v.,feng,w.,kim,d.,nair,v.s.,xu,y.,khuong,a.,hoang,c.d.,et al.(2015).the prognostic landscape of genes and infiltrating immune cells across human cancers.nature medicine 21,938
–
945.
[0385]
glennie,m.j.,mcbride,h.m.,worth,a.t.,and stevenson,g.t.(1987).preparation and performance of bispecific f(ab’gamma)2antibody containing thioether
‑
linked fab’gamma fragments.the journal of immunology 139,2367
–
2375.
[0386]
goeddel,d.v.(1990).[1]systems for heterologous gene expression.in methods in enzymology,(academic press),pp.3
–
7.
[0387]
greenwald,r.j.,freeman,g.j.,and sharpe,a.h.(2005).the b7 family revisited.annu.rev.immunol.23,515
–
548.
[0388]
harly,c.,guillaume,y.,nedellec,s.,peign
é
,c.
‑
m.,h.,j.,li,j.,kuball,j.,adams,e.j.,netzer,s.,et al.(2012).key implication of cd277/butyrophilin
‑
3(btn3a)in cellular stress sensing by a major human vγ9vδ2 t
‑
cell subset.blood 120,2269
–
2279.
[0389]
huston,j.s.,levinson,d.,mudgett
‑
hunter,m.,tai,m.s.,novotny,j.,margolies,m.n.,ridge,r.j.,bruccoleri,r.e.,haber,e.,and crea,r.(1988).protein engineering of antibody binding sites:recovery of specific activity in an anti
‑
digoxin single
‑
chain fv analogue produced in escherichia coli.pnas 85,5879
–
5883.
[0390]
kabat,e.a.,wu,t.t.,foeller,c.,perry,h.m.,and gottesman,k.s.(1992).sequences of proteins of immunological interest(diane publishing).
[0391]
karpovsky,b.,titus,j.a.,stephany,d.a.,and segal,d.m.(1984).production of target
‑
specific effector cells using hetero
‑
cross
‑
linked aggregates containing anti
‑
target cell and anti
‑
fc gamma receptor antibodies.journal of experimental medicine 160,1686
–
1701.
[0392]
kaufman,r.j.,and sharp,p.a.(1982).construction of a modular dihydrofolate reductase cdna gene:analysis of signals utilized for efficient expression.mol cell biol 2,1304
–
1319.
[0393]
liu,m.a.,kranz,d.m.,kurnick,j.t.,boyle,l.a.,levy,r.,and eisen,h.n.(1985).heteroantibody duplexes target cells for lysis by cytotoxic t lymphocytes.pnas 82,8648
–
8652.
[0394]
mccafferty,j.,griffiths,a.d.,winter,g.,and chiswell,d.j.(1990).phage antibodies:filamentous phage displaying antibody variable domains.nature 348,552
–
554.
[0395]
morrison,s.l.(1985).transfectomas provide novel chimeric antibodies.science 229,1202
–
1207.
[0396]
palakodeti,a.,sandstrom,a.,sundaresan,l.,harly,c.,nedellec,s.,olive,d.,scotet,e.,bonneville,m.,and adams,e.j.(2012).the molecular basis for modulation of human vγ9vδ2t cell responses by cd277/butyrophilin
‑
3(btn3a)
‑
specific antibodies.j.biol.chem.287,32780
–
32790.
[0397]
paulus,h.(1985).preparation and biomedical applications of bispecific antibodies.behring inst.mitt.118
–
132.
[0398]
perry,l.c.a.,jones,t.d.,and baker,m.p.(2008).new approaches to prediction of immune responses to therapeutic proteins during preclinical development.drugs r d 9,385
–
396.
[0399]
remington,j.p.,and gennaro,a.r.(1995).remington:the science and practice of pharmacy(easton,pa:mack publishing).
[0400]
riley,j.l.,and june,c.h.(2005).the cd28 family:a t
‑
cell rheostat for therapeutic control of t
‑
cell activation.blood 105,13
–
21.
[0401]
sedykh,s.e.,prinz,v.v.,buneva,v.n.,and nevinsky,g.a.(2018).bispecific antibodies:design,therapy,perspectives.
[0402]
shukla,a.a.,hubbard,b.,tressel,t.,guhan,s.,and low,d.(2007).downstream processing of monoclonal antibodies—application of platform approaches.journal of chromatography b848,28
–
39.
[0403]
stech,m.,nikolaeva,o.,thoring,l.,w.f.m.,w
ü
stenhagen,d.a.,hust,m.,d
ü
bel,s.,and kubick,s.(2017).cell
‑
free synthesis of functional antibodies using a coupled in vitro transcription
‑
translation system based on cho cell lysates.scientific reports 7,12030.
[0404]
takebe,y.,seiki,m.,fujisawa,j.,hoy,p.,yokota,k.,arai,k.,yoshida,m.,and arai,n.(1988).sr alpha promoter:an efficient and versatile mammalian cdna expression system composed of the simian virus 40 early promoter and the r
‑
u5 segment of human t
‑
cell leukemia virus type 1 long terminal repeat.mol.cell.biol.8,466
–
472.
[0405]
tosolini,m.,pont,f.,poupot,m.,vergez,f.,nicolau
‑
travers,m.
‑
l.,vermijlen,d.,sarry,j.
‑
e.,dieli,f.,and fourni
é
,j.
‑
j.(2017).assessment of tumor
‑
infiltrating tcrvγ9vδ2 vγ9vδ2lymphocyte abundance by deconvolution of human cancers microarrays.oncoimmunology 6,e1284723.
[0406]
urlaub,g.,and chasin,l.a.(1980).isolation of chinese hamster cell mutants deficient in dihydrofolate reductase activity.proc natl acad sci u s a 77,4216
–
4220.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1