通用型双阴性T细胞的制备和治疗用途
本申请要求于2018年12月19日提交的美国临时专利申请号62/782,005的优先权,该美国临时专利申请的全部内容在此以引用的方式并入本文。
技术领域
本发明涉及双阴性T细胞(DNT)并且更具体地,涉及可冷冻保存的DNT的制备以及DNT作为通用型过继性细胞疗法用于治疗癌症的用途。
背景技术
在多项临床研究中已经证实了使用T细胞治疗不同的血液学和实体恶性肿瘤的过继性细胞疗法(ACT)的有效性1,2。诸如对免疫细胞进行遗传修饰以表达嵌合抗原受体(CAR)或转基因T细胞受体和使用人工抗原呈递细胞的技术的进步已经被实现以提高ACT的治疗效力3,4。最近,CD19-CAR T细胞疗法在患有B细胞恶性肿瘤的患者中实现了有效的临床响应1并且已经被FDA批准用于这些疾病的临床使用5。然而,随着需要用ACT治疗的患者数量的增加,当前的ACT形式的局限性已经变得明显,包括复杂的扩增方法导致产生治疗相关数量的T细胞的不确定性、细胞扩增所需的时间、需要临床批准的用于细胞扩增的设施、所制造的细胞产品不一致以及生产成本高6。
同种异体造血干细胞移植(allo-HSCT)是对患有多种类型的造血系统恶性肿瘤的患者具有长期治愈潜力的标准化的二线治疗7。allo-HSCT的治疗益处来自于靶向对常规诱导化疗具有抗性的白血病原始细胞的供者来源的免疫细胞介导的移植物抗白血病(GvL)效应7。接受allo-HSCT的患者的存活率提高证实了免疫细胞介导的GvL效应的效力,但是该效应并不完全。为了增强GvL效应,患者可以接受供者淋巴细胞输注(DLI)治疗,其中向移植受者给予来自HSC供者的外周的成熟淋巴细胞,作为预防或治疗方案以预防或治疗移植后疾病复发8。然而,复发性疾病仍然是死亡的主要原因并且在30%-40%的allo-HSCT患者中见到9。
此外,allo-HSCT与高的治疗相关毒性有关。其中,移植物抗宿主病(GvHD)是接受allo-HSCT的患者中非复发死亡(NRM)的主要原因10,11。GvHD通过供者来源的免疫细胞将受者的正常同种异体组织识别为外来物并且对它们进行攻击而发生。在30%-50%接受治疗的患者中见到急性GVHD,其中14%患有更严重的III级或IV级,并且30%-70%的allo-HSCT受者表现出慢性GvHD10,11。GvHD显著损害了患者的生活质量并且增加了他们的发病率和死亡率。令人遗憾的是,目前可用的免疫抑制剂靶向供者来源的T细胞,而不区分诱导GvL效应的T细胞和诱导GvHD的T细胞。因此,当前形式的免疫抑制剂的副作用包括疾病复发和感染的风险增加。因此,当与allo-HSCT辅助使用时可以在没有GvHD的情况下诱导GvL或在维持GvL的同时控制GvHD的治疗是allo-HSCT患者的“圣杯”。
通用型ACT侧重于从同种异体供者产生大批量细胞并且使用它们来治疗大量患者12。由于这种方法不是患者特异性的,因此可以预先制造细胞产品以节省时间6,12。大量生产还以较低的成本增加了产品的一致性、可用性和可靠性。然而,有效的临床适用的通用型同种异体T细胞疗法应当满足以下标准:1)可在符合临床要求的条件下扩增到治疗相关数量;2)不会引起移植物抗宿主病(GvHD);3)能够以不受供者限制的方式靶向一系列癌症;4)不会被受者的免疫系统排斥而实现足够的持久性;5)可以在GMP条件下储存而不会妨碍它们的功能。据我们所知,还没有报道显示这样的过继性细胞疗法,在不进行任何遗传修饰的情况下,所述过继性细胞疗法具有长期储存能力并且可以避免宿主抗移植物(HvG)排斥反应,同时满足通用型疗法的其它要求。
双阴性T细胞(DNT)是成熟的T细胞,其占外周T细胞的3%-5%并且被定义为在不存在CD4和CD8的情况下表达CD313-15。最近,证实了健康供者(HD)来源的同种异体DNT在体外和患者来源的异种移植模型中靶向急性骨髓性白血病(AML)并且与常规化疗具有协同的抗癌活性13-15。
技术实现要素:
在一个方面,本申请的发明人已经开发了在GMP条件下将DNT扩增到治疗水平的方法,所述DNT可以冷冻保存以用于长期储存并且使用基于流式细胞术的高通量筛选来表征它们的表面分子表达模式。通过在体外和异种移植模型中评估由各种供者来源的DNT诱导的针对多种癌症类型的细胞毒性和它们的肿瘤外毒性并且确定在GMP条件下冷冻保存对细胞活力和功能的影响来研究临床级DNT的通用潜能。此外,确定了DNT在体外和体内对常规的同种异体T细胞的敏感性。
在一个方面,本申请的发明人研究了通用型DNT作为单一疗法或作为同种异体造血干细胞移植(allo-HSCT)的辅助疗法治疗癌症的应用。在异种移植模型中DNT与外周单核细胞(PBMC)一起输注显示出比DNT单一疗法更好的抗白血病活性并且显示出与PBMC单一疗法相比降低的肿瘤外毒性。
值得注意的是,如实施例1中所示,临床级DNT在17天内扩增了1558±795.5倍,纯度>90%。扩增的DNT以不受供者限制的方式对各种癌症类型显示出强效的体外细胞毒活性,其中来自单个供者的DNT靶向多种白血病靶细胞并且来自不同供者的DNT对相同的靶细胞显示出相似程度的抗白血病活性。DNT提高了输注致死剂量的爱泼斯坦-巴尔病毒(Epstein-Barr virus)转化的淋巴母细胞样细胞系(EBV-LCL)的小鼠的存活率,并且显著地减少了人类白血病异种移植模型中的白血病植入。本申请的发明人建立了扩增临床级可冷冻保存的DNT的方案和使用符合GMP的试剂对它们进行最佳冷冻保存的方案,其将活力和抗癌功能维持了至少600天。重要的是,活的同种异体DNT在体外没有诱导同种异体反应性CD8+ T细胞的细胞毒性,并且将活的DNT与来自不同供者的PBMC共同输注到小鼠体内引起了DNT和PBMC来源的同种异体常规T细胞的共植入而不存在对DNT的细胞毒性,这表明了没有宿主抗移植物反应。本文所述的方法因此可用于产生满足通用型过继性细胞疗法的要求的治疗数量的可冷冻保存的临床级DNT。
如实施例2中所示,可以在同一培养物中从多个不同(同种异体)供者扩增临床级DNT,而不会在扩增期间彼此产生同种异体反应性。从汇集的供者样品离体扩增的DNT的表征显示,扩增的同种异体细胞维持了针对癌细胞的细胞毒性,而不会诱导针对正常细胞的细胞毒性或引起移植物抗宿主病(GvHD)。因此,在一个实施方案中,提供了一种离体扩增双阴性T细胞(DNT)群体的方法,所述方法包括:
a)提供DNT样品群体,其中所述DNT样品群体包含来自一个或多个供者的DNT;和
b)在培养基中培养所述DNT样品群体以产生扩增的DNT群体,任选地临床级DNT群体。
在一个实施方案中,所述DNT样品群体包含来自两个或更多个供者的DNT。在一个实施方案中,所述DNT样品群体包含来自外周血、白细胞去除术、Leukopak、骨髓和/或脐带血样品的DNT。
在一个实施方案中,所述来自不同供者的DNT在所述扩增的DNT群体中不会彼此产生同种异体反应性。在一个实施方案中,在所述样品群体中来自不同供者的DNT不会彼此产生同种异体反应性。在一个实施方案中,所述培养基是无动物血清的培养基。在一个实施方案中,所述培养基还包含人类血液来源的组分,任选地人类血浆、血清或HSA。所述人类血液来源的组分可以与所述DNT样品群体是自体的或同种异体的。任选地,所述人类血液来源的组分包含来自一个或多个供者的血浆。在一个实施方案中,在所述培养基中所述人类血液来源的组分的浓度是约1%-20%。在一个实施方案中,在所述培养基中所述血浆的浓度是2%-15%。在一个实施方案中,所述DNT样品群体包含来自外周血的DNT。在一个实施方案中,所述扩增的DNT群体产生每毫升外周血至少0.1×108个、0.2×108个、0.5×108个、0.8×108个或1.0×108个DNT。
在一个实施方案中,所述扩增的DNT群体包含至少50%、60%、70%、80%、85%或90%的DNT或由至少50%、60%、70%、80%、85%或90%的DNT组成。在一个实施方案中,所述方法包括将所述细胞分瓶以维持高于每毫升所述培养基10万个且低于每毫升所述培养基400万个的细胞群体。
如实施例3中所示,对DNT的长期冷冻保存进行的进一步研究鉴定了将细胞的活力和细胞毒活性保持至少600天的冷冻保存方法。
在一个实施方案中,提供了一种产生用于治疗应用的双阴性T细胞(DNT)群体的方法。在一个实施方案中,所述方法包括:
提供DNT样品群体,其中所述DNT样品群体包含来自一个或多个供者的DNT;
在培养基中培养所述DNT样品群体以产生扩增的DNT群体,任选地其中所述培养基符合GMP;
将所述扩增的DNT群体在储存培养基中重悬;和任选地
将DMSO添加到所述储存培养基中达到约3%至约15%DMSO,任选地约5%至10%DMSO的最终浓度。
在一个实施方案中,所述方法包括将DMSO添加到所述储存培养基中达到约3%至约15%DMSO,任选地约5%至10%DMSO的最终浓度。
还提供了一种用于冷冻保存DNT的方法。在一个实施方案中,所述方法包括:
a)将扩增的DNT群体在储存培养基中重悬;
b)将DMSO添加到所述储存培养基中达到约3%至约15%DMSO的最终浓度;和
c)在低于-70℃的温度下将所述DNT群体在所述储存培养基中冷冻保存。
在一个实施方案中,在将所述DNT群体在所述储存培养基中重悬之前,所述DNT群体已经离体扩增,任选地根据如本文所述的用于扩增DNT的方法。
在一个实施方案中,在所述储存培养基中DMSO的最终浓度是约3%至约15%,任选地是约5%至10%。在一个实施方案中,将DMSO添加到所述储存培养基中。在一个实施方案中,所述DNT在所述储存培养基中的最终浓度是约2.5×107个至约2.5×108个细胞/毫升,任选地是约5×107个至10×107个细胞/毫升。
还提供了根据本文所述的方法产生、扩增和/或冷冻保存的DNT群体。在一个实施方案中,所述群体来自于来自一个或多个供者的DNT的单次扩增并且用于向一个或多个受试者使用或施用以治疗癌症。在一个实施方案中,所述DNT群体来自于来自一个或多个供者的DNT的单次扩增并且用于在一种或多种治疗中向患有癌症的一个受试者使用或施用。在一个实施方案中,所述DNT群体包含来自两个或更多个供者的DNT并且用于使用或施用以治疗癌症。
在一个实施方案中,所述DNT群体在扩增前表达CD3而不表达CD4或CD8和/或在扩增后至少5天、10天、14天、17天或20天表达CD3而不表达CD4或CD8。
在一个实施方案中,所述DNT群体是CD11a+、CD18+、CD10-和/或TCR Vα24-Jα18-。在一个实施方案中,所述DNT群体是CD49d+、CD45+、CD58+CD147+CD98+CD43+CD66b-CD35-CD36-和/或CD103-的DNT。
在另一个方面,提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向所述受试者施用有效量的如本文所述的DNT群体,任选地与allo-HSC和/或PBMC组合施用。在一个实施方案中,所述DNT群体包含来自一个或多个供者,任选地两个或更多个供者的同种异体DNT。还提供了DNT群体作为单一疗法或与allo-HSC和/或PBMC组合用于治疗癌症的用途,其中所述DNT群体包含来自一个或多个供者,任选地两个或更多个供者的同种异体DNT。在一个实施方案中,本文所述的方法和用途包括施用或使用DNT作为单一疗法。在一个实施方案中,本文所述的方法和用途包括同时施用或使用DNT和同种异体HSC和/或PBMC。在另一个实施方案中,本文所述的方法和用途包括在不同的时间施用或使用DNT和同种异体HSC和/或PBMC。值得注意的是,如实施例3和图18B中所示,在AML的NSG异种移植小鼠模型中,在先用PBMC处理而后用DNT处理的小鼠的骨髓中无法检测到AML细胞。
还提供了包含DNT和HSC的组合物或试剂盒。还提供了包含DNT和PBMC的组合物或试剂盒。在一个实施方案中,所述PBMC是淋巴细胞,如常规的CD4+ CD8+ T细胞。在一个实施方案中,本文所述的DNT与供者淋巴细胞输注组合用于治疗有需要的受试者的癌症。在一个实施方案中,所述试剂盒在不同的容器中包含DNT与HSC和/或PBMC。
在一个实施方案中,所述DNT已经离体扩增,任选地其中所述同种异体DNT已经根据本文所述的方法扩增。
在一个实施方案中,所述来自不同供者的DNT在所述DNT群体中不会彼此产生同种异体反应性。在一个实施方案中,所述DNT群体在所述受试者体内对同种异体免疫细胞介导的排斥反应具有抗性。在一个实施方案中,所述DNT群体在所述受试者体内持续存在至少10天,任选地至少2周、至少3周或至少4周。
还提供了用于扩增和/或冷冻保存如本文所述的DNT群体的试剂盒。
附图说明
现在将关于附图描述本发明的实施方案,在所述附图中:
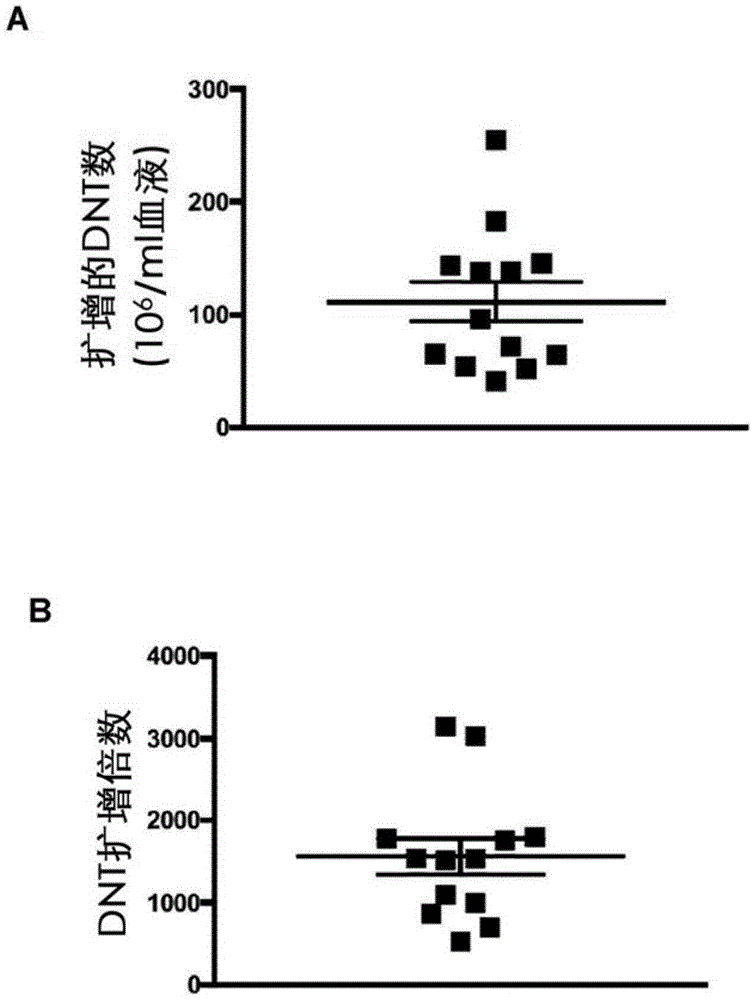
图1:在GMP条件下扩增的临床级DNT。(A和B)示出了在培养17天后源自于每毫升血液的DNT数量(A)和扩增倍数(B)。每一个符号代表源自于11个不同供者的13个DNT培养物之一的结果。C)用免疫细胞亚群标志物对如本文所述扩增的DNT进行染色:CD3、CD4和CD8,以检查细胞的纯度。所示的结果代表了从13次扩增中扩增的DNT。(D-I)示出了对来自三个供者的扩增DNT进行基于流式细胞术的表面分子高通量筛选的结果。直方图示出了T细胞相关标志物CD2、CD3和CD5以及B细胞相关标志物CD19和CD20的代表性结果,以确认筛选方法的有效性(D)。图示出了在来自三个供者的扩增DNT上T细胞分化标志物(E)、趋化因子受体(F)、细胞毒性分子(G)、共刺激分子(H)和共抑制分子(I)的表达。每一个符号代表来自一个供者的DNT。所示的数字是在DNT上表达相应分子的细胞%。水平条柱代表平均值±SEM。(J)添加TIM-3抗体降低了由DNT介导的针对AML3/OCI的杀伤水平。(K)添加抗CD3抗体增加了由DNT介导的针对AML3/OCI的杀伤。
图2:DNT在没有肿瘤外毒性的情况下诱导了针对各种癌症靶细胞的细胞毒活性。A)使用如本文所述的体外基于流式细胞术的杀伤测定,从HD扩增的DNT针对源自于各种癌症类型的细胞系的细胞毒性:骨髓瘤(82)、T细胞白血病(Jurkat)、伯基特氏淋巴瘤(Burkitt's lymphoma)(Daudi)、AML(OCI/AML3)、EBV-LCL、大细胞肺癌(H460)和腺癌(A549)。按一式三份进行实验并且所示的结果代表了针对每一种靶细胞的超过3次独立实验。B)使用从两个HD(HD1和HD2)扩增的DNT针对两种白血病细胞系OCI/AML3和MV4-11以及原代AML患者样品进行的体外杀伤测定显示来自单个供者的DNT杀伤多种癌症靶细胞。按一式三份进行实验。所示的结果代表了三次独立的实验。C)使用从6个HD扩增的DNT针对同一癌症靶细胞OCI/AML3进行了体外杀伤测定,证实了DNT的活性不受供者限制。按一式三份进行实验。所示的结果代表了三次类似的独立实验。(D和E)通过DNT或PBS的三次输注来处理植入了EBV-LCL(D)或MV4-11(E)的NSG小鼠。D)监测用DNT(n=6)或PBS(n=6)处理的输注了EBV-LCL的小鼠的存活率。所示的结果代表了用来自不同供者的DNT进行的三次独立实验。E)确定骨髓中的AML植入水平。所示的结果代表了四次独立的实验。每一个点代表来自一只小鼠的结果并且水平条柱代表每一组的平均值±SEM。F)针对含有白血病原始细胞和正常细胞的原代AML患者样品进行的体外杀伤测定。左侧流式图示出了用于区分白血病细胞与正常细胞的门控策略。直方图示出了在DNT诱导对癌细胞的强效细胞毒性的同时不存在由DNT介导的肿瘤外毒性。按一式三份进行实验。所示的结果代表了用不同的患者样品进行的四次独立实验。(G和H)用PBS、人类DNT或PBMC处理接种了AML细胞系MV4-11的NSG小鼠。在注射AML后28天,将小鼠安乐死并且将肝脏和肺组织用福尔马林固定并且用苏木精和伊红(H&E)染色。G)示出了来自每一组的肝脏(400×放大倍数)和肺(200×放大倍数)的代表性H&E染色载片。白色箭头指示胆管,灰色箭头指示细支气管,并且黑色箭头指示血管。PV:门静脉;alv:肺泡。H)由病理学家对H&E染色的肺(左侧)和肝脏(右侧)载片的组织损伤进行盲法评分。每一个点代表一只小鼠并且水平条柱代表平均值±SEM。所示的数据代表了四次独立的实验。**,p<0.01;***,p<0.001;****,p<0.0001,使用非配对双尾学生t检验(Student's t test)。
图3:同种异体DNT可以在符合临床要求的条件下冷冻保存,同时维持它们的功能。(A和B)使用如本文所述的无动物血清试剂冷冻保存离体扩增的DNT。将冷冻和解冻(FT)后DNT的活力%(A)和体外细胞毒性(B)与在没有进行FT的情况下来自同一扩增培养物的DNT进行比较。C)使用冷冻保存的DNT处理预先输注了MV4-11的NSG小鼠并且如图2E中所述,在骨髓中确定植入水平。D)通过将冷冻不同持续时间(617天、534天、276天、129天和8天)的DNT解冻并且检查它们的活力(左侧)和针对已知的DNT敏感性癌症靶细胞(OCI/AML3)的细胞毒性(右侧)来确定冷冻保存的DNT的保存期。所示的数据代表了三次类似的实验。
图4:DNT在同种异体CD4+和CD8+ T细胞存在下可以在体外和体内持续存在。(A-C)将CFSE标记的离体扩增的DNT静脉内注射到经过亚致死辐照的NSG小鼠体内(n=12)。在所示的天数时,用抗人类CD45和CD3抗体对来自血液、脾脏、骨髓(BM)、肝脏和肺的细胞进行染色,并且通过流式细胞术检测DNT(A,每天n=3)。通过流式细胞术测量注射后第0天、第2天、第7天、第10天和第14天DNT的CFSE中值荧光强度(MFI)。示出了CFSE MFI的直方图(B)和CFSE MFI相对于第0天CFSE MFI的相对降低(C)。结果显示了每个时间点从3只小鼠获得的结果并且代表了使用来自两个不同HD的DNT的两次独立实验。(D-G)使用HD1 PBMC和HD2扩增的DNT进行混合淋巴细胞反应(MLR)以确定扩增的DNT对同种异体T细胞的免疫原性。D)示意图示出了进行的MLR。E)将CFSE标记或未标记的HD1 PBMC与活的或经过辐照的扩增的HD1或HD2 DNT共培养4天-6天。在MLR结束时,如本文所述确定与未刺激的对照相比增殖细胞的增加%。左侧直方图示出了代表性的CFSE稀释,对CD8+ T细胞进行门控。按一式三份进行实验,并且右侧的条形图示出了三次平行实验的平均值。结果代表了针对自体DNT使用不同HD进行的2次独立实验和针对同种异体DNT使用4个不同HD对进行的5次独立实验。F)确定了用活的或经过辐照的自体或同种异体DNT刺激的CD8+ T细胞对DNT的细胞毒性水平。以不同的效应细胞与靶细胞的比例将在MLR后分离的HD1 CD8+ T细胞与自体DNT(空心)或同种异体DNT(实心)共培养。所示的结果代表了针对同种异体DNT使用4对供者进行的5次独立实验和针对自体DNT使用2对供者进行的2次独立实验。G)向经过亚致死辐照的小鼠输注HLA-A2+PBMC和HLA-A2-DNT(n=5)。在输注后28天时,将小鼠处死并且用人类抗CD45、抗HLA-A2、抗CD3、抗CD4和抗CD8抗体以及DAPI对来自肺中的细胞进行染色以确定人类T细胞亚群的植入。数字代表了相应门中的细胞%。条形图示出了肺中HLA-A2+CD4+/CD8+ T细胞和HLA-A2-DNT的频率。每一个点代表一只小鼠。所示的结果代表了两次独立的实验。
图5:使用GMP级试剂进行的健康供者(HD)DNT扩增的表征。使用GMP级试剂离体扩增DNT,所述GMP级试剂包括两种类型的无动物血清培养基(AIM V和GT-T551)。(A和B)使用两种不同的培养基,来自同一供者的DNT的扩增曲线(A)和纯度(B)。C)使用两种类型的培养基扩增的DNT针对OCI/AML3和MV4-11的细胞毒性。结果代表了使用3个HD进行的3次实验。*,p<0.01。
图6:将来自两个不同供者的DNT混合保留了抗白血病功能而不会彼此产生同种异体反应性。A)使用HLA-A2-DNT、HLA-A2+DNT和以1:1比例混合的这两种供者DNT针对AML细胞系进行体外基于流式细胞术的杀伤测定。B)在共孵育2小时后通过流式细胞术确定在混合或不混合的情况下来自每一个供者的死DNT%。结果代表了使用两组不同的HD DNT进行的两次独立实验。
图7:共植入的同种异体CD8+ T细胞对DNT没有细胞毒性。向经过亚致死辐照的小鼠输注HLA-A2+ PBMC和HLA-A2-DNT。在PBMC输注后4周,将小鼠处死并且汇集来自脾脏的细胞并且分离HLA-A2+ CD8+ T细胞。在体外杀伤测定中以4:1的CD8:DNT使用分离的CD8+ T细胞作为效应细胞针对最初用于异种移植实验的HLA-A2- DNT,持续14小时。流式图示出了在与HLA-A2+ CD8+ T细胞共培养或未与HLA-A2+ CD8+ T细胞共培养的情况下HLA-A2- DNT的活力。所示的结果代表了两次独立的实验。
图8:同种异体DNT的通用潜能。A)从不同HD扩增的DNT针对相同的AML原始细胞显示出相似的细胞毒性水平。通过使用从6个HD扩增的DNT作为效应细胞针对白血病细胞进行杀伤测定。B)使用从2个不同HD扩增的DNT针对原代和永生化AML样品进行杀伤测定,证实了来自单个HD的DNT可以靶向一系列AML样品。
图9:鉴定用于冷冻离体扩增的DNT的冷冻保存试剂中DMSO的最佳浓度。(A和B)在含有5%、7.5%或10%DMSO的FBS中冷冻使用本文所述的方法从健康供者离体扩增的DNT。通过膜联蛋白V染色,使用流式细胞术确定解冻的DNT细胞的活力(A)并且通过基于流式细胞术的杀伤测定针对白血病细胞系确定细胞毒性功能(B)。水平条柱代表平均值并且误差棒代表±SEM。使用非配对双尾学生t检验进行统计分析。
图10:冷冻培养基中的动物血清对冷冻保存的扩增DNT细胞的活力和抗白血病活性的影响。(A和B)将从同一培养物离体扩增的DNT细胞分别在含有相同浓度的DMSO且含有或不含动物血清的冷冻培养基中冷冻:FBS+7.5%DMSO和Cryostor+7.5%DMSO。如图9中所述确定解冻细胞的活力(A)和它们的抗白血病功能(B)。水平条柱代表平均值并且误差棒代表±SEM。使用非配对双尾学生t检验进行统计分析。
图11:验证扩增的冷冻保存的DNT的活力和功能。(A和B)将从同一培养物离体扩增的DNT细胞冷冻或保持在培养物中。在解冻后,如图9中所述,将解冻细胞的活力(A)和它们的抗白血病功能(B)与保持在培养物中而未进行冷冻的DNT进行了比较。水平条柱代表平均值并且误差棒代表±SEM。使用非配对双尾学生t检验进行统计分析。(C)向免疫缺陷NSG小鼠植入原代AML样品,并且将其用PBS或解冻的DNT处理。将收获的骨髓细胞用抗人类CD45和CD33抗体染色并且通过流式细胞术分析以确定AML植入水平。每一个点代表一只小鼠,条柱代表平均值,并且误差棒代表±SEM。使用非配对双尾学生t检验进行统计分析:*p<0.05。
图12:在使用先前建立的研究级扩增方法和本文所述的新建立的GMP级扩增方法进行14天-17天离体扩增结束时获得的DNT数量。
图13:在存在或不存在血浆(a)或HSA(b)的情况下使用如本文所述的GMP扩增方法对DNT进行离体扩增。
图14:在添加从自体供者(空心符号)和两个同种异体供者(实心符号)获得的血浆的情况下使用本文所述的GMP扩增方法对DNT进行离体扩增。(b和c)使用自体血浆和同种异体血浆,离体扩增的DNT的活力(b)和针对AML细胞系AML3/OCI的抗癌活性(c)。
图15:汇集的供者DNT的扩增。a)通过HLA-A2表达模式确定在汇集的供者DNT扩增培养开始时(左侧)和结束时(右侧)HLA-A2-DNT(HD1)和HLA-A2+DNT(HD2)的组成。b)HD1 DNT和HD2 DNT以及在扩增开始时从HD1和HD2以1:1混合的DNT的扩增曲线。c)在扩增结束时对HLA-A2+DNT(左侧)和HLA-A2-DNT(右侧)进行门控的DNT活力。d)在扩增结束时HD1、HD2以及HD1和HD2混合DNT培养物的纯度。数字代表每个门的细胞频率。e)在不同的效应细胞:靶细胞比下HD1 DNT、HD2DNT和混合DNT针对两种AML细胞系AML3/OCI(左侧)和MV4-11(右侧)的细胞毒性。
图16:将从HLA-A2-供者和HLA-A2+供者获得的DNT汇集并且扩增20天。在混合DNT的扩增结束时分离HLA-A2-DNT和HLA-A2+DNT并且将其用作效应细胞针对自体DNT(实心)和同种异体DNT(空心)。将用HD2 DNT刺激的HD1常规CD4+和CD8+ T细胞(T常规)用作阳性对照。
图17:DNT疗法与PBMC组合的功效和安全性。(A和B)用DNT、PBMC或DNT+PBMC处理荷白血病小鼠。A)通过确定骨髓中的白血病植入水平来评估每一种处理的功效。B)如图2中所述由病理学家对由每一种处理引起的组织损伤水平进行盲法评估。C)在存在或不存在DNT的情况下用异种GvHD诱导性人类PBMC处理的未接受过实验的NSG小鼠的存活率。
图18:DNT疗法增强了整体抗白血病活性,而不妨碍由T常规细胞介导的移植物抗白血病(GvL)活性。(A和B)示出了用于确定在与PBMC组合时DNT细胞的累加抗白血病活性的实验模型的示意图(A)。流式细胞图代表了用PBMC+PBS和PBMC+DNT处理的小鼠中的骨髓白血病植入。点图示出了每一个处理组中白血病植入水平的汇总(B)。(C)通过比较从用PBMC+PBS和PBMC+DNT细胞处理的小鼠分离的CD8+ T细胞针对用于植入的相同白血病靶细胞的离体细胞毒性而确定的DNT输注对CD8+ T细胞的抗白血病活性的影响。
图19:从PBMC而非全血中获得的DNT可以被扩增而具有相当的扩增倍数、纯度和抗白血病功能。从由全血或白细胞去除术样品中获得的PBMC中分离DNT。A)扩增17天的PBMC来源的DNT的纯度。B)如先前所述16,从PBMC中分离的DNT与从全血中获得的DNT之间扩增倍数的比较。C)从PBMC中分离的DNT与从全血中获得的DNT针对OCI-AML3和MV4-11的体外细胞毒性的比较。
具体实施方式
在临床中使用同种异体T细胞疗法的主要限制之一是输注的供者细胞导致GvHD的风险。开发同种异体T细胞疗法的常规方法依赖于使用基因编辑或RNA干扰技术敲除/敲低TCRα或免疫抑制17,18。然而,我们已经证实,在没有敲除同种异体DNT的TCR的情况下,同种异体DNT不攻击正常的PBMC,并且提供了一种新方法来克服GvHD问题以用于开发同种异体通用型T细胞疗法,而无需去除TCR。然而,有可能当DNT针对白血病靶细胞被激活时,它们可能会诱导对附近正常细胞的细胞毒性。为了评估离体扩增的HD DNT在它们具有癌症靶向活性期间针对正常细胞的潜在同种异体反应性,使用同种异体DNT针对AML患者PB来源的白血病样品进行体外杀伤测定,所述白血病样品含有通过CD33、CD34和CD45表达模式定义的白血病细胞和正常细胞的混合物(图2F)。值得注意的是,DNT诱导了针对两个白血病原始细胞群体(P1和P2)的强效的细胞毒性,但是没有观测到针对正常细胞群体(P3;图2F)的细胞毒性,这证实了即使在单个培养物中,DNT也可以选择性地识别和靶向白血病原始细胞而不伤害来自同一受者的正常细胞。为了进一步验证这一点,用PBS、PBMC或DNT处理荷有人类AML的小鼠。与体外发现一致,在异种移植模型中观测到DNT的显著抗癌活性,但是与PBMC处理组不同,DNT处理的小鼠没有表现出异种GvHD的体征(图2G)。来自PBMC处理的小鼠的肝组织显示中度门静脉淋巴细胞浸润和严重胆管损伤(白色箭头)。相比之下,DNT处理的小鼠显示出轻度门静脉淋巴细胞浸润,但是没有胆管损伤。在肺中,PBMC处理的小鼠在血管(黑色箭头)和细支气管(灰色箭头)周围显示出严重炎症,并且在肺泡(alv)周围也存在内皮炎和肺泡隔炎症。相比之下,DNT处理的小鼠在血管和细支气管周围没有显示炎症,并且在肺泡周围没有内皮炎或肺泡隔炎症。由病理学家对在组织学载片中观测到的组织损伤进行盲法评分,并且评定DNT处理组中的组织损伤评分显著低于PBMC处理组(图2H)。
已经证实输注的免疫细胞的持久性与治疗结果相关19。同种异体疗法的常见限制在于宿主免疫系统通过被称为宿主抗移植物(HvG)排斥反应的现象快速排斥输注的细胞6,20。克服同种异体T细胞疗法的HvG问题的常规方法试图通过基因编辑敲除β2微球蛋白(β-2M)链来使MHC-I丧失功能,或依赖于免疫抑制20,21。在此,已经惊人地确定,使用本文所述的方法产生的临床级DNT不会诱导同种异体反应性,并且可以在同种异体T细胞存在下持续存在,而无需进行基因编辑以去除MHC-I,并且提供了一种新方法来克服HvG问题以用于开发同种异体通用型细胞疗法,而无需去除MHC-I或MHC-II。图4D示出了进行混合淋巴细胞反应(MLR)以确定同种异体DNT是否将诱导受者的常规T细胞的同种异体反应性,其中将HD1 PBMC与自体DNT或来自HD2的同种异体DNT共培养。为了确定同种异体DNT是否携带可以激活常规T细胞的同种异体抗原,在另一组中,在MLR之前对DNT进行辐照。如图4E中所示,与活的或经过辐照的自体DNT和活的同种异体DNT共培养的PBMC没有显示出显著水平的增殖。相比之下,用经过辐照的同种异体DNT刺激的PBMC诱导了显著水平的增殖,这表明活的DNT不会激活常规的同种异体反应性T细胞,尽管DNT确实携带可以被识别的同种异体抗原,如经过辐照的同种异体DNT培养物所示。随后,将CD8+细胞毒性T细胞从MLR中分离出并且将其用作效应细胞针对最初用于刺激的DNT。虽然用自体DNT或活的同种异体DNT刺激的CD8+ T细胞没有诱导细胞毒性,但是用经过辐照的同种异体DNT刺激的CD8+ T细胞却诱导了细胞毒性,这支持了活的DNT不会引起常规T细胞的同种异体反应性的观点(图4F)。
为了在体内验证这一发现,向NSG小鼠输注来自HLA-A2+供者的PBMC和来自HLA-A2-供者的DNT(图4G)。在输注后28天,获得来自受者小鼠的各种组织的细胞并且分析CD4+和CD8+ T细胞的频率,通过HLA-A2表达鉴定DNT和供者CD4+和CD8+ T细胞。在同一组织中检测到HLA-A2+CD4+ T细胞、CD8+ T细胞和HLA-A2-DNT的持续存在,这证实了同种异体DNT可以与常规T细胞共同持续存在。为了进一步研究植入的CD8+ T细胞的同种异体反应性,随后从DNT和PBMC处理的小鼠中分离出HLA-A2+CD8+ T细胞,并且将其用作效应细胞针对来自与用于异种移植实验相同的供者来源的HLA-A2-DNT。在分离的HLA-A2+CD8+ T细胞存在下,没有观测到DNT细胞活力的显著降低(图7),这证实了同种异体CD8+ T细胞在异种移植模型中没有对DNT产生同种异体反应性。总的来说,这些数据表明,离体扩增的DNT对同种异体免疫细胞介导的排斥反应具有抗性,并且为在临床研究中进一步测试同种异体DNT作为对HvG排斥反应具有抗性的通用型ACT的潜力提供了基础。
如本文所用的术语“癌症”指的是由可以扩散到相邻组织或身体其它部位的细胞不受控制的异常生长而引起的一组疾病之一。癌细胞可以形成实体肿瘤,其中癌细胞聚集在一起,或作为分散的细胞存在,如在血液学癌症如白血病中。
术语“癌细胞”指的是特征在于不受控制的异常生长和侵入另一组织的能力的细胞或衍生自这样的细胞的细胞。癌细胞包括例如从患有癌症的患者获得的原代癌细胞或衍生自这样的细胞的细胞系。在一个实施方案中,所述癌细胞是血液学癌细胞,如白血病细胞或淋巴瘤细胞。
如本文所用的术语“受试者”包括动物界的所有成员,包括哺乳动物,并且适当地指的是人类。任选地,术语“受试者”包括已经被诊断为患有癌症或处于缓解期的哺乳动物。在一个实施方案中,术语“受试者”指的是患有或疑似患有癌症的人类。
在一个实施方案中,本文所述的方法和用途提供了癌症的治疗。如本文所用并且本领域充分理解的术语“治疗(treating)”或“治疗(treatment)”意指用于获得有益或期望的结果(包括临床结果)的方法。有益或期望的临床结果可以包括但不限于减轻或改善一种或多种症状或病症、降低疾病程度、稳定(即不恶化)疾病状态(例如将患者维持在缓解期)、预防疾病或预防疾病传播、延缓或减慢疾病进展、改善或缓和疾病状态、减少疾病复发以及缓解(部分或全部),无论是可检出的还是不可检出的。“治疗(treating)”和“治疗(treatment)”还可以意指与在未接受治疗的情况下预期的存活期相比延长存活期。如本文所用的“治疗(treating)”和“治疗(treatment)”还包括预防性治疗。在一个实施方案中,治疗方法包括向受试者施用治疗有效量的如本文所述的DNT并且任选地由单次施用组成,或可选地包括一系列施用。
在一个实施方案中,本文所述的方法和用途包括施用或使用有效量的DNT。在一个实施方案中,本文所述的方法和用途包括施用或使用有效量的DNT与同种异体造血干细胞(HSC)和/或外周血单核细胞(PBMC)的组合。在一个实施方案中,本文所述的方法和用途包括施用或使用有效量的DNT与淋巴细胞如常规T细胞的组合。在一个实施方案中,所述PBMC和/或淋巴细胞是同种异体细胞。如本文所用的短语“有效量”或“治疗有效量”意指在实现所期望的结果所需的剂量和时间段下有效的量。例如,在治疗癌症的背景下,有效量是与在未施用化合物的情况下获得的响应相比,例如诱导缓解、减轻肿瘤负荷和/或预防肿瘤扩散或癌细胞生长的量。有效量可以根据动物的疾病状态、年龄、性别和体重等因素而变化。将对应于这样的量的给定化合物或细胞群体的量将根据各种因素而变化,如给定的药物、化合物或细胞群体、药物制剂、施用途径、疾病或病症的类型、所治疗的受试者或宿主的身份等,但是仍可以由本领域技术人员常规确定。
在一个实施方案中,本文所述的方法和组合物涉及DNT的施用或使用。DNT表现出将它们与其它种类的T细胞相区分的许多特征。在一个实施方案中,DNT不表达CD4或CD8。在一个实施方案中,扩增10天-20天的DNT表达CD3-TCR复合物而不表达CD4和CD8。在一个实施方案中,扩增的DNT还是CD11a+、CD18+、CD10-和/或TCR Vα24-Jα18-。在一个实施方案中,扩增的DNT还是CD49d+、CD45+、CD58+CD147+CD98+CD43+CD66b-CD35-CD36-和/或CD103-。
在一个实施方案中,本文所述的DNT表达一种或多种表面标志物、细胞因子和/或趋化因子。在一个实施方案中,所述表面标志物包括一种或多种细胞毒性分子,如穿孔素、革兰氏酶(gramenzyme)TRAIL、NKG2D、DNAM-1、NKp30和/或KIR2DS4;免疫共刺激分子,如CD28、CD27、CD30、GITR、CD40L和/或HVEM;免疫共抑制分子,如TIM-3、LAIR1、NKG2A、CD94、LAG-3、CD160和/或BTLA;粘附分子,如LFA-1、CD44、CD49d和/或CD62L;和/或趋化因子受体,如CXCR3、CCR3、CCR6和/或CCR9;细胞因子受体,如CD122和/或CD127。
在一个实施方案中,本文所述的DNT不表达或低表达免疫共抑制分子PD-1和/或CTLA-4,对PD-1和/或CTLA-4途径介导的T细胞抑制和耗竭和/或癌症免疫抑制或逃逸机制具有抗性。
如本文所述的DNT可以使用本领域已知的技术获得,诸如但不限于荧光激活细胞分选(FACS)。
如本文所用的术语“同种异体”指的是最初从受试者获得的细胞,所述受试者是与所述细胞的预期受者不同的个体,但是与所述受者属于同一物种。任选地,同种异体细胞可以是来自细胞培养物的细胞。在一个实施方案中,DNT是从健康供者获得的同种异体细胞。如本文所用的术语“健康供者”(“HD”)指的是没有癌症的一个或多个受试者。在一个实施方案中,所述健康供者是没有可检测的癌细胞的受试者,如没有可检测的白血病细胞的受试者。
在一个实施方案中,DNT和/或同种异体HSC和/或PBMC,任选地供者淋巴细胞可以被配制用于或制备用于使用本领域已知的药学上可接受的制剂向受试者施用。用于选择和制备合适的制剂的常规程序和成分描述于例如Remington's Pharmaceutical Sciences(《雷明顿药物科学》)(2003年-第20版)和1999年出版的The United States Pharmacopeia:The National Formulary(《美国药典:国家处方集》)(USP 24NF19)中。术语“药学上可接受的”意指与动物,特别是人类的治疗相容。
如本文所用的“储存培养基”指的是本领域技术人员了解的用于长期保存哺乳动物细胞的任何细胞培养基(相对于例如扩增培养基)。储存培养基包括针对细胞的冷冻/冷冻保存优化的培养基(即冷冻培养基或冷冻保存培养基)。这样的培养基可以含有动物血清(例如胎牛血清)或可以不含动物血清。示例性储存培养基包括含有DMSO的FBS和
如本文所用的“冷冻保存”指的是通过冷却到极低温度来保存细胞,例如T细胞并且优选地DNT的过程。这样的低温是-70℃至-90℃,优选地是约-80℃,使用-80℃冷冻机、固态二氧化碳或-196℃(使用液氮),并且用于减慢/停止可能对细胞造成损害的任何酶或化学活性。冷冻保存方法设法达到低温,而不会导致因冷冻期间形成细胞内冰晶而造成的额外损害。
用于产生DNT群体、扩增可冷冻保存的通用型DNT和/或冷冻保存扩增的DNT以供临床使用的方法
在一个实施方案中,提供了一种离体扩增双阴性T细胞(DNT)群体的方法。在一个实施方案中,所述方法用于离体扩增可冷冻保存的通用型DNT群体。在一个实施方案中,所述方法包括:
a)提供DNT样品群体,其中所述DNT样品群体包含来自一个或多个供者的DNT;和
b)在培养基中培养所述DNT样品群体以产生扩增的DNT群体。
在一个实施方案中,所述DNT样品群体包含来自两个或更多个供者的DNT。在一个实施方案中,在培养基中培养DNT样品群体产生扩增的DNT群体,任选地具有大于80%纯度的扩增的DNT群体。
在一个实施方案中,所述方法包括将DNT培养至少5天、8天或10天,任选地培养5天至20天。在一个实施方案中,将DNT培养约8天至17天。在一个实施方案中,所述方法包括将DNT培养至少5天、至少8天、至少10天、至少12天、至少14天、至少17天、至少20天或至少25天,任选地培养10天至20天。
如实施例中所示,已经惊人地确定,来自多个供者的DNT不会彼此表现出同种异体反应性。因此,在一个实施方案中,来自不同供者的DNT在扩增期间不会彼此产生同种异体反应性。
在一个实施方案中,将来自两个或更多个供者的同种异体DNT组合,之后进行离体扩增。在一个实施方案中,将来自两个或更多个供者的同种异体DNT分别离体扩增,之后组合以形成DNT群体。
在一个实施方案中,所述培养基是无动物血清的培养基。在一个实施方案中,所述培养基包含AIM-V、GT-T551、Stemline T细胞扩增培养基、Immunocult-XF T细胞扩增培养基、人类StemXVivo、无血清人类T细胞基础培养基、CTS T细胞扩增SFM、Prime-XV T细胞扩增XSFM或等效的无动物血清的人类T细胞扩增培养基。在一个实施方案中,所述培养基符合GMP。
在一个实施方案中,所述培养基还包含人类血液来源的组分、血浆、血清或HSA,任选地人类血浆。在一个实施方案中,所述人类血液来源的组分和DNT可以来自同一个体,即与DNT样品群体是自体的。值得注意的是,如实施例中所示,DNT可以使用与DNT样品群体同种异体的人类血液来源的组分进行扩增。例如,在一个实施方案中,血浆包含来自一个或多个供者,任选地两个或更多个供者的混合血浆。在一个实施方案中,在培养基中人类血液来源的组分的浓度是1%-20%,任选地是约2%至15%。
在一个实施方案中,所述培养基包含可溶性抗CD3抗体、IL-15、IL-7和/或IL-2。在一个实施方案中,所述培养基包含重组或外源性IL-2、IL-15、IL-7、IFNγ、抗4-1BB、抗CD28、抗OX40、抗ICOS、抗CD40、重组CD83、MIP-1a、IL-6、IL-8、IL-21、Jq1抑制剂和/或抗CD3。在一个实施方案中,所述培养基不包含外源性IL-4。例如,在一个实施方案中,所述培养基包含约50IU/ml至500IU/ml或约50IU/ml至800IU/ml的IL-2和/或约0.05μg/ml至1.0μg/ml的抗CD3。在一个实施方案中,所述方法包括将抗CD3抗体和/或IL-2添加到所述培养基中。
如图12中所示,本文所述的方法能够从人类样品中产生显著的DNT扩增。在一个实施方案中,所述DNT群体包含来自外周血的DNT并且所述扩增的DNT群体产生每毫升外周血至少0.1×108个、0.2×108个、0.5×108个、0.8×108个或1.0×108个DNT。本文所述的方法还产生具有相对高纯度水平的DNT群体。例如,在一个实施方案中,所述扩增的DNT群体包含至少50%、60%、70%、75%或80%的DNT,任选地至少85%或90%的DNT或由其组成。在一个实施方案中,所述扩增的DNT群体包含至少80%的DNT,任选地至少85%或90%的DNT。
在一个实施方案中,所述方法包括将细胞分瓶以维持健康和不断扩增的细胞群体。在一个实施方案中,所述方法包括将所述细胞分瓶以维持高于每毫升培养基10万个且低于每毫升培养基400万个的细胞群体。
DNT样品群体的各种来源可以用于产生或扩增如本文所述的DNT群体。例如,在一个实施方案中,其中所述DNT样品群体包含来自外周血、白细胞去除术、Leukopak、骨髓和/或脐带血样品的DNT或由其组成。
在一个实施方案中,本文所述的DNT被遗传修饰。例如,在一个实施方案中,所述DNT是已经被修饰以表达一种或多种外源性蛋白的重组细胞。在一个实施方案中,所述DNT被遗传修饰以增强它们的抗肿瘤活性并且降低对受者的风险。
在另一个实施方案中,所述DNT没有被遗传修饰。在一个实施方案中,所述DNT没有被遗传修饰以减少或阻止TCR和/或MHC-I/II的表达。
用于冷冻保存DNT的方法
在一个实施方案中,提供了一种用于冷冻保存双阴性T细胞(DNT)的方法。在一个实施方案中,所述方法包括:
a)将DNT群体在储存培养基中重悬;
b)将DMSO添加到所述储存培养基中达到约2.5%至约15%DMSO的最终浓度;和
c)在低于-70℃的温度下将所述DNT群体在所述储存培养基中冷冻保存。
在一个实施方案中,所述方法包括将使用如本文所述的方法扩增的DNT群体在储存培养基中重悬。在一个实施方案中,所述方法还包括使用如本文所述的方法扩增DNT群体,之后将所述DNT群体在所述储存培养基中重悬。
在一个实施方案中,所述方法包括在-70℃至-90℃,优选地约-80℃的温度下在所述储存培养基中冷冻保存所述DNT群体。
在一个实施方案中,所述DNT群体在冷冻保存细胞之前已经离体扩增。例如,可以在冷冻保存DNT之前使用如本文所述的用于离体扩增DNT群体的方法对DNT进行离体扩增。
在一个实施方案中,在冷冻保存所述细胞之前将所述细胞离体扩增5天至25天,任选地约8天至14天或约10天。在一个实施方案中,在冷冻保存所述细胞之前将所述细胞扩增约8天至20天。
在一个实施方案中,本文所述的用于冷冻保存DNT群体的方法包括添加DMSO。在一个优选的实施方案中,将DMSO逐滴添加到储存培养基中。在一个实施方案中,DMSO的最终浓度是约3%至15%、4%至10%或约5%至约8.5%。在一个实施方案中,DMSO的最终浓度是约7%至8%,任选地是约7.5%。
在一个实施方案中,将DMSO以储存培养基中DMSO浓度的增加速率受到控制的方式添加到储存培养基中。
在一个实施方案中,其中在添加到所述储存培养基中之前DMSO具有约10%至约20%的浓度,任选地约10%、约15%或约20%的浓度。
在一个实施方案中,DNT在所述储存培养基中的最终浓度是约2.5×107个至约2.5×108个细胞/毫升,任选地是约5×107个至10×107个细胞/毫升。
在一个实施方案中,冷却与DNT接触的储存培养基。例如,在一个实施方案中,将所述DNT群体在冷却到低于10℃但未冷冻的储存培养基中重悬,任选地其中将所述储存培养基冷却到约8℃、6℃、4℃或2℃。
在一个实施方案中,所述方法还包括在步骤b)之后,但在步骤c)之前将所述DNT群体储存在约1℃至约7℃的温度下。在一个实施方案中,所述方法包括将所述DNT群体储存约2分钟至20分钟,任选地约5分钟、约10分钟或约15分钟。
如实施例中所述,储存培养基的选择可影响DNT的活力和/或活性。在一个实施方案中,所述储存培养基包含动物血清,任选地胎牛血清。在一个实施方案中,所述储存培养基不含动物血清,优选地是CryostorTM。
任选地,然后可以将根据本文所述的方法冷冻保存的细胞储存在低于-130℃的温度下,任选地储存在液氮中。在一个实施方案中,所述方法包括在将所述冷冻保存的细胞储存在低于-130℃的温度下之前将所述DNT群体在-70℃至-90℃的温度下储存至少8小时、至少10小时、至少12小时或至少16小时。
药物组合物和细胞群体
在一个实施方案中,提供了已经根据如本文所述的方法扩增和/或冷冻保存的DNT群体。在一个实施方案中,所述DNT群体用于治疗癌症。还提供了已经根据如本文所述的方法扩增和/或冷冻保存的DNT群体与造血干细胞(HSC)群体的组合,其中所述DNT和HSC来自同一供者或不同供者。在一个实施方案中,DNT与同种异体HSC组合显示出增强的抗癌活性,同时DNT还减少来自同种异体HSC的GvHD。还提供了已经根据如本文所述的方法扩增和/或冷冻保存的DNT群体与PBMC群体,任选地淋巴细胞群体,如常规T细胞的组合,其中所述DNT和PBMC来自同一供者或不同供者。在一个实施方案中,将DNT与同种异体PBMC组合使用减少了来自同种异体PBMC的GvHD。
在一个实施方案中,所述DNT来自于来自一个或多个供者的DNT的单次扩增并且用于向一个或多个受试者使用或施用以治疗癌症,或用于向一个或多个受试者使用或施用以用于癌症的多种治疗。在一个实施方案中,所述DNT来自于来自两个或更多个供者的DNT的单次扩增并且用于向一个或多个受试者使用或施用以治疗癌症,或用于向一个或多个受试者使用或施用以用于癌症的多种治疗。还提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向所述受试者施用有效量的如本文所述的DNT群体和任选的HSC或PBMC。还提供了如本文所述的DNT群体和任选的HSC或PBMC用于制备药物,任选地用于治疗癌症的药物的用途。
同种异体DNT治疗癌症的方法和用途
如实施例中所示,已经惊人地证实包含来自不同供者的同种异体DNT的制剂可用于治疗癌症。
在一个实施方案中,提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向所述受试者施用有效量的双阴性T细胞(DNT)群体,其中所述DNT群体包含来自一个或多个健康供者(HD)的同种异体DNT。在一个实施方案中,所述DNT群体包含来自两个或更多个HD的同种异体DNT。还提供了包含来自一个或多个供者或两个或更多个供者的同种异体DNT的有效DNT群体用于治疗癌症的用途。
在一个实施方案中,所述同种异体DNT已经离体扩增,任选地使用如本文所述的方法。在一个实施方案中,将来自两个或更多个供者的同种异体DNT组合,之后进行离体扩增。在另一个实施方案中,将来自两个或更多个供者的同种异体DNT分别离体扩增,之后组合以形成DNT群体。在一个实施方案中,所述一个或多个供者是没有癌症的一个或多个受试者。
本文所述的同种异体DNT群体表现出许多在体内用于治疗癌症所需的特征。在一个实施方案中,来自不同供者的DNT在DNT群体中不会彼此产生同种异体反应性。在一个实施方案中,所述DNT群体在所述受试者体内对同种异体免疫细胞介导的排斥反应具有抗性。
在一个实施方案中,所述DNT在受试者体内持续存在至少10天。在一个实施方案中,所述DNT群体在受试者体内持续存在至少2周、至少3周或至少4周。在一个实施方案中,所述DNT群体在体内对正常细胞没有细胞毒性。
在一个实施方案中,在向受试者施用DNT群体之前,所述DNT群体已经被冷冻保存,任选地通过使用如本文所述的用于冷冻保存DNT的方法。在一个实施方案中,所述DNT群体已经被冷冻保存而没有丧失活力和/或功能。例如,在一个实施方案中,所述DNT群体可以冷冻保存至少10天、30天、60天、100天、300天、400天或600天而不会丧失活力和/或用于治疗癌症的功能。
在一个实施方案中,所述DNT群体在使用或施用以治疗癌症之前没有被遗传修饰。例如,在一个实施方案中,所述DNT没有被遗传修饰以减少或阻止TCR和/或MHC-I/II的表达。在一个实施方案中,在施用所述DNT群体以治疗癌症之前或期间,不向受试者施用免疫抑制疗法。在另一个实施方案中,在施用所述DNT群体以治疗癌症之前或期间,向受试者施用免疫抑制疗法。
如实施例中所示,本文所述的DNT可以与同种异体造血干细胞(HSC)和/或外周血单核细胞(PBMC)组合用于治疗癌症。在一个实施方案中,所述PBMC是淋巴细胞,任选地是常规T细胞。因此,在一个实施方案中,本文所述的方法包括向有需要的受试者施用DNT和包含HSC的细胞群体。在一个实施方案中,本文所述的方法包括向有需要的受试者施用DNT和包含PBMC的细胞群体。还提供了如本文所述的DNT群体与包含同种异体HSC的群体组合用于治疗癌症的用途。还提供了如本文所述的DNT群体与包含同种异体PBMC的群体组合用于治疗癌症的用途。
在一个实施方案中,所述DNT是来自多个健康供者的同种异体DNT,任选地其中根据本文所述的方法扩增所述DNT。
在一个实施方案中,在施用所述DNT群体之前或期间,不向受试者施用免疫抑制疗法。在一个实施方案中,本文所述的DNT用于在不存在免疫抑制疗法的情况下向受试者使用或施用。
在一个实施方案中,所述DNT群体来自于来自一个或多个供者,任选地两个或更多个供者的DNT的单次扩增,并且用于向单个癌症患者或多个癌症患者使用或施用。
在一个实施方案中,所述DNT群体来自于来自一个或多个供者的DNT的单次扩增并且用于向多个不同的受试者使用或施用以治疗癌症。
在一个实施方案中,所述DNT是已经离体扩增和/或冷冻保存,任选地根据本文所述的方法离体扩增和/或冷冻保存的同种异体DNT。
在一个实施方案中,所述DNT用于与HSC和/或PBMC同时或在不同时间向受试者使用或施用。例如,在一个实施方案中,所述DNT用于在与HSC和/或PBMC的使用或施用相差1小时、2小时、4小时、8小时、12小时、1天、2天、3天、4天、5天、6天、1周、10天、2周、3周、4周或更长时间内向受试者使用或施用。在一个实施方案中,DNT和HSC和/或PBMC的组合用于在受试者中治疗骨髓增生异常综合征、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤或白血病。
在一个实施方案中,所述HSC来自外周血、白细胞去除术、骨髓或脐带血。在一个实施方案中,使用G-CSF动员所述allo-HSC。在一个实施方案中,所述DNT和HSC来自同一供者。在一个实施方案中,所述DNT和HSC来自不同的供者并且任选地是用于治疗癌症的同种异体DNT和HSC。
在一个实施方案中,所述PBMC是淋巴细胞,任选地是常规CD4+CD8+ T细胞。在一个实施方案中,所述DNT用于与PBMC同时或在不同时间向受试者使用或施用。
在一个实施方案中,本文所述的方法和用途包括使用抗TIM3、抗NKG2A、抗LAIR1、抗CD94、抗LAG3、抗CD160和/或抗BTLA拮抗剂抑制免疫共抑制分子,和/或使用抗CD28、抗CD27、抗GITR、抗CD40L、抗HVEM和/或抗CD30激动剂增强免疫共刺激分子。在一个实施方案中,提供了一种增强DNT活性的方法,所述方法包括使用抗TIM3、抗NKG2A、抗LAIR1、抗CD94、抗LAG3、抗CD160和/或抗BTLA拮抗剂抑制免疫共抑制分子,和/或使用抗CD28、抗CD27、抗GITR、抗CD40L、抗HVEM和/或抗CD30激动剂增强免疫共刺激分子。在一个实施方案中,所述方法包括使用或施用抗CD3以增强DNT的抗癌活性。
因此,在一个实施方案中,本文所述的方法和用途包括使用或施用抗CD3、抗TIM3、抗NKG2A、抗LAIR1、抗CD94、抗LAG3、抗CD160和/或抗BTLA拮抗剂,和/或抗CD28、抗CD27、抗GITR、抗CD40L、抗HVEM和/或抗CD30激动剂。在一个实施方案中,本文所述的用于治疗癌症的方法和用途还包括使用或施用针对CD3的抗体。在一个实施方案中,所述针对CD3的抗体用于与DNT的使用或施用同时或在不同时间向受试者使用或施用。
如图1J和图1K中所示,添加TIM-3或CD3抗体调节了由DNT介导的针对AML3/OCI的杀伤水平。因此,使用DNT和用于改善它们的功能的针对DNT上表达的分子的抗体的联合疗法预期可以改善DNT用于治疗癌症的治疗应用。在一个实施方案中,所述抗体用于与DNT同时或在不同时间使用或施用。例如,在一个实施方案中,所述DNT用于在与所述抗体的使用或施用相差1小时、2小时、4小时、8小时、12小时、1天、2天、3天、4天、5天、6天、1周、10天、2周、3周、4周或更长时间内向受试者使用或施用。
还提供了一种调节DNT的组织运输和归巢的方法。在一个实施方案中,所述方法包括在所期望的靶组织和部位诱导或递送粘附配体/受体至CD44、CD49d和/或CD62L和/或诱导或递送趋化因子至CXCR3、CCR3、CCR6和/或CCR9。
以下非限制性实施例说明了本公开:
实施例1:同种异体双阴性T细胞作为用于癌症的通用型过继性细胞疗法
过继性T细胞疗法是癌症患者的实际治疗选择。然而,随着过继性细胞疗法(ACT)的临床使用的增加,它的局限性,包括高治疗成本和技术要求,正变得显而易见并且限制了ACT的广泛临床使用22。通用型同种异体ACT具有几个优点,包括较低的治疗成本、可靠的细胞产品供应和易于获取,但是在它的临床应用之前必须满足几个要求12,20。本实施例描述了一种用于扩增来自健康供者的可冷冻保存的临床级双阴性T细胞的简单且易于应用的方法,其满足通用型ACT的要求:靶向各种癌症类型而没有明显的肿瘤外毒性;可以克服宿主抗移植物反应并且实现足够的持久性;并且可储存的疗法。值得注意的是,如本文所述的DNT的使用代表了一种T细胞疗法,其可以用作通用型疗法,而无需任何遗传修饰。
材料和方法
在GMP条件下DNT的离体扩增
如先前所述20,在GMP条件下进行DNT扩增,但有一些改动。简单地说,将CD4+和CD8+细胞耗竭的PBMC在抗CD3抗体包被的板(GMP级OKT3;美天旎公司(Miltenyi))上在含有250IU/ml的IL-2(Proleukin,加拿大的诺华制药公司(Novartis Pharmaceuticals,Canada))的无血清培养基(AIM-V(赛默飞世尔科技公司(ThermoFisher))或GT-551(宝生物工程株式会社(Takara Bio)))中培养3天;将可溶性抗CD3抗体和IL-2添加到培养物中。在扩增的第0天和第10天以及在收获后用于后续实验前评估DNT的纯度。通过用荧光染料缀合的抗人类CD3、-CD4、-CD8和-CD56抗体对细胞进行染色并且进行流式细胞术分析来测量DNT纯度。对于验证运行,在玛格丽特公主癌症中心(Princess Margaret Cancer Centre)的Philip S.Orsino细胞疗法设施(Philip S.Orsino Cell Therapy Facility)或森尼布鲁克研究所(Sunnybrook Research Institute)GMP设施扩增DNT。为了测试无菌性、支原体和内毒素,将扩增的DNT产品分别送到西奈山医院(Mount Sinai Hospital)、药明康德公司(WuXiApp Tech)和玛格丽特公主癌症中心。
基于流式细胞术的体外杀伤测定
对于非贴壁癌细胞,将DNT与靶细胞共培养2小时-4小时,然后用抗人类CD3(HIT3a)、CD33(WM53)、CD45(HI30)和CD34(561)抗体、膜联蛋白V和7AAD(均来自BioLegend公司)对细胞进行染色,并且使用流式细胞术进行分析。通过下式计算特异性杀伤:
对于贴壁癌细胞,将细胞系用DiO(英杰公司(Invitrogen))标记并且与DNT共培养14小时。在0.25%胰蛋白酶-EDTA溶液中孵育之后收集所有细胞并且用TO-PRO-3(生命科技公司(Life Technologies))染色。通过流式细胞术分析细胞悬浮液以确定标记的靶细胞的特异性裂解。通过下式计算特异性杀伤:
抗体和流式细胞术
使用以下抗人类抗体进行细胞染色:CD3-FITC或CD3-PECy7、CD4-FITC或CD4-PE、CD8-FITC或CD8-PE、CD33-APC或CD33-PECy5、CD56-PE、iNKT TCR(Vα24-Jα18TCR)-APC和膜联蛋白V-FITC或膜联蛋白V-Pacific Blue,并且这些抗体均购自BioLegend公司。使用BD Accuri C6流式细胞仪(碧迪生物科技公司(BD Bioscience))或Attune NXT细胞仪(赛默飞世尔科技公司)进行数据采集。使用FlowJo软件(Tree Star公司)分析流式细胞术数据。
高通量流式细胞术筛选
如先前所述23,准备离体扩增的DNT以进行基于流式细胞术的高通量筛选。简单地说,将扩增的DNT短暂离心并且用于含有0.5%BSA的PBS中的FcX TrueStain(Biolegend公司)处理10分钟,继而用抗CD3 PE-Cy7抗体染色。随后,将细胞送到玛格丽特公主基因组学中心(Princess Margaret Genomics Centre),在那里将细胞用针对385种不同细胞表面分子的抗体染色,继而用活力染料DAPI染色,之后通过流式细胞术进行分析。使用本文所述的方案进行CTLA-4的细胞内染色。使用FlowJo软件(Tree Star公司)分析数据。
DNT的冷冻保存
将第7天-第20天离体扩增的DNT在含有2%临床级DMSO(干细胞技术公司(StemCell Tech.))的4℃CryoStor2(干细胞技术公司)中重悬,继而添加适当体积的含有10%DMSO的CryoStor10(干细胞技术公司),以使DMSO的最终浓度为7.5%并且使细胞浓度为5×107个-10×107个细胞/ml。将细胞在CoolCellTM(飞世尔科技公司)中转移到-80℃冰箱中以使温度缓慢降低。第二天将冷冻的细胞转移到液氮中以进行更长时间的储存。
为了解冻DNT,将从液氮中取出的细胞在37℃水浴或珠浴中解冻并且以细胞体积的20倍添加血清。将细胞以300×g离心10分钟。将沉淀物用含有IL-2和抗CD3(OKT3)抗体的无血清培养基以106个细胞/ml重悬以供进一步使用。
混合淋巴细胞反应
将从健康供者获得的CFSE标记或未标记的PBMC与来自自体或同种异体供者的活的或经过辐照的扩增DNT以2:1的PBMC与DNT的比例共培养4天-6天。通过流式细胞术确定基于CFSE稀释的增殖细胞百分比。
通过下式计算增殖增加百分比:
为了确定同种异体反应性,使用CD8阳性选择试剂盒(干细胞技术公司)分离CD8+T细胞,并且将分离的CD8+ T细胞与DNT以4:1的CD8:DNT比例共培养4小时至14小时。然后将细胞用膜联蛋白V和抗CD8抗体染色并且通过流式细胞术进行分析。
异种移植模型
对于所有异种移植实验,使用维持在大学健康网络(University Health Network,UHN)动物设施处的NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ(NSG)小鼠(缅因州巴港的杰克逊实验室公司(Jackson Laboratories,Bar Harbor,ME))。为了表征DNT的持久性,在单次注射5μM CFSE标记的2×107个DNT前24小时对8周-12周大的雌性小鼠进行辐照(250cGy)。在第2天、第7天、第10天和第14天收获来自骨髓、脾脏、肝脏、肺和外周血的细胞,并且通过流式细胞术确定DNT的频率和CFSE稀释。为了确定体内抗癌活性,通过尾静脉注射向经过辐照的NSG小鼠输注1×106-5×106个MV4-11或EBV-LCL细胞。在癌细胞注射后第3天、第6天和第10天静脉内注射1×107-3×107个DNT。在最后一次DNT注射后2周将输注了MV4-11的小鼠处死,并且如先前所述,使用流式细胞术确定MV4-11在骨髓中的植入20。当输注了EBV-LCL的小鼠的体重减轻了20%时,将它们安乐死。为了评估组织损伤,如上文所述向荷有MV4-11的小鼠输注DNT或作为阳性对照的PBMC。收获肝脏和肺组织并且在10%福尔马林中固定过夜并且送到病理学研究计划实验室(Pathology Research Program Laboratory)(多伦多综合医院(Toronto General Hospital))进行苏木精和伊红(H&E)染色。遵循先前描述的评分方法24,由病理学家对H&E染色的组织学载片的组织损伤进行盲法评分,但有一些改动。本文描述了所使用的改动的评分方法。为了确定DNT的同种异体反应性,向小鼠输注2×106-3×106个HLA-A2+PBMC(在第0天)和HLA-A2-DNT(在第0天、第3天和第6天)。在输注后4周,通过流式细胞术分析来自骨髓、脾脏和肺的细胞以监测人类T细胞的植入水平。在所有实验中,在DNT输注时以及在最后一次DNT注射后每周一次腹膜内施用rIL-2(阿地白介素(Proleukin))(104IU/小鼠)直到安乐死为止。
统计分析
使用GraphPad Prism 5生成所有图表和统计分析。使用学生t检验和线性回归检验。*p<0.05;**p<0.01;***p<0.001;****p<0.0001表示实验值与对照值之间的显著性。误差棒代表如所示的±SEM或SD。
人类样品和研究批准
在获得书面知情同意书之后从健康成年供者采集人类血液并且根据UHN研究伦理委员会(UHN Research Ethics Board)(05-0221-T)进行使用。动物研究经UHN的机构动物护理委员会(Institutional Animal Care Committee)批准(AUP:741.22)并且根据加拿大动物护理委员会指南(Canadian Council on Animal Care Guidelines)进行。
抗体、流式细胞术和ELISA
使用以下抗人类抗体进行细胞染色:CD3-FITC或CD3-PECy7、CD4-FITC或CD4-PE、CD8-FITC或CD8-PE、CD34-FITC或CD34-PE和CD33-APC或CD33-PECy5购自BioLegend公司。使用BD Accuri C6流式细胞术(碧迪生物科技公司)或LSRII(碧迪生物科技公司)流式细胞仪进行数据采集并且使用FlowJo软件(Tree Star公司)分析数据。
细胞系
细胞系AML3/OCI、MV4-11、Jurkat、Daudi、H460和A549是从ATCC KG1a获得的,EBV-LCL是从病童医院(The Hospital for Sick Children)的应用基因组学中心(The Center for Applied Genomics)获得的。在补充有10%胎牛血清(FBS)的α-MEM中培养AML3/OCI,在补充有10%FBS的RPMI-1640中培养EBV-LCL、Jurkat和Daudi,在补充有10%FBS的IMDM中培养MV4-11,在补充有10%FBS的DMEM/F12中维持H460和A549。所有细胞系均在37℃在5%CO2中孵育。
CTLA-4的细胞内染色
将离体扩增的DNT表面用抗人类CD3、CD4和CD8抗体染色,并且使用细胞内固定和透化试剂盒(eBioscience公司)进行固定和透化。在4℃将透化细胞用抗CTLA-4抗体(克隆L3D10)染色30分钟。在洗涤之后,通过流式细胞术分析细胞。
GvHD模型组织损伤评分
将用PBS、DNT或PBMC处理的小鼠处死并且收获肝和肺组织,在10%福尔马林中固定,并且进行H&E染色。由病理学家遵循以下评分表对肝和肺组织学载片进行盲法评分:
肝脏GVHD评分
肺GVHD评分
表1:GvHD模型组织损伤的评分表
结果
临床级DNT的离体扩增和表征
在临床应用之前,需要在GMP条件下对细胞产品进行扩增。我们先前的研究是利用使用含有异种组分的研究级试剂扩增的DNT进行的14,15。由于与异种添加剂相关的风险,因此动物来源的补充剂的使用限制了最终产品用于患者治疗24。为了在GMP条件下扩增DNT,使用临床级试剂并且比较了使用不同类型的无动物血清培养基扩增的DNT的产量、纯度和功能(图5)。随后,研究了几个参数,包括细胞浓度、IL-2浓度和细胞分瓶方案。使用本文所述的改进的扩增方法,在13个培养物中从11个供者扩增DNT。通过17天的扩增,从每毫升外周血(PB;图1A)产生了1.11×108±0.63×108个DNT,平均扩增倍数是1558±795.5(图1B)并且平均纯度是91.9%±4.29%(图1C)。为了确认我们的方法,在GMP认证的设施中进行了三次“验证运行”。在所有三次运行中均观测到相似的产量、纯度和于输注缓冲液中的细胞稳定性,并且所有3个批次的扩增DNT都通过了无菌性、支原体和内毒素测试。
为了表征扩增的DNT,使用由Gedye C.等23开发的高通量流式细胞术筛选方法对来自三个供者的离体扩增DNT进行细胞表面分子表达谱分析。通过流式细胞术分析了用针对385种不同表面分子的抗体染色的DNT。通过检查T细胞相关标志物CD2、CD3和CD5的表达以及B细胞标志物CD19和CD20表达的缺乏来确认筛选方法的有效性(图1D)。总体上,离体扩增的DNT显示出效应记忆T细胞表型,其中CD45RA、CD44、CD43和CD49d表达,而CCR7、CD62L、BTLA和CD127低表达或不表达(图1E)。离体扩增的DNT关于趋化因子受体CXCR3(38.0%)、CCR3(42.6%)、CCR6(20.1%)和CCR9(17.6%)呈阳性(图1F),所有这些趋化因子受体均与免疫细胞向炎症区域的募集有关25-27,但是关于其它趋化因子受体呈阴性。
为了更好地了解由DNT介导的免疫应答,研究了细胞毒性分子(图1G)、共刺激分子(图1H)和共抑制分子(图1I)的表达。在所述细胞毒性分子中,两种先前鉴定的涉及DNT介导的抗白血病活性的分子NKG2D和DNAM-1以高水平表达(分别为83.3%和77.3%)。检测到较低水平的其它细胞毒性分子NKp30(13.4%)、KIR2DS4(15.2%)和膜结合TRAIL(16.3%),但是DNT关于FasL、NKp44、NKp46和KIR3DS1呈阴性。DNT表达共刺激分子CD30(49.5%)、GITR(22.5%)、CD27(15.3%)和CD28(25.2%),但是OX40、CD40、4-1BB和HVEM的表达非常低或不存在。与大多数离体扩增的效应T细胞不同,扩增DNT的共抑制分子ICOS、CTLA-4和PD-1以及PD-1配体较低,这表明DNT可能对T细胞耗竭或癌症免疫逃逸机制具有适应性。然而,还检测到TIM-3(65.7%)、LAIR1(95%)和NKG2A/CD94(58.9%和42.6%)的高表达,这表明了这些分子对DNT介导的抗癌活性具有潜在的抑制活性。
将抗TIM3、抗NKG2A和抗CD94拮抗抗体以及抗CD27、抗CD28、抗GITR或抗CD30激动抗体与DNT组合使用可以促进DNT的活性。由于DNT的活性需要DNT迁移到靶组织,因此DNT上的趋化因子受体表达模式可以用于促进DNT迁移到所期望的组织。
如图1J和图1K中所示,添加不同的抗体可以调节DNT针对AML的细胞毒性。例如,添加TIM-3抗体降低了由DNT介导的针对相对更具抗性的细胞系AML3/OCI的杀伤水平,而针对高度敏感的白血病细胞系MV4-11的细胞毒性仍然相当。相比之下,添加抗CD3抗体增加了DNT针对AML3/OCI的细胞毒性。
扩增的DNT以不受供者限制的方式在体外和体内靶向各种类型的癌症
对于通用型ACT,由单个供者制造的细胞应当能够以不受供者限制的方式靶向多个患者的癌症。为了确定临床级DNT的功能,在体外研究了扩增细胞对源自于骨髓瘤、T细胞白血病、伯基特氏淋巴瘤、AML、EBV-LCL、大细胞肺癌和肺腺癌的各种癌细胞系的细胞毒性。DNT对所测试的所有癌症靶细胞均表现出广泛的抗癌细胞毒性(图2A)。此外,来自单个供者的临床级DNT有效地靶向多种癌症靶细胞,即OCI/AML3和MV4-11以及原代AML样品(图2B),并且来自6个不同供者的DNT针对同一癌症靶细胞介导了相似水平的细胞毒性(图2C)。此外,与来自任一供者的DNT单独诱导的细胞毒性相比,将从2个不同供者扩增的DNT混合没有损害整体细胞毒性,并且供者DNT在体外混合时没有彼此表现出同种异体反应性(图6)。这些结果共同证实了,DNT以不受供者限制的方式诱导广泛的癌症特异性细胞毒性。
为了确定DNT在体内的抗肿瘤活性,使用人类EBV-LCL和AML在免疫缺陷NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ(NSG)小鼠中建立了异种移植模型。在EBV-LCL异种移植模型中,用PBS或DNT处理接种了致死剂量的EBV-LCL的小鼠。PBS处理组中的所有小鼠均在28天内死亡(n=6),而六只DNT处理的小鼠中有四只在本研究的整个过程中(85天)存活下来(图2D)。类似地,与用PBS处理的小鼠(40.5%±4.56%)相比,用DNT处理的荷有人类AML细胞的小鼠显示出骨髓中的AML植入水平降低到10/171(2.37%±0.749%)(图2E)。有趣的是,在相同的杀伤测定中,DNT对表达与白血病原始细胞相关的标志物(CD33+CD45低CD34+和CD33高CD34+)的原代AML患者细胞显示出强效的细胞毒性活性,但是对具有与正常细胞相关的表型(CD33-CD45高CD34-)的那些没有显示出强效的细胞毒性活性(图2F),这表明DNT优先靶向白血病细胞,而不靶向正常细胞。为了进一步验证这一结果,如图2E中所述,在AML异种移植模型中评估了由DNT引起的组织损伤水平,并且与由PBMC引起的组织损伤水平进行了比较。与体外发现一致,在异种移植模型中观测到DNT的显著抗癌活性,但是DNT处理的荷癌小鼠都没有表现出异种GvHD的体征(图2G和图2H)。来自PBMC处理的小鼠的肝组织显示出中度门静脉淋巴细胞浸润和严重的胆管损伤,而DNT处理的小鼠显示出轻度门静脉淋巴细胞浸润,而没有胆管、血管或其它损伤(图2G)。在肺中,PBMC处理的小鼠显示出血管和细支气管周围严重的炎症、肺泡周围的内皮炎和肺泡隔炎症。相比之下,DNT处理的小鼠在血管和细支气管周围没有显示出炎症,并且在肺泡周围没有观测到内皮炎或肺泡隔炎症。由病理学家对肝脏和肺中的组织损伤进行盲法评分并且DNT处理组的评分显著低于PBMC处理组(图2H)。综上所述,这些数据表明,在GMP条件下扩增的HD来源的DNT以不受供者限制的方式在体外和异种移植模型中有效地靶向广泛范围的癌症类型,而没有肿瘤外毒性,这些是成功的通用型同种异体ACT的必要特征。
扩增的DNT可以在GMP条件下冷冻保存
往往,在对细胞活力和功能的影响可忽略不计的情况下在符合临床要求的条件下冷冻保存扩增细胞的重要性被忽视28。有效的冷冻保存方法允许储存所制造的细胞,提高细胞产品的一致性,为患者输注提供细胞疗法的即时可用性,并且提供了一种将细胞疗法分配到无法制造细胞的地区的方式,从而共同提高了ACT的灵活性和可及性。为此,研究了多个参数以在符合GMP的无动物血清培养基中冷冻保存离体扩增的DNT,包括DMSO浓度、添加和去除DMSO的方法、解冻的DNT的重新刺激和用于冷冻的细胞浓度。最佳冷冻保存的DNT保留了它们的活力(图3A)以及在体外(图3B)和异种移植模型中(图3C)的抗白血病活性。为了将冷冻保存的DNT用作即用型产品,它们作为冷冻细胞的保存期是重要的。为了对此进行研究,测定了冷冻617天、534天、276天、129天或8天的DNT的活力和细胞毒性。所有DNT均保持活力并且保留了它们的抗白血病功能(图3D)。总的来说,在临床上可接受的条件下扩增的DNT可以在符合GMP的培养基中冷冻保存至少600天而不会损害它们的功能,从而提供了一种将同种异体DNT作为“即用型”治疗用于癌症患者的方式。
活的DNT在体外不会激活同种异体免疫应答并且可以在体内持续存在
过继转移的细胞在受者体内持续存在的能力会影响ACT的结果29,并且它的重要性在同种异体环境中更为明显,这是因为输注的细胞会被患者的免疫系统识别和排斥30。因此,通过将CFSE标记的离体扩增的人类DNT全身注射到未接受过实验的经过亚致死辐照的NSG小鼠体内来确定DNT在体内的持久性、增殖能力和迁移模式。在输注后第2天、第7天、第10天和第14天获得来自外周血、脾脏、骨髓(BM)、肝脏和肺的细胞。在输注后2天检查的所有组织中均检测到DNT,并且之后DNT的频率降低,但是在注射后14天仍可检测到细胞(图4A)。与第0天相比,CFSE荧光强度被稀释直到输注后第10天为止,但是从第10天到第14天没有进一步降低(图4B和图4C)。这些结果表明,DNT迁移到不同的组织并且在体内进行有限的细胞分裂,并且在输注到未接受过实验的NSG小鼠体内后至少两周内可以被检测到。
然而,DNT在未接受过实验的NSG小鼠体内的持续存在并不反映它们在临床环境中持续存在,这是因为免疫缺陷小鼠不能排斥输注的细胞。为了确定DNT是否容易被同种异体免疫应答排斥,我们建立了经典的混合淋巴细胞反应(MLR)测定,如图4D中示意性示出的那样。将来自一个供者(HD1)的CFSE标记的PBMC用来自同一供者(HD1)或不同供者(HD2)的活的或经过辐照的离体扩增的DNT刺激以确定同种异体DNT对常规T细胞的免疫原性。用经过辐照的同种异体DNT刺激使CD4+和CD8+ T细胞的增殖分别增加了27.7%±0.12%和37.7%±0.91%,这显著高于经过辐照的自体DNT的刺激作用(CD4+ T细胞为13.7%±0.94%,并且CD8+ T细胞为10.8%±0.12%;图4E)。有趣的是,活的同种异体DNT诱导了显著更低程度的CD4+ T细胞(6.04%±0.69%)和CD8+ T细胞(6.32%±0.55%)的增殖,这与活的自体DNT诱导的增殖水平(CD4+ T细胞为6.61%±0.38%,并且CD8+ T细胞为6.79%±0.21%;图4E)相当。为了进一步确定与自体或同种异体DNT共培养的CD8+ T细胞是否能够靶向同种异体DNT,在共培养后4天-6天分离CD8+细胞并且将其用作效应细胞针对自体或同种异体DNT,如图4D中所示。如所预期,用活的或经过辐照的自体DNT刺激的CD8+ T细胞没有诱导对同种异体DNT的任何细胞毒性。重要的是,尽管受经过辐照的同种异体DNT刺激的CD8+ T细胞以剂量依赖性方式引起针对同种异体DNT的强效细胞毒性,但是当用活的DNT刺激CD8细胞时,没有检测到CD8+ T细胞针对同种异体DNT的细胞毒性(图4F)。总的来说,这些结果表明,虽然DNT携带同种异体抗原,但是活的同种异体DNT在体外不会诱导显著水平的常规T细胞的同种异体反应性。
为了进一步确认活的DNT在体内对同种异体免疫应答具有抗性,向未接受过实验的NSG小鼠输注来自HLA-A2+供者的PBMC,继而注射0次或3次来自另一个供者的HLA-A2-DNT。
在输注后4周,分离来自脾脏、骨髓和肺的细胞并且确定人类T细胞的植入。我们发现,在5只接受处理的小鼠中的4只中,在相同的组织中显著水平的HLA-A2-DNT与HLA-A2+CD4+和CD8+ T细胞共植入(图4G),这表明在同种异体常规T细胞存在下DNT在受者体内持续存在至少4周。为了进一步研究植入的CD8+ T细胞的同种异体反应性,随后从DNT和PBMC处理的小鼠中分离出HLA-A2+CD8+ T细胞并且将其用作效应细胞针对来自与用于异种移植实验相同的供者来源的DNT。在分离的HLA-A2+CD8+ T细胞存在下,没有观测到DNT细胞活力的显著降低(图7),这进一步支持了同种异体CD8+ T细胞在异种移植模型中不会引起DNT的消除。总的来说,这些数据表明,离体扩增的DNT对同种异体免疫细胞介导的排斥反应具有抗性,并且需要进一步测试同种异体DNT在临床环境中作为对HvG排斥反应具有抗性的通用型ACT的潜力。
讨论
虽然新疗法的功效和安全性是开发新治疗时的优先事项,但是不应当忽视转化为患者治疗的可行性。当前形式的ACT采取“个性化”方法,使用患者自身的免疫细胞“按需”为单个患者产生细胞产品,并且已经在一些患者中实现了显著的结果,但是限制它们广泛应用的因素也已经从这些研究中变得明显31,32。因此,将允许更大的患者可及性的通用型细胞疗法被认为是下一代ACT12,33。
通用型细胞产品的基本特性是它能够以非供者依赖性方式靶向广泛的癌症。我们已经证实,临床级DNT在体外靶向一系列血液学和实体癌症(图2A)并且在异种移植模型中靶向EBV-LCL和AML(分别为图2D和图2E)。除了在本研究中呈现的癌症类型之外,我们还在异种移植模型中观测到在DNT处理后非小细胞肺癌的进展受到显著抑制34。值得注意的是,来自单个供者的DNT可以杀伤不同来源的癌细胞(图2B),并且在源自于不同供者的DNT之间针对同一癌症靶细胞的细胞毒性水平相当(图2C),而没有观测到肿瘤外毒性(图2F和图2G)。此外,在符合临床要求的条件下冷冻保存扩增的DNT没有损害DNT的功能(图3)。总的来说,这些发现强调了冷冻保存大批量的扩增DNT作为即用型治疗用于多个患者的可能性。
使用同种异体T细胞作为细胞疗法的主要问题之一是GvHD的风险6。Jacoby等报道了,由于内源性TCR识别宿主同种异体抗原,因此同种异体CD19-CAR T细胞的输注在受者小鼠体内诱导了严重的GvHD35。为了解决这个问题,几个研究小组从CD19-CAR T细胞18或转基因TCR转导的T细胞36中敲除了内源性TCR并且成功地阻止了GvHD的发生并且维持了抗癌活性。然而,这些方法限于针对已知肿瘤抗原的ACT,这是因为需要使用针对癌症相关抗原的外源转导受体来替代内源性TCR的丧失的抗肿瘤特异性,并且在细胞生产中设置了另一个障碍。我们和其它人先前已经证实,与常规的CD4+和CD8+ T细胞不同,同种异体小鼠DNT或异种人类DNT的输注不会引起GvHD14,37。与先前的发现一致,在同一细胞毒性测定中,DNT特异性地靶向白血病细胞,而不伤害来自同一患者样品的正常细胞(图2F),并且用扩增的人类DNT处理的荷癌小鼠显示出白血病负荷的显著降低,而对正常小鼠组织没有毒性迹象(图2G)。综上所述,这些研究表明,非遗传修饰的同种异体DNT的输注不可能引起GvHD。
已经证实输注的免疫细胞的持久性与治疗结果相关19。输注的T细胞的持久性由内在因素和外在因素决定。作为细胞内在因素,输注细胞的激活状态会影响它们的持久性。我们发现,当单独注射DNT时,它们迁移并且在NSG小鼠的各种组织中持续存在长达14天,包括肝脏、肺、血液、骨髓和脾脏(图4A)。基于表面分子谱分析数据,与中央记忆T细胞相比,DNT表现出与更稳固的免疫应答和更短时间的持续存在相关的效应记忆表型(图1E)19。虽然在我们的I期临床试验中目前正在研究输注的同种异体DNT在患者体内的持久性,但是如果期望更长时间的持续存在,那么对细胞扩增方法进行修改可能有助于产生具有中央记忆表型的DNT。可选地,这样的问题可以通过使用DNT的通用特性并且根据需要向患者重新输注冷冻保存的DNT来克服。
影响细胞持久性的主要外在因素是宿主免疫系统对输注细胞的排斥反应。对同种异体ACT的许多研究侧重于避免GvHD,但较少侧重于HvG排斥反应。在Torakai等进行的一项研究中,通过遗传操作敲除了同种异体CAR-T细胞上的HLA表达,这成功地逃避了同种异体CD8+ T细胞介导的细胞毒性21。然而,需要验证这种方法在临床环境中的可行性和安全性。有趣的是,我们发现,用活的同种异体DNT刺激常规T细胞不会引起对同种异体DNT的细胞毒性(图4E)。此外,将同种异体DNT与来自不同供者的PBMC共同输注引起了它们在NSG小鼠中的共植入(图4G)并且共植入的同种异体CD8+ T细胞没有对DNT显示出同种异体反应性(图7)。据我们所知,这是第一种在没有遗传修饰或外源性免疫抑制剂的情况下对HvG反应具有抗性的同种异体ACT形式。然而,鉴于经过辐照的同种异体DNT是同种异体反应性T细胞的强效刺激剂,需要仔细监测患者输注的DNT活力以防止HvG反应的发生。
活的同种异体DNT逃避常规T细胞排斥的机制正在研究中。我们先前已经证实,小鼠DNT可以杀伤由激活DNT的相同同种异体抗原激活的同种异体反应性CD8+ T细胞38。此外,在同种异体造血干细胞移植患者中,较高的DNT与CD8+ T细胞之比与不太严重的GvHD相关39。总的来说,这些数据支持了,与常规T细胞不同,活的同种异体DNT的输注不太可能引起由于HvG反应而导致的排斥反应。
NK细胞由于具有不受HLA限制的抗肿瘤功能和有限的引起GvHD的活性而具有在不进行遗传修饰的情况下用作通用型疗法的潜力40。NK-92是一种源自于患者NK细胞淋巴瘤的细胞系,在临床研究中已经被证实作为通用型ACT是安全且可行的40。然而,只有一项研究报道了,在15个接受治疗的患者中,两个患者具有混合响应并且一个患者具有稳定的疾病。有限的抗肿瘤活性可能是由于持续存在的时间短,这是因为NK-92仅在输注后约48小时内可检测到41,这可能是因为在患者输注前对细胞进行辐照以避免由于它们是永生化细胞而导致的潜在体内肿瘤发生。也有可能输注的NK92由于HvG排斥反应而被排斥41,这尚未得到研究。在Romee等进行的临床研究中,细胞因子诱导的记忆样同种异体原代NK细胞的输注显示出更有前途的临床响应,其中9个AML患者中有4个患者实现完全缓解,而不存在剂量限制毒性42。然而,供者来源的NK细胞到输注后2周至3周时无法检测到,这表明了宿主免疫系统恢复并且排斥供者来源的同种异体NK细胞或输注的NK细胞具有有限的预期寿命。我们发现,在不存在淋巴细胞耗竭的情况下与同种异体PBMC共同输注后4周在小鼠中检测到显著数量的DNT,这表明了同种异体DNT的体内持久性优于NK细胞(图4G)。
在我们先前的研究14中,我们已经直接比较了DNT与NK-92和扩增的原代NK细胞的细胞毒活性。我们证实了,虽然观测到相似的针对已知的NK细胞靶细胞K562的毒性,但是DNT介导了更好的针对所测试的所有七种AML靶细胞的杀伤,包括四种对NK-92介导的细胞毒性具有抗性的样品。类似地,与原代激活NK细胞相比,源自于健康供者的DNT显示出更好的针对AML细胞系的杀伤。这表明DNT通过与NK细胞不同的机制起作用,并且DNT可能能够靶向对NK-92具有抗性的癌症。此外,DNT对HvG反应的抗性可能使得DNT在患者体内持续存在的时间更长,并且因此作用时间更长。
综上所述,我们已经建立了一种从健康供者扩增临床级DNT而无需进行遗传修饰或广泛操作的方法。据我们所知,DNT是第一种在不进行遗传改变的情况下满足通用型同种异体细胞疗法的所有要求的T细胞ACT。扩增的DNT可以被冷冻保存,在不存在免疫抑制的情况下在同种异体环境中持续存在,并且有效地靶向各种癌症而没有肿瘤外毒性。这些特性允许将同种异体DNT用作通用型ACT以作为独立疗法或与其它常规疗法组合用于患有不同癌症类型的患者。此外,DNT也可以与可以调节诸如Tim-3、CD94/NKG2A、LAIR-1、CCR3和CXCR3的抗体组合使用。
实施例2:同种异体DNT的冷冻保存和通用潜力
已经确定,从不同健康供者扩增的同种异体DNT针对同一AML靶细胞显示出相似水平的细胞毒性(图8),并且来自单个供者的DNT细胞可以靶向从一系列AML患者获得的AML细胞(图8),而没有观测到任何针对正常细胞的毒性。这些发现表明,无论DNT源自于哪个供者,DNT疗法的响应水平将是相当的,并且来自单个供者的DNT可以用于治疗多个AML患者,这支持了利用同种异体DNT细胞作为“通用型”治疗方法的潜力。然而,可以保持离体扩增的DNT的抗白血病功能的储存方法的缺乏阻碍了它们作为“通用型”治疗剂的使用。
扩增的冷冻保存的DNT的功能分析
为了确定抗白血病功能,在体外细胞毒性测定中使用冷冻保存的DNT作为效应细胞针对癌细胞系并且使用来自同一供者或培养物的非冷冻DNT作为对照。在AML异种移植模型中进一步验证冷冻保存的DNT的抗白血病功能。
离体扩增的DNT的冷冻保存。
虽然本发明的申请人已经建立了冷冻保存未扩增的DNT细胞的标准方案15,但是该同一种方案不能保持离体扩增的DNT的功能和活力。修改了几个参数以开发用于离体DNT的最佳冷冻方法。首先,通过比较在FBS+5%DMSO、FBS+7.5%DMSO和FBS+10%DMSO中冷冻的DNT的活力和细胞毒性功能,确定了冷冻培养基中DMSO的最佳浓度和添加DMSO的方法。发现与在FBS+5%DMSO或10%DMSO中冷冻的那些细胞相比,在FBS+7.5%中冷冻的DNT具有更高的活力和细胞毒性功能(图9)。
为了测试在冷冻过程中是否可以避免使用动物血清以使该技术易于向临床转化,比较了在FBS+7.5%DMSO和Cryostor+7.5%DMSO中冷冻的DNT的活力和细胞毒性功能,并且证实了来自这两种冷冻试剂的细胞的活力(图10)和细胞毒性功能(图10)是相当的。
验证离体扩增的DNT在冷冻保存后的功能。
虽然上述研究显示了冷冻保存扩增的DNT的最佳方法,但是我们希望确保冷冻保存的DNT与非冷冻DNT相比功能没有受损。为此,将使用本文所述的优化方案冷冻保存的扩增DNT的体外抗白血病功能与从同一供者或同一扩增培养物扩增的非冷冻DNT进行比较。如图11中所示,DNT的活力和细胞毒性功能均相当。为了进一步确认冷冻细胞的体内功能得到保持,用解冻的DNT处理植入有原代AML原始细胞的免疫缺陷NSG小鼠。与非冷冻DNT相似,冷冻保存的DNT显著降低了异种移植模型中的AML植入水平(图11)。
综上所述,通过优化冷冻保存方法的每一个步骤,我们已经开发了一种用于冷冻保存离体扩增DNT的方法。使用这种方法,我们证实了离体扩增的DNT可以被冷冻保存并且在体外和体内维持它们的抗肿瘤功能。这种方法允许将DNT储存为“通用型”活体药物以治疗有需要的患者。其也可以用于冷冻保存其它扩增的抗肿瘤T细胞、NKT细胞和NK细胞以供它们的研究和临床使用。
实施例3:用于通用型同种异体细胞疗法的临床级DNT的扩增
专利申请号PCT/CA2006/001870描述了一种用于离体扩增双阴性T(DNT)细胞的方法。使用该方法,可以使用涉及异种添加剂的扩增方法和试剂从1毫升血液产生2.5×106个DNT细胞。然而,为了生产用于通用型疗法的DNT,其中从单次扩增中获得的DNT可以用于多种治疗和/或多个患者,需要更高的DNT产量。使用先前的方法产生的另外的DNT是研究级的。为了允许将DNT疗法转化到临床,需要建立这样的方法,所述方法1)提高最终细胞产量;2)使用符合临床要求的扩增方法和试剂。在此,描述了一种新的离体DNT细胞扩增方案,其产生临床级DNT,在扩增结束时显著提高产量。
研究了各种参数,如扩增期间的细胞浓度、细胞分瓶的天数、在扩增期间给予的添加剂的类型和浓度以及不同类型的临床级培养基。与使用先前限定的研究级扩增方法扩增的那些相比,使用新建立的GMP级扩增方法扩增来自健康供者(HD)的DNT在扩增结束时产生显著更高数量的DNT(图12)。
如实施例1和图5中所示,使用两种不同的符合临床要求的培养基(AIM V和GT-T551)扩增的DNT在扩增时产生显著性差异。AIM V产生了更高数量的细胞并且用于后续的DNT扩增。
添加血浆(图13A)也显著提高了HD-DNT的离体扩增,但是添加人血清白蛋白(HSA;图13B)并没有显著提高HD-DNT的离体扩增。
惊人的是,可以使用来自同种异体来源的血浆扩增DNT,所述血浆提供与使用自体血浆相当的扩增曲线(图14A)、活力(图14B)和针对癌细胞的细胞毒性(图14C)。
惊人的是,源自于不同供者的DNT可以在同一培养物中混合和扩增(图15A),而不会妨碍它们的扩增曲线(图15B)、活力(图15C)、纯度(图15D)或抗癌活性(图15E)。
为了确定从汇集的供者扩增的DNT在扩增期间是否彼此产生同种异体反应性,使用差异表达的HLA亚型分离不同供者来源的DNT并且测试它们彼此的细胞毒性。如图16中所示,虽然源自于相同供者的常规T细胞产生了强效的同种异体反应性,但是共培养17天的DNT没有彼此产生同种异体反应性。
尽管allo-HSCT是对于许多血液学恶性肿瘤具有长期治愈潜力的唯一巩固疗法,但是它的功效和安全性仍需提高。为了确定DNT是否可以用作佐剂来提高allo-HSCT的功效和安全性,在存在或不存在DNT的情况下向荷癌小鼠输注PBMC。值得注意的是,与单独的DNT相比,DNT与PBMC的共同输注显示出更好的抗白血病活性,并且在所有五只接受处理的小鼠中完全根除癌症,而在单独PBMC组中,五只接受处理的小鼠中有一只具有可检测的癌症水平(图17A)。重要的是,DNT共同输注降低了PBMC来源的T细胞诱导的GVHD程度(图17B)。这在GvHD异种移植模型中得到进一步验证,其中DNT输注显著延长了用PBMC处理的小鼠的存活期(图17C)。
接下来,为了确定DNT是否可以增强用PBMC治疗的荷白血病宿主的整体抗白血病作用,用PBS、人类PBMC、离体扩增的DNT或先用人类PBMC,再用DNT处理植入有侵袭性人类AML细胞系MV411的NSG小鼠,并且评估骨髓中的白血病植入水平(图18A)。如先前所报道16,与PBS对照组相比,用DNT处理使得白血病负荷降低了50%(从20.6%±7.8%降低到10.5%±3.7%),但是作用不完全(图18B)。PBMC来源的T常规细胞介导了强烈的抗白血病响应,将AML水平降低到0.68%±0.27%,但是在骨髓中仍存在可检测到的残留白血病细胞(图18B)。有趣的是,在先用PBMC,再用DNT处理的小鼠的骨髓中检测不到AML细胞(图18B)。鉴于在PBMC处理组中CD8+ T细胞既参与GvL,也参与GvHD,并且DNT会减轻GvHD的严重程度,将PBMC+DNT处理组中DNT共处理对CD8 T细胞介导的GvL活性的影响与PBMC处理组进行比较。从PBMC和PBMC+DNT处理的小鼠中分离出CD8+ T细胞,并且将其用作效应细胞针对最初用于异种移植实验的白血病细胞。发现来自这两组的CD8+ T细胞均诱导显著且相当程度的针对AML细胞的离体细胞毒性(图18C),这表明DNT对T常规细胞的抗白血病活性没有负面影响,同时诱导它们自身的抗白血病活性以在异种移植模型中产生更大的抗白血病活性。总之,这些数据支持了以下观点,即DNT不会抑制T常规细胞的GvL效应,相反,它们可以增加整体抗白血病响应,这可以引起疾病的根除。
目前使用的DNT分离方法需要从供者获得全血,这是因为CD4+和CD8+细胞通过与红细胞交联而被耗竭。虽然这种方法已经成功地提供了足够的数量来治疗1个到2个患者,但是更大规模的扩增受到可以安全地从供者体内抽取的血量的限制。因此,通过利用白细胞去除术样品代替全血来按比例放大DNT扩增的方法将增加可以一次扩增的DNT的量并且使DNT疗法的通用潜力达到最大。为此,使用选择柱从源自于白细胞去除术的PBMC中分离出起始DNT细胞群体并且获得具有89.5%±2.51%的平均纯度的DNT(图19A)。此外,从PBMC中获得的DNT显示出与从全血中获得的DNT相当的扩增倍数,其中平均扩增倍数是1899±615.7(图19B)。最后,从PBMC扩增的DNT显示出与从全血中分离和扩增的DNT相当的体外细胞毒性(图19C)。这些数据表明,DNT可以使用优化的方法从PBMC中分离和扩增并且显示出与从全血中分离的DNT相当的特征。
总的来说,本专利中概述的结果表明,可以从多供者白细胞去除术样品中分离和汇集DNT以允许大规模扩增,所述大规模扩增可以用于从单个扩增培养物中制造足够的细胞产品来治疗数百个患者,而不是使用一次可以从单个供者获得的最大量的全血治疗2个-3个患者。
本文引用的所有出版物、专利和专利申请在此以引用的方式整体并入本文,其引用的程度就如同每一篇单独的出版物、专利或专利申请被具体地和单独地指示为以引用的方式整体并入本文一样。
参考文献
1 Park,J.H.等,Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia.N.Engl.J.Med.378,449-459,doi:10.1056/NEJMoa1709919(2018)。
2 Tran,E.等,T-Cell Transfer Therapy Targeting Mutant KRAS in Cancer.N.Engl.J.Med.375,2255-2262,doi:10.1056/NEJMoa1609279(2016)。
3 Kalos,M.和June,C.H.Adoptive T cell transfer for cancer immunotherapy in the era of synthetic biology.Immunity 39,49-60,doi:10.1016/j.immuni.2013.07.002(2013)。
4 Maus,M.V.等,Ex vivo expansion of polyclonal and antigen-specific cytotoxic T lymphocytes by artificial APCs expressing ligands for the T-cell receptor,CD28 and 4-1BB.Nat.Biotechnol.20,143-148,doi:10.1038/nbt0202-143(2002)。
5 FDA Approves Second CAR T-cell Therapy.Cancer Discov 8,5-6,doi:10.1158/2159-8290.CD-NB2017-155(2018)。
6 June,C.H.,Riddell,S.R.和Schumacher,T.N.Adoptive cellular therapy:a race to the finish line.Sci Transl Med 7,280ps287,doi:10.1126/scitranslmed.aaa3643(2015)。
7 Dickinson,A.M.等,Graft-versus-Leukemia Effect Following Hematopoietic Stem Cell Transplantation for Leukemia.Front Immunol 8,496,doi:10.3389/fimmu.2017.00496(2017)。
8 Chang,X.,Zang,X.和Xia,C.Q.New strategies of DLI in the management of relapse of hematological malignancies after allogeneic hematopoietic SCT.Bone Marrow Transplant.51,324-332,doi:10.1038/bmt.2015.288(2016)。
9 Devillier,R.等,Outcome of relapse after allogeneic stem cell transplant in patients with acute myeloid leukemia.Leuk.Lymphoma 54,1228-1234,doi:10.3109/10428194.2012.741230(2013)。
10 Zeiser,R.和Blazar,B.R.Acute Graft-versus-Host Disease-Biologic Process,Prevention,and Therapy.N.Engl.J.Med.377,2167-2179,doi:10.1056/NEJMra1609337(2017)。
11 Zeiser,R.和Blazar,B.R.Pathophysiology of Chronic Graft-versus-Host Disease and Therapeutic Targets.N.Engl.J.Med.377,2565-2579,doi:10.1056/NEJMra1703472(2017)。
12 Ruella,M.和Kenderian,S.S.Next-Generation Chimeric Antigen Receptor T-Cell Therapy:Going off the Shelf.BioDrugs 31,473-481,doi:10.1007/s40259-017-0247-0(2017)。
13 Chen,B.,Lee,J.B.,Kang,H.,Minden,M.D.和Zhang,L.Targeting chemotherapy-resistant leukemia by combining DNT cellular therapy with conventional chemotherapy.J.Exp.Clin.Cancer Res.37,88,doi:10.1186/s13046-018-0756-9(2018)。
14 Lee,J.等,Allogeneic human double negative T cells as a novel immunotherapy for acute myeloid leukemia and its underlying mechanisms.Clinical Cancer Research(provisionally accepted)(2017)。
15 Merims,S.等,Anti-leukemia effect of ex vivo expanded DNT cells from AML patients:a potential novel autologous T-cell adoptive immunotherapy.Leukemia 25,1415-1422,doi:10.1038/leu.2011.99(2011)。
16 Lee,J.B.等,Developing Allogeneic Double-Negative T Cells as a Novel Off-the-Shelf Adoptive Cellular Therapy for Cancer.Clin.Cancer Res.25,2241-2253,doi:10.1158/1078-0432.CCR-18-2291(2019)。
17 Legut,M.,Dolton,G.,Mian,A.A.,Ottmann,O.G.和Sewell,A.K.CRISPR-mediated TCR replacement generates superior anticancer transgenic T cells.Blood 131,311-322,doi:10.1182/blood-2017-05-787598(2018)。
18 Poirot,L.等,Multiplex Genome-Edited T-cell Manufacturing Platform for\"Off-the-Shelf\"Adoptive T-cell Immunotherapies.Cancer Res.75,3853-3864,doi:10.1158/0008-5472.CAN-14-3321(2015)。
19 Gattinoni,L.,Klebanoff,C.A.和Restifo,N.P.Paths to stemness:building the ultimate antitumour T cell.Nat.Rev.Cancer 12,671-684,doi:10.1038/nrc3322(2012)。
20 Torikai,H.和Cooper,L.J.Translational Implications for Off-the-shelf Immune Cells Expressing Chimeric Antigen Receptors.Mol.Ther.24,1178-1186,doi:10.1038/mt.2016.106(2016)。
21 Torikai,H.等,Toward eliminating HLA class I expression to generate universal cells from allogeneic donors.Blood 122,1341-1349,doi:10.1182/blood-2013-03-478255(2013)。
22 Rosenbaum,L.Tragedy,Perseverance,and Chance-The Story of CAR-T Therapy.N.Engl.J.Med.377,1313-1315,doi:10.1056/NEJMp1711886(2017)。
23 Gedye,C.A.等,Cell surface profiling using high-throughput flow cytometry:a platform for biomarker discovery and analysis of cellular heterogeneity.PLoS ONE 9,e105602,doi:10.1371/journal.pone.0105602(2014)。
24 Chimenti,I.等,Serum and supplement optimization for EU GMP-compliance in cardiospheres cell culture.J.Cell.Mol.Med.18,624-634,doi:10.1111/jcmm.12210(2014)。
25 O'Boyle,G.等,Chemokine receptor CXCR3 agonist prevents human T-cell migration in a humanized model of arthritic inflammation.Proc.Natl.Acad.Sci.U.S.A.109,4598-4603,doi:10.1073/pnas.1118104109(2012)。
26 Hirota,K.等,Preferential recruitment of CCR6-expressing Th17cells to inflamed joints via CCL20 in rheumatoid arthritis and its animal model.J.Exp.Med.204,2803-2812,doi:10.1084/jem.20071397(2007)。
27 Oswald,C.等,Intracellular allosteric antagonism of the CCR9 receptor.Nature 540,462-465,doi:10.1038/nature20606(2016)。
28 Woods,E.J.,Thirumala,S.,Badhe-Buchanan,S.S.,Clarke,D.和Mathew,A.J.Off the shelf cellular therapeutics:Factors to consider during cryopreservation and storage of human cells for clinical use.Cytotherapy 18,697-711,doi:10.1016/j.jcyt.2016.03.295(2016)。
29 Dudley,M.E.和Rosenberg,S.A.Adoptive-cell-transfer therapy for the treatment of patients with cancer.Nat.Rev.Cancer 3,666-675,doi:10.1038/nrc1167(2003)。
30 Boni,A.等,Adoptive transfer of allogeneic tumor-specific T cells mediates effective regression of large tumors across major histocompatibility barriers.Blood 112,4746-4754,doi:10.1182/blood-2008-07-169797(2008)。
31 Chambers,J.D.和Neumann,P.J.Listening to Provenge--what a costly cancer treatment says about future Medicare policy.N.Engl.J.Med.364,1687-1689,doi:10.1056/NEJMp1103057(2011)。
32 Brenner,M.K.Will T-cell therapy for cancer ever be a standard of care?Cancer Gene Ther.19,818-821,doi:10.1038/cgt.2012.74(2012)。
33 Sheridan,C.Allogene and Celularity move CAR-T therapy off the shelf.Nat.Biotechnol.36,375-377,doi:10.1038/nbt0518-375(2018)。
34 Yao,J.等,Human double negative T cells target lung cancer via ligand-dependent mechanisms that can be enhanced by IL-15.Journal for ImmunoTherapy of Cancer第7卷,文章编号:17(2019),doi:https://doi.org/10.1186/s40425-019-0507-2。
35 Jacoby,E.等,Murine allogeneic CD19 CAR T cells harbor potent antileukemic activity but have the potential to mediate lethal GVHD.Blood127,1361-1370,doi:10.1182/blood-2015-08-664250(2016)。
36 Provasi,E.等,Editing T cell specificity towards leukemia by zinc finger nucleases and lentiviral gene transfer.Nat.Med.18,807-815,doi:10.1038/nm.2700(2012)。
37 Young,K.J.,Kay,L.S.,Phillips,M.J.和Zhang,L.Antitumor activity mediated by double-negative T cells.Cancer Res.63,8014-8021(2003)。
38 Young,K.J.,DuTemple,B.,Zhang,Z.X.,Levy,G.和Zhang,L.CD4-CD8-regulatory T cells implicated in preventing graft-versus-host and promoting graft-versus-leukemia responses.Transplant.Proc.33,1762-1763,doi:10.1016/s0041-1345(00)02670-1(2001)。
39 Bian,Z.等,Association of Epstein-Barr virus reactivation with the recovery of CD4/CD8 double-negative T lymphocytes after haploidentical hematopoietic stem cell transplantation.Bone Marrow Transplant.52,264-269,doi:10.1038/bmt.2016.238(2017)。
40 Suck,G.等,NK-92:an'off-the-shelf therapeutic'for adoptive natural killer cell-based cancer immunotherapy.Cancer Immunol.Immunother.65,485-492,doi:10.1007/s00262-015-1761-x(2016)。
41 Tonn,T.等,Treatment of patients with advanced cancer with the natural killer cell line NK-92.Cytotherapy 15,1563-1570,doi:10.1016/j.jcyt.2013.06.017(2013)。
42 Romee,R.等,Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia.Sci Transl Med 8,357ra123,doi:10.1126/scitranslmed.aaf2341(2016)。
- 还没有人留言评论。精彩留言会获得点赞!