用于测量微藻类培养物活性的方法与流程
1.本发明涉及用于测量包含微藻类和任选的细菌的培养物的活性和生长的方法和装置。
背景技术:
2.多年来,在生物废水处理中使用微藻类越来越受到关注。更具体地说,微藻类能够吸收养分,例如铵、硝酸盐和磷酸盐,以生产生物燃料或增值产品。此外,微藻类可以捕获二氧化碳(co2)以产生氧气和碳(碳水化合物、藻类细胞、脂类
……
),因为它们具有光合作用活性。产生的氧气可以被废水中存在的细菌利用,以将铵氧化成硝酸盐。
3.对微藻类活性和生长的监测,特别是存在细菌的情况下,可以确定用于描述生物过程的行为所必需的动力学和化学计量参数、其最佳生长条件、以优化生物废水处理。此外,当废水中存在细菌时,对其活性的研究可以代表根据环境参数了解微生物种群与微藻类之间的相互作用的理想解决方案。这允许获得信息以预测这些处理的性能和效率。
4.s.rossi等人(activity assessment of microalgal-bacteria consortia based on respirometric tests)2018年的文章(doi:10.2166/wst.2018.078)描述了一种实验性呼吸运动计量协议,以确定实验腔室规模下的微藻类-细菌聚生体的摄氧速率和产氧速率。
5.g.vargas等人(assessment of microalgae and nitrifiers activity in a consortium in a continuous operation and the effect of oxygen depletion)2016年的文章(doi:10.1016/j.ejbt.2106.08.002)涉及能够使用来自废水处理厂的好氧污泥以溶解氧的低要求操作的硝化细菌和微藻类聚生体。根据本文,通过比较无机氮化合物的变化率,建立了测量硝化细菌和微藻类比活性的方法。该文章的方法以不连续的方式在实验室规模下进行。
6.a.m.j.kliphuis等人(light respiration in chlorella sorokiniana)2011年的文章(doi:10.1007/s10811-010-9614-7)描述了使用光纤氧气微传感器和栽培体系的小而简单的扩展,微藻类培养物原位光照后立即呼吸摄氧速率。这种方法允许快速且频繁的测量,而不会干扰微藻类的栽培和生长。
7.a.ruiz-martinez等人(behavior of mixed chlorophyceae cultures under prolonged dark exposure.respiration rate modeling)的文章涉及基于呼吸运动计量法的三种不同微藻类培养物当长时间暴露于避光条件下时的行为研究。
8.文献us2012/0156711描述了一种系统和方法,其提供光电传感器和呼吸运动计量传感器的联合性能,以即时和准确地确定液状工业废料中的生化需氧量。
9.文献us5,811,255描述了一种用于无氧和有氧呼吸运动计量法的设备和方法。该设备和方法提供自动收集并分析校准涉及无氧呼吸和脱卤的生物过程的数学模型所需的数据。
10.文献us6,905,872描述了一种在线呼吸计和一种使用呼吸计以确定诸如包含污水
和微生物水培养物的混合物的浆液样品的呼吸样品的摄氧量的方法。
11.文献us4,314,969描述了一种包括氧气分析仪的潜水式记录呼吸计,该氧气分析仪测量包含在曝气腔室中的废水样品吸收的氧气浓度。
12.仍然需要以快速、在线、自动化和有效的方式表征包含微藻类和任选细菌的培养物的方法,特别是通过测量溶解氧浓度(和任选地溶解二氧化碳浓度),以便能够评估和监测培养物的生长,并且在存在细菌时,确定培养物中微藻类和细菌各自的活性。
技术实现要素:
13.本发明的第一目的是提供一种用于表征包含微藻类的培养物的活性的方法,所述方法包括以下步骤:
14.从生物反应器向与生物反应器流体连接的腔室供应培养物样品;
15.照射腔室中的样品;
16.测量样品中的溶解氧浓度,以确定受照射样品的产氧速率。
17.根据一些实施方案,所述方法还包括以下步骤:
18.没有光的情况下保存生物反应器中的培养物样品;
19.测量所述样品中的溶解氧浓度,以确定没有光的情况下样品的氧消耗速率。
20.根据一些实施方案,没有光的情况下保存的样品与被照射的样品相同。
21.根据一些实施方案,没有光的情况下保存的样品与被照射的样品不同。
22.根据一些实施方案,没有光的情况下保存样品的步骤在腔室中进行。
23.根据一些实施方案,没有光的情况下保存样品的步骤在与所述腔室和/或生物反应器流体连接的额外腔室中进行,优选从所述腔室向额外腔室供应样品,或直接从生物反应器向额外腔室供应样品。
24.根据一些实施方案,通过将受照射样品的产氧速率和没有光的情况下样品的氧消耗速率相加确定微藻类光合作用的产氧速率。
25.根据一些实施方案,在照射样品的步骤期间和/或在没有光的情况下保存样品的步骤期间测量样品中的溶解氧浓度。
26.根据一些实施方案,照射样品的步骤进行第一持续时间和/或在没有光的情况下保存样品的步骤进行第二持续时间,并且通过计算在照射样品的步骤期间根据时间测量的溶解氧浓度导数,确定受照射样品的产氧速率和/或通过计算在没有光的情况下保存样品的步骤期间根据时间测量的溶解氧浓度导数,确定没有光的情况下保存的样品的氧消耗速率。
27.根据一些实施方案,通过在照射样品的步骤之前和之后测量样品中的溶解氧浓度,确定受照射样品的产氧速率和/或通过没有光的情况下保存样品的步骤之前和之后测量样品中的溶解氧浓度,确定没有光的情况下样品的氧消耗速率。
28.根据一些实施方案,进行一个以上测量溶解氧浓度的步骤,并且在测量样品中的溶解氧浓度的第一步骤之后,所述方法包括用生物反应器中的新样品更新腔室中的样品的步骤和测量样品中的溶解氧浓度的第二步骤。
29.根据一些实施方案,在照射样品的步骤期间进行测量样品中的溶解氧浓度的第一步骤,在没有光的情况下保存样品的步骤期间进行测量样品中的溶解氧浓度的第二步骤;
或者,在没有光的情况下保存样品的步骤期间进行测量样品中的溶解氧浓度的第一步骤,在照射样品的步骤期间进行测量样品中的溶解氧浓度的第二步骤;或者,在照射样品的步骤期间进行测量样品中的溶解氧浓度的第一步骤和第二步骤;或者,在没有光的情况下保存样品的步骤期间进行测量样品中的溶解氧浓度的第一步骤和第二步骤。
30.根据一些实施方案,所述方法包括一个以上照射样品的步骤以及一个以上没有光的情况下保存样品的步骤,每个照射样品的步骤都与没有光的情况下保存样品的步骤交替,所述方法优选包括在照射样品的步骤期间,或在没有光的情况下保存样品的步骤期间,或在照射样品的步骤和没有光的情况下保存样品的步骤两者期间中,测量溶解氧浓度。
31.根据一些实施方案,培养物还包括细菌。
32.根据一些实施方案,在照射样品的步骤期间和/或在没有光的情况下保存样品的步骤期间,将至少一种细菌底物添加到样品中。
33.根据一些实施方案,在照射样品的步骤期间和/或在没有光的情况下保存样品的步骤期间,将至少一种细菌或微藻类的抑制剂或毒性化合物添加到样品中。
34.根据一些实施方案,当培养物中存在细菌时:通过进行照射样品并测量溶解氧浓度以确定受照射样品的第一产氧速率的第一步骤,所述样品不含细菌的抑制剂或毒性化合物;进行照射样品并测量溶解氧浓度以确定受照射样品的第二产氧速率的第二步骤,所述样品包含至少一种细菌的抑制剂或毒性化合物,并通过计算第二产氧速率和第一产氧速率之间的差值,确定细菌的氧消耗速率;和/或通过进行没有光的情况下保存样品并测量溶解氧浓度以确定没有光的情况下样品的第三氧消耗速率的第一步骤,所述样品不含细菌的抑制剂或毒性化合物,进行没有光的情况下保存样品并测量溶解氧浓度以确定没有光的情况下样品的第四氧消耗速率的第二步骤,所述样品包含至少一种细菌的抑制剂或毒性化合物,并通过计算第三氧消耗速率和第四氧消耗速率之间的差值,确定细菌的氧消耗速率。
35.根据一些实施方案,所述方法包括测量样品中溶解二氧化碳浓度以确定受照射样品和/或没有光的情况下保存的样品的二氧化碳消耗或产生速率的步骤。
36.根据一些实施方案,微藻类选自绿藻类、黄藻类、金藻类、硅藻类、隐藻类、甲藻类、绿胞藻类、裸藻类、褐藻类、红藻类、蓝藻类。
37.根据一些实施方案,培养物包含源自采出水、淡水、海水、含水层水或废水的水介质。
38.根据一些实施方案,以连续方式进行样品从生物反应器向腔室的供应。
39.根据一些实施方案,以不连续的方式进行样品从生物反应器向腔室的供应。
40.根据一些实施方案,所述方法还包括测量样品的ph的步骤。
41.根据一些实施方案,所述方法还包括测量样品的浊度的步骤。
42.本发明的另一目的是提供一种用于表征包含微藻类的培养物的装置,所述装置包括:
43.生物反应器,被配置为接收包含微藻类的培养物;
44.腔室,具有入口和出口,并与生物反应器流体连接,从而可以通过入口从生物反应器向腔室直接供应培养物样品;
45.光源,用于在腔室中发光;
46.至少一个传感器,用于测量样品中的溶解氧浓度。
47.本发明的另一目的是提供一种用于表征包含微藻类的培养物的设备,所述设备包括:
48.腔室,具有入口和出口,所述腔室被配置为与生物反应器流体连接,所述生物反应器被配置为接收包含微藻类的培养物,从而可以通过入口从生物反应器向腔室直接供应培养物样品;
49.光源,用于在腔室中发光;
50.至少一个传感器,用于测量样品中的溶解氧浓度。
51.根据一些实施方案,腔室是密封的。
52.根据一些实施方案,所述装置或设备包括具有入口和出口的至少一个额外腔室,所述额外腔室流体连接到所述腔室和生物反应器。
53.根据一些实施方案,所述装置或设备包括用于测量位于腔室中的溶解氧浓度的传感器和/或包括用于测量位于额外腔室中的溶解氧浓度的传感器。
54.根据一些实施方案,所述装置或设备包括用于测量腔室入口上游和/或出口下游的溶解氧浓度的传感器;和/或包括用于测量额外腔室入口上游和/或出口下游的溶解氧浓度的传感器。
55.根据一些实施方案,额外腔室没有发光源。
56.根据一些实施方案,所述装置或设备包括用于测量样品中溶解二氧化碳浓度的至少一个传感器。
57.根据一些实施方案,所述装置或设备包括用于测量样品的ph、样品的温度和/或样品的浊度的一个或多个传感器。
58.根据一些实施方案,所述装置或设备包括用于将样品从生物反应器循环到腔室和/或从腔室循环到生物反应器的至少一个泵。
59.根据一些实施方案,所述装置或设备包括一个或多个注入器,用于将微藻类和/或细菌底物或细菌或微藻类的抑制剂或毒性化合物添加到腔室中或腔室上游和/或额外腔室中或额外腔室上游。
60.本发明的另一目的是提供一种计算机程序,包括用于执行上述方法的指令。
61.本发明的另一目的是提供一种数据存储介质,其上记录有上述计算机程序。
62.本发明的另一目的是提供一种系统,包括耦合到存储器的处理器,所述存储器上记录有上述计算机程序。
63.本发明的另一目的是提供一种组件,包括上述系统和设备或装置。
64.本发明可以满足上述需求。特别地,本发明提供了一种以快速、在线、自动化和有效的方式表征包含微藻类和任选的细菌的培养物的方法,特别是通过测量溶解氧浓度(和任选地溶解二氧化碳浓度),以能够评估和测量培养物的生长,并且在存在细菌时,确定培养物中微藻类和细菌各自的活性。
65.这通过允许将位于生物反应器中的样品直接供应到与生物反应器流体连接的腔室以进行溶解氧的测量和任选地溶解二氧化碳的测量的方法实现。有利地,该供应可以以连续的方式进行,以提高过程的速度。
66.由于腔室中样品的照射,根据本发明的方法可以评估微藻类的光合作用活性,从而评估其氧气产量以及用于微藻类呼吸和任选地用于细菌呼吸所消耗的氧气量。有利地,
由于没有光的情况下保存样品的步骤,根据本发明的方法可以测量与微藻类呼吸和任选的细菌呼吸相关的氧消耗。仍然有利的是,当存在细菌时,底物例如养分或碳源和/或细菌的抑制剂和/或有毒物质等的注入可以评估微藻类和细菌各自的活性。例如,没有光的情况下保存样品的步骤中,细菌底物的注入允许测量细菌的最大活性。或者,没有光的情况下保存样品的步骤期间,细菌的抑制剂或有毒物质的注入可以降低或抑制细菌的活性,以测量由于微藻类呼吸引起的氧消耗。因此,这种方法允许在抑制剂或有毒物质存在的情况下评估微生物(微藻类和细菌)的表现。
67.此外,存在包括光源的腔室的和存在没有光源的额外腔室,以及腔室和额外腔室流体连接到生物反应器的事实,允许过程自动化并提高了过程速度。
68.仍然有利的是,所述方法还允许测量对于监测微藻类和/或细菌的生长和活性例如二氧化碳、ph、浊度或光密度等重要的其他参数。例如,在照射腔室中的样品期间,可以测量二氧化碳的消耗量,该量对应于微藻类用于光合作用的二氧化碳量以及微藻类和任选的细菌对于其呼吸产生的二氧化碳量。
附图说明
69.图1示意性地示出了根据本发明的一实施方案的装置。
70.图2示意性地示出了根据本发明的另一实施方案的装置。
71.图3示出了包含微藻类的培养物样品中的根据时间的溶解氧浓度(a)和溶解氧产生速率(b)。溶解氧浓度(mg/l)和产氧速率(mg/l.h)可在y轴上读取,时间(h)可在x轴上读取。
72.图4示出了包含微藻类和细菌的培养物样品中的根据时间的溶解氧浓度(a)和溶解氧产生速率(b)。溶解氧浓度(mg/l)和产氧速率(mg/l.h)可在y轴上读取,时间(h)可在x轴上读取。
具体实施方式
73.现将通过以下描述对本发明进行更详细地介绍,但不限于以下描述。
74.微藻类培养物
75.根据本发明的培养物包含微藻类。“微藻类”是指微型藻类,其最大尺寸的范围可以从几微米(μm)到几百微米。微藻类能够在有光的情况下通过将二氧化碳转化为碳水化合物并产生氧气来进行光合作用。同时(在有光的情况下),微藻类消耗氧气用于呼吸。然而,在有光的情况下,与由于光合作用产生的氧气相比,消耗的氧气量可以忽略不计。微藻类在没有光的情况下也会消耗氧气。
76.微藻类可以产自某个环境,也可以通过使用官方培养物保藏中心进行选择。微藻类可以是例如绿藻类、黄藻类、金藻类、硅藻类、隐藻类、甲藻类、绿胞藻类、裸藻类、褐藻类、红藻类、蓝藻类的类型中的一种。
77.根据一些实施方案,培养物可包含仅一种微藻类菌株。
78.根据其他实施方案,培养物可包含一种以上微藻类菌株,例如2种或3种或4种或5种或10种或10种以上不同的微藻类菌株。
79.优选地,根据本发明的微藻类是自养生物,这意味着其消耗无机碳源以产生有机
物质。
80.可替代地,根据本发明的微藻类是兼养微生物。“兼养微生物”是一种可以使用不同碳源(有机碳和无机碳)的混合体,而不是具有从一端完全自养到另一端异养的连续体上的单一营养模式的生物。
81.微藻类在培养物中的浓度可为0.1至5g/l,优选为0.3至2g/l。可以通过测量样品在680nm处的总固体浓度或浊度或光密度测量该浓度。可替代地,可以通过细胞计数测量该浓度。
82.培养物可包含其中培养有微藻类的水介质。该水介质可源自采出水(源自从地层中提取烃)、淡水、海水、含水层水或废水。
83.培养物的铵阳离子浓度可为0至200mg/l。
84.培养物的磷酸阴离子浓度可为3至150mg/l。
85.培养物的硝酸阴离子浓度可为0至1500mg/l。
86.培养物的溶解有机碳浓度可为0至500mg/l。
87.培养物的浊度可为0至200ntu。
88.培养物的溶解氧浓度可为1至21mg/l。
89.培养物的ph可为2至11。
90.培养物的盐度可为0至最多300g/l。
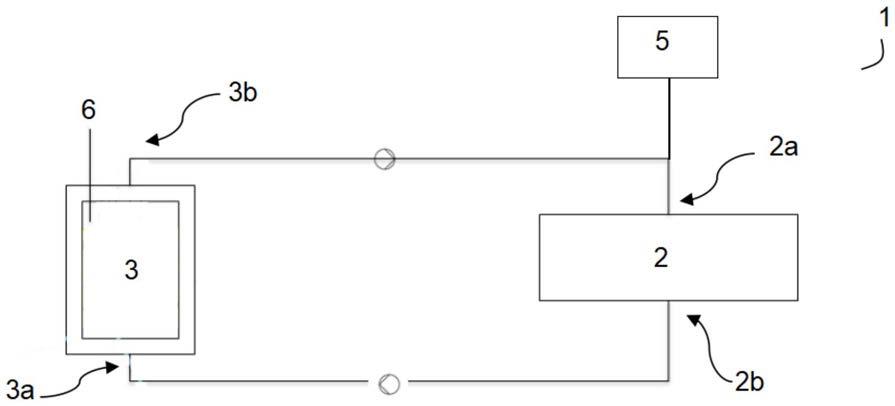
91.培养物的温度可为0至40℃。
92.根据一些优选的实施方案,培养物可包含细菌。
93.根据一些实施方案,培养物中存在的细菌是自养细菌。当培养物中存在自养细菌时,优选其为氨氧化细菌(将氨氧化为亚硝酸盐的细菌)和亚硝酸盐氧化细菌(将亚硝酸盐氧化为硝酸盐的细菌)。这种细菌原产于在水介质中。
94.根据其他实施方案,培养物中存在的细菌是异养细菌。这种细菌原产于水介质中。
95.根据优选的实施方案,培养物包含自养细菌和异养细菌。
96.细菌在培养物中的浓度可为0至0.5g/l,优选为0至0.2g/l。可以通过测量样品的总固体浓度来测量该浓度。
97.在一些实施方案中,培养物中细菌浓度与微藻类浓度的比可以等于或低于20%并且优选低于10%。
98.在培养物中,细菌(如果存在)由于其呼吸而消耗氧气。培养物中存在底物(如碳源或养分)可以提高细菌的活性,从而提高其氧消耗。抑制剂或有毒物质的存在可以降低或抑制细菌的活性,从而降低或抑制其氧消耗。
99.用于表征包含微藻类的培养物的活性的装置
100.本发明涉及一种用于表征包含微藻类的培养物并且特别是用于测量包含微藻类和任选的细菌的培养物样品中的溶解氧产生和消耗率的装置,培养物如上所述。
101.将参考图1和图2对装置进行描述。装置1包括生物反应器,培养物最初放置并培养在其中。
102.生物反应器2优选为好氧生物反应器。因此,生物反应器2是封闭的或开放的容器。根据一些实施方案,可以通过人造光源照射生物反应器2的内容物。
103.根据一些实施方案,特别是当容器封闭时,容器因此优选是透明的。
104.生物反应器2可任选的包括温度控制系统,包括例如冷却和/或加热装置,以将培养物的温度维持在预定温度范围内,例如0-40℃,优选20-30℃。除此以外,生物反应器2可以在环境温度下操作。
105.生物反应器2还可以包括ph控制系统和用于将底物例如氮和磷化合物(如铵、硝酸盐和/或磷酸盐)和有机碳等添加到培养物中的底物添加系统。
106.此外,生物反应器2可包括搅拌系统,其可促进培养物的均化。例如,搅拌系统可以包括使样品中的空气起泡的系统或桨轮或泵、推进器、磁力搅拌系统
……
。
107.生物反应器2的体积可为0.003至20m3,优选为1至10m3。
108.生物反应器2可具有入口2a和出口2b,用于培养物样品的进出。
109.根据一些实施方案,装置1中存在仅一个生物反应器2。
110.根据其他实施方案(图中未示出),装置1中存在例如并联放置的几个生物反应器2,在这种情况下,生物反应器一个接一个地供给腔室3。
111.根据本发明的装置1还包括至少一个具有入口3a和出口3b的腔室3。腔室3流体连接到生物反应器2,使得生物反应器2可以直接向腔室3供应培养物样品。可以通过连接生物反应器2与腔室3(如图所示)的导管、通道或管材来实现生物反应器2和腔室3之间(直接)流体连接。因此,在例如通过使用蠕动泵将培养物样品从生物反应器2转移到腔室3期间,样品不会与外部环境接触并且不会转移到诸如灌注器、吸移管等外部元件。
112.腔室3的入口3a与生物反应器2的出口2b流体连接。根据一些实施方案(并且如图1所示),腔室3的出口3b与生物反应器2的入口2a流体连接,以形成包括腔室3和生物反应器2的回路。可替代地,腔室3的出口3b可以连接到如下所述的额外腔室。
113.腔室3被密封,以阻止其中的样品与外部环境接触(从而避免培养物氧化)。腔室3是封闭的容器。可以对腔室3的内容物进行照射(通过人造光或自然光)。腔室3的壁可以是部分透明的、全部透明的或不透明的。此外,腔室可包括搅拌系统,其可促进培养物的均化。
114.腔室3的内部容积可为0.1至1l,优选为0.25至0.5l。
115.根据本发明的装置1,更具体地是腔室3,包括发光源,或腔室3中的光源(图中未示出)。光源可以使微藻类进行光合作用。
116.光源可以是例如位于腔室3内部的发光二极管灯。可替代地,光源可以位于腔室3的外部(腔室3是至少部分透明的)。在这种情况下,优选地将腔室3封闭在不透明的外壳中,以保护其免受外部光的影响。
117.可替代地,腔室3可以是至少部分透明的并且光源可以是外部自然光。在这种情况下,腔室3优选地设有被配置为阻挡外部自然光的可移动的不透明保护装置(例如外壳或罩)。
118.优选地,装置1包括仅一个具有发光源的腔室3。然而,如果装置1包括一个以上具有光源(图中未示出)的腔室3,则腔室3可以彼此串联的流体连接。在这种情况下,将串联的第一腔室3的入口3a与生物反应器2的出口2b流体连接,而串联的最后一个腔室3的出口3b任选地与生物反应器2的入口2a流体连接。可替代地,腔室3可以并联放置。在这种情况下,每个腔室3的入口3a与生物反应器2的出口2b流体连接,而每个腔室3的出口3b任选地与生物反应器2的入口2a流体连接。
119.根据一些优选实施方案,装置还可包括至少一个与腔室3和生物反应器2流体连接
的额外腔室4。因此,额外腔室4可具有入口4a和出口4b,额外腔室4的入口4a例如与腔室3的出口3b流体连接并且额外腔室4的出口4b与生物反应器2的入口2a流体连接,以形成包括腔室3、额外腔室4和生物反应器2(如图2所示)的回路。可以通过导管、通道或管材来实现额外腔室4、腔室3和生物反应器2之间(直接)流体连接。
120.因此,根据装置1的配置,可以例如通过使用蠕动泵使样品从生物反应器2循环到腔室3,然后循环回到生物反应器2(如图1所示)或额外腔室4,再循环回到生物反应器2(如图2所示)。可替代地,样品在进入腔室3和/或额外腔室4之后,可被引导至包含在装置1中的废料容器5。在这种情况下,装置1还可包括切换阀,以将样品引导至生物反应器2或废料容器5。
121.可替代地,与图2所示的相反,额外腔室4可以沿流动方向放置在生物反应器2和腔室3之间(而不是将腔室3放置在生物反应器2和额外腔室4之间)。在这种情况下,生物反应器2的出口2b与额外腔室4的入口4a流体连接,额外腔室4的出口4b与腔室3的入口3a流体连接。
122.额外腔室4被密封,以阻止与外部环境的接触。此外,额外腔室4不允许外部环境的光进入额外腔室4。额外腔室4可以包括由选自玻璃或聚合物的材料制成的外壁。额外腔室4可以被封闭在不透明外壳中或被不透明罩或不透明层覆盖。
123.额外腔室4的内部容积可为0.1至1l,优选为0.25至0.5l。
124.该额外腔室4可以优选地没有发光源。因此,当样品在额外腔室4中时,不仅样品不与外部环境的光接触,而且额外腔室4中的光源也不会发光,因此在腔室4中不会发生光合作用。
125.优选地,装置1仅包括一个额外腔室4。然而,如果装置1包括几个额外腔室4(图中未示出),则额外腔室4可以彼此串联的流体连接。例如,当装置1包括几个腔室3(具有光源)和几个额外腔室4时,腔室3和额外腔室4可以串联地流体连接,每个腔室3与额外腔室4交替(一个腔室3和一个额外腔室4如图2所示)。在这种情况下,串联的第一腔室3的入口3a可以与生物反应器2的出口2b流体连接,而串联的最后一个腔室3的出口3b(或最后一个额外腔室4的出口4b)可以与生物反应器2的入口2a流体连接。
126.根据其他实施方案(图中未示出),几个腔室3可以并联放置并且单个额外腔室4可以串联放置;或者单个腔室3可以相对于并联放置的几个额外腔室4串联放置;或者几个腔室3可以并联放置,且相对于每个腔室3串联一个额外腔室4。
127.此外,腔室3和/或额外腔室4可以包括搅拌系统(图中未示出),其可以促进样品的均化。
128.装置1还包括用于测量样品中的溶解氧浓度的至少一个传感器6。
129.根据一些实施方案,装置1包括用于测量溶解氧浓度的仅一个传感器6。
130.这种传感器6可以是光学氧传感器(例如由hach或hamilton公司商业化的光学氧传感器)。该传感器6可以位于例如腔室3中(如图1所示)。可替代地,传感器6可位于腔室3的上游或下游,更具体地靠近腔室3的入口3a或出口3b。
131.根据其他实施方案,装置1包括用于测量溶解氧浓度的几个传感器6。装置可以特别地包括用于测量溶解氧浓度的两个或三个或四个传感器6。例如,第一传感器6可以位于腔室3的入口3a的上游(并且靠近腔室3的入口3a),第二传感器6可以位于腔室3的出口3b的
下游(并且靠近腔室3的出口3b)。当装置1包括额外腔室4,第一传感器6可以位于腔室3中并且第二传感器6可以位于额外腔室4中(图中未示出)。可替代的并且优选地(如图2所示),第一传感器6可以位于腔室3的入口3a的上游(并且靠近腔室3的入口3a),第二传感器6可以位于腔室3的出口3b和额外腔室4的入口4a之间,并且第三传感器6可以位于额外腔室4的出口4b的下游(并且靠近额外腔室4的出口4b)。
132.装置1还可包括用于测量样品中溶解二氧化碳浓度的至少一个传感器(图中未示出)。
133.这种传感器可以是由mettler toledo公司商业化的传感器或其他同等传感器。
134.根据一些优选实施方案,装置1包括用于测量溶解二氧化碳浓度的仅一个传感器。该传感器可以位于例如腔室3或额外腔室4中。可替代地,传感器可以位于腔室3(或额外腔室4)之外,更具体地位于腔室3的入口3a的上游或出口3b的下游(或额外腔室4的入口4a的上游或出口4b的下游)。
135.根据其他实施方案,装置1包括用于测量溶解二氧化碳浓度的几个传感器。装置可以特别地包括用于测量溶解二氧化碳浓度的两个或三个或四个传感器。例如,第一传感器可以位于腔室3的入口3a的上游(靠近腔室3的入口3a),第二传感器可以位于腔室3的出口3b的下游(靠近腔室3的出口3b)。当装置1包括额外腔室4时,第一传感器可以位于腔室3中并且第二传感器可以位于额外腔室4中。可替代的并且优选地,第一传感器可以位于腔室3的入口3a的上游(靠近腔室3的入口3a),第二传感器可以位于腔室3的出口3b和额外腔室4的入口4a之间,并且第三传感器可以位于额外腔室4的出口4b的下游(靠近额外腔室4的出口4b)。
136.装置1还可包括用于测量样品的ph的一个或多个传感器,和/或用于测量样品的温度的一个或多个传感器,和/或用于测量样品的浊度的一个或多个传感器,和/或用于测量样品的光密度(例如在680nm处)的一个或多个传感器和/或用于测量样品(图中未示出)的悬浮固体总量(tss)的一个或多个传感器。
137.用于测量ph的传感器可以是由hamilton或hach公司商业化的与数据采集系统兼容的传感器。用于测量温度的传感器可以与用于测量溶解氧浓度或样品的ph的传感器相同。
138.根据一些优选实施方案,装置1包括仅一个用于测量ph的传感器和/或仅一个用于测量温度的传感器和/或仅一个用于测量浊度的传感器和/或仅一个用于测量光密度的传感器和/或仅一个用于测量样品悬浮固体总量(tss)的传感器。这个或这些传感器可以优选地位于例如腔室3(或额外腔室4)中。可替代地,传感器可位于腔室3(或额外腔室4)之外,更具体地位于腔室3的入口3a的上游或出口3b的下游(或额外腔室4的入口4a的上游或出口4b的下游)。
139.根据其他实施方案,装置1包括几个用于测量ph的传感器,和/或几个用于测量温度的传感器和/或几个用于测量浊度的传感器和/或几个用于测量光密度的传感器和/或几个用于测量样品悬浮固体总量(tss)的传感器。装置可以特别地包括两个或三个或四个用于测量ph的传感器和/或两个或三个或四个用于测量温度的传感器和/或两个或三个或四个用于测量浊度的传感器和/或两个或三个或四个用于测量光密度的传感器和/或两个或三个或四个用于测量样品的悬浮固体总量(tss)的传感器。例如,第一传感器(ph传感器和/
或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于腔室3的入口3a的上游(靠近腔室3的入口3a),而第二传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于腔室3的出口3b的下游(靠近腔室3的出口3b)。当装置1包括额外腔室4,第一传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可位于腔室3中,并且第二传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于额外腔室4中。可替代地,并且优选地,第一传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于腔室3的入口3a的上游(靠近腔室3的入口3a),第二传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于腔室3的出口3b和额外腔室4的入口4a之间,并且第三传感器(ph传感器和/或温度传感器和/或浊度传感器和/或光密度传感器和/或悬浮固体总量传感器)可以位于额外腔室4的出口4b的下游(靠近额外腔室4的出口4b)。
140.此外,装置1可以包括至少一个泵(例如蠕动泵),所述至少一个泵用于将样品例如从生物反应器2循环到腔室3,并循环回和/或循环到生物反应器2,再循环到腔室3,然后循环到额外腔室4并循环回到生物反应器2。
141.根据一些实施方案,装置1还可包括一个或多个注入器。这些注入器可用于例如将诸如底物和/或抑制剂(或有毒物质)等组分引入到流体回路中,例如引入到腔室3和/或额外腔室4之一。
142.根据一些实施方案,注入器可被配置为直接在腔室3和/或额外腔室4中进行注入。
143.根据其他实施方案,注入器可被配置为在将腔室3和/或额外腔室4与生物反应器2连接和/或通向腔室3和/或额外腔室4的导管、通道或管材中进行注入。
144.每个注入器可以与容纳诸如底物和/或抑制剂(或有毒物质)等组分的一个或多个罐流体连接。
145.装置1可包括多个开/关阀,以启动或停止从装置1的一部分到另一部分的流动。
146.根据一些实施方案,腔室3、腔室中的发光源和至少一个氧传感器可以形成设备,所述设备被配置为经由腔室3连接到生物反应器2以形成装置1。该设备可以具有与装置1相同的特征,如上所述。该设备可以是便携式的。
147.用于表征包含微藻类的培养物的活性的方法
148.本发明还涉及一种用于表征包含微藻类和任选的细菌的培养物的活性的方法(特别是通过测量溶解氧或二氧化碳的浓度),该培养物如上所述。该方法优选的在上述装置1中实现。
149.该方法可以包括先将培养物置于生物反应器2的步骤。根据一些实施方案,在将培养物置于生物反应器2之前,该方法可以包括接种步骤和培养物(微藻类和/或细菌)生长步骤。根据一些实施方案,该方法可以包括将微藻类和任选的细菌底物注入到生物反应器2中以增加培养物的步骤。培养物可以在生物反应器2中保留并培养一段时间。该段时间可以是例如从几天(例如3天或4天或5天或6天或7天或7天以上)到几年(例如1年或2年或3年或4年或5年或5年以上)。
150.然后,通过使用循环(蠕动)泵将培养物样品(或一定量的培养物)从生物反应器2
直接供应到腔室3。可以通过连接生物反应器2与腔室3的导管、通道或管材进行该供应。
151.腔室3中的样品的体积可为0.1至1l,优选为0.25至0.5l。
152.根据一些实施方案,3可以以不连续的方式进行样品到腔室的供应。换言之,可以将一定量的培养物供应到腔室3。然后可以停止从生物反应器2到腔室的流动。然后可以将样品排放(例如排放到废料中,或排放到额外腔室4中)或返回到生物反应器2(任选的同时可以将新样品从生物反应器2供应到腔室3)。图1的实施方案中的装置特别适用于这种不连续的操作模式。
153.根据其他实施方案,可以以连续的方式进行样品向腔室3的供应。换言之,可以将一定量的培养物连续地供应到腔室3,同时可以将一定量的培养物连续地排放(例如排放到废料中,或排放到额外腔室4中)或返回到生物反应器2。图2的实施方案中的装置特别适用于这种连续的操作模式。
154.该方法还包括照射腔室3中的样品的步骤。可以施加该照射一段时间,该段时间在1分钟到几个小时(例如1小时或2小时或3小时或4小时或5小时或5小时以上)之间变化。
155.根据一些实施方案,根据本发明的方法包括一个照射样品(腔室3中)的步骤。
156.根据其他优选实施方案,根据本发明的方法包括几个照射样品的步骤,例如两个或三个或四个或五个或十个或十五个或二十个照射样品的步骤。例如,可以将样品供应到腔室3,以进行照射样品的第一步骤(测量受照射样品中的溶解氧浓度)。然后可以将样品排放或返回到生物反应器2,并且可以将新样品从生物反应器2供应到腔室3,以进行照射(新)样品的第二步骤(测量受照射样品中的溶解氧浓度)。在这种情况下,照射样品的各个步骤都是连续的,并且在每个照射样品的步骤之前更新样品。
157.可替代地,在两个照射样品的步骤之间可以存在其他步骤(如下所述),换言之,两个照射样品的步骤是不连续的。
158.在照射样品的步骤中,微藻类进行光合作用产生氧气。同时,其消耗氧气用于呼吸(与产生的氧气相比可以忽略不计)。
159.根据一些实施方案,在样品的照射过程中,样品中存在至少一种底物(例如将至少一种底物添加到样品中)。这种底物可以是微藻类底物。可替代的或者优选地,当培养物中存在细菌时,这种底物可以是细菌底物。一些底物既可以是微藻类底物又可以是细菌底物。例如通过将底物注入到腔室3中或注入到通向腔室3的导管/通道/管材中添加底物,可以使微藻类和/或细菌的活性最大化,以在这些(最大化)条件下测量溶解氧浓度。这种底物可以是例如氯化铵、亚硝酸钠、乙醇、乙酸钠、甘油。
160.样品中这种底物浓度可以在1到400ppm之间变化,优选为3-200ppm。
161.根据一些实施方案,在样品照射过程中,样品中存在至少一种抑制剂或毒性化合物(例如将至少一种抑制剂或毒性化合物添加到样品中)。这种抑制剂或毒性化合物可以是微藻类的抑制剂或毒性化合物。可替代的并且优选地,当培养物中存在细菌时,此类抑制剂或毒性化合物可以是细菌的抑制剂或毒性化合物。例如通过将抑制剂或毒性化合物注入到腔室3中或注入到通向腔室3的导管/通道/管材中添加抑制剂或毒性化合物,可以使培养物中存在的细菌失活,以测量仅与微藻类活性相对应的溶解氧浓度(光合作用产生的氧气和由于微藻类呼吸消耗的氧气)。例如,添加抑制剂或毒性化合物可以使样品中存在的所有细菌失活。除此以外,特别是当样品中存在异养细菌和自养细菌时,添加特定抑制剂或毒性化
合物可以使仅自养细菌失活,而异养细菌保持有活性。可替代地,添加特定抑制剂或毒性化合物可以使仅异养细菌失活,而自养细菌保持有活性。这种抑制剂或毒性化合物可以是例如硫酸铜、氯酸钾、氯酸钠、烯丙基硫脲、萘、甲苯、甲醇、戊二醛、季铵盐、thps(四羟甲基硫酸磷)、乙二醇、2丁氧基乙醇,4叔辛基苯酚。
162.根据一些实施方案,在样品照射过程中,样品中存在仅底物(例如将仅底物添加到样品中)。
163.根据一些实施方案,在样品照射过程中,样品中存在仅抑制剂或毒性化合物(例如将仅抑制剂或毒性化合物添加到样品中)。
164.根据其他实施方案,在样品照射过程中,样品中存在底物和抑制剂或毒性化合物(例如将底物和抑制剂或毒性化合物添加到样品中)。
165.例如,在照射样品的第一步骤期间,样品中可以存在底物(例如将底物添加到样品中),而在照射样品的第二步骤期间,样品中可以存在抑制剂或毒性化合物(例如将抑制剂或毒性化合物添加到样品中)。
166.可替代地,在照射样品的第一步骤期间,样品中可以存在底物(例如将底物添加到样品中),并且在照射样品的第二步骤期间,样品中可以存在抑制剂或毒性化合物和底物(例如将抑制剂或毒性化合物和底物添加到样品中)。
167.测量样品中的溶解氧浓度。
168.基于溶解氧的测量,可以确定受照射样品的产氧速率和/或未受照射样品的氧消耗速率。该测量可在一个或多个照射样品的步骤期间和/或在一个或多个没有光的情况下保存样品的步骤期间或在这些步骤之前和之后进行。
169.如果样品中总消耗净氧,则“产氧速率”具有负值,如果样品中总产生净氧,则“产氧速率”具有正值。其可以例如用mg o2/(l
·
h)表示。
170.如果样品中总消耗净氧,则“氧消耗速率”具有正值,如果样品中总产生净氧,则“氧消耗速率”具有负值。其可以例如用mg o2/(l
·
h)表示。换言之,氧消耗速率对应于负产氧速率。
171.可以例如通过根据时间计算溶解氧浓度的导数和任选地通过求取一段时间内所述导数的平均值,或者通过计算两个时间点之间溶解氧浓度的差值并除以所述时间点之间的时隔来确定氧产生或消耗率。
172.参考图1,当样品以不连续的方式(如上所述)供应到腔室3中时,例如可以利用位于腔室3中的传感器进行该测量。例如,进行照射样品的步骤一定持续时间时,可以通过计算在照射样品的步骤期间根据该持续时间测量的溶解氧浓度导数,确定受照射样品的产氧速率。
173.可替代地,参考图2,当样品以连续方式供应时(如上所述),在样品被供应到腔室3之前以及被从腔室3排出之后(因此在照射步骤之前和之后),例如可以利用位于所述腔室3的入口3a上游(靠近所述腔室3的入口3a)的传感器6和位于所述腔室3的出口3b下游(靠近所述腔室3的出口3b)的传感器6进行该测量。考虑了系统中的流速和腔室3的体积,从两个传感器获得的测量之间的差值可以确定受照射样品的产氧速率。
174.在这样的测量之后,样品可以被引导到废料容器5。可替代地,样品可以返回到生物反应器2。可替代的并且优选地,样品可以经过至少一个没有光的情况下将样品保存在例
如额外腔室4中的步骤。在所述步骤期间,样品保存在暗处,换言之,不向样品提供光。
175.例如参考图1,可以在进行照射步骤的相同腔室3中进行没有光的情况下保存样品的步骤。在这种情况下,在没有光的情况下保存样品的步骤期间,光源停止照射样品。优选的是,以不连续的方式向腔室3供应样品。
176.可替代的并且例如参考图2,可以在与进行照射步骤的腔室3不同的额外腔室4中进行没有光的情况下保存样品的步骤。优选的是以连续的方式向腔室3供应样品。在这种情况下,可以通过连接腔室3与额外腔室4流体的通道或导管或管材将样品从腔室3转移到额外腔室4。
177.根据一些实施方案,根据本发明的方法包括一个没有光的情况下保存样品的步骤。
178.根据其他优选实施方案,根据本发明的方法包括几个没有光的情况下保存样品的步骤,例如两个或三个或四个或五个或十个或十五个或二十个没有光的情况下保存样品的步骤。
179.例如,位于腔室3中的样品(例如在经过一个或多个照射步骤之后)可以经过没有光的情况下保存样品的第一步骤(在该步骤期间进行溶解氧浓度的测量)。然后可以将样品排放或返回到生物反应器2,并且可以将新样品从生物反应器2供应到腔室3,以进行没有光的情况下保存(新)样品的第二步骤(在该步骤期间进行溶解氧浓度的测量)。在这种情况下,没有光的情况下保存样品的步骤是连续的,并且在每个没有光的情况下保存样品的步骤之前更新样品。
180.可替代地,可以在腔室3中进行没有光的情况下保存样品的第一步骤,然后可以将样品转移到另一腔室(例如额外腔室4),以进行没有光的情况下保存样品的第二步骤。在这种情况下,两个没有光的情况下保存样品的步骤是连续的,但样品在转移到另一腔室之前不被更新。
181.在没有光的情况下保存样品的步骤期间,微藻类不能进行光合作用。样品中的溶解氧浓度对应于与微藻类呼吸相关的氧消耗,以及与样品中存在细菌时的细菌呼吸相关的氧消耗。
182.根据一些实施方案,在没有光的情况下保存样品的步骤期间,样品中可以存在至少一种底物(例如将至少一种底物添加到样品中)。这种底物可以如上所述。例如通过将底物注入到腔室3(或额外腔室4)中或注入到通向腔室3(或额外腔室4)的导管/通道/管材中添加底物,可以使微藻类和/或细菌的活性最大化,以在这些(最大化)条件下测量溶解氧浓度。
183.根据一些实施方案,在没有光的情况下保存样品的步骤期间,样品中可以存在至少一种抑制剂或毒性化合物(例如将至少一种抑制剂或毒性化合物添加到样品中)。这种抑制剂或毒性化合物可以如上所述。例如通过将抑制剂或毒性化合物注入到腔室3(或额外腔室4)中或注入到通向腔室3(或额外腔室4)的导管/通道/管材中添加抑制剂或毒性化合物,可以使培养物中存在的细菌失活,以测量仅与由于微藻类呼吸而消耗的氧气对应的溶解氧浓度。例如,添加抑制剂或毒性化合物可以使样品中存在的所有细菌失活。除此以外,特别是当样品中存在异养细菌和自养细菌时,添加特定抑制剂或毒性化合物可以使仅自养细菌失活,而异养细菌保持有活性。可替代地,添加特定抑制剂或毒性化合物可以使仅异养细菌
失活,而自养细菌保持有活性。
184.根据一些实施方案,在没有光的情况下保存样品的步骤期间,样品中存在仅底物(例如将仅底物添加到样品中)。
185.根据一些实施方案,在没有光的情况下保存样品的步骤期间,样品中存在仅抑制剂或毒性化合物(例如将仅抑制剂或毒性化合物添加到样品中)。
186.根据其他实施方案,在没有光的情况下保存样品的步骤期间,样品中存在底物和抑制剂或毒性化合物(例如将底物和抑制剂或毒性化合物添加到样品中)。
187.例如,在没有光的情况下保存样品的第一步骤期间,样品中可以存在底物(例如将底物添加到样品中),并且在没有光的情况下保存样品的第二步骤期间,样品中可以存在抑制剂或毒性化合物(例如将抑制剂或毒性化合物添加到样品中)。
188.可替代地,在没有光的情况下保存样品的第一步骤期间,样品中可以存在底物(例如将底物添加到样品中),并且在没有光的情况下保存样品的第二步骤期间,样品中可以存在抑制剂或毒性化合物和底物(例如将抑制剂或毒性化合物和底物添加到样品中)。
189.可以测量样品中的溶解氧浓度,以确定在没有光的情况下样品的氧消耗速率。可以在一个或多个没有光的情况下保存样品的步骤期间,或者在这些步骤之前和之后进行该测量。
190.参考图1,当样品以不连续的方式(如上所述)供应到腔室3中时,例如可以使用位于腔室3中的传感器6进行该测量。例如,进行没有光的情况下保存样品的步骤一定持续时间时,可以通过计算在没有光的情况下保存样品的步骤期间根据该持续时间测量的溶解氧浓度的导数,确定未受照射样品的氧消耗速率。
191.可替代地,参考图2,当样品以连续的方式供应时(如上所述),在样品被供应到额外腔室4之前和从额外腔室4排出之后(因此在没有光的情况下保存样品的步骤之前和之后),例如可以使用位于所述额外腔室4的入口4a上游(靠近所述额外腔室4的入口4a)的传感器6和位于所述额外腔室4的出口4b下游(靠近所述额外腔室4的出口4b)的传感器6进行该测量。考虑了系统中的流速和额外腔室4的体积,从两个传感器获得的测量之间的差值可以确定在没有光的情况下样品的氧消耗速率。
192.根据一些实施方案,可以在一个照射样品的步骤之后,进行一个没有光的情况下保存样品的步骤。根据可替代实施方案,可以在一个照射样品的步骤之前,进行一个没有光的情况下保存样品的步骤。当进行几个照射样品的步骤和几个没有光的情况下保存样品的步骤时,优选每个照射步骤与没有光的情况下保存样品的步骤交替。可以通过打开和关闭光源,或者通过将样品从其被照射的腔室传递到其不被照射的装置的另一腔室或部分来实现交替。在通过打开和关闭光源来实现交替的情况下,在照射步骤(和溶解氧浓度的测量)之后,样品可以被排放或返回到生物反应器2并用新样品进行替换,该新样品可以经过没有光的情况下保存(新)样品(并测量其溶解氧浓度)的步骤。在通过将样品从其被照射的腔室传递到其不被照射的装置的另一腔室或部分来实现交替的情况下,相同样品可用于进行两个步骤和两次测量。
193.此外,在进行几个照射样品的步骤时且在进行几个没有光的情况下保存样品的步骤时,且在每个照射步骤与至少一个没有光的情况下保存样品的步骤交替时,对于每次交替,样品可以保持不变(即,生物反应器2在一系列的照射步骤和没有光的情况下保存样品
的步骤之间不供应新样品)。
194.可替代地,在进行几个照射样品的步骤时且在进行几个没有光的情况下保存样品的步骤时且在每个照射步骤与至少一个没有光的情况下保存样品的步骤交替时,生物反应器2可以针对每次交替(换言之,为每一轮照射步骤和没有光的情况下保存样品的步骤)供应新样品。
195.根据本发明的方法还可以包括通过导管或通道或管材将样品排放到废料容器5中的步骤。可替代地,该方法可包括通过导管或通道或管材将样品返回到生物反应器2中的步骤。
196.根据一些优选实施方案并且参考图1,根据本发明的方法包括将包含微藻类和细菌的样品以不连续的方式从生物反应器2供应到腔室3。该方法还包括应用第一照射步骤,在该步骤期间,优选样品中存在至少一种底物(优选细菌底物)或者将至少一种底物(优选细菌底物)添加到样品中,并且溶解氧浓度的测量对应于微藻类光合作用引起的氧产生以及微藻类和细菌呼吸引起的氧消耗。可以使用位于腔室3中的传感器6测量溶解氧。然后可以将样品排放(例如在废料容器5中)或返回到生物反应器2,并且可以将新样品供应到腔室3。任选的可以重复这些步骤几次。
197.然后,可以进行没有光的情况下保存样品的第一步骤(即关闭光源),优选样品中存在至少一种底物(优选细菌底物)或将至少一种底物(优选细菌底物)添加到样品中,并且进行溶解氧浓度的测量,本次测量对应于由于微藻类和细菌呼吸引起的氧消耗。可以使用位于腔室3中的相同传感器6测量溶解氧。在该步骤结束时,可以将样品排放(例如在废料容器5中)或返回到生物反应器2中,并且可以将新样品供应到腔室3。任选的可以重复这些步骤几次。
198.可选地,然后可以在样品中存在至少一种抑制剂或毒性化合物(优选细菌的抑制剂或毒性化合物)和任选的至少一种底物(当例如抑制剂或毒性化合物使仅一种细菌类型失活时,优选细菌底物)的情况下,进行第二照射步骤,并且测量溶解氧浓度(对应于由于微藻类光合作用引起的氧产生以及由于微藻类呼吸和可选的未被抑制的细菌呼吸引起的氧消耗)。例如,可以在没有光的情况下保存样品的第一步骤与第二照射步骤之间或者在第二照射步骤开始时或者在整个第二照射步骤中,添加至少一种抑制剂或毒性化合物(以及任选的至少一种底物)。可以使用位于腔室3中的相同传感器6测量溶解氧,然后可以将样品排放(例如在废料容器5中)或返回到生物反应器2,并且可以将新样品供应到腔室3。任选的可以重复几次这些步骤。
199.任选地,然后可以在样品中存在至少一种抑制剂或毒性化合物(优选细菌的抑制剂或毒性化合物)和任选的至少一种底物(当例如抑制剂或毒性化合物仅使一种细菌类型失活时,优选细菌底物)的情况下,进行没有光的情况下保存样品的第二步骤,并测量溶解氧浓度(这次对应于由于微藻类呼吸和任选地未被抑制的细菌呼吸引起的氧消耗)。任选地,可以在第二照射步骤和没有光的情况下保存样品的第二步骤之间或者在没有光的情况下保存样品的第二步骤开始时或者在整个在没有光的情况下保存样品的第二步骤中,添加至少一种抑制剂或毒性化合物和/或至少一种底物。可以使用位于腔室3中的相同传感器6测量溶解氧。在这些步骤结束时,样品可以排出腔室3,以便排放到废料容器5或返回到生物反应器2。任选的可以重复几次这些步骤。
200.因此,根据这些实施方案,根据本发明的方法以不连续的方式进行,换言之,取样量的培养物从生物反应器2循环到腔室3一次,以进行必要的测量。测量完成后,将样品转移回生物反应器2(或废料容器5)。
201.根据这些实施方案,将照射样品的步骤中的产氧速率(受照射样品的产氧速率)和没有光的情况下保存样品的步骤中的氧消耗速率(未受照射样品的氧消耗速率)相加可以确定微藻类光合作用的产氧速率(因为在此操作中消除了微藻类和细菌的呼吸贡献)。例如,参考前面的段落,可以通过计算照射样品的第一步骤中的产氧速率与没有光的情况下保存样品的第一步骤中的氧消耗速率之间的差值,或通过计算照射样品的第二步骤中的产氧速率与没有光的情况下保存样品的第二步骤中的氧消耗速率之间的差值,确定微藻类光合作用的产氧速率。
202.仍然根据这些实施方案,没有光的情况下保存样品的第一步骤中的氧消耗速率与没有光的情况下保存样品的第二步骤中的氧消耗速率之间的差值或者第一照射步骤中的产氧速率与第二照射步骤中的产氧速率之间的差值使得可以计算受抑制剂或毒性化合物抑制的细菌的氧消耗速率。
203.根据其他优选实施方案并且参考图2,根据本发明的方法包括以连续的方式将来自生物反应器2的包含微藻类和细菌的样品供应到腔室3。
204.该方法进一步包括应用第一照射步骤,在该步骤期间,在样品进入腔室3(例如进入通向腔室3的通道)之前,任选地将至少一种底物(优选细菌底物)添加到样品中,并且使用位于腔室3的入口3a上游(靠近腔室3的入口3a)的第一传感器6和位于腔室3的出口3b下游(靠近腔室3的出口3b)的第二传感器6测量溶解氧浓度。考虑到腔室3的体积和装置中的流速,两次测量之间的差值使得可以确定腔室3中样品的产氧速率。该产氧速率考虑了由于微藻类光合作用引起的氧产生以及由于微藻类和任选的细菌呼吸引起的氧消耗。
205.然后,可以进行没有光的情况下保存样品的第一步骤,在此步骤期间,在样品进入额外腔室4(例如进入通向额外腔室4的通道,虽然针对第一照射步骤进行的底物添加可能是足够的)之前,任选地将至少一种底物(优选细菌底物)添加到样品中。这次,使用第二传感器6和位于额外腔室4的出口4b下游(靠近额外腔室4的出口4b)的第三传感器6测量溶解氧浓度。考虑到额外腔室4的体积和装置中的流速,两次测量之间的差值可以确定腔室3中样品的氧消耗速率。该氧消耗速率考虑了由于微藻类和任选的细菌呼吸(在没有微藻类光合作用的情况下)引起的氧消耗。
206.可以将样品连续地转移回生物反应器2。
207.随后可以进行第二照射步骤和没有光的情况下保存样品的第二步骤(在进行第一照射步骤和没有光的情况下保存样品的第一步骤之后),在该步骤期间,将至少一种抑制剂或毒性化合物(优选细菌的抑制剂或毒性化合物)和任选的至少一种底物(当例如抑制剂或毒性化合物使仅一种细菌类型失活时,优选细菌底物)添加到样品中(例如添加到通向腔室3的通道中)。使用上述第一和第二传感器6测量溶解氧浓度。考虑到腔室3的体积和装置中的流速,两次测量之间的差值使得可以确定腔室3中样品的产氧速率。该产氧速率考虑了由于微藻类光合作用引起的氧产生和由于微藻类呼吸(以及如果样品中的部分细菌未被抑制,任选的细菌呼吸)引起的氧消耗。
208.然后,将样品引导至额外腔室4,在额外腔室中,可以进行没有光的情况下保存样
品的第二步骤,在此步骤期间,将至少一种抑制剂或毒性化合物(优选细菌的抑制剂或毒性化合物)和任选的至少一种底物(当例如抑制剂或毒性化合物使仅一种细菌类型失活时,优选细菌底物)添加到样品中(例如添加到通向额外腔室4的通道,虽然针对第二照射步骤进行的抑制剂或毒性化合物/底物添加可能是足够的)。使用上述第二和第三传感器6测量溶解氧浓度。考虑到额外腔室4的体积和装置中的流速,两次测量之间的差值使得可以确定额外腔室4中样品的氧消耗速率。该氧消耗速率考虑了由于微藻类呼吸(以及如果样品中的部分细菌未被抑制,任选的细菌呼吸)引起的氧消耗。
209.样品在排出额外腔室4之后,可以排放到废料容器5或返回到生物反应器2。
210.根据这些实施方案,将照射样品的步骤中的产氧速率(受照射样品的产氧速率)和没有光的情况下保存样品的步骤中的氧消耗速率(未受照射样品的氧消耗速率)相加使得可以确定微藻类光合作用的产氧速率(因为在此操作中消除了微藻类和细菌的呼吸贡献)。例如,参考前面的段落,可以通过将照射样品的第一步骤中的产氧速率与没有光的情况下保存样品的第一步骤中的氧消耗速率相加,或通过将照射样品的第二步骤中的产氧速率与没有光的情况下保存样品的第二步骤中的氧消耗速率相加,确定微藻类光合作用的产氧速率。
211.仍然根据这些实施方案,没有光的情况下保存样品的第一步骤中的氧消耗速率与没有光的情况下保存样品的第二步骤中的氧消耗速率之间的差值或者第一照射步骤中的产氧速率与第二照射步骤中的产氧速率之间的差值使得可以确定受抑制剂或毒性化合物抑制的细菌的氧消耗速率。
212.在上述照射样品的步骤和/或上述没有光的情况下保存样品的步骤中的至少一个步骤期间,该方法还可以包括进行测量样品中溶解二氧化碳浓度的步骤。例如可以与上述测量溶解氧浓度类似的测量溶解二氧化碳浓度。
213.基于溶解二氧化碳的测量,类似于上文对产氧速率的描述,可以在一个或多个照射步骤期间确定二氧化碳的消耗率,和/或类似于上文对氧消耗或产生率的描述,可以在一个或多个没有光的情况下保存样品的步骤期间确定二氧化碳产生率。
214.基于对不同步骤中二氧化碳产生或消耗率的加减,可以确定由于微藻类光合作用引起的二氧化碳消耗率,和/或可以确定由于细菌呼吸(与受抑制剂或毒性化合物抑制的细菌相关)引起的二氧化碳产生率,类似于上文对氧消耗或产生的描述。
215.根据一些实施方案,该方法还可以包括进行至少一次测量样品的ph的步骤。
216.根据一些实施方案,该方法还可以包括进行至少一次测量样品的浊度的步骤。
217.根据一些实施方案,该方法还可以包括进行至少一次测量样品的光密度的步骤。
218.根据一些实施方案,该方法还可以包括进行至少一次测量样品中的悬浮固体总量的步骤。
219.根据一些实施方案,腔室3和/或额外腔室4中样品的ph可以为5-9。当样品的ph变得低于最小值例如5时,可以将碱例如氢氧化钠添加到样品中,以提高样品的ph。当样品的ph变得高于最大值例如9时,可以将酸例如二氧化碳或硫酸溶液添加到样品中,以降低样品的ph。
220.计算机辅助实现
221.该方法可以由计算机实现。这意味着该方法的步骤(或基本上所有步骤)可以由至
少一台计算机或任何类似系统执行。因此,该方法的步骤可以由计算机完全自动地或半自动地执行。在一些变型中,该方法的至少一些步骤的触发可以通过人机交互来执行。所需人机交互的程度可取决于预见的自动化程度,并与实现用户愿望的需求平衡。在示例中,该程度可以是用户定义的和/或预定义的。
222.方法由计算机实现的典型示例是使用适合此目的的系统来执行该方法。该系统可以包括耦合到存储器和图形用户界面(gui)的处理器,存储器上记录有包括用于执行该方法的指令的计算机程序。存储器还可以存储数据库。存储器是适合这种存储的任何硬件,可以包括几个物理分区(例如一个分区用于程序,一个分区可以用于数据库)。
223.在一些实施方案中,系统是客户端计算机系统,例如用户的工作站。
224.客户端计算机系统可以接收上述各种传感器的输入,并且可以尤其是向各种机械和/或电气元件例如阀门、泵、注入器和发光源等发送输出信号,以执行上述方法。其还可以存储和/或向用户显示各种测量结果。
225.示例的客户端计算机可以包括连接到内部通信bus的中央处理器(cpu)、也连接到bus的随机存取存储器。客户端计算机还可设置有与连接到bus的视频随机存取存储器相关联的图形处理单元(gpu)。视频ram在本领域中也称为帧缓冲器。大容量存储设备控制器可以管理对大容量存储设备例如硬盘驱动器的访问。适用于有形地体现计算机程序指令和数据的大容量存储设备包括所有形式的非易失性存储器,例如包括半导体存储器设备,例如eprom、eeprom和闪存设备;磁盘,例如内置硬盘和可移动磁盘;磁光盘;以及cd-rom磁盘。任何上述内容都可以由专门设计的asic(专用集成电路)补充或包含在其中。网络适配器可以管理对网络的访问。客户端计算机还可以包括诸如光标控制设备、键盘等触觉设备。可以在客户端计算机中使用光标控制设备,以允许用户选择性地将光标定位在显示器上的任何期望位置。此外,光标控制设备可以允许用户选择各种指令,并输入控制信号。光标控制设备可以包括用于将控制信号输入到系统的多个信号生成设备。通常,光标控制设备可以是鼠标,鼠标的按钮用于生成信号。可替代的或附加地,客户端计算机系统可以包括传感垫和/或传感屏幕。
226.计算机程序可以包括可由计算机执行的指令,该指令包括用于使上述系统执行方法的装置。该程序可以记录在任何数据存储介质上,包括系统的存储器。该程序可以例如在数字电子电路中或者在计算机硬件、固件、软件中或者它们的组合中实现。该程序可以实现为装置,例如有形地体现在机器可读存储设备中以供可编程处理器执行的产品。方法步骤可由可编程处理器执行,该处理器执行指令程序以通过对输入数据进行操作并生成输出来执行方法的功能。处理器因此可以是可编程的并且被耦合以从数据存储系统、至少一个输入设备和至少一个输出设备接收数据和指令,并且将数据和指令发送到数据存储系统、至少一个输入设备和至少一个输出设备。如果需要,可以以高级过程或面向对象的编程语言或以汇编或机器语言来实现应用程序。在任何情况下,该语言都可以是编译型或解释型语言。该程序可以是完整安装程序或更新程序。在系统上的应用程序在任何情况下都会产生用于执行方法的指令。
227.实施例
228.以下实施例对本发明进行解释说明,但不限制本发明。
229.实施例1:
230.将包含浓度为0.3g/l的微绿球藻型微藻类的培养物样品从生物反应器转移到体积为300ml并包括磁力搅拌器和发光源的腔室中。发光源包括位于腔室周围的发光二极管串。样品的ph为7.5至8.5,并包含110ppm的硝酸根离子和7ppm的磷酸根离子。样品的盐度为50g/l。
231.在117h期间,连续进行几个照射步骤,以在每个照射步骤期间对样品中存在的溶解氧进行测量。使用插入腔室中的发光溶解氧(ldo)传感器(hach)进行该测量。在每个照射步骤之后,将样品返回到生物反应器并且替换为新样品。因此,如图3所示,直到117h,曲线(a)的每个向上的斜率对应照射步骤(其中由于光合作用溶解氧浓度增加),曲线(a)的每个向下的斜率对应于样品返回生物反应器中并且替换为新样品(新样品开始其光合过程)。从117到120h,进行了一系列没有光的情况下保存样品的步骤,在该步骤期间,由于没有光合作用并且微藻类呼吸消耗溶解氧,所以溶解氧浓度(a)和氧消耗速率(b)降低了。120小时之后,进行了一系列连续的照射步骤,在该步骤期间,溶解氧浓度和产氧速率升高。再次,曲线(a)的每个向上的斜率对应照射步骤(其中溶解氧浓度由于光合作用增大),曲线(a)的每个向下的斜率对应于样品返回生物反应器中并且替换为另一样品(该另一样品开始其光合作用过程)。
232.实施例2:
233.将包含浓度为0.3g/l的微绿球藻型的微藻类和浓度为0.05g/l的好氧细菌的培养物样品从生物反应器转移到体积为300ml并包括磁力搅拌器和发光源的腔室中。发光源包括位于腔室周围的发光二极管串。样品的ph为7.5至8.5,并包含110ppm的硝酸根离子和7ppm的磷酸根离子。样品的盐度为50g/l。
234.在整个实验过程中,腔室中提供有光。换言之,连续进行几个照射步骤,以在每个照射步骤期间对样品中存在的溶解氧进行测量。使用插入腔室中的发光溶解氧(ldo)传感器(hach)进行该测量。在每个照射步骤之后,将样品返回到生物反应器并替换为新样品。因此,如图4所示,曲线(a)的每个向上的斜率对应照射步骤(其中溶解氧浓度由于光合作用增大),曲线(a)的每个向下的斜率对应于样品返回生物反应器中并且替换为新样品。
235.如图4所示,点1至11对应于连续添加作为细菌底物的乙醇和连续添加作为细菌抑制剂的cuso4。更具体地说,在点11之后,向样品中添加总量为70mg/l的cuso4。因此,如图4所示,每次添加(1至11)之后,溶解氧浓度(a)以及氧消耗速率(b)由于底物的存在而降低,这提高了细菌的活性,并因此由于细菌呼吸而提高了氧消耗。底物消耗完之后,溶解氧浓度(a)直到下一次添加才会增大。随着时间的推移,样品中积累的cuso4的存在对细菌活性的抑制作用越来越大。因此,尽管连续添加底物,细菌活性还是从点1降低到点11(产氧速率(b)提高)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1